C selama 1 menit, dan 72 C selama 2 menit. Hasil konfirmasi dicek dengan elektroforesis gel agarosa 1%.
Isolasi DNA Plasmid Rekombinan (Fermentas 2006)
Isolasi DNA plasmid menggunakan GeneJETTM Plasmid MiniPrep Kit dari
Fermentas. Koloni bakteri yang tumbuh pada media LA dikulturkan ke media LB cair yang telah ditambahkan antibiotik kanamisin 50 ppm. Kultur diinkubasi dengan menggunakan shaker incubator pada suhu 37 oC selama semalam dengan kecepatan 220 rpm.
Kultur bakteri yang telah tumbuh kemudian dipindahkan ke tabung mikro sebanyak 2 mL, dan disentrifus pada 8000 rpm, 25 oC, selama 3 menit. Pelet yang terbentuk diambil dan dilarutkan dengan penambahan 250 µL larutan resuspensi. Pelet yang telah larut kemudian ditambahkan 250 µL larutan lisis, lalu tabung dibolak-balik sebanyak 6 kali. Sebanyak 350 µL larutan netralisasi kemudian ditambahkan ke dalam larutan tersebut dan tabung dibolak-balik lagi 6 kali, lalu disentrifus pada 12000 rpm, 25 oC, selama 5 menit.
Supernatan dipindahkan ke GeneJETYM
Spin Column (kolom) dan disentrifus pada 12000 rpm selama 1 menit. Sebanyak 500 µL larutan pencuci ditambahkan ke dalam kolom dan disentrifus pada 12000 rpm selama 1 menit (dilakukan dua kali). Tabung beserta kolom dalam keadaan kosong kemudian disentrifus lagi pada 12000 rpm selama 1 menit. Kolom dipindahkan ke dalam tabung baru, kemudian ditambahkan 30 µL larutan bufer elusi tepat di tengah kolom, lalu diinkubasi selama 2 menit dan disentrifus pada 12000 rpm selama 2 menit. Hasil isolasi dicek dengan elektroforesis gel agarosa 1%. Transformasi ke dalam Agrobacterium
tumefaciens galur AGL0
Transformasi ke A. tumefaciens dilakukan dengan sebanyak 10 µL hasil rekombinasi pada vektor destinasi dimasukkan ke dalam 500 µL sel kompeten A. tumefaciens galur AGL0 lalu didiamkan di dalam es selama 15 menit. Campuran tersebut kemudian diinkubasi di dalam nitrogen cair selama 5 menit, dilanjutkan diinkubasi pada suhu 37 oC selama 5 menit di dalam water bath. Sebanyak 1 mL media Yeast Extract Pepton
suhu 28 C selama 3 jam di dalam shaker incubator. Hasil inkubasi kemudian disentrifus pada kecepatan 6000 rpm selama 3 menit. Supernatan yang terbentuk dibuang sebagian, dan sebanyak ± 100 µL supernatan yang tersisa diresuspensikan dengan pelet lalu disebar ke media LA yang telah ditambahkan antibiotik kanamisin 50 ppm dan rifampisin 50 ppm. Media diinkubasi selama 2 hari pada suhu 28 oC dalam kondisi gelap.
HASIL DAN PEMBAHASAN
Hasil Amplifikasi Gen Stilbena Sintase dengan Primer GatewayLangkah awal yang dilakukan dalam konstruksi gen STS pada vektor ekspresi adalah mendesain primer Gateway yang spesifik. Primer tersebut dirancang berdasarkan sekuen gen STS yang telah diperoleh pada penelitian sebelumnya. Primer yang digunakan, yaitu Gateway STS-Forward dan Gateway STS-Reverse, dirancang khusus untuk metode Gateway (Lampiran 3). Rancangan tersebut adalah empat basa nukleotida guanin (GGGG), diikuti situs attB (pada ujung Forward dan Reverse), kemudian ditambahkan 18-25 urutan basa nukleotida spesifik gen STS (Invitrogen 2003). Situs attB disebut sebagai tempat pengikatan lambda (lambda attachment site), yaitu tempat integrasi DNA lambda ke dalam kromosom E. coli (Yuwono 2005).
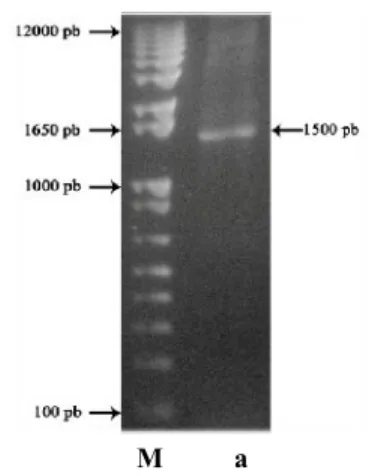
Amplifikasi gen STS dengan proses PCR dilakukan untuk menggandakan gen tersebut secara in vitro. Hasil amplifikasi kemudian dielektroforesis pada gel agarosa dengan konsentrasi 1% untuk mengetahui apakah gen tersebut berhasil teramplifikasi. Hasil elektroforesis menunjukkan pita berukuran sekitar 1500 pb (Gambar 5). Berdasarkan ukuran pita yang dihasilkan dan dengan membandingkan tingkat homologi ukuran pita dengan menggunakan situs NCBI, gen tersebut merupakan gen STS (Lampiran 7). Salah satu hasil perbandingannya adalah dengan gen STS dari tanaman Vitis vinifera kultivar Carignane yang memiliki ukuran 1535 pb (Xu et al. 2011). Hasil ini juga memperkuat simpulan Lilis (2009) yang menyatakan ukuran gen STS sebesar 1500 pb. Gen STS yang telah teramplifikasi selanjutnya diekstraksi dan dimurnikan.
M a
Gambar 5 Elektroforegram amplikon gen STS dengan primer Gateway; (M) marker 1 Kb Plus DNA Ladder, (a) gen STS berukuran
1500 pb.
Hasil Ekstraksi dan Purifikasi DNA Gel Agarosa (Elusi Gel)
Ekstraksi dan purifikasi DNA dari gel menggunakan kit PureLink
Extraction dari Invitrogen. Gel agarosa yang mengandung hasil elektroforesis dari tahap sebelumnya diletakkan di atas transluminator UV untuk melihat pita yang akan dipotong. Pita DNA yang terlihat dipotong dengan scalpel kemudian diekstraksi da
Gel agarosa mengandung berbagai pengotor yang dapat menghambat reaksi dalam perlakuan selanjutnya terhadap DNA jika tidak dihilangkan. Ekstraksi dan purifikasi bertujuan memurnikan DNA dari
pengotor lain yang tidak diinginkan komponen PCR, sehingga efisiensi perlakuan terhadap DNA selanjutnya dapat meningkat (Lewis 2001).
Ukuran pita DNA hasil ekstraksi dan purifikasi seharusnya tidak berbeda jauh dengan ukuran pita hasil amplifikasi karena hanya menghilangkan pengotor dari DNA. Hasil ekstraksi dan purifikasi dielektroforesis dengan gel agarosa 1% dan menghasilkan pita berukuran sekitar 1500 pb (Gambar 6). Hasil ekstraksi dan purifikasi kemudian direkombinasikan ke dalam vektor donor dengan menggunakan metode Gateway. Hasil Rekombinasi Gen Stilbena Sintase pada Vektor Donor dan Vektor Destinasi
Rekombinasi gen STS pada vektor donor dan vektor destinasi pada prinsipnya merupakan teknik pengklonan. Pengklonan
Elektroforegram amplikon gen STS dengan primer Gateway; (M) marker 1 Kb Plus DNA
, (a) gen STS berukuran
Ekstraksi dan Purifikasi DNA dari Ekstraksi dan purifikasi DNA dari gel PureLinkTM Quick Gel
Gel agarosa yang mengandung hasil elektroforesis dari tahap sebelumnya diletakkan di atas transluminator UV untuk melihat pita yang akan dipotong. Pita DNA yang terlihat dipotong dengan dian diekstraksi dan dimurnikan. Gel agarosa mengandung berbagai pengotor yang dapat menghambat reaksi dalam perlakuan selanjutnya terhadap DNA jika Ekstraksi dan purifikasi bertujuan memurnikan DNA dari gel dan yang tidak diinginkan seperti komponen PCR, sehingga efisiensi perlakuan terhadap DNA selanjutnya dapat meningkat
Ukuran pita DNA hasil ekstraksi dan purifikasi seharusnya tidak berbeda jauh dengan ukuran pita hasil amplifikasi karena hanya menghilangkan pengotor dari DNA. Hasil ekstraksi dan purifikasi dielektroforesis dengan gel agarosa 1% dan menghasilkan pita berukuran sekitar 1500 pb (Gambar 6). Hasil ekstraksi dan purifikasi kemudian direkombinasikan ke dalam vektor donor
menggunakan metode Gateway. Hasil Rekombinasi Gen Stilbena Sintase pada Vektor Donor dan Vektor Destinasi
Rekombinasi gen STS pada vektor donor dan vektor destinasi pada prinsipnya merupakan teknik pengklonan. Pengklonan
bertujuan memperbanyak dan meng DNA yang diklon. Pengklonan dengan metode Gateway terdiri atas dua tahapan, yaitu rekombinasi BP dan rekombinasi LR. Hasil elusi gel disisipkan ke dalam vektor donor pada tahap rekombinasi BP. Gen STS hasil amplifikasi yang telah memiliki situs attB1 (pada bagian forward) dan situs attB2 (pada bagian reverse) direaksikan dengan vektor donor yang memiliki situs attP1 dan situs attP2 sebagai tempat rekombinasi. Situs rekombinasi tersebut memungkinkan tidak adanya kesalahan orientasi gen yang direkombinasikan. Reaksi rekombinasi ini dikatalisis oleh enzim BP Clonase
dalam metode Gateway reaksi rekombinasi pada donor vektor disebut juga reaksi BP (BP reaction). Reaksi BP menghasilkan suatu klon entri (pENTR) yang diapit oleh dua situs attL (Lampiran 4).
Hasil rekombinasi gen STS pada vektor donor kemudian ditransformasikan ke sel kompeten Escherichia coli galur
dengan perlakuan kejut panas (
Sel kompeten adalah sel yang telah mengalami perlakuan fisik atau kimiawi sedemikian rupa sehingga meningkatkan kemampuannya untuk mengambil DNA. Sel dapat dibuat kompeten biasanya dengan perlakuan garam CaCl2 atau RbCl. Garam CaCl2 menyebabkan presipitasi DNA pada permukaan luar sel dan menyebabkan perubahan tertentu pada dinding sel yang meningkatkan pengikatan DNA. Gerakan DNA menuju ke dalam sel distimulasi dengan menaikkan temperatur sampai 42
waktu singkat atau kejut panas (Brown 1991).
M a
Gambar 6 Elektroforegram hasil ekstraksi dan purifikasi gen STS dari gel; (M) marker 1 Kb Plus DNA
Ladder, (a) gen STS berukuran 1500 pb.
bertujuan memperbanyak dan mengisolasi DNA yang diklon. Pengklonan dengan metode Gateway terdiri atas dua tahapan, yaitu rekombinasi BP dan rekombinasi LR. Hasil elusi gel disisipkan ke dalam vektor donor pada tahap rekombinasi BP. Gen STS hasil amplifikasi yang telah memiliki situs ) dan situs attB2 ) direaksikan dengan vektor donor yang memiliki situs attP1 dan situs attP2 sebagai tempat rekombinasi. Situs rekombinasi tersebut memungkinkan tidak adanya kesalahan orientasi gen yang nasikan. Reaksi rekombinasi ini dikatalisis oleh enzim BP ClonaseTMsehingga dalam metode Gateway reaksi rekombinasi pada donor vektor disebut juga reaksi BP (BP ). Reaksi BP menghasilkan suatu klon entri (pENTR) yang diapit oleh dua situs attL Hasil rekombinasi gen STS pada vektor donor kemudian ditransformasikan ke sel galur XL1-Blue dengan perlakuan kejut panas (heat shock). Sel kompeten adalah sel yang telah mengalami perlakuan fisik atau kimiawi sedemikian rupa sehingga meningkatkan kemampuannya untuk mengambil DNA. Sel dapat dibuat kompeten biasanya dengan atau RbCl. Garam menyebabkan presipitasi DNA pada permukaan luar sel dan menyebabkan ing sel yang meningkatkan pengikatan DNA. Gerakan DNA menuju ke dalam sel distimulasi dengan menaikkan temperatur sampai 42 oC dalam waktu singkat atau kejut panas (Brown 1991).
Elektroforegram hasil ekstraksi gen STS dari gel; (M) marker 1 Kb Plus DNA
E. coli merupakan mikroorganisme yang paling umum digunakan dalam industri bioteknologi dan dalam sebagian besar eksperimen kloning gen. E. coli
beberapa alasan, yaitu memiliki ukuran genom yang relatif kecil, pertumbuhannya sangat cepat, relatif aman, sifat genetiknya telah banyak diketahui, dan mampu menjadi inang bagi DNA asing (Weaver & Hedrick 1989).
Hasil transformasi ditumbuhkan pada media LA (Luria Agar) yang telah ditambahkan antibiotik kanamisin 50 ppm. Penambahan kanamisin dilakukan karena vektor donor yang digunakan (pDONR 221) memiliki marka seleksi resisten terhadap antibiotik tersebut (Lampiran 6
transforman dilakukan dengan
koloni yang tahan terhadap kanamisi sehingga tumbuh pada media LA yang telah ditambahkan kanamisin 50 ppm
diinkubasi. Koloni yang tumbuh semuanya berwarna putih (Gambar 7
dipastikan merupakan klon entri yang membawa gen STS, sedangkan
(by product) tidak akan tumbuh sebagai koloni putih. Hal tersebut disebabkan oleh gen ccdB yang mengganggu kerja enzim DNA gyrase pada E. coli sehingga pertumbuhannya terhambat (Bernard & Couturier 1992). Koloni yang tumbuh diduplikasi dan dikultur untuk memperbanyak jumlah plasmid rekombinan. Hasil duplikasi kemudian diuji dengan metode PCR koloni untuk membuktikan plasmid rekombinan telah tersisipi gen STS.
Koloni yang terbukti membawa
rekombinan kemudian diisolasi DNA plasmidnya untuk direkombinasikan ke dalam vektor destinasi melalui tahap rekombinasi LR. Plasmid rekombinan (pENTR) yang telah diapit oleh situs attL1 dan situs attL2 direaksikan dengan vektor destinasi yang memiliki situs attR1 dan situs attR2. Reaksi ini dikatalisis oleh enzim LR Clonase
Gambar 7 Koloni yang tumbuh setelah reaksi BP pada metode Gateway.
merupakan mikroorganisme yang paling umum digunakan dalam industri bioteknologi dan dalam sebagian besar E. coli dipilih karena apa alasan, yaitu memiliki ukuran genom yang relatif kecil, pertumbuhannya , sifat genetiknya telah banyak diketahui, dan mampu menjadi inang bagi DNA asing (Weaver & Hedrick Hasil transformasi ditumbuhkan pada (Luria Agar) yang telah ditambahkan antibiotik kanamisin 50 ppm. Penambahan kanamisin dilakukan karena vektor donor yang digunakan (pDONRTM
seleksi resisten terhadap Lampiran 6). Seleksi transforman dilakukan dengan mengamati koloni yang tahan terhadap kanamisin sehingga tumbuh pada media LA yang telah ditambahkan kanamisin 50 ppm setelah diinkubasi. Koloni yang tumbuh semuanya erwarna putih (Gambar 7) dan hampir dipastikan merupakan klon entri yang sedangkan hasil samping tidak akan tumbuh sebagai tersebut disebabkan oleh gen ccdB yang mengganggu kerja enzim DNA sehingga pertumbuhannya Couturier 1992). Koloni yang tumbuh diduplikasi dan dikultur untuk memperbanyak jumlah plasmid rekombinan. Hasil duplikasi kemudian diuji dengan metode PCR koloni untuk membuktikan plasmid rekombinan telah Koloni yang terbukti membawa plasmid rekombinan kemudian diisolasi DNA plasmidnya untuk direkombinasikan ke dalam vektor destinasi melalui tahap rekombinasi LR. Plasmid rekombinan (pENTR) yang telah diapit oleh situs attL1 dan situs attL2 direaksikan dengan vektor destinasi yang iki situs attR1 dan situs attR2. Reaksi ini dikatalisis oleh enzim LR ClonaseTMyang
Koloni yang tumbuh setelah reaksi BP pada metode Gateway.
disebut juga reaksi LR (LR reaction
LR menghasilkan suatu klon ekspresi (pEXPR) yang diapit oleh dua situs attB (Lampiran 5).
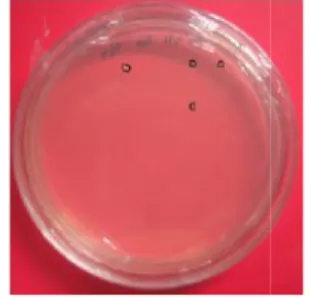
Hasil rekombinasi gen STS pada vektor destinasi kemudian ditransformasikan juga kekanamisin sehingga seleksi transforman juga dilakukan dengan melihat koloni putih yang dapat tumbuh pada media tersebut (Gambar 8). Koloni yang tumbuh relatif sedikit disebabkan oleh sel kompeten yang digunakan telah berkurang keefektifannya. Koloni yang tumbuh diduplikasi untuk menyimpan koloni yang membawa gen sisipan agar tidak terkontaminasi
juga dilakukan pengujian plasmid rekombinan dengan metode PCR koloni.
Gambar 8 Koloni yang tumbuh setelah reaksi LR pada metode Gateway.
Hasil Konfirmasi Koloni Transforman Reaksi BP dengan Metode PCR Koloni dan Isolasi DNA Plasmid Rekombinan
PCR koloni dilakukan untuk memastikan bahwa koloni bakteri yang tumbuh setelah transformasi ke dalam E. coli
plasmid rekombinan. Metode PCR koloni yang dilakukan setelah reaksi BP menggunakan sepasang primer universal M karena peta vektor donor (pDONR
menunjukkan bahwa amplifikasi dengan PCR koloni memerlukan primer M13-Forward primer M13-Reverse (Lampiran 6 Elektroforegram PCR koloni setelah reaksi BP menunjukkan bahwa ada 7 dari 14 koloni yang diujikan mengandung gen STS. Hal ini ditunjukkan dengan adanya pita berukuran sekitar 1500 pb setelah elektroforesis. dari 7 koloni hanya 2 koloni saja yang benar benar bersih dari pengotor, yaitu koloni 2 dan nomor 14 (Gambar 9).
Koloni bakteri yang telah membawa plasmid rekombinan selanjutnya dikulturkan ke dalam media Luria Bertani (LB) cair yang berisi sumber nutrisi untuk membantu pertumbuhan bakteri. Media LB merupakan
reaction). Reaksi LR menghasilkan suatu klon ekspresi ang diapit oleh dua situs attB Hasil rekombinasi gen STS pada vektor destinasi kemudian ditransformasikan juga kanamisin sehingga seleksi transforman juga dilakukan dengan melihat koloni putih ada media tersebut Koloni yang tumbuh relatif disebabkan oleh sel kompeten yang digunakan telah berkurang keefektifannya. Koloni yang tumbuh diduplikasi untuk menyimpan koloni yang membawa gen sisipan agar tidak terkontaminasi, selanjutnya n plasmid rekombinan
loni yang tumbuh setelah reaksi LR pada metode
Hasil Konfirmasi Koloni Transforman Reaksi BP dengan Metode PCR Koloni dan Isolasi DNA Plasmid Rekombinan
PCR koloni dilakukan untuk memastikan bahwa koloni bakteri yang tumbuh setelah mengandung Metode PCR koloni yang dilakukan setelah reaksi BP menggunakan sepasang primer universal M13 karena peta vektor donor (pDONRTM 221) menunjukkan bahwa amplifikasi dengan PCR Forward dan Lampiran 6). Elektroforegram PCR koloni setelah reaksi BP menunjukkan bahwa ada 7 dari 14 koloni gandung gen STS. Hal ini ditunjukkan dengan adanya pita berukuran sekitar 1500 pb setelah elektroforesis. Namun dari 7 koloni hanya 2 koloni saja yang benar-benar bersih dari pengotor, yaitu koloni nomor
h membawa plasmid rekombinan selanjutnya dikulturkan Luria Bertani (LB) cair yang sumber nutrisi untuk membantu pertumbuhan bakteri. Media LB merupakan
12000 pb 1650 pb 1000 pb 100 pb M 1 2 3 4
Gambar 9 Elektroforegram PCR koloni rekombinasi gen STS pada vektor donor; (M) marker 1 Kb Plus DNA
koloni bakteri.
media kompleks karena terdiri atas tripton, ekstrak yeast (ragi), dan NaCl. Tripton berfungsi sebagai sumber asam amino dan peptida, sedangkan ekstrak yeast
kebutuhan nitrogen, gula, serta nutrien organik dan anorganik (Brown 1991). Hasil kultur koloni dalam media LB kemudian diisolasi DNA plasmidnya
direkombinasikan pada vektor destinasi. Isolasi DNA plasmid, yang dilakukan dengan kit GeneJETTM Plasmid MiniPrep
Fermentas, pada prinsipnya hampir sama dengan isolasi DNA kromosom. Perbedaannya adalah ukuran DNA plasmid lebih kecil dari DNA k
konformasi keduanya berbeda. Hasil elektroforesis isolat DNA plasmid menghasilkan suatu pita, yang menunjukkan bahwa DNA plasmid telah berhasil diisolasi Elektroforesis hasil isolasi plasmid sebenarnya bertujuan untuk mengecek secara kualitatif keberhasilan isolasi plasmid. plasmid yang telah diisolasi selanjutnya direkombinasikan ke dalam vektor destinasi. Hasil Konfirmasi Koloni Transforman Reaksi LR dengan Metode PCR Koloni dan Isolasi DNA Plasmid Rekombinan
Metode PCR koloni juga dilakukan untuk mengecek koloni bakteri yang tumbuh setelah transformasi ke dalam E. coli
rekombinasi LR. Metode PCR koloni yang dilakukan setelah reaksi LR menggunakan sepasang primer spesifik Gateway, ya Gateway STS-Forward dan
Reverse. Vektor destinasi yang digunakan 2 3 4 5 ... 14 Elektroforegram PCR koloni rekombinasi gen STS pada vektor donor; (M) marker 1 Kb Plus DNA Ladder, (1-14) koloni bakteri.
media kompleks karena terdiri atas tripton, (ragi), dan NaCl. Tripton berfungsi sebagai sumber asam amino dan yeast menyediakan kebutuhan nitrogen, gula, serta nutrien organik dan anorganik (Brown 1991). Hasil kultur koloni dalam media LB kemudian diisolasi DNA plasmidnya untuk direkombinasikan pada vektor destinasi.
Isolasi DNA plasmid, yang dilakukan Plasmid MiniPrep dari Fermentas, pada prinsipnya hampir sama dengan isolasi DNA kromosom. Perbedaannya adalah ukuran DNA plasmid lebih kecil dari DNA kromosom, dan konformasi keduanya berbeda. Hasil foresis isolat DNA plasmid menghasilkan suatu pita, yang menunjukkan bahwa DNA plasmid telah berhasil diisolasi. Elektroforesis hasil isolasi plasmid sebenarnya bertujuan untuk mengecek secara if keberhasilan isolasi plasmid. DNA plasmid yang telah diisolasi selanjutnya direkombinasikan ke dalam vektor destinasi. Hasil Konfirmasi Koloni Transforman Reaksi LR dengan Metode PCR Koloni dan Isolasi DNA Plasmid Rekombinan
Metode PCR koloni juga dilakukan untuk mengecek koloni bakteri yang tumbuh setelah E. coli pada tahap Metode PCR koloni yang dilakukan setelah reaksi LR menggunakan sepasang primer spesifik Gateway, yaitu dan Gateway STS-Vektor destinasi yang digunakan
pada tahap rekombinasi LR ini ada tiga, yaitu pGD625, pARC983, dan pDEST
PCR koloni ini memungkinkan konfirmasi koloni bakteri yang tumbuh sekaligus amplifikasi gen STS yang disisipka
vektor destinasi dengan primer spesifik. Elektroforegram PCR koloni setelah reaksi LR pada gen STS yang disisipkan dalam pGD625 menunjukkan bahwa 3 dari 3 koloni
M 1 2 3
Gambar 10 Elektroforegram PCR koloni rekombinasi gen STS pada vektor destinasi pGD625; (M) marker 1 Kb Plus, (1
bakteri.
M 1 2 3
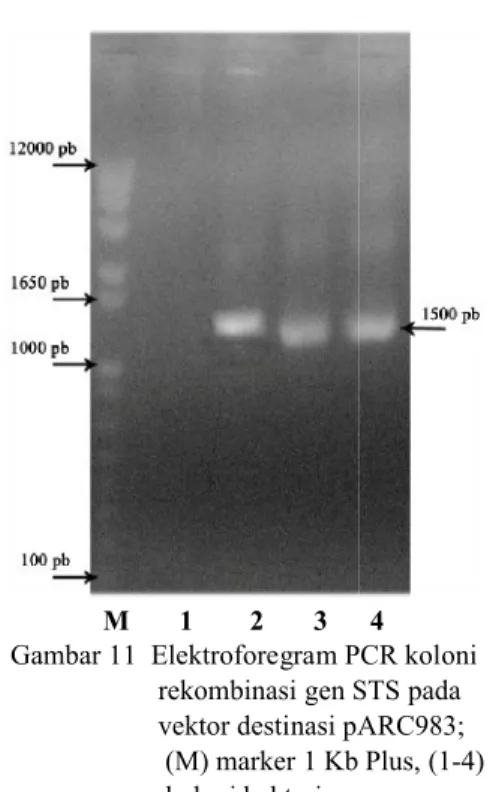
Gambar 11 Elektroforegram PCR koloni rekombinasi gen STS pada vektor destinasi pARC983; (M) marker 1 Kb Plus, (1 koloni bakteri.
pada tahap rekombinasi LR ini ada tiga, yaitu DEST. Tahapan PCR koloni ini memungkinkan konfirmasi koloni bakteri yang tumbuh sekaligus amplifikasi gen STS yang disisipkan dalam vektor destinasi dengan primer spesifik.
Elektroforegram PCR koloni setelah reaksi LR pada gen STS yang disisipkan dalam pGD625 menunjukkan bahwa 3 dari 3 koloni
Elektroforegram PCR koloni rekombinasi gen STS pada vektor destinasi pGD625; (M) marker 1 Kb Plus, (1-3) koloni
4 Elektroforegram PCR koloni
rekombinasi gen STS pada destinasi pARC983; (M) marker 1 Kb Plus, (1-4)
1500 pb
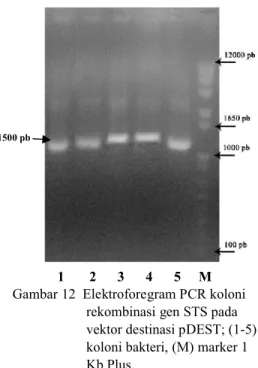
1 2 3 4 5 M Gambar 12 Elektroforegram PCR koloni
rekombinasi gen STS pada vektor destinasi pDEST; (1-5) koloni bakteri, (M) marker 1 Kb Plus.
yang diujikan semuanya mengandung gen STS. Hal ini ditunjukkan dengan pita yang berukuran sekitar 1500 pb pada elektroforegram (Gambar 10).
Ukuran pita sekitar 1500 pb tersebut juga digunakan sebagai acuan untuk konfirmasi koloni bakteri yang mengandung gen STS pada vektor destinasi pARC983 dan pDEST. Elektroforegram menunjukkan bahwa 3 dari 4 koloni yang diujikan pada vektor destinasi pARC983 (Gambar 11) dan 5 dari 5 koloni yang diujikan pada vektor destinasi pDEST (Gambar 12) positif mengandung gen STS.
Isolasi DNA plasmid kemudian dilakukan terhadap koloni bakteri yang positif mengandung gen STS. Hasil elektroforesis isolat DNA plasmid menunjukkan bahwa DNA plasmid telah berhasil diisolasi. DNA plasmid yang telah diisolasi selanjutnya ditransformasikan ke dalam Agrobacterium tumefaciens.
Hasil Transformasi Klon Ekspresi ke dalam Agrobacterium tumefaciens galur AGL0
Transformasi ke dalam Agrobacterium tumefaciens dilakukan untuk menguji ekspresi pengaruh gen sisipan pada tanaman. Sel Agrobacterium digunakan sebagai wahana yang membawa plasmid rekombinan untuk menginfeksi sel tanaman. Agrobacterium yang digunakan adalah galur AGL0 karena memiliki virulensi yang tinggi dibandingkan galur Agrobacterium lainnya.
Transformasi klon ekspresi ke dalam A. tumefaciens menggunakan metode kejut dingin (cool shock) lalu dilanjutkan dengan metode kejut panas (heat shock). Lonjakan suhu dari sekitar -196 oC (inkubasi dalam N2 cair) ke suhu 37 oC (inkubasi dalam water bath) menyebabkan membran sel Agrobacterium menjadi tidak selektif terhadap molekul asing sehingga plasmid rekombinan yang berisi gen sisipan dapat masuk. Campuran sel kompeten AGL0 dan klon ekspresi kemudian disebar ke media LA yang mengandung antibiotik kanamisin dan rifampisin lalu diinkubasi dalam kondisi gelap. Kanamisin digunakan karena vektor destinasi yang digunakan memiliki marka seleksi berupa resistensi terhadap antibiotik kanamisin, sedangkan rifampisin digunakan untuk membunuh E. coli. Inkubasi dalam keadaan gelap dilakukan karena A. tumefaciens merupakan bakteri tanah yang sensitif terhadap cahaya, sehingga perlu dikondisikan seperti habitat aslinya.
Hasil transformasi menunjukkan terbentuknya koloni berwarna putih pada media LA yang mengandung kanamisin 50 ppm dan rifampisin 50 ppm (Gambar 13). Koloni yang tumbuh berjumlah masing-masing 1 koloni untuk setiap vektor destinasi yang digunakan. Koloni yang tumbuh merupakan koloni yang mengandung klon ekspresi, yaitu klon yang membawa gen STS. Jumlah koloni yang tumbuh di media saat transformasi ke A. tumefaciens lebih sedikit dibandingkan saat transformasi ke E. coli. Hal ini terjadi karena A. tumefaciens memiliki jumlah salinan (copy number) yang lebih sedikit dibandingkan dengan E. coli (Brown 1991).
Koloni bakteri yang tumbuh kemudian diuji dengan metode PCR koloni untuk memastikan bahwa koloni tersebut mengandung klon ekspresi. Primer yang digunakan adalah primer spesifik Gateway.
Gambar 13 Koloni bakteri yang tumbuh setelah transformasi ke dalam Agrobacterium tumefaciens.
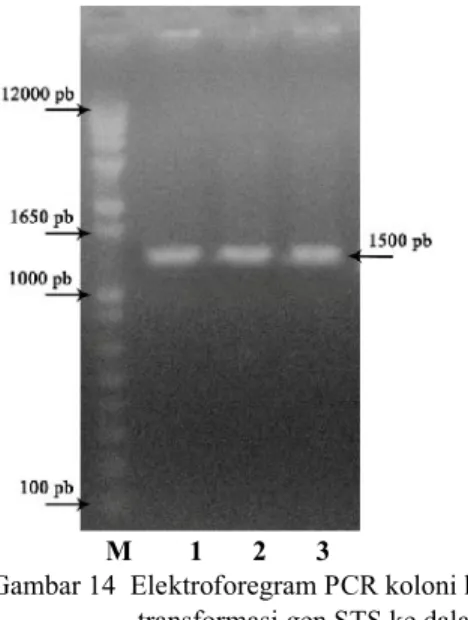
M 1 2 3
Gambar 14 Elektroforegram PCR koloni hasil transformasi gen STS ke dalam Agrobacterium tumefaciens; (M)
marker 1 Kb Plus, (1) koloni pGD625, (2) koloni pARC983, (3) koloni pDEST.
Elektroforegram PCR koloni menunjukkan bahwa setiap koloni yang diujikan mengandung gen STS yang disisipkan karena pita yang dihasilkan berada pada kisaran 1500 pb (Gambar 14). A. tumefaciens yang telah mengandung gen STS selanjutnya disimpan dalam stok gliserol pada suhu sekitar -70 oC untuk kemudian ditransfer ke dalam tanaman pada penelitian selanjutnya.
SIMPULAN DAN SARAN
SimpulanGen stilbena sintase (STS) telah berhasil disisipkan pada vektor ekspresi dengan menggunakan metode Gateway. Hal tersebut ditunjukkan oleh hasil konfirmasi gen STS setelah reaksi BP maupun reaksi LR yang menunjukkan hasil sekitar 1500 pb. DNA plasmid dalam vektor ekspresi juga telah berhasil ditransformasikan ke dalam Agrobacterium tumefaciens sehingga siap ditransfer ke dalam tanaman.
Saran
Penelitian lebih lanjut tentang transformasi Agrobacterium tumefaciens ke dalam tanaman perlu dilakukan untuk mengetahui keberhasilan ekspresi gen stilbena sintase (STS) dalam hal membuat tanaman resisten terhadap penyakit busuk pangkal batang.
the F plasmid ccdB protein involves poisoning of DNA-topoisomerase II complexes. J. Mol. Biol. 226:735-745. [Biotek UnUd] Bioteknologi Universitas
Udayana. 2008. Mekanisme molekuler induksi tumor crown gall oleh Agrobacterium tumefaciens. [terhubung berkala]. http://fp.unud.ac.id/. [4 April 2011].
Breuil AC et al. 1999. Characterization of a pterostilbene dehydrodimer produced by laccase of Botrytis cinerea. Phytopathology 89:298-302.
Brown TA. 1991. Pengantar Kloning Gena. Muhammad SA, penerjemah; Praseno, editor. Yogyakarta: Yayasan Essentia Medica. Terjemahan dari: Gene Cloning an Introduction.
Deacon J. 2002. Biology and control of crown gall (Agrobacterium tumefaciens).
[terhubung berkala].
http://helios.bto.ed.ac.uk/. [4 April 2011]. Donepudi A. 2011. What is a PCR?
[terhubung berkala].
http://protocolpedia.com/. [2 April 2011]. Escobar MA, Dandekar AM. 2003.
Agrobacterium tumefaciens as an agent of disease. Plant Scie. 8:380-386.
Ferguson KA. 1964. Starch-gel electrophoresis-application to the classification of pituitary proteins and polypeptides. Metabolism 13(10):985-1002.
Fermentas. 2006. GeneJETTM Plasmid
MiniPrep Kit. Canada: Life Science. Hain R et al. 1993. Disease resistance results
from foreign phytoalexin expression in a novel plant. Nature 361:153-156.
Hartley JL, Temple GF, Brasch MA. 2000. DNA cloning using in vitro site-spesific recombination. Genome Research 10:1788-95.
[HGP] Human Genome Project. 2009. Cloning fact sheet. [terhubung berkala]. http://www.ornl.gov/. [31 Maret 2011].