1
Program Magister Program Studi Ilmu Biomedik Kekhususan Anti Aging Program Pascasarjana Universitas Udayana Denpasar
Diterima : 29 September 2017 Disetujui : 16 Oktober 2017 Diterbitkan : 25 Oktober 2017
Volume 1, Nomor 1, Oktober 2017 : 1 - 9
Pemberian Krim Ekstrak Metanolik Buah Delima Merah
(
Punica granatum
) Menghambat Penurunan Jumlah
Kolagen Dermis Kulit Mencit
(
Mus gusculus
) Yang Dipapar Sinar Ultraviolet B
Ariana Suryadewi Soejanto1
ABSTRAK
Photoaging adalah penuaan kulit ekstrinsik yang disebabkan oleh paparan kronis sinar ultraviolet. Photoaging terutama ditandai timbulnya kerutan yang terjadi akibat kerusakan kolagen oleh reactive oxygen species (ROS) yang terbentuk selama paparan sinar ulraviolet. Proses ini dapat dicegah dengan pemberian antioksidan, baik topikal maupun sistemik. Buah delima merah (Punica granatum) memiliki kandungan
vitamin C, asam amino, dan komponen fenol yaitu flavonoid dan tannin (jenis elagitanin) yang dapat berperan sebagai antioksidan. Tujuan penelitian ini adalah untuk mengetahui peran pemberian krim ekstrak metanolik buah delima merah 20% dalam menghambat penurunan jumlah kolagen dermis kulit mencit (Mus musculus) yang dipapar sinar ultraviolet. Penelitian ini merupakan penelitian eksperimental murni dengan menggunakan randomized post test only control group design. Penelitian ini menggunakan 36 ekor mencit yang dibagi menjadi 2 kelompok dan masing-masing kelompok terdiri dari 18 ekor mencit. Kedua kelompok diberi paparan sinar UVB selama 4 minggu dengan dosis total penyinaran sebesar 840 mJ/cm2. Kelompok 1 adalah kelompok kontrol, diberi
PENDAHULUAN
Sejalan dengan bertambahnya usia, akan terjadi penurunan fungsi dan kemampuan tubuh dalam beradaptasi terhadap kerusakan yang terjadi dalam tubuh. Terdapat beberapa faktor yang berperan dalam proses penuaan, yang dapat dikelompokkan menjadi dua yakni, faktor internal dan faktor eksternal. Faktor internal meliputi radikal bebas, hormon yang berkurang, proses glikosilasi, apoptosis, sistem kekebalan yang menurun dan gen. Kemudian yang termasuk dalam faktor eksternal adalah diet yang tidak sehat, gaya hidup yang tidak sehat, kebiasaan yang salah, polusi lingkungan, radiasi, sinar UV, asap rokok, dan stress (Rabe et al., 2006; Pangkahila, 2011).
Sama seperti organ lainnya, kulit pun akan mengalami proses penuaan, faktor lingkungan yang
memiliki peranan besar terhadap proses penuaan adalah radiasi sinar ultra violet. Pajanan sinar ultra violet yang terjadi secara terus menerus dapat menimbulkan suatu kerusakan pada struktur dan fungsi dari kulit sehingga mempercepat terjadinya proses penuaan pada kulit, oleh sebab itu proses ini disebut penuaan dini kulit atau biasa disebut dengan istilah, photoaging (Fisher et al., 2002; Rabe et al., 2006). Photoaging terutama ditandai timbulnya kerutan yang terjadi akibat kerusakan kolagen oleh reactive oxygen species (ROS) yang terbentuk selama paparan sinar ulraviolet. Proses ini dapat dicegah dengan pemberian antioksidan, baik topikal maupun sistemik.
Buah delima merah (Punica granatum) adalah salah satu sumber antioksidan polifenol, khususnya
punicalagin (elagitanin) yang telah dibuktikan memiliki aktivitas antioksidan yang kuat,
anti-perlakuan pengolesan plasebo (bahan dasar krim). Kelompok 2 adalah kelompok perlakuan, diberi perlakuan pengolesan krim ekstrak metanolik buah delima merah. Selanjutnya dilakukan pengambilan sampel lapisan kulit mencit dan dibuat sediaan histologis untuk kemudian dilakukan pengecatan dengan reagen Sirius Red. Jumlah kolagen dermis pasca perlakuan (post test) pada kelompok kontrol dan perlakuan dinilai secara kuantitatif dari hasil foto kolagen yang diberi pewarnaan Sirius Red dengan metode analisis digital.
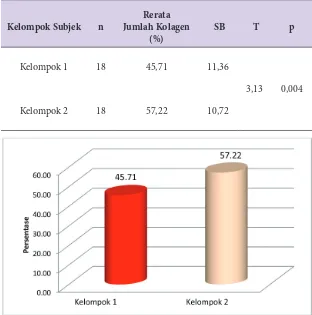
Hasil penelitian menunjukkan rerata jumlah kolagen kelompok kontrol adalah 45,71±11,36% dan rerata jumlah kolagen kelompok perlakuan adalah 57,22±10,72%. Analisis kemaknaan dengan uji t-independent menunjukkan bahwa nilai p = 0,004. Hal ini berarti bahwa kedua kelompok sesudah diberikan perlakuan pengolesan krim, rerata jumlah kolagennya berbeda secara bermakna (p < 0,05).
Dapat disimpulkan dari penelitian ini bahwa krim ekstrak buah delima merah dapat menghambat penurunan jumlah kolagen dermis kulit mencit yang dipapar sinar ultraviolet B.
mencit (area yang mendapat penyinaran) untuk kemudian diaplikasikan bahan dasar krim untuk kelompok 1 dan krim ekstrak buah delima merah pada kelompok. Dilakukan penyinaran dengan menggunakan sinar UVB merek Kernel, KN-4003, dengan dosis total penyinaran pada kelompok pertama sampai dengan kelompok ketiga sebesar 840 mJ/cm2, dengan perincian: 50 mJ/cm2 . pada
minggu pertama, 70 mJ/cm2 pada minggu ke
dua dan 80 mJ/cm2 pada minggu ke 3 dan ke 4.
Penyinaran diberikan 3 kali seminggu selama 4 minggu, sehingga dosis totalnya mencapai 840 mJ/cm2. Bahan dasar krim dan krim buah delima
dioleskan pada punggung mencit dari masing-masing kelompok 1 dan kelompok 2 secara merata pada punggung mencit, dengan volume 0.1 mg/ cm2 pada 3 cm2 luas area penyinaran pada setiap
kali pengolesan. Pengambilan krim dilakukan menggunakan spuit 1 cc, krim diambil sebanyak 0.3 cc, kemudian dioleskan merata pada punggung mencit 2 kali sehari pada pukul 09.40 yaitu 20 menit sebelum disinari (memberikan waktu absorpsi bahan topikal pada kulit) dan pukul 14.00 yaitu 4 jam setelah penyinaran (terbentuknya ROS dimulai 4 jam setelah paparan). Aplikasi bahan topikal tetap dilakukan di hari tanpa penyinaran. Mencit dibiarkan terlebih dahulu selama dua puluh empat jam setelah penyinaran berakhir untuk menyingkirkan pengaruh efek penyinaran akut (Vayalil, 2004).
Pengamatan Histopatologi
Pengambilan sampel kulit dilakukan setelah mengorbankan mencit untuk tujuan pemeriksaan histopatologi. Daerah punggung mencit dieksisi dengan diameter 1 cm dan ketebalan 3 mm. Sampel kemudian dipersiapkan untuk pemeriksaan histopatologi dengan dibuat preparat menggunakan pewarnaan picro Sirius red. Jaringan kolagen yang ditunjukkan dengan warna merah pada gambar kemudian dihitung dengan menggunakan piranti lunak Adobe Photoshop dan Image J.
inflamasi, dan anti-karsinogenik pada beberapa penelitian (Afaq et al.,2005; Seeram et al.,2005, Kawaii et al., 2004). Dalam kondisi fisiologis in vivo, elagitannin akan terhidrolisis menjadi asam elagik (ellagic acid). Pemberian ellagic acid
dari pada fibroblas kulit manusia secara in vitro menunjukkan peningkatan ekspresi mRNA kolagen tipe 1 dan menghambat MMP-1, enzim yang mendegradasi kolagen (Kim et al.,2010).
Ellagic acid juga memberikan efek anti-inflamasi dengan menghambat faktor pro-inflamasi IL-1beta dan IL-6, dan menghambat makrofag (Bae et al., 2010). Jenis polifenol lain dalam buah delima adalah antosianin. Antosianin yang terkandung dalam buah delima terdiri atas jenis delfinidin-3-glukosida, sianidin-delfinidin-3-glukosida, delfinidin 3,5-diglukosida, sianidin-3,5-diglukosida, dan pelargonidin. Antosianin memproteksi kolagen melalui mekanisme penghambatan fosforilasi tirosin kinase, enzim inaktivasi EGF (Bei et al.,2009). Kandungan lain buah delima adalah vitamin C. Vitamin C adalah antioksidan yang berfungsi untuk menjaga jaringan sel, termasuk sel-sel kulit. Selain melindungi kesehatan sel kulit, vitamin C juga berperan aktif dalam produksi kolagen.
Pemberian krim buah delima merah terhadap lapisan kulit diharapkan mampu menghambat penurunan jumlah kolagen dermis yang disebabkan oleh paparan sinar ultraviolet B.
BAHAN DAN METODE
Buah delima merah (Punica granatum) didapatkan dari perkebunan buah delima di daerah Kopeng, Jawa Tengah diekstraksi menggunakan metanol 50% kemudian diformulasikan menjadi krim dengan konsentrasi 20% water in oil pada bahan dasar krim.
Pembuatan krim
Dari ekstrak metanolik buah delima merah, dibuat sedian krim dengan menggunakan basis vanishing cream, dengan formulasi krim yang terdiri dari cera alba 16%, mineral oil 45%, span 80 5%, metilparaben 0.1%, propil paraben 0.2%, pewangi, air suling dan kandungan ekstrak buah delima sebesar 20% (Soejanto, 2013).
Pelaksanaan penelitian
Pada awal penelitian, mencit dibagi menjadi dua kelompok (masing masing kelompok sebanyak 18 ekor) yang dipilih secara random diaklimatisasi di unit Animasi Laboratorium Farmakologi Universitas Udayana. Dilakukan pencukuran dengan menggunakan silet goul pada punggung
Analisa Statistik
Data dianalisis dengan langkah sebagai berikut. Analisa deskriptif untuk melihat karakteristik data, normalitas data diperiksa menggunakan tes Shapiro-Wilk, analisa homogenitas data menggunakan Levene’s test. Analisa komparasi antar kedua kelompok dilakukan dengan menggunakan
HASIL
Analisis efek perlakuan diuji berdasarkan rerata persentase jumlah kolagen antar kelompok sesudah diberikan perlakuan. Hasil analisis kemaknaan dengan uji t-independent disajikan pada Tabel 1.
Tabel 1 menunjukkan bahwa rerata persentase jumlah kolagen kelompok 1 adalah 45,71±11,36% dan rerata jumlah kolagen kelompok 2adalah 57,22±10,72%. Analisis kemaknaan dengan uji
t-independent menunjukkan bahwa nilai t = 3,13 dan nilai p = 0,004. Hal ini berarti bahwa kedua kelompok sesudah diberikan perlakuan, rerata jumlah kolagennya berbeda secara bermakna (p < 0,05).
Histologis
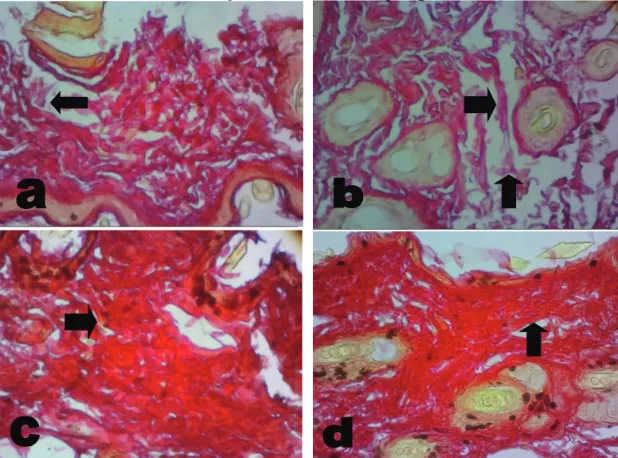
Sediaan histologis kulit mencit dengan pewarnaan Sirius red tampak seperti gambar 2.
DISKUSI
Jumlah Kolagen Mencit
Data jumlah kolagen sesudah perlakuan pada masing-masing kelompok diuji normalitasnya
dengan menggunakan uji Shapiro-Wilk dan homogenitasnya dengan Levene’s test. Hasilnya menunjukkan bahwa semua data berdistribusi normal dan homogen, sehingga digunakan uji parametrik, yaitu uji t-independent.
Pembahasan hasil kelompok 1
Kelompok 1 pada penelitian ini diberikan perlakuan berupa paparan sinar ultraviolet B dengan dosis 840 mJ/cm2 selama 4 minggu dan pengolesan plasebo, menunjukkan adanya kerusakan pada susunan dan struktur jaringan kolagen, sehingga terlihat serat kolagen tidak utuh (mengalami fragmentasi) dan tidak menyerap pewarnaan merah dari Sirius red dengan baik. Kulit yang mengalami photoaging
memiliki gambaran histologis atrofi epidermis dan fragmentasi kolagen dan elastin. Serat kolagen akan mengalami disorganisasi. (Baumann dan Saghari, 2009; Pinnel, 2003).
Penelitian sebelumnya oleh Wahyuningsih (2010) menghasilkan bahwa paparan sinar ultraviolet B pada mencit dengan total dosis 840 mJ/cm2
menunjukan rerata ekspresi kolagen 41.01% dan pada kelompok yang tidak diberi paparan menunjukkan rerata ekspresi kolagen 68.05%. Hal ini menunjukkan persentase penurunan kolagen dermis pada paparan sinar ultraviolet B.
Pembahasan hasil kelompok 2
Berdasarkan hasil analisis sesudah diberikan perlakuan, didapatkan bahwa rerata jumlah kolagen kelompok 1 adalah 45,71±11,36% dan rerata jumlah kolagen kelompok 2 adalah 57,22±10,72%. Analisis kemaknaan dengan uji
t-independent menunjukkan bahwa nilai p = 0,004. Hal ini berarti bahwa kedua kelompok sesudah diberikan perlakuan, rerata jumlah kolagennya berbeda secara bermakna (p < 0,05).
Hal ini didukung dengan penelitian sebelumnya oleh Sun-Young (2004) yaitu gambaran histokimia kulit yang mengalami photoaging menunjukkan jumlah kolagen yang lebih rendah akibat radiasi ultraviolet dan pemberian antioksidan mengakibatkan deposisi kolagen lebih banyak dibandingkan dengan kelompok yang tidak mendapar antioksidan
Jumlah kolagen pada kelompok 1 lebih rendah dibandingkan kelompok 2 disebabkan karena sinar ultra violet dapat membentuk radikal bebas yang dapat mengaktifkan mitogen-activated protein kinase pathways sebagai penghasil kolagenase (MMP-1) yang dapat menghancurkan kolagen. Molekul oksigen (O2) yang ada di bagian bawah
Kelompok Subjek n
Rerata Jumlah Kolagen
(%)
SB T p
Kelompok 1
Kelompok 2
18
18
45,71
57,22
11,36
10,72
3,13 0,004
Tabel 1
Rerata Jumlah Kolagen antar Kelompok Sesudah Diberikan Perlakuan
epidermis merupakan target utama sinar UV-B yang masuk ke dalam kulit. Sinar UV yang menembus kulit dapat sebagai donator sebuah elektron pada molekul oksigen yang menyebabkan oksigen menjadi tidak stabil, kemudian menjadi radikal bebas yang agresif. Di lapisan dermis radiasi ultra violet B menyebabkan kerusakan kolagen pada tingkat yang lebih tinggi daripada kerusakan yang disebabkan penuaan secara alamiah.
Cahaya matahari merusak serat kolagen dan menyebabkan penumpukan atau akumulasi elastin abnormal. Ketika elastin ini terakumulasi enzim yang disebut metalloproteinases akan diproduksi dalam jumlah besar. Biasanya enzim ini berfungsi memperbaiki kulit yang rusak karena sinar dengan menghasilkan dan membentuk kolagen, tapi proses ini tidak selalu berjalan baik dan sejumlah protein ini malah menghancurkan kolagen, hasilnya adalah munculnya kumpulan serat kolagen yang tidak beraturan dikenal sebagai solar scar. Ketika kulit mengulangi proses perbaikan yang tidak sempurna ini secara berulang-ulang terbentuklah keriput. Pada kulit yang mengalami photoaging, serat kolagen mengalami disorganisasi. Hasil penelitian ini sesuai dengan hasil penelitian Gilchrest dan Krutmann (2006), yang mendapatkan bahwa pada kulit yang mengalami photoaging didapatkan penurunan jumlah precursor kolagen tipe I dan III dan
crosslink. Demikian juga penelitian Wahyuningsih
(2010) menunjukan bahwa pajanan sinar ultraviolet B dengan total dosis 840 mJ/cm2 selama 4 minggu
dapat mengakibatkan penurunan jumlah kolagen pada kulit mencit (Mus musculus). Diketahui bahwa ultraviolet B lebih banyak menyebabkan kerusakan sel DNA. Kerusakan yang dapat ditimbulkan berupa lesi DNA pada cyclobutane pyrimidine dimer. Secara klinis kelainannya berupa eritema atau kemerahan. Hasil akhir dari proses glikasi atau advance glycation end product (AGE) yang terakumulasi pada protein yang berusia panjang seperti matriks ekstraseluler ternyata juga berfungsi sebagai sensitiser untuk ultraviolet sehingga dapat merusak sel fibroblas di dermal. Sinar ultra violet juga terbukti meningkatkan degradasi kolagen melalui aktivasi matriks metalloproteinase (MMP). Sinar ultra violet dapat memacu sintesis MMP-1 dan MMP-3 melalui pelepasan TNF-α oleh keratinosit dan fibroblas. UVB secara langsung berefek pada kerusakan DNA terutama pada dua lesi besar yaitu
cyclobutanedimer dan pyrimidine pyrimidonephoto product. Yang secara langsung mempengaruhi sintesis asam nukleat. Walaupun DNA inti memiliki kemampuan untuk memperbaiki diri, kerusakan DNA jarang sekali di perbaiki secara komplit dan berpotensi untuk menjadi sel kanker (Gilchrest dan Yaar, 2000).
Sedangkan pada kelompok 2 terdapat rerata jumlah kolagen yang lebih tinggi menunjukkan bahwa krim ekstrak metanolik buah delima merah dapat menghambat penurunan jumlah kolagen dermis yang disebabkan oleh paparan sinar ultraviolet B. Hal ini disebabkan karena ekstrak metanol krim buah delima merah (Punica granatum)
mengandung polifenol, khususnya punicalagins
(golongan tannin, ellagitanin) dan antosianin (golongan flavonoid) yang telah terbukti memiliki aktivitas antioksidan yang kuat, anti-inflamasi, dan anti-karsinogenik (Afaq et al., 2005; Seeram et al.,
2005; Kawaii et al., 2004). Polifenol mempunyai aktivitas antioksidan yang lebih baik dibandingkan vitamin A, C dan E (Gonzales et al.,2008). Oleh karena itu polifenol dapat mencegah terbentuknya radikal bebas dan peroksidasi lipid akibat paparan sinar ultraviolet. Mekanisme aksi dari polifenol dalam menghambat kerusakan yang disebabkan oleh sinar UV meliputi 3 efek, yaitu efek sunscreen, efek anti inflamasi dan efek antioksidan. Sebagian besar polifenol natural adalah pigmen, umumnya kuning, merah atau ungu dan dapat menyerap radiasi UV. Ketika diberikan secara topikal, polifenol dan mencegah masuknya radiasi ke dalam lapisan kulit. Radiasi yang dapat diserap oleh polifenol meliputi seluruh spectrum UVB dan sebagian UVA dan UVC. Melalui kemampuan absorbsi ini
Gambar 2.A dan B. Sediaan histologis kulit mencit pada kelompok 1 dengan pewarnaan Sirius red pada perbesaran 400x. Tanda panah menunjukan serat kolagen yang tidak utuh
polifenol natural dapat bertindak sebagai sunscreen. Kemampuan polifenol bertindak sebagai sunscreen
dapat mengurangi inflamasi, stress oksidatif, dan kerusakan DNA yang disebabkan oleh radiasi UV pada kulit. Pada pemberian topikal, kemampuan fotoprotektif dari polifenol didapatkan melalui efek
sunscreen tersebut (Nichols dan Katiyar, 2010).
Selain itu, krim ekstrak metanolik buah delima
merah juga mengandung vitamin C, yang merupakan antioksidan yang berfungsi untuk menjaga jaringan sel, termasuk sel-sel kulit. Selain melindungi kesehatan sel kulit, vitamin C
juga berperan aktif dalam produksi kolagen. Dari
hasil penelitian ini didapatkan bahwa pengolesan ekstrak buah delima dapat menghambat penurunan jumlah kolagen sebesar 20,12%. Hasil penelitian ini didukung oleh penelitian sebelumnya yang menyatakan bahwa konsumsi ekstrak kasar buah delima telah dibuktikan berhubungan dengan peningkatan aktivitas penyembuhan luka dan inhibisi dari mitogen-activated protein kinase
(MAPK), MMP, dan NF κB pada keratinosit epidermal manusia dan kondrosit (Vayalil et al.,
2003; Kawaii et al., 2004). Demikian juga hasil penelitian Khan et al .(2012), yang menyatakan bahwa konsumsi per oral dari ekstrak delima merah pada tikus SKH-1 dapat menghambat hyperplasia epidermal, infiltrasi leukosit, oksidasi protein dan peroksidasi lipid. yang diinduksi oleh sinar UVB. Penelitian tentang penggunaan delima secara topikal masih belum banyak dipublikasikan. Kemampuan ekstrak metanolik buah delima merah dalam menghambat penurunan kolagen dermis kemungkinan disebabkan karena kandungan polifenol khususnya elagitanin (golongan tanin) dan antosianin serta vitamin C.
SIMPULAN
Berdasarkan hasil penelitian dapat disimpulan bahwa pemberian krim ekstrak metanolik buah delima merah dapat menghambat penurunan jumlah kolagen dermis kulit mencit (Mus musculus)
yang dipapar sinar ultraviolet B.
DAFTAR PUSTAKA
Adlhiati, F. 2007. Efek Pemaparan Ultraviolet secara Kronis terhadap Histologi Telinga luar (Auricula) mencit (Mus musculus). Universitas Muhammadiyah Yogyakarta.
Afaq, F., and Mukhtar, H. 2006. Botanical Antioxidants in Prevention of Photocarcinogenesis and Photoaging. Journal of Experimental Dermatology.15(9):678-84
Afaq, F., Saleem, M., Krueger, C. G., Reed, J. D. and Mukhtar, H. 2005. Anthocyanin- and hydrolysable tannin-rich pomegranate fruit extract modulates MAPK and NF-kappaB pathways and inhibits skin tumorigenesis in CD-1 mice. International Journal of Cancer 113 (3),423–33.
Al-Maiman, S.A.,and Ahmad, D. 2002. Changes in physical and chemical properties during pomegranate (Punica granatum) fruit maturation.
Journal of Agricultural Food Chemistry 76: 437-41. Angernofer, C.K., Maes, D., Giacomoni, P.O. 2008. The Use of Natural Copounds and Botanicals in the Development of Anti Aging Skin Care Product. In: Nava Dayan, editor. Skin Aging Handbook, An Integrated Approach to Biochemistry and Product. William Andrew Inc. p.157-226
Astawan, M. 2008. Sehat Dengan Buah. Cetakan pertama. Jakarta. Penerbit Dian Rakyat. Halaman:40-45
Baskoro, A., Konthen, P.G. 2008. Basic Immunology of Aging Process. Naskah Lengkap pada 5th Bali
Endocrine Update 2nd Bali Aging and Geriatric
Update Symposium. Bali 11-13 April 2008.
Baumann, L. 2005. How to Prevent Photoaging. The Journal of Investigative Dermatology, 125:12-13 Baumann, L. 2008. Cosmetic and Skin Care in Dermatology, in : Wolff, K., Goldsmith, L.A, Katz, S.L., Gilchrest, B.A., Paller, A.S., Leffell, D.J., editors.
Fitzpatrick’s Dermatology in General Medicine.7th.
Ed. New York: Mc graw-Hill. P.2363-67.
Baumann, L. and Alleman, I.B. 2009. Antioksidant. In: Baumann, L., editor. Cosmetic Dermatology. Principle and Practice. New York: Mc Graw Hill. p. 292-311
Baumann, L. and Saghari, S. 2009. Basic Science of the Epidermis. In : Baumann, L., Saghari, S., Weisberg, E., editors. Cosmetic Dermatology Principles And Practice. Second Edition. USA: The McGraw-Hill Companies. 3-7.
Beers, M. 2005. The Merck Manual of Health and Aging. USA:Ballantine Book Trade Paperback. P 24-25
Bei R., Masuelli L., Turriziani M., Volti G.L., Malaguarnera M. and Galvano F. 2009. Impaired Expression and Function of Signaling Pathway Enzymes by Anthocyanins: Role on Cancer Prevention and Progression. Journal of Enzyme Inhibiton and Medical Chemistry. 5:184-97
Berneburg, M., Plettenberg, H., Krutmann, J. 2000.
Biewenga, G.P., Haenen G.R.M.M., Bast A. 1997. The Pharmacology of the Antioxidant Lipoic Acid.
General Pharmacology. 29(3):315-31
Biro Pusat Statistik (BPS). 2005. Proyeksi Penduduk Indonesia 2000-2005 . Badan Perencanaan pembangunan Nasional. BPS. United Population Fund. Jakarta.
Budka, F. 2008. Active Ingredients, Their Bioavaibility and The Health Benefit of Punica granatum.
Accessed 19 December 2012
Campbell, D. 1963. Experimental and Quasi-Experimental Design for Research. Boston: Houghton Miffin Company. p. 13-22.
Chen, L., Hu, J.Y. and Wang, S.Q. 2012. The Role Antioxidant in Photoprotection: a critical review. The Journal of the American Academy of Dermatology. 63:1-12
Choi, C.P., Kim, Y.I., Lee, J.W., Lee, M.H. 2007. The Effect of Narrowband Ultraviolet B on the Expressions of Matrix Metalloproteinase-1,Transforming Growth Factor- β1 and Type 1 Collagen in Human Skin Fibroblast. Experimental Dermatology. Department of Dermatology, Kyunghee University, Seoul, Korea. Chung, J., Hanf, V.N. and Kang, S. 2003. Aging and Photoaging. The Journal of the American Academy of Dermatology . 49:690-7
Chung, J.H., Cho, S. and Kang, S. 2004. Why Does the Skin Age? Intrinsic Aging , Photoaging and Their Pathophysiology. in: Rigel, D.S., Weiss, R.A., Lim, H.W., Dover, J.S. editors. Photoaging. New York: Marcel Dekker Inc. p. 1-23.
Chung, J.H., Seo, J.Y., Choi, H.R., Lee, M.K., Youn, C.S., Rhie, G., Cho, K.H., Kim, K.H., Park, K.C. and Eun, H.C. 2001. Modulation of Skin Collagen Metabolism in aged and Photoaged Human Skin In Vivo. Journal of Investigative Dermatology. 117:1218-1224
Cooper, R. 1997. Oxidant, antioxidant and Free Radicals, in Antioxidant, Woodland Health Series. In: Cooper, R. 1-8
Cunningham, W., Baran, R. and Maibah H. 2005.
Aging and Photoaging. In:Textbook of Cosmetic Dermatology. Francis: Taylor 3rd. ed. London. 443-5.
Desmond, T. 2000. Tropical Fruit of Indonesia.
Archipelago Press.
Diegelmann, R.F. 2008. Collagen Metabolism., Available from: www.medscape.com
Eroschenko, V.P. 2008. DiFiore’s Atlas of Histology with Functional Correlation. Philadelphia: Lippincot Williams & Wilkins
Fisher, G.J., Wang, Z.Q., Datta , S.C., Varani, J., and Kang, S., 2001. Pathophysiology of Premature Skin Aging. New England Journal of Medicine. Vol. 337: 1419-29
Fisher, G.J., Kang, S., Varani, J., Csorgo, Z.B., Wan, Y., Datta, S., Voorhees, J.J. 2002. Mechanism of Photoaging and Chronological Skin Aging.Archives of Dermatology. Department of Dermatology, University of Michigan, Ann Arbor. 138:1462-1470. Fisher, G.J., Voorhees, J.J., Kang, S., Quan, T., He, T. 2004. Solar UV Irradiation Reduces Collagen in Photoaged Human Skin by Blocking Transforming Growth Factor-β TypeII Receptor/Smad Signaling. American Journal of Pathology. vol 165(3):741-58. Fisher, G.J., Choi, H.C., Sorgo, Z., Kang, W.S. and Voorhess, J.J. 2007. Ultraviolet Irradiation Increase Matrix Metalloproteinase-8 Protein in Human Skin Invitro. Journal of Investigative Dermatology .117-26
Fowler, B. 2003. Functional and Biological Markers of Aging in Klatz, R. Anti Aging Medical Therapeutic Vol 5. The A4M Publication.Chicago. p. 43.
Garmyn, M., Vander Oord, J.C., Cho, S., and Kang S. 2004. Clinic and Histological change in Photoaging
in: Rigel, D.S., Weiss, R.A., Linn, H.W., Dover, J.S. editors. Photoaging, 2nd ed. Canada: Maarced
Decker inc. p33-55
Gilchrest, B.A., Yaar, M. 2000. Aging of Skin. In: Fitzpatrick T.B. et al, editors. Dermatology in General Medicine, Mc Graw-Hill Book Co 2, p. 1386-1387.
Gilchrest, B.A., Krutmann, J. 2006. Skin Aging. Springer Publisher.
Glogau, R.G. S. 2004. Photo Aging and Aging Skin. in: Rigel D.S., Weiss R.A., Linn H.W., Dover J.S. editors. Photoaging, 2nd ed. Canada: Maarced
Decker inc. p 65-73
Gloster, H.M., and Neal, K. 2006. Skin Cancer in Skin Colour.The Journal of American Academy of Dermatology . Vol.55: 741-60
Goldman, R., and Klatz, R. 2003. The New Anti-Aging Revolution. Theories of Aging; 19-32
Gonzales, S., Fernandez-Lorente, M., Gilaberte-Calzada, Y. 2008. The latest on Skin photoprotection.
Clinics in Dermatology. 26:614-26
Gunjan, J., Nainwani, R., Singh, D. and Soni, P.K. 2012. Review Article: Antioxidant Activity of Various Parts of Punica granatum. Journal of Drug Delivery & Therapeutics. 2(6):13
Haywood, R., Wardman, P., Sanders, R. and Linge, C. 2003. Sunscreens inadequately protect against ultraviolet-A-induced free radicals in skin, implication for skin aging and melanoma? Journal of Investigative Dermatology. 121:862-8
Helfrich Y.R., Sachs D.L. and Voorhes J.J. 2008. Overview of Skin Aging and Photoaging. Medscape Dermatology Nursing. 20(3):177-183
Heryani. 2010. Aktivitas Fraksi Polifenol Buah Delima (Punica granatum) terhadap Peroksidasi Lipid Darah Tikus yang Diinduksi Parasetamol. Skripsi. Departemen Biokima. IPB.
Holder, R.M., and Richard, G. 2004. Photo Aging in Patients of Skin Colour in: Rigel D.S., Weiss, R.A., Linn, H.W., J.S. editors. Photoaging, 2nd ed. Canada:
Maarced Decker inc. p 55-65.
Huy, L.A.P., He, H. and Huy, C.P. 2008. Free Radical, Antioxidants in Disease and Health. International Journal of Biomedical Science. Vol: 4, no. 2. p. 89-95. Jain, S. 2012. Dermatology. Journal of Ilustrated Study Guide and Comprehensive Board Review. USA: Springer Science, Bussiness Media. ILC. p. 2-10.
Junqueira, L.C., Carneiro, J., Kelley, R.O. 2004. Histologi Dasar Kulit. Edisi 10. Penerbit Buku Kedokteran EGC. hal 357-369.
Kawaii, S., Lansky, E. P. 2004. Differentiation-promoting activity of pomegranate (Punica granatum) fruit extracts in HL-60 human promyelocytic leukemia cells. Journal of Medicinal Food, 7 (1), 13–18.
Khan,N., Syed, D.S., Pal, H.C., Mukhtar, H., Afaq, F. 2012. Pomegranate Fruit Extract Inhibits UVB-induced Inflammation and Proliferation by Modulating NF-κB and MAPK Signaling Pathways in Mouse Skin. In: Photochemistry and Photobiology. Wiley Periodicals, Inc.
Kierman, J.A. 2010. Sirius Red Staining Protocollagen. IHC World. Available from: URL:http//print/Sirius Red 20% Protocol/html.
Klatz, R. 2003. Anti Aging medical Therapeutics Vol 5..The A4M publication. Chicago. p. 3.
Klatz, R., and Goldman, R. 2003. Anti Aging Revolution. Third Edition. Boulevard East:Basic Health Publication.
Kochevar, I.E., and Taylor, C.R. 2008. Photophysics, Photochemistry and Photobiology.In: Feedberg
I.M., Eisen A.Z., Wolff K, Austen K.F., Goldsmith LA, Katz S.I, editors. Fitzpatrick’s dermatology in general medicine; 7th ed. New York:McGraw-Hill.
p. 1267-75.
Kristina, A.S. 2007. Kapita Selekta Dispensing 1. Edisi Revisi. Yogyakarta
Kullavanijaya, P., and Lim, H.W. 2005.
Photoprotection. The Journal of American Academy of Dermatology. 52:937-958
Li Y. 2006. Evaluation of antioxidant properties of pomegranate peel extract in comparison with pomegranate pulp extract. Journal of Food Chemistry. 96: 254-260
Lingga, L. 2012. The Healing Power of Antioxidant.
Jakarta: PT Elex Media Komputindo. Hal: 1-6, 26-28.
Lisbeth, A., Pacheco-Palencia., Giuliana, N., Lal, H., Stephen, T.T., Susanne, U. 2008. Protective Effects of Standardized Pomegranate (Punica granatum
L.) Polyphenolic Extract in Ultraviolet-Irradiated Human Skin Fibroblasts. Journal of Agricultural Food Chemistry. 56(18):8434-41
Lodovici, M., Guglielmi, F., Casalini, C., Meoni, M., Chenier, V., Dolara, P. 2001. Antioxidant and radical scavenging properties in vitro of polyphenolic extracts from red wine. European Journal of Nutrition. 40(2):74-77
Marcyxk, G.R., DeMatteo, D., Festinger, D. 2005.
Essentials of Research Design and Methodology. UK: Wiley Publisher.
Masaki, H. 2010. Role of antioxidant in the Skin: Anti Aging effects. Journal of Dermatology Science.
58: 85-90.
Moyal, D., Fountainer, A. 2004. Acute and Chronic Effect of Ultraviolet. What are they and How to Study. in : Rigel, D.S., Weiss R,A., Linn H.W., Dover J.S. editor. Photoaging 2nd ed. Canada: Marceed
Decker Inc. p.15-54
Murthy, K. N.; Reddy, V. K.; Veigas, J. M.; Murthy, U. D. 2004. Study on wound healing activity of Punica granatum peel. Journal of Medicinal Food, 7
(2), 256–259.
Ngatidjan. 2006. Dasar-dasar Uji Laboratorium dalam Toksikologi. Metode Laboratorium dalam Toksikologi. Yogyakarta: UGM. p. 81-82
Nichols J.A., and Katiyar S.K. 2010. Archives of Dermatology Research. 302:71-83
Obagi, Z.E. 2000. Skin Health Concepts, in Obagi Skin Health Restoration & Rejuvenation. Springer.
Pangkahila, W. 2011. Anti Aging Medicine:Memperlambat Penuaan, Meningkatkan Kualitas Hidup. Cetakan ke 2. Jakarta: Penerbit Buku Kompas
Pinnel, R.S. 2003. Cutaneous Photodamage, Oxidative Stress, and Topical Antioxidant Protection, A Continuing Medical Education,
American Academy of Dermatology. p. 1-19. Rabe, J.H., Mamelak, A.J., Mc Elgunn, P., Morison, W.L., Sauder, D.N. 2006. Photoaging : Mechanism and Repair, Continuing Medical Education,
American Academy of Dermatology, Inc. p.1-19. Rhein, L.D. and Santiago, J.M. 2010. Matrix Metallo Proteinase, Fibrosis, and Regulationby Transforming Growth Factor Beta: A new Frontier in Wrinkle Repair. In:Rhein, L.D., Fluhr J.M., editors. Aging Skin: Current and FutureTherapeutic Strategis 1st
ed.USA: AlluRed Bussiness Media. P. 26-81
Rigel, D. S., Weiss, R. A., Lim, H.W. and Dover, J. S. 2004. Photoaging. New York: Marcel Dekker, Inc. Ryan, T.P., 2008. Sample Size Determination and Power. New Jersey:Wiley
Seeram, N. P.; Adams, L. S.; Henning, S. M.; Niu, Y.; Zhang,Y.; Nair, M. G.; Heber, D. 2005. In vitro antiproliferative, apoptotic and antioxidant activities of punicalagin, ellagic acid and a total pomegranate tannin extract are enhanced in combination with other polyphenols as found in pomegranate juice.
Journal of Nutrition and Biochemistry, 16 (6), 360– 67.
Seltzer, J.L. and Eisen, A.Z. 2006. The Role of Extracellular Matrix Metalloproteinases in Conective Tissue Remodelling. In: Fitzpatrick T.B. et al, editors. Dermatology. Mc Graw-Hill Book co, p 200-209. Singh, R.P., Murthy, K.N.C. and Jayaprakasha, G.K. 2002. Studies on antioxidant activity of pomegranate peel and seed extract using in vitro models. Journal of Agricultural and Food Chemical. 50:81-86. Smith, E.S. 2001. Demographics of Aging and Skin Disease, in Geriatric Dermatology part I. p. 63. Soejanto, A.S. 2013. Pemberian Krim Ekstrak Metanolik Buah Delima Merah (Punica granatum) Menghambat Penurunan Jumlah Kolagen Dermis Kulit Mencit (Mus musculus) yang Dipapar Sinar Ultraviolet B. Penelitian pendahuluan. Denpasar:Universitas Udayana.
Soepardiman, L. 2003. Etiopatogenesis Kulit Menua. In: Peremajaan Kulit. Jakarta: Balai Penerbit FKUI. P. 1-9.
Soni, M.G., Thurmond T.S. Miller, E.R., Spriggs, T,Bendicht, A. and Omave, S.T. 2010. Safety of Vitamins and Mieneral Controversi and Perspective.
Toxicological Science. Vol.118, issues 2:348-55 Sterm, R.S. 2004. Treatment of Photoaging. New England Journal of Medicine. Vol. 35 1526-34 Suryohusodo, P. 2000. Kapita Selekta Ilmu Kedokteran Molekuler. Perpustakaan Nasional RI. Jakarta: Sagung Seto.
Suwardi. 2011. The Miracle of Noni: Keajaiban Mengkudu dalam Mencegah dan Menyembuhkan Kanker. PT. Ufuk Publishing House. Hal: 104, 128-135.
Tandon, R. 2005. Antioxidant: Past and Present. Available from: www pharmainfo-net/reviews/ antioxidant past and present
Uito, J.,Chu, M., Gallo, R. and Eizen, A.Z. 2008.
Collagen, Elastic fibers and Extracellular Matrix of the Dermis. In: Wolff, K., Gold Smith, L.A., Katt S.I.,Gilchrest., B.A., Paller, A.S.,Leffel, D.J., editors.
Fitzpatrick’s Dermatology in General Medicine. 6th.
ed. New York: McGraw-Hill. p. 517-41
Varani, J., Quan, T.H. and Fisher GJ. 2010.
Mechanism and Pathophysiologi of Photoaging and Chronological Skin Aging. In:Rhein, L.D., Fluhr J.M., editors. Aging Skin: Current and Future Therapeutic Strategic. 1st ed. USA:AlluRed Bussiness Media. P.
1-25
Vayalil, P. K.; Elmets, C. A. and Katiyar, S. K. 2003. Treatment of green tea polyphenols in hydrophilic cream prevents UVB-induced oxidation of lipids and proteins, depletion of antioxidant enzymes and phosphorylation of MAPK proteins in SKH-1 hairless mouse skin. Journal of Carcinogenesis, 24 (5), 927-936.
Vayalil, P.K., Mitta, A., Hara, Y., Elmets, C.A., Hara, Y. and Katiyar, S.K. 2004. Green Tea Polyphenol Prevent Ultraviolet Light Induce Oxidative Damage and Matrix Metalloproteinase Expression in Mouse Skin. Journal of Investigation Dermatology.
122:1480-87.
Wasitaatmadja, S.M. 2007. Anatomi dan Faal kulit.
dalam: Djuanda, A., Hamzah, M., Aisah, S. editor. Ilmu Penyakit kulit dan Kelamin. Edisi 5. Balai Penerbit FKUI. 7-8.
WHO Report . 2010. WHOSIS (WHO Statistical Information System). Available at: http://apps.who. int/whosis/database/core/core_select_proccess. cfm/ Accesed Januari 9, 2012
Widodo, Y., Dahlan I., 2007. The Effect of Narrow and Broad Band Ultraviolet B Onto Keloid Fibroblast-VEGF Expressions. Berkala Ilmu Kedokteran vol 39(2).
Winarsi, H. 2007. Antioksidan alami dan Radikal Bebas, Potensi dan aplikasinya dalam kesehatan. Kanisius. .
Yaar, M. 2006. Clinical and Histological Features of Intrinsic versus Extrinsic Skin Agin., in : Gilchrest, B.A., Krutmann, J. editors. Skin Aging. Springer. p.10-21.
Yaar, M., and Gilchrest, B.A. 2008. Aging of Skin. In: Feedberg, I.M., Eisen, A.Z., A.Z., Wolff,K.,Austen, K.F., Goldsmith, L.A.Katz, S.I., editors. Fitzpatrick’s Dermatology in General Medicine. 6th ed. Newyork:
Mc Graw-Hill.p 963-75