RENCANA PELAKSANAAN PEMBELAJARAN (RPP) A. Nama Satuan Pendidikan : SMA ……….
B. Mata Pelajaran : Kimia C. Kelas/Semester : XI / Dua
D. Materi Pokok : Asam dan Basa
E. Alokasi Waktu : 2 x 45 menit F. Tujuan Pembelajaran :
Kognitif
1. Menjelaskan pengertian asam basa menurut Arrhenius. 2. Membedakan larutan berdasarkan sifat asam dan basa. 3. Menjelaskan pengertian asam basa menurut Bronsted-Lowry. 4. Menunjukkan pasangan asam basa konjugasinya.
5. Menjelaskan pengertian asam basa menurut Lewis. Afektif
1. Mengajukan pertanyaan.
2. Menjawab / menanggapi pertanyaan. 3. Menyampaikan ide / pendapat. 4. Bekerja sama dalam kelompok. G. Kompetensi Dasar
2.1 Menunjukkan perilaku ilmiah (memiliki rasa ingin tahu, disiplin, jujur, objektif, terbuka, mampu membedakan fakta dan opini, ulet, teliti, bertanggung jawab, kritis, kreatif, inovatif, demokratis, komunikatif) dalam merancang dan melakukan percobaan serta berdiskusi yang diwujudkan dalam sikap sehari-hari.
2.2 Menunjukkan perilaku kerjasama, santun, toleran, cinta damai dan peduli lingkungan serta hemat dalam memanfaatkan sumber daya alam.
3.1 Menganalisis sifat larutan berdasarkan konsep asam basa dan/atau pH larutan. H. Indikator pencapaian kompetensi
1. Mendeskripsikan teori-teori asam-basa 2. Mengidentifikasi sifat larutan asam-basa 3. Menjelaskan sifat larutan asam-basa
4. Menentukan derajat keasaman (pH), derajat ionisasi, dan tetapan kesetimbangan asam-basa
6. Melakukan, menyimpulkan dan menyajikan hasil percobaan tentang penggunaan indikator yang tepat untuk menentukan keasaman asam/basa I. Materi pembelajaran
Teori Asam Basa
Larutan yang bersifat asam dan basa berkaitan erat dengan adanya ion hidrogen (H+) dan ion hidroksi (OH-). Fenomena ini diselidiki oleh Arrhenius, yang selanjutnya dikenal dengan Teori Asam-Basa Arrhenius.
Menurut Arrhenius, jika hidrogen klorida (HCl) dilarutkan dalan air (H2O), maka terjadi reaksi ionisasi:
HCl H+ + Cl
-Dalam hal ini dihasilkan ion H+ sehingga HCl dinyatakan bersifat asam.
Hal lain terjadi jika Kristal natrium hidroksida (NaOH) dilarutkan dalam air, maka terjadi reaksi ionisasi:
NaOH Na+ + OH
-Oleh karena menghasilkan ion OH-, maka NaOH dinyatakan bersifat basa.
Teori asam basa terus mengalami perkembangan sejalan dengan berbagai fenomena yang tidak dapat dijelaskan dengan Teori Asam-Basa Arrhenius. Seperti pada reaksi berikut: H2SO4 + NH3 NH4+ + HSO4
-Dalam hal ini tidak terlihat jelas adanya ion H+ atau ion OH-. Untuk menjawab fenomena ini, maka Brosted dan Lowry mengajukan teori yang selanjutnya dikenal dengan Teori Asam-Basa Bronsted-Lowry.
Pada kasus reaksi H2SO4 dan NH3, terlihat bahwa NH3 menerima proton (H+) menjadi NH4+ sehingga NH3 dinyatakan sebagai basa. Sedangkan H2SO4 memberi proton (H+) menjadi HSO4- sehingga H2SO4 disebut sebagai asam.
Dalam hal ini dikenal adanya pasangan asam basa konjugasi, yang disajikan pada tabel berikut:
Asam Konjugasi Basa Konjugasi
H2SO4 HSO4
-NH4+ NH3
Pada reaksi berikut: NH3 + HCl NH4Cl
Pada kasus tersebut tidak terlihat adanya ion H+, ion OH-, donor proton, dan akseptor proton. Untuk menjawab fenomena tersebut, maka Lewis mengemukakan teori yang selanjutnya dikenal dengan Teori Asam Basa Lewis. Penjelasannya adalah sebagai berikut:
H3N: + H+ + Cl- NH4+ + Cl- → NH4Cl
Dalam hal ini, NH3 menyumbang (donor) pasangan elektron sehingga disebut Basa Lewis. Sedangkan HCl penerima (akseptor) pasangan elektron sehingga disebut sebagai Asam Lewis.
Asam Basa dalam Kehidupan Sehari-hari
untuk memecah makanan dalam lambung. Asam mengaktifkan enzim yang dapat memecah protein dalam makanan. Namun jika asam yang ada di dalam lambung terlalu tinggi, maka dapat menyebabkan penyakit maag. Untuk pengobatannya dapat menggunakan antasid, yang berfungsi untuk menetralkan asam lambung. Antasid terbuat dari aluminium hidroksida serta magnesium hidroksida, yang mana keduanya merupakan senyawa basa. Jika basa bertemu dengan asam akan menghasilkan garam dan air, yang mana merupakan senyawa yang netral. Kekuatan Asam Dan Basa
Asam Kuat dan Basa Kuat Asam Kuat
Asam kuat yaitu senyawa asam yang dalam larutannya terion seluruhnya menjadi ion-ionnya. Reaksi ionisasi asam kuat merupakan reaksi berkesudahan. Secara umum, ionisasi asam kuat dirumuskan sebagai berikut.
HA(aq) H+(aq) + A–(aq) [H+] = valensi asam · M Basa Kuat
Basa kuat yaitu senyawa basa yang dalam larutannya terion seluruhnya menjadi ion-ionnya. Reaksi ionisasi basa kuat merupakan reaksi berkesudahan. Secara umum, ionisasi basa kuat dirumuskan sebagai berikut.
M(OH)x(aq) Mx+(aq) + x OH–(aq)
[OH–] = valensi basa · M
1. Asam Lemah dna Basa lemah Asam Lemah
Asam lemah yaitu senyawa asam yang dalam larutannya hanya sedikit terionisasi menjadi ion-ionnya. Reaksi ionisasi asam lemah merupakan reaksi kesetimbangan. Secara umum, ionisasi asam lemah valensi satu dapat dirumuskan sebagai berikut.
HA(aq) H+(aq) + A–(aq)
Makin kuat asam maka reaksi kesetimbangan asam makin condong ke kanan, akibatnya Ka bertambah besar. Oleh karena itu, harga Ka merupakan ukuran kekuatan asam, makin besar Ka makin kuat asam.
Basa Lemah
Basa lemah yaitu senyawa basa yang dalam larutannya hanya sedikit terionisasi menjadi ion-ionnya. Reaksi ionisasi basa lemah juga merupakan reaksi kesetimbangan. Secara umum, ionisasi basa lemah valensi satu dapat dirumuskan sebagai berikut.
M ¿ X+¿
−¿ OH¿
¿ ¿ ¿ Kb=¿ O H
¿ −¿
¿ ¿ O H
¿ −¿
¿ ¿
Makin kuat basa maka reaksi kesetimbangan basa makin condong ke kanan, akibatnya Kb bertambah besar. Oleh karena itu, harga Kb merupakan ukuran kekuatan basa, makin besar Kb makin kuat basa.
2. Derajat Disosiasi (α)
Banyak sedikitnya jumlah zat yang terionisasi dinyatakn dengan derajat disosiasi (α ). Derajat disosiasi (α) adalah harga perbandingan antara jumlah molekul zat yang terionisasi dengan jumlah molekul zat mula-mula. Nilai derajat ionisasi (α ) dapat ditentukan dengan persamaan berikut.
α=jumlah zat yang terionisasi jumlah zat mula−mula
Berdasarkan rumus di atas, maka nilai a untuk: 1. Elektrolit kuat, α = 1
2. Elektrolit lemah, 0 < α < 1 3. Non-elektrolit, α = 0 Derajat Keasaman (pH)
1. Konsep pH
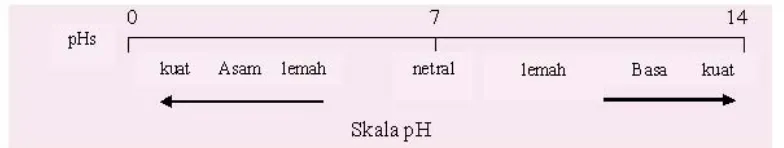
pH adalah derajat keasaman yang digunakan untuk menyatakan tingkat keasaman atau kebasaan yang dimiliki oleh suatu larutan. Nilai pH berkisar antara 0 sampai 14. Air murni
bersifat netral, dengan pH-nya pada suhu 25 °C ditetapkan sebagai 7. Larutan dengan pH kurang dari tujuh disebut bersifat asam, dan larutan dengan pH lebih dari tujuh dikatakan bersifat basa atau alkali. Gambar 1 menunjukan skala derajat keasaman.
Gambar 1. Skala Derajat Keasaman
sederhana. Bilangan ini diperoleh dari hasil logaritma konsentrasi H+. Bilangan ini kita kenal dengan skala pH. Nilai pH dinyatakan dengan rumus:
pH= -log[H+]
Untuk menyatakan konsentrasi OH- digunakan skala pOH. Niali pOH dinyatakan dengan rumus:
pOH= -log[OH-] 2. Menghitung pH larutan
a. Asam Kuat dan Basa Kuat
Setelah kita dapat menghitung konsentrasi ion H+ dan ion OH–, maka kita dapat menghitung harga pH–nya.
[H+] = valensi asam · M pH= -log[H+] [OH-] = valensi basa · M
pOH= -log[OH-] pH= 14-pOH b. Asam Lemah dan Basa Lemah
Setelah kita dapat menghitung konsentrasi ion H+ dan ion OH–, maka kita dapat menghitung harga pH–nya.
H ¿ +¿
¿ ¿
pH= -log[H+] O H
¿ −¿
¿ ¿
pOH= -log[OH-] pH= 14-pOH 3. Campuran Asam dan Asam
+¿
4. Campuran Basa dan Basa
Campuran basa dan basa merupakan campuran yang memiliki ion sama yaitu OH- , sehingga tidak bereaksi. pH larutan tersebut dapat dihitung jika konsentrasi diketahui
−¿
J. Metode Pembelajaran Model : Etnosains
Metode : Demonstrasi dan diskusi kelompok Pendekatan : Kontekstual
K. Kegiatan Pembelajaran
No Aktivitas
1. Pendahuluan (10 menit)
Dengan disiplin guru memasuki ruang kelas dengan tepat waktu.
Untuk menanamkan karakter religius pada siswa, guru
mengucapkan salam dan memimpin doa sebelum pembelajaran dimulai.
Guru memeriksa kehadiran siswa.
Guru memberi motivasi kepada siswa dengan menyampaikan materi yang akan dipelajari beserta manfaatnya dalam
kehidupan sehari-hari
Guru mengkomunikasikan tujuan dan model pembelajaran kepada siswa
2. Kegiatan inti (65 menit):
Guru membagi siswa dalam beberapa kelompok secara acak dan duduk sesuai dengan kelompok yang telah dibagi, misalnya dibagi 4 kelompok
Guru menginstruksikan kepada setiap kelompok untuk mengeluarkan bahan-bahan indikator asam-basa alami yang telah diperintahkan pada pertemuan sebelumnya. Adapun indikator asam-basa alami yang dibawa siswa yaitu (Kunyit, Daun pacar air, Daun rhoeo discolor, dan Bunga sepatu)
Mengamati :
Kepada tiap kelompok siswa diberikan bahan-bahan kimia berupa larutan asam dan basa serta prosedur kerja yang akan dilakukan kemudian siswa melakukan percobaan berdasarkan prosedur kerja Menanya :
Siswa diberi kesempatan untuk mengajukan pertanyaan yang terkait dengan materi asam basa yang telah dipelajari dari buku pegangan siswa maupun dari hasil percobaan yang dilakukan siswa. Peserta didik menanyakan (menimbulkan rasa ingin tahu) bahan alami apa saja yang digunakan sebagai indikator mengapa bisa terjadi demikian. Guru menanyakan fungsi dari indikator alami yang digunakan.
Mengumpulkan data :
Peserta didik melakukan percobaan mengenai identifikasi sifat larutan asam dan basa dengan menggunakan indikator, serta penentuan bahan alam yang dapat dijadikan sebagai indikator larutan asam dan basa. Peserta didik mengamati dan mencatat data hasil percobaan dalam LKPD.
Mengasosiasikan :
Peserta didik mengolah dan menganalisis data percobaan untuk menyimpulkan sifat berbagai larutan uji serta menentukan bahan alam yang dapat digunakan sebagai indikator larutan asam dan basa. Peserta didik mendiskusikan dengan teman kelompok hasil percobaan yang diperoleh dan menjawab permasalahan yang tertera dalam LKPD.
a. Pada larutan asam :
Jika diberi indikator alami kunyit maka warna larutan berubah menjadi kuning.
Jika diberi indikator alami daun pacar air maka warna larutan berubah menjadi merah.
Jika diberi indikator alami daun rhoeo discolor maka warna larutan berubah menjadi merah muda.
b. Pada larutan basa :
Jika diberi indikator alami kunyit maka warna larutan berubah menjadi merah
Jika diberi indikator alami daun pacar air maka warna larutan berubah menjadi kuning
Jika diberi indikator alami daun rhoeo discolor maka warna larutan berubah menjadi hijau
Jika diberi indikator alami bunga sepatu maka warna larutan berubah menjadi hijau
Mengkomunikasikan :
Peserta didik membuat laporan percobaan dan mempresentasikan sifat berbagai larutan uji berdasarkan percobaan serta menyampaikan bahan alam apa saja yang dapat dijadikan sebagai indikator larutan asam dan basa.
3. Penutup (15 menit)
Guru memandu siswa menyimpulkan dengan menarik benang merah dari percobaan yang dilakukan.
Setiap kelompok membuat hasil diskusi dan laporan praktikumnya untuk dikumpulkan.
Bersama siswa, guru melakukan refleksi pembelajaran serta menunjuk siswa secara acak untuk mengemukakan pendapatnya mengenai proses identifikasi larutan asam basa dengan indikator alami.
Guru memberikan tugas rumah dan meminta siswa untuk mengerjakan dengan penuh tanggung jawab.
Guru menyampaikan informasi pertemuan berikutnya akan membahas titrasi asam basa dan kurva titrasi
Guru menutup pembelajaran dengan memimpin doa dan mengucapkan salam untuk menanamkan religius pada siswa.
L. Penilaian Pembelajaran, Remedial, dan Pengayaan
1. Teknik Penilaian dan Instrumen Penilaian
No .
Aspek Mekanisme dan Prosedur
Instrumen Ketera -ngan
1. Kognitif 1. Penugasan
2. Tes tertulis 1. Soal penugasan 2. Soal objektif
-2. Afektif 1. Observasi kerja kelompok
1. Lembar observasi
-3. Psikomoto rik
1. Kinerja presentasi 2. Laporan praktik
1. Kinerja presentasi 2. Rubrik
penilaian
-M. Media, Alat dan Bahan, dan Sumber Belajar 1. Media : Bahan tayang (Power Point)
2. Alat dan Bahan : Sampel larutan, bahan-bahan alami Kunyit, Daun pacar air, Daun rhoeo discolor, dan Bunga sepatu), kertas indicator
universal