LAPORAN
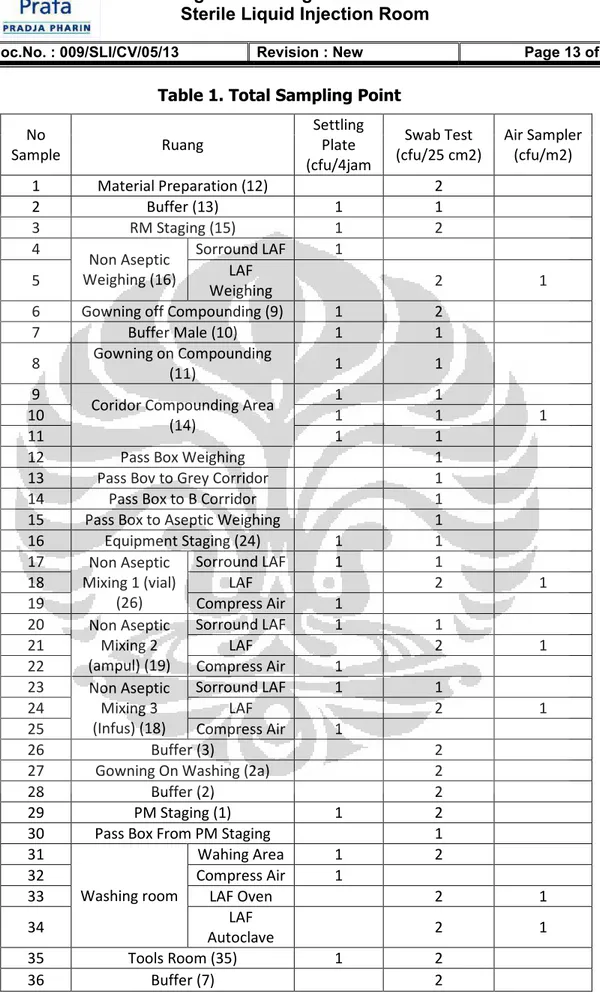
DESA KAR
PER
LAPORAN
PROG
UNIVERSITAS INDONESIA
PRAKTEK KERJA PROFESI APOTE
DI PT. PRADJA PHARIN
DESA KARANG ASEM BARAT CITEUREUP
BOGOR JAWA BARAT
PERIODE 1 APRIL – 31MEI 2013
PRAKTEK KERJA PROFESI APOTE
RAHMI RAMDANIS, S. Farm.
1206313583
ANGKATAN LXXVI
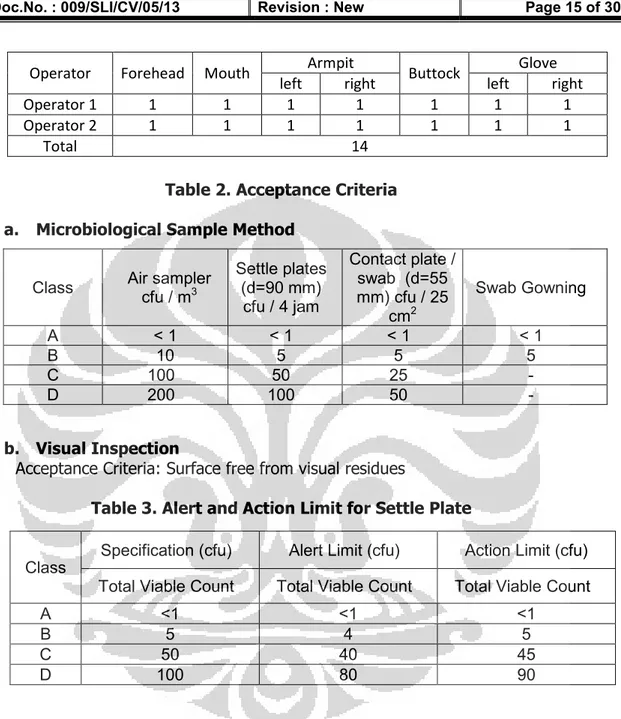
FAKULTAS FARMASI
PROGRAM PROFESI APOTEKER
DEPOK
JUNI 2013
ESI APOTEKER
ITEUREUP
LAPORAN
DESA KA
PER
LAPORAN
Diajukan sebagai sPROG
UNIVERSITAS INDONESIA
PRAKTEK KERJA PROFESI APOTE
DI PT. PRADJA PHARIN
KARANG ASEM BARAT CITEUREUP
BOGOR JAWA BARAT
PERIODE 1 APRIL – 31MEI 2013
PRAKTEK KERJA PROFESI APOTE
an sebagai salah satu syarat untuk memperoleh gelar A
RAHMI RAMDANIS, S. Farm.
1206313583
ANGKATAN LXXVI
FAKULTAS FARMASI
PROGRAM PROFESI APOTEKER
ESI APOTEKER
ITEUREUP
ESI APOTEKER
Karya akhir ini adalah hasil karya saya sendiri, dan semua sumber baik yang dikutip maupun dirujuk telah saya nyatakan dengan benar.
Nama : Rahmi Ramdanis, S.Farm
NPM : 1206313583
Tanda Tangan :
Nama : Rahmi Ramdanis, S. Farm
NPM : 1206313583
Program Studi : Apoteker – Fakultas Farmasi Universitas Indonesia Judul Laporan : Laporan Praktek Kerja Profesi Apoteker di
PT. Pradja Pharin Desa Karang Asem Barat Citeureup Bogor Jawa Barat Periode 1 April – 31 Mei 2013
Telah berhasil dipertahankan di hadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar Apoteker pada Program Profesi Apoteker Fakultas Farmasi Universitas Indonesia
DEWAN PENGUJI
Pembimbing I : Dewi Sulistyowati S.Farm, Apt Pembimbing II : Dr. Herman Suryadi, M.S. Apt Penguji I : Dr. Harmita, Apt.
Penguji II : Nadia Farhanah Syafhan, M.Si, Apt Penguji III : Sutriyo, M.Si, Apt.
Ditetapkan di : Depok Tanggal : 6 Juli 2013
rahmat-Nya, penulis dapat melaksanakan Praktek Kerja Profesi Apoteker di PT. Pradja Pharin (Prafa) pada periode 1 April – 31 Mei 2013. Kegiatan Praktek Kerja Profesi Apoteker (PKPA) ini dilaksanakan sebagai salah satu syarat untuk meraih gelar Apoteker di Fakultas Farmasi, Universitas Indonesia, dengan tujuan untuk meningkatkan pemahaman dan mengaplikasikan ilmu yang telah diperoleh selama perkuliahan.
Penulis menyadari sangat sulit menyelesaikan Kegiatan Praktek Kerja Profesi Apoteker (PKPA) ini tanpa bantuan dan bimbingan dari berbagai pihak. Oleh karena itu, penulis mengucapkan terima kasih kepada:
1. Drs. Antonius Sutaryo, Apt. selaku Plant Manager PT. Pradja Pharin yang telah memberikan kesempatan bagi penulis untuk melaksanakan kegiatan PKPA di PT. Pradja Pharin;
2. Prof. Dr. Yahdiana Harahap, M.S., Apt. selaku Dekan Fakultas Farmasi Universitas Indonesia;
3. Dr. Harmita, Apt. selaku Ketua Program Profesi Apoteker Fakultas Farmasi Universitas Indonesia;
4. Dewi Sulistyowati S.Farm, Apt. selaku Pembimbing I, yang telah memberikan kesempatan, bimbingan, pengarahan serta nasehat kepada penulis selama kegiatan PKPA di PT. Pradja Pharin;
5. Dr. Herman Suryadi MS. Apt. selaku Pembimbing II dari Fakultas Farmasi Universitas Indonesia, yang telah bersedia memberikan bimbingan dan pengarahan dalam penyusunan laporan ini;
6. Seluruh staf dan karyawan PT. Pradja Pharin atas segala keramahan, pengarahan dan bantuan yang telah diberikan kepada penulis selama melaksanakan PKPA;
7. Seluruh staf pengajar dan tata usaha Program Profesi Apoteker Fakultas Farmasi Universitas Indonesia atas bantuan yang telah diberikan kepada penulis;
kebersamaan, semangat, dukungan dan kerja sama selama ini;
10. Seluruh pihak yang telah memberikan bantuan kepada penulis selama penyusunan laporan ini.
Akhir kata, semoga Allah SWT membalas segala kebaikan semua pihak yang telah membantu. Penulis menyadari penyusunan laporan PKPA ini masih jauh dari kesempurnaan, namun penulis berharap pengetahuan dan pengalaman yang diperoleh selama kegiatan PKPA ini dapat berguna bagi penulis dan pembaca di masa mendatang.
Penulis,
Sebagai sivitas akademik Universitas Indonesia, saya yang bertanda tangan di bawah ini:
Nama : Rahmi Ramdanis
NPM : 1206313583
Program Studi : Profesi Apoteker Departemen : Farmasi
Fakultas : Farmasi
Jenis karya : Karya Ilmiah: Laporan Kerja Praktek
demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Indonesia Hak Bebas Royalti Noneksklusif (Non-exclusive Royalty Free Right) atas karya ilmiah saya yang berjudul :
Laporan Praktek Kerja Profesi Apoteker di PT. Pradja Pharin Desa Karang Asem Barat Citeureup Bogor Jawa Barat Periode 1 April – 31 Mei 2013.
beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Noneksklusif ini Universitas Indonesia berhak menyimpan, mengalihmedia/format-kan, mengelola dalam bentuk pangkalan data (database), merawat, dan memublikasikan tugas akhir saya selama tetap mencantumkan nama saya sebagai penulis/pencipta dan sebagai pemilik Hak Cipta.
Demikian pernyataan ini saya buat dengan sebenarnya.
Dibuat di : Depok Pada tanggal : Juli 2013
Yang menyatakan
HALAMAN JUDUL ... i
DAFTAR ISI ... ii
DAFTAR GAMBAR ... vii
DAFTRA LAMPIRAN ... vii
BAB 1 PENDAHULUAN ... 1
1.1 Latar Belakang... 1
1.2 Tujuan ... 2
BAB 2 TINJAUAN UMUM INDUSTRI FARMASI ... 3
2.1 Industri Farmasi ... 3
2.2 Cara Pembuatan Obat yang Baik ... 6
BAB 3 TINJAUAN KHUSUS PT. PRADJA PHARIN... 18
3.1 Sejarah dan Perkembangan PT. Pradja Pharin ... 18
3.2 Visi dan Misi PT. Pradja Pharin ... 19
3.3 Struktur Organisasi PT. Pradja Pharin... 21
3.4 Lokasi dan Sarana PT. Pradja Pharin ... 21
3.5 Kegiatan Industri PT. Pradja Pharin ... 22
BAB 4 PEMBAHASAN ... 55
4.1 Manajemen Mutu... 55
4.2 Personalia ... 56
4.3 Bangunan dan Fasilitas ... 56
4.4 Peralatan ... 58
4.5 Sanitasi dan Higiene ... 59
4.6 Produksi ... 60
4.7 Pengawasan Mutu ... 61
4.8 Inspeksi Diri, Audit Mutu dan Audit dan Persetujuan Pemasok ... 62
4.9 Penanganan Keluhan terhadap Produk dan Penarikan Kembali Produk ... 63
4.10 Dokumentasi ... 64
4.11 Pembuatan dan Analisis Berdasarkan Kontrak ... 64
4.12 Kualifikasi dan Validasi ... 65
BAB 5 KESIMPULAN DAN SARAN ... 66
5.1 Kesimpulan ... 66
5.2 Saran ... 66
DAFTAR LAMPIRAN
Lampiran 1. Struktur Organisasi PT. Pradja Pharin... 68
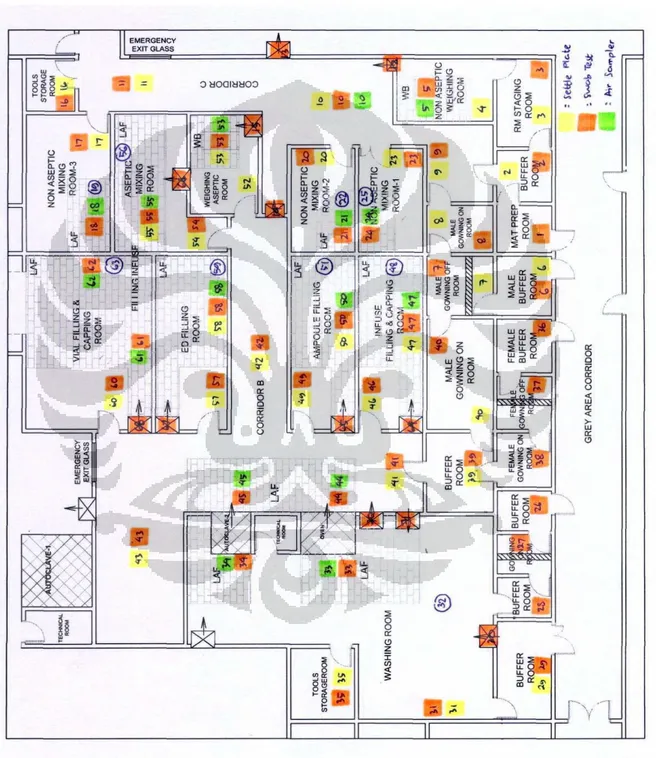
Lampiran 2. Denah PT. Pradja Pharin ... 69
Lampiran 3. Sistem Pengolahan Air PT. Pradja Pharin ... 70
PENDAHULUAN
1.1 Latar Belakang
Industri farmasi adalah badan usaha yang memiliki izin dari Menteri Kesehatan untuk melakukan kegiatan pembuatan obat atau bahan obat (Menteri Kesehatan Republik Indonesia, 2010). Industri farmasi harus membuat obat sedemikian rupa agar sesuai dengan tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam dokumen izin edar (registrasi) dan tidak menimbulkan risiko yang membahayakan penggunanya karena tidak aman, mutu rendah atau tidak efektif (Badan Pengawas Obat dan Makanan, 2012). Dalam rangka pemenuhan kriteria tersebut, pemerintah mengeluarkan ketentuan dan persyaratan yang harus diterapkan dan dilaksanakan oleh setiap industri farmasi, yaitu Cara Pembuatan Obat yang Baik (CPOB). Industri farmasi wajib menerapkan CPOB dalam seluruh aspek dan rangkaian kegiatan pembuatan obat dan kegiatan pembuatan obat tersebut dikontrol dan diawasi dengan ketat oleh pemerintah dan Badan Pengawasan Obat dan Makanan (Badan Pengawas Obat dan Makanan, 2006).
Cara Pembuatan Obat yang Baik adalah pedoman cara pembuatan obat yang bertujuan untuk memastikan agar mutu obat yang dihasilkan sesuai dengan persyaratan dan tujuan penggunaannya (Menteri Kesehatan Republik Indonesia, 2010). Mutu obat tergantung pada bahan awal, bahan pengemas, proses produksi, pengendalian mutu, bangunan, peralatan yang dipakai dan personil yang terlibat (Badan Pengawas Obat dan Makanan, 2012).
Salah satu personil yang terlibat industri farmasi tersebut adalah apoteker. Apoteker yang berada di industri farmasi mempunyai peranan dan tanggung jawab penting untuk menerapkan aspek-aspek yang terdapat dalam CPOB, antara lain sebagai penanggung jawab produksi, pengawasan mutu dan pemastian mutu (Menteri Kesehatan Republik Indonesia, 2010). Oleh karena itu, apoteker diharapkan memiliki pemahaman yang lebih dalam mengenai tugas dan fungsinya di industri farmasi. Untuk mencapai hal tersebut, maka Program Profesi Apoteker
PKPA berlangsung dari tanggal 1 April – 31 Mei 2013.
1.2 Tujuan
Pelaksanaan Praktek Kerja Profesi Apoteker di industri farmasi bagi para calon apoteker bertujuan untuk:
1.2.1 Mengetahui dan memahami penerapan Cara Pembuatan Obat yang Baik (CPOB) di industri farmasi, khususnya di PT. Pradja Pharin
1.2.2 Memahami peran dan tanggung jawab seorang apoteker dalam industri farmasi
2.1 Industri Farmasi
2.1.1 Pengertian Industri Farmasi
Menurut Peraturan Menteri Kesehatan Republik Indonesia Nomor 1799/Menkes/Per/XII/2010 tentang Industri Farmasi, industri farmasi adalah badan usaha yang memiliki izin dari Menteri Kesehatan untuk melakukan kegiatan pembuatan obat atau bahan obat.
2.1.2 Izin Industri Farmasi (Menteri Kesehatan Republik Indonesia, 2010) Proses pembuatan obat dan/atau bahan obat hanya dapat dilakukan oleh industri farmasi. Industri farmasi dapat melakukan kegiatan proses pembuatan obat dan/atau bahan obat untuk semua tahapan dan/atau sebagian tahapan. Industri farmasi yang melakukan kegiatan proses pembuatan obat dan/atau bahan obat untuk sebagian tahapan harus berdasarkan penelitian dan pengembangan yang menyangkut produk sebagai hasil kemajuan ilmu pengetahuan dan teknologi. Produk hasil penelitian dan pengembangan dapat dilakukan proses pembuatan sebagian tahapan oleh industri farmasi di Indonesia.
Setiap pendirian industri farmasi wajib memperoleh izin industri farmasi dari Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan Kementerian Kesehatan RI. Industri farmasi yang membuat obat dan/atau bahan obat yang termasuk dalam golongan narkotika wajib memperoleh izin khusus untuk memproduksi narkotika sesuai dengan ketentuan peraturan perundang-undangan.
Persyaratan untuk memperoleh izin industri farmasi terdiri atas: a. Berbadan usaha berupa perseroan terbatas.
b. Memiliki rencana investasi dan kegiatan pembuatan obat. c. Memiliki Nomor Pokok Wajib Pajak.
Indonesia, masing-masing sebagai penanggung jawab pemastian mutu, produksi, dan pengawasan mutu.
e. Komisaris dan direksi tidak pernah terlibat, baik langsung atau tidak langsung dalam pelanggaran peraturan perundang-undangan di bidang kefarmasian.
Setiap pendirian industry farmasi wajib memenuhi ketentuan sebagaimana diatur dalam peraturan perundang-undangan di bidang tata ruang dan lingkungan hidup. Industri farmasi wajib memenuhi persyaratan CPOB. Pemenuhan persyaratan CPOB dibuktikan dengan sertifikat CPOB. Sertifikat CPOB berlaku selama 5 tahun sepanjang memenuhi persyaratan. Ketentuan mengenai persyaratan dan tata cara sertifikasi CPOB diatur oleh Kepala Badan Pengawasan Obat dan Makanan.
Izin usaha industri farmasi diberikan oleh Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan Kementerian Kesehatan RI dengan rekomendasi dari kepala Badan Pengawasan Obat dan Makanan (BPOM). Izin ini berlaku seterusnya selama perusahaan industri farmasi tersebut berproduksi dan memenuhi ketentuan peraturan perundang-undangan. Industri farmasi yang akan melakukan perubahan bermakna terhadap pemenuhan persyaratan CPOB, baik untuk perubahan kapasitas dan/atau fasilitas produksi wajib melapor dan mendapat persetujuan sesuai ketentuan perundang-undangan.
Perusahaan industri farmasi yang telah mendapat izin usaha industri wajib menyampaikan laporan industri secara berkala mengenai kegiatan usahanya:
a. Sekali dalam 6 (enam) bulan, meliputi jumlah dan nilai produksi setiap obat atau bahan obat yang dihasilkan sekali dalam 1 (satu) tahun.
b. Laporan industri faramsi disampaikan kepada Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan Kementerian Kesehatan RI dengan tembusan kepada Kepala Badan.
Republik Indonesia, 2010)
Pembinaan terhadap pengembangan industri farmasi dilakukan Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan Kementerian Kesehatan RI. Pedoman mengenai pembinaan ditetapkan oleh Direktur Jenderal. Pengawasan terhadap industri farmasi dilakukan oleh Kepala Badan.
Dalam melaksanakan pengawasan, tenaga pengawas dapat melakukan pemeriksaan dan:
a. Memasuki setiap tempat yang diduga digunakan dalam kegiatan pembuatan, penyimpanan, pengangkutan dan perdagangan obat dan bahan obat untuk memeriksa, meneliti dan mengambil contoh segala sesuatu yang digunakan dalam kegiatan pembuatan, penyimpanan, pengangkutan, dan perdagangan obat dan bahan obat.
b. Membuka dan meneliti kemasan obat dan bahan obat.
c. Memeriksa dokumen atau catatan lain yang diduga memuat keterangan mengenai kegiatan pembuatan, penyimpanan, pengangkutan dan perdagangan obat dan bahan obat.
d. Mengambil gambar (foto) seluruh atau sebagian fasilitas dan peralatan yang digunakan dalam pembuatan, penyimpanan, pengangkutan, dan/atau perdagangan obat dan bahan obat.
Pelanggaran terhadap ketentuan yang tercantum dalam peraturan Menteri Kesehatan Republik Indonesia No.1799/Menkes/Per/XII/2010 tentang Industri Farmasi dapat dikenakan sanksi administratif berupa:
a. Peringatan secara tertulis (diberikan oleh Kepala Badan POM).
b. Larangan mengedarkan untuk sementara waktu dan/atau perintah untuk penarikan kembali obat atau bahan obat dari peredaran bagi obat atau bahan obat yang tidak memenuhi standar dan persyaratan keamanan, khasiat, atau mutu (diberikan oleh Kepala Badan POM).
c. Perintah pemusnahan obat atau bahan obat jika terbukti tidak memenuhi persyaratan keamanan, khasiat atau mutu (diberikan oleh Kepala Badan POM).
Kefarmasian dan Alat Kesehatan atas rekomendasi Kepala Badan POM). f. Pencabutan izin industri farmasi (diberikan oleh Direktur Jenderal Bina
Kefarmasian dan Alat Kesehatan atas rekomendasi Kepala Badan POM). Izin usaha industri farmasi dapat dicabut dalam hal:
a. Perusahaan industri farmasi yang telah mendapat Izin Usaha Industri Farmasi melakukan pemindahtanganan hak milik Izin Usaha Industri Farmasi dan perluasan tanpa memiliki izin sesuai dengan ketentuan dalam Surat Keputusan.
b. Perusahaan industri farmasi yang telah mendapat Izin Usaha Industri Farmasi tidak menyampaikan informasi industri farmasi secara berturut-turut 3 kali atau dengan sengaja menyampaikan informasi yang tidak benar.
c. Perusahaan industri farmasi yang telah mendapat Izin Usaha Industri Farmasi melakukan pemindahan lokasi usaha industri tanpa persetujuan tertulis terlebih dahulu dari menteri.
d. Perusahaan industri farmasi yang telah mendapat Izin Usaha Industri Farmasi dengan sengaja memproduksi Obat Jadi atau Bahan Baku Obat yang tidak memenuhi persyaratan dan ketentuan yang berlaku.
e. Tidak dipenuhinya ketentuan dalam Izin Usaha Industri Farmasi yang ditetapkan dalam surat keputusan.
2.2 Cara Pembuatan Obat yang Baik (Badan Pengawas Obat dan Makanan, 2012)
Cara Pembuatan Obat yang Baik (CPOB) atau Good Manufacturing Practices (GMP) bertujuan untuk menjamin obat dibuat secara konsisten, memenuhi persyaratan yang ditetapkan dan sesuai dengan tujuan penggunaannya. CPOB mencakup seluruh aspek produksi dan pengendalian mutu. Dalam CPOB terdapat 12 aspek yang telah diatur yaitu sistem manajemen mutu, personalia, bangunan dan fasilitas, peralatan, sanitasi dan higiene, produksi, pengawasan mutu, inspeksi diri, audit mutu, dan audit dan persetujuan pemasok, penanganan keluhan terhadap produk dan penarikan
serta kualifikasi dan validasi.
2.2.1 Manajemen Mutu
Industri farmasi harus membuat obat sedemikian rupa agar sesuai dengan tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam dokumen izin edar (registrasi), dan tidak menimbulkan risiko yang membahayakan penggunanya karena tidak aman, mutu rendah, atau tidak efektif. Manajemen bertanggung jawab untuk pencapaian tujuan ini melalui suatu kebijakan mutu yang memerlukan partisipasi dan komitmen jajaran di semua departemen di dalam perusahaan, para pemasok, dan para distributor. Untuk mencapai tujuan mutu secara konsisten dan dapat diandalkan, diperlukan sistem pemastian mutu yang didesain secara menyeluruh dan diterapkan secara benar serta menginkorporasi Cara Pembuatan Obat yang Baik termasuk Pengawasan Mutu dan Manajemen Risiko Mutu. Hal ini hendaklah didokumentasikan dan dimonitor efektivitasnya.
Unsur dasar manajemen mutu adalah suatu infrastruktur atau sistem mutu yang tepat mencakup struktur organisasi, prosedur, proses, dan sumber daya, dan tindakan sistematis diperlukan untuk mendapatkan kepastian dengan tingkat kepercayaan yang tinggi, sehingga produk yang dihasilkan akan selalu memenuhi persyaratan yang telah ditetapkan. Konsep dasar pemastian mutu, Cara Pembuatan Obat yang Baik (CPOB), pengawasan mutu dan manajemen risiko mutu adalah aspek manajemen mutu yang saling terkait.
Pengkajian mutu produk secara berkala hendaklah dilakukan terhadap semua obat terdaftar, termasuk produk ekspor, dengan tujuan untuk membuktikan konsistensi proses, kesesuaian dari spesifikasi bahan awal, bahan pengemas dan produk jadi, untuk melihat tren dan mengidentifikasi perbaikan yang diperlukan untuk produk dan proses.
Manajemen risiko mutu adalah suatu proses sistematis untuk melakukan penilaian, pengendalian dan pengkajian risiko terhadap mutu suatu produk. Manajemen risiko mutu hendaklah memastikan bahwa evaluasi risiko terhadap
formalitas dan dokumentasi dari proses manajemen risiko mutu sepadan dengan tingkat risiko.
2.2.2 Personalia
Sumber daya manusia sangat penting dalam pembentukan dan penerapan sistem pemastian mutu yang memuaskan dan pembuatan obat yang benar. Oleh sebab itu, industri farmasi bertanggung jawab untuk menyediakan personil yang terkualifikasi dan berpengalaman dalam jumlah yang memadai untuk melaksanakan semua tugas. Tiap personil hendaklah memahami prinsip CPOB dan memperoleh pelatihan awal dan berkesinambungan termasuk instruksi mengenai higienis yang berkaitan dengan pekerjaan.
Industri farmasi harus memiliki struktur organisasi. Tugas spesifik dan kewenangan dari personil pada posisi penanggung jawab hendaklah dicantumkan dalam uraian tugas tertulis. Hendaklah aspek penerapan CPOB tidak ada yang terlewatkan ataupun tumpang tindih dalam tanggung jawab yang tercantum dalam uraian tugas.
Personil kunci mencakup kepala bagian produksi, kepala bagian pengawasan mutu dan kepala bagian manajemen mutu (pemastian mutu). Posisi utama tersebut dijabat oleh personil purnawaktu. Kepala bagian produksi dan kepala bagian manajemen mutu (pemastian mutu)/kepala bagian pengawasan mutu harus independen satu terhadap yang lain.
Struktur organisasi industri farmasi hendaklah sedemikian rupa sehingga bagian produksi, pengawasan mutu, manajemen mutu (pemastian mutu) dipimpin oleh orang yang berbeda serta tidak saling bertanggung jawab satu terhadap yang lain. Masing-masing personil hendaklah diberi wewenang penuh dan sarana yang memadai yang diperlukan untuk dapat melaksanakan tugasnya secara efektif.
2.2.3 Bangunan dan Fasilitas
Bangunan dan fasilitas untuk pembuatan obat harus memiliki desain, konstruksi dan letak yang memadai, serta disesuaikan kondisinya dan dirawat
desain ruangan harus dibuat sedemikian rupa untuk memperkecil risiko terjadinya kekeliruan, pencemaran silang dan kesalahan lain, dan memudahkan pembersihan, sanitasi dan perawatan yang efektif untuk menghindarkan pencemaran silang, penumpukan debu atau kotoran, dan dampak lain yang dapat menurunkan mutu obat.
Adapun syarat-syarat bangunan dan fasilitas menurut CPOB adalah sebagai berikut:
a. Letak bangunan hendaklah sedemikian rupa untuk menghindarkan pencemaran dari lingkungan sekelilingnya, seperti pencemaran dari udara, tanah dan air serta dari kegiatan industri lain yang berdekatan;
b. Bangunan dan fasilitas hendaklah didesain, dikonstruksi, dilengkapi dan dirawat sedemikian agar memperoleh perlindungan maksimal terhadap pengaruh cuaca, banjir, rembesan dari tanah serta masuk dan bersarang serangga, burung, binatang pengerat, kutu, atau hewan lainnya. Hendaklah tersedia prosedur untuk pengendalian binatang pengerat dan hama.
c. Bangunan dan fasilitas hendaklah dirawat dengan cermat, dibersihkan dan, bila perlu, didisinfeksi sesuai prosedur tertulis rinci. Catatan pembersihan dan disinfeksi hendaklah disimpan.
d. Seluruh bangunan dan fasilitas termasuk area produksi, laboratorium, area penyimpanan, koridor dan lingkungan sekeliling bangunan hendaklah dirawat dalam kondisi bersih dan rapi. Kondisi bangunan hendaklah ditinjau secara teratur dan diperbaiki di mana perlu. Perbaikan serta perawatan bangunan dan fasilitas hendaklah dilakukan hati-hati agar kegiatan tersebut tidak memengaruhi mutu obat.
e. Tenaga listrik, lampu penerangan, suhu, kelembaban dan ventilasi hendaklah tepat agar tidak mengakibatkan dampak yang merugikan baik secara langsung maupun tidak langsung terhadap produk selama proses pembuatan dan penyimpanan, atau terhadap ketepatan/ketelitian fungsi dari peralatan. f. Desain dan tata letak ruang hendaklah memastikan kompatibilitas dengan
sebagai tempat penyimpanan bahan atau produk selain yang sedang diproses. g. Tindakan pencegahan hendaklah diambil untuk mencegah personil yang
tidak berkepentingan masuk. Area produksi, area penyimpanan dan area pengawasan mutu tidak boleh digunakan sebagai jalur lalu lintas bagi personil yang tidak bekerja di area tersebut.
h. Kegiatan penerimaan bahan, karantina barang masuk, penyimpanan bahan awal dan bahan pengemas, penimbangan dan penyerahan bahan atau produk, pengolahan, pencucian peralatan, penyimpanan peralatan, penyimpanan produk ruahan, pengemasan, karantina produk jadi sebelum memperoleh pelulusan akhir, pengiriman produk dan laboratorium pengawasan mutu hendaklah dilakukan di area yang ditentukan.
2.2.4 Peralatan
Peralatan untuk pembuatan obat hendaklah memiliki desain dan konstruksi yang tepat, ukuran yang memadai serta ditempatkan dan dikualifikasi dengan tepat, agar mutu obat terjamin sesuai desain serta seragam dari bets ke bets dan untuk memudahkan pembersihan serta perawatan agar dapat mencegah kontaminasi silang, penumpukan debu atau kotoran dan hal-hal yang umumnya berdampak buruk pada mutu produk.
2.2.5 Sanitasi dan Higiene
Tingkat sanitasi dan higiene yang tinggi hendaklah diterapkan pada setiap aspek pembuatan obat. Ruang lingkup sanitasi dan higiene meliputi personil, bangunan, peralatan dan perlengkapan, bahan produksi serta wadahnya, bahan pembersih dan desinfeksi, dan segala sesuatu yang dapat merupakan sumber pencemaran produk. Sumber pencemaran potensial hendaklah dihilangkan melalui suatu program sanitasi dan higiene yang menyeluruh dan terpadu.
Tiap personil yang masuk ke area pembuatan hendaklah mengenakan pakaian pelindung yang sesuai dengan kegiatan yang dilaksanakannya. Program higiene yang rinci hendaklah dibuat dan diadaptasikan terhadap berbagai
prosedur yang berkaitan dengan kesehatan, praktik higiene dan pakaian pelindung personil. Prosedur hendaklah dipahami dan dipatuhi secara ketat oleh setiap personil yang bertugas di area produksi dan pengawasan. Program higiene hendaklah dipromosikan oleh manajemen dan dibahas secara luas selama sesi pelatihan.
Bangunan yang digunakan untuk pembuatan obat hendaklah didesain dan dikonstruksi dengan tepat untuk memudahkan sanitasi yang baik. Bangunan hendaklah dilengkapi dengan sarana toilet dengan ventilasi yang baik, tempat cuci bagi personil yang letaknya mudah diakses dari area pembuatan serta sarana yang memadai untuk penyimpanan pakaian personil dan milik pribadinya di tempat yang tepat.
Peralatan yang telah digunakan hendaklah dibersihkan baik bagian luar maupun bagian dalam sesuai dengan prosedur yang telah ditetapkan, serta dijaga dan disimpan dalam kondisi yang bersih. Tiap kali sebelum dipakai, kebersihannya diperiksa untuk memastikan bahwa semua produk atau bahan dari bets sebelumnya telah dihilangkan. Catatan mengenai pelaksanaan pembersihan, sanitasi, sterilisasi dan inspeksi sebelum penggunaan peralatan hendaklah disimpan secara benar.
Prosedur tertulis hendaklah ditetapkan untuk pembersihan alat dan persetujuan untuk penggunaan bagi produksi obat, termasuk produk antara. Prosedur pembersihan hendaklah rinci supaya operator dapat melakukan pembersihan tiap jenis alat secara konsisten dan efektif.
2.2.6 Produksi
Produksi obat hendaklah dilaksanakan dengan mengikuti prosedur yang telah ditetapkan dan memenuhi ketentuan CPOB yang menjamin senantiasa menghasilkan produk yang memenuhi persyaratan mutu serta memenuhi ketentuan izin pembuatan dan izin edar.
Produksi obat membutuhkan sarana gedung produksi-pengemasan-penyimpanan, material yang memenuhi persyaratan, peralatan yang
ditelusuri. Mutu suatu obat tidak hanya ditentukan oleh hasil analisis terhadap produk akhir melainkan juga oleh mutu yang dianalisis selama tahapan proses produksi sejak pemilihan bahan awal, penimbangan, proses produksi, personalia, bangunan, peralatan kebersihan, dan higienis sampai dengan pengemasan.
Produksi hendaklah dilakukan dan diawasi oleh personil yang kompeten. Prosedur produksi dibuat oleh penanggung jawab produksi bersama dengan penanggung jawab pengawasan mutu yang dapat menjamin obat yang dihasilkan memenuhi spesifikasi yang telah ditentukan. Akses ke fasilitas produksi hendaklah dibatasi hanya untuk personil yang berwenang. Prosedur kerja standar hendaklah tertulis, mudah dipahami dan dipatuhi oleh karyawan produksi, serta didokumentasikan. Dokumentasi setiap langkah dilakukan dengan cermat, tepat dan ditangani oleh karyawan yang melaksanakan tugas.
2.2.7 Pengawasan Mutu
Pengawasan mutu merupakan bagian yang esensial dari CPOB untuk memberikan kepastian bahwa produk secara konsisten mempunyai mutu yang sesuai dengan tujuan pemakaiannya. Keterlibatan dan komitmen semua pihak yang berkepentingan pada semua tahap merupakan keharusan untuk mencapai sasaran mutu mulai dari awal pembuatan sampai kepada distribusi produk jadi.
Pengawasan mutu mencakup pengambilan sampel, spesifikasi, pengujian serta termasuk pengaturan, dokumentasi dan prosedur pelulusan yang memastikan bahwa semua pengujian yang relevan telah dilakukan, dan bahan tidak diluluskan untuk dipakai atau produk diluluskan untuk dijual, sampai mutunya telah dibuktikan memenuhi persyaratan.
Pengawasan Mutu tidak terbatas pada kegiatan laboratorium, tapi juga harus terlibat dalam semua keputusan yang terkait dengan mutu produk. Ketidaktergantungan pengawasan mutu dari produksi dianggap hal yang fundamental agar pengawasan mutu dapat melakukan kegiatan dengan memuaskan.
Inspeksi diri bertujuan untuk mengevaluasi apakah semua aspek produksi dan pengawasan mutu industri farmasi memenuhi ketentuan Cara Pembuatan Obat yang Baik (CPOB). Program inspeksi diri hendaklah dirancang untuk mendeteksi kelemahan dalam pelaksanaan CPOB dan untuk menetapkan tindakan perbaikan yang diperlukan. Inspeksi diri hendaklah dilakukan secara independen dan rinci oleh petugas yang kompeten dari perusahaan yang dapat mengevaluasi penerapan CPOB secara obyektif.
Inspeksi diri hendaklah dilakukan secara rutin dan disamping itu pada situasi khusus, misalnya dalam hal terjadi penarikan kembali obat jadi atau terjadi penolakan yang berulang. Semua saran untuk tindakan perbaikan supaya dilaksanakan. Prosedur dan catatan inspeksi diri hendaklah didokumentasikan dan dibuat program tindak lanjut yang efektif.
Inspeksi diri meliputi seluruh aspek yang tercantum dalam CPOB, yaitu antara lain personalia, bangunan termasuk fasilitas untuk personil, bangunan termasuk fasilitas untuk personil, perawatan bangunan dan peralatan, penyimpanan bahan awal, bahan pengemas dan obat jadi, peralatan, pengolahan dan pengawasan selama proses, pengawasan mutu, dokumentasi, sanitasi dan higiene, program validasi dan revalidasi, kalibrasi alat atau sistem pengukuran, prosedur penarikan kembali obat jadi, penanganan keluhan, pengawasan label, hasil inspeksi diri sebelumnya dan tindakan perbaikan.
Penyelenggaraan audit mutu berguna sebagai pelengkap inspeksi diri. Audit mutu meliputi pemeriksaan dan penilaian semua atau sebagian dari sistem manajemen dengan tujuan spesifik untuk meningkatkannya. Audit mutu umumnya dilaksanakan oleh spesialis dari luar atau independen atau tim yang dibentuk khusus untuk hal ini oleh manajemen perusahaan. Audit mutu juga dapat diperluas terhadap pemasok dan penerima kontrak.
Kepala bagian manajemen mutu (pemastian mutu) hendaklah bertanggung jawab bersama bagian lain yang terkait untuk memberi persetujuan pemasok yang dapat diandalkan memasok bahan awal dan bahan pengemas yang memenuhi spesifikasi yang telah ditentukan. Sebelum pemasok disetujui
secara teratur. Evaluasi pemasok dilakukan dengan mempertimbangkan riwayat pemasok dan sifat bahan yang dipasok. Jika audit diperlukan, audit tersebut hendaklah menetapkan kemampuan pemasok dalam pemenuhan standar CPOB.
2.2.9 Penanganan Keluhan terhadap Produk dan Penarikan Kembali Produk Semua keluhan dan informasi lain yang berkaitan dengan kemungkinan terjadi kerusakan obat hendaklah dikaji dengan teliti sesuai dengan prosedur tertulis. Untuk menangani semua kasus yang mendesak hendaklah disusun suatu sistem, bila perlu mencakup penarikan kembali produk yang diketahui atau diduga cacat dari peredaran secara cepat dan efektif. Hendaklah ditunjuk personil yang bertanggung jawab untuk menangani keluhan dan memutuskan tindakan yang hendak dilakukan bersama staf yang memadai untuk membantunya. Apabila personil tersebut bukan kepala bagian manajemen mutu (pemastian mutu), maka personil tersebut hendaklah memahami cara penanganan seluruh keluhan, penyelidikan atau penarikan kembali produk.
Dalam penanganan keluhan, hendaklah tersedia prosedur tertulis yang merinci penyelidikan, evaluasi, tindak lanjut yang sesuai, termasuk pertimbangan untuk penarikan kembali produk, dalam menanggapi keluhan terhadap obat yang diduga cacat. Tiap keluhan yang menyangkut kerusakan produk hendaklah dicatat yang mencakup rincian mengenai asal-usul keluhan dan diselidiki secara menyeluruh dan mendalam. Kepala bagian Pengawasan Mutu hendaklah dilibatkan dalam pengkajian masalah tersebut. Perhatian khusus hendaklah diberikan untuk menetapkan apakah keluhan disebabkan oleh pemalsuan.
Jika produk pada suatu bets ditemukan atau diduga cacat, maka hendaklah dipertimbangkan untuk memeriksa bets lain untuk memastikan apakah bets lain juga terpengaruh. Khusus bets yang mengandung hasil pengolahan ulang dari bets yang cacat hendaklah diselidiki. Setelah melakukan penyelidikan dan evaluasi terhadap laporan dan keluhan mengenai suatu produk hendaklah dilakukan tindak lanjut. Tindak lanjut ini mencakup tindakan
akhir yang bersangkutan, dan tindakan lain yang tepat.
Tindakan penarikan kembali produk hendaklah dilakukan segera setelah diketahui ada produk yang cacat mutu atau diterima laporan mengenai reaksi yang merugikan. Pemakaian produk yang berisiko tinggi terhadap kesehatan, hendaklah dihentikan dengan cara embargo yang dilanjutkan dengan penarikan kembali dengan segera. Penarikan kembali hendaklah menjangkau sampai tingkat konsumen. Sistem dokumentasi penarikan kembali produk di industri farmasi, hendaklah menjamin bahwa embargo dan penarikan kembali dilaksanakan secara cepat, efektif dan tuntas. Pedoman dan prosedur penarikan kembali terhadap produk hendaklah dibuat untuk memungkinkan embargo dan penarikan kembali dapat dilakukan dengan cepat dan efektif dari seluruh mata rantai distribusi. Keputusan penarikan kembali produk dapat diprakarsai oleh industri farmasi atau atas perintah Otoritas Pengawasan Obat, serta secara intern datang dari kepala bagian manajemen mutu (pemastian mutu) dan manajemen perusahaan.
2.2.10 Dokumentasi
Dokumentasi adalah bagian dari sistem informasi manajemen dan dokumentasi yang baik merupakan bagian yang esensial dari pemastian mutu. Dokumentasi yang jelas adalah fundamental untuk memastikan bahwa tiap personil menerima uraian tugas yang relevan secara jelas dan rinci sehingga memperkecil resiko terjadi salah tafsir dan kekeliruan yang biasanya timbul karena hanya mengandalkan komunikasi lisan. Spesifikasi, dokumen produksi induk/formula pembuatan, prosedur, metode dan instruksi, laporan dan catatan harus bebas dari kekeliruan dan tersedia secara tertulis. Keterbacaan dokumen adalah sangat penting.
2.2.11 Pembuatan dan Analisis Berdasarkan Kontrak
Pembuatan dan analisa berdasarkan kontrak harus dibuat secara benar, disetujui dan dikendalikan untuk menghindarkan kesalahpahaman yang dapat
secara jelas yang menentukan tanggung jawab dan kewajiban masing-masing pihak. Kontrak harus menyatakan secara jelas prosedur pelulusan tiap bets produk untuk diedarkan yang menjadi tanggung jawab penuh kepala bagian manajeman mutu atau pemastian mutu.
Penerima kontrak harus mempunyai gedung dan peralatan yang cukup, pengetahuan dan pengalaman, dan personil yang kompeten untuk melakukan pekerjaan yang diberikan oleh pemberi kontrak dengan memuaskan. Pembuatan obat berdasarkan kontrak hanya dapat dilakukan oleh industri farmasi yang memiliki sertifikat CPOB yang diterbitkan oleh Badan POM.
Kontrak hendaklah dibuat antara pemberi kontrak dan penerima kontrak dengan menetapkan tanggung jawab masing-masing pihak yang berhubungan dengan produksi dan pengendalian mutu produk. Aspek teknis dari kontrak hendaklah dibuat oleh personil yang kompeten yang mempunyai pengetahuan yang sesuai di bidang teknologi farmasi, analisis dan Cara Pembuatan Obat yang Baik. Semua pengaturan pembuatan dan analisis harus sesuai dengan izin edar dan disetujui oleh kedua belah pihak. Kontrak hendaklah memuat izin pemberi kontrak untuk menginspeksi sarana penerima kontrak.
2.2.12 Kualifikasi dan Validasi
CPOB mensyaratkan industri farmasi untuk mengidentifikasi validasi yang perlu dilakukan sebagai bukti pengendalian terhadap aspek kritis dari kegiatan yang dilakukan. Perubahan signifikan terhadap fasilitas, peralatan dan proses yang dapat mempengaruhi mutu produk hendaklah divalidasi. Pendekatan dengan kajian risiko hendaklah digunakan untuk menentukan ruang lingkup dan cakupan validasi.
Seluruh kegiatan validasi hendaklah direncanakan. Unsur utama program validasi hendaklah dirinci dengan jelas dan didokumentasikan di dalam Rencana Induk Validasi (RIV) atau dokumen setara. RIV hendaklah merupakan dokumen yang singkat, tepat dan jelas. RIV hendaklah mencakup sekurang-kurangnya data sebagai berikut: kebijakan validasi; struktur organisasi kegiatan validasi; ringkasan fasilitas, sistem, peralatan dan proses
perencanaan dan jadwal pelaksanaan; pengendalian perubahan; dan acuan dokumen yang digunakan.
Protokol validasi tertulis hendaklah dibuat untuk merinci kualifikasi dan validasi yang akan dilakukan. Protokol hendaklah dikaji dan disetujui oleh kepala bagian manajemen mutu (pemastian mutu). Protokol validasi hendaklah merinci langkah kritis dan kriteria penerimaan.
Kualifikasi terdiri dari kualifikasi desain, kualifikasi instalasi, kualifikasi operasional, kualifikasi kinerja dan kualifikasi fasilitas, peralatan dan sistem terpasang yang telah operasional.
BAB 3
TINJAUAN KHUSUS PT. PRADJA PHARIN
3.1 Sejarah dan Perkembangan PT. Pradja Pharin
PT. Pradja Pharin (Prafa) didirikan pada tahun 1960 oleh Tjipto Pusposuharto dengan karyawan berjumlah 20 orang di areal berukuran 350 m2. Pada tahun 1968, PT. Prafa ditunjuk sebagai importir dan penyalur tunggal Meiji Seika, Jepang di Indonesia. PT. Prafa menjadi perusahaan Penanaman Modal Dalam Negeri (PMDN) pada tahun 1971. Sejak saat itu, pembangunan pabrik di mulai di areal seluas 2300 m2 di jalan Bandengan Selatan 58 A, Jakarta Utara.
Sejak tahun 1988, PT. Prafa tumbuh menjadi suatu industri farmasi dengan memproduksi 200 jenis sediaan obat. Pada tahun yang sama dibangun pabrik yang terletak di daerah Citeureup, kabupaten Bogor. Pabrik baru selesai dibangun pada tahun 1990 dan PT. Prafa resmi pindah ke lokasi tersebut sampai sekarang.
PT. Prafa melakukan akuisisi dengan Darya Varia Group dan dibeli oleh
First Pacific Investment, Hongkong, pada tahun 1995. Darya Varia Group terdiri
dari tiga perusahaan yaitu PT. Darya Varia Laboratoria Tbk., PT. Kenrose Indonesia, dan PT. Obat Dupa dengan distributor PT. Wigo Distributor Farmasi. Pada tahun 1998 PT. Obat Dupa dan PT. Kenrose ditutup. Sejak tanggal 21 Desember 2001 hingga sekarang Darya Varia Group diambil alih oleh United Laboratories, Inc. (Unilab), Filipina. Unilab juga memiliki perusahaan farmasi lain di Indonesia yakni PT. Medifarma Laboratories Inc.
PT. Prafa menerima kontrak kerja sama dalam proses produksi dari perusahaan lain atau contract manufacture atau toll manufacturing. Prinsipal yang
melakukan kerjasama toll manufacturing dengan PT. Prafa antara lain PT. Actavis
Indonesia, PT. Novell Pharmaceutical Laboratories, PT. Procter & Gamble (P&G) Indonesia, PT. Sandoz Indonesia, PT. Servier Indonesia, PT. Guardian Pharmatama, PT. Kalbe Farma, PT. Lapi Laboratories, PT. Nufarindo Pharmaceutical Laboratories, PT. Pharos Indonesia, dan PT. Pyridam Pharma Tbk.
Pada tahun 2009, Unilab Indonesia melakukan spesialisasi produksi yaitu PT. Medifarma Laboratories Inc. dikhususkan dalam produksi
order dan obat-obat bebas (Over The Counter/OTC), PT. Darya Varia Laboratoria
Tbk. untuk produksi kapsul gelatin lunak, sediaan cair, dan semisolid serta PT. Prafa diarahkan pada produksi low volume solid order, produk etikal (solid dan
injeksi), antibiotik betalaktam dan sefalosporin (solid dan injeksi), serta produk
toll manufacturing. PT. Prafa lalu dikhususkan sebagai Centre of Excellent Toll Manufacturing.
Gambar 3.1. Logo PT. Pradja Pharin (Prafa)
Logo PT. Prafa berbentuk segitiga dengan sisi yang sama panjang dan tajam seperti (lihat Gambar 1). Segitiga pada gambar tersebut melambangkan huruf awal nama perusahaan. Sementara, bentuk segitiga itu sendiri melambangkan kemajuan dan budaya perusahaan yang modern. Pertemuan antar segitiga pada logo tersebut melambangkan kerja sama, kebersamaan, dan komitmen. Sisi sama panjang mencerminkan bahwa Prafa terdiri dari elemen yang memiliki kepentingan bersama serta saling menunjang dan mendukung sehingga tidak ada yang dapat berdiri sendiri tanpa dukungan kekuatan elemen yang lain. Warna biru pada logo Prafa melambangkan semangat, rasa aman, bersih, dan kepercayaan melalui produk-produk yang dihasilkannya sehingga akan memberikan kesan yang berlangsung lama di hati para konsumennya.
3.2 Visi dan Misi PT. Pradja Pharin
3.2.1 Visi
Visi PT. Prafa adalah menjadi salah satu dari lima perusahaan farmasi terbesar di Indonesia.
3.2.2 Misi
Misi PT. Prafa adalah membangun Indonesia yang sehat secara bertahap setiap orang di setiap waktu, dengan menyediakan produk dan pelayanan kesehatan yang bermutu dan terjangkau, serta mendorong promosi kesehatan, bekerja sama dalam sebuah keluarga “BERSATU”.
3.2.3 Nilai-Nilai Perusahaan
Nilai-nilai inti PT. Prafa adalah “BERSATU” yang merupakan singkatan dari:
3.2.3.1Bayanihan
Kami bekerja sama dengan semangat gotong royong demi kemajuan perusahaan.
3.2.3.2Etos keterbukaan
Kami mengutamakan komunikasi yang transparan, jujur, dan saling menghormati serta meningkatkan kolaborasi yang tulus di dalam perusahaan. 3.2.3.3Rasa Peduli
Kami menghargai sesama dan membina hubungan baik antar rekan kerja dan dengan masyarakat sekitar kami.
3.2.3.4Semangat Untuk Maju
Kami selalu mengupayakan yang terbaik untuk memberikan hasil yang melampaui harapan para pemangku kepentingan.
3.2.3.5Ahli di bidangnya
Kami menguasai bidang pekerjaan kami dan memegang teguh panduan profesional yang berlaku.
3.2.3.6Tanggung jawab
Kami bertanggung jawab terhadap apa yang kami katakan dan perbuat. 3.2.3.7Utamakan pelanggan
Kami memberikan kepuasan lebih kepada pelanggan melalui cara unik dan relevan yang memberikan nilai tambah pada kehidupan mereka.
3.3 Struktur Organisasi PT. Pradja Pharin
PT. Prafa dipimpin oleh seorang Plant Manager yang membawahi 7
departemen dan masing-masing departemen dipimpin oleh seorang manajer yang dibantu oleh beberapa supervisor. Struktur organisasi PT.Prafa dapat dilihat pada Lampiran1.
3.4 Lokasi dan Sarana PT. Pradja Pharin
Kantor pusat PT. Prafa berada di Talavera Office Park, 8th-10th Floor, Jl. Letjen Simatupang No. 22-26, Jakarta. Pabrik PT. Prafa berada di Desa Karang Asem Barat, Kecamatan Citeureup, Kabupaten Bogor, Jawa Barat (Lampiran 2). Pabrik ini menempati areal seluas ±12 hektar dengan bangunan produksi seluas 17.208 m2 yang relatif terpisah dari lokasi pemukiman penduduk.
Sarana produksi yang dimiliki PT. Prafa antara lain: a. Bangunan utama terdiri dari tiga gedung besar, yaitu:
- Gedung pertama digunakan untuk ruang kantor, General Pharmacy Solid, Sterile Liquid Injection, ruang produksi dan kemas P&G, ruang Product Development Department (PDD), ruang Central Packaging (pengemasan
sentral), dan mesjid.
- Gedung kedua digunakan untuk ruang Quality Assurance (QA)/ Quality Control (QC) Department, gudang bahan baku, gudang bahan baku dan
bahan kemas P&G.
- Gedung ketiga digunakan untuk ruang produksi betalaktam dan sefalosporin, gudang non inventory dan gudang bahan kemas.
b. Bangunan penunjang lain meliputi gedung Technical Service (TS), area parkir,
pos satpam, kantin, unit laundry, Instalasi Pengolahan Air Limbah (IPAL), dan
tempat penyimpanan sementara (TPS) limbah padat. c. Bangunan gudang api dan gudang obat jadi.
3.5 Kegiatan Industri PT. Pradja Pharin
3.5.1 Departemen Logistik
Departemen logistik terdiri dari 4 bagian yaitu gudang bahan baku dan bahan kemas, gudang obat jadi, material and production planning, dan P&G material and production planning. Gudang bahan baku dan bahan kemas
membawahi bagian dispensary atau penimbangan dan gudang non inventory.
Departemen ini menggunakan program komputer EXACT sebagai sistem pencatatan stok.
Adapun tugas dan tanggung jawab departemen ini adalah:
- Menerima, menyimpan dan mengeluarkan barang serta mengelola semua inventaris yang meliputi bahan baku, bahan kemas dan obat jadi.
- Menjaga kualitas dan kuantitas bahan baku, bahan kemas dan obat jadi di dalam gudang sesuai dengan syarat dan ketentuan CPOB yang berlaku.
- Memonitor persediaan bahan baku, bahan kemas dan obat jadi
Secara umum, kegiatan departemen logistik meliputi kegiatan penerimaan, penyimpanan, pengeluaran dan penimbangan barang baik itu bahan baku, bahan kemas maupun obat jadi.
a. Penerimaan barang.
Kegiatan penerimaan barang yang berupa bahan baku ataupun bahan kemas dari pemasok diawali dengan pemesanan barang oleh bagian material and production planning dengan menggunakan Purchase Order Request (POR) dan
mengirimkan Purchase Order (PO) ke pemasok yang dituju. Pemasok kemudian
datang membawa barang pesanan beserta surat jalan dan Certificate of Analysis
(CoA) dari barang tersebut sesuai dengan PO. Pada saat penerimaan barang, petugas gudang harus memeriksa kesesuaian barang dengan PO, supir dan truk yang datang dengan mengisi Form List Truck serta kondisi fisik barang dengan
mengisi Incoming Material Check List. Supirdiwajibkan untuk berpakaian sopan,
bersepatu dan memiliki SIM sedangkan truk diperiksa kondisi fisiknya seperti kebersihan, ada atau tidaknya kerusakan pada bagian langit-langit truk, kondisi lantai box/container truk dan bila truk bak terbuka, harus ditutupi dengan dua
lapis terpal yang tidak tembus air. Hal ini dilakukan untuk memastikan tidak terjadi kontaminasi terhadap barang yang diangkut sehingga kualitasnya tetap terjamin.
Kondisi fisik barang diperiksa dengan mengamati kondisi kemasan (bersih dan kering, tersegel rapat, tidak rusak dan tidak robek atau bocor), jumlah barang dan lain-lain. Bila sudah sesuai dengan persyaratan, barang akan diterima dan surat jalan akan diparaf dan distempel oleh petugas. Setelah itu,barang disusun di atas pallet yang bersih. Petugas gudang kemudian memasukkan data barang yang datang ke sistem komputer. Setelah itu dilakukan pemberian nomor QC dan pencetakan label quarantine (warna kuning) dan General Receive Number (GRN).
Petugas gudang kemudian menempelkan label quarantine pada tiap pallet dan
label GRN pada tiap wadah serta mencatatnya ke dalam bincard.
Selanjutnya petugas gudang membuat Purchase Receipt Local (PRL) atau Purchase Receipt Import (PRI) untuk barang impor sebagai bukti penerimaan
bahan baku atau bahan kemas yang kemudian akan diperiksa oleh pihak departemen QA.Setelah itu, petugas QCakan datang ke gudang untuk melakukan sampling terhadap barang yang masuk. Jika sesuai dengan spesifikasi, maka barang tersebut akan diluluskan dan ditempelkan label QA released berwarna
hijau. Di samping itu, bincard dari barang tersebut juga akan distempel QA released dan diubah statusnya menjadi released pada sistem EXACT. Namun,
jika tidak sesuai spesifikasi, maka barang tersebut tidak diluluskan dan ditempelkan label rejected berwarna merah. Barang bersangkutan akan ditolak
dan dikembalikan ke pemasok atau dimusnahkan sesuai dengan kesepakatan kedua belah pihak.
Proses penerimaan obat jadi dimulai ketika divisi pengemasan sentral menyerahkan obat jadi beserta tanda terima dan dokumen Pengiriman Hasil Produksi (PHP) yang mencantumkan tanggal dokumen, nomor dokumen, nomor dan nama item produk, nomor bets, tanggal kadaluarsa, satuan unit hitung dan jumlah unit yang diserahkan. Kemudian petugas di gudang obat jadi akan menandatangani bukti serah terima. Obat jadi tersebut belum dapat diedarkan ke
Pihak gudang menerimabarang retur dari distributor berupa obat jadi yang sudah mendekati masa kadaluarsa atau yang kemasannya rusak yang disertai dengan dokumen retur. Dokumen ini sama seperti dokumen PHP sehingga dapat ditelusuri nomor bets produk yang diretur. Proses penerimaan ini disertai pemeriksaan fisik oleh petugas gudang dan petugas QC. Departemen QA berwenang membuat disposisi untuk produk retur terkait masa kadaluarsa. Produk dapat diretur minimal 3 bulan sebelum tanggal kadaluarsa. Produk yang kemasannya rusak ditangani dengan pengemasan ulang. Jika kerusakan disebabkan kelalaian distributor misalnya kondisi penyimpanan yang tidak sesuai dengan persyaratan, maka biaya pengemasan ulang ditanggung oleh pihak distributor.
b. Penyimpanan barang.
Penyimpanan bahan baku dan bahan kemas diwajibkan mematuhi persyaratan kondisi penyimpanan yang baik sesuai dengan rekomendasi pemasok terkait. Hal ini terkait dengan suhu penyimpanan yang dapat mempengaruhi kualitas barang. Oleh karena itu, gudang memiliki beberapa area penyimpanan seperti area AC, area non AC dan cool storage area (2-8oC). Setiap stok barang
memiliki kartu rak/bincard tersendiri dengan tujuan untuk mencatat kegiatan
keluar-masuk barang, jumlah dan tanggal transaksi serta untuk memudahkan pengambilan barang dari rak gudang.
c. Pengeluaran barang.
Bahan baku dan bahan kemas yang keluar dari gudang didasarkan pada
Production Order (PO) dan Picking List (PL). Barang dikeluarkan dari gudang
dengan memperhatikan sistem First Expired First Out (FEFO) dan First In First Out (FIFO) untuk bahan baku dan sistem First In First Out (FIFO) untuk bahan
kemas, sementara itu pengurangan stok barang dilakukan di sistem EXACT. Sebagai tanda bukti pengeluaran barang, pihak gudang akan mengeluarkan dokumen yang bernama Production Issue (PI). PI akan dikeluarkan setelah
penimbangan yang mengacu pada Batch Production Record (BPR) untuk bahan
baku atau setelah dikirim atau diterima oleh divisi pengemasan sentral untuk bahan kemas.
d. Penimbangan barang (Dispensary)
Kegiatan penimbangan yang dilakukan sudah terjadwal dan disesuaikan dengan jadwal kegiatan produksi. Dokumen penimbangan yang terkait antara lain
Production Order (PO), Picking List (PL), Batch Production Record Dispensary
(BPRD), dan label penimbangan. Sebelum penimbangan dilakukan, setiap alat timbang harus sudah mendapat label bersih yang berisi nama alat, nomor alat, dibersihkan oleh siapa, tanggal dan jam mulai dan selesai pembersihan, nama dan nomor bets produk terakhir yang ditimbang, tanggal dan paraf kepala bagian/supervisor serta nama dan nomor bets produk yang akan ditimbang. Selanjutnya dilakukan penyiapan jalur (line clearance) serta diperiksa kondisi
lingkungan dengan menggunakan formchecklist yang meliputi pemeriksaan suhu,
kelembaban, perbedaan tekanan antar ruang saat penimbangan dan ruang timbang, alat, drum, pallet bersih, dan ruang timbang harus bebas dari penimbangan sebelumnya. Alat timbang harus selalu diverifikasi dengan batu timbang yang terkalibrasi dengan syarat penyimpangan tidak boleh lebih dari 0,1 % dari berat konvensional anak timbangan.
Semua bahan baku yang akan ditimbang harus mendapat status QA released dan kegiatan penimbangan bahan aktif dilakukan terakhir setelah semua
bahan tambahan selesai ditimbang. Hal ini bertujuan untuk mencegah kontaminasi dari bahan aktif ke bahan yang lainnya. Penimbangan bahan untuk produk steril dilakukan di bawah Laminar Air Flow (LAF).
Bahan baku beserta bincard-nya yang sudah disiapkan sesuai dengan PL
dibawa ke ruang antara untuk dibersihkan dan dibuka kemasan terluarnya lalu dimasukkan ke dalam ruang dispensary untuk ditimbang. Bincard digunakan
untuk mencatat hasil penimbangan dan disesuaikan dengan pencatatan stok di EXACT. Setelah penimbangan selesai, bagian gudang akan mengeluarkan
Production Issue (PI) dimana waktu pemotongan stoknya di sistem EXACT
paling lama 16 jam setelah ditimbang. Hasil penimbangan selanjutnya akan diberi label penimbangan dan diserahkan ke bagian produksi beserta dokumen terkait.
3.5.1.1. Material and Production Planning
Material and production planning berfungsi sebagai penghubung
komunikasi antara produksi, pemasaran, pengadaan, akuntansi dan penyimpanan yang masing–masing berfungsi dalam penyediaan obat.
Tugas dan tanggung jawab departemen ini antara lain: 1. Merencanakan dan memonitor jalannya produksi.
2. Sebagai sumber data informasi yang berkaitan dengan pelaksanaan produksi. 3.5.1.2 P&G Material and Production Planning
Fungsi, tugas dan tanggung jawab departemen ini sama dengan material and production planning tetapi dikhususkan untuk menangani produk P&G.
3.5.1.3 Gudang Bahan Baku dan Bahan Kemas
Gudang bahan baku ditujukan sebagai tempat penyimpanan semua bahan baku, baik untuk kegiatan produksi Prafa maupun toll manufacturing dimana area
penyimpanan bahan P&G dan bahan toll manufacturing ditempatkan di lokasi
tersendiri, sementara bahan baku berupa zat aktif untuk kegiatan produksi betalaktam dan sefalosporin disimpan di area gudang yang terpisah secara fisik dari gudang lain. Gudang ini sendiri terdiri dari beberapa area penyimpanan yaitu: a. Area AC, merupakan area gudang dengan suhu ≤ 25°C dan Rh ≤ 75% untuk
menyimpan bahan baku yang tidak stabil pada suhu > 25°C.
b. Area non AC, merupakan gudang dengan suhu 32°C dan Rh ≤ 75% untuk
menyimpan bahan yang stabil pada suhu tersebut
c. Cool Storage Area, merupakan gudang dengan suhu 2-8°C untuk menyimpan
bahan yang tidak stabil pada suhu kamar.
d. Area prekursor, merupakan area gudang untuk penyimpanan prekursor seperti fenilpropanolamin dan pseudoefedrin. Area ini memiliki kunci ganda, masing-masing disimpan oleh petugas gudang dan QA.
Gudang bahan kemas ditujukan sebagai tempat penyimpanan semua bahan yang diperlukan pada proses pengemasan untuk menghasilkan obat jadi. Gudang ini memiliki dua ruang penyimpanan yaitu :
a. area AC merupakan area gudang untuk penyimpanan label dan alu-foil.
b. area non AC merupakan area gudang untuk penyimpanan box, botol, ampul, vial dan rubber stopper dan leaflet.
3.5.1.4 Gudang Obat Jadi
Gudang obat jadi digunakan untuk menyimpan hasil produksi berupa obat jadi yang siap dikirimkan ke distributor. Gudang ini memiliki beberapa fasilitas ruangan yakni:
a. Area AC, untuk menyimpan obat jadi yang memerlukan penyimpanan pada suhu ≤ 25°C dan Rh ≤ 75%.
b. Area non AC, untuk menyimpan obat jadi yang tidak memerlukan persyaratan khusus dalam penyimpanannya.
c. Cool Storage Area, dengan suhu 2-8°C.
d. Area Barang Kembalian, untuk menyimpan obat kembalian dari distributor yang sedang menunggu disposisi QA.
Selain keempat gudang yang telah disebutkan, terdapat juga fasilitas gudang api untuk menyimpan bahan-bahan yang mudah terbakar.
3.5.2 Departemen Technical Service (TS)
Departemen TS bertanggung jawab atas kelancaran kegiatan pabrik terutama pemeliharaan mesin atau peralatan produksi dan sarana penunjang produksi. Adapun tugas dan tanggung jawab departemen TS adalah sebagai berikut:
a. Memelihara semua mesin produksi dan sarana penunjang sesuai dengan jadwal yang ditentukan.
c. Menangani proyek pembangunan. Rencana pembangunan fasilitas produksi terlebih dahulu diajukan kepada departemen TS, kemudian ditentukan material dan bahan kontruksi yang diperlukan serta anggaran belanja.
Perawatan rutin dan modifikasi yang dilakukan oleh departemen TS bertujuan agar mesin produksi tidak rusak pada saat dipakai sehingga jadwal produksi yang telah disusun material and production planning tidak mengalami downtime. Ada dua jenis downtime yang dapat terjadi yaitu:
a. Unschedule downtime, merupakan downtime yang terjadi karena berhentinya
mesin secara tiba-tiba selama proses produksi sedang berlangsung. Hal ini menyebabkan mesin harus diperbaiki sehingga memperpanjang waktu produksi.
b. Schedule downtime, merupakan downtime yang terjadi karena mesin berhenti
beroperasi akibat suatu kegiatan yang tidak dapat ditolak, misalnya gulungan aluminium foil habis pada saat proses stripping sehingga membutuhkan waktu
untuk memasang gulungan aluminium foil yang baru pada mesin stripping,
saat sanitasi ruangan atau pelaksanaan preventive maintenance.
Sedangkan sarana penunjang produksi di PT. Prafa yang dikelola departemen TS antara lain:
3.5.2.1Electricity
Electrical berperan dalam pemantauan dan perawatan perangkat
kelistrikan dan berhubungan langsung dengan PLN sebagai penyedia tenaga listrik. Rangkaian listrik untuk pabrik dimulai dari gardu PLN kemudian menuju gardu listrik kecil kemudian menuju ke panel besar yang berada di setiap gedung dan terakhir menuju setiap panel kecil yang berada di ruangan.
3.5.2.2Clean Compressed Air
Terdapat dua buah kompressor yang digunakan untuk menghasilkan clean compressed air atau udara bersih bertekanan di pabrik. Clean compressed air ini
digunakan baik untuk yang contact product seperti proses spraying pada Fluid Bed Dryer (FBD) maupun yang non-contact product seperti deduster pada mesin
3.5.2.3Sistem Pengolahan Air
Ada tiga jenis kualitas air yang digunakan untuk keperluan pabrik yakni
tap water, hot purified water (HPW) dan water for injection (WFI). Sumber air ini
berasal dari 3 sumur artesis dengan kedalaman ±150 m. Awalnya air dipompa ke permukaan dan ditampung ke dalam dua tangki penampungan (storagetank).
Proses klorinasi dilakukan terhadap air di dalam storage tank dengan
penambahan natrium hipoklorit (NaOCl) 0,7-1,0 ppm untuk membunuh bakteri. Air hasil olahan lalu dialirkan ke fasilitas pengolahan hot purified water (HPW)
serta ke fasilitas pabrik lainnya seperti ruang ketel uap, produksi dan toilet sebagai air ledeng.
Proses produksi hot purified water yaitu air yang mengandung klorin
dilewatkan ke multimedia filter berisi ferolite dan antrasite. Ferolite berfungsi
untuk menurunkan kadar zat besi sedangkan antrasite berfungsi untuk memisahkan partikel kasar dari air. Setelah itu, air dialirkan ke carbon filter untuk
menetralkan klorin dan menghilangkan bau lalu dilakukan penyaringan dengan menggunakan cartridge filter 5 µm. Selanjutnya air dilewatkan melalui cation bed
untuk memisahkan kation dengan mengunakan resin penukar kation dan anion bed untuk memisahkan anion dengan menggunaan resin penukar anion. Kemudian
air dilewatkan ke mix bed (gabungan resin penukar anion dan kation) untuk
mencegah adanya anion dan kation yang terlewat melalui resin penukar ion sebelumnya. Air yang keluar dari mix bed kemudian disaring dengan
menggunakan cartridge filter berturut-turut 1 µm dan 0,5 µm lalu disinari UV
untuk merusak DNA bakteri. Hasilnya kemudian disaring lagi dengan cartridge
filter 0,2 µm lalu dipanaskan dengan menggunakan plate heat exchanger (PHE)
sebelum dimasukkan ke dalam storage tank. Suhu HPW di storage tank
dipertahankan dalam kisaran 88-92oC. Air dalam storage tank lalu disirkulasi ke
gedung produksi dan ke ruang produksi air water for injection (WFI).
Proses pembuatan WFI dimulai ketika HPW dialirkan menuju ruang produksi WFI. HPW ini kemudian ditampung dalam tangki double jacket dan
dikondensasi secara bertahap dan ditampung ke dalam storage tank untuk
dialirkan ke user point sebagai WFI.
3.5.2.4HVAC (Heating, Ventilating and Air Conditioning)
Heating, Ventilating, Air Conditioning (HVAC) merupakan sistem
sirkulasi udara yang mengatur temperatur, kelembaban relatif, dan jumlah partikel. Air Handling Unit (AHU) merupakan suatu perangkat pengolahan udara
yang menggunakan prinsip HVAC. Tiga fungsi Utama HVAC, yaitu heating, ventilating, dan air conditioning saling berhubungan untuk menghasilkan udara
dalam gedung yang berkualitas, mengurangi infiltrasi udara, ventilasi, dan menjaga hubungan tekanan antar ruangan.
Prinsip kerja HVAC adalah sebagai berikut, udara luar dan udara hasil resirkulasi di dalam ruangan masuk ke dalam washable filter untuk disaring yang
bertujuan untuk mencegah masuknya kotoran. Udara kemudian dialirkan menuju
fan cooling unit (FCU) untuk didinginkan. Udara hasil pendinginan melewati booster fan untuk didorong menuju premedium filter housing yang merupakan
filter dengan efisiensi 90-95%. Udara hasil penyaringan tersebut akan mengalami penyaringan akhir oleh HEPA filter H11 (95%) dan keluar menuju electricity heater untuk menurunkan Rh dan selanjutnya didistribusikan melalui pipa.
Ada empat parameter yang perlu diperhatikan dan dikendalikan dalam sistem AHU, yaitu yang pertama temperatur ruangan yang harus diatur sedemikian rupa agar persyaratan temperatur ruangan untuk kegiatan produksi dapat terpenuhi. Kedua adalah kelembaban relatif ruangan, kelembaban udara adalah parameter kritis bagi produk yang bersifat higroskopis. Ketiga yaitu jumlah partikel. Jumlah partikel dalam setiap ruangan berbeda-beda tergantung klasifikasi ruangan. Jumlah partikel dikendalikan oleh beberapa filter yang terdapat pada AHU. Kemudian yang keempat adalah jumlah sirkulasi udara dan perbedaan tekanan. Jumlah sirkulasi udara dan perbedaan tekanan akan menentukan tingkat kebersihan ruangan. Hal ini bertujuan untuk meminimalisasi terjadinya kontaminasi silang.
3.5.2.5Steam Boiler
Berdasarkan kualitas uap yang dihasilkannya, terdapat dua buah steam boiler yang digunakan di PT. Prafa, yaitu:
a. Plant steam boiler. Boiler ini digunakan untuk menghasilkan uap panas
bertekanan tinggi yang dipakai sebagai sumber energi panas untuk memanaskan double jacket tank dan pengolahan air.
b. Clean steam boiler. Boiler ini digunakan sebagai sumber uap panas untuk
peralatan dan/atau mesin di fasilitas steril pabrik, seperti misalnya autoklaf. Sumber air yang digunakan boiler ini adalah water for injection (WFI).
3.5.3 Departemen Human Resources and General Services (HRGS)
Departemen HRGS dipimpin oleh seorang manajer yang membawahi tiga divisi yaitu personnel affairs, general affairs dan building maintenance. Manajer
HRGS bertugas untuk memimpin, mengarahkan, mengevaluasi dan mengembangkan suatu tim yang terdiri dari staf-staf untuk memastikan bahwa manajemen dokumentasi ketenagakerjaan, proses dan kegiatan administrasi lainnya berjalan dengan baik dan sesuai dengan perencanaan.
Tugas divisi personnel affairs adalah menangani segala hal yang berkaitan
dengan sumber daya manusia yang ada di PT. Prafa antara lain:
a. Menyusun daftar gaji dan tunjangan jabatan serta menghitung pembayarannya setiap akhir bulan.
b. Membuat laporan jumlah karyawan.
c. Melakukan perekrutan karyawan atas permintaan departemen lain yang membutuhkan.
d. Membuat dan memeriksa absensi/kehadiran karyawan serta memasukkan data absensi karyawan.
Divisi building maintenance bertanggung jawab dalam pemeliharaan
bangunan pabrik PT. Prafa. Divisi general affairs bertugas menangani seluruh hal
yang berkaitan dengan kesejahteraan dan fasilitas umum karyawan yaitu: a. Menangani masalah kebersihan dan keamanan.
c. Makan siang karyawan, supir, dan laundry.
d. Pengolahan limbah
General affairs juga menangani hubungan antara pabrik dengan pihak luar
yaitu masyarakat, instansi pemerintah ataupun instansi non pemerintah serta menangani keluhan dari masyarakat terkait gangguan yang mungkin ditimbulkan oleh pabrik ataupun limbahnya. Administrasi kesekretariatan dan keuangan pabrik juga ditangani oleh departemen HRGS yang meliputi surat masuk dan surat keluar, membuat laporan-laporan dan mengurus hal-hal yang berkaitan dengan pengeluaran-pengeluaran pabrik.
Salah satu tugas general affairs adalah menangani pengolahan limbah.
Limbah padat dapat berasal dari debu hasil proses produksi, sampah sisa proses pengemasan, sampah dari lingkungan pabrik, produk rejected dan obat yang telah
kadaluarsa. Limbah padat yang masih dapat dimanfaatkan serta memiliki nilai jual seperti sisa kemasan (kaleng, drum, alumunium foil, plastik, botol, kardus) dikumpulkan di Tempat Penyimpanan Sementara (TPS) kemudian dijual kembali. Limbah padat berupa debu hasil proses produksi akan disedot oleh dust collector
yang kemudian dikumpulkan oleh petugas technical service sebulan sekali dan
disimpan di TPS. Limbah padat yang berasal dari proses produksi betalaktam dan sefalosporin terlebih dahulu dimasukkan dalam kantung plastik transparan yang dibasahi bagian luar dan dalamnya dengan larutan NaOH pH 12 kemudian disimpan di TPS. Selanjutnya, limbah padat tersebut dikirim ke PT. Wastec International untuk dimusnahkan.
Limbah cair berasal dari proses produksi, pencucian peralatan produksi, limbah laboratorium dan buangan lainnya. Semua limbah cair ini kemudian diolah di Instalasi Pengelolaan Air Limbah (IPAL). Limbah cair yang berasal dari proses produksi betalaktam dan sefalosporin dilakukan pretreatment dahulu sebelum
dilanjutkan ke tahap selanjutnya.
Dalam proses pengolahan limbah cair, IPAL di Prafa terdiri dari 11 buah bak yang masing-masing kegunaannya dijelaskan secara ringkas sebagai berikut: a. Antibiotic denaturation Tank 1. Bak ini merupakan bak penampungan limbah
dilakukan penambahan NaOH sehingga pH cairan menjadi 12 dan terjadi hidrolisis cincin laktam.
b. Antibiotic denaturation Tank 2. Di dalam bak ini berlangsung proses netralisasi
limbah cair sehingga diperoleh limbah dengan pH ± 7 yaitu dengan penambahan HCl. Hal ini diperlukan karena bakteri aerobik yang akan digunakan dalam tahap pengolahan limbah selanjutnya, tumbuh dan bekerja pada pH netral. Proses penambahan HCl dan NaOH dilakukan secara otomatis menggunakan dosing pump.
c. Oil separation. Bak ini merupakan bak penampungan limbah cair utama yang
berasal dari produksi non betalaktam dan sefalosporin. Di dalam bak ini berlangsung proses netralisasi limbah cair sehingga diperoleh limbah dengan pH ± 7 yaitu dengan penambahan HCl.
d. Oil Collection. Bak ini berfungsi untuk memisahkan cairan dengan minyak
secara manual.
e. Contact Tank. Bak ini merupakan bak penampungan limbah produksi baik beta
laktam dan sefalosporin atau non betalaktam (NBL) yang telah mengalami penetralan. Bak ini memiliki kanal berkisi (fish bone weir) untuk mengurangi
gas yang terkandung di dalam air limbah.
f. Primary Clarifier. Bak ini berbentuk kerucut atau luas bagian bawah lebih
sempit dibandingkan dengan bagian atas.
g. Sludge stabilization. Bak ini berfungsi untuk menampung lumpur yang
berlebih untuk selanjutnya dialirkan ke filter press.
h. Aeration Tank. Bak ini memiliki diffuser untuk mensuplai oksigen bagi bakteri. Diffuser ini memiliki dua blower yang bekerja 24 jam secara bergantian.
i. Secondary Clarifier. Bak ini berfungsi untuk memisahkan air dan lumpur
dengan cara menyedot lumpur untuk dialirkan ke bak sludge stabilization.
j. Break Tank. Bak ini merupakan bak untuk menampung air limbah yang sudah
tidak mengandung lumpur. Setelah itu limbah dialirkan berturut-turut menuju
sand filter dan carbon filter. Filtrasi ini bertujuan untuk menyaring air limbah