diidentifikasi dilakukan pemurnian terhadap isolat potensial dan dilakukan pengamatan morfologi sel di bawah mikroskop, pewarnaan Gram dan identifikasi genus. Hasil identifikasi genus dilanjutkan dengan pengujian karakteristik biokimianya untuk melihat tingkat taksonomi yang lebih rendah lagi (spesies) dan hasil dari pengujian biokimiawi kemudian dicocokkan dengan kunci taksonomi yang terdapat dalam Bergey’s Manual of Determinative Bacteriology.
HASIL DAN PEMBAHASAN
Isolat Bakteri Penghasil Bioflokulan
Indonesia merupakan salah satu negara yang memiliki banyak industri tekstil. Untuk mengolah limbah yang dihasilkannya tidak semua industri di Indonesia menggunakan pengolahan limbah secara biologis. Pada umumnya dalam pengolahan limbah secara biologis digunakan lumpur aktif yang merupakan gumpalan yang terdiri atas ribuan jenis bakteri aerobik dengan komposisi terbanyak adalah bakteri 95% dan 5% merupakan campuran fungi, alga, rotifera, dan protozoa. Proses pengolahan limbah dengan metode lumpur aktif ini lebih aman karena menggunakan campuran mikroorganisme. Bakteri yang berada di dalam lumpur aktif bertanggung jawab dalam mengoksidasi bahan-bahan organik, dan beberapa diantaranya dapat membentuk flok. Beberapa penelitian telah melaporkan bahwa bakteri yang diisolasi dari lumpur aktif yaitu Zooglea ramigera merupakan bakteri pembentuk flok (Shimizu & Odawara 1985).
Bakteri diisolasi dalam penelitian ini dari lumpur aktif yang berasal dari industri tekstil PT Indonesian Toray Synthetics (PT ITS), Tangerang dan PT UNITEX, Bogor. Isolasi bakteri dilakukan dengan metode cawan sebar menggunakan media Nutrient Agar (NA) kemudian diinkubasi selama 16 jam pada suhu 37 oC. Media ini digunakan karena sebagian besar mikroorganisme lebih menyukai media nutrien daripada media lengkap seperti ester pthalate (Kurane et al. 1986). Koloni murni yang memiliki morfologi yang berbeda secara visual baik bentuk atau warna dipilih sebagai bakteri yang akan diuji lebih lanjut kemudian dikumpulkan dalam satu cawan petri yang berisi media NA dan diinkubasi kembali selama 16 jam pada suhu 37 oC (Gambar 4) .
Gambar 4 Isolat-isolat yang diisolasi dari lumpur aktif.
Hasil percobaan diperoleh delapan isolat bakteri dengan bentuk dan warna yang berbeda yaitu lima jenis bakteri berasal dari PT UNITEX dan tiga jenis bakteri berasal dari PT ITS. Semua isolat yang didapat bentuknya bulat, secara umum berwarna putih dan diberi kode sesuai dengan nama sampel yang diambil yaitu LA yang berarti lumpur aktif (Tabel 2). Untuk menghindari terjadinya kontaminasi, masing-masing isolat bakteri yang terpilih ditumbuhkan pada media agar miring (Gambar 5). Setelah ditumbuhkan pada media agar miring, warna dari masing-masing isolat terlihat lebih jelas dan terjadi perubahan warna pada isolat LA-7 dan LA-8 yang asalnya hasil isolasi berwarna putih tipis dan putih bening menjadi hijau berpendar untuk LA-7 dan hijau tua berpendar untuk LA-8. Tabel 2 Jenis-jenis bakteri hasil isolasi dari
lumpur aktif Jenis isolat Lokasi pengambilan sampel Bentuk/Warna
LA-1 PT UNITEX Bulat/kuning
LA-2 PT UNITEX Bulat/ merah
kecoklatan
LA-3 PT UNITEX Bulat/kuning tebal
LA-4 PT UNITEX Bulat/putih tipis
LA-5 PT UNITEX Bulat/putih tebal
LA-6 PT ITS Bulat/putih keruh
LA-7 PT ITS Bulat/putih tipis
LA-8 PT ITS Bulat/putih bening
Gambar 5 Isolat-isolat yang diisolasi dari lumpur aktif pada media agar miring. LA ( 1 3 7 8 2 4 )
Media Produksi Bioflokulan
Media produksi bioflokulan digunakan untuk menstimulasi bakteri mengeluarkan bioflokulannya yang merupakan polimer esensial yang diproduksi oleh mikroorganisme pada waktu masa pertumbuhannya (Jie et al. 2005). Komposisi media produksi bioflokulan mengandung yeast ekstract yang bertujuan dalam menstimulasi produksi bioflokulan dan sebagai sumber nitrogen organik yang paling baik untuk pembentukan bioflokulan dibanding sumber nitrogen organik lain. Penambahan yeast ekstract yang paling sesuai adalah pada konsentrasi 0.5 % (Nohata dan Kurane 1994). Selain itu ditambahkan juga urea yang berfungsi sebagai sumber nitrogen anorganik. Senyawa KH2PO4 berfungsi
sebagai sumber energi dan mampu menjaga pH media selama kultivasi agar selalu berkisar pada kondisi pH netral. Glukosa dan sukrosa selain sebagai sumber karbon atau substrat pada media pertumbuhannya juga dapat menstimulasi bioflokulan.
Produksi bioflokulan pada penelitian ini dilakukan setelah propagasi tujuannya untuk mempersiapkan dan mengaktifkan sel sampai pada fase eksponensial sehingga dapat mempercepat fase adaptasi (lag phase) pada waktu produksi bioflokulan. Didalam propagasi tersebut, mikroorganisme melakukan pengaturan metabolisme sintesa enzim dan aktivitas enzim sehingga mampu tumbuh lebih efisien dalam kondisi baru. Bakteri yang telah dipropagasi dinamakan kultur bioflokulan. Kultur bioflokulan diambil 1% kemudian ditumbuhkan pada media produksi bioflokulan dan dikocok dengan kecepatan 180 rpm selama 72 jam pada suhu 27 oC. Waktu yang ditetapkan digunakan sebagai screening untuk menghasilkan kultur bioflokulan dan selanjutnya kultur bioflokulan tersebut diuji aktivitas flokulasinya terhadap suspensi kaolin clay. Penggunaan waktu kultivasi yang lebih lama dimaksudkan untuk memperoleh jumlah bioflokulan yang lebih banyak, dikarenakan adanya kemungkinan terdapatnya jenis bakteri yang lebih lambat dalam mensintesis bioflokulan. Selain itu lamanya waktu yang ditetapkan dikarenakan kurva aktivitas flokulasi paralel dengan kurva pertumbuhan sel dan aktivitas flokulasi meningkat dengan meningkatnya umur biakan ( Jie et al. 2005).
Hasil Pengukuran Aktivitas Flokulasi
Kultur bioflokulan dari isolat bakteri yang terpilih kemudian diuji kemampuan
flokulasinya terhadap suspensi kaolin clay (5.5 g/L) yang merupakan bahan uji standar dalam penentuan aktivitas flokulasi (Kurane et al. 1986). Kedalam suspensi kaolin clay tersebut ditambahkan kultur bioflokulan dari masing-masing isolat sebanyak 1 mL. Selain itu ditambahkan juga FeCl3 dengan
konsentrasi 0.05% (Susanti et al. 2007) dan sisanya ditambah akuades sampai volume akhir 100 mL.
Penentuan aktivitas flokulasi dilakukan dalam dua waktu yaitu, pada lima dan dua menit diawal saat terjadinya flokulasi. Hasil yang diperoleh pada pengamatan lima menit menunjukkan ada ketidaksesuaian antara pengamatan secara visual dengan hasil persentase aktivitas flokulasi yang didapat melalui pengukuran OD supernatan pada ë 550 nm. Hal ini terlihat pada isolat LA-7. Hasil pengamatan secara visual, isolat LA-7 dapat membentuk flok yang lebih besar dan dapat mengendap dengan cepat jika dibandingkan dengan isolat lain khususnya LA-6. Tetapi berdasarkan hasil pengukuran OD supernatan, nilai kekeruhan dari isolat LA-7 tidak jauh berbeda dengan isolat LA-6. Hal ini dikarenakan jika dilihat secara visual aktivitas flokulasi terjadi pada menit-menit pertama sehingga dengan pengamatan yang cukup lama tingkat kekeruhan antara sampel dan kontrol dengan pengambilan supernatan sebanyak 5 mL kurang memberikan perbedaan yang signifikan (Tabel 3).
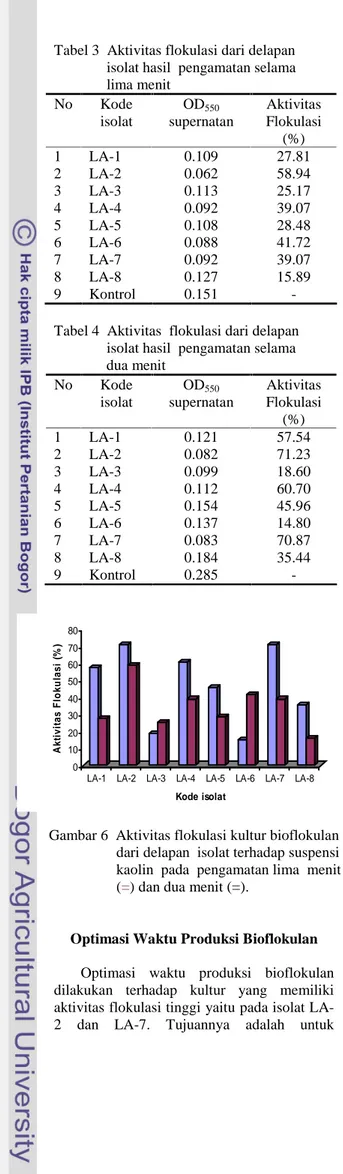
Pengamatan kedua dilakukan selama dua menit, dengan tujuan untuk membandingkan hasil pengamatan selama lima menit dan dua menit. Hasil dari pengamatan menunjukkan adanya perbedaan yang sangat signifikan dari kedelapan isolat tersebut. Aktivitas flokulasi kultur bioflokulan beberapa isolat cukup bervariasi (Gambar 6). Pada pengamatan selama dua menit, isolat LA-7 dan LA-2 mempunyai persentase aktivitas flokulasi yang lebih besar jika dibandingkan isolat lain. Selain itu diperoleh hasil yang sesuai antara pengukuran OD dengan pengamatan visual terhadap terbentuknya flok dan kecepatan pengendapan (Tabel 4). Dengan mengetahui penurunan turbiditas yang diukur menggunakan spektrofotometer pada ë 550 nm maka aktivitas flokulasi (AF) dapat dihitung mengikuti persamaan AF = (A – B) /A x 100%. Dalam hal ini A adalah optikal densiti kontrol pada ë 550 nm dan B adalah optikal densiti sampel pada ë 550 nm. Berdasarkan penelitian diperoleh presentase hasil uji flokulasi isolat LA-2 sebesar 71.23% dan isolat LA-7 sebesar 70.87%.
Tabel 3 Aktivitas flokulasi dari delapan isolat hasil pengamatan selama lima menit No Kode isolat OD550 supernatan Aktivitas Flokulasi (%) 1 LA-1 0.109 27.81 2 LA-2 0.062 58.94 3 LA-3 0.113 25.17 4 LA-4 0.092 39.07 5 LA-5 0.108 28.48 6 LA-6 0.088 41.72 7 LA-7 0.092 39.07 8 LA-8 0.127 15.89 9 Kontrol 0.151 -
Tabel 4 Aktivitas flokulasi dari delapan isolat hasil pengamatan selama dua menit
Gambar 6 Aktivitas flokulasi kultur bioflokulan dari delapan isolat terhadap suspensi kaolin pada pengamatan lima menit (=) dan dua menit (=).
Optimasi Waktu Produksi Bioflokulan
Optimasi waktu produksi bioflokulan dilakukan terhadap kultur yang memiliki aktivitas flokulasi tinggi yaitu pada isolat LA-2 dan LA-7. Tujuannya adalah untuk
mengetahui hubungan antara pola perubahan kemampuan flokulasi dengan pola perubahan dari beberapa karakteristik kulturnya seperti pertumbuhan bakteri, pH kultur, dan aktivitas flokulasi. Selain itu untuk mengetahui waktu optimum kultur tersebut menghasilkan bioflokulan. Pengamatan dilakukan dari jam ke 0-96. Penetapan lamanya waktu tersebut karena pada tahap screening produksi bioflokulan dilakukan selama 72 jam selain itu untuk mengetahui masih ada atau tidaknya bioflokulan yang diproduksi setelah 72 jam. Hal tersebut dapat diketahui dengan melakukan pengujian aktivitas flokulasi.
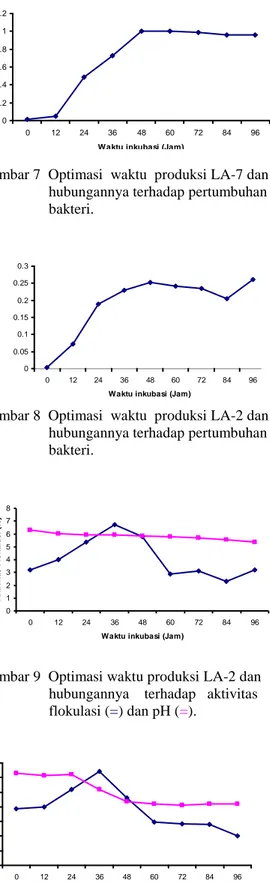
Hasil pengamatan optimasi bioflokulan terhadap isolat LA-7 dapat dilihat pada Gambar 7 sedangkan untuk LA-2 dapat dilihat pada Gambar 8. Dari gambar tersebut dapat dilihat bahwa pertumbuhan bakteri dalam kultur pada kedua isolat terus mengalami peningkatan selama selang waktu kultivasi. Pertumbuhan bakteri dari isolat 2 dan LA-7 memiliki pola yang sama, yaitu pada awal kultivasi meningkat dengan lambat diikuti pertumbuhan yang makin pesat, kemudian mencapai titik maksimum pada jam tertentu dan cenderung menurun pada akhir kultivasi. Laju pertumbuhan menurun akibat persediaan substrat atau nutrien berkurang dan terjadi akumulasi zat-zat metabolik yang menghambat pertumbuhan. Laju pertumbuhan akan menurun terus menerus sampai nilainya sama dengan nol (jumlah sel yang tumbuh sama dengan jumlah sel yang mati). Selanjutnya total massa sel akan konstan, tetapi jumlah sel hidup akan berkurang dan adanya lisis akan menyebabkan penurunan massa sel (Wang et al. 1979).
Pertumbuhan mikroorganisme pada media tertentu terbagi menjadi tiga fase pertumbuhan yaitu, fase awal (lag phase) yang diikuti dengan fase eksponensial atau fase logaritmik, fase stasioner dan fase menurun atau kematian (Wang et al. 1978). Dari data hasil penelitian (Gambar 7 dan Gambar 8) diketahui bahwa fase pertumbuhan lambat tidak terjadi pada produksi mikrobial karena isolat-isolat tersebut sebelum di produksi dilakukan dulu propagasi. Propagasi bertujuan untuk mempersiapkan sel sampai pada fase eksponensial. Fase eksponensial terjadi mulai jam ke 12 sampai jam ke 48 untuk LA-2 dan jam ke 60 untuk LA-7. Hal ini dapat terlihat dari makin meningkatnya OD bakteri pada pengukuran spektrofotometre ë 550 nm. Fase stasioner dan fase kematian terjadi apabila jumlah sel yang tumbuh sama jumlahnya dengan sel yang mati. Fase No Kode isolat OD550 supernatan Aktivitas Flokulasi (%) 1 LA-1 0.121 57.54 2 LA-2 0.082 71.23 3 LA-3 0.099 18.60 4 LA-4 0.112 60.70 5 LA-5 0.154 45.96 6 LA-6 0.137 14.80 7 LA-7 0.083 70.87 8 LA-8 0.184 35.44 9 Kontrol 0.285 - 0 10 20 30 40 50 60 70 80 A k ti v it a s F lo k u la s i (% )
LA-1 LA-2 LA-3 LA-4 LA-5 LA-6 LA-7 LA-8 Kode isolat
stasioner terjadi pada jam ke 60 untuk LA-2 dan jam ke 72 untuk LA-7 dan kemudian diikuti oleh fase kematian. Hal ini dapat dilihat dari nilai OD bakteri yang semakin menurun. Fase kematian terjadi disebabkan oleh terbatasnya jumlah substrat yang akan digunakan untuk pertumbuhan dan terbentuknya metabolit sekunder yang diperkirakan dapat menghambat pertumbuhan mikroorganisme. Hal ini juga dapat disebabkan oleh menurunnya produk (bioflokulan) yang merupakan sumber cadangan makanan untuk bakteri.
Optimasi waktu produksi bioflokulan dari kedua isolat potensial jika dilihat hubungannya terhadap pH terus mengalami penurunan pada kulturnya hingga jam ke 96 dengan sedikit fluktuasi (Gambar 9 dan Gambar 10). Penurunan pH kultur ini terjadi karena terbentuknya asam-asam organik hasil fermentasi glukosa dan sukrosa yang digunakan sebagai sumber karbon dalam medium pertumbuhannya. Selain itu turunnya nilai pH dapat dijadikan indikasi bahwa pertumbuhan mikroorganisme telah mengalami fase stasioner. Pada fase stasioner ini mikroorganisme tidak memproduksi biomassa sehingga proses metabolismenya menurun dan asam yang merupakan produk sampingnya tidak dihasilkan lagi.
Aktivitas flokulasi diukur berdasarkan tingkat kejernihan larutan yang mengandung kaolin yang ditambahkan kultur bioflokulan. Setelah didiamkan selama dua menit akan terbentuk agregat-agregat yang lebih besar yang mempercepat proses pengendapan. Aktivitas flokulasi dari kultur bakteri LA-2 dan LA-7 meningkat selama selang waktu kultivasi seiring dengan terus meningkatnya pertumbuhan bakteri pada kulturnya. Aktivitas flokulasi mencapai puncaknya pada awal fase pertumbuhan eksponensial. Hal ini menunjukkan bahwa pembentukkan bioflokulan terkait dengan pertumbuhan sel-sel bakteri dalam kultur. Penurunan aktivitas flokulasi seperti yang terlihat pada grafik dapat disebabkan oleh kultur bioflokulan yang sedikit dan juga disebabkan oleh kultur bioflokulan yang mempunyai tingkat kekeruhan tinggi yang mengakibatkan bertambah keruhnya larutan.
Aktivitas flokulasi optimum untuk kedua isolat dicapai pada jam ke 36 dengan persentase sebesar 67.25% untuk LA-2 dan 64.04% untuk LA-7 pada pH 5.92 dan 5.19 dan OD bakteri 0.229 dan 0.729 (Gambar 9 dan Gambar 10).
Gambar 7 Optimasi waktu produksi LA-7 dan hubungannya terhadap pertumbuhan bakteri.
Gambar 8 Optimasi waktu produksi LA-2 dan hubungannya terhadap pertumbuhan bakteri. 0 1 2 3 4 5 6 7 8 0 12 24 36 48 60 72 84 96
Waktu inkubasi (Jam)
A k ti v it a s F lo k u la s i (% )
Gambar 9 Optimasi waktu produksi LA-2 dan hubungannya terhadap aktivitas flokulasi (=) dan pH (=).
Gambar 10 Optimasi waktu produksi LA-7 dan hubungannya terhadap aktivitas flokulasi (=) dan pH (=). 0 0.2 0.4 0.6 0.8 1 1.2 0 12 24 36 48 60 72 84 96
Waktu inkubasi (Jam)
P e rt u m b u h a n b a k te ri 0 1 2 3 4 5 6 7 0 12 24 36 48 60 72 84 96
Waktu inkubasi (Jam)
A k ti v it a s F lo k u la s i (% ) 0 0.05 0.1 0.15 0.2 0.25 0.3 0 12 24 36 48 60 72 84 96
Waktu inkubasi (Jam)
P e rt u m b u h a n b a k te ri
Karakterisasi Bioflokulan
Karakterisasi bioflokulan dilakukan untuk mengetahui kondisi optimum dari bioflokulan tersebut terhadap hubungannya dengan kation (koagulan), pH, dan suhu. Karakterisasi dilakukan terhadap isolat LA-2 dan LA-7 yang merupakan isolat potensial.
Karakterisasi bioflokulan dari kedua isolat potensial terhadap kation dilakukan dengan menggunakan ZnSO4, MgSO4, CaCl2,
FeCl3, dan AlCl3. Alasan pemilihan
kation-kation ini adalah untuk membandingkan kekuatan valensi ion dari kation-kation tersebut terhadap kemampuannya dalam memflokulasi koloid-koloid dalam suspensi kaolin. Menurut Siregar (2005) valensi ion akan berpengaruh terhadap proses koagulasi. Ion yang memiliki muatan berlawanan dengan koloid akan dinetralkan kemudian diendapkan melalui proses koagulasi. Semakin besar valensi koagulan maka efektivitas gaya koagulasi makin besar.
Kation yang paling efektif dalam memflokulasikan suspensi kaolin adalah AlCl3 dengan pengamatan selama dua menit.
Aktivitas flokulasi yang diperoleh sebesar 46.12% untuk LA-2 dan 49.16% untuk LA-7 (Gambar 11). Aktivitas flokulasi yang cukup besar ini diperoleh karena AlCl3 merupakan
kation multivalen yang memiliki ion valensi lebih tinggi (+3) daripada ion-ion lain. Sehingga kemampuannya dalam mengikat koloid-koloid bermuatan negatif dalam suspensi kaolin semakin besar. Karena sifat muatannya yang lebih positif, kation multivalen ini akan menggantikan posisi kation monovalen yang terikat pada partikel bermuatan negatif sehingga terbentuk agregat-agregat. Agregat-agregat tersebut merupakan ikatan antara bioflokulan, ion Al3+ dan padatan yang tersuspensi. Semakin besar agregat yang terbentuk berarti semakin besar pula flok dan bobot yang dihasilkan sehingga mempermudah terjadinya pengendapan.
Kation AlCl3 dan FeCl3 sama-sama
merupakan kation multivalen. Jika dilihat dari hasil uji flokulasi, kedua kation tersebut dapat digunakan sebagai koagulan yang baik. Tetapi pada penelitian ini setelah dibandingkan keefektifannya antara kedua kation multivalen tersebut, AlCl3 memiliki aktivitas flokulasi
lebih tinggi daripada FeCl3 dengan perbedaan
yang sangat kecil (Gambar 11). Oleh karena itu pada tahap optimasi selanjutnya menggunakan kation AlCl3 sebagai koagulan.
Sama halnya dengan kation bervalensi dua pada ZnSO4, MgSO4, CaCl2. Kation-kation
tersebut memiliki valensi ion yang sama yaitu (+2) tetapi jika dilihat dari hasil penelitian ketiga kation tersebut memiliki kemampuan memflokulasi yang berbeda-beda setelah penambahan kultur bioflokulan. Isolat LA-7 memiliki kemampuan memflokulasi hampir pada semua kation yang digunakan kecuali pada ZnSO4. Berbeda dengan isolat LA-2 yang
hanya memiliki kemampuan flokulasi pada penambahan kation AlCl3 dan FeCl3 saja.
Gambar 11 Hubungan kation (koagulan) dengan aktivitas flokulasi isolat LA-2 (=) dan LA-7 (=).
Rentang pH dalam proses koagulasi-flokulasi merupakan salah satu faktor penting untuk mengetahui kondisi optimum dari bioflokulan dan koagulan yang digunakan. AlCl3 merupakan koagulan yang paling efektif
diabandngkan dengan koagulan lainnya. AlCl3
dan bioflokulan kemudian dioptimasi terhadap pH pada rentang 4-10. Hasil dari optimasi terhadap koagulan dan bioflokulan diperoleh pada pH 6. Untuk koagulan kondisi ini berada dalam spesi bermuatan positif sehingga spesi yang bermuatan positif tersebut akan segera teradsorpsi oleh permukaan koloid (Gambar 12). Proses flokulasi biasanya menggunakan flokulan dalam bentuk polimer organik yang monomer-monomernya dapat terionisasi (Turkman & Uslu 1991). Proses ionisasinya merupakan suatu reaksi kesetimbangan yang dapat dipengaruhi oleh perubahan pH larutan. Penambahan bioflokulan dilakukan pada rentang pH 4–10, dimana setelah dilakukan uji flokulasi bioflokulannya efektif pada pH 6. Hal ini dapat diketahui dari presentase aktivitas flokulasi dari kultur bioflokulan isolat LA-2 dan LA-7 yaitu sebesar 55.05% untuk LA-2 dan 47.22% untuk LA-7.
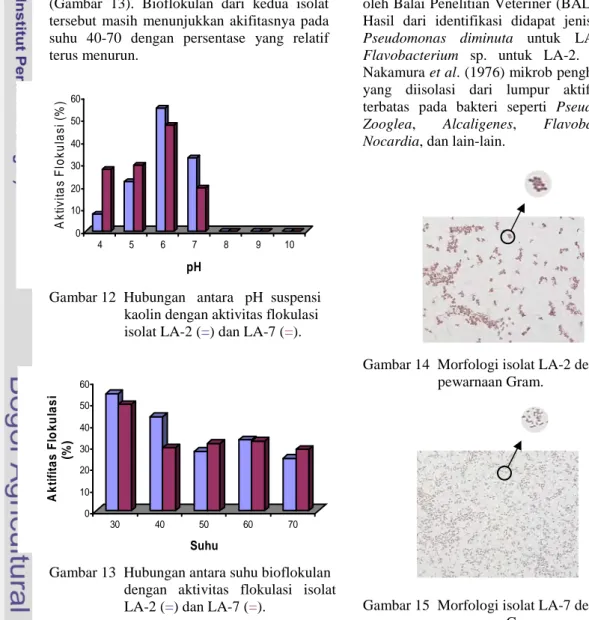
Karakterisasi bioflokulan terhadap suhu dilakukan setelah diperoleh kondisi optimum untuk bioflokulan terhadap kation dan pH. Suhu merupakan salah satu faktor yang berpengaruh terhadap proses
koagulasi-0 5 10 15 20 25 30 35 40 45 50 A kt iv ita s Fl ok ul as i (% )
ZnSO4 MgSO4 CaCl2 FeCl3 AlCL3
0 10 20 30 40 50 60 A k ti fi ta s F lo k u la s i (% ) 30 40 50 60 70 Suhu
flokulasi. Pada suhu air dingin (jauh dibawah temperatur standar, 25 oC) dapat menambah kesulitan pada proses koagulasi (http://www.geocities.com). Pada temperatur tersebut kebanyakan reaksi kimia berjalan lebih lambat, sehingga penambahan koagulan pada air menghasilkan proses koagulasi yang kurang efisien oleh karena itu konsesntrasi koagulan yang besar diperlukan untuk mengganti kerugian pengaruh tersebut. Optimasi bioflokulan terhadap suhu dilakukan mulai suhu 30 oC – 70 oC. Karakterisasi bioflokulan LA-2 dan LA-7 dilakukan menggunakan koagulan efektif yaitu AlCl3
dan pH yang optimum. Hasil dari penelitian terhadap suhu pada kondisi optimum dengan penambahan bioflokulan, diperoleh hasil yang paling tinggi dengan presentase aktivitas flokulasi terbesar yaitu pada suhu 30 oC. Presentase dari kedua isolat tersebut diperoleh 54.24% untuk LA-2 dan 49.36% untuk LA-7 (Gambar 13). Bioflokulan dari kedua isolat tersebut masih menunjukkan akifitasnya pada suhu 40-70 dengan persentase yang relatif terus menurun.
Gambar 12 Hubungan antara pH suspensi kaolin dengan aktivitas flokulasi isolat LA-2 (=) dan LA-7 (=).
Gambar 13 Hubungan antara suhu bioflokulan dengan aktivitas flokulasi isolat LA-2 (=) dan LA-7 (=).
Identifikasi Bakteri
Identifikasi bakteri dilakukan terhadap isolat yang mempunyai aktivitas flokulasi tinggi yaitu isolat LA-2 dan LA-7. Tujuan dari identifikasi bakteri ini adalah untuk mengetahui jenis dan spesies bakteri tersebut dan patogenitasnya terhadap manusia. Sehingga jika digunakan dalam berbagai industri bersifat aman. Pewarnaan Gram dilakukan untuk mengetahui morfologi bakteri tersebut. Pewarnaan Gram dilakukan di Laboratorium Taksonomi, Lembaga Ilmu Pengetahuan Indonesia (LIPI).
Hasil yang diperoleh melalui pewarnaan Gram diamati di bawah mikroskop pada perbesaran 10 x 100. Setelah dilakukan pewarnaan Gram diperoleh Gram negatif untuk kedua isolat dengan bentuk kokus untuk LA-2 dan basil untuk LA-7 (Gambar 14 dan Gambar 15). Identifikasi bakteri dilakukan oleh Balai Penelitian Veteriner (BALITVET). Hasil dari identifikasi didapat jenis bakteri Pseudomonas diminuta untuk LA-7 dan Flavobacterium sp. untuk LA-2. Menurut Nakamura et al. (1976) mikrob penghasil flok yang diisolasi dari lumpur aktif sangat terbatas pada bakteri seperti Pseudomonas, Zooglea, Alcaligenes, Flavobacterium, Nocardia, dan lain-lain.
Gambar 14 Morfologi isolat LA-2 dengan pewarnaan Gram.
Gambar 15 Morfologi isolat LA-7 dengan pewarnaan Gram. 0 10 20 30 40 50 60 A k ti v it a s F lo k u la s i (% ) 4 5 6 7 8 9 10 pH