A. PERKEMBANGAN TABEL PERIODIK UNSUR
B. STRUKTUR ATOM
C. SIFAT-SIFAT UNSUR
D. PERKEMBANGAN MODEL ATOM
S T R U K T U R A T O M D A N S I S T E M P
E-R I O D I K
1
Materi di alam jenisnya sangat banyak, untuk mempermudah mem-pelajarinya perlu dikelompok-kelompokkan menjadi zat tunggal (unsur dan senyawa) dan campuran (homogen dan heterogen). Unsur, senyawa maupun campuran tersusun oleh partikel dasar yang sama disebut atom. Atom adalah bagian terkecil dari unsur yang masih memiliki sifat sama seperti unsur terse-but. Para ahli kimia berusaha mencari cara untuk mempelajari unsur yang jenisnya kian bertambah. Unsur-unsur disusun berdasarkan nomor atom, masa atom relatif, dan sifat-sifat periodik unsur.
Hubungan antara konsep yang satu dengan konsep yang lain dapat Anda perhatikan pada peta konsep berikut ini.
Peta Konsep Unsur Periodik Unsur
periode golongan sistem oktaf sistem triade sistem mendeleyev modern massa atom atom netron proton inti atom elektron nomor atom berkembang menjadi SIFAT -SIFAT PERIODIK 1. Jari jari atom 2. Energi ionisasi 3.Afinitas elektron 4. Keeletronegatifan
SISTEM PERIODIK UNSUR
Salah satu kegiatan ilmiah adalah mencari keteraturan. Fakta sebagai hasil pengamatan harus disusun dan diklasifikasikan sehingga mudah melihat keteraturan, memahami, dan menjelaskannya. Pada awalnya para ahli mengelompokkan unsur-unsur ke dalam dua golongan, yaitu berdasarkan sifat logam dan non-logam. Logam mempunyai sifat mengkilap, penghantar panas yang baik, dan mudah ditempa. Unsur non-logam tidak mengkilap, rapuh, dan bukan penghantar panas yang baik (kecuali karbon).
A. PERKEMBANGAN TABEL PERIODIK UNSUR
1. Triade Dobereiner
Pada tahun 1829, Johann W. Dobereiner adalah orang pertama yang menemukan adanya hubungan antara sifat unsur dengan massa atom. Johann W. Dobereiner mengelompokkan tiga unsur yang mempunyai kemiripan sifat ke dalam satu kelompok yang disebut Triade.
Massa unsur yang ada di tengah (unsur nomor 2) sama dengan massa rata-rata unsur nomor 1 dan nomor 3.
Tabel 1.1
2. Hukum Oktaf dari Newland
Pada tahun 1865, John Newland mengelompokkan unsur berdasarkan kenaikan massa atom relatifnya. Menurut susunan unsurnya, ia menga-mati adanya pengulangan sifat-sifat unsur tersebut. Unsur ke-8 ternyata sifatnya mirip dengan unsur 1, sifat unsur 9 mirip dengan unsur ke-2, dan seterusnya. Sama halnya dengan oktaf dalam nada musik. Dengan
Kelompok Massa Atom Massa Rata-rata dari Unsur
demikian tersusunlah kelompok-kelompok unsur yang teratur kemudian disebut hukum oktaf. Jika unsur-unsur disusun menurut kenaikan massa atom unsur tersebut akan terjadi pengulangan sifat setelah unsur ke-8. (sama halnya dengan oktaf dalam nada musik)
Tabel 1.2 Hukum Oktaf dari Newland
Latihan
1
1. Apakah dasar pengelompokan unsur-unsur menurut Dobereiner?
2. Berdasarkan tabel oktaf dari Newland, sebutkan 3 contoh pasangan unsur-unsur yang mempunyai kemiripan sifat!
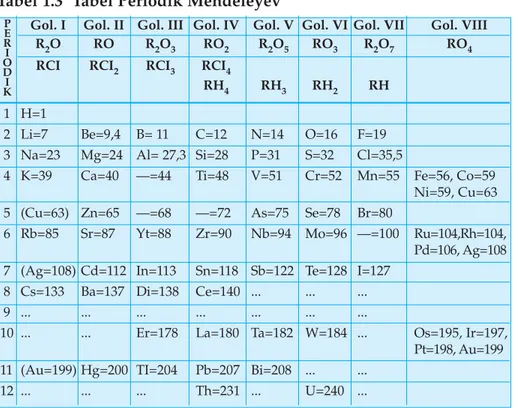
3. Sistem Periodik Mendeleyev
Secara terpisah, Dimitri Mendeleyev (Rusia) dan Lothar Meyer (Jerman) tahun 1869 menyusun sistem berkala berdasarkan pada kenaikan massa atom. Jika unsur disusun berdasarkan kenaikan massa atomnya maka sifat-sifat unsur akan berulang secara periodik.
Do Re Mi Fa Sol La Si 1 2 3 4 5 6 7 H Li Be B C N O F Na Mg Al Si P S Cl K Ca Cr Ti Mn Fe Co, Ni Cu Zn Y In As Se
Br Rb Sr Ce, La Zr Di, Mo Ro, Ru
Pd Ag Cd U Sn Sb I
Te Cs Ba Ta W Nb Au
Tabel 1.3 Tabel Periodik Mendeleyev
Dalam tabel berkala tersebut unsur-unsur ditata dalam 12 baris horizontal dan delapan kolom vertikal. Unsur-unsur yang termasuk dalam satu golongan mempunyai sifat fisika dan kimia mirip. Sifat-sifat tersebut akan berubah secara berangsur dari atas ke bawah, kolom itu disebut golongan. Adapun pengulangan sifat akan menghasilkan baris yang disebut periode.
Kelebihan sistem periodik Mendeleyev
1. Sengaja memberikan tempat kosong untuk unsur-unsur yang belum ditemukan.
2. Dapat meramalkan sifat-sifat unsur yang belum ditemukan.
Tempat kosong dengan massa atom 72 adalah unsur yang golongannya sama dengan silikon yang dinamakan eka-silikon.
Latihan
2
1. Apakah dasar pengelompokan unsur-unsur dalam sistem periodik Mendeleyev di atas?
2. Salah satu kelemahan sistem periodik Mendeleyev adalah tidak dipenuhinya hukum periodik oleh beberapa unsur. Unsur-unsur manakah itu?
Gol. I Gol. II Gol. III Gol. IV Gol. V Gol. VI Gol. VII Gol. VIII R2O RO R2O3 RO2 R2O5 RO3 R2O7 RO4 RCI RCI2 RCI3 RCI4
RH4 RH3 RH2 RH
1 H=1
2 Li=7 Be=9,4 B= 11 C=12 N=14 O=16 F=19 3 Na=23 Mg=24 Al= 27,3 Si=28 P=31 S=32 Cl=35,5
4 K=39 Ca=40 ––=44 Ti=48 V=51 Cr=52 Mn=55 Fe=56, Co=59 Ni=59, Cu=63 5 (Cu=63) Zn=65 ––=68 ––=72 As=75 Se=78 Br=80
6 Rb=85 Sr=87 Yt=88 Zr=90 Nb=94 Mo=96 ––=100 Ru=104,Rh=104, Pd=106, Ag=108 7 (Ag=108) Cd=112 In=113 Sn=118 Sb=122 Te=128 I=127
8 Cs=133 Ba=137 Di=138 Ce=140 ... ... ... 9 ... ... ... ... ... ... ...
10 ... ... Er=178 La=180 Ta=182 W=184 ... Os=195, Ir=197, Pt=198, Au=199 11 (Au=199) Hg=200 TI=204 Pb=207 Bi=208 ... ...
4. Sistem Periodik Modern
Sistem periodik Mendeleyev sudah baik, namun masih banyak kelemahannya. Pada tahun 1915, Henry Moseley menyimpulkan bahwa ada perubahan yang teratur sesuai dengan perubahan nomor atomnya dan bukan massa atom relatif. Dengan demikian Tabel Periodik Unsur Mendeleyev mengalami perbaikan menjadi Tabel Periodik Unsur Modern yang berbunyi “sifat-sifat unsur merupakan fungsi periodik dari nomor atomnya”.
Gambar 1.1 Tabel Periodik Modern
Latihan
3
1. Apakah yang mendasari pengelompokan unsur oleh Newland? 2. Apakah yang mendasari para ahli mengelompokkan unsur-unsur?
3. Apakah yang membedakan tabel periodik unsur Mendeleyev dengan tabel periodik unsur modern?
1 H 1.008 98 Cf (249) 99 Es (254) 66 Dy 162.5 67 Ho 164.9 96 Cm (247) 97 Bk (247) 4 Be 9.012 3 Li 6.941 50 Sn 118.7 82 Pb 207.2 83 Bi 209.0 22 T 47.88 40 Zr 91.22 44 Ru 101.1 108 Ils (265) 26 Fe 55.85 76 Oa 190.2 Nomor atom 12 Mg 2 4.31 19 K 39.10 20 Ca 40.08 21 Sc 44.96 23 V 50.94 27 Co 58.93 28 Ni 58.69 29 Cu 63.55 30 Zn 65.39 37 Rb 85.47 38 Sr 87.62 39 Y 88.91 41 Nb 92.91 45 Rh 102.9 46 Pd 106.4 47 Ag 107.9 48 Cd 112.4 55 Cs 132.9 56 Ba 137.3 57 La 138.9 72 Hr 178.5 73 Ta 180.9 77 Ir 192.2 78 Pt 195.1 79 Au 197.0 87 Fr (223) 88 Ra (226) 89 **Ac (227) 104 Rf (257) 105 Db (262) 109 Mt (266) 58 Ce 140.1 59 Pr 140.9 60 Nd 144.2 61 Pm (147) 64 Gd 157.3 65 Tb 158.9 68 Er 167.3 69 Tm 168.9 70 Yb 173.0 71 Lu 175.0 90 Th 232.0 91 Pa (231) 92 U 238.0 93 Np (237) 95 Am (243) 100 Fm (253) 101 Md (256) 102 No (254) 103 Lr (257) 14
IVA VA15 VIA16 VIIA17 13
IIIA
3
IIIB IVB4 VB5 VIB6 VIIB7 Logam 11 Na 22.99 62 Sm 150.4 94 Am (243) 63 Eu 152.0 24 Cr 52.00 42 Mo 95.94 74 W 183.9 106 Sg (263) 25 Mn 54.94 43 Tc (98) 75 Re 186.2 107 Bh (262) 31 Ga 69.72 49 In 114.8 81 Ti 204.4 113 Uut 80 Hg 200.6 112 Uub (227) 110 Ds (269) 111 Uuu (272) 114 Uuq (289) 1115 Uup Uuh116 (289) 117 Uus Uuo118 (293) 13 Al 26.98 8 9 10 11 IB IIB12 metaloid Non logam Simbol massa atom 3 Li 6.941 2 IIA 1 IA 1 2 3 4 5 6 7 Lantanida aktinida 18 VIIIA VIIIB logam - logam transisi
B. STRUKTUR ATOM
Materi di alam terdiri atas zat tunggal (unsur dan senyawa) dan campuran (homogen dan heterogen). Para ahli telah mengelompokkan unsur-unsur sebagaimana yang sudah kamu pelajari. Tersusun dari apakah unsur itu? Semua jenis materi (unsur, senyawa atau campuran) tersusun atas partikel dasar yang sama disebut atom. Struktur atom sangat penting kita pelajari untuk mengungkap semua sifat-sifat materi. Seperti apakah atom? Pernahkah Anda melihat atom? Bagaimanakah para ahli menggam-barkan tentang model atom?
Setelah mempelajari bab ini Anda akan mampu mengidentifikasi atom, struktur atom, sifat-sifat unsur, massa atom relatif dan sifat-sifat periodik unsur dari tabel periodik.
1. Partikel Penyusun Atom
Atom terdiri atas tiga partikel subatom yaitu elektron, proton, dan netron.
a. Elektron
Penelitian pertama yang menunjukkan adanya elektron dilakukan oleh J. Plucker pada tahun 1859 menggunakan tabung yang berisi gas bertekanan rendah dialiri listrik tegangan tinggi. Kedua ujung tabung dipasang 2 pelat logam sebagai elektroda yaitu katoda (yang dihubungkan kutub negatif) dan anoda (yang dihubungkan kutub positif), gas di dalam tabung ternyata berpendar. Dari percobaan itu Plucker dapat menyimpulkan sifat sinar katoda.
Sejak saat itu banyak percobaan yang dilakukan dengan tabung hampa. Tahun 1880 W. Crooks membuat tabung yang lebih baik dan dikenal sebagai tabung Crookes. Pada tahun 1897 J.J. Thomson melakukan percobaan sinar katoda. Percobaan tersebut dapat dijelaskan sebagai berikut.
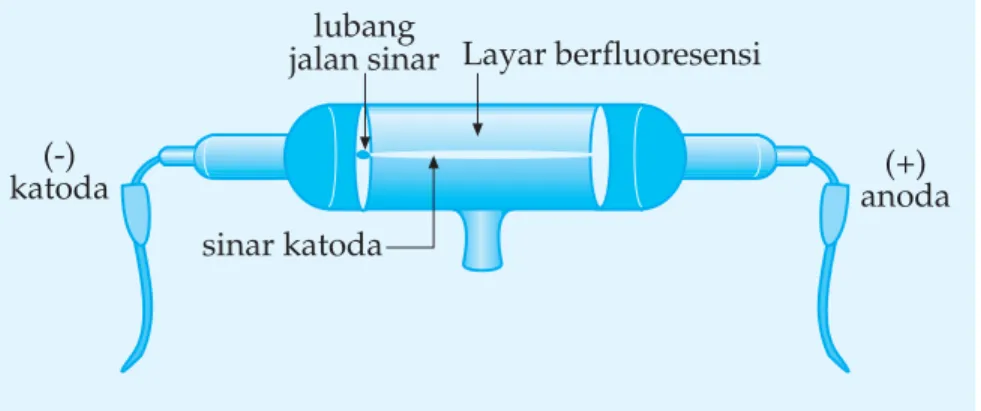
Gambar 1.2 Skema sinar katoda merambat lurus
lubang
jalan sinar Layar berfluoresensi
(+) anoda (-)
katoda
(a) (b) Gambar 1.3 Pembelokan sinar katoda oleh kutub negatif Keterangan:
(a) sinar yang dihasilkan dari tabung sinar katoda (b) pengaruh medan magnet terhadap sinar katoda
Pada kedua ujung tabung terdapat dua pelat logam berfungsi sebagai elektroda yang dihubungkan dengan sumber tegangan tinggi. Pompa isap berfungsi mengatur tekanan gas dalam tabung. Pada tegangan yang sangat tinggi dan tekanan rendah bagian tabung di depan katoda akan berpendar. Hal ini disebabkan karena terjadi radiasi dari katoda menuju anoda. Sinar yang keluar dari katoda itu disebut sinar katoda dan tabung volum itu dinamakan tabung sinar katoda.
Akhirnya dapat disimpulkan sifat-sifat sinar katoda, yaitu sebagai berikut.
a. Sinar katoda merambat lurus dari katoda menuju anoda. b. Sinar katoda dapat memutar kincir pada jalan sinarnya.
c. Sinar katoda dibelokkan oleh muatan listrik ke arah kutub positif. Partikel sinar katoda ini oleh Thomson dinamakan elektron. Muatan dari elektron ditentukan oleh R. Millikan melalui percobaan tetesan minyak. Muatan setiap tetes minyak selalu merupakan kelipatan dari
1,6 x 10-19coulomb maka dapat disimpulkan bahwa elektron mempunyai
muatan sebesar 1,6 x 10-19 coulomb. Dalam perbandingan muatan
terhadap massa elektron dari Thomson (1,76 x 108 c/g), akhirnya
Millikan dapat menghitung massa elektron = 9,109 x 10-31kg.
b. Proton
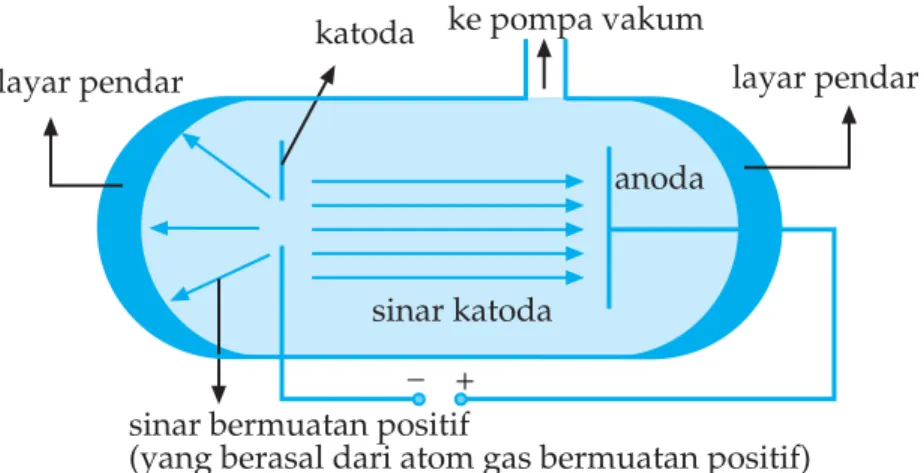
Gambar 1.4 Sinar positif
Menurut penemuan proton oleh Goldstein, bagaimanakah kedudukan proton dalam menyusun atom? Pada tahun 1919 Ernest
Rutherford melakukan percobaan hamburan sinar alfa. Rutherford
mengarahkan berkas sinar alfa yang bermuatan positif pada lempeng logam tipis misalnya emas atau platina. Ternyata sebagian besar partikel alfa dapat menembus lempeng logam tanpa penyimpangan arah. Hanya sebagian kecil dibelokkan dan sebagian kecil dipantulkan (Gambar 1.4). Rutherford menyimpulkan bahwa atom berongga, dalam atom terdapat inti yang bermuatan positif dan berukuran sangat kecil dibandingkan atom, namun hampir seluruh massa atom terpusat pada inti atom.
Massa 1 proton = 1,67 x 10-27kg.
Gambar 1.5 Percobaan hamburan sinarα
layar berlapis seng sulfida yang dapat bergerak memutar
Uranium (sumber partikel alfa) disimpan dalam kotak yang terbuat dari timbal
sinar dipantulkan
lempeng emas tipis
sinar dibelokkan sinar lurus
katoda ke pompa vakum
layar pendar
sinar katoda sinar bermuatan positif
(yang berasal dari atom gas bermuatan positif) layar pendar
_ +
c. Netron
Netron ditemukan oleh J. Chadwick tahun 1932 berdasarkan eksperimen penembakan atom berilium dengan partikel alfa. Setiap penembakan mengeluarkan radiasi yang terdiri atas partikel netral, berdaya tembus tinggi, dan mempunyai massa yang hampir sama dengan proton. Partikel itu disebut netron. Netron termasuk partikel dasar karena semua atom mengandung netron kecuali isotop Hidrogen -1.
Tabel 1.3 Massa dan muatan partikel penyusun atom
*amu = atomic massa unit **sme = satuan muatan elektron
Latihan
4
1. Sebutkan partikel-partikel dasar pembentuk atom! Sebutkan pula massa relatif dan muatan relatif partikel tersebut!
2. Jelaskan percobaan yang memberikan bukti adanya elektron dalam atom! 3. Sebutkan sifat-sifat sinar katoda!
4. Jelaskan mengapa, Rutherford dapat menyimpulkan bahwa di dalam atom terdapat inti yang ukurannya sangat kecil dibandingkan atom!
5. Mengapa setiap atom pasti mengandung netron, kecuali Hidrogen-1? Jelaskan!
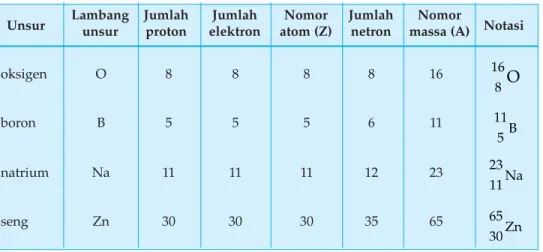
2. Nomor Atom dan Nomor Massa
Jumlah proton dalam inti atom suatu unsur sama dengan nomor atom-nya. Nomor atom suatu unsur bersifat khas, sehingga berbeda dengan nomor atom unsur lain.
Contoh:
- Unsur Hidrogen mempunyai jumlah proton satu maka nomor atom Hidrogen sama dengan satu.
- Unsur Helium mempunyai jumlah proton dua maka nomor atom Helium sama dengan dua.
Partikel dan Massa Muatan
lambang eksak relatif (amu*) eksak (coulomb) relatif (sme**)
elektron (e) 9,109390 x 10-28 0 -1,602177 x 10-19 -1
proton (p) 1,672623 x 10-24 1 +1,602177 x 10-19 +1
Atom bersifat netral maka dalam atom jumlah proton harus sama dengan jumlah elektron. Jadi nomor atom juga menunjukkan jumlah elektron dalam atom.
Nomor atom = jumlah proton = jumlah elektron
Di dalam inti atom terdapat proton dan netron yang mempunyai massa jauh lebih besar dibandingkan dengan massa elektron. Massa dari suatu atom dianggap sama dengan jumlah proton dan netron yang diberi simbol A. Dalam menunjukkan nomor atom dan nomor massa suatu atom dapat ditulis dengan simbol sebagai berikut.
A = nomor massa menyatakan jumlah proton dan netron X = lambang unsur
Z = nomor atom menyatakan jumlah proton atau elektron Contoh:
Tabel 1.4 Nomor atom, nomor massa, jumlah elektron, jumlah proton, dan jumlah netron beberapa unsur
Latihan
5
Lengkapi titik-titik dalam tabel berikut!
A
Z
X
No. Unsur Lambang Jumlahunsur proton elektron atom (Z) netron massa (A)Jumlah Nomor Jumlah Nomor Notasi
1. kalium K 19 .... .... .... 39 .... 2. galium Ga .... 31 .... 39 .... .... 3. bromin Br .... .... 35 .... .... 4. ksenon Xe .... .... .... .... .... 131 54Xe 80 35Br
Unsur Lambang Jumlahunsur proton elektronJumlah atom (Z)Nomor Jumlahnetron massa (A)Nomor Notasi
3. Konfigurasi elektron dan Elektron Valensi
Gambar 1.6 Kulit dan subkulit sebuah atom
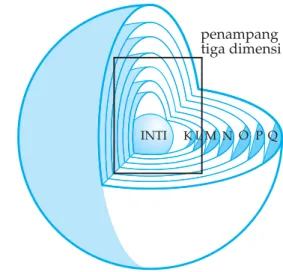
Dalam atom terdapat berbagai macam kulit, makin jauh dari inti makin tinggi tingkat energi kulit tersebut. Kulit yang paling dekat dengan inti dinamakan kulit K (n = 1), kulit L (n = 2), kulit M (n = 3), kulit N (n = 4) dan seterusnya.
Kulit elektron baru dikenal sampai kulit Q. (n = 7) Jumlah elektron paling banyak yang diketemukan pada kulit pertama K adalah 2, kulit kedua (L) 8, kulit ketiga (M) 18, berapa pada kulit keempat (N)? Cobalah rumuskan jumlah elektron maksimum setiap kulit elektron! Sifat-sifat unsur ditentukan oleh susunan elektron dalam atom. Susunan elektron yang terdapat pada kulit-kulit atom disebut konfigurasi elektron. Kulit-kulit elektron dalam atom terisi sesuai dengan nomor atomnya. Nomor atom menunjukkan jumlah elektron yang dimiliki oleh atom unsur itu.
Kulit-kulit itu terisi dengan urutan sebagai berikut. 1. Kulit K terisi lebih dulu, maksimum 2 elektron.
2. Jika kulit K sudah penuh, dilanjutkan kulit L, maksimum 8 elektron. 3. Setelah kulit L penuh dilanjutkan kulit M.
Kulit M penuh dengan 8 elektron atau 18 elektron. a. 8 elekton, jika elektron yang tersisa kurang dari 18. b. 18 elektron, jika elektron yang tersisa lebih dari 18.
4. Elektron menempati kulit N, jika kulit M sudah penuh. Kulit N penuh dengan 8, 18, atau 32.
a. 8 elektron jika yang tersisa kurang dari 18,
b. 18 elektron, jika elektron yang tersisa lebih dari 18 kurang dari 32, dan c. 32 eletron, jika ada elekron yang tersisa lebih dari 32 elektron.
penampang tiga dimensi
Contoh:
1. Tuliskanlah konfigurasi elektron unsur dengan nomor atom sebagai berikut: 19K, 37Rb, 56Ba
Jawab:
Unsur 19K
- Kulit K terisi 2 elektron → sisa 17 elektron - Kulit L terisi 8 elektron → sisa 9 elektron - Kulit M terisi 8 elektron → sisa 1 elektron - Kulit N terisi 1 elektron → sisa 0 elektron
Jadi, konfigurasi elektronnya ditulis sebagai berikut: 19K = 2 . 8 . 8 . 1
Unsur 37Rb
- Kulit K terisi 2 elektron → masih sisa 35 elektron - Kulit L terisi 8 elektron → masih sisa 27 elektron - Kulit M terisi 18 elektron → masih sisa 9 elektron - Kulit N terisi 8 elektron → masih sisa 1 elektron - Kulit O terisi 1 elektron → masih sisa 0 elektron Jadi, konfigurasinya ditulis
37Rb = 2 . 8 . 18 . 8 . 1
Sifat kimia unsur ditentukan oleh elektron yang terletak pada kulit terluar. Elektron yang terletak pada kulit terluar disebut elektron valensi. Contoh:
Atom C (Z = 6) dengan konfigurasi elektron 6C = 2 4 maka elektron
valensinya = 4
Atom Na (Z = 11) dengan konfigurasi elektron 11Na = 2 8 1 maka elektron
valensinya = 1
Latihan
6
1. Tuliskalah konfigurasi elektron atom-atom berikut!
a. 10Ne c. 14Si e. 35Br
b. 12Mg d. 17Cl f. 37Rb
4. Massa Atom Relatif (Ar)
Atom suatu unsur sangat kecil dan sangat ringan sehingga atom tidak dapat ditimbang. Satuan kilogram (kg), gram (g), maupun miligram (mg) masih terlalu besar untuk menyatakan satu atom suatu unsur. Massa satu
atom hidrogen adalah 1,66 x 10-24 g, dan massa satu atom karbon adalah
1,99 x 10-23g. Oleh karena itu, digunakan massa atom relatif.
Massa atom relatif sangat penting dan menjadi prinsip yang paling mendasar dalam hitungan kimia. Pengertian massa atom relatif (Ar) di dalam ilmu kimia tidak dimaksudkan sebagai massa sesungguhnya dari sebuah atom sebab atom dan molekul mempunyai massa yang sangat kecil.
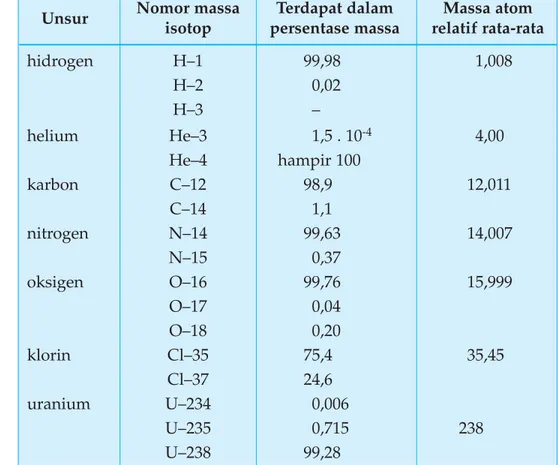
Pada mulanya, massa atom relatif dihitung dengan cara mengukur jumlah unsur yang saling bersenyawa. Sebagai standar pertama, massa atom relatif digunakan hidrogen. Kemudian, standar hidrogen diganti dengan oksigen karena massa atom relatif oksigen adalah enam belas satuan pada skala hidrogen. Penggunaan skala hidrogen tidak menyebabkan kesulitan. Setelah penemuan spektrometer massa dibuktikan bahwa standar oksigen sudah tidak tepat karena oksigen di alam terdiri atas
campuran isotop 16
8O, 178O, 188O, dengan kelimpahan relatif berturut-turut 99, 76%, 0,04%, dan 0,2%
Para ahli kimia dan ahli fisika mempunyai perbedaan dalam menetapkan massa atom relatif. Oleh karena itu, pada tahun 1962 IUPAP (Inernational Union of Pure and Applied Physic) dan IUPAC (International Union of Pure and Applied Chemistry) sepakat untuk menggunakan pembanding isotop karbon -12. Ditetapkan pula massa atom karbon -12 adalah tepat 12, sedangkan 1/12 massa atom karbon -12 merupakan satuan untuk menyatakan massa atom dan disebut satuan massa atom (sma).
Isotop suatu unsur adalah jenis atom dari unsur yang sejenis dengan sifat-sifat kimia yang sama, tetapi massa atomnya berbeda. Berdasarkan pengamatan spektrometer, unsur-unsur yang terdapat di alam merupakan campuran dari isotop-isotopnya. Misalnya, atom C yang mempunyai massa 12 dan 13, keduanya mempunyai sifat kimia unsur karbon yang sama, tetapi massa atomnya berbeda.
Masa atom relatif suatu unsur adalah bilangan yang menyatakan perbandingan massa satu atom suatu unsur dengan 1/12 massa satu atom
12C yang diberi simbol Ar.
Ar
C , unsur X = massa 1 atom unsur X1
12 x massa 1 atom
Contoh:
Atom Cl mempunyai massa 35 dan 37, perbandingan jumlah
isotop 35Cl masing-masing 75% dan 25%. Jika kita mengikuti skala
isotop 12C yang mempunyai massa 12 sma, maka massa rata-rata atom
Cl = . Jadi, massa atom relatif rata-rata
Cl = 35,5.
Massa atom relatif (Ar) suatu unsur merupakan harga rata-rata dari massa atom relatif isotop-isotop unsur itu.
Besarnya Ar masing-masing atom suatu unsur dapat dilihat pada tabel sistem periodik.
5. Isotop, Isobar, dan Isoton
a. Isotop
Atom-atom suatu unsur dapat mempunyai nomor massa yang berbeda. Atom-atom yang mempunyai nomor atom sama tetapi nomor massa berbeda disebut isotop.
Contoh:
1. Helium di alam terdiri atas 2 isotop, yaitu
2. Oksigen di alam terdiri atas 3 isotop yaitu
16 8 17 8 18 8 O, O dan O Z = 2 A = 4 p = 2 e = 2 n = 2 4 2He Z = 2 A = 3 p = 2 e = 2 n = 1 3 2He 3 2 4 2 He dan He ⎛ ⎝10075 ⎞⎠ +⎛⎝ ⎞⎠ = 25 100 35 5 x 35 x 37 , Massa C 1 atom H = 1 sma
Tabel 1.5 Beberapa Isotop di Alam
b. Isobar
Menurut tabel 1.5 antara atom dengan keduanya
mempunyai nomor massa yang sama walaupun atom-atom unsurnya berbeda. Kedua atom tersebut dinamakan isobar, jadi isobar adalah atom-atom dari unsur yang berbeda tetapi mempunyai nomor massa yang sama.
c. Isoton
Atom-atom unsur yang berbeda tetapi mempunyai jumlah netron yang sama disebut isoton.
14 6C 14
7 N
Unsur Nomor massaisotop persentase massaTerdapat dalam relatif rata-rataMassa atom
Contoh:
Latihan
7
Tunjukkanlah unsur-unsur di bawah ini yang merupakan isotop, isobar, dan isoton!
6. Hubungan Konfigurasi Elektron dengan Letak Unsur dalam
Tabel Periodik
a. Golongan dalam sistem periodik modern
Unsur-unsur yang terletak pada lajur vertikal dan mempunyai sifat-sifat mirip disebut unsur-unsur segolongan. Berdasarkan IUPAC (International Union of Pure and Applied Chemistry) sistem periodik modern terdiri atas 18 golongan unsur yang diberi angka 1 sampai 18.
Menurut cara tradisional dikelompokkan menjadi golongan A (utama) dan golongan B (unsur transisi).
1) Golongan A (utama) yaitu:
golongan I A = golongan logam alkali
golongan II A = golongan logam alkali tanah
golongan III A = golongan logam aluminium golongan IV A = golongan karbon
golongan V A = golongan nitrogen
golongan VI A = golongan khalkogen/oksigen golongan VII A = golongan halogen
golongan VIII A = golongan gas mulia
Persamaan sifat dalam satu golongan disebabkan karena mempu-nyai elektron valensi yang sama.
Contoh:
Gol. IA Gol. IIA Gol. IIIA
3Li 2 1 4Be 2 2 5B 2 3
11Na 2 8 1 12Mg 2 8 2 13Al 2 8 3
19K 2 8 8 1 20Ca 2 2 8 2 31Ga 2 8 18 3
Menurut contoh di atas jelas bahwa nomor golongan ditunjukkan oleh jumlah elektron valensi.
2) Golongan B (transisi)
- Unsur golongan B meliputi golongan IB, IIB, IIIB, IVB, VB, VIB, VIIB, VIIIB.
- Unsur-unsur lain disebut dengan unsur-unsur transisi dalam, yaitu deret lantanida dan deret aktinida (terletak dua baris paling bawah).
b. Perioda dalam sistem periodik modern
Unsur-unsur yang terletak pada lajur mendatar (horizontal) disebut perioda. Jumlah perioda dalam sistem periodik modern ada 7.
Perioda 1 disebut perioda sangat pendek terdiri atas 2 unsur. Perioda 2 disebut perioda pendek terdiri atas 8 unsur.
Perioda 3 disebut perioda pendek terdiri atas 8 unsur. Perioda 4 disebut perioda panjang terdiri atas 18 unsur. Perioda 5 disebut perioda panjang terdiri atas 18 unsur.
Perioda 6 disebut perioda sangat panjang terdiri atas 32 unsur.
Untuk menghemat tempat, unsur dengan nomor atom 58 sampai 71 ditempatkan terpisah pada bagian bawah sistem periodik. Kelompok unsur ini disebut unsur-unsur lantanida karena terdapat satu golongan dengan lantanium.
Perioda 7 disebut perioda belum lengkap karena diperkirakan masih akan bertambah. Pada unsur nomor atom 90 – 103 disebut unsur aktinida karena terletak satu golongan dengan atom aktinium, yang diletakkan di bawah lantanida.
Nomor perioda ditunjukkan oleh jumlah kulit yang terisi elektron. Jadi, unsur-unsur yang mempunyai jumlah kulit sama terletak pada perioda yang sama.
Contoh:
* 3Li 2 1 4Be 2 2 5B 2 3
* 11Na 2 8 1 12Mg 2 8 2 13Al 2 8 3 Terletak pada perioda 3
Contoh soal:
Tentukanlah perioda dan golongan dari unsur:
a. 17Cl b. 38Sr
Jawab:
a. 17Cl 2 8 7 golongan VII A, perioda 3
b. 38Sr 2 8 18 8 2 golongan II A, perioda 5
Latihan
8
1. Tanpa melihat sistem periodik unsur, tentukan letak unsur-unsur di bawah ini dalam sistem periodik!
a. 36P b. 51Q c. 55R d. 87S
2. Suatu unsur terletak pada periode 4 golongan VIIA. Tentukan berapakah nomor atom unsur tersebut?
3. Apakah unsur-unsur A, B, C, D yang masing-masing mempunyai nomor atom 12, 20, 38, 56 termasuk golongan alkali tanah? Jelaskan!
C. SIFAT-SIFAT UNSUR
1. Sifat Logam dan Nonlogam Pada Unsur
Berdasarkan sistem periodik sifat-sifat unsur dapat dikelompokkan menjadi unsur logam, semilogam (metaloid), dan nonlogam. Contoh, unsur-unsur periode 2 dari kiri ke kanan, sifat-sifat unsur berubah dari logam, menuju nonlogam. Unsur Li dan Be bersifat logam, unsur B bersifat semilogam dan unsur C, N, O, F, Ne bersifat nonlogam.
Sifat-sifat unsur logam adalah sebagai berikut.
a. Hampir semua logam pada suhu kamar (25oC) berwujud padat, keras, dan
kuat kecuali raksa (Hg) yang berwujud cair serta Na yang lunak.
b. Dapat ditempa (malleable) menjadi lempengan dan dapat diregangkan (ductile) menjadi kawat.
c. Merupakan penghantar (konduktor) listrik dan panas. d. Mengkilap jika digosok/terkena cahaya.
Sifat-sifat unsur nonlogam sebagai berikut.
b. Tidak dapat ditempa (bila ditempa mudah hancur dengan bentuk tak beraturan).
c. Tidak dapat menghantarkan panas dan listrik dengan baik (isolator). d. Tidak mengkilap jika digosok.
2. Sifat-sifat Unsur
Sifat-sifat periodik unsur berhubungan dengan konfigurasi elektron, sehingga berhubungan langsung dengan perioda dan golongan dalam sistem periodik. Beberapa sifat periodik unsur adalah jari-jari atom, affinitas elektron, keelektronegatifan, dan energi ionisasi.
a. Jari-jari atom
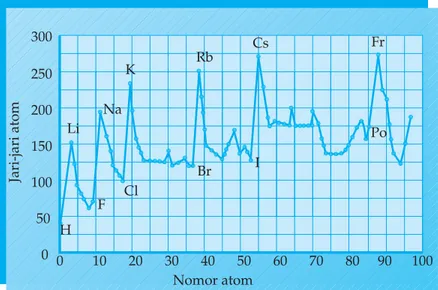
Jarak inti atom sampai elektron pada kulit terluar disebut jari-jari atom. Keteraturan jari-jari atom dalam sistem periodik dapat dilihat pada grafik berikut.
Gambar 1.7 Grafik jari-jari atom
Berdasarkan grafik di atas bagaimanakah keteraturan jari-jari atom dalam satu periode? Bagaimanakah keteraturannya dalam satu golongan?
Dalam satu perioda, jari-jari atom semakin pendek dari kiri ke kanan. Kiri ke kanan jumlah proton dalam inti semakin banyak sedangkan elektron yang jumlahnya bertambah masih dalam jumlah kulit sama, sehingga gaya tarik inti terhadap elektron semakin kuat yang berakibat jari-jari atom semakin berkurang. Dalam satu golongan dari atas ke bawah semakin panjang meskipun jumlah muatan inti bertambah, namun tidak seimbang dengan bertambahnya jumlah kulit sehingga gaya tarik-menarik inti terhadap elektron semakin lemah yang berarti makin ke bawah jari-jari atom makin panjang.
Tabel 1.6 Jari-jari Atom (nm)
b. Energi ionisasi
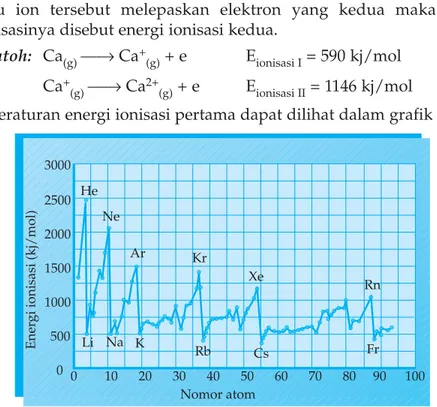
Energi ionisasi adalah energi minimum yang diperlukan atom atau ion dalam bentuk gas untuk melepaskan satu elektron yang terikat paling lemah, sehingga membentuk ion bermuatan positif. Jika atom atau ion tersebut melepaskan elektron yang kedua maka energi ionisasinya disebut energi ionisasi kedua.
Contoh: Ca(g)⎯→ Ca+
(g)+ e Eionisasi I= 590 kj/mol
Ca+
(g)⎯→ Ca2+(g)+ e Eionisasi II= 1146 kj/mol
Keteraturan energi ionisasi pertama dapat dilihat dalam grafik
Gambar 1.8 Energi ionisasi pertama dengan nomor atom
Berdasarkan grafik, unsur golongan berapakah yang mempunyai energi ionisasi pertama paling besar?
Besarnya muatan inti dan ukuran jari-jari atom sangat mempengaruhi besar kecilnya energi ionisasi. Semakin panjang jari-jari atom semakin kecil energi ionisasi, semakin besar muatan inti semakin besar energi ionisasinya.
Jadi, berdasarkan hal tersebut, dalam satu perioda energi ionisasi bertambah dari kiri ke kanan. Jumlah muatan inti bertambah dan jari-jari atom berkurang sehingga gaya tarik inti terhadap elektron ter-luar semakin kuat yang berarti energi ionisasinya semakin besar.
Dalam satu golongan, energi ionisasi berkurang dari atas ke bawah. Meskipun muatan inti bertambah tetapi jari-jari atom bertambah besar. Bertambahnya jari-jari atom tersebut menyebabkan gaya tarik inti terhadap elektron semakin kecil sehingga energi ionisasinya semakin kecil.
Tabel 1.7 Energi Ionisasi I (kj/mol)
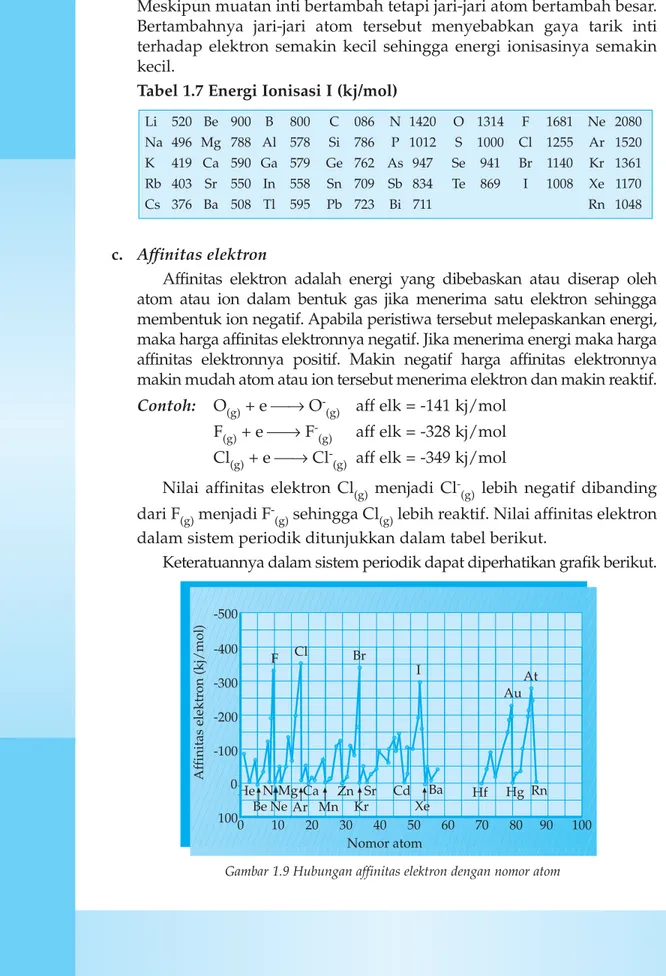
c. Affinitas elektron
Affinitas elektron adalah energi yang dibebaskan atau diserap oleh atom atau ion dalam bentuk gas jika menerima satu elektron sehingga membentuk ion negatif. Apabila peristiwa tersebut melepaskankan energi, maka harga affinitas elektronnya negatif. Jika menerima energi maka harga affinitas elektronnya positif. Makin negatif harga affinitas elektronnya makin mudah atom atau ion tersebut menerima elektron dan makin reaktif.
Contoh: O(g)+ e⎯→ O
-(g) aff elk = -141 kj/mol
F(g)+ e⎯→ F
-(g) aff elk = -328 kj/mol
Cl(g)+ e⎯→ Cl
-(g) aff elk = -349 kj/mol
Nilai affinitas elektron Cl(g) menjadi Cl
-(g) lebih negatif dibanding
dari F(g)menjadi F
-(g)sehingga Cl(g)lebih reaktif. Nilai affinitas elektron dalam sistem periodik ditunjukkan dalam tabel berikut.
Keteratuannya dalam sistem periodik dapat diperhatikan grafik berikut.
Gambar 1.9 Hubungan affinitas elektron dengan nomor atom
Berdasarkan grafik 1.9 jelaskan bagaimanakah keteraturan affinitas elektron unsur-unsur dalam satu golongan?
Tabel 1.8 Tabel Affinitas Elektron
IA IIA IIIA IVA VA VIA VIIA VIIIA
Tanda (-) berarti melepas energi Tanda (+) berarti menyerap energi
d. Keelektronegatifan
Keelektronegatifan merupakan ukuran kemampuan atom untuk menarik elektron dalam ikatan kimia. Harga keelektronegatifan bersifat relatif antara atom dengan atom lain.
Tabel 1.9 Harga keelektronegatifan menurut Skala Pauling
Tabel nilai keelektronegatifan di atas dapat disimpulkan sebagai berikut.
Dalam satu perioda, keelektronegatifan bertambah dari kiri ke kanan. Jari-jari atom berkurang sehingga gaya tarik inti terhadap elektron semakin kuat, akibatnya kecenderungan inti menarik elektron semakin besar.
Latihan
9
1. Dalam sistem periodik, unsur-unsur golongan manakah yang mempunyai jari-jari atom paling pendek? Jelaskan!
2. Mengapa energi ionisasi II mempunyai harga yang lebih besar daripada energi ionisasi I? Jelaskan!
3. Antara Cl dan Br, manakah yang mempunyai energi ionisasi lebih besar? Jelaskan!
4. Apakah yang dimaksud affinitas elektron? Jelaskan kecenderungan affinitas elektron dalam satu perioda!
5. Mengapa unsur-unsur golongan halogen dikatakan unsur yang paling elektronegatif? Jelaskan!
6. Diketahui unsur-unsur dengan nomor atom 11A, 13B, 14C, 17D, 35E a. Urutkan unsur-unsur tersebut menurut kenaikan jari-jari atom! b. Urutkan unsur-unsur tersebut menurut kenaikan energi ionisasi! c. Urutkan unsur-unsur tersebut menurut kenaikan keelektronegatifan!
D. PERKEMBANGAN MODEL ATOM
Perkembangan model atom berawal dari pendapat filsafat Yunani,
Leucippus dan muridnya Democritus mengatakan bahwa materi tersusun
atas partikel-partikel terkecil yang tidak dapat dibagi lagi disebut atom (a = tidak, tomos = dibagi). Pendapat tersebut merupakan pembuka untuk model atom selanjutnya. Marilah kita tinjau perkembangan pemikiran para ahli berdasarkan fakta-fakta dan secara eksperimen maupun kajian teoritis tentang atom.
1. Model Atom Dalton
John Dalton ahli kimia Inggris (1776 – 1844). Berdasarkan dua
percobaan, yaitu Hukum Kekekalan Massa dan Hukum Perbandingan Tetap, Dalton merumuskan model atom sebagai berikut.
a. Atom merupakan partikel terkecil dari materi.
b. Atom-atom unsur mempunyai sifat-sifat yang sama, sedangkan atom-atom unsur yang berbeda mempunyai sifat-sifat yang berbeda pula.
c. Senyawa terbentuk bila dua jenis atom yang berbeda bergabung dengan perbandingan tetap dan tertentu.
Pada dasarnya teori Dalton menunjukkan bahwa hukum-hukum dasar ilmu kimia hanya dapat dimengerti jika atom-atom suatu unsur semua sifatnya sama dan pada reaksi kimia hanya terjadi penggabungan dan pemisahan atom. Teori atom Dalton masih banyak mengandung beberapa kelemahan. Kelemahan teori atom Dalton di antaranya:
- tidak dapat menerangkan mengapa atom dapat bersenyawa dengan atom lain,
- tidak dapat menerangkan mengapa berbagai senyawa terdiri atas ion-ion,
- ditemukannya zat-zat radioaktif yang ternyata dapat dibagi-bagi.
b. Model Atom Thomson
Dari percobaan elektron berdasarkan percobaan tabung sinar katoda, J.J. Thomson mengemukakan teori sebagai berikut.
Atom merupakan bola pejal bermuatan positif dan di dalamnya terdapat elektron yang tersebar secara merata. Model atom Thomson dapat diumpamakan sebagai roti kismis dengan roti sebagai muatan positif dan kismisnya sebagai muatan negatif.
Gambar 1.10 Model atom Thomson
3. Model Atom Rutherford
Berdasarkan percobaan hamburan sinar α Rutherford (murid Thomson) menemukan bukti bahwa dalam atom terdapat inti atom yang bermuatan positif di mana massa atom berpusat. Oleh karena percobaan tersebut model atom Thomson akhirnya gugur. Model atom Rutherford adalah atom tersusun atas inti atom yang bermuatan positif dan dikelilingi oleh elektron yang bermuatan negatif, seperti halnya planet mengelilingi matahari. Massa atom berpusat pada inti, sedangkan elektron terdapat di kulit atom.
Gambar 1.11 Model Atom Rutherford
Model atom ini mempunyai kelemahan karena bertentangan dengan Hukum Fisika Klasik. Menurut hukum ini, suatu partikel yang bermuatan listrik (dalam hal ini elektron) apabila mengalami percepatan maka akan memancarkan energi, sehingga akan jatuh ke inti.
4. Model Atom Bohr
Model atom ini bertitik tolak dari model atom Rutherford dan teori Planck tentang spektrum. Model atom Bohr adalah sebagai berikut. 1) Dalam mengelilingi atom elektron berada pada lintasan tertentu
tanpa menyerap atau memancarkan energi.
2) Bila elektron berpindah dari tingkat energi rendah ke tingkat energi tinggi maka akan menyerap energi sedangkan bila berpindah dari tingkat energi tinggi ke rendah akan melepas energi.
e. Model Atom Mekanika Gelombang
Model atom Bohr mempunyai kelemahan yaitu tidak dapat menjelaskan spektra atom berelektron banyak. Model atom mekanika gelombang memberikan gambaran tentang keberadaan elektron dalam atom yang berbeda dengan model atom Bohr. Posisi elektron dalam mengelilingi inti tidak dapat ditentukan secara pasti tetapi hanya kebolehjadian. Suatu daerah dalam ruang yang di dalamnya terdapat kebolehjadian ditemukannya elektron disebut orbital.
Latihan
10
1. Jelaskan dan gambarkan perkembangan model atom dari model atom Dalton sampai model atom mekanika gelombang!
2. Jelaskan perbedaan dari model atom Dalton sampai model atom mekanika gelombang!
elektron
• Perkembangan sistem periodik
Triade Dobereiner. Tiga unsur yang
mempunyai kemiripan sifat dikelompok-kan menjadi satu kelompok. Massa unsur yang ditengah sama dengan massa rata-rata unsur yang mengapitnya.
Hukum Oktaf dari Newland. Jika
unsur-unsur disusun menurut kenaikan massa atomnya akan terjadi pengulangan sifat setelah unsur ke-8
Sistem periodik Mendeleyev. Unsur-unsur dikelompkkan berdasarkan kenaikan massa atomnya maka sifat-sifat unsur akan berulang secara periodik.
Sistem periodik modern. Disusun
berdasarkan kenaikan nomor atom dan kemiripan sifat unsur-unsur. Untuk baris mendatar disebut perioda sedangkan kolom menurun disebut golongan. Nomor periode menyatakan jumlah kulit. Nomor golongan menyatakan jumlah elektron valensi.
• Atom terdiri atas tiga partikel subatom yaitu elektron, proton, dan netron
Partikel Penemu Lambang
neutron Chadwick 1 0n proton Goldstein 1 1p elektron Thomson -10e • Tanda atom
A = nomor massa menyatakan jumlah proton dan netron X = lambang unsur
Z = nomor atom menyatakan jumlah proton atau elektron
Isotop adalah atom-atom suatu unsur yang mempunyai nomor atom sama tetapi nomor massa berbeda.
A Z
X
RANGKUMAN
Johan W. Dobereiner Johann Newland Dimitri Mendeleyev Henry Moseley Struktur atom Elektron J.J. Thomson R. Millikan Proton Goldstein Netron Nomor atom Nomor massa Konfigurasi elektron Elektron valensi Massa atom relatif IsotopIsobar Isoton
contoh: 12
6C dan 136C
Isobar adalah atom-atom yang mempunyai nomor massa sama.
contoh: 3
1H dan 32H
Isoton adalah atom-atom yang mempunyai jumlah netron sama.
contoh: 3
1H dan 42He
Konfigurasi elektron pengisian elektron dimulai dari kulit dengan tingkat energi terendah. Tiap-tiap kulit elektron hanya
dapat ditempati maksimum 2n2, n adalah
nomor kulit.
contoh: konfigurasi 20Ca 2 8 8 2 • Sifat-sifat periodik unsur
Jari-jari atom adalah jarak antara inti atom sampai elektron kulit terluar. Dalam satu perioda jari-jari atom berkurang dari kiri ke kanan dalam satu golongan bertambah dari atas ke bawah.
Energi ionisiasi adalah energi minimum yang diperlukan atom atau ion dalam bentuk gas untuk melepaskan satu elektron membentuk ion positif.
Dalam satu perioda energi ionisasi cenderung bertambah dari kiri ke kanan, dalam satu golongan berkurang dari atas ke bawah.
Affinitas elektron adalah perubahan energi yang terjadi pada atom atau ion dalam bentuk gas jika menerima satu elektron membentuk ion negatif.
Dalam satu perioda affinitas elektron cenderung bertambah dari kiri ke kanan, dalam satu golongan cenderung berkurang dari atas ke bawah.
Kelektronegatifan adalah ukuran kemampuan atom untuk menarik elektron dalam ikatan kimia
Bohr
Dalam satu perioda keelektronegatifan bertambah dari kiri ke kanan, dalam satu golongan berkurang dari atas ke bawah. • Perkembangan model atom
Model atom Dalton
• Atom merupakan partikel terkecil dari materi
• Atom-atom satu unsur mempunyai sifat-sifat yang sama, atom-atom unsur yang berbeda mempunyai sifat yang berbeda
• Senyawa terbentuk dari dua jenis atom atau lebih yang berbeda dengan perbandingan tetap dan tertentu. • Reaksi kimia merupakan penataan
ulang atom-atom yang bereaksi sehingga tidak ada atom yang musnah.
Model atom Thomson
Atom merupakan bola pejal bermuatan positif dan di dalamnya terdapat elektron yang tersebar merata.
Model atom Rutherford
Atom tersusun atas inti atom yang bermuatan positif dan dikelilingi oleh elektron yang bermuatan negatif.
Model atom Bohr
Elektron mengelilingi inti atom berada pada lintasan tertentu tanpa menyerap atau memancarkan energi.
Model atom mekanika gelombang
Posisi elektron dalam mengelilingi inti tidak dapat ditentukan secara pasti tetapi hanya kebolehjadian.
• Massa atom relatif (Ar) unsur menyata-kan perbandingan massa atom rata-rata suatu unsur terhadap 1⁄
12massa atom C-12.
Ar
C , unsur X=massa 1 atom unsur X1
• Hubungan konfigurasi elektron dan sistem periodik adalah sebagai berikut. a. Nilai n terbesar pada konfigurasi
elektron suatu unsur menyatakan nomor periode unsur tersebut.
b. Jumlah elektron valensi menentukan nomor golongan dan jenis subkulit yang ditempati elektron valensi menentukan jenis golongan.
ELATIHAN SOAL
P
P
I. Pilihlah huruf a, b, c, d, atau e pada jawaban yang tepat!
1. Partikel penyusun yang terdapat di dalam inti atom adalah .... a. elektron-elektron
b. elektron dan netron c. proton dan elektron d. proton dan netron e. proton-proton
2. Berdasarkan percobaan ham-buran sinar α, Rutherford dapat menyimpulkan bahwa .... a. di dalam atom terdapat
elektron
b. di dalam atom terdapat partikel yang bermuatan sama dengan sinar α
c. di dalam atom elektron tersebar merata
d. di dalam atom elektron dan inti atom tersebar merata e. netron di dalam atom
adalah netral
3. Nomor atom suatu unsur X adalah 53 dan bilangan massanya adalah 130. Unsur tersebut mempunyai jumlah elektron, proton, netron masing-masing .... a. 53, 53, 130 d 53, 130, 24
b. 53, 53, 77 e. 53, 77, 53
c. 53, 24, 53
4. Atom Kalsium dengan nomor atom 20, mempunyai konfi-gurasi elektron ....
a. 2 18 d. 2 8 8 2
b. 2 8 10 e. 2 8 9 1
c. 2 10 8
5. Elektron valensi dari unsur Argon dengan nomor atom 18 adalah ....
a. 2 d. 12
b. 8 e. 18
6. Suatu ion Na+ yang bernomor atom 11 maka mempunyai elektron sebanyak ....
a. 8 d. 11
b. 9 e. 12
c. 10
7. Bilangan massa suatu unsur X adalah 31 sedangkan jumlah proton pada inti atomnya adalah 15 maka konfigurasi elektron unsur tersebut adalah .... a. 2 8 5
b. 2 8 6 c. 1 8 18 3 d. 2 8 18 2 1 e. 2 8 8 8 3
8. Dari pasangan di bawah ini yang merupakan contoh isotop adalah .... a. b. c. d. e.
9. Atom merupakan suatu materi yang berbentuk bola bermuatan positif dan di dalamnya terdapat elektron yang tersebar merata. Pernyataan ini merupakan teori atom dari ....
a. John Dalton b. J.J. Thomson c. Rutherford d. Neils Bohr
e. Schrodinger dan Heisenberg
10. Suatu atom mempunyai 7 elektron valensi pada kulit M maka nomor atom unsur tersebut adalah .... a. 7 b. 9 c. 17 d. 25 e. 35
11. Dalam sistem periodik modern unsur-unsur disusun berdasar-kan ....
a. kenaikan massa atom b. kenaikan massa atom dan
kemiripan sifat
c. kenaikan nomor massa dan kemiripan sifat
d. kenaikan nomor atom dan kemiripan sifat
e. kenaikan jumlah proton dan kemiripan sifat
12. Unsur-unsur dalam satu golongan mempunyai .... a. jumlah elektron dan netron
yang sama
b. jumlah elektron yang sama c. jumlah kulit yang sama d. jumlah elektron valensi
yang sama
e. konfigurasi elektron yang sama
13. Unsur dengan nomor atom 17 dalam sistem periodik terletak pada ....
a. golongan IIIA perioda 3 b. golongan VIIA perioda 3 c. golongan IIIA perioda 7 d. golongan VA perioda 4 e. golongan IVA perioda 5
14. Di antara unsur-unsur di bawah ini yang sifatnya mirip adalah .... a. K dengan Ar b. Ar dengan Na c. Mg dengan Mn d. Mg dengan Ba e. Rb dengan Sr
15. Pernyataan yang benar tentang jari-jari atom adalah ....
a. dalam satu golongan dari atas ke bawah semakin kecil b. dalam satu perioda dari kiri
ke kanan semakin besar c. jari-jari atom golongan IA
lebih kecil daripada jari-jari atom golongan IIA
d. jari-jari atom Magnesium lebih kecil daripada jari-jari atom Stronsium
e. semakin banyak jumlah kulit dalam konfigurasi elektron semakin kecil jari-jari atomnya
16. Diketahui unsur-unsur 9A,11B,
12C dan 17D, urutan kenaikan
energi ionisasi dari yang terkecil adalah .... a. A, B, C, D b. A, C, D, B c. B, C, D, A d. B, C, A, D e. C, A, D, B
17. Energi ionisasi II lebih besar dibandingkan dengan energi ionisasi I karena ....
a. gaya tarik inti terhadap elektron semakin kuat b. gaya tarik inti terhadap
elektron semakin lemah
c. jarak inti terhadap elektron semakin besar
d. energi yang diperlukan berkurang
e. lebih mudah melepaskan elektron
18. Di antara kelompok unsur berikut ini yang harga keelektronegatifannya semakin kecil adalah .... a. Cs, Rb, K, Na b. Ba, Sr, Ca, Mg c. Sb, As, P, N d. Sn, Ge, Si, C e. F, Cl, Br, I
19. Unsur yang sifatnya sama dengan unsur 18X adalah ....
a. 11Na d. 37Rb
b. 13Al e. 54Xe
c. 17Cl
20. Di bawah ini adalah sifat-sifat golongan Alkali, kecuali .... a. mempunyai elektron valensi 1 b. sangat elektropositif
c. sangat reaktif d. tergolong logam
e. membentuk molekul diatomik 21. Jika diketahui massa 1 atm C-12 adalah a dan massa atom X adalah b maka massa atom relatif X sama dengan ....
II. Kerjakan soal-soal di bawah ini dengan benar!
1. Tentukan jumlah proton, netron, dan elektron dari atom-atom berikut!
a. b. c. d.
2. Tentukan jumlah proton dan elektron dari ion-ion berikut:
a. 19K+ b.
13Al3+ c. 9F- d. 17Cl
-3. Tuliskan konfigurasi elektron unsur-unsur berikut!
a. 16S b. 38Sr c. 35Br d. 55Cs
4. Tuliskan konfigurasi elektron dari ion-ion di bawah ini!
a. 11Na+ b.
4Be2+ c. 16S2- d. 9F
-5. Jelaskan perbedaan prinsip antara sistem periodik modern dengan sistem periodik sebelumnya!
6. Bagaimana jari-jari atom Natrium dibandingkan dengan jari-jari ion
Natrium (Na+)? Jelaskan!
131 54Xe 80 35Br 85 37Rb 24 12Mg
22. Unsur A mempunyai 53 proton, 53 elektron, dan 74 neutron maka unsur A dalam sistem periodik terletak pada .... a golongan IIA, periode 5 b. golongan VA, periode 2 c. golongan VA, periode 7 d. golongan VA, periode 5 e. golongan VIIA, periode 5 23. Skala massa atom relatif secara
internasional sekarang dikaitkan dengan ....
a. satu atom oksigen b. satu atom karbon c. 1/16 atom oksigen -16 d. satu atom hidrogen
e. 1/12 atom 12C
24. Pernyataan di bawah ini yang benar adalah ....
a. massa 1 atom suatu unsur = 12 massa atom unsur x berat 1 atom 12C
b. massa 1 atom suatu unsur =
c. massa 1 atom suatu unsur =
d. massa 1 atom suatu unsur = massa atom relatif unsur x massa 1 atom oksigen e. massa 1 atom suatu unsur =
massa atom relatif unsur x
massa 1 atom 12C
25. Berikut ini yang mempunyai massa rumus relatif terkecil adalah .... a. CaO b. H2O c. NaOH d. CaCl2 e. Ca(OH)2
massa atom unsur itu 1
12 massa atom 12C massa atom unsur itu
7. Tentukan letak unsur-unsur berikut di dalam sistem periodik modern!
a. 35Br b. 38Sr c. 54Xe d. 55Cs
8. Diketahui unsur-unsur sebagai berikut. 11Na, 13Al , 15P, 37Rb, 38Sr
a. Tentukan urutan kenaikan jari-jari atomnya! b. Tentukan urutan kenaikan energi ionisasinya! c. Tentukan urutan kenaikan keelektronegatifannya!
9. Mengapa tidak dijumpai unsur fluorin bermuatan positif? Jelaskan! 10. a. Jelaskan apa yang dimaksud dengan affinitas elektron!