AKTIVITAS ANTIANGIOGENESIS EKSTRAK METANOL DAUN SENGGUGU (Clerodendrum serratum L.) TERHADAP
CHORIOALLANTOIC MEMBRANE YANG DIINDUKSI bFGF
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.) Program Studi Farmasi
Oleh :
Retno Pamungkas
NIM : 108114135
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
i
AKTIVITAS ANTIANGIOGENESIS EKSTRAK METANOL DAUN SENGGUGU (Clerodendrum serratum L.) TERHADAP
CHORIOALLANTOIC MEMBRANE YANG DIINDUKSI bFGF
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.) Program Studi Farmasi
Oleh :
Retno Pamungkas
NIM : 108114135
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
Skripsi ini kupersembahkan untuk:
Sang Triratna atas perlindungannya disetiap langkah hidupku.
Ibu dan Ayahku tercinta
yang telah merawat, mendidik dan menjadi panutan hidupku.
Adikku dan keluarga besarku
yang telah saling berbagi rasa dan selalu mendukungku.
Skripsi ini kupersembahkan sebagai ungkapan baktiku.
vii
PRAKATA
Puji syukur kepada Tuhan Yang Maha Esa atas semua berkat dan
penyertaan-Nya kepada penulis sehingga penulis dapat menyelesaikan skripsi
yang berjudul “AKTIVITAS ANTIANGIOGENESIS EKSTRAK METANOL DAUN SENGGUGU (Clerodendrum serratum L.) TERHADAP
CHORIOALLANTOIC MEMBRANE YANG DIINDUKSI bFGF” ini dengan baik. Laporan akhir ini disusun untuk memenuhi salah satu persyaratan untuk
memperoleh gelar Sarjana Strata 1 Program Studi Ilmu Farmasi (S. Farm).
Penulis banyak mengalami kesulitan dan masalah dalam menyelesaikan
laporan ini. Tetapi dengan adanya bantuan dari berbagai pihak, akhirnya penulis
dapat menyelesaikan laporan akhir ini. Oleh karena itu, dengan segala kerendahan
hati penulis ingin mengucapkan terima kasih atas segala bantuan yang telah
diberikan kepada:
1. Aris Widayati M.Si, Ph.D., Apt., selaku Dekan Fakultas Farmasi Universitas
Sanata Dharma.
2. Drh. Sitarina Widyarini MP, Ph.D., selaku Dosen Pembimbing Utama yang
telah memberikan bantuan dan bimbingan selama rancangan, pengusulan
skripsi, saat dilakukan penelitian dan selama penulisan skripsi dengan
kesabaran dan penuh perhatian.
3. Phebe Hendra, Ph.D., Apt., selaku Dosen Pembimbing Pendamping yang
viii
skripsi, saat dilakukan penelitian dan selama penulisan skripsi dengan
kesabaran dan penuh perhatian.
4. Yohanes Dwiatmaka, M.Si. selaku Dosen Penguji yang menguji sekaligus
memberi arahan, kritik, dan saran yang membangun bagi penulis.
5. Agustina Setiawati, M.Sc., Apt., selaku Dosen Penguji yang menguji
sekaligus memberi arahan, kritik, dan saran yang membangun bagi penulis.
6. C.M. Ratna Rini Nastiti, M.Pharm, Apt., selaku Dosen Pembimbing
Akademik yang telah mendidik, memberi dukungan dan nasihat positif.
7. Segenap laboran Laboratorium Farmakognosi-Fitokimia (Pak Wagiran) dan
Perbekalan Steril (Pak Agung) Universitas Sanata Dharma atas segala
bantuan selama penulis melakukan penelitian di Laboratorium
Farmakognosi-Fitokimia dan Perbekalan Steril.
8. Segenap laboran Laboratorium Mikrobiologi Fakultas Kedokteran Hewan
(Pak Iwan) Universitas Gadjah Mada atas segala bantuan selama penulis
melakukan penelitian di Laboratorium Mikrobiologi.
9. Ketut Noveryka Lendra, Stien Dwiny dan Pande Krisna Wedana, tim
antiangiogenesis yang kompak, saling mengisi kekurangan, pantang
menyerah dan saling menyemangati. Tanpa mereka skripsi ini tidak akan
berjalan dengan baik dan selesai.
10. Kedua orang tuaku dan adikku, yang terus menyemangati dan mendorongku
untuk menyelesaikan skripsiku dengan baik.
11. Desi Irwanta, Kristin Yunita dan Rosiana Cahyono, yang telah menyemangati
ix
12. Teman-teman farmasi FKK B 2010, yang telah memberikan perhatian,
dukungan, doa, semangat, kritik dan masukan yang membangun.
13. Teman-teman farmasi angkatan 2010, yang telah memberikan perhatian,
dukungan, doa, semangat, kritik dan masukan yang membangun.
14. Semua pihak yang tidak dapat penulis sebutkan satu persatu yang telah
memberikan dukungan dan bantuan.
Penulis menyadari bahwa dalam penyususnan skripsi ini masih terdapat
banyak kekurangan. Oleh karena itu, dengan segenap kerendahan hati Penulis
memohon maaf apabila terdapat hal-hal yang kurang berkenan serta Penulis
mengharapkan saran dan kritik yang membangun dari semua pihak. Akhir kata
Penulis berharap semoga laporan ini dapat berguna bagi pembaca.
Yogyakarta, 11 Agustus 2014
x
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS ... v
PERNYATAAN KEASLIAN KARYA ... vi
PRAKATA ... vii
DAFTAR ISI ... x
DAFTAR TABEL... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
INTISARI ... xvi
ABSTRACT ... xvii
BAB I PENGANTAR ... 1
A. Latar Belakang ... 1
1.Permasalahan ... 3
2.Keaslian Penelitian ... 4
3.Manfaat Penelitian ... 4
xi
3.Basic Fibroblast Growth Factor (bFGF) ... 15
D. Inhibitor Angiogenesis ... 16
E. Inhibitor Angiogenesis dari Senyawa Alam ... 16
F. Chorioallantoic Membrane ... 18
G. Uji Angiogenesis Chick Chorioallantoic Membrane (CAM) ... 19
H. Landasan Teori ... 20
I. Hipotesis ... 22
BAB III METODOLOGI PENELITIAN ... 23
A. Jenis dan Rancangan Penelitian ... 23
B. Variabel dan Definisi Operasional ... 23
xii
2.Definisi Operasional ... 24
C. Bahan Penelitian ... 24
D. Alat Penelitian ... 24
E. Tata Cara Penelitian ... 25
1.Determinasi Tanaman ... 25
2.Preparasi Ekstrak Metanol Daun Senggugu ... 25
3.Uji Kromatografi Lapis Tipis (KLT) ... 26
4.Orientasi Kelarutan Ekstrak Metanol Daun Senggugu ... 27
5.Sterilisasi Alat ... 27
6.Pembuatan Larutan Uji dan Larutan bFGF ... 27
7.Uji Antiangiogenesis ... 28
F. Analisis Data ... 30
BAB VI HASIL DAN PEMBAHASAN ... 31
A. Hasil Determinasi Tanaman ... 31
B. Hasil Pembuatan Ekstrak Metanol Daun Senggugu ... 31
C. Hasil Uji Kromatografi Lapis Tipis ... 33
D. Hasil Uji Antiangiogenesis ... 34
xiii
DAFTAR TABEL
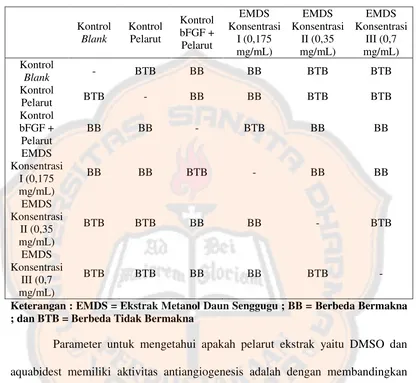
Tabel I. Jumlah Pembuluh Darah Baru Kelompok Kontrol dan
Perlakuan Ekstrak Metanol Daun Senggugu ... 39
Tabel II. Uji Tukey Kelompok Kontrol dan Perlakuan Ekstrak
Metanol Daun Senggugu ... 41
Tabel III Persentase Pertumbuhan Pembuluh Darah Baru dan
Persentase Penghambatan Angiogenesis Kelompok
Perlakuan Ekstrak Metanol Daun Senggugu ... 42
Tabel IV Rerata dan Standar Deviasi Pembuluh Darah Baru Setiap
xiv
DAFTAR GAMBAR
Gambar 1. Foto Tanaman Senggugu... 6
Gambar 2. Hasil Uji CAM pada Kelompok Kontrol dan Perlakuan
Ekstrak Metanol Daun Senggugu ... 39
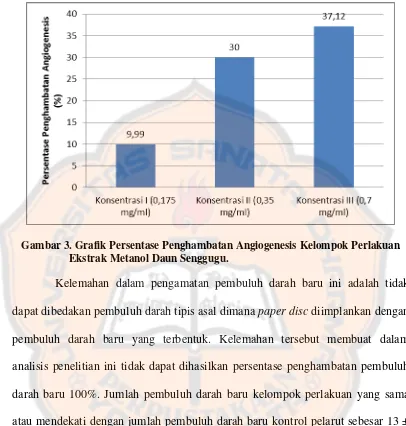
Gambar 3. Grafik Persentase Penghambatan Angiogenesis
Kelompok Perlakuan Ekstrak Metanol Daun Senggugu 43
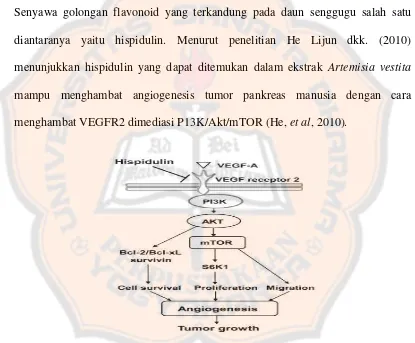
Gambar 4. Kemungkinan Jalur Sinyal Angiogenesis yang
Diregulasi oleh Hispidulin dalam Sel Endotelial ... 46
Gambar 5. Tanaman Senggugu di Kebun Obat Universitas Sanata
Dharma ... 56
Gambar 6. Foto Prosedur Kerja Uji CAM ... 66
xv
DAFTAR LAMPIRAN
Lampiran 1. Surat Determinasi Tanaman Senggugu ... 55
Lampiran 2. Foto Tanaman Senggugu dari Kebun Obat Universitas Sanata Dharma ... 56
Lampiran 3. Data Perhitungan Rendemen Ekstrak Metanol Daun Senggugu ... 57
Lampiran 4. Hasil Uji Kromatografi Lapis Tipis ... 58
Lampiran 5. Data Perhitungan KontrolbFGF ... 61
Lampiran 6. Data Perhitungan Kontrol Pelarut ... 63
Lampiran 7. Data Perhitungan Kelompok Konsentrasi Ekstrak Metanol Daun Senggugu ... 64
Lampiran 8. Foto Prosedur Kerja Uji CAM ... 66
Lampiran 9. Hasil uji CAM ... 67
Lampiran 10. Persentase Penghambatan Angiogenesis ... 69
xvi
INTISARI
Daun senggugu (Clerodendrum serratum L.) merupakan daun yang banyak mengandung senyawa polifenol seperti flavonoid. Beberapa senyawa flavonoid telah diuji dapat menghambat angiogenesis. Contoh senyawa flavonoid tersebut adalah hispidulin, apigenin dan luteolin, yang juga terkandung dalam daun senggugu. Berdasarkan hal tersebut daun senggugu berpotensi memiliki aktivitas antiangiogenesis.
Penelitian ini bertujuan untuk mengetahui aktivitas antiangiogenesis dari ekstrak metanol daun senggugu dengan metode Chick Chorioallantoic Membrane
(CAM), dan mengetahui kekerabatan antara konsentrasi ekstrak metanol daun senggugu dengan aktivitas antiangiogenesis. Chorioallantoic membrane yang digunakan berasal dari telur ayam yang berusia 9 hari. Konsentrasi ekstrak yang diuji terdiri dari 3 variasi kadar yaitu 0,175; 0,35 dan 0,7 mg/mL.
Aktivitas antiangiogenesis dilihat melalui pengamatan makroskopis dengan menghitung pembuluh darah baru yang keluar dari pembuluh darah utama secara langsung dan tidak langsung. Data tersebut dianalisis persentase penghambatan angiogenesis dan diuji statistik dengan one way anova dan uji
Tukey. Hasil penelitian ini menunjukan ekstrak metanol daun senggugu memiliki aktivitas antiangiogenesis pada konsentrasi 0,35 dan 0,7 mg/mL dengan persentase penghambatan angiogenesis 30,00 dan 37,12%, dan tidak ada kekerabatan antara konsentrasi ekstrak metanol daun senggugu dengan aktivitas antiangiogenesis.
xvii
ABSTRACT
The leaves of senggugu (Clerodendrum serratum L.) is a leaves that contains polyphenolic compounds such as flavonoids. Several compounds have been tested flavonoids can inhibit angiogenesis. Examples of these flavonoids is hispidulin, apigenin and luteolin, which contained in the senggugu leaves. Based on that statement, senggugu leaves potentially have antiangiogenesis activity.
This study aims to determine antiangiogenesis activity of the metanol extract of senggugu leaves by Chick Chorioallantoic Membrane (CAM) method, and find out the relationship between the concentration metanol extract of senggugu leaves with antiangiogenesis activity. Chorioallantoic membrane is
derived from chicken’s egg was 9 days. The concentration extract metanol of senggugu leaves which tested consists of three variation concentrations is 0.175; 0.35 and 0.7 mg/mL.
Antiangiogenesis activity can be seen through macroscopic observation by counting the newly formed blood vessels where out from main blood vessel directly and indirectly. The data were analyzed with the percentage of inhibition angiogenesis and statistically tested by one way anova and tukey test. The result showed that the methanol extract of senggugu leaves have antiangiogenesis activity at concentrations 0.35 and 0.7 mg/mL, which the percentage of inhibition angiogenesis are 30.00 and 37.12%, and there was no relationship between the concentration metanol extract of senggugu leaves with antiangiogenesis activity.
1
BAB I PENGANTAR
A. Latar Belakang
Kanker adalah penyakit yang ditandai oleh pertumbuhan sel yang tidak
terkendali, bersifat parasit dengan mengambil makanan dari sel sehat terdekat.
Kanker merupakan salah satu penyakit mematikan di dunia. Resiko individu
untuk menderita kanker dipengaruhi oleh faktor genetik dan pemejanan terhadap
agen yang mempredisposisi kanker (Brooker, 2005). Berdasarkan estimasi dari
International Agency for Research on Cancer (IARC), pada tahun 2008 terjadi
12,7 juta kasus kanker di dunia, dan 7,6 juta kematian akibat kanker. Pada tahun
2030 diduga kasus kanker akan terus bertambah menjadi 21,4 juta dan 13,2 juta
kematian akibat kanker (American Cancer Society, 2011).
Tingginya kasus kematian akibat kanker membuat penelitian dan
pengembangan pengobatan kanker menjadi perhatian besar bagi dunia. Sekarang
ini sudah ada beberapa terapi pengobatan kanker secara medis antara lain terapi
operatif, kemoterapi, radioterapi, hormonal, dan imunoterapi. Saat ini telah
berkembang pula pengobatan kanker dengan menggunakan tanaman obat. Secara
empiris tanaman telah lama digunakan oleh nenek moyang sebagai obat untuk
beragam penyakit. Tanaman obat yang digunakan untuk mengobati kanker pada
prinsipnya berfungsi menghambat pertumbuhan kanker, menghancurkan kanker,
dan memperbaiki fungsi organ vital yang rusak oleh kanker. Penggunaan tanaman
membutuhkan penelitian lebih lanjut oleh para ahli untuk memastikan
keefektifannya (Mardiana, 2007).
Angiogenesis terdiri dari dua kata, yaitu angio (pembuluh darah) dan
genesis (pertumbuhan), jadi angiogenesis adalah pertumbuhan pembuluh darah
baru. Pertumbuhan pembuluh darah baru berperan penting agar tumor (terutama
tumor padat atau solid) dapat hidup dan berkembang. Berdasarkan hal tersebut
maka salah satu cara membunuh tumor adalah dengan menghambat pertumbuhan
pembuluh darah tumor sehingga tumor tidak bisa berkembang dan kemudian mati
pelan-pelan (Tapan, 2005). Hal tersebut membuat pencarian obat antiangiogenesis
menjadi salah satu perhatian besar dalam penelitian pengobatan kanker, salah
satunya pencarian senyawa antiangiogenesis yang berasal dari tanaman obat.
Senyawa tersebut kemudian akan dikembangkan menjadi obat kanker.
Salah satu metode uji angiogenesis, yaitu metode Chick Chorioallantoic
Membrane (CAM). Metode CAM adalah organotypic model yang awalnya
dirancang untuk menggantikan Draize-test untuk mengidentifikasi iritasi di mata,
pendarahan, lisis dan koagulasi. Tes ini lambat laun memungkinkan untuk analisis
angiogenesis tumor yang tumbuh di chorioallantoic membrane (Hock, Zheng,
Buckfelder, Eyupoglu, and Savaskan, 2013).
Indonesia memiliki kekayaan hayati yang melimpah. Salah satunya
kekayaan hayati tumbuhan. Tumbuhan memiliki peranan penting dalam
menghasilkan senyawa bioaktif untuk obat, termasuk obat kanker. Salah satu
tanaman yang diduga kandungan senyawa bioaktifnya dapat menyembuhkan
in vivo dengan parameter seperti studi hematologi dan estimasi protein, Median
Survival Time (MST), Life Span (%LS) dan studi in vitro dengan uji garam
tetrazolium dan metode tryphan blue dry exclusion dapat disimpulkan bahwa
ekstrak daun senggugu memiliki aktivitas antikanker (Thalla, Tanmu, Pentela, and
Thalla, 2012). Berdasarkan hasil uji angiogenesis menggunakan metode rat
aortic, ekstrak metanol daun senggugu memiliki aktivitas antiangiogenesis yang
lebih besar dibandingkan dengan penyari petroleum eter, kloroform, dan air
(Mohamed, Mohamed, Aisha, Ameer, Ismail, Ismail, et al., 2012). Kandungan
polifenolik dari daun senggugu sebagai antioksidan diduga memiliki peranan
penting dalam aktivitas antiangiogenesis yang dapat bermanfaat sebagai
antikanker. Penelitian ini diharapkan dapat membuktikan apakah ekstrak metanol
daun senggugu (Clerodendrum serratum L.) mempunyai potensi sebagai
antiangiogenesis dengan uji angiogenesis lain, yaitu metode CAM dengan
chorioallantoic membrane embrio ayam yang telah diinduksi basic Fibroblast
Growth Factor (bFGF), sehingga dapat dijadikan bukti ilmiah untuk
pengembangan penelitian pengobatan kanker pada manusia.
1. Permasalahan
a. Apakah ekstrak metanol daun senggugu memiliki aktivitas antiangiogenesis
pada chorioallantoicmembrane embrio ayam yang diinduksi bFGF?
b. Adakah kekerabatan antara konsentrasi ekstrak metanol daun senggugu dengan
aktivitas antiangiogenesis pada chorioallantoic membrane embrio ayam yang
2. Keaslian Penelitian
Sejauh pengamatan penulis, penelitian tentang uji angiogenesis daun
senggugu pernah dilakukan oleh Mohamed, et al., 2012, yang melakukan
penelitian uji angiogenesis menggunakan model rat aortic.
Perbedaan penelitian ini dengan penelitian sebelumnya adalah simplisia
yang digunakan didapat dari Kebun Obat Universitas Sanata Dharma, dan model
uji angiogenesis yang digunakan adalah metode CAM dengan chorioallantoic
membrane embrio ayam yang telah diinduksi bFGF. Sepanjang pengetahuan
penulis, penelitian uji angiogenesis daun senggugu dengan metode CAM
menggunakan chorioallantoic membrane embrio ayam yang diinduksi bFGF
belum pernah dilaporkan.
3. Manfaat Penelitian
a. Manfaat teoritis. Dapat memperkaya ilmu pengetahuan mengenai adanya
aktivitas antiangiogenesis pada daun senggugu.
b. Manfaat metodologi. Dapat memberikan pengetahuan mengenai tata cara
pengujian aktivitas antiangiogenesis ekstrak metanolik daun senggugu
menggunakan metode CAM pada embrio ayam yang diinduksi bFGF.
c. Manfaat praktis. Dapat memberikan informasi mengenai adanya aktivitas
B. Tujuan Penelitian 1. Tujuan Umum
Untuk memberikan informasi kepada masyarakat tentang ekstrak daun
senggugusebagai obat antikanker.
2. Tujuan Khusus
a. Untuk mengetahui aktivitas antiangiogenesis dari ekstrak metanol daun
senggugu.
b. Untuk mengetahui kekerabatan antara konsentrasi ekstrak metanol daun
6
BAB II
PENELAAHAN PUSTAKA
A.Senggugu 1. Nama Tumbuhan
Nama Latin : Clerodendron serratum L.
Nama Umum : Senggugu (Gambar 1)
Nama Daerah : Simar buangkudu (Batak Toba); Tanjau handak (Lampung);
Senggugu (Melayu dan Jawa Tengah); Singgugu (Sunda);
Kertase (Madura)
(Direktorat Obat Asli Indonesia, 2008).
Gambar 1. Foto Tanaman Senggugu (Clerodendrum serratum L.)
2. Taksonomi Tumbuhan
Kingdom : Plantae
Subkingdom : Tracheobionta
Super Divisi : Spermatophyta
Divisi : Spermatophyta
Subdivisi : Angiopermae
Kelas : Dicotyledoneae
Bangsa : Lamiales
Suku : Verbenaceae
Marga : Clerodendron
Jenis : Clerodendron serratum Spreng.
Sinonim tumbuhan : Clerodendrum serratum, Clerodendron serratum (L.)
Moon dan Clerodendron javanicum Walp., Clerodendrum
serratum Spreng.
(Direktorat Obat Asli Indonesia, 2008; Singh, et al., 2012; Van Steenis, 1975;
Heyne, 1950).
3. Manfaat Tanaman
Secara tradisional tanaman senggugu sudah digunakan sebagai obat anti
rematik, anti asma, penurun panas, sakit kepala, ophtalmia, memar, bronchitis,
patah tulang, malaria, digigit ular, bisul dan perut busung. Berdasarkan hasil
anti kanker, hepatoprotektif, anti diare, dan anti mikroba (Singh, et al., 2012;
Redaksi Agromedia, 2008).
4. Kandungan Kimia
Kandungan kimia yang banyak terdapat di tanaman genus Clerodendrum
adalah karbohidrat, fenolik, flavonoid, terpenoid dan steroid. Daun senggugu
mengandung α-spinosterol, luteolin, luteolin-7-o-glucoronide, diterpin-clerodin,
ethycholesta-5, 24 25 -trine 3β-o-hispidulin, 7-o- glukonoid hispidulin,
cruteuarein, stigmasterol, apigenin, dan baicalin. Kandungan flavonoid dalam
daun senggugu, yaitu hispidulin memiliki aktivitas antioksidan yang kuat, anti
mikroba, anti asma, anti tumor, dan aktivitas Central Nervous System (CNS)
binding. Kandungan polifenol yang besar dalam daun senggugu diduga kuat
berperan penting dalam aktivitas ekstrak metanol daun senggugu sebagai
antiangiogenesis, antioksidan, dan vasorelaktan (Kumar and Nishteswar, 2013;
Mohamed, et al., 2012; Vidya, Krishna, Manjunatha, Mankani, Ahmed and Singh,
2006).
B.Senyawa Polifenol
Polifenol adalah kelompok zat kimia yang ditemukan pada tumbuhan.
Zat ini memiliki tanda khas yaitu memiliki banyak gugus fenol dalam
molekulnya. Polifenol berperan sebagai antioksidan, dengan cara melindungi sel
melawan kerusakan oksidatif dan meminimalkan resiko dari berbagai macam
eksperimental menunjukkan peran polifenol yang kuat dalan pencegahan penyakit
kardiovaskular, kanker, osteoporosis, dan diabetes melitus. Polifenol dibagi
menjadi beberapa kelas sesuai dengan jumlah cincin fenol yang dikandung dan
elemen struktural yang mengikat cincin satu sama lain. Kelompok utama polifenol
yaitu flavonoid, asam fenolik, alkohol fenolik, stilbene, dan lignin
(Hattenschwiler and Vitousek, 2000; Archivio, Filesi, Benedetto, Gargiulo,
Giovannini and Masella, 2007).
C.Kanker
Kanker merupakan penyakit yang berpotensi mematikan yang
disebabkan mutasi gen yang mengkode protein sel regulasi yang penting. Akibat
mutasi gen tersebut menyebabkan disregulasi dari program sel normal untuk
pembelahan sel dan diferensiasi sel. Pembelahan sel tersebut menyebabkan
ketidakseimbangan replikasi sel dan kematian sel tumor, sehingga pertumbuhan
populasi sel tumor tak terkendali (Alison, 2001; Ruddon, 2007).
Penyakit kanker ditandai oleh pertumbuhan sel yang tidak terkendali dan
bersifat parasit. Karakteristik yang menunjukkan perbedaan kanker ganas dengan
tumor jinak adalah kemampuan untuk menginvasi secara lokal, menyebar ke
kelenjar getah bening regional, dan metastasis ke jaringan lain dalam tubuh.
Secara morfologi sel kanker memiliki karakteristik nukleus yang besar, memiliki
ukuran dan bentuk yang tidak biasa, nukleolus yang menonjol, sitoplasma yang
jarang dan warnanya intens atau sebaliknya pucat. Resiko individu untuk
lingkungan (agen yang mempredisposisi kanker). Gaya hidup yang tidak sehat,
merokok, western diet (tinggi lemak, rendah serat) juga dapat meningkatkan
resiko timbulnya kanker (Baba and Catoi, 2007; Brooker, 2005).
1. Sifat Sel Kanker
Secara umum, sel kanker memiliki sifat-sifat sebagai berikut:
a. Potensi replikasi sel yang tidak terkendali. Sel normal tumbuh dan bereplikasi
ketika sel mendapat sinyal dari sel disekitar mereka untuk tumbuh. Sel dapat
bereplikasi 60 sampai 80 lipat dari populasi, telomer Human Diploid
Fibroblasts (HDFs) memendek dan memicu respon kerusakan, kemudian sel
akan berhenti membelah diri dan berkembang menjadi fenotip senescence.
Senescence adalah program growth-arrest yang membatasi usia sel dan
mencegah proliferasi sel yang tidak terbatas. Proses senescence diatur oleh
tumour suppressors p53 dan retinoblastoma (RB). Jika RB dan p53
dilumpuhkan maka memungkinkan pembelahan sel terus berlangsung sampai
telomer memendek secara kritis dan memicu krisis. Beberapa sel muncul dari
krisis dengan mengaktifkan mekanisme stabilisasi telomer. Ekspresi eksogen
Telomerase Reverse Transcriptase (TERT) pada beberapa tahap replikasi
memungkinkan sel-sel tersebut immortal. Proses stabilisasi telomer memiliki
peranan penting pada perkembangan tumor. Hal tersebut menyebabkan sel
kanker dapat meningkatkan dan mempercepat pertumbuhannya sendiri. Sel
kanker kehilangan kontrol untuk terus membelah diri (Mathon and Lloyd,
b. Kemampuan sel mencukupi sendiri kebutuhannya terhadap sinyal
pertumbuhan. Apabila sel normal dikulturkan, proliferasi sel bergantung pada
sinyal pertumbuhan yang dimasukkan kedalam kultur tersebut. Sedangkan
pada sel kanker, onkoprotein dapat meniru sinyal pertumbuhan pada sel
normal, sehingga pada kultur sel kanker menunjukkan berkurangnya
ketergantung sel pada sinyal pertumbuhan dari luar, karena sel kanker sudah
memproduksinya sendiri (Hanahan and Weinberg, 2000).
c. Respon terhadap stop signal (sinyal anti pertumbuhan) lemah. Sel normal akan
berhenti membelah diri ketika menerima stop signal dari sel di dekatnya bahwa
jumlah sel di sekitarnya sudah penuh atau bagian dari sel rusak. Proses
proliferasi dihentikan oleh stop signal. Stop signal dapat menghentikan
proliferasi dengan 2 mekanisme tertentu. Mekanisme pertama yaitu sel dipaksa
berhenti berproliferasi dan memasuki fase istirahat (G0) yang dapat aktif
kembali bila terdapat sinyal ekstraseluler. Sedangkan mekanisme kedua adalah
sel diinduksi untuk menghilangkan potensi proliferasi secara permanen dengan
memasuki tahap post mitosis, yang dihubungkan dengan terjadinya diferensiasi
spesifik. Untuk mulai tumbuh, sel kanker harus menghindari faktor anti
pertumbuhan yang sebagian besar berperan pada fase G1 yang menyebabkan
sel berhenti berproliferasi dengan memasuki fase istirahat atau post mitosis.
Sinyal antiproliferatif tersebut diperankan melalui retinoblastoma protein
(pRB). pRB dapat mengeblok proliferasi dengan mengasingkan dan mengubah
fungsi faktor transkripsi E2F yang mengontrol ekspresi simpanan gen esensial
Gangguan pada jalur pRB akan membebaskan E2F yang dapat menjadikan sel
terus berproliferasi, dan juga membuat sel tidak sensitif terhadap faktor anti
pertumbuhan yang beroperasi selama jalur ini, dengan cara mengeblok
kemajuan fase G1 dari siklus sel (Hanahan and Weinberg, 2000; Weinberg,
1996).
d. Mampu menghindari terjadinya apoptosis. Sel normal dapat mengalami
kematian sel yang terdiri dari nekrosis, onkosis dan apoptosis. Apoptosis
adalah kematian sel melalui mekanisme genetik yaitu kerusakan atau
fragmentasi kromosom atau DNA. Apoptosis dibedakan menjadi dua yaitu
apoptosis fisiologis dan apoptosis patologis. Sel kanker dapat menghindari dari
proses apoptosis fisiologis karena aktivitas enzim ribonukleoprotein atau
telomerase yang berperan dalam sintesis telomerik DNA aktif secara terus
menerus sehingga ukuran telomer ujung kromosom dapat dipertahankan terus
menerus. Akibatnya sel kanker tidak mengalami kematian sel (Sudiana, 2008).
e. Merekrut suplai makanan. Semua sel untuk dapat tumbuh membutuhkan
oksigen dan nutrisi yang dihantarkan dalam darah, salah satunya darah yang
ada di pembuluh darah sekitarnya. Umumnya, sistem tubuh berhati-hati dalam
meregulasi pertumbuhan pembuluh darah baru (angiogenesis). Namun tumor
dapat mengaktifkan pemicu angiogenesis dengan merubah keseimbangan
antara induktor dan inhibitor angiogenesis. Salah satu strategi untuk merubah
keseimbangan melibatkan perubahan transkripsi gen. Pada sel tumor ekspresi
produksi inhibitor endogen seperti thrombospondin-1 atau interferon-β lebih
sedikit (Hanahan and Weinberg, 2000).
f. Menginvasi jaringan dan metastasis. Dalam jaringan sehat, sel-sel melekat
pada tempat sel berada, mengikuti satu sama lain dalam struktur yang
mencirikan jaringan dan membantu dalam fungsinya. Sebaliknya pada sel
kanker yang sudah matang dapat melepaskan pegangan molekular sehingga
dapat berpindah melalui pembuluh darah dan bergerak sampai bagian lain
dalam tubuh dan menginvasi jaringan dengan membentuk koloni baru.
Kemampuan untuk membentuk koloni baru yang jauh dari tempat primernya
dinamakan metastasis. Metastasis merupakan karakteristik yang paling
menentukan keganasan sel kanker karena penyebaran metastasis sel kanker
sangat sulit diobati. Beberapa protein yang terlibat pada proses perlekatan sel
dalam jaringan dalam proses invasi dan metastasis, diantaranya Cell Adhesion
Molecules (CAMs), E-cadherin dan integrin yang menghubungkan sel dengan
matriks ekstraseluler. (Alison, 2001; Hanahan and Weinberg, 2000).
2. Angiogenesis
Angiogenesis adalah pertumbuhan pembuluh darah baru dari pembuluh
darah yang sudah ada. Angiogenesis terjadi pada tubuh manusia, mulai dari janin
dan terus berlanjut sampai tua, baik saat sehat maupun sakit. Angiogenesis
patologis terjadi pada penyakit seperti kanker, rheumatoid arthritis (RA),
endometriosis, psoriasis, stroke, luka kronik, coronary artery disease, komplikasi
Angiogenesis berperan penting dalam perkembangan kanker. Kanker untuk
menyebar membutuhkan suplai pembuluh darah yang membawa oksigen dan
nutrisi dan membuang sampah metabolit (Adair and Montani, 2011; Jeong, Koh,
Lee, Lee, Lee, Bae, et al., 2010; Bisht, Dhasmana and Bist, 2010).
Proses angiogenesis berawal dari jaringan yang sakit, luka, mengalami
hipoksia, atau tumor yang akan memproduksi dan melepaskan faktor
pertumbuhan angiogenesis yang berupa protein, faktor pertumbuhan angiogenesis
tersebut berdifusi ke jaringan di sekitarnya. Contoh faktor pertumbuhan
angiogenesis yaitu angiopoietin-1, Fibroblast Growth Factors: acidic (aFGF) dan
basic (bFGF), Vascular Endothelial Growth Factor (VEGF), Transforming
Growth Factor (TGF) dan lain-lain. Faktor pertumbuhan angiogenesis tersebut
berikatan dengan reseptor spesifik dari sel endotelial pembuluh darah sekitarnya
sehingga sel endotelial teraktivasi. Sel endotelial yang teraktivasi menghasilkan
sinyal dari permukaan sel kemudian dikirim ke nukleus. Organel-organel sel
endotelial kemudian memproduksi molekul baru termasuk enzim protease. Enzim
protease mendegradasi matriks ekstraseluler. Sel endotelial kemudian mulai
membelah diri dan migrasi keluar melalui lubang hasil degradasi matriks
ekstraseluler menuju jaringan yang sakit, luka, hipoksia atau tumor tersebut. Sel
endotelial mengalami elongasi dan saling menyejajarkandiri dengan sel endotelial
lain untuk membentuk struktur percabangan pembuluh darah yang kuat. Struktur
pembuluh darah akan distabilkan oleh sel mural (sel otot polos dan pericytes)
pembentukan anastomosis dan akhirnya aliran darah (Frisca, Sardjono, dan
Sandra, 2009; Gupta and Qin, 2003).
3. Basic Fibroblast Growth Factor (bFGF)
Basic Fibroblast Growth Factor disebut juga Fibroblast Growth
Factor-2 (FGF2 /FGF-2). bFGF menginduksi migrasi, proliferasi dan diferensiasi sel
endotelial secara in vitro, oleh karena itu bFGF memiliki peranan penting dalam
angiogenesis. bFGF berperan pada proses regulasi ekspresi beberapa protein
termasuk intestinal collagenase, urokinase type plasminogen activator (uPa) dan
integrin β1, yang semuanya berperan penting untuk invasi sel endotelial ke dalam
matriks selama angiogenesis. Selain itu bFGF juga dapat menginduksi proliferasi
sel otot polos (Wingerter, Elliot, Clark, and Farr, 2000; Mogensen, 2005).
Faktor pertumbuhan termasuk bFGF dapat berikatan dengan reseptornya
pada permukaan sel endotelial dari pembuluh darah jaringan sekitar yang telah
ada sebelumnya. bFGF mampu berinteraksi dengan sel endotelial melalui
ikatannya dengan reseptor Fibroblast Growth Factor (FGF) tirosin kinase dan
reseptor Heparan Sulphate Proteoglycans (HSPGs) di permukaan sel dan di
matriks ekstraseluler. Ikatan tersebut menyebabkan sel endotelial teraktivasi dan
menghasilkan enzim degradatif matrix metalloproteinases (MMPs). Enzim ini
dilepaskan dari endotelial dan menyebar disekitar sel. MMPs mendegradasi
matriks ekstraseluler dan menyebar ke jaringan sekitarnya. Kemudian sel
endotelial mulai membelah diri dan migrasi keluar ke ruang intestinal, kemudian
pembentukan lumen, generasi membran basement baru dengan perekrutan dari
pericyte, kemudian pembentukan anastomosis dan akhirnya aliran darah
(Chrisnanto, 2014; Gupta and Qin, 2003; Kleinsmith, Kerrigan, Kelly and Hollan,
2006; Ribbati, Leali, Gualandris, Bastaki, Vacca, Roncali, et al., 1999).
D.Inhibitor Angiogenesis
Inhibitor angiogenesis dibedakan menjadi 2 tipe yaitu inhibitor
angiogenesis langsung dan tidak langsung. Inhibitor angiogenesis tipe tidak
langsung bekerja dengan memblok sel onkogen tumor atau produknya atau
reseptor dari produknya. Contoh dari inhibitor angiogenesis tipe tidak langsung
adalah iressa. Iressa menghambat sintesis protein angiogenik bFGF, Vascular
Endothelial Growth Factor (VEGF), Transforming Growth Factor- Alpha
(TGF-α) dari sel tumor (Folkman, 2003).
Inhibitor angiogenesis tipe langsung bekerja dengan memblok sel
endotelial dari respon protein pro angiogenik. Contoh inhibitor angiogenesis tipe
langsung adalah endostatin. Endostatin menghambat sel endotelial merespon
beberapa protein angiogenik seperti bFGF, VEGF, IL-8 dan Platelet Derived
Growth Factor (PDGF) (Folkman, 2003).
E.Inhibitor Angiogenesis dari Senyawa Alam
Berbagai penelitian telah membuktikan beberapa senyawa dari produk
alam memiliki aktivitas antiangiogenesis Hispidulin yang merupakan senyawa
penelitian He Lijun dan kawan-kawan (2010) menunjukkan hispidulin dari ekstrak
Artemisia vestita menghambat angiogenesis tumor pankreas manusia dan
pertumbuhan tumor dengan cara mentarget jalur sinyal VEGFR2 yang dimediasi
P13K/Akt/mTOR (He, Wu, Lin, Wang, Wu, Chen, et al, 2010).
Selain hispidulin, apigenin juga merupakan senyawa bioaktif golongan
flavonoid yang memiliki aktivitas antiangiogenesis. Menurut penelitian Jing Fang
dan kawan kawan (2004) apigenin memiliki aktivitas antiangiogenesis dengan
cara menghambat tube formation melalui uji Human Umbilical Vein Endothelial
Cells (HUVEC). Apigenin menghambat tube formation dengan cara menurunkan
ekspresi VEGF. Apigenin menghambat ekspresi VEGF pada level transkripsi
melalui ekspresi hypoxia inducible factor 1α (HIF-1α). Apigenin menghambat
HIF-1α dan ekspresi VEGF melalui 2 jalur sinyal P13K/AKT/p70S6K1 dan
HDM2/p53. (Fang, Xia, Cao, Zheng, Reed, and Jiang,2004).
Luteolin menghambat proliferasi sel dengan cara menghambat reseptor
tirosin kinase. Ekstrak luteolin dari Platycodon grandiflorum juga terbukti
memiliki aktivitas antiangiogenesis yang diduga aktivitasnya berkaitan dengan
aktivitas antioksidan dari luteolin dengan cara memblok produksi Reactive
Oxygen Species (ROS) sehingga menekan ekspresi VEGF dan efek proangiogenik
dari VEGF. Senyawa flavonoid lainnya yang sudah terbukti memiliki aktivitas
penghambatan angiogenesis adalah 3-hydroxyflavone, 3’,4’-dihydroxyflavone,
2’3’-dihydroxyflavone, fisetin dan morin. Senyawa golongan alkaloid seperti
pterogynidine yang diisolasi dari Alchornea glandulosa juga memiliki aktivitas
NFκB (Park, Cho, Jun, Ryu, Kim, Yu et al, 2010; Lopes, Rocha, Pirraco,
Regasini, Silva, Bolzani, et al., 2009).
F. Chorioallantoic Membrane
Chorioallantoic membrane adalah membran ekstraembrionik yang
berasal dari perpaduan lapisan mesodermal alantois dengan lapisan mesodermal
korio yang berdampingan. Chorioallantoic membrane dari embrio ayam kaya
akan pembuluh darah, yang menyerupai jaringan endometrium pada uterus.
Ketika chorioallantoic membrane tervaskularisasi dengan tinggi, chorioallantoic
membrane menjadi media yang cocok / baik untuk propagansi virus dan
mikroorganisme yang lain (Gajovic and Gruss, 1988; Ribbati, Bertossi, Nico,
Vacca, Ria, Riva et al., 1998).
Chorioallantoic membrane muncul pada hari ke-4 atau ke-5 diikuti
pertumbuhan pembuluh darah yang meluas diatas permukaan kuning telur dan
segera menutup seluruh daerah tersebut. Membran yang sangat kaya dengan
pembuluh darah ini berhubungan dengan sirkulasi embrionik melalui arteri dan
vena allantoic. Melalui sirkulasi ini berlangsung pertukaran oksigen dan
karbondioksida yang dibutuhkan oleh embrio. Selain berfungsi sebagai sistem
sirkulasi, membran ini juga berfungsi sebagai tempat pembuangan dan pencernaan
dan juga bertanggung jawab terhadap perkembangan embrio. Chorioallantoic
membrane adalah tempat yang cocok untuk transplantasi jaringan karena sistem
imun embrio ayam belum sepenuhnya berkembang dan reaksi penolakan benda
membrane embrio ayam dapat digunakan sebagai metode untuk mempelajari
respon angiogenesis terhadap implan jaringan tumor (Folkman, 1971; Knighton,
Ausprunk, Folkman, and Tapper, 1977; Patten, 1978; Shepro, 2006; Storer,
Stebins, Usinger, and Nybakker, 1979).
Uji angiogenesis dengan menggunakan chorioallantoic membrane dapat
dilakukan secara in vivo maupun in vitro. Metode lain yang dapat digunakan
sebagai uji angiogenesis dikelompokkan menjadi 3 jenis uji yaitu uji in vivo, uji in
vitro sel dan uji organotropik. Selain uji angiogenesis CAM, uji in vivo
angiogenesis yang lain yaitu Matrigel plug dan neovaskularisasi kornea. Uji in
vitro sel dilakukan untuk mengukur proliferatif sel, migrasi sel, dan pembentukan
tube. Uji in vitro menghasilkan informasi kritikal dan merupakan langkah awal
esensial untuk validasi. Uji organotropik yang digunakan untuk uji angiogenesis
yaitu dengan menggunakan cincin aorta dari tikus atau anak ayam (Auerbach,
Lewis, Shinners, Kubai and Akhtar, 2003).
G.Uji Angiogenesis Chick Chorioallantoic Membrane (CAM)
Uji Chick Chorioallantoic Membrane (CAM) merupakan metode dengan
sistem yang sederhana untuk mempelajari angiogenesis in vivo. Uji CAM sudah
banyak digunakan untuk studi angiogenesis dan invasi tumor dari kanker
kolorektal, prostat, otak dan rahim. Pembuluh darah pada chorioallantoic
membrane ayam berbeda dengan pembuluh darah pada kanker. Pada kanker
struktur anatomi mikroskopik pembuluh darahnya mudah rapuh sedangkan pada
permeabilitasnya normal. Model angiogenesis pada chorioallantoic membrane
embrio ayam secara teknik lebih mudah dan murah untuk sampel dalam jumlah
besar pada screening bahan alam yang berpotensi sebagai antiangiogenik.
Aplikasi CAM hanya membutuhkan alat-alat yang murah, dan memungkinkan uji
dapat dilakukan di laboratorium manapun. Selain itu, sistem yang sangat fleksibel,
mengakomodasi sistem kompleks seperti sel dan jaringan. Kelemahan dari CAM
yaitu tidak memungkinkan untuk manipulasi genetik, serial imaging dan
intervensi sistemik yang memungkinkan studi terkontrol neovaskularisasi dalam
pengaturan fisiologis yang kompleks (Mustafida, Munawir dan Dewi, 2014;
Staton, Lewis and Bicknell, 2006; Lokman, Elder, Ricciardelli, and Oehler,
2012).
H.Landasan Teori
Angiogenesis adalah proses pertumbuhan pembuluh darah baru dari
pembuluh yang sudah ada. Angiogenesis berperan penting dalam proses
pertumbuhan sel kanker. Berdasarkan pernyataan tersebut bila proses
angiogenesis sel kanker dihambat kemungkinan sel kanker lambat laun akan mati,
sehingga inhibitor angiogenesis dapat digunakan sebagai obat untuk pengobatan
kanker. Beberapa senyawa inhibitor angiogenesis berasal dari senyawa bioaktif
tumbuhan.
Berdasarkan hasil uji angiogenesis dengan metode rat aortic yang
dilakukan Ali Jimale Mohammed dan kawan-kawan (2012), ekstrak metanol daun
penyari petroleum eter, kloroform, dan air. Dalam penelitian tersebut juga
diketahui bahwa senyawa polifenol merupakan senyawa yang dominan terdapat
dalam ekstrak metanol daun senggugu. Kemungkinan senyawa polifenol yang
berperan dalam aktivitas antiangiogenesis dari ekstrak metanol daun senggugu.
Banyak senyawa dari produk alam sudah terbukti memiliki aktivitas
antiangiogenesis melalui berbagai penelitian salah satunya senyawa golongan
flavonoid. Flavonoid merupakan salah satu jenis dari polifenol. Senyawa
golongan flavonoid yang terkandung pada daun senggugu, beberapa diantaranya
adalah hispidulin, luteolin, dan apigenin. Menurut penelitian He Lijun dan
kawan-kawan pada tahun 2010 menunjukkan hispidulin yang dapat ditemukan pada
ekstrak Artemisia vestita memiliki aktivitas antiangiogenesis tumor pankreas
manusia dan pertumbuhan tumor. Hispidulin dapat menghambat angiogensis
dengan cara mentarget jalur sinyal VEGFR2 yang dimediasi P13K/Akt/mTOR.
Ekstrak luteolin dari Platycodon grandiflorum terbukti memiliki aktivitas
antiangiogenesis. Aktivitas antiangiogenesis dari luteolin diduga berkaitan dengan
aktivitas antioksidannya. Luteolin bekerja dengan cara memblok produksi
Reactive Oxygen Species (ROS) sehingga menekan ekspresi VEGF dan efek
proangiogenik dari VEGF.
Seperti hispidulin dan luteolin, apigenin juga memiliki aktivitas
antiangiogenesis. Menurut penelitian Jing Fang dan kawan-kawan pada tahun
2004, apigenin memiliki aktivitas antiangiogenesis dengan cara menghambat tube
formation yang dibuktikan melalui uji Human Umbilical Vein Endothelial Cells
apigenin atau senyawa polifenol lainnya dalam ekstrak metanol daun senggugu
juga memiliki aktivitas antiangiogenesis. Aktivitas antiangiogenesis ini dapat diuji
dengan metode CAM. Metode CAM adalah metode untuk uji angiogenesis
dengan sistem yang sederhana. (Fang, et al., 2004; He et al, 2010; Mohamed et
al., 2012; Park, et al, 2010).
I. Hipotesis
1. Ekstrak metanol daun senggugu memiliki aktivitas antiangiogenesis pada
chorioallantoicmembrane embrio ayam yang diinduksi bFGF.
2. Terdapat kekerabatan antara konsentrasi ekstrak metanol daun senggugu
dengan aktivitas antiangiogenesis pada chorioallantoic membrane embrio
23
BAB III
METODOLOGI PENELITIAN
A.Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental murni dengan
rancangan lengkap pola searah. Jenis penelitian yang dilakukan termasuk jenis
penelitian eksperimental murni yaitu dengan melakukan percobaan pada
kelompok perlakuan dan dibandingkan dengan kelompok kontrol. Rancangan
penelitian ini menggunakan rancangan lengkap pola searah. Penelitian ini
dilakukan secara lengkap yaitu terdapat kontrol negatif, kontrol positif dan
kelompok perlakuan. Pola searah yaitu dengan memberikan perlakuan yang sama
dengan kelompok perlakuan. Penelitian ini dilakukan di Laboratorium
Farmakognosi-Fitokimia dan Laboratorium Teknologi dan Formulasi Steril
Fakultas Farmasi Universitas Sanata Dharma serta Laboratorium Mikrobiologi
Fakultas Kedokteran Hewan Universitas Gadjah Mada.
B.Variabel dan Definisi Operasional 1. Variabel
a. Variabel bebas berupa konsentrasi ekstrak daun senggugu.
c. Variabel pengacau terkendali berupa tempat tumbuh tanaman, cara panen,
cara pengeringan dan pembuatan simplisia, dan jumlah (gram) daun segar
yang digunakan.
d. Variabel pengacau tak terkendali berupa cuaca, musim, dan kelembaban
ruangan.
2. Definisi Operasional
a. Pembuluh darah baru adalah pembuluh darah yang tipis yang keluar dari
pembuluh darah utama.
C.Bahan Penelitian
Bahan-bahan yang digunakan antara lain : daun senggugu,
Chorioallantoic Membrane (CAM) yang berasal dari telur ayam berembrio dalam
kondisi terinkubasi, larutan basic Fibroblast Growth Factor (bFGF), Phosphate
Buffered Saline (PBS), Dimethyl Sulfoxide (DMSO), aquadest steril, aquabidest
steril, etanol 70%, iodin povidon, kertas payung, kapas, cotton buds, paper disc
berisi ampisilin, metanol, kertas Whatman filter, plat KLT silika gel 60 F 254,
butanol, asam asetat, air, standar rutin, asam klorida 4 N, dietileter, gas nitrogen,
dan uap amoniak.
D.Alat Penelitian
Alat-alat yang digunakan pada penelitian ini antara lain : oven, ayakan,
spektrofotometer Ultra Violet (UV), bejana, Laminar Air Flow (LAF), autoklaf,
mikropipet, inkubator, lampu spiritus, korek api, teropong telur, mini drill,
gunting bengkok, gunting bedah, penyedot udara, pinset, scalpel, kamera, kaca
pembesar dan alat-alat gelas.
E.Tata Cara Penelitian 1. Determinasi Tanaman
Determinasi tanaman dilakukan di Laboratorium Sistematika Tumbuhan,
Fakultas Biologi Universitas Gadjah Mada (UGM). Untuk membuktikan bahwa
tanaman yang digunakan untuk penelitian adalah tanaman senggugu
(Clerodendrum serratum L.).
2. Preparasi Ekstrak Metanol Daun Senggugu
Daun senggugu diperoleh dari Kebun Obat Universitas Sanata Dharma.
Daun senggugu dipanen pada bulan Januari 2014. Daun senggugu yang telah
dikumpulkan, kemudian dibersihkan dengan air mengalir. Setelah itu daun
senggugu dikeringkan dengan cara dijemur di bawah sinar matahari dengan
ditutup kain hitam untuk menghindari sinar matahari secara langsung.
Pengeringan daun senggugu dioptimalkan dengan dikeringkan dalam oven dengan
suhu terkontrol hingga daun sudah benar-benar kering (kadar air < 10%) dengan
ciri bila diremas bergemirisik dan berubah menjadi serpihan. Simplisia yang
kering kemudian digiling hingga menjadi serbuk halus dengan blender, kemudian
dituang dalam bejana maserasi. Kemudian ditambah metanol p.a. sebanyak 200
mL dan dicampur homogen. Campuran dimaserasi pada suhu ruangan selama 1
hari. Kemudian disaring dengan kertas Whatman filter dengan corong Buchner.
Hasil penyarian diuapkan pelarutnya menggunakan vaccum rotary evaporator
pada suhu 400C-500C. Hasil penyaringan filtrat diuapkan lagi dengan waterbath
hingga diperoleh ekstrak kental.
3. Uji Kromatografi Lapis Tipis (KLT)
Uji Kromatografi Lapis Tipis (KLT) dilakukan di Laboratorium
Penelitian dan Pengujian Terpadu Universitas Gadjah Mada (LPPT UGM).
Ekstrak kental ditimbang sebanyak 50 mg, kemudian dimasukkan ke dalam labu
dan ditambahkan 10 mL asam klorida 4 N. Larutan kemudian dihidrolisis atau
refluk dengan pendingin balik selama 30 menit, lalu didinginkan dan ekstraksi
dengan 5 mL dietileter. Fase dietileter diambil, lalu diuapkan dengan gas nitrogen.
Sampel dan pembanding rutin ditotolkan sebanyak 10 µL pada plat KLT silika gel
60 F 254 sebagai fase diam. Plat KLT kemudian dimasukkan ke dalam bejana
jenuh fase gerak butanol : asam asetat : air (3:1:1), dan dieluasikan hingga batas.
Setelah terelusi hingga batas plat dikeringkan. Hasil plat KLT yang diperoleh
diidentifikasi di bawah lampu UV (254 nm dan 366 nm) dan dideteksi dengan
4. Orientasi Kelarutan Ekstrak MetanolDaun Senggugu
Orientasi kelarutan ekstrak metanol daun senggugu dilakukan dengan
menggunakan pelarut DMSO. DMSO ditambahkan pada beberapa mg ekstrak
sampai ekstrak larut, kemudian diencerkan dengan aquabidest steril. Konsentrasi
DMSO yang digunakan adalah 0,2%.
5. Sterilisasi Alat
Alat-alat yang digunakan untuk uji antiangiogenesis dicuci bersih dan
dikeringkan kemudian dibungkus dengan kertas payung dan disterilkan dengan
pemanasan basah dalam autoklaf, suhu 121oC selama 15-30 menit.
6. Pembuatan Larutan Uji dan Larutan bFGF
a. Preparasi bFGF Sebagai Induktor Angiogenesis. bFGF yang digunakan
sebanyak 25 ng/µ L menggunakan larutan PBS pH 7,4 kemudian diencerkan
sehingga didapat kadar 1 ng/µ L. Preparasi bFGF ini dilakukan secara aseptis
di dalam Laminar Air Flow (LAF). Kadar bFGF yang diberikan untuk
setiap telur perlakuan terinduksi adalah 10 ng.
b. Preparasi Sediaan Larutan Uji. Ekstrak metanol daun senggugu dilarutkan
dengan DMSO – aquabidest steril kemudian dibuat seri konsentrasi (0,175,
0,35 dan 0,7 mg/mL). Konsentrasi pelarut (DMSO– aquabidest steril)
disesuaikan dengan hasil orientasi kelarutan ekstrak metanol daun
7. Uji Antiangiogenesis
Satu atau beberapa hari sebelum diberi perlakuan, telur diinkubasi dalam
inkubator laboratorium pada suhu 37oC agar dapat menyesuaikan diri dengan
lingkungan barunya. Telur ayam usia 9 hari diberikan diperlakuan. Tahap awal
perlakuan yaitu dengan membersihkan telur dari kotoran yang menempel di
cangkang telur menggunakan alkohol 70%. Telur diberi tanda pada kerabang telur
yang meliputi batas ruang udara, lokasi embrio dan daerah yang akan dibuat segi
empat (jendela) berukuran 1x1 cm di atas embrio menggunakan pensil. Lokasi
embrio diketahui melalui candling menggunakan cahaya lampu pada telur.
Kerabang telur pada bagian kutub yang mengandung ruang udara dan kerabang di
atas embrio dibersihkan dengan iodin povidon. Selanjutnya pada ruang udara
tersebut dibuat lubang kecil dan pada daerah yang dibuat segiempat (jendela)
dibuat luka dengan menggunakan mini drill dan scalpel.
Udara dari ruang udara disedot dengan penyedot udara sampai berpindah
dari kutub kerabang bagian atas telur. Perlakuan ini dilakukan dengan posisi telur
horizontal, di ruang gelap, dan melalui candling, sehingga ruang udara buatan
yang terbentuk di atas embrio dapat terlihat.
Kerabang telur di atas embrio dipotong dengan mini drill untuk
membuat lubang segiempat dengan luas 1x1 cm. Melalui lubang ini, paper disc
untuk setiap perlakuan diimplantasikan ke dalam telur. Subyek uji berupa telur
dibagi secara acak dalam 6 kelompok (masing-masing perlakuan terdiri dari 3
telur), sebagai berikut :
b. Kelompok II adalah kelompok pelarut dengan implantasi paper disc + pelarut
(DMSO – aquabidest steril).
c. Kelompok III kelompok kontrol bFGF + pelarut adalah kelompok telur dengan
implantasi paper disc termuati bFGF 10 ng + pelarut (DMSO – aquabidest
steril) sebanyak 10µ L.
d. Kelompok IV, V dan VI merupakan kelompok perlakuan yang digunakan
untuk melihat efek penghambatan ekstrak metanol daun senggugu dengan 3
variasi konsentrasi (0,175 ; 0,35 dan 0,7 mg/mL). Kelompok ini adalah
kelompok telur implantasi paper disc termuati bFGF 10 ng + larutan ekstrak
metanol daun senggugu dengan masing-masing konsentrasi sebanyak 10 µL.
Setelah diberi perlakuan implantasi paper disc sesuai kelompok
perlakuan, lubang kecil pada daerah kutub dan lubang segiempat ditutup dengan
parafin solidum yang dicairkan. Telur kemudian diinkubasi pada suhu 37oC
dengan kelembaban relatif 60% selama 3 hari atau 72 jam dengan inkubator,
kemudian telur dimasukkan ke dalam kulkas selama 24 jam. Telur dibuka (umur
13 hari) dengan cara menggunting cangkang telur menjadi dua bagian dimulai dari
cangkang yang dekat dengan rongga udara menggunakan gunting bedah secara
hati-hati agar tidak merusak chorioallantoic membrane telur, setelah itu
chorioallantoic membrane dibersihkan secara hati-hati dengan aquabidest steril.
Chorioallantoic membrane yang melekat pada bagian cangkang yang terdapat
paper disc diamati secara makroskopis. Pengamatan makroskopis dilakukan
secara langsung dan tidak langsung. Pengamatan makroskopis secara langsung
jumlah pembuluh darah baru yang terbentuk pada paper disc dan di sekitar paper
disc dan secara tidak langsung dengan foto kamera hasil CAM. Pembuluh darah
baru yang dihitung yaitu pembuluh darah tipis yang keluar dari pembuluh darah
utama. Pembuluh darah utama adalah pembuluh darah besar yang berada disekitar
paper disk. Pengamatan makroskopis ini dilakukan oleh empat orang pengamat.
F. Analisis Data
Data penelitian uji antiangiogenesis berupa banyaknya pembuluh darah
baru pada dan sekitar paper disc dianalisis dengan menghitung persentase
pertumbuhan pembuluh darah baru pada masing-masing konsentrasi ekstrak
metanol daun senggugu, rumusnya sebagai berikut:
a = jumlah pembuluh darah baru rata-rata konsentrasi ekstrak metanol daun
senggugu
b = jumlah pembuluh darah baru rata-rata kontrol bFGF
Data uji antiangiogenesis juga dianalisis secara statistik dengan uji one way anova
31
BAB IV
HASIL DAN PEMBAHASAN
A.Hasil Determinasi Tanaman
Determinasi dilakukan dengan tujuan memastikan kebenaran identitas
tanaman yang digunakan dalam penelitian sehingga menghindari terjadinya
kesalahan dalam pengambilan sampel. Berdasarkan hasil determinasi yang
dilakukan di Laboratorium Sistematika Tumbuhan, Fakultas Biologi Universitas
Gadjah Mada pada tanggal 6 Juni 2014 (Lampiran 1), telah dibuktikan bahwa
tanaman yang digunakan untuk penelitian adalah tanaman senggugu
(Clerodendrum serratum L.).
B.Hasil Pembuatan Ekstrak Metanol Daun Senggugu
Ekstrak dibuat dari daun senggugu yang dikeringkan kemudian diserbuk.
Daun senggugu dikeringkan dengan sinar matahari dan kemudian dioptimalkan
menggunakan oven dengan suhu terkontrol hingga daun sudah benar-benar
kering. Pengeringan tersebut bertujuan untuk mengurangi kandungan air yang
dapat menjadi media pertumbuhan yang baik untuk jamur dan mikroorganisme
lainnya. Selain itu tujuan dari pengeringan yaitu untuk menghentikan aktivitas
enzim yang bisa menguraikan kandungan zat aktif sehingga mutu dari simplisia
dapat dipertahankan, terjamin keawetannya, mudah disimpan dan juga untuk
memudahkan dalam pembuatan serbuk. Syarat pengeringan simplisia yaitu kadar
menjadi serpihan, tidak berjamur, berbau dan berasa khas menyerupai bahan
segarnya. Proses penyerbukan simplisia daun senggugu bertujuan untuk
memperkecil ukuran partikel sehingga luas permukaannya semakin besar. Luas
permukaan yang semakin besar akan mengoptimalkan kontak serbuk dengan
penyari sehingga proses penyarian lebih optimal (Endrasari, Qanytah dan Prayudi,
2011; Herawati, Nuraida, Sumarto, 2012).
Ekstraksi dilakukan dengan metode maserasi dan dengan penyari
metanol. Metode maserasi dipilih karena merupakan metode ekstraksi dingin
sehingga perubahan atau kerusakan senyawa dapat dihindari. Alasan pemilihan
penyari metanol, sebagai berikut:
1. Metanol merupakan pelarut universal dan viskositas metanol yang lebih
rendah dibanding etanol walupun memiliki polaritas yang hampir sama,
sehingga metanol dapat berpenetrasi ke dalam sel-sel tanaman dengan kuat.
2. Metanol memiliki konsistensi yang lebih encer menyebabkan metanol lebih
mudah berdifusi menembus sel-sel tanaman.
3. Metanol memiliki persentase OH yang lebih besar dibandingkan dengan etanol
sehingga daya penetrasinya kuat dan ekstraksinya lebih efektif.
4. Berdasarkan hasil uji angiogenesis dengan metode rat aortic dengan, ekstrak
metanol daun senggugu memiliki aktivitas anti-angiogenesis yang lebih besar
dibandingkan dengan ekstrak petroleum eter, kloroform, dan air daun senggugu
(Departemen Kesehatan RI, 2000; Mohamed et al., 2012; Pedricilli, 2001).
Saat proses maserasi berlangsung terjadi pemecahan dinding dan
sehingga metabolit sekunder yang berada dalam sitoplasma akan terlarut didalam
cairan penyari. Proses maserasi dibantu pengadukan dengan menggunakan alat
shaker selama 24 jam agar proses maserasi lebih efektif karena penyari lebih
banyak kontak langsung dengan sel-sel dalam daun senggugu dibandingkan jika
hanya didiamkan saja. Hasil penyarian diuapkan pelarutnya menggunakan vaccum
rotary evaporator pada suhu 400C-500C. Tujuan penggunaan vaccum rotary
evaporator pada suhu tersebut agar filtrat metanol yang akan diuapkan pelarutnya
tidak mengalami kontak dengan panas yang berlebihan sehingga kerusakan
senyawa-senyawa kimia yang terkandung dalam filtrat metanol dapat dihindari.
Sari yang didapat kemudian diuapkan lagi dengan waterbath hingga diperoleh
ekstrak kental. Bobot ekstrak kental daun senggugu yang didapat adalah 4,36
gram dan rendeman yang didapat adalah 8,72 %.
C.Hasil Uji Kromatografi Lapis Tipis
Tujuan dilakukannya uji Kromatografi Lapis Tipis (KLT) adalah untuk
membuktikan adanya senyawa flavonoid dalam ekstrak metanol daun senggugu.
Uji KLT dilakukan di Laboratorium Penelitian dan Pengujian Terpadu Universitas
Gadjah Mada (LPPT UGM). Fase diam yang digunakan adalah silika gel 60 F 254
dan fase gerak yang digunakan adalah butanol : asam asetat : air (3:1:1).
Pembanding flavonoid yang digunakan adalah standar rutin. Hasil yang diperoleh
diidentifikasi di bawah lampu UV (254 nm dan 366 nm) dan dideteksi dengan
pereaksi amoniak. Flavonoid akan menunjukkan pemadaman bercak pada UV 254
Setelah diuapi dengan uap amoniak akan memberikan warna kuning (Wagner and
Bladt, 1996; Harborne, 1987).
Pada lampiran 4 terlihat saat diamati pada sinar UV 254 terjadi
pemadaman pada standar rutin dan sampel ekstrak metanol daun senggugu. Saat
diamati pada sinar UV 366 bercak standar rutin dan sampel berfluoresensi
berwarna biru. Secara visibel terlihat adanya noda flavonoid berwarna kuning
pada bercak rutin dan sampel ekstrak metanol daun senggugu, dengan Rf.
flavonoid terdeteksi 0,81. Hal ini menunjukkan bahwa terdapat kandungan
flavonoid dalam ekstrak metanol daun senggugu.
D.Hasil Uji Antiangiogenesis
Penelitian ini menggunakan metode Chick Chorioallantoic Membrane
(CAM) untuk mengetahui aktivitas antiangiogenesis dari ekstrak metanol daun
senggugu. Penelitian ini merupakan penelitian in vivo, dengan media yang
digunakan yaitu chorioallatoic membrane telur ayam berembrio. Chorioallatoic
membrane telur ayam akan terbentuk banyak pembuluh darah baru, perubahan
pembuluh darah baru digunakan sebagai indikator angiogenesis baik berupa
pengurangan atau penambahan pembuluh darah baru. Induktor angiogenesis yang
digunakan adalah basic Fibroblast Growth Factor (bFGF) yang merupakan salah
satu faktor pro angiogenik. bFGF tersebut diinduksikan pada chorioallatoic
membrane telur ayam dengan tujuan memperjelas pengamatan efek angiogenesis
ekstrak pada chorioallantoic membrane. Mekanisme bFGF sebagai protein faktor
pembuluh darah jaringan sekitar yang telah ada sebelumnya melalui ikatannya
dengan reseptor FGF tirosin kinase atau reseptor Heparan Sulphate Proteoglycans
(HSPGs) di permukaan sel endotelial. Ikatan tersebut menyebabkan sel endotelial
teraktivasi dan menghasilkan enzim degradatif matrix metalloproteinases
(MMPs). Enzim ini dilepaskan dari endotelial dan menyebar disekitar sel. MMPs
mendegradasi matriks ekstraseluler dan menyebar ke jaringan sekitarnya. Sel
endotelial mulai membelah diri dan migrasi keluar ke ruang intestinal, kemudian
tumbuh dan berproliferasi melalui lubang hasil degradasi. Selanjutnya
pembentukan lumen, generasi membran basement baru dengan perekrutan dari
pericyte, kemudian pembentukan anastomosis dan akhirnya aliran darah
(Chrisnanto, 2014; Gupta and Qin, 2003; Kleinsmith, et al., 1999; Ribbati et al.,
1999).
Menurut penelitian Puspita dkk. (2008) dan penelitian Hamid dkk. (2013)
menunjukkan bahwa terjadi ekspresi VEGF pada sitoplasma sel yang diberi
induktor bFGF. Penghambatan proses angiogenesis dapat dilakukan dengan
penetralan salah satu faktor proangiogenik contohnya bFGF. Penetralan faktor
proangiogenik sudah cukup dapat mengganggu proses keseimbangan
angiogenesis (Hamid, Nazar dan Ratnani, 2013; Puspita, Ardiani, Fina,
Septisetyani dan Meiyanto, 2008; Ribbati, Vacca, Roncalli and Dammacco,
2000).
Telur ayam berembrio yang dipergunakan untuk uji respon angiogenesis
dapat dilakukan setelah terbentuknya chorioallatoic membrane pada hari ke-4 dan
berembrio umur 5-16 hari. Penelitian ini menggunakan telur berembrio yang
berumur 9 hari. Hal ini karena pada umur tersebut letak rongga udara lebih mudah
diamati dan pembuluh darahnya pun sudah lebih banyak dan lebih jelas. Selain itu
chorioallatoic membrane lebih mudah menempel pada cangkang telur (Knighton,
et al., 1977; Patten, 1978).
Penelitian ini menggunakan 6 kelompok perlakuan yaitu 3 kelompok
kontrol dan 3 kelompok perlakuan. Kelompok kontrol tersebut terdiri dari kontrol
blank, kontrol pelarut, kontrol bFGF + pelarut. Kelompok perlakuan terdiri dari
kelompok ekstrak metanol daun senggugu konsentrasi I (0,175 mg/mL),
konsentrasi II (0,35 mg/mL), dan konsentrasi III (0,7 mg/mL). Penentuan
konsentrasi larutan uji didasarkan IC50 ekstrak metanol daun senggugu dari
penelitian Thalla dkk. (2012) sebesar 0,35 mg/mL. IC50 ini dijadikan konsentrasi
tengah (0,35 mg/mL). Konsentrasi terbawah yang digunakan sebesar setengah dari
IC50 (0,175 mg/mL), sedangkan konsentrasi tertinggi yang digunakan sebesar dua
kali dari IC50 (0,7 mg/mL). Larutan uji (larutan ekstrak, bFGF dan pelarut) untuk
masing-masing kelompok dimasukkan dalam media berupa paper disc, dan
kemudian paper disc diimplantasikan ke dalam chorioallatoic membrane telur
ayam berembrio. Larutan ekstrak, bFGF dan pelarut tidak diinjeksikan langsung
ke telur, melainkan diimplantasikan pada paper disc. Tujuannya agar dapat
mengamati proses angiogenesis dengan mudah melalui pengamatan banyaknya
pembuluh darah baru yang keluar dari pembuluh darah utama yang berada di
Kontrol blank berfungsi untuk mengetahui jumlah pembuluh darah baru
normal yang ada pada chorioallantoic membrane embrio ayam. Kontrol blank
hanya berisikan paper disc saja. Kontrol pelarut berfungsi sebagai pembanding
untuk menentukan apakah pelarut ekstrak memiliki aktivitas antiangiogenesis.
Pelarut ekstrak yang digunakan dalam penelitian ini adalah dimethylsulfoxide
(DMSO) dan aquabidest. DMSO berfungsi sebagai co-solvent untuk membantu
aquabidest melarutkan ekstrak metanol daun senggugu. Menurut penelitian
Koizumi dkk. (2003) DMSO memiliki aktivitas antiinflamasi kemungkinan
dengan cara menghambat pembentukan pembuluh darah (antiangiogenesis) pada
jaringan inflamasi. Aktivitas antiangiogenesis DMSO melalui penghambatan
produksi MMP-2. DMSO juga bersifat toksik akut atau kronik yang rendah pada
hewan, maka DMSO yang digunakan harus seminimal mungkin namun juga harus
efektif melarutkan ekstrak metanol daun senggugu. Konsentrasi DMSO yang
digunakan untuk melarutkan ekstrak metanol daun senggugu sebesar 0,2 %.
Kontrol bFGF + pelarut berfungsi sebagai pembanding untuk menentukan apakah
ekstrak metanol daun senggugu memiliki aktivitas antiangiogenesis terhadap
chorioallantoic membrane yang diinduksi bFGF. (Gaylord Chemical Company,
2007; Koizumi, Tsutsumi, Yoshioka, Watanabe, Okamoto, Mukai, et al., 2003).
Telur diinkubasi dalam inkubator agar embrio dalam telur dapat tetap
hidup. Inkubator diatur pada suhu terkontrol 380C - 400C karena pada suhu
tersebut embrio telur ayam dapat tumbuh secara optimal. Setelah tiga hari telur
tersebut dimasukkan ke dalam kulkas selama 24 jam. Tujuan telur dimasukkan ke
kemudian dibuka dan pembuluh darah baru pada chorioallatoic membrane yang
melekat pada bagian cangkang yang terdapat paper disc diamati secara
makroskopis. Hasil dari uji antiangiogenesis ini adalah jumlah pembuluh darah
baru. Pembuluh darah baru yang dihitung berupa percabangan pembuluh darah
tipis yang keluar dari pembuluh darah utama. Pembuluh darah utama adalah
pembuluh darah besar yang berada disekitar paper disc. Pengamatan makroskopis
ini dilakukan oleh empat orang pengamat untuk mengurangi subjektivitas (Hamid,
Bijanti, Wahyuni, Maslachah dan Yuliani, 2011). Hasil pengamatan makroskopis
tercantum pada gambar 2 dan data hasil uji angiogenesis masing-masing