KIMIA ANORGANIK 1
I.
PENDAHULUAN
II. STRUKTUR ATOM
III. STRUKTUR MOLEKUL
IV. SISTEM PERIODIK UNSUR
V.
IKATAN KIMIA
VI. ASAM-BASA BRONSTED
VII. ASAM-BASA LEWIS
I. PENDAHULUAN
1. PERANAN MIPA MENUJU
MASYARAKAT AIL DAN MAKMUR
2. MIPA TAHUN PERTAMA DALAM PT
3. KIMIA DI LINGKUNGAN MIPA
4. PAKAH KIMIA ITU?
5. RUANG LINGKUP KIMIA
6. MATERI
1. PERANAN MIPA MENUJU MASYARAKAT ADIL-MAKMUR
KEMAKMURAN RAKYAT
KETEKNIKAN DAN
PERINDUSTRIAN KESEHATAN DSB PERTANIAN,
FISIKA MURNI
MIPA MURNI
PENGETAHUAN FISIKA
YANG LUAS DAN DALAM YANG LUAS DAN DALAM PENGETAHUAN MIPA
2. MIPA TAHUN PERTAMA DALAM
PENDIDIKAN TINGGI
MIPA KESEHATAN ILMU SOSIAL PERTANIAN KEBUMIAN LANDASAN MIPA TAHUN PERTMA3. KIMIA DI LINGKUNGAN MIPA MATEMATIKA KIMIA FISIKA BIOLOGI BIOKIMIA GEOLOGI GEOKIMIA HULU HILIR
4. APAKAH KIMIA ITU?
KIMIA
MEMPELAJARI SEGALA SESUATU TENTANG MATERI
STRUKTUR SIFAT REAKSI
IKATAN KIMIA TERMODINAMIKA KIKIA
KINETIKA KIMIA KIMIA FISIK
5. RUANG LINGKUP KIMIA
KIMIA
MATERIORGANIK ANORGANIK
KIMIA ORGANIK KIMIA ANORGANIK
6. APAKAH MATERI ITU
MATERI
APAKAH DAPAT DIPISAHKAN DENGAN PROSES FISIKA
TIDAK ZAT MURNI YA CAMPURAN
APAKAH DAPAT DIPISAHKAN MENJADI ZAT LEBIH
SEDERHANA
DENGAN PROSES KIMIA
APAKAH HOMOGEN ATAU TIDAK?
UNSUR SENYAWA CAMPURAN
HETEROGEN
II. STRUKTUR ATOM
1. PERKEMBANGAN TEORI ATOM
2. PARTIKEL PENYUSUN ATOM
1. PERKEMBANGAN TEORI ATOM
PAHAM ATOMISMUSDikemukakan oleh LEUKIPPOS (475 SM) dan DEMOKRITOS (460-380 SM)
Materi tersusun dari tak terhingga banyak partikel yang sangat kecil dan tidak dapat dibagi lagi yang disebut atom
Faham atomismus tidak berkembang karena pengaruh
ARISTOTELES (384-322SM) yang menganut:AJARAN 4 UNSUR Materi tersusun dari 4 unsur; tanah, air, udara dan api, yang berkaitan
dengan 4 sifat; panas, dingin, kering dan basah. GASSENSI (1592-1655, menentang ajaran ARISTOTELES
TEORI ATOM DALTON (1808) HIPOTESIS PROUT (1785-1850) Atom unsur-unsur tersusun dari
atom teringan = atom hidrogen panas kering
basah dingin api
udara tanah
Penemuan Elektron Oleh Thomson Model Atom Thomson (1897) Percobaan Hamburan Partikel α Model Atom Rutherford (1911) Pengamatan Spektrum Atom Hidrogen
Model Atom Bohr (1913)
Hipotesa De Broglie (1924)
Model Atom Mekanika Gelombang (1926)
2. PARTIKEL PENYUSUN ATOM
elektron Proton Neutron Penemu JJ. Thomson Eugene Golstein J. Chadwick
Tahun 1897 1915 1932 Lambang muatan relatif terhadap proton e- p+ n Muatan absolut 1- 1+ 0
3. MODEL ATOM
A. Teori Atom Dalton
1. Partikel penyusun materi tidak dapat
dibelah/ diubah menjadi partikel lain adalah
atom.
2. Atom tidak dapat dimusnahkan.
3. Atom suatu unsur adalah sama dan
mempunyai berat yang sama.
4. Atom unsur yang berbeda mempunyai berat
yang berbeda.
5. Perubahan kimia yang terjadi karena
penggabungan dan pemisahan atom.
B. Model Atom J.J. Thomson Atom-atom dalam unsur
unsur kimia yang membentuk
masing-masing kumpulan partikel pokok berasal
dari jenis yang sama disebut zarah yang sekarang dikenal dengan
nama elektron. Elektron ini bermuatan negatif =
bintik-bintik listrik negatif.
C. Model Atom Rutherford 1. Atom harus terdiri atas
inti dimana uatan positif dan massa atom
dipusatkan, dan Elektron beredar disekeliling inti. 2. Jari-jari atom 10 –8 cm 3. Jari-jari inti 10 –13 cm.
So: bagian besar atom adalah ruang kosong.
D. Model Atom Bohr
1. Atom H terdiri atas inti yang mengandung satu proton (bermuatan e), dan satu elektron (bermuatan e) yang
beredar di sekeliling inti melalui lintasan berbentuk lingkaran berjari-jari r.
2. Tidak sebarang berbentuk lintasan berbentuk lingkaran boleh dilalui elektron. Hanya lintasan yang menghasilkan momentum sudut elektron (mvr) yang merupakan kelipatan bulat h/2 boleh dilalui elektron. nvr = n h/2
n = 1, 2, 3, ... = bilangan kuantum
3. Karena momentum sudut suatu lintasan dibatasi, energi
elektron dalam suatu lintasan adalah tertentu. Selama elektron menempati suatu lintasan, elektron itu tidak menyerap atau
melepaskan energi.
4. Perpindahan elektron dari satu lintasan ke lintasan lain hanya dapat terjadi apabila elektron itu menyerap atau melepaskan energi sebesar selisih energi kedua lintasan itu.Apabila energi dilepaskan dalam bentuk cahaya, frekuensi cahaya tersebut adalah; V = E2-E1/h
E. Model Atom Mekanika Gelombang
Efek fotolistrik Radiasi benda hitam (Cahaya bersifat partikel)
Cahaya bersifat dualistis
Gelombang bersifat dualistis yaitu sebagai gelombang dan sebagai partikel
DE BROGLIE (1924):
Partikel bermassa m yang bergerak dengan kecepatan v selalu disertai
gelombang dengan panjang gelombang : = h/mv
Elektron dalam atom bersifat gelombang partikel elektron dalam atom harus
III. STRUKTUR MOLEKUL
1. BENTUK MOLEKUL
2. IKATAN PASANGAN ELEKTRON
3. BENTUK MOLEKUL DAN TEORI
1. BENTUK MOLEKUL
A. Molekul Linier (garis lurus)
B. Molekul Triangular (sudut segitiga)
yang rata (satu bidang)
C. Molekul Tetrahedron
D. Molekul bipiramid yang trigonal
E. Molekul Oktahedron
180o
120o
109,5
2. IKATAN PASANGAN ELEKTRON
A. Struktur Lewis
Lewis : setiap pasang elektron yang terikat
dalam ikatan terletak diantara 2 atom dan
digunakan bersama oleh kedua atom
tersebut (ikatan kovalen).
Lone pair = pasangan elektron valensi suatu
atom yang tidak digunakan bersama. Secara
langsung tidak memberi kontribusi untuk
ikatan, tetapi mempengaruhi bentuk suatu
molekul dan sifat-sifat kimianya.
B. Aturan Oktet
Setiap atom terus berupaya membentuk penggunaan bersama elektron sampai kulit valensinya berisi delapan elektron.
Membuat struktur Lewis:
• Tentukan berapa banyak elektron yang akan berada dalam struktur dengan cara menjumlahkan semua elektron valensi yang dimiliki semua atom.
• Tuliskan simbol kimia atom-atom dalam suatu susunan yang memperlihatkan atom-atom mana yang saling berikatan. Biasanya kita telah tahu susunannya atau kita dapat menebak. Sebagai contoh; unsur yang kurang elektronegatif biasanya adalah atom pusat suatu molekul, seperti pada CO2, SO42-, PCl
5.
• Distribusikan elektron dalam pasangan-pasangan sedemikian rupa sehingga terdapat satu pasang elektron diantara dua atom yang terikat bersama, selanjutnya letakkan pasangan-pasangan elektron (membentuk ikatan rangkap ataupun lone pair) sampai setiap atom memiliki oktet.
3. BENTUK MOLEKUL DAN TEORI VSEPR
Bentuk deskripsi Bentuk Contoh
Linier HCN, CO2 Angular H2O, O3, NO2- Trigonal planar BF3, SO3, NO3-, CO 32- Trigonal piramid NH3, SO32- Tetrahedral CH4, SO42-, NSF 3
Square planar XeF4
Square piramid Sb(Ph)5
Trigonal bipiramid PCl5(g), SOF4
Oktahedral SF6, PCl6-, IO(OH) 5
IV. SISTEM PERIODIK UNSUR
1. PERKEMBANGAN SISTEM PERIODIK
UNSUR
2. SISTEM PERIODIK MODERN
3. HUBUNGAN SISTEM PERIODIK
UNSUR DENGAN KONFIGURASI
ELEKTRON
4. CARA PENULISAN KONFIGURASI
ELEKTRON
1. PERKEMBANGAN SISTEM PERIODIK
UNSUR
Tujuan untuk mempermudah peramalan sifat sifat suatu unsur dan mencari hubungan sifat antara unsur yang
satu dengan unsur lainnya.
A. Ilmuan Arab dan Persia (Abad Pertengahan).
mengolompokkan zat-zat menjadi lugham (ligam) dan
laisa lugham (nonlogam) perbandingan kadar Hg dan S
dalam masing-masing zat.
Ilmuan ini menyatakan Fe dapat berubah menjadi Au
timbul kegiatan ilmiah dan eksperimen untuk mensitesa zat-zat baru. Penelitian bertujuan memperoleh emas, akan tetapi yang ditemukan adalah zat-zat baru yang lebih berharga dari emas seperti P, arsen, bismuth, antimon, alkohol, boraks, kamper, soda, sabun, dan asam-asam. Penemuan ini merupakan revolusi besar dalam eksperimen ilmu kimia.
B. Antonie Laurent Lavoisier (1743-1794) Antonie Laurent Lavoisier mengolompokkan unsur-unsur dalam empat kolompok yaitu;
1. Kelompok unsur umum. Kelompok ini terdiri atas cahaya, kalor, oksigen, azote (nitrogen), dan
hidrogen.
2. Kelompok unsur nonlogam. Kelompok ini terdiri
atas belerang, karbon, fosfor, muriat, fluorat dan borak.
3. Kelompok unsur logam. Kelompok ini terdiri atas antimon, perak, arsen, bismuth, kobalt, tembaga, besi, mangan, raksa, molibdan, nikel, emas,
platina, timbal, wolfram, dan seng.
4. Kelompok unsur tanah. Kelompok ini terdiri atas kapur, magnesia, barit, aluminium, dan silikon.
C. Triade Döbereiner
1. Johan Wolfgang Döbereiner merupakan
orang pertama yang menemukan hubungan
antara sifat unsur dan massa atom.
2. Johan Wolfgang Döberiner membagi
unsur-unsur yang mempunyai persamaan sifat dalam
kelompok yang disebut Triade (terdiri dari
tiga anggota). Ternyata massa atom unsur
yang di tengah merupakan setengah jumlah
massa unsur pertama dan ketiga.
D. Hukum Oktaf Newland (1863)
1. Hukum ini merupakan awal mulanya
penggolongan unsur untuk masa berikutnya.
2. Jika unsur-unsur disusun menurut kenaikan
massa atomnya, maka sifat-sifat unsur
tersebut akan berulang pada unsur
kedelapan dan kelipatannya, sehingga sifat
unsur kedelapan sama dengan unsur pertama
dan seterusnya.
3. Hukum ini mempunyai kelemahan yaitu;
pengulangan oktaf hanya cocok untuk unsur
yang massa atomnya kecil.
E. Sistem Periodik Mendeleyev
1. Mendeleyev; unsur-unsur menunjukkan
sifat periodik jika diurut berdasarkan
massa atomnya.
2. Bersamaan dgn Mendeleyev, Lothaar
Meyer di Jerman
jika unsur disusun
atas Ar -nya, beberapa sifat fisika
unsur akan bertambah sp mencapai
harga maks secara periodik
SP Mendeleyev memiliki kelebihan dibandingkan
dengan sistem periodik Meyer yaitu;
• Selain sifat fisika, Mendeleyev menggunakan
sifat kimia dalam menyusun unsur-unsur.
• Mendeleyev berani menukar letak beberapa
unsur
dalam
sistem
periodik
untuk
mempertahankan kemiripan sifat periodik.
• Mendeleyev mengoreksi beberapa harga massa
atom unsur seperti indium dari 76 menjadi 113.
• Mendeleyev tidak ragu-ragu mengosongkan
beberapa tempat dalam sistem periodik untuk
menempatkan unsur-unsur yang saat itu belum
diketemukan.
• Unsur gas mulia yg ditemukan thn 1890-1900
dpt diletakkan dalam sp Mendeleyev tanpa
mengubah susunan unsur yg telah ada
sebelumnya
Sistem periodik Mendeleyev masih memiliki
kekurangan;
1. Panjang periode tidak sama. Beberapa urutan unsur terbalik jika ditinjau menurut urutan bertambahnya massa atom relatif/berat atom.
2. Triade besi (Fe,Co,Ni), triade platina ringan (Ru, Rh, Pd), dan triade platina (Os, Ir, Pt), dimasukkan ke dalam golongan VIII. Unsur-unsur golongan ini tidak sesuai karena hanya Ru dan Os yang memiliki valensi 8.
3. Selisih Ar antara dua unsur yg berurutan tidak teratur (berkisar antara –1 dan +4) sehingga sulit untuk meramalkan unsur-unsur yang belum ditemukan.
4. Perubahan sifat elektronegatif unsur melalui sifat lamban (inert) dari gas mulia ke sifat elektropositip tidak dapat dijelaskan dengan bertambahnya Ar.
5. Unsur Lantanida yang terdiri dr 14 unsur
satu golongan.
6. Valensi unsur yg lebih dr 1 valensi sukar
diramalkan kedudukannya dalam sp.
7. Sifat anomali unsur pertama setiap golongan
tidak ada hubungannya dengan Ar.
8. Jika daftar disusun berdasarkan Ar, isotop
dr unsur yg sama hrs dlm golongan yg beda,
sedangkan isobar hrs 1 golongan.
9. Dr kelemahan dan kelebihan sp Mendeleyev,
awal abad ke-20 dibuat suatu sp modern.
2. SISTEM PERIODIK MODERN
Kimia
Struktur materi Sifat materi reaksi materi
Sifat unsur
System klasifikasi unsur
3. HUBUNGAN SISTEM PERIODIK UNSUR DENGAN KONFIGURASI ELEKTRON
Ada tiga aturan yang mendasari pengisian konfigurasi elektron pada atom-atom;
Asas Aufbau; orbital atom terisi elektron sesuai dengan energi relatifnya ; orbital dengan energi lebih rendah terisi elektron lebih dulu.
Asas Eksklusi Pauli; dalam suatu atom tidak boleh ada 2 elektron yang memiliki keempat bilangan kuantum sama.
Kaidah Hund; pada pengisian orbital setingkat, elektron terisi satu persatu dahulu kemudian setelah orbital terisi setengah penuh kemudian boleh berpasangan.
l = 0 1 2 3 n = 1 2 3 4 5 6 7 2s 3s 1s 4d 5d 4p 7s 5p 6s 5f 5s 4s 3p 7p 6p 2p 3d 6d 4f Untuk dapat menerapkan ketiga aturan tersebut pada penulisan konfigurasi elektron semua unsur diperlukan “mnemonic”, sekedar cara untuk
mengingat urutan
energi orbital, sebagai berikut;
4. CARA PENULISAN KONFIGURASI ELEKTRON Bagaimana menuliskan konfigurasi elektronik unsur? a. Berurutan sesuai urutan bilangan kuantum utama,
26Fe : 1s2 2s2 2p6 3s2 3p6 3d6 4s2
b. Berurutan sesuai “mnemonic”
26Fe : 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Sebaiknya Berurutan sesuai urutan bilangan kuantum utama!
a. Kemudahan membaca
b. Tidak ada urutan energi orbital yang berlaku untuk semua unsur
c. Kemudahan menerangkan kemiripan sifat unsur. d. Kemudahan menerangkan pembentukan ion positif
Sifat umum sistem periodik unsur
a. Jari-jari atom
b. Energi ionisasi; Jumlah energi yang
dibutuhkan untuk melepaskan elektron
c. Affinitas elektron; Energi yang dibebaskan
pada proses penangkapan elektron oleh
suatu atom dalam keadaan gas
d. Elektronegativitas; Kempuan atom suatu
unsur didalam suatu molekul untuk menarik
elektron dibandingkan dengan unsur lainnya
5. BEBERAPA SIFAT PERIODIK UNSUR
DARI TABEL SISTEM PERIODIK DIPEROLEH HAL-HAL SEBAGAI BERIKUT;
Dari kiri ke kanan;
1. Sifat logam makin berkurang, dan sifat non logam semakin bertambah.
2. Volume molar atom berkurang. 3. Titik leleh dan titik didih
bertambah.
4. Jari-jari atom semakin kecil. 5. Affinitas bertambah.
6. Energi ionisasi bertambah. 7. Keelektronegatifan
bertambah.
8. Keasaman makin besar, sifat basa semakin kecil.
Dari atas ke bawah
1. Sifat logam makin bertambah. 2. Volume molar atom
bertambah.
3. Titik leleh dan titik didih bertambah, kecuali pada
golongan alkali titik didih dan titik leleh berkurang.
4. Jari-jari atom semakin besar. 5. Affinitas berkurang.
6. Energi ionisasi berkurang.
7. Keelektronegatifan berkurang. 8. Keasaman makin kecil, sifat
V. IKATAN KIMIA
1. PERANAN ELEKTRON DALAM
IKATAN KIMIA
2. IKATAN ION
3. IKATAN KOVALEN
4. IKATAN LOGAM
1. PERANAN ELEKTRON DALAM IKATAN
KIMIA
a. Stuktur elektron yang stabil a/ yang
mempunyai 8 elektron di kulit terluar
(teori duplet oktet)
b. Untuk mencapai struktur atom yang
stabil, maka ada atom yang cenderung
melepaskan elektron dan ada yang
cenderung menangkap elektron.
c. Teori duplet dan oktet mempunyai
kelemahan
1) Tdk berlaku pada senyawa BCl
3 danPCl
5
,
2) jumlah ikatan kovalen yg dapat dibentuk
oleh suatu unsur bergantung pada jumlah
elektron yg tidak berpasangan dlm unsur
tersebut.
3) Unsur gas mulia tdk dpt membentuk
ikatan karena sudah dikelilingi 8 elektron
2. IKATAN ION
a. Terjadinya ikatan karena salah satu
atau lebih elektron ditransfer dari
kulit valensi suatu atom ke kulit
valensi atom yang lain.
b. Kation adalah atom yang melepaskan
elektron menjadi ion positif. Anion
adalah atom yang menangkap elektron
menjadi ion negatif.
c. Ikatan ion hanya dapat terjadi antara;
1) Unsur-unsur yang mempunyai potensial ionsasi rendah dengan unsur-unsur yang mempunyai afinitas elektron tinggi.
2) Unsur-unsur yang elektronegativitasnya rendah dengan unsur-unsur yang elektronegativitasnya tinggi.
3) Unsur-unsur yang dalam sistem periodik terletak di sebelah kiri dengan unsur-unsur yang dalam sistem periodik terletak di sebelah kanan.
4) Atom yang cenderung melepaskan elektron (atom logam) dengan atom yang cenderung menangkap elektron (atom non logam).
d. Sifat-Sitat Ikatan Ion
1) Senyawa-senyawa ion dalam keadaan padat tidak tersusun dari molekul, tetapi tersusun dari ion-ion.
2) Larutannya bersifat elektrolit. Dalam keadaan cair atau dalam pelarut polar, seperti air dan amonia cair,
senyawa ion terpecah menjadi ion-ion yang dapat
menghantar aliran listrik disertai dengan oksidasi dan reduksi.
3) Titik Iebur dan titik didih larutan tinggi karena untuk memecah gaya tarik antar ion sangat besar.
4) Berupa zat padat yang keras karena gaya-gaya antar ion sangat kuat.
5) Mudah larut dalam pelarut polar (bersifat ion), misalnya larutan NaCI dalam air dan yang mempunyai ketetapan dielektrikum tinggi.
6) Tidak larut dalam pelarut nonpolar (pelarut organik, alkohol),
Sifat senyawa ionik ditentukan juga oleh jari-jari ion,
bilangan oksidasi ion-ionnya, dan konfigurasi elektron ion-ionnya
Pembentukan Ikatan Ion
a. Ion Negatif
Ion negatif sederhana mempunyai
susunan elektron gas mulia
b. Ion Positif
Ion positif dapat mempunyai susunan
yang berbeda-beda bergantung jenis
logamnya.
Kossel (1916) menemukan bahwa
unsur-unsur sebelum gas mulia mudah
membentuk ion negatif (elektronegatif),
sedangkan unsur-unsur sesudah gas
mulia membentuk ion positif
(elektopositif)
3. IKATAN KOVALEN
Ikatan kovalen terjadi antara nonlogam
yang bergabung dengan nonlogam.
Ikatan kovalen merupakan pemakaian
bersama elektron oleh dua atom
sehingga masing-masing atom yang
membentuk ikatan kovalen memperoleh
konfigurasi elektron gas mulia. Cara ini
merupakan salah satu upaya untuk
merendahkan energi. Nama lain
ikatan
homopolar.
a. Sifat umum senyawa yang
berikatan kovalen
1. Umumnya berupa gas atau zat cair
yang mudah menguap.
2. Medan listrik yang ditimbulkan oleh
molekul ini adalah nol atau sangat
kecil.
3. Senyawa kovalen umumnya larut dalam
air.
b. Jenis-jenis Ikatan Kovalen
Ikatan kovalen berdasarkan jumlah pasangan
elektron yang digunakan bersama.
1. Ikatan Kovalen Tunggal (Single Covalent Bond)
2. Ikatan Kovalen Rangkap Dua (Double Covalent
Bond)
3. Ikatan Kovalen Rangkap Tiga (Triple Covalent
Bond)
Macam ikatan kovalen berdasarkan
letak pasangan elektron yang dipakai
bersama
1. Ikatan Kovalen Polar (Polar Covalent
Bonding)
2. Ikatan kovalen Non Polar (Polar
NonCovalent Bonding)
4. IKATAN LOGAM
a. Ikatan logam adalah gaya tarik menarik antara dua ion logam yang positif dan elektron terdelokalisasi diantara ion-ion tersebut.
b. Elektron valensi logam tidak erat terikat
c. Kekuatan ikatan logam akan bertambah jika;
1) Jumlah elektron dalam sistem terdelokalisasi bertambah
2) Ukuran pusat atom yang merupakan satuan struktur logam bertambah kecil.
d. Logam alkali sangat lemah/lunak dan titik lelehnya rendah karena hanya 1 elektron valensinya
e. Logam transisi keras dan titik leleh tinggi karena punya beberapa elektron valensi.
5. IKATAN LAIN
a. Ikatan Hidrogen
Ikatan hidrogen adalah ikatan antar molekul senyawa hidrogen yang disebabkan oleh gaya tarik menarik atom hidrogen dari molekul yang satu dengan atom lain yang sangat elektronegatif. Atom-atom H yang terikat pada N, O dan F menempatkan diri diantara atom-atom unsur itu dan menghassilkan gaya tarik menarik menjembatani unsur-unsur yang elektronegatif itu membentuk ikatan hidrogen.
Adanya ikatan hidrogen dalam senyawa menimbulkan penyimpangan sifat beberapa senyawa dari unsun-unsur segolongan.
b. Ikatan Hibrida
Suatu ikatan yang terjadi sebagai akibat
penggabungan orbital-orbital dari dua jenis
subkulit atau lebih dinamakan ikatan hibrida.
c. Ikatan Van Der Waals
Dalam beberapa penelitian tentang gas ideal,
gas mulia, serta beberapa gas yang
mempunyai struktur molekul sederhana, Van
der Waals, seorang ahli fisika Belanda
menemukan bahwa ada gaya kohesi antara
molekul-molekul nonpolar. Gaya kohesi ini
sangat lemah, lebih lemah dari ikatan kovalen
dan ikatan ion.
VI. ASAM BASA BRONSED
1. PROTON DALAM AIR
2. KESETIMBANGAN ASAM DALAM
AIR
3. FAKTOR YANG MEMPENGARUHI
KEKUATAN ASAM
HF(g) + H2O → H3O+ (aq) + F-(aq) asam Bronsted HF(g) + NH3(aq) → NH4+ (aq) + F-(aq) basa Bronsted
• Asam = zat yang bertindak sebagai donor proton → asam Bronsted
• Basa = zat yang bertindak sebagai akseptor proton → basa Bronsted
• Defenisi ini tidak memberi ketentuan pada lingkungan apa terjadi transfer proton hingga dapat diaplikasikan baik pada fase gas maupun pada fase larutan dalam
sembarang pelarut.
• Sehingga air bisa bertindak sebagai asam maupun basa bronsted.
H2O(l) + NH3(aq) → NH4+
(aq) + OH-(aq)
H2O(l) + H2S(aq) → H3O+
1. PROTON DALAM AIR
a. Ion Hidronium (H
3O
+)
Ion Hidronium (H
3O
+)
merupakan produk yang
terbentuk jika asam
mendonor proton pada
molekul air.
Analisis laju tranfer
proton memperlihatkan
bahwa ion hidronium dalam
air paling baik dinyatakan
dengan H
9O
4+.
O H H H H2O H2O H2O + (H9O4+)b. Mobilitas Ion-ion Hidrogen dalam Air
H
9O
4+bukan unit tetap/pasti dlm larutan
proton dapat berpindah dengan cepat dari
satu molekul H
2O ke molekul yang lain.
migrasi proton
merupakan suatu penataan
ulang atom-atomnya, proton berpindah dari
satu atom O ke atom O yang berikutnya
sepanjang ikatan hidrogen dan molekul yang
menerima proton berubah menjadi kation
+ O H H H O H H + O H H H O H H
2. KESETIMBANGAN ASAM DALAM AIR
a. Asam dan Basa Konjugat
HF
(g)+ H
2O
H
3O
+(aq)
+ F
-(aq)As.Bronsted bs Bronsted as.Bronsted bs.Bronsted
H
3O
+adalah as.konjugat dari H
2
O
F
-adalah basa konjugat dari HF
Karena tidak ada perbedaan mendasar
antara asam dan asam konjugat atau antara
basa dan basa konjugat, maka dapat pula
dikatakan bahwa HF adalah asam konjugat
dari F
-dan H
2
O adalah basa konjugat dari
b. Kekuatan asam Bronsted
Kekuatan asam Bronsted dapat dinyatakan
dengan konstanta keasaman (atau konstanta
ionisasi asam) Ka.
HA
(aq)+ H
2O
(l)
H
3O+
(aq)+ A
-(aq)
Harga a untuk air murni adalah 1
Jika ketepatan termodinamika tidak
diperlukan, atau jika konsentrasi sangat
rendah (kurang dari 1 mM, maka aktivitas
dapat digantikan dengan konsentrasi molar.
O] [H [HA] ] [A ] O [H 2 -3
a
a
a
a
Ka
[HA]
]
][A
O
[H
Ka
3
• Transfer proton dari air yang bertindak sbg
asam Bronsted digambarkan dengan konstanta
autoprotolisis (Kw) air;
H
2O
(l)+ H
2O
(l)
H
3O
+(aq)
+ OH
-(aq)• Karena konsentrasi molar dan konstanta asam
merupakan bilangan pangkat beberapa orde,
maka bila dubah kedalam bentuk logaritma,
maka; pH = - log [H
3O
+],
pKa = - log Ka
pKw = - log Kw
• Harga Kw naik dengan naiknya temperatur;
Kw = 1,008 x 10-14 pada 25C dan Kw = 5,48 pada 50C.]
OH
][
O
H
[
K
w
3 Keuntungan lain dlm menggunakan logaritma
yaitu hubungan simpel antara energi bebas Gibbs
suatu Rx. dengan konstanta kesetimbangan.
pada 25
C,
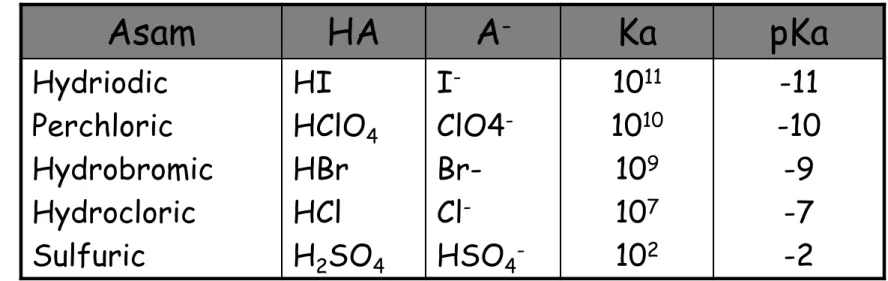
Tabel Konstannta Keasaman Beberapa Asam
pK . RT . 303 , 2 K ln RT G 1 mol . kJ . pK 71 , 5 G Asam HA A- Ka pKa Hydriodic Perchloric Hydrobromic Hydrocloric Sulfuric HI HClO4 HBr HCl H2SO4 I- ClO4- Br- Cl- HSO4 -1011 1010 109 107 102 -11 -10 -9 -7 -2
Asam HA A- Ka apKa
Hydronium ion Sulfurous
Hydrogen sulfate ion Phosphoric Hydrofluoric Phyridinium ion Carbonic Hydrogen sulfide Ammonium ion Hydrocyanic
Hydrogen carbonate ion Hydrogen arsenate ion Hydrogen sulfide ion
Hydrogen phosphate ion
H3O+ H2SO3 HSO4- H3PO4 HF HC5H5N- H2CO3 H2S NH4+ HCN HCO3- HAsO4= HS- HPO4= H2O HSO3- SO4= H2PO4- F- C5H5N= HCO3- HS- NH3 CN- CO3= AsO43- S= PO43- 1 1,5 x 10-2 1,2 x 10-2 7,5 x 10-3 3,5 x 10-4 5,6 x 10-6 4,3 x 10-7 9,1 x 10-8 5,6 x 10-10 4,9 x 10-10 4,8 x 10-11 3,0 x 10-12 1,1 x 10-12 2,2 x 10-13 0,0 1,81 1,92 2,12 3,45 5,25 6,37 7,04 9,25 9.31 10.32 11.53 11.96 12.67
• Kiraan Ka yang melebihi order 24 memang
nampak sangat besar, namun faktanya nilai ini
bersesuaian dengan
G
yang bervariasi hanya
340 kJ.mol
-1untuk reaksi transfer proton.
• Asam kuat = zat dengan pKa negatif ( Ka > 1 ),
kstgn transfer proton > ke arah air.
• Asam lemah = zat dengan pKa positif ( Ka < 1 ),
kstgn transfer proton > ke arah HA
• Basa lemah = basa konjugat dari asam kuat,
karena secara termodinamik basa konjugat ini
tidak menguntungkan (
unfavorable
) untuk
menerima proton dari H
3O+.
• Perlu di ingat semakin lemah asamnya, maka
basa konjugat semakin lebih kuat.
3. Asam Poliprotik
• Konstannta keasaman asam poliprotik (zat
yang dapat mendonor lebih dari satu proton)
dapat dianalogikan dengan asam monoprotik.
H
2A
(aq)+ H
2O
(l)
H
3O
+(aq)
+ HA
-(aq) ...Ka
1HA
-(aq)
+ H
2O
(l)
H
3O
+(aq)+ A
2-(aq)....Ka
2Nilai Ka
1selalu > Ka
2( pKa
1< pKa
2)
] A H [ ] HA ][ O H [ Ka 2 3 1 ] HA [ ] A ][ O H [ Ka 2 3 2
3. FAKTOR YANG MEMPENGARUHI
KEKUATAN ASAM
a. Keasaman Fase Gas
• Rx. ion H yg paling sederhana; rx dengan basa B dalam fase gas. Reaksi ini di karakterisasi dengan entalpi perolehan/penangkapan proton (Hp, proton
-gain enthalpy) yaitu entalpi standar untuk reaksi B(g) + H+
(g) BH+(g) Hp(B)
• Entalpi protonasi sering dinyatakan dlm hub. dgn afinitas proton (Ap), yang nilainya adalah negatiff dari Hp.
• Jika Hp negatif (reaksi eksotermik), maka afinitas
protonnya dikatakan tinggi. Jika perolehan proton adalah eksotermik lemah, maka afinitas proton oleh basa ( B atau A- ) lemah dikatakan rendah.
Transfer proton dari HA ke B dalam fase gas;
HA
(g)+ B
(g)
HB
+(g)
+ A
-(g)
H
Adalah selisih antara perolehan proton oleh B;
B
(g)+ H+
(g)
BH+
(g)
H
p
(B)
dan perolehan proton oleh A-;
A-
(g)+ H+
(g)
HA
(g)
H
p
(A-)
Sehingga;
Kekuatan HA sebagai asam, perlu energi bebas
Gibbs, sebagai pendekatan dapat dianggap
G
H
.
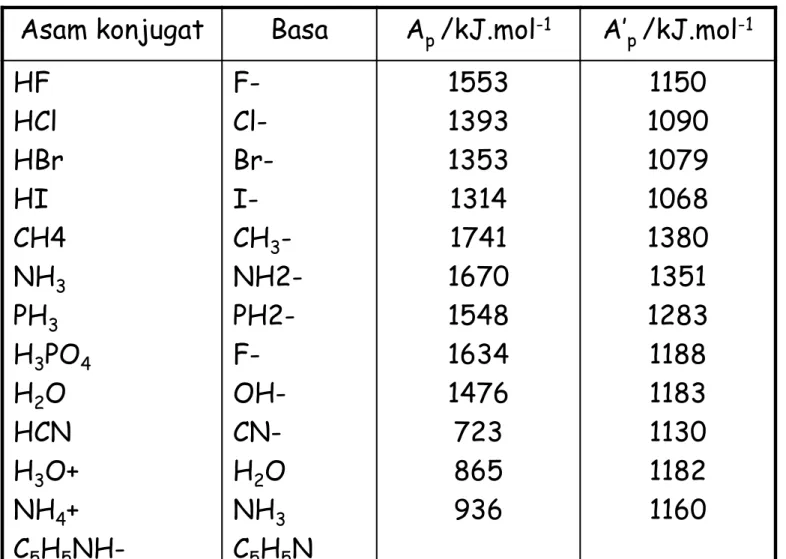
Tabel Harga Konstanta Asam dalam Pelarut Air
pada Suhu 25
C
Asam konjugat Basa Ap /kJ.mol-1 A’
p /kJ.mol-1 HF HCl HBr HI CH4 NH3 PH3 H3PO4 H2O HCN H3O+ NH4+ C5H5NH- F- Cl- Br- I- CH3- NH2- PH2- F- OH- CN- H2O NH3 C5H5N 1553 1393 1353 1314 1741 1670 1548 1634 1476 723 865 936 1150 1090 1079 1068 1380 1351 1283 1188 1183 1130 1182 1160
Semua entalpi protonasi bernilai negatif.
Kesesuaian dengan perolehan proton
eksotermik dan afinitas proton positif.
Semakin tinggi affinitas proton dari A-, maka
semakin lemah ke-as. fase gas HA dan semakin
tinggi harga pKa. Jadi ke-as. fase gas HF < HCl
dan ke-as. fase gas HCl < HI.
2.
Asam-Asam Biner Fase Gas
Dalam satu periode; dari kiri ke kanan, ke-as.
fase gas asambiner blok p makin meningkat.
Dalam satu golongan; dari atas ke bawah,
keasaman fase gas asam biner blok p semakin
meningkat
Kecenderungan ini dapat dipahami dengan
melihat perolehan proton sbg hasil dari tahapan
seperti pada gambar dibawah ini.
A-(g) A(g) + e-(g)
Ae(A) = affinitas elektron dari A
H+
(g) + e-(g) H(g)
-I(H) = neg- energi ionisasi H
H(g) + A(g) HA(g)
- B(HA) = neg- entalpi ikatan H-A
A-(g) + H+(g) HA(g)
Hp = Ae(A) – I(H) – B(HA)
Negatif dr Hp , yaitu afinitas
dari proton A-;
Ap(A-) = B(HA) + I(H) – Ae(A)
H+ (g) + e-(g) + A(g) I (H) Ae(A) H+ (g) + A-(g) H(g) + A(g) Ap (A-) B (HA) HA(g)
• Dalam satu periode;
Affinitas elektron A meningkat dari kiri ke
kanan sehingga afinitas proton A- menurun
dari kiri ke kanan. Sehingga keasaman fase
gas HA meningkat ketika afinitas elektron A
meningkat dari kiri ke kanan. Juga keasaman
fase gas HA meningkat ketika
elektronegatifitas A meningkat dari kiri ke
kanan.
• Dalam satu golongan;
Entalpi disosiasi ikatan HA menurun dari atas
ke bawah sehingga afinitas proton A- menurun
dari atas ke bawah. Sehingga keasaman fase
gas HA meningkat ketika entalpi disosiasi
5. Faktor-faktor yang Mempengaruhi
4. LEVELING OLEH PELARUT
a. Diskriminasi Dalam Air
NH3 dmso CH3CH2OH H2O CH3COOH HF 1400 1200 1000 800 NH2- OH- F- Cl- ClO -A’p/(kJ/mol)
c. Kecenderungan Periodik dlm Keasaman
Bronsted
Fe OH2 OH2 OH2 H2O H2O OH2 OH OH Si HO OH OH O S O OH [Fe(OH2)6]3+ Si(OH) 4 H2SO4