BAGIAN PROYEK PENGEMBANGAN KURIKULUM DIREKTORAT PENDIDIKAN MENENGAH KEJURUAN
DIREKTORAT JENDERAL PENDIDIKAN DASAR DAN MENENGAH DEPARTEMEN PENDIDIKAN NASIONAL
JAKARTA
2002
KATA PENGANTAR
Pendidikan Menengah Kejuruan sebagai penyedia tenaga kerja terampil tingkat menengah dituntut mampu membekali tamatan dengan kualifikasi keahlian standar serta memiliki sikap dan prilaku yang sesuai dengan tuntutan dunia kerja. Sejalan dengan itu maka dilakukan berbagai perubahan mendasar dalam penyelenggaraan pendidikan kejuruan. Salah satu perubahan tersebut adalah penerapan Sistem Pendidikan dan Pelatihan Berbasis Kompetensi.
Dalam rangka mengimplementasikan kebijakan tersebut, maka dirancang kurikulum yang didasarkan pada jenis pekerjaan dan uraian pekerjaan yang dilakukan oleh seorang analis dan teknisi kimia di dunia kerja. Berdasarkan hal itu disusun kompetensi yang harus dikuasai dan selanjutnya dijabarkan ke dalam deskripsi program pembelajaran dan materi ajar yang dibutuhkan dan disusun ke dalam paket-paket pembelajaran berupa modul.
Modul-modul yang disusun untuk tingkat I di SMK Program Keahlian Kimia Analisis dan Kimia Industri berjumlah dua belas modul yang semuanya merupakan paket materi ajar yang harus dikuasai peserta didik untuk memperoleh sertifikat sebagai laboran.
Judul-judul modul dapat dilihat pada peta bahan ajar yang dilampirkan pada setiap modul.
BANDUNG, DESEMBER 2002
TIM KONSULTAN KIMIA FPTK UPI
i
DESKRIPSI
Modul ikatan kimia ini adalah modul ke tujuh yang harus dikuasai di tingkat I, baik untuk Analisis Kimia maupun Kimia Industri. Modul ini membahas mengenai ikatan kimia dan struktur molekul yang meliputi ikatan kovalen, ikatan ion, ikatan hidrogen, ikatan VanderWalls dan ikatan logam. Pembahasan materi tersebut dibagi ke dalam empat kegiatan yaitu kegiatan belajar ke-1 membahas mengenai ikatan kimia dan struktur molekul, kegiatan belajar ke-2 mengenai ikatan kovalen dan ikatan oin, kegiatan belajar ke-3 mengenai ikatan kovalen dan VanderWalls, dan kegiatan belajar ke -4 membahas mengenai ikatan logam.
Disamping pembahasan mengenai konsep-konsep yang berkaitan dengan ikatan kimia, juga disajikan lembar kegiatan untuk membantu peserta didik dalam memahami konsep-konsep tersebut. Waktu untuk mempelajari modul ini, dialokasikan sebanyak 80 jam.
ii
PETA KEDUDUKAN MODUL
iii
PRASYARAT
Sebelum mempelajari modul ini, Anda harus sudah menguasai materi yang dibahas dalam modul struktur atom (modul 5) dan modul sistem periodik (modul 6).
PERISTILAHAN/GLOSARY
Ikatan kimia
Ikatan Ion
Ikatan kovalen
Ikatan kovalen koordinasi
Ikatan hidrogen
Ikatan yang terjadi antara dua atom yang terdapat dalam dua molekul baik sebagai molekul gas maupun sebagai molekul senyawa atau antar atom dalam molekul berbeda
Dibentuk dengan adanya transfer satu atau lebih elektron di kulit terluar dari satu atom menuju elektron di kulit terluar atom lain untuk membentuk konfigurasi elektron gas mulia.
Dibentuk oleh pemakaian elektron bersama antara atom unsur yang sama atau atom unsur yang berbeda Ikatan kovalen yang pemakaian elektron bersama hanya berasal dari satu atom atau tidak terjadi kontribusi elektron diantara atom yang berikatan
Gaya tarik antara atom hidrogen dari satu molekul dengan atom sangat elektro negatif
iv
DAFTAR ISI
Kata Pengantar ………. i
Deskripsi ………. ii
Peta Kedudukan Modul ………. iii
Prasyarat ………. iv
Daftar Isi ………. v
Peristilahan ……….. vi
Petunjuk Penggunaan Modul ……….. 1
Tujuan a. Tujuan Akhir ……… b. Tujuan Antara ……….. 1 Kegiatan Belajar 1: Ikatan Kimia dan Struktur Molekul……….. 2
Kegiatan Belajar 2: Ikatan Kovalen ……… 7
Kegiatan Belajar 3 : Ikatan Hidrogen dan Van der Walls ……….. 20
Kegiatan Belajar 4 : Ikatan Logam ……….. 27
Lembar Evaluasi ………. 34
Kunci Jawaban Lembar Evaluasi ……… 42
Daftar Pustaka ………. 43
v
PETUNJUK PENGGUNAAN MODUL
1. Pelajarilah materi dalam modul ini hingga benar-benar paham dan mengerti
2. Jawablah latihan-latihan yang ada, kemudian cocokkan hasil latihan Anda dengan kunci jawaban
3. Ukurlah kemampuan Anda dengan mengerjakan evaluasi, bila jawaban Anda banyak yang salah (kurang 75%), bacalah lagi modul ini dan kerjakan lagi soal-soalnya
4. Bila mengalami kesulitan dalam melakukan kegiatan mintalah bimbingan guru Anda.
TUJUAN
Tujuan Akhir
Menerapkan konsep ikatan kimia untuk mengenail sifat bahan dan menggunakannya.
Tujuan Antara
Setelah mempelajari modul ini siswa dapat :
1. Menjelaskan teori oktet dan duplet dalam menntukan kestabilan konfigurasi elektron 2. Menjelaskan ikatan kimia berdasarkan pada kestabilan konfigurasi elektron unsur 3. Menjelaskan pembentukan ikatan ion berdasarkan pada serah terima elektron dari
unsur yang berikatan
4. Menjelaskan pembentukan ikatan kovalen berdasarkan pada penggunaan bersama elektron
5. Menentukan sifat kepolaran senyawa- senyawa berdasarkan keelektronegatifan unsur yang berikatan
6. Menjelaskan terbentuknya ikatan hidrogen berdasarkan pada kepolaran molekul 7. Menjelaskan terbentuknya ikatan vander Walls berdasarkan pada bentuk molekul 8. Menjelaskan ikatan logam berdasarkan elektron bebas pada logam
KEGIATAN BELAJAR 1
IKATAN KIMIA DAN STRUKTUR MOLEKUL Tujuan:
Setelah mempelajari kegiatan belajar ini, diharapkan Anda dapat:
1. Menjelaskan teori oktet dan duplet dalam menntukan kestabilan konfigurasi elektron 2. Menjelaskan ikatan kimia berdasarkan pada kestabilan konfigurasi elektron unsur 3. Menjelaskan pembentukan ikatan ion berdasarkan pada serah terima elektron dari
unsur yang berikatan.
Lembar informasi
Ikatan kimia merupakan ikatan yang terjadi antara dua atom yang terdapat dalam molekul baik sebagai molekul gas maupun molekul senyawa atau antar atom dalam molekul berbeda. Ikatan kimia ini dapat berupa ikatan ion (heteropolar), ikatan kovalen (polar dan nonpolar), ikatan hidrogen, ikatan logam. Berdasarkan ikatan yang terbentuk dapat diganbarkan bentuk struktur molekulnya. Berdasarkan hal tersebut, maka bab ini akan diuraikan peranan elektron dalam ikatan kimia, ikatan ion, ikatan kovalen, ikatan logam, ikatan hidrogen dan bentuk molekul atau struktur molekulnya.
1. Peranan Elektron dalam Ikatan Kimia
Unsur – unsur yang terdapat di alam , umumnya, sebagai senyawa. Hal ini menunjukkan bahwa atom-atom unsur cenderung berikatan dengan dirinya sendiri atau dengan atom unsur lain untuk membentuk molekul atau senyawa yang stabil. Unsur yang stabil atau diperoleh di alam sebagai unsur bebas adalah unsur –unsur gas mulia. Hal ini menunjukkan bahwa unsur gas mulia lebih sukar bereaksi daripada unsur lain. Untuk itu, perhatikan konfigurasi elektron atom unsur gas mulia seperti tabel 4.1
Tabel 1 Konfigurasi Unsur Gas Mulia
Unsur Konfigurasi elektron
He Ne Ar Kr Xe
1s2 1s2 2s2 2p6
1s2 2s2 2p6 3s2 3p6 4s2 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6
Berdasarkan tabel 1 terlihat bahwa konfigurasi elektron unsur gas mulia sudah penuh yaitu orbital s dengan 2 elektron dan orbital p dengan 6 elektron atau pada kulit terluar terisi 2 elektron (duplet) dan 8 elektron (oktet). Konfigurasi elektron seperti atom unsur gas mulia ini disebut konfigurasi elektron yang stabil (sudah penuh). Oleh karena itu,
atom unsur yang lain cenderung berikatan dengan atom lain supaya mempunyai konfiguarasi seperti atom unsur gas mulia. Atom – atom tersebut saling berikatan dengan cara melepaskan atau menerima elektron dan konfigurasi elektron pada kulit terluar terjadi perubahan, yaitu menjadi 2 atau 8 elektron. Dengan demikian, elektron pada kulit terluar disebut elektron valensi yang berperanan dalam pembentukan ikatan kimia.
Berdasarkan peranan elektron di kulit terluar ini, maka Lewis menjelaskan pembentukan ikatan kimia antar atom dengan menggambarkan jumlah elektron terluar di sekitar simbol atom unsur yang berikatan. Sebagai Contoh struktur Lewis beberapa atom ditunjukkan sebagai berikut:
1) Konfigurasi elektron kulit terluar atom Na adalah satu (1) elektron, digambarkan dengan Na .
2) Konfigurasi elektron kulit terluar atom C adalah empat (4) elektron, digambarkan dengan : C :
3) Konfigurasi elektron kulit terluar atom Mg adalah dua (2) elektron, digambarkan dengan Mg :
4) Konfigurasi elektron kulit terluar atom P adalah tujuh (7) elektron, digambarkan dengan : P :
Berdasarkan cara pembentukan ikatan kimia antar atom terdapat beberapa ikatan kimia , yaitu
Ø ikatan ion (elektrovalen = heteropolar) Ø ikatan kovalen (atom = homopolar) Ø ikatan hidrogen
Ø ikatan logam
Ikatan ion merupakan ikatan yang terjadi akibat adanya transfer elektron antar atom, sedangkan ikatan kovalen terjadi akibat adanya pemakaian elektron bersama. Ikatan kovalen koordinat merupakan ikatan kovalen yang pemakaian elektron bersama berasal dari satu atom. Ikatan hidrogen terjadi antara atom hidrogen dengan atom yang mempunyai keelektronegatifan besar dalam suatu molekul atau pada molekul lain. Ikatan logam terjadi pada struktur logam.
2 Ikatan Ion
Ikatan ion dibentuk dengan adanya transfer satu atau lebih elektron di kulit terluar dari satu atom menuju elektron di kulit terluar atom lain untuk membentuk konfigurasi elekton gas mulia, yaitu dengan 8 elektron. Atom yang melepaskan elektron membentuk ion bermuatan positif (kation). Sebaliknya, atom yang menerima elektron membentuk ion bermuatan negatif (anion). Kedua ion yang mempunyai muatan berlawanan akan terjadi tarik menarik dengan gaya elektrostatik membentuk senyawa ionik atau elektrovalen. Jadi ikatan ion terjadi antara kation dan anion dengan gaya elektrostatik.
Umumnya, ion positip (kation) dibentuk oleh atom unsur logam, sedangkan ion negatif (anion) dibentuk oleh atom unsur bukan logam. Dengan kata lain, senyawa ionik dibentuk antara atom unsur logam dengan atom unsur bukan logam.
Sebagai contoh pembentukan senyawa ionik
Senyawa natrium klorida (NaCl) dibentuk antara atom Na dengan satu (1) elektron di kulit terluar dengan atom klor (Cl) dengan tujuh (7) elektron di kulit terluar. Atom Na melepaskan satu elektron (membentuk ion Na+ ) diterima oleh atom klor (menjadi Cl - ) secara bersamaan. Kedua ion yang mempunyai muatan berlawanan bergabung dengan gaya elektrostatik menjadi senyawa natrium klorida (Na + - Cl-). Transfer elektron terjadi dari atom natrium menuju atom klor.
Pembentukan ikatan ion dapat digambarkan dengan titik (.) menurut rumus Lewis sebagai berikut.
Na . + . Cl : àà [ Na + ][ : Cl : -] - Atom Na (2.8.1) atom Cl (2.8.7) ion Na (2.8) ion Cl(2.8.8)
atau Na + - Cl (molekul NaCl)
Jumlah elektron yang dilepaskan atau diterima oleh suatu atom untuk membentuk konfigurasi gas mulia yang stabil disebut elektrovalensi atom. Berdasrkan contoh di atas, elektrovalensi natrium adalah + 1, dan elektrovalensi klor adalah – 1. Jadi unsur elektropositif memiliki elektrovalensi positif (+) dan unsur elektronegatif memiliki elektrovalensi negatif (-). Beberapa contoh pembentukan ikatan ion ditunjukkan sebagai berikut.
1). Atom litium (Li: 2 . 1) berikatan dengan atom fluor (F : 2.. 7) membentuk molekul litium fluorida (LiF)
2). Atom magnesium (Mg: 2.8.2) berikatan dengan atom oksigen (O : 2. 6) membentuk molekul magnesium oksida (MgO)
3). Atom kalium (K : 2.8.8.1) berikatan dengan atom belerang (S: 2.8.6) membentuk kalium sulfida
4). Atom kalsium (Ca : 2.8.8.2) berikatan dengan atom klor (Cl : 2.8.7) membentuk molekul kalsium klorida
Berdasarkan beberapa contoh tersebut terlihat bahwa senywa ionik dibentuk antara unsur logam (golongan alkali dan alkali tanah) dengan unsur bukan logam (golongan VIIA dan VIA).
Li . + . F : à [Li + ] [ : F : - ] à Li + - F -
Atom Li atom F molekul LiF
Mg : + O : à [ Mg 2+ ] [ : O : 2- ] à M g 2+ - O 2-
K . + O : à [ K + ] [ : O : 2-] à K + O 2-
K . [K + ] K +
.
Ca : + . Cl : à [Ca 2+ ] [ : Cl : - ] à Ca 2+ Cl -
. Cl : [ : Cl : - ] Cl -
LEMBAR KERJA 1 IKATAN KIMIA
Garam dan gula merupakan dua contoh senyawa kimia yang setiap hari kita makan. Garam membantu keseimbangan tubuh dan menambah rasa pada makanan, gula merupakan sumber energi dan pemanis. Kedua senyawa ini berwarna putih tetapi mempunyai sifat yang sangat berbeda seperti pada tabel.
Tabel 2
Sifat Garam Gula
Rumus kimia Titik leleh
Lelehannya menghantar listrik Larut dalam air
Larutannya menghantar listrik
NaCl 810 oC
ya ya ya
C12H22O11
180 oC tidak
ya tidak
Bagaimana menjelaskan perbedaan ini?
Garam dan gula merupakan suatu senyawa. Atom-atom pada kedua senyawa ini bergabung dengan cara yang berbeda. Atom-atom bergabung sehingga mempunyai susunan elektron seperti gas mulia, yaitu susunan elektron yang stabil. Perhatikan tabel 3!
Tabel 3
Nama Helium Neon Argon
Gambar susunan elektron
Konfigurasi elektron 2 2,8 2,8,8
Atom-atom akan bergabung dengan dua cara, yaitu membentuk ikatan ion atau ikatan kovalen.
Pada kegiatan ini akan dipelajari bagaimana terbentuknya ikatan ion atau ikatan kovalen dalam suatu senyawa.
A. Ikatan Ion
Salah satu contoh senyawa yang mempunyai ikatan ion adalah natrium klorida.
Pertanyaan 1
Lengkapi diagram yang ada di bawah ini!
Ketika natrium bereaksi dengan klor, satu elektron terluar dari natrium diberikan pada atom klor sehingga keduanya membentuk ion yang susunan elektronnya stabil seperti gas mulia.
Lengkapi diagram di bawah ini!
Ion Na+ dan ion Cl- akan berikatan dengan gaya elektrostatik membentuk ikatan ion. Di dalam kristal ion setiap ion terikat pada sejumlah ion lain dengan ikatan yang kuat, maka diperoleh struktur yang kokoh dan titik leleh yang tinggi.
Ion Na+ dan ion Cl - akan berikatan dengan gaya elektrostatik membentuk ikatan ion. Di dalam kristal ion setiap ion terikat pada sejumlah ion lain dengan ikatan yang kuat, maka diperoleh struktur yang kokoh dan titik leleh yang tinggi.
Natrium Klor Natrium Klorida
Logam yang reaktif Gas yang berwarna kuning Senyawa ion berwarna putih
Atom natrium (NA = 11) Atom klor ( NA = 17)
Konfigurasi elektron --- --- --- --- --- --- Jumlah proton --- --- (masing-masing muatan +1)
Jumlah elektron --- --- (masing-masing muatan -1)
Muatan total --- ---
Magnesium mudah melepaskan dua elektron terluarnya dan ditangkap oleh dua atom klor sehingga keduanya membentuk ion yang susunan elektronnya stabil seperti gas mulia. Ion- ion tersebut berikatan membentuk ikatan ion.
Pertanyaan 2
Lengkapi diagram di bawah ini dengan tanda elektron!
Atom klor ( 2 8 7 ) atom klor ( 2 8 7 )
Atom magnesium atom klor atom klor ( 2 8 7 ) ( 2 8 2 ) ( 2 8 7 )
Berdasarkan data di atas, jelaskan apa yang kamu simpulkan mengenai ikatan ion!
________________________________
________________________________
________________________________
Latihan 1
Soal Penyelesaian
1. Di dalam sistem periodik ikatan ion pada umumnya mudah terjadi dari unsur-unsur pada golongan berapa?
___________________________________
___________________________________
2. Buatlah diagram pembentukan ikatan ion pada senyawa KBr?
3. Buatlah diagram pembentukan ikatan pada senyawa CaF2
4. Sebutkan sifat-sifat dari senyawa ion ___________________________________
___________________________________
___________________________________
KEGIATAN BELAJAR 2 IKATAN KOVALEN Tujuan:
Setelah mempelajari kegiatan belajar ini, diharapkan Anda dapat:
1. Menjelaskan pembentukan ikatan kovalen berdasarkan pada penggunaan bersama elektron
2. Menentukan sifat kepolaran senyawa- senyawa berdasarkan keelektronegatifan unsur yang berikatan
Lembar Informasi
Ikatan kovalen dibentuk oleh pemakaian elektron bersama antara atom unsur yang sama atau atom unsur berbeda. Pada ikatan kovalen tidak terjadi transfer elektron, tetapi kedua atom yang berikatan saling memberikan elekron untuk digunakan bersama. Senyawa yang terbentuk akibat terjadinya ikatan kovalen disebut senyawa kovalen.
Sebagai contoh pembentukan molekul dari dua atom hidrogen. Setiap atom hidrogen mempunyai satu (1) elektron di kulit terluar. Penggabungan dua atom hidrogen saling memberikan sebuah elektron yang digunakan bersama untuk membentuk molekul hidrogen. Pembentukan moelekul hidrogen ini dapat dijelaskan menurut Lewis seperti berikut.
Dengan cara yang sama, molekul klor, oksigen, dan nitrogen dapat dijelaskan menurut rumus Lewis.
1). Dua atom klor yang masing – masing mempunyai 7 elektron di kulit terluar (Cl ; 2.8.7) bergabung membentuk molekul klor.
2). Dua atom oksigen (O: 2.6) bergabung membentuk molekul oksigen dengan pemakaian bersama dua pasang elektron
H . + .H à H :.H à H – H
Atom H atom H molekul hidrogen
: Cl . + . Cl : à : Cl : Cl : à Cl – Cl
dua atom klor pasangan elektron molekul klor
3). Dua atom nitrogen (N: 2.5) bergabung membentuk molekul nitrogen dengan tiga elektron berpasangan digunakan bersama.
Sepasang elektron digunakan bersama menggambarkan sebuah ikatan kovalen. Dengan cara yang sama, ikatan kovalen dikenal ikatan rangkap dua atau rangkap tiga, apabila dua atau tiga pasang elektron berpasangan antara dua atom yang berikatan. Ikatan satu, dua, dan tiga digambarkan dengan garis satu, rangkap dua, dan rangkap tiga antara dua atom yang berikatan.
Beberapa contoh pembentukan ikatan kovalen antara dua atom yang berbeda anatara lain adalah molekul air (H2O), molekul hidrogen sulfida (H2S), molekul amonia (NH3), molekul metana (CH4), molekul etena (C2H4), molekul asetelin (C2H2), dan lain-lain.
Nama molekul Ikatan Nama molekul Ikatan
Air H – O -H Hidrogen sulfida H – S – H
Amonia H – N – H
H
Metana H
H - C - H H
Etena H – C = C – H
H H
Asetelin H - C ≡ C - H
1. Perbedaan Senyawa Ionik dengan Senyawa Kovalen
Senyawa ionik merupakan senyawa yang terjadi antara ion positif (kation) dengan ion negatif (anion) oleh gaya elektrostatik. Hal ini berarti senyawa ionik terdapat ikatan ion antar atom yang berikatan. Senyawa kovalen terjadi antara dua atom yang berikatan dengan pemakaian elektron bersama atau dengan ikatan kovalen. Senyawa ionik dan kovalen mempunyai perbedaan seperti ditunjukkan pada tabel 4.2
Tabel 2.1 Perbedaan Senyawa Ionik dan Kovalen
No Senyawa ionik Senyawa kovalen
: O: + : O : à : O : : O à O = O
dua atom O pasangan elektron molekul oksigen
: N :. + . : N : à : N : : : N : à N = N
dua atom N tiga pasang elektron molekul nitrogen
1
2
3
4
5 6
7
Senyawa ionik terjadi transfer elektron antara atom yang berikatan Senyawa ionik adalah polar dan terionisasi dalam air, misalnya:
NaCl = Na + + Cl –
Dalam bentuk laruran atau leburan, senyawa ionik adalah penghantar listrik.
Senyawa ionik adalah larut dalam air dan tidak larut dalam pelarut organik seperti alkohol, aseton
Senyawa ionik merupakan zat padat Umumnya, senyawa ionik adalah keras dan mempunyai titik lebur dan didih tinggi
Senyawa ionik tidak dapat menunjukkan ruang isomer sebagai rantai elektrovalen tidak keras dan tidak langsung.
Senyawa kovalen terjadi pemakaian elektron bersama antara yang berikatan
Senyawa kovalen adalah tidak polar dan tidak terion dalam air
Senyawa kovalen adalah non konduktor
Umumnya, senyawa kovalen tidak larut dalam air, tetapi larut dalam pelarut organik
Senyawa kovalen dapat berupa padat, cair, atau gas
Umumnya, senyawa kovalen adalah lunak , mudah melebur dan menguap Pada kasus tertentu, senyawa kovalen dapat menunjukkan ruang isomer, karena senyawa kovalen melibatkan sudut ikatan yang pasti.
2. Ikatan kovalen koordinasi (Datif)
Ikatan kovalen koordinasi adalah ikatan kovalen yang pemakaian elektron bersama hanya berasal dari satu atom atau tidak terjadi kontribusi elektron di antara atom yang berikatan.
Sehingga pada senyawa koordinasi terdapat atom sebagai donor sepasang elektron dan atom sebagai aseptor sepasang elektron. Sebagai contoh ion amonium ( NH4+
)
Dengan demikian, pembentukan ikatan kovalen koordinasi adalah hanya mungkin terjadi antara atom yang tidak memiliki sepasang elektron di kulit terluar dengan atom atau ion yang memiliki sepasang elektron di kulit terluar yang stabil. Pada contoh di atas, molekul amonia (NH3) adalah molekul netral berikatan dengan ion hidrogen (H+) menghasilkan ion amonium yang berbuatan positif (NH4+)
Berikut merupakan beberapa contoh molekul dengan ikatan kovalen koordinasi.
1). Pembentukan ion hidronium dari molekul air dan ion H +
H3 N : + H + à [H3 N : H] + à [H3NàH] +
Molekul amonia ion H ion amonium
2). Pembentukan molekul ozon dari molekul oksigen dan atom oksigen
Contoh lain adalah pada molekul senyawa asam fosfat, asam sulfat,belerang dioksida, dan senyawa koordinasi atau senyawa kompleks [misalnya kalium ferri sianida ; K3Fe(CN)6].
Umumnya, senyawa kompleks dibentuk antara kation atom unsur transisi,dengan molekul netral atau anion sederhana. Pada senyawa kalium ferri sianida dalam larutan terion menjadi ion K + dan ion kompleks dari ferri sianida (Fe (CN)6 3-
). Pada ion ferri sianida ini : Fe sebagai ion pusat dan ion sianida (CN -) sebagai ligand yang berfungsi mengelilingi ion pusat. Dalam hal ini, ion pusat sebagai aseptor sepasang elektron dan ligan sebagai donor sepasang elektron.
3. Sifat kepolaran ikatan kovalen
Suatu ikatan kovalen antara atom A dan atom B melibatkan pasangan elektron dan digambarkan sebagai A : B. Suatu ikatan kovalen antara atom-atom, pasangan elektron yang digunakan bersama berada tepat di tengah dari penggabungan dua atom atau dapat diasumsikan sebagai ikatan kovalen murni (ikatan non polar). Sebagai contoh, molekul H2, molekul Cl2, molekul N2, dan molekul O2.
Pada sisi lain, ikatan antara dua atom yang berbeda , pasangan elektron yang digunakan bersama tidak akan digunakan sama besar antara ke dua atom yang berikatan. Misalnya ikatan A – B, jika atom B mempunyai daya tarik elektron lebih kuat daripada A, maka pasangan elektron bersama akan ditarik ke B lebih kuat daripada A. Senyawa yang berikatan seperti ini akan memberikan ke arah ionik atau sifat polar dan secara nyata dapat digambarkan seperti berikut
H- O: + H + à H- O : H + à H – O àH +
H H H
O :: O: + O : à O: : O : O à O = O àO
Molekul oksigen atom O molekul ozon
H : H Cl : Cl O : : O N: : : N
Sebagai contoh , asam klorida dapat digambarkan sebagai;
Setiap ikatan kovalen yang mempunyai sifat ionik sebagian disebut ikatan kovalen polar. Keberadaan sifat ionik dalam ikatan kovalen tergantung pada daya tarik relatif elektron antara atom yang bersenyawa. Kemampuan suatu atom untuk menarik pasangan elektron menuju dirinya sendiri dikenal elektronegativitas atom itu sendiri. Sehingga perbedaan elektronegativitas antara dua atom yang terlibat dalam ikatan kovalen lebih besar, cenderung mempunyai sifat ionik semakin besar. Apabila perbedaan elektronegativitas antara dua atom yang berikatan adalah lebih besar atau sama dengan 1,5, maka molekul cenderung bersifat ionik, dan bila lebih kecil dari 1,5 molekul cenderung bersifat kovalen polar .
Hasil perkalian muatan positif atau negatif dengan jarak antara pusat ke dua atom dalam molekul disebut momen dipol, yang secara matematis dirumuskan sebagai
Apabila besarnya muatan elektron (e) = 1.10 -10 ses (satuan elektrostatik). Jarak (d) = 1. 10
–8 Cm, maka harga momen dipol = 1.10 –10 x .1. 10 –8 ses Cm = 10 –18 ses C,m atau Debey (D).
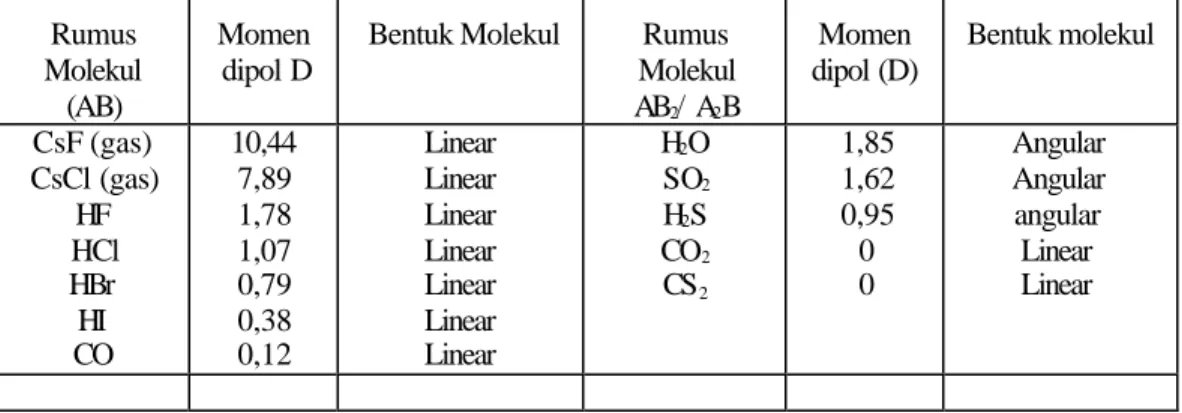
Besarnya momen dipol beberapa molekul dapat dilihat pada Tabel 2.2
Tabel 2.2 Momen Dipol Beberapa Molekul *) Rumus
Molekul (AB)
Momen dipol D
Bentuk Molekul Rumus Molekul AB2/ A2B
Momen dipol (D)
Bentuk molekul
CsF (gas) CsCl (gas)
HF HCl HBr HI CO
10,44 7,89 1,78 1,07 0,79 0,38 0,12
Linear Linear Linear Linear Linear Linear Linear
H2O SO2
H2S CO2
CS2
1,85 1,62 0,95 0 0
Angular Angular angular
Linear Linear A δ + - B δ -
H δ + - Cl δ -
Momen dipol = muatan x jarak
AB3 AB4
NH3
PF3
PH3
NF3
BF3
SO3
1,47 1,03 0,56 0,23 0 0
Piramidal Piramidal Piramidal Piramidal Datar trigonal Datar trigonal
CH3Cl CH2Cl2
CHCl3
CCl4
CH4
1,92 1,59 1,03 0 0
Tetrahedral Tetrahedral Tetrahedral Tetrahedral Tetrahedral
*). Sumber dari :Kimia untuk Universitas oleh Keenan hal 174
Berdasarkan harga momen dipol dari suatu zat dapat digunakan untuk mengistimasi sifat ionik dari suatu ikatan kimia. Suatu molekul dengan sifat ionik penuh momen dipolnya dapat dihitung berdasarkan : muatan negatif 4,80 .10 –8 ses dan muatan positif 4,80.10 –8 ses , jarak antar muatan 1,27.10 –10 Cm, maka
momen dipol = muatan x jarak
= 4,80 . 10 –8 x 1,27 . 10 –10 6,07 . 10 –18 ses Cm = 6,07 D
Sebagai contoh, molekul HCl mempunyai momen dipol 1,07 D dan karbon teraklorida (CCl4)
Sifat ionik molekul HCl = 1,07/6,07 x 100% = 17,63%
Sifat ionik molekul CCl4 = 0/6,07 x 100% = 0%
Jadi molekul HCl mempunyai sifat ionik 17,63% atu bersifat polar, sedangkan molekul CCl4 tidak mempunyai sifat ionik atau bersifat non polar.
LEMBAR KERJA IKATAN KOVALEN
Senyawa lain yang mempunyai cara berikatan yang berbeda dengan senyawa ion adalah senyawa kovalen, misalnya gula alkohol, gas oksigen, gas hidrogen, dan air. Pada senyawa ini semua unsur yang berikatan akan membentuk susunan elektron yang stabil seperti gas mulia dengan ikatan kovalen. Ikatan kovalen jenisnya berbeda-beda. Untuk mempelajarinya, lakukan kegiatan berikut ini!
Ion natrium ion klor
Konfigurasi elektron --- --- --- --- --- --- Jumlah proton --- --- Jumlah elektron --- --- Muatan total --- --- Lambang ion --- ---
Perhatikan diagram di bawah ini!
Ikatan kovalen
1. +
H-H
H H H 2
Ikatan kovalen 2. +
Cl-Cl
Cl Cl Cl2
Ikatan kovalen 3
H Cl HCl
Pertanyaan 3
Dari diagram di atas, jelaskan apa yang dimaksud dengan ikatan kovalen!
___________________________________
___________________________________
___________________________________
Latihan 2
1. Gambarkan ikatan kovalen pada senyawa berikut:
F2 Br2
HF HBr
2. Perhatikan ikatan kovalen yang terjadi pada H2O
+
2 atom H atom O H2O Buatlah ikatan kovalen pada senyawa berikut!
CH4 CCl4
NH3 C2H5OH
3. Perhatikan ikatan kovalen yang terjadi pada senyawa O2 berikut
Buat seperti di atas, untuk ikatan kovalen yang terjadi pada N2!
.
Berdasarkan latihan (1) dan (2), ikatan kovalen dapat membentuk ikatan yang berbeda, sebutkan!
Ikatan kovalen ada yang membentuk ikatan ………, ikatan ………, dan ikatan
………
2. Buatlah ikatan kovalen yang terjadi pada CO2 berikut:
C
1 atom C 2 atom O CO2
Buat ikatan kovalen pada SiO2
Berikan contoh lain untuk senyawa dari unsur berbeda dan mempunyai ikatan rangkap!
___________________________________
___________________________________
___________________________________
___________________________________
4.Ikatan Kovalen Koordinat
Jika molekul NH3 mengikat ion H+ akan terjadi ion NH4+
. Pada ion tersebut terjadi ikatan kovelen koordinat. Ikatan semacam itu terjadi pula pada ion H3O+ dan ion-ion kompleks dari unsur transisi.
Pertanyaan 4
1. Pada kedua ion di atas, ikatan kovalen koordinat itu berasal dari mana?
___________________________________________________________________
2. Jelaskan apa yang dimaksud dengan ikatan kovalen koordinat!
___________________________________________________________________
Latihan 3
Gambarkan elektron-elektron yang membentuk ikatan, apakah termasuk ikatan kovalen koordinat atau ikatan ion pada senyawa-senyawa di bawah ini!
No. Rumus Struktur elektron Jenis
1. SO3 ________________
________________
2. H2SO4 ________________
________________
3. O3 ________________
________________
4. HNO3 ________________
________________
4. Ikatan Kovalen Nonpolar dan Polar
Cara menetukan ikatan kovalen nonpolar dan ikatan kovalen polar dapat menggunakan data keelektronegatifan, (lihat tabel pada buku teks) yaitu:
Ikatan kovalen nonpolar Ikatan kovalen polar Contoh
Struktur Lewis Harga
keelektronegatifan
Selisih
keelekronegatifan
H2 dan Cl
…. ….
H = ….
Cl = ….
Pada H2 = ….
Pada Cl2 = …
HCl ….
H = ….
Cl = ….
Pada HCl = ….
Berdasarkan contoh di atas, jelaskan pengertian ikatan kovalen nonpolar dan ikatan kovalen polar!
Ikatan kovalen nonpolar =
________________________________________________
________________________________________________
Ikatan kovalen polar = ________________________________________________
___________________________________________________
Berikan contoh ikatan kovalen nonpolar dan ikatan kovalen, masukkan pada tabel berikut.
Ikatan kovalen polar Ikatan kovalen polar
Rumus Struktur Lewis Rumus Struktur Lewis
KEGIATAN BELAJAR 3
IKATAN HIDROGEN DAN VANDER WALLS
Tujuan
1. Menjelaskan terbentuknya ikatan hidrogen berdasarkan pada kepolaran molekul
2. Menjelaskan terbentuknya ikatan vander Walls berdasarkan pada bentuk molekul
Lembar Informasi
Ikatan hidrogen merupakan gaya tarik antara atom hidrogen dari satu molekul dengsn atom sangat elektronegatif (seperti F,N,dan O dari molekul lain pada zat yang sama. Ikatan hidrogen ini disebut juga jembatam hidrogen, sebab atom hidrogen bertindak sebagai jembatan antara dua atom elektronegatif. Sebagai contoh.
Gaya tarik antara atom H dari satu molekul dan atom F dari molekul lain merupakan ikatan hidrogen. Pada kenyataan dua molekul H_F dapat berasosiasi membentuk molekul yang besar dan dirumuskan senbagai (HF)n.
Umumnya, ikatan hidrogen digambarkan dengan garis potong-potong. Ikatan hidrogen ini dapat terjadi pada intermolekul dan intramolekul. Intermolekul melibatkan gaya tarik elektrostatik antara atom hidrogen dengan atom unsur elektronegatif dalam molekul yang berbeda. Intramolekul melibatkan gaya tarik elektrostatik antara atom hidrogen dengan atom elektronegatif yang keduanya berada dalam molekul yang sama.
Contoh ikatan hidrogen pada inter molekul adalah sebagai berikut.
1). Air
Hδ+ - Fδ- + Hδ+ - Fδ- à Hδ+ - Fδ- - - - Hδ+ - Fδ- Ikatan hidrogen
- - - Hδ+ - Fδ- - - - Hδ+ - Fδ- - - - Hδ+ - Fδ- - - - Hδ+ - Fδ- - - -
O – H - - - O – H - - - O –H - - - O – H - - - O – H
H H H H H
2). Alkohol
3). Asam karboksilat
4). Asam benzoat
5). Amida
6) . p-nitrofenol
Contoh ikatan hidrogen pada intra molekul 1). Orto-nitrofenol
2). Orto – klorofenol
Akibat terjadinya ikatan hidrogen dalam molekul adalah
O – H - - - O – H - - - O –H - - - O – H - - - O – H
R R R R R
O - - - H - O
R – C C - R
O – H - - - O
O - - - H – O
C6H5 – C C – C6H5
O – H - - - O
O - R - C C - R
H – O
- - - H-O - - N à O - - - H –O - - N à O
O O
O - H O
NàO
O
Cl
1) molekul dapat berasosiasi artinya dua atau lebih molekul dapat membentuk melekul yang besar dengan berikatan hidrogen
2) adanya ikatan hidrogen dalam senyawa mengakibatkan senyawa tersebut mempunyai titik didih dan titik lebur yang lebih tinggi. Contoh air mempunyai titik didih lebih tinggi dibandingkan molekul lain yang mempunyai massa molekul sama.
Gaya Van der Waals
Elektron dalam sebuah prtikel pada suatu saat tidak tersebar merata di seluruh bagian partikel, sehingga ada bagian yang bersifat negatif yang lainnya bersifat positif.
Peristiwa ini disebut dipol sesaat. Makin banyak elektron, makin banyak terjadi dipol semacam ini. Suatu dipol sesaat dapat menginduksi dipol lain, dalam partikel yang berdekatan. Kedua partikel ini saling tarik.
ä- ä+
dipol sesaat
ä- ä+ ä- ä+
dipol kedua menginduksi dipol lainnya
Tarikan oleh Gaya van der Waals
Gaya yang lemah antara partikel-partikel ini disebut gaya van der Waals. Kekuatan gaya ini bergantung pada jumlah elektron dalam partikel. Hal ini ditunjukkan adanya hubungan antara jumlah elektron dan titik didih. (lihat tabel)
Tabel.3.1. Kaitan antara Jumlah Elektron dan Titik Didih
Molekul Jumlah elektron Titik didih oC H2
N2
Cl2
I2
2 14 34 126
-253 -196 -35 +185
.+
.+ .+
Konsep Hibridisasi
Konsep hibridisasi digunakan untuk menjelaskan ikatan kovalen yang terjadi dalam molekul yang tidak dapat dijelaskan dengan teori orbital molekul dan teori ikatan valensi. Konsep hibridisasi dikemukakan oleh Linus Pauling pada tahun 1931.
Hibridisasi adalah campuran pembagian kembali satu atau lebih orbital terluar (elektron kulit terluar) dari suatu atom untuk memberikan orbital baru yang mempunyai energi sama.
Orbital baru ini disebut orbital hibrida.
1. Hibridisasi dalam berelium
Berelium mempunyai konfigurasi elektron 1s2 2s2 dalam keadaan dasar.
Dalam keadaan dasar, semua elektron atom Be sudah berpasangan, sehingga tidak mampu untuk bergabung dengan elektron atom lain untuk membentuk ikatan. Berdasarkan fakta atom Be mampu bersenyawa dengan atom lain membentuk ikatan kovalen, misalnya senyawa BeCl2, BeF2. Pembentukan ikatan kovalen dari senyawa berilium dapat dijelaskan sebagai berikut.
Selama Be mengadakan ikatan dengan klor atau fluor membebaskan energi. Energi ini digunakan untuk mempromosikan satu elektron pada orbital 2s ke orbital 2p yang masih kososng. Selanjutnya, suatu keadaan tereksitasi atom Be memiliki dua orbital 2s dan 2p yang masin- masing terisi sebuah elektron mengalami hibridisasi sp dengan kekuatan dan bentuk sama untuk membentuk orbital hibrida sp yang linier. Pembentukan orbital hibrida sp dapat ditunjukkan sebagai berikut.
2p
2s hibrida sp
1s
Keadaan dasar Keadaan tereksitasi keadaan hibridisasi
+ à
Orbital s orbital p orbital hibrida sp
↑↓
↑↓
↑
↑
↑↓
↑ ↑
↑↓
Apabila atom Be berikatan dengan atom klor (17 e) yang mempunyai konfigurasi elektron: 1s2 2 s2 2p6 3s2 3p5, berarti pada atom klor mempunyai satu orbital p yang masih terisi sebuah elektron , maka terjadi ikatan antara orbital p pada atom klor dengan orbital hibrida sp pada atom Be.
+ à
orbital hibrida sp atom klor (px1) Molekul Be Cl2
2. Hibridisasi dalam boron
Konfigurasi elektron atom B (5 e ) adalah 1s2 2s2 2p1, seperti atom Be, atom B mengalami hibridisasi sp2 dengan membentuk orbital hibrida – sp2 yang membentuk segitiga palnar sudut 120 0 setiap sudutnya. Contoh senyawa boron adalah BCl3, BF3.
2p
2s hibridisasi sp2
Energi
1s
keadaan dasar keadaan tereksitasi orbital hibrida
3. Hibridisasi dalam karbon
Konfigurasi elektron atom karbon (C ) adalah 1s2 2s2 2px1 2py1. Seperti atom Be , bila atom C berikatan dengan atom H (misalnya) untuk membentuk ikatan kovalen dalam senyawa metana (CH4) maka energi yang dibebaskan mempromosikan satu elektron pada orbital 2s menuju orbital 2pz yang masih kosong, sehingga ke empat elektron ini (2s1 2px1 2py1 2pz1) berhibridisasi membentuk orbital hibrida –sp3 yang secaralangsung membentuk bidang tetrahedral, dengan sudut ikatan 109 0 - 28 ‘ .
↑ ↑ ↑
↑↓ ↑
↑↓ ↑↓
↑ ↑ ↑
↑↓
2p
2s
1s
Keadaan dasar keadaan tereksitasi orbital hibrida
H
+ à H C H
H
Atom H atom C molekul metana
Contoh lain ikatan atom C dengan H dalam senyawa etana (C2H6), propana (C3H8), butana, (C4H10) , dan seterusnya.
H H H H
H --- C ---- + --- C --- H à H --- C --- C --- H --- H H H H H H
Sp3 sp3 molekul etana
Dalam molekul etena ( C2H4), setiap atom karbon membentuk ikatan kovalen melalui orbital hibrida sp2. Dua orbital sp2 dari setiap atom karbon membentuk ikatan σ (sigma) dengan orbital 1s dari atom H. Orbital sp 2 antara dua atom karbon jugam membentuk ikatan σ. Dua atom karbon dan empat hidrogen terletak bidang datar dengan membentuk sudut 120 0. Dua orbital –2p pada setiap atom karbon terjadi overlapping dengan cara sisi dengan ikatan π . Dengan demikian, antara atom karbon terjadi ikatan rangkap yang mengandung ikatan σ dan π.
H H
C C
H H
Molekul etena (etilena)
↑ ↑
↑↓
↑↓
↑ ↑ ↑
↑
↑↓
↑ ↑ ↑ ↑
↑↓
LEMBAR KERJA 3 IKATAN HIDROGEN
Ikatan higrogen dapat pula terjadi di antara molekul-molekul dan menyebabkan titik didihnya tinggi. Ikatan semacam ini disebut ikatan hydrogen. H2O, HF, dan NH3 mempunyai titik didih yang lebih tinggi daripada hidrida lain, golongan yang sama. Pada H2O, HF, dan NH3 terdapat unsur O, F, dan N yang mempunyai keelektronegatifan tinggi dan H dengan keelekronegatifan rendah sehingga senyawa tersebut mempunyai polaritas yang tinggi. Akibatnya terjadilah tarik menarik molekul- molekul dan membentuk ikatan hidrogen yang digambarkan sebagai berikut.
Soal Penyelesaian
Apa yang dimaksud dengan ikatan hidrogen?
Sebutkan sifat senyawa yang mengandung ikatan hidrogen
KEGIATAN BELAJAR 4 IKATAN LOGAM Tujuan
Menjelaskan ikatan logam berdasarkan elektron bebas pada logam Lembar Informasi
Logam mempunyai sifat yang beraneka ragam, tetapi ada bebrapa sifat khas yang dapat membedakan antara logam dengan bukan logam. Sifat fisika logam antara lain adalah
Ø daya hantar jenis listrik dan panas yang tinggi, berarti di dalam logam terdapat beberapa elektron yang terikat secara lemah dan dapat bergerak bebas akibat pengaruh listrik atau panas
Ø permukaannya mengkilap, umumnya permukaan logam yang baru dipotong berwarna abu- abu atau keperakan yang mengkilap, kecuali emas dan tembaga
Ø struktur khas logam berupa kristal yang sangat rapat tersusun oleh atom-atom
Ø bila diberi tegangan mampu mengubah bentuk tanpa retak. Logam dapat ditempa, ditarik, walaupun susunan atom-atom dalam logam sangat rapat.
Menurut pandangan modern, suatu logam terdiri atas suatu kisi yang rapat dari ion-ion positif dan di sekitarnya dikelilingi atau terdapat lautan elektron –elektron valensi.
Elektron valensi ini terbatas pada permukaan energi tertentu, tetapi elektron valensi ini mempunyai kebebasan bergerak. Apabila diberi energi, elektron – elektron ini mudah dipndahkan dari satu atom ke atom lain. Sistem ikatan yang terdapat pada logam disebut ikatan logam. Ikatan logam ini memberikan kekuatan dan keuletan kepada logam dan sekaligus memungkinkan terjadinya deformasi. Ion positif pada logam menempati posisi yang relatif tetap dalam lautan elektron, tetapi ion-ion ini dapat menggelincir satu melewati yang lain dengan mudah seprti ditunjukkan pada gambar berikut. Oleh karena itu, logam tidak retak bila dipukul dengan palu atau digilas menjadi lembaran atau ditarik menjadi kawat.
Gambar 4.1 Bila atom- atom logam didistrorsikan , sepotong logam, masih dapat kuat kembali karena terbentuknya ikatan logam yang baru
Ikatan logam mudah dipahami dengan menggunakan teori orbital molekul. Sebagai contoh, ikatan logam yang terjadi dalam logam natrium. Atom Na mempunyai konfigurasi elektron : 1s2 2s2 2p6 3s1.Bila dua atom na didekatkan, maka orbital 3 s1 akan bergabung dengan orbital atom 3 s1 dari atom yang lain, membentuk dua orbital molekul. Orbital ini mempunyai energi lebih rendah dan yang lain lebih tinggi. Apabila 3 atom Na bergabung membentuk 3 orbital moelkul, dan n atom Na bergabung membentuk N orbital molekul.
Jumlah orbital molekul adalah sama dengan jumlah atomnya. Tingkat energi dari orbital molekul ini sangat berdekatan sehingga berbentuk pita energi, dengan distribusi energi yang kontinu seprti ditunjukkan pada Gambar 4. 2 Karena kerapatan pita energi paling besar di tengah, maka makin ke atas dan ke bawah makin berkurang. Gabungan orbital atom 3p yang kosong membentuk pita energi yang kosong pula.
Karena setiap orbital atom memberikan satu tingkat energi kepada pita energi dan setiap tingkat energi dapat diisi dua elektron, maka pita energi dari N atom dapat diisi oleh 2N elektron.
--- energi
Gambar 4.2 Pembentukan pita energi
Dalam natrium, pita energi hanya terisi setengah, yaitu pada orbital ikatan
+ + + + + + + + e e e e e e e e + + + + + + + e e e e e e e + + + + + + + e e e e e e e
+ + + + + + e e e e e e
+ + + + + + e e e e e e
kristal dan orbital 3s yang setengah terisi tidak terarah dalam kristal. Pada ga mbar 4.3 diberikan contoh tingkat energi dalam atom Na dan pita energi dalam kristal Na dan Mg (atom Mg dengan konfigurasi elektron : 1s2 2s2 2p6 3s2)
3p 3s Energi 2p
2s 1s
Atom Na Kristal Na
Kristal Mg
Gambar 4.3 Tingkat energi atom Na dan pita energi kristal Na.
Struktur Molekul
Struktur suatu senyawa dapat dibedakan berdasarkan bentuk kristalnya, yaitu kristal senyawa ion (kristal ionik), kristal molekul yang berikatan kovalen, dan kristal berikatam hidrogen, dan kristal logam.
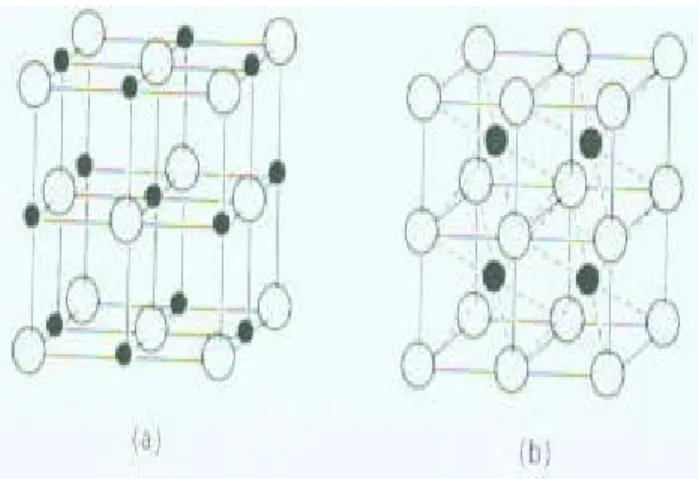
Kristal ionik
Kristal ion dibentuk oleh senyawa yang berikatan ion, seprti kristal NaCl, kristal CsCl, CaCO3, MgCl2, dan seterusnya. Gambar 4.4 menunjukkan contoh kristal NaCl dan CsCl berbentuk kubus.
Gambar 4.4 Bentuk Kristal NaCl dan CsCl
Kristal Kovalen
Kristal kovalen dibentuk oleh senyawa atau molekul yang berikatan kovalen antara atom-atom di dalam kristal. Sebagi contoh kristal intan, atom-atom karbon terikat secara kovalen dengan atom C tetangganya dalam bentuk tetrahedral. Kristal kovalen ini mempunyai sifat keras, dengan titik lebur tinggi dan bukan penghantar. Gambar 4.5 menunjukkan contoh kristal grafit.
Gambar 4.5 Kristal intan
Senyawa kovalen umumnya mempunyai bentuk molekul yang khas. Tabel 4.4 menunjukkan bentuk molekul beberapa molekul kovalen.
Tabel 4.4 Bentuk Molekul Beberapa Senyawa Kovalen Orbital
hibrida
Bentuk molekul Jumlah pasangan elektron
Contoh senywa sp
sp2 sp3 dsp2 dsp3 d2sp3/
sp3d2
Linier Segitiga datar
Tertrahedral Segiempat planar Trigonal bipiramidal
Oktahedral
1 2 3 4 5 6
BCl2, CO2, HCN BF3, SO3, CO32-,
NO3–
CH4, BF4-
, NH4+
, SO42-
Cu(NH3)42+
PCl5, SbCl5
SF6, SiF62- , PF6-
Kristal molekul
Kristal molekul tersusun oleh kisi-kisi molekul oleh atom –atom itu sendiri. Kekuatan ikatan antar molekul lebih lemah daripada ikatan kovalen dalam molekul itu sendiri.
Contoh struktur molekul yang berikatan hdrogen adalah struktur molekul dalam es.
(molekul air dalam bentuk padat).
Gambar 4.6 Struktur molekul air dalam zat padat (es) Kristal logam
Kristal logam tersusun oleh atom – atom logam yang berikatan logam. Susunan atom di dalam logam sangat rapat, sehingga massa jenis logam sangat tinggi. Struktur kristal logam dapat berbentuk kubus, heksagonal, dan sebagainya. Gambar berikut merupakan contoh
Gambar 4.7 Kristal logam berbentuk heksagonal
LEMBAR LATIHAN
Kerjakan semua soal berikut dengan singkat dan jelas!
1. Apa yang dimaksud dengan: konfigurasi elektron yang stabil, ikatan ion, ikatan kovalen, ikatan logam, orbital hibrida, dan ikatan hidrogen!
2. Berilah contoh senyawa yang berikatan ion, kovalen, dan hidrogen masing-masing 5 buah!
3. Jelaskan perbedaan senyawa ion dan senyawa kovalen!
4. Jelaskan pembentukan ikatan ion dan kovalen!
5. Sebutkan ikatan yang terjadi pada senyawa: H2SO4, Fe2O3, FeCl3, KNO3, dan CaCO3.
6. Berilah contoh bentuk struktur senyawa yang berikatan ion, kovalen, dan logam masing-masing 2 buah!
7. Jelaskan pembentukan molekul H2, CH4, BeCl2, dan C2H4 menurut teori Lewis dan hibridisasi
LEMBAR EVALUASI
1. Partikel atom unsur X, mempunyai nomor massa 56, jumlah neutron 36, maka jumlah proton atom unsur tersebut ….
A. 16 B. 26 C. 30 D. 36 E. 56
2. Suatu atom fosfor nomor atomnya 15 dan nomor massa 31. Jumlah proton, neutron, dan elektron untuk P3- adalah ….
A. 15-16-18 D. 18-15-18 B. 15-16-12 E. 16-18-15 C. 18-16-15
3. Unsur X dengan massa atom 39, jumlah neutron 20, konfigurasi elektron untuk X+1 adalah ….
K L M N K L M N A. 2 8 8 D. 2 8 9 B. 2 8 8 2 E. 2 8 9 3 C. 2 8 8 8 1
4. Diketahui unsur-unsur
I. 25Cl17 II. 32P15 III.32S16 IV. 37C17 V. 31P15
Yang merpakan isotop ialah pasangan unsur ….
A. I dan II D. III dan IV B. I dan IV E. IV dan V C. II dan III
5. Atom unsur manakah yang mempunyai elektron valensi yang sama?
A. 24Mg12 dan 40Ca20 D. 40Al13 dan 46V23
B. 24Na11 dan 24Mg12 E. 27Al13 dan 24Mg12
C. 24Mg12 dan 39K19
6. Unsur-unsur manakah yang mempunyai periode yang sama dalam sistem peiodik?
A. 12Mg dan 4Be D. 9F dan 11Na B. 12Mg dan 17Cl E. 12Cl dan 19K C. 11Na dan 19K
7. Kelompok senyawa di bawah ini yang terbentuk dengan ikatan kovalen adalah ….
A. KCl, NaBr, KI D. HCl, H2O, KCl B. HBr, KBr, KI E. KI, KCl, NaCl C. CO2, C2H4, H2O
8. Unsur X nomor atom 13 dan Y nomor atom 8 membentuk senyawa dengan rumus ….
A. XY D. XY2
B. X2Y E. X2Y2 C. X2Y3
9. Ikatan kovalen rangkap dua terdapat pada molekul ….
A. O2 D. F2 B. N2 E. H2
C. Cl2
12. Keelektronegatifan H = 2,1 F = 4,0 Cl = 3,0 N = 3,1 Senyawa kovalen manakah yang paling polar?
A. NH3 D. HCl B. HF E. NCl3
C. H2O
13. Ikatan kovalen rangkap tiga terdapat pada molekul ….
A. H2 D. N2
B. O2 E. P4 C. Cl2
14. Kelompok senyawa yang semuanya berikatan ion adalah ….
A. NaCl-CO2-H2O D. KCl-MgO-NaCl B. Cl2-CO2-H2O E. KCl-CO2-N2 C. HCl-H2O-NaOH
15. Unsur Na akan membentuk ikatan ion paling kuat dengan unsur ….
A. 9F D. 53I B. 17Cl E. 87At C. 35Br
16. Salah satu teori yang menjadi dasar timbulnya model atom modern adalah … A. Rutherford, Niels Bohr, dan de Broglie.
B. Pauli, Niels Bohr, dan de Broglie.
D. De Broglie, Niels Bohr, dan Schrodinger.
E. Dalton, de Broglie, dan Husenberg.
17. Di bawah ini adalah lambang unsur dan nomor atomnya, atom yang memiliki 6 elektron valensi adalah …
A. 6C B. 8O C. 12Mg D. 14Si E. 19K
18. Suatu ion bermuatan +2 dan bernomor 20, konfigurasi elektronnya adalah … A. 1s22s22p63s23p64p2 D. 1s22s22p63s23p64s24p2 B. 1s22s22p63s23p6 E. 1s22s22p63s23p63d2 C. 1s22s22p63s22p64s24d2
19. Pada pasangan mana molekul-molekul mempunyai bentuk yang sama ? A. AlCl3 dan BCl3
B. AlCl3 dan PCl3
C. BF3 dan NH3
D. BCl12 dan H2O E. CO2 dan SO2
(No. Atom : 1H, 6C, 8O, 13Al, 9F, 7N, 5B, 15P, 16S)
20. Unsur X nomor atom 5 dan Y nomor atom 7 membentuk senyawa XY3, bentuk molekul senyawa ini adalah …
A. linier. D. segi empat datar.
B. segitiga sama sisi. E. oktahedral.
C. tetrahedral.
SOAL-SOAL PILIHAN BERGANDA
Jawablah pertanyaan-pertanyaan di bawah ini dengan cara melingkari salah satu huruf di depan pernyataan jawaban yang benar!
1. Atom X mempunyai konfigurasi elektron 1s2 2s2 2p6 3s2
Senyawa yang mungkin dibentuk oleh atom X adalah:
a. HX2 b. XCl2 c. CaX d. X2SO4 e. X2(PO4)3
2. Kelompok zat di bawah ini yang semuanya memiliki ikatan kovalen adalah:
KI, HBr, Cl2 d. I2, HF, KBr CO2, CH4, NaCl e. NaBr, KCl, NaI
3. X mempunyai nomor atom 12 dan Y mempunyai nomor atom 9. Senyawa antara X dan Y adalah:
a. XY2 b. XY c. X2Y d. X2Y3 e. X3Y2
4. Kaidah oktet tidak berlaku bagi senyawa:
a. CH4 b. NH3 c. CH3Cl d. BF3 e. H2O 5. Rumus elektron asam nitrit, HNO2, adalah sebagai berikut:
B . . H : N : : O
. . . . : O : A . .
C
Pasangan elektron yang membentuk ikatan kovalen koordinat adalah:
a. A b. B c. C d. A dan C e. B dan C
6. Unsur A dengan nomor atom 5 membentuk senyawa XY. Bentuk molekul senyawa ini adalah:
a. Linier d. bujur sangkar
b. Segitiga e. oktahedral
c. tetrahedral
7. Pada molekul N2 (nomor atom N = 7), jumlah pasangan elektron yang dipakai bersama adalah
1 b. 2 c. 3 d. 4 e. 5
8. Pasangan senyawa yang mengandung ikatan kovalen koordinat adalah:
a. NH4+
dan CH4 d. H2O dan NH3
b. H3O+ dan Ag(NH3)2Cl e. K4Fe(CN)6 dan NaBr c. AgCl dan FeSO4
9. Molekul NH3 memiliki struktur tetrahedral. Jenis hibridisasi dalam molekul senyawa ini adalah:
a. sp b. sp2 c. sp3 d. sp3d e. sp3d2
10. Molekul XY3 bersifat polar, dan memenuhi kaidah oktet. Maka dapat disimpulkan bahwa:
a. Atom X mempunyai sepasang elektron bebas b. Atom X mempunyai dua pasang elektron bebas c. Atom X mempunyai tiga pasang elektron bebas
d. Atom X mempunyai empat pasang elektron bebas e. Atom X tidak mempunyai pasangan elektron bebas
11. Keelektronegatifan unsur-unsur H, F, Cl, Br, dan I masing-masing adalah 2,1; 4,0;
3,0; 2,8; dan 2,5
Senyawa manakah yang paling polar?
a. F2 b. IBr c. HI d. BrCl e. HCl
12. Unsur M dengan struktur elektron 1s2 2s2 2p6 3s2 3p1 akan membentuk senyawa klorida dengan rumus:
a. MCl b. MCl2 c. MCl3 d. M2Cl e. M3Cl
13. Senyawa di bawah ini yang paling polar adalah:
a. N2 b. NH3 c. Cl2 d. CS2 e. H2O
14. Unsur dengan konfigurasi elektron 1s2 2s2 2p6 3s2 3p5 akan membentuk ikatan yang paling bersifat ion, jika bersenyawa dengan unsur yang konfigurasi elektronnya:
a. 1s2 2s2 2p4 b. 1s2 2s1
c. 1s2 2s2 2p6 3s2 3p6 3d10 4s1 d. 1s2 2s2 2p6 3s2 3p6 4s2 e. 1s2 2s2 2p6 3s2 3p6 4s1
15. Pasangan berikut yang merupakan senyawa ionik adalah:
a. CO2 dan Na2O d. H2O dan H2S b. HCl dan NaCl e. NaI dan ICl c. KH dan KBr
16. Sulfida di bawah ini yang mengandung ikatan kovalen adalah:
a. Na2S b. BaS c. Al2S3 d. CS2 d. PbS
17. Dengan mengingat struktur kristalnya, manakah zat padat berikut yang titik leburnya paling tinggi:
a. belerang b. natrium c. intan d. NaCl d. besi 18. Suatu padatan dengan struktur kristal ionik akan memiliki sifat-sifat:
a. lunak, titik lebur rendah dan tidak menghantar listrik b. keras, titik lebur rendah dan cairannya menghantar listrik