Bab 4
KELARUTAN DAN HASIL KALIKELARUTAN
Apa yang terjadipada saatgula dilarutkan ke dalam air, mengapa bila gula yang dilarutkan dalam jumlah banyak tidak dapatterlarutsemua ? Mengapa gula tidak bisa larutdidalam bensin.
Gula tersusun darimolekul-molekulgula dimana antarmolekul-molekultesebutsaling tarik menarik membentuk zatpadat.Bila zatpadattersebutdimasukkan ke dalam air maka terjaditarik menarik antara molekul-molekulgula dengan molekul-molekulair yang mengakibatkan lepasnya gaya tarik antarmolekulgula yang berakibatzatpadat (gula)tersebuttersebar secara merata sebagaimolekul-molekulyang berdirisendiri. Karena haltersebutmaka pada saatkristalgula dilarutkan ke dalam airseakan-akan menghilang karena mata kita tidak mungkin dapat melihat partikel-partikelyang sangatkecil.
Setiap molekulairakan menarik beberapa molekulgula sehingga gaya antarmolekul gula terlepas.Karena gaya tarik molekulairterbatas maka ketika jumlah gula sudah sangatbanyak pengaruh gaya tarik molekulair tidak mampu lagimelepaskan gaya tarik antar molekulgula dan akibatnya gula tidak melarut.Jumlah gula yang dapat larutdalam 1 literairkurang lebih 1800 gram,dengan kata lain kelarutan gula dalam airadalah 1800 gram perliterair.
Bagiamana jika senyawa ion sepertiNaClatau AgCldilarutkan ke dalam air.Jika kristalNaCldilarutkan ke dalam airmaka terjadiproses ionisasiNaClsebagaiberikut,
H2O
NaCl(s)———→ Na+(aq)+ Cl–(aq)
Proses yang serupa terjadipula pada waktu kristalAgCldilarutkan ke dalam air, H2O
AgCl(s)———→ Ag+(aq)+ Cl–(aq)
Proses peruraian tersebutdiperlukan energi,dimana untuk pelarutan NaCldiperlukan 3,8 kJ/moldan untuk AgCldiperlukan 65,5 kJ/mol. Harga energitersebutdapat digunakan untuk menjelaskan mengapa NaCllebih mudah larutdidalam airdaripada
AgClpada suhu yang sama.
Jika suatu zatmelarutdidalam air,maka zattersebutakan teruraimenjadipartikel -partikeldasar(molekul-molekulatau ion-ion)penyusun zattersebut.
A.Kelarutan (s )
Kelarutan (solubility) suatu zat di dalam suatu pelarut menyatakan jumlah maksimum suatu zatyang dapatlarutdidalam suatu pelarut. Satuan kelarutan umumnya dinyatakan dalam gram/Latau mol/L.
Bila garam dapur sejumlah garam dapur dilarutkan ke dalam airdan ada sebagian yang tidak larut,maka larutan diatasnya merupakan larutan jenuh (gambar 4.1). Bila ke dalam
larutan jenuh NaClditambahkan lagisedikit NaClmaka NaCL yang ditambahkan tersebut tidak bisa melarut dan akhirnya akan tetap sebagaiendapan kristalNaCl.Konsentrasizat terlarut didalam larutan jenuh adalah sama dengan kelarutannya.
Besarnya kelarutan suatu zatdipengaruhioleh beberapa faktorantara lain,
1. Jenis Pelarut
Senyawa polar (mempunyaikutub muatan)akan mudah larutdalam senyawa polar,misalnya gula,NaCl,alkoholdan semua asam merupakan senyawa polar sehingga mudah larutdalam airyang juga merupakan senyawa polar.
Senyawa non polarakan mudah larutdalam senyawa non polar,misalnya lemak mudah larutdalam minyak.Senyawa non polar umumnya tidak larutdalam senyawa polar,misalnya NaCltidak larutdalam minyak tanah.
2. Suhu
Kelarutan zat padat dalam air akan semakin tinggibila suhunya dinaikkan, halinidisebabkan adanya kalor akan mengakibatkan semakin renggangnya jarak antarmolekulzatpadattersebut. Merenggangnya gaya antar molekul yang bekerja pada molekul-molekulzat padat menjadikan kekutan gaya antar molekul tersebut menjadi lemah dan akibatselanjutnya akan mudah terlepas oleh adanya pengaruh gaya tarik air molekul-molekul air. Grafik 4.1. menunjukkan pengaruh suhu terhadap kelarutan beberapa zatpadat.
Grafik.4.1.Pengaruh suhu Terhadap Kelarutan Beberapa zat padat
Berbeda dengan zatpadat,adanya pengaruh kenaikan suhu akan menyebabkan kelarutan gas dalam air berkurang,halinidisebabkan bila suhu meningkat mengakibatkan gas yang terlarutdidalam airakan terlepas meninggalkan air.
B.HasilKaliKelarutan (Ksp)
Senyawa – senyawa ion yang terlarutdidalam air akan teruraimenjadipartikel dasar pembentuknya yang berupa ion positip dan ion negatif. Bila ke dalam larutan jenuh suatu senyawa ion ditambahkan kristalsenyawa ion maka kristal tersebut tidak melarut dan akan mengendap.Kristalyang tidak larut initidak mengalamiionisasi.Bila ke dalam sistem tersebutditambahkan air maka kristal
endapan kristaltersebutakan segera terionisasi,dan sebaliknya bila air dalam larutan tersebutdiuapkan maka ion-ion akan segera mengkristal.Dalam peristiwa tersebutakan terjadisistem kesetimbangan antaarzatpadatdengan ion-ionnya di dalam larutan.
Bila sejumlah AgCldilarutkan ke dalam 100 mL airdan larutsebagian.AgClyang melarutmengalamiionisasi
AgCl(s)→ Ag+(aq)+ Cl–(aq)
sedangkan AgClyang tidak laruttetap sebagaikristalAgClyang mengendap. Bila airdiuapkan maka terjadipenggabungan ion Ag+dan ion Cl-menjadikristal
AgCl,
Ag+(aq)+ Cl–(aq)→ AgCl(s)
Proses sebaliknya bila ke dalam airtersebutditambahkan airmaka endapan AgCl akan segera larutdan terionisasi,
AgCl(s)→Ag+(aq)+ Cl-(aq)
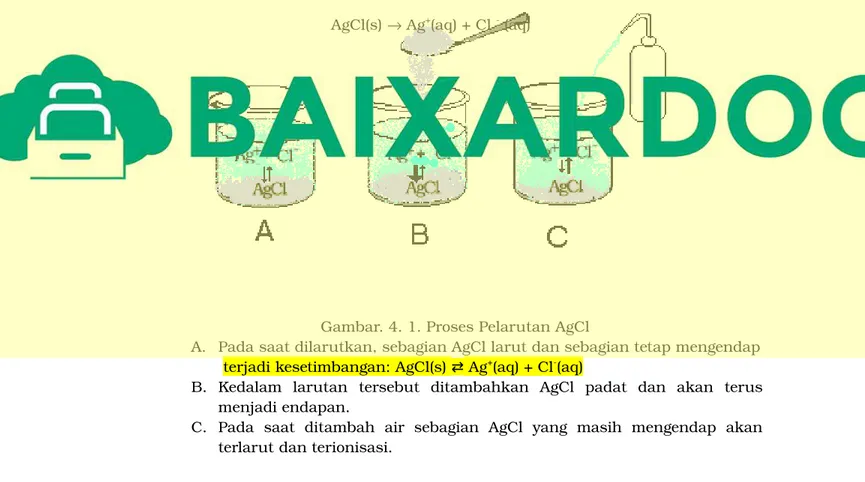
Gambar.4.1.Proses Pelarutan AgCl
A. Pada saatdilarutkan,sebagian AgCllarutdan sebagian tetap mengendap terjadikesetimbangan:AgCl(s)⇄Ag+(aq)+ Cl-(aq)
B.Kedalam larutan tersebut ditambahkan AgCl padat dan akan terus menjadiendapan.
C.Pada saat ditambah air sebagian AgClyang masih mengendap akan terlarutdan terionisasi.
Dengan demikian didalam larutan jenuh tersebutterdapatreaksikesetimbangan, AgCl(s)⇄ Ag+(aq)+ Cl–(aq)
Dari reaksi kesetimbangan tersebut maka dapat diperleh harga tetapan kesetimbangannya adalah
K = [Ag+][Cl-]
Untuk larutan jenuh AgCl,maka konsentrasiion Ag+dan Cl-akan setara dengan
harga kelarutan AgCldalam air,sehingga harga K pada kesetimbangan kelarutan hasilkalikelarutan dan dilambangkan sebagaiKsp.
Ksp AgCl= [Ag+][Cl-]
Untuk larutan jenuh senyawa ion AmBn didalam air akan menghasilkan reaksi
kesetimbangan,
AmBn(s)⇄ mAn+(aq)+ nBm –(aq)
harga hasilkalikelarutannya dinyatakan dengan rumusan, Ksp AmBn= [An+]m.[Bm -]n
Contoh :
1. Untuk senyawa ion sukarlarutAg2CrO4dengan reaksikesetimbangan,
Ag2CrO4(s)⇄ 2 Ag+(aq)+ CrO42 –(aq)
Ksp Ag2CrO4 = [Ag+]2 [CrO42 -]
2. Untuk senyawa ion sukarlarutCa3(PO4)2dengan reaksikesetimbangan,
Ca3(PO4)2(s)⇄ 3Ca2+(aq)+ 2PO42 –(aq)
Ksp Ca3(PO4)2 = [Ca2+]3[PO42 -]2
C.Hubungan Kelarutan dengan Ksp
Pada larutan jenuh senyawa ion AmBn konsentrasizatdidalam larutan adalah
sama dengan harga kelarutannya dalam satuan mol/liter. Senyawa AmBn yang
terlarutakan mengalamiionisasidalam sistem kesetimbangan, AmBn(s)⇄ mAn+(aq)+ nBm –(aq)
Jika harga kelarutan darisenyawa AmBn sebesar smol/L,maka didalam reaksi
kesetimbangan tersebutkonsentrasiion-ion An+dan Bm –adalah ,
AmBn(s) ⇄ mAn+(aq)+ nBm –(aq)
sehingga harga hasilkalikelarutannya adalah, Ksp AmBn = [An+]m[Bm -]n
= (m s)m(n s)n
= mm x nnx(s)m + n
maka secara umum untuk reaksikesetimbangan:
A
mB
n(
s)
⇄
mA
n+(
aq)
+
nB
m –(
aq)
Ksp AmBn yang mempunyaiharga kelarutan s mol/L dinyatakan dengan
Dan harga kelarutan dariAmBndapatdinyatakan sebagai
Besarnya Ksp suatu zat bersifat tetap pada temperatur tetap. Bila terjadi perubahan temepraturmaka harga Ksp zattersebutakan mengalamiperubahan.
Contoh :
1. Pada suhu tertentu kelarutan AgCldalam airadalah 1,435 mg/liter. a) Berapa kelarutan AgCldalam satuan mol/literjika MrAgCl= 143,5 b) Tentukan [Ag+]dan [Cl-]dalam larutan jenuh AgCltersebut
c) Tentukan Ksp-nya Jawab :
a)s AgCl = 1,435 mg/L
= 1,435 x 10–3gram/L
= 1,435/143,5 x 10–3mol/L
= 10–5 mol/L
b) AgCl(s) ⇄ Ag+(aq) + Cl–(aq)
10–5 mol/L 10-5mol/L 10–5mol/L
Jadi [Ag+] = 10-5mol/L [Cl-] = 10–5 mol/L c) Ksp AgCl = [Ag+][Cl-] = 10–5x 10–5 = 10–10
( )
(m n) n m n mB m x n x s A Ksp = + (m n) n m n x m Ksp s = +atau dengan rumus Ksp AgCl = s2
= (10–5)2
= 10-10
2. Pada suhu tertentu harga Ksp Ca(OH)2 = 4 x 10-12,hitunglah kelarutan Ca(OH)2
dalam airpada suhu tersebut. Penyelesaian :
Ksp Ca(OH)2= 4 x 10–12
Reaksikesetimbangan kelarutan :Ca(OH)2(s)⇄ Ca2+(aq)+ 2 OH–(aq)
harga m = 1 dan n = 2,maka
= 10-4mol/L
Cara lain :
Dimisalkan kelarutan Ca(OH)2= s mol/L
maka,
Ca(OH)2(s)⇄ Ca2+(aq) + 2 OH–(aq)
s mol/L s mol/L 2s mol/L Ksp Ca(OH)2 = [Ca2+]{OH-]2
= (s)(2s)2
4 x 10-12 = 4s3
10-12 = s3
s = 10-4mol/L
3. Berapa gram Mg(OH)2yang dapatlarutdalam 250 mL airpada suhu toC jika pada
suhu tersebutKsp Mg(OH)2= 3,2 x 10-11(MrMg(OH)2= 58)
Penyelesaian :
Ksp Mg(OH)2= 3,2 x 10–11
Mg(OH)2(s)⇄ Mg2+(aq)+ 2OH-(aq)
s = 2 x 10-4 mol/L 3 4 Ksp s = 3 12 4 10 4 − = x s 3 4 Ksp s = 3 11 4 10 2 , 3 − = x s
Jadidalam 250 mL Mg(OH)2yang dapatlarutsebanyak,M= gr/Mrx 1000/v = 2 x 10-4x (250/1000) 2x 10-4= gr/58 x 1000/250 = 0,5 x 10–4mol 4 gr= 2 x10-4x 58 = 0,5 x 10–4x 58 gram gr= 2/4 x 58 x10-4 = 0,0029 gram gr= 29x10-4 Latihan 4.1.
1. Tuliskan rumusan harga K
sp untuk senyawa –senyawa berikut:
a. PbI2 b. CdS c. Ca(OH)2 d. Ag2CrO4 e. Cu2S 2.
Jika hasilkalikelarutan AxBy= Ksp ,hitunglah kelarutan (s)dariAxBy. 3. Kelarutan A
xBydalam airadalah s mol/ literhitunglah Ksp AxBy? 4. Bila pada suhu tertentu kelarutan PbI
2= 1 x 10-4mol/L,hitunglah Ksp PbI2.=4s3 5. Bila Ksp Mg(OH)
2 pada 25oC adalah 4 x 10-12hitunglah pH larutan jenuh Mg(OH)2.
D. Pengaruh Ion Senama terhadap Kelarutan
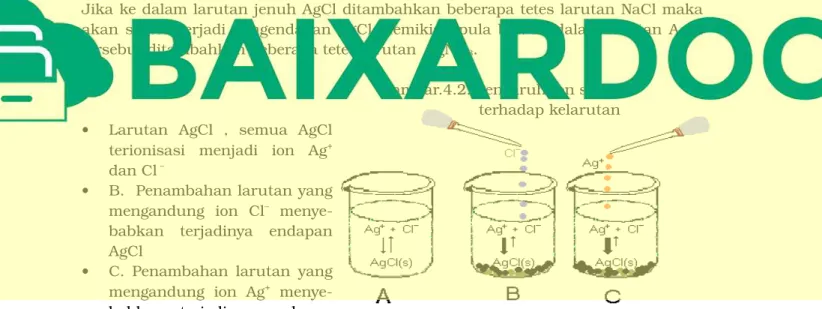
Jika ke dalam larutan jenuh AgClditambahkan beberapa tetes larutan NaClmaka akan segera terjadipengendapan AgCl,demikian pula bila ke dalam larutan AgCl tersebutditambahkan beberapa tetes larutan AgNO3.
Gambar.4.2.Pengaruh Ion senama terhadap kelarutan • Larutan AgCl, semua AgCl
terionisasi menjadi ion Ag+
dan Cl–
• B.Penambahan larutan yang mengandung ion Cl– meny e-babkan terjadinya endapan AgCl
• C.Penambahan larutan yang mengandung ion Ag+ meny
e-babkan terjadinya endapan AgCl.
Mengapa penambahan NaCl atau AgClke dalam larutan jenuh AgCltersebut mengakibatkan terjadinya endapan AgCl.Untuk menjawab peristiwa tersebutdapat dimulaidengan mempelajarireaksikesetimbangan kelarutan AgCl,
AgCl(s)⇄ Ag+(aq)+ Cl–(aq)
Bila ke dalam sistem kesetimbangan tersebut ditambahkan ion Cl- maka
kesetimbangan akan bergeser ke kirisehingga mengakibatkan jumlah AgClyang mengendap betambah.Demikian pula bila ke dalam sistem kesetimbangan tersebut
ditambahkan ion Ag+,maka sistem kesetimbangan akan bergeser ke kiridan
berakibatbertambahnya jumlah AgClyang mengendap.
Kesimpulannya bila ke dalam sistem kesetimbangan kelarutan ditambahkan ion yang senama akan mengakibatkan kelarutan senyawa tersebutberkurang.Secara teoritis dapatdijelaskan dengan contoh berikut,
Contoh:
Ksp AgClpada 25oC adalah 2,0 x 10-10.
a) Berapa kelarutan AgCldalam airpada suhu tersebut. b) Berapa kelarutan AgCldidalam larutan NaCl0,1 M. Penyelesaian :
a) misalkelarutan AgCldalam air:s mol/L AgCl(s) ⇄ Ag+(aq)+ Cl–(aq)
s mol/L s mol/L s mol/L Ksp AgCl = [Ag+][Cl-]
2 x 10-10 = (s){s)
2 x 10-10 = s2
s = 1,41 x 10-5mol/L
b) misalkelarutan AgCldalam larutan NaCl0,1 M = n mol/L AgCl(s) ⇄ Ag+(aq)+ Cl–(aq)
n mol/L n mol/L n mol/L NaCl(aq) → Na+(aq)+ Cl–(aq)
0,1 mol/L 0,1 mol/L 0,1 mol/L Didalam sistem terdapat:
[Ag+] = n mol/L
[Cl-] = (n + 0,1)mol/L
= 0,1 mol/L
(Karena [Cl-]yang berasaldariAgClsangatsedikitdibanding [Cl-]yang berasal
dariNaCl,maka [Cl-]yang berasaldariAgCldapatdiabaikan)
Ksp AgCl = [Ag+][Cl-]
2 x 10–10 = (n)(0,1) n = 2 x 10–9mol/L
Kelarutan AgCl dalam air 1,41 x 10 –5 mol/L jauh lebih besar daripada
kelarutan AgCldalam larutan NaCl0,1 M yang besarnya 2 x 10–9mol/L.Dari
perhitungan tersebutakan makin jelas bahwa semakin besar konsentrasiion yang senama (Cl - :klorida)semakin kecilkelarutannya, buktikan sendiri
dengan mengambilkonsentrasiNaCl1 M. Latihan 4.2.
1. Hitunglah kelarutan PbI2 didalam larutan KI0,2 M jika pada suhu tersebut
diketahuihasilkalikelarutan (Ksp)PbI2= 7 x 10-9.
2. Pada suhu 25oC Ksp Ni(OH)2= 6 x 10-18.Hitunglah kelarutan Ni(OH)2pada:
a) larutan NaOH 0,001 M b) Larutan NiCl20,001 M
c) larutan yang mempunyaipH = 11
d) larutan yang berisiNH30,1M dan NH4Cl0,1 M,KbNH3= 10-5. E.Fungsidan ManfaatHasilKaliKelautan (Ksp)
[Cl-]= (n + 0,1)mol/L
= 0,1 mol/L
Harga hasilkalikelarutan (Ksp )suatu senyawa ionik yang sukar larut dapat memberikan informasitentang kelarutan senyawa tersebutdalam air. Makin besarharga Ksp suatu zatmakin mudah larutsenyawa tersebut.
Harga Ksp suatu zatdapatdigunakan untuk meramalkan terjaditidaknya endapan suatu zatjika dua larutan yang mengandung ion – ion darisenyawa sukar larut dicampurkan.
Untuk meramalkan terjaditidaknya endapan AmBnjika larutan yang mengandung
ion An+dan Bm –dicampurkan digunakan konsep hasilkaliion (Qsp),dimana
Qsp AmBn = [An+]m[Bm -]n
• Jika Qsp > Ksp maka akan terjadiendapan AmBn (LEWAT JENUH)
• Jika Qsp = Ksp maka akan terjadilarutan jenuh AmBn(TEPAT JENUH)
• Jika Qsp < Ksp maka belum terjadilarutan jenuh maupun endapan AmBn
(BELUM JENUH) Contoh :
Ke dalam 100 mL larutan AgNO3 0,001 M ditambahkan 100 mL larutan Na2CO3
0,001 M,selidikilah dengan perhitungan apakah pada penambahan tersebutsudah mengakibatkan terjadinya endapan Ag2CO3.DiketahuiKsp Ag2CO3pada suhu 25oC
adalah 6,3 x 10–12. Penyelesaian : AgNO3= 0,001 M;100 mL Na2CO3 = 0,001 M;100mL = 0,1 mmol = 0,1 mmol Ag+ = 0,1 mmol CO 32- = 0,1 mmol
Volume campuran 200 mL sehingga, [Ag+]= 0,1/200 mol/L [CO 32 -]= 0,1/200 mol/L = 5 x 10-4 = 5 x 10-4mol/L Qsp Ag2CO3 = [Ag+]2[CO32 -] = (5x10-4)2(5x 10-4) = 1,25 x 10-10 Ksp Ag2CO3 = 6,3 x 10–12(diketahui)
Karena Qsp > Ksp maka pada pencampuran terjadiendapan Ag2CO3.
Selain memberiinformasitentang kelarutan harga Ksp dapatdimanfaatkan sebagai sdalah satu faktor yang perlu dipertimbangkan dalam pemisahan zat dalam campuran dengan cara pengendapan selektif.
Contoh:
Untuk memisahkan ion Zn2+dan ion Cd2+yang terdapatsecara bersama-sama
dalam suatu larutan dapatdilakukan dengan mengalirkan gas H2S ke dalam
larutan tersebutsehingga terjadireaksi: Zn2+(aq)+ S2 -(aq)⇄ ZnS(s) Cd2+(aq)+ S2 –(aq)⇄ CdS(s)
Diketahuiharga Ksp ZnS = 1,6 x 10-22dan Ksp CdS = 8 x 10-27dengan mengatur
3 2 4 Ksp Mn(OH) = s 3 2 4 13 10 x 1,8 Mn(OH) = − s
hingga Qsp ZnS < Ksp ZnS sehingga belum mengendap dan Qsp CdS > Ksp CdS sehingga CdS mengendap.Dengan demikian kedua ion tersebut dapat dipisahkan darilarutan.
Contoh:
Suatu larutan mengandung ion Mg2+ dan ion Mn2+ akan dipisahkan dengan
menaikkan harga pH larutan (dengan menambahkan NH3), Berapa pH larutan
supaya Mn2+mengendap sebagaiMn(OH)
2sedangkan Mg2+tetap didalam larutan.
DiketahuiKsp Mg(OH)2= 1,8 x 10-18dan Ksp Mn(OH)2= 1,9 x 10–13
Penyelesaian :
Jika diperhatikan dariharga Ksp darikedua zattersebutmaka Mg(OH)2lebih
mudah mengendap daripada Mn(OH)2 sehingga dapat dicari [OH -] untuk
larutan jenuh Mn(OH)2 = 3,6 x 10–4mol/L Mn(OH)2 Mn2++ 2 OH -3,6 x 10–4 mol/L 2 x 3,6 x 10–4 mol/L [OH-]= 2 x (3,6 x 10–4)mol/L = 7,2 x 10–4 pOH = -log [OH-] = -log 7,2 x 10–4 = 4-0.85 = 3,15 pH = 14 –pOH = 14-3,15 =10,85
Pada pH= 10,85 konsentrasi[OH-]= 7,2 x 10-4maka harga
Qsp Mn(OH)2= Ksp
Mn(OH)2 sehingga Mn2+ membentuk larutan jenuh Mn(OH)2 dan belum
mengendap, sedangkan Qsp Mg(OH)2 > Ksp Mg(OH)2 sehingga Mg2+ akan
mengendap sebagaiMg(OH)2.
Latihan 4.3.
1. Larutan CaCl20,001M sebanyak 200 mL dicampurdengan 300 mL larutan Na2CO3
0,001M .Apakah campuran yang terjaditimbulendapan (Ksp CaCO3= 5 x 10-9)
2. KspAg2S = 2,56 x 10-15.Jika Mr Ag2S = 248,hitunglah massa Ag2S yang dapat
larutdalam 500 mL air!
3. pH larutan jenuh Pb(OH)2pada toC adalah 9+log 2,hitunglah KspPb(OH)2pada toC
4. Hitunglah kelarutan Al(OH)3yang terdapatdalam larutan penyangga dengan pH = 9
Jika diketahuiKsp Al(OH)3= 1,3 x 10-33.
5. Bila ke dalam 1 literlarutan yang mengandung ion Pb2+,Fe2+,Cu2+dan Cd2+dengan
konsentrasimasing-masing 10-4 M dicampur dengan 1 liter larutan Na
2S 10-4M,
dengan menggunakan perhitungan ion mana sajakah yang akan mengendap.Diketahui:KspPbS= 8 x 10-28 KspCdS= 8 x 10-27;KspCuS = 6,3 x 10-36 dan KspFeS = 6,3 x 10-18.