BAB II
TINJAUAN PUSTAKA
2.1 Uraian tumbuhan
Uraian tumbuhan meliputi daerah tumbuh (habitat), morfologi tumbuhan, sistematika tumbuhan, nama asing, kandungan kimia dan kegunaan tumbuhan. 2.1.1 Daerah tumbuh (habitat)
Andaliman (Zanthoxylum acanthopodium DC.) merupakan salah satu jenis rempah-rempah dari tumbuhan liar yang dikenal oleh masyarakat batak, Sumatera Utara. Andaliman termasuk tanaman rempah yang tumbuh di pegunungan kawasan Danau Toba dan sekitarnnya. Diduga penyebaran tanaman secara umum melalui burung yang memakan buah andaliman, kemudian melalui kotoran burung tersebut biji andaliman tersebar kemana-mana dan tumbuh secara liar. DiSumatera Utara tanaman ini tumbuh liar pada berbagai tempat, yaitu di daerah Angkola, Mandailing, Humbang, Silindung, Dairi dan Toba Holbung (Parhusip, 2006).
2.1.2 Morfologi tumbuhan
daun majemuk dengan panjang 2-25 cm, anak daun 1-6 pasang dengan tangkai yang pendek, tepi daun bergerigi, ujung daun runcing, warna daun hijau dan permukaan atas daun lebih tua dibanding permukaan bawah daun. Panjang bunganya 3 mm. Tumbuhan ini berkembang biak dengan biji. Sistem akar tunggang dimana akar lembaga tumbuh terus menjadi akar pokok yang bercabang-cabang menjadi akar-akar yang lebih kecil dan sedikit berbulu halus di seluruh permukaannya (Parhusip, 2006).
2.1.3 Sistematika tumbuhan
Sistematika tumbuhan andaliman menurut Sharma (1993),sebagai berikut: Divisi : Spermatophyta
Sub divisi : Angiospermae Kelas : Dicotyledoneae Anak Kelas : Dialypetalae Bangsa : Geraniales Suku : Rutaceae Marga : Zanthoxylum
Jenis : Zanthoxylum acanthopodium DC. 2.1.4 Nama asing
2.1.5 Kandungan kimia
Buah andaliman (Zanthoxylum acanthopodium DC.) mengandung senyawa alkaloida, fenol hidrokuinon, flavonoida, steroida/triterpenoida, tannin, glikosida dan minyak atsiri (Parhusip, 2006).
2.1.6 Kegunaan
Buah andaliman banyak digunakan sebagai bahan aromatik, tonik, perangsang nafsu makan dan obat sakit perut (Sirait, 1991). Selain itu buah andaliman memiliki aktivitas fisiologi sebagai antioksidan dan antimikroba (Wijaya, 1999).
2.2 Ekstraksi
Metode ekstraksi dapat dilakukan dengan beberapa cara: a. Maserasi
Maserasi adalah proses ekstraksi simplisia yang paling sederhana, dengan cara perendaman menggunakan pelarut yang cocok dengan beberapa kali pengadukan pada temperatur ruangan atau (kamar) (Depkes, 2000). Maserasi pada umumnya dilakukan dengan cara merendam 10 bagian serbuk simplisia dalam 75 bagian cairan penyari (pelarut) kemudian sampai 100 bagian penyari (Depkes, 1986).
b. Perkolasi
dari tahapan pengembangan bahan, tahap perendaman antara,tahap perkolasi sebenarnya (penetesan/penampungan perkolat) sampaidiperoleh ekstrak (Depkes, 2000).
Keuntungan dari metode perkolasi ini adalah proses penarikan zat berkhasiat dari tumbuhan lebih sempurna (Agoes, 2007).
c. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut relatif konstan dengan adanya pendingin balik (Depkes, 2000).
d. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan secara terus-menerus) pada temperatur yang lebih tinggi dari temperatur ruangan, yaitu secara umum dilakukan pada temperatur 40-50°C (Depkes, 2000).
e. Sokletasi
Sokletasi adalah proses penyarian simplisia dengan menggunakan pelarut yang selalu baru, yang umumnya dilakukan dengan alat khusus (menggunakan alat Sokhlet) sehingga terjadi ekstraksi berkesinambungan dengan jumlah pelarut relatif konstan dengan adanya pendingin balik (Depkes, 2000).
f. Infundasi
Infundasi adalah ekstraksi dengan pelarut air pada temperatur pemanasan air (bejana infus diatas penangas air mendidih), temperatur terukur (90-98°C) selama waktu tertentu (15-20 menit) (Depkes, 2000).
g. Dekoktasi
2.3 Kanker
Kanker adalah segolonga tidak terkendali dan kemampuan sel-sel tersebut untuk menyera bersebelahan(invasi)atau dengan migrasi sel ke tempat yang lebih ja Pertumbuhan yang tidak terkendali tersebut disebabkan kerusaka menyebabkan kehilangan fungsi kontrolnya terhadapregulasi daur sel maupun fungsi homeostasis sel pada organisme multiseluler.Dengan kegagalan tersebut, sel tidak dapat berproliferasi secara normal. Akibatnyasel akan berproliferasi terus-menerus sehingga menimbulkan pertumbuhan jaringanyang abnormal (Dianda,2009).Penyakit kanker merupakan penyakit ke-2 terbesar di dunia setelah jantung yangmenyebabkan kematian, sedangkan di Indonesia pada urutan ke-6. Kanker terjadiakibat adanya gangguan fungsi homeostasis atau kegagalan mekanisme pengatur multiplikasi pada organisme multiseluler (Kompas, 2003).
bersifat jinak dantidak menyebar ke jaringan di sekitarnya. Sebaliknya, maligna disinonimkan sebagaitumor yang melakukan metastasis, yaitu menyebar dan menyerang jaringan lain.Maligna sering dikatakan sebagai kanker (Dianda, 2009).
Sel kanker memiliki perbedaan yang sangat signifikan dengan sel normal dalamtubuh. Ciri-ciri khusus sel kanker yang membedakannya dengan sel normal antaralain:
a. Sel kanker tidak mengenal program kematian sel yang dikenal dengan nama apoptosis. Protein p53 mampu mencegah replikasi dari DNA yang rusak pada sel normal dan mendorong penghancuran sendiri dari sel yang mengandung DNA yang tidak normal. Peristiwa ini disebut apoptosis. Apoptosis sangat dibutuhkan untuk mengatur berapa jumlah sel yang dibutuhkan dalam tubuh, yang mana semuanya fungsional dan menempati tempat yang tepat dengan umur tertentu. Bila telah melewati masa hidupnya, sel-sel normal (nonkanker) akan mati dengan sendirinya tanpa ada efek peradangan (inflamasi). Sel kanker berbeda dengan karakteristik tersebut. Sel kankerakan terus hidup meski seharusnya mati (immortal). Mutasi dari gen p53 menyebabkan proliferasi dan transformasi sel menjadi kehilangan kendali (Sofyan, 2000). b. Sel kanker tidak mengenal komunikasi ekstraseluler atau asosial. Komunikasi
menghentikan pertumbuhan dan pembelahan sel. Sel kanker mampu menghindar dari sinyal anti pertumbuhan yang berhubungan dengan daur sel, salahsatu mekanismenya adalah dengan rusaknya gen Rb (Kumar, et al., 2005).
c. Sel kanker mampu menyerang jaringan lain (invasif), merusak jaringan tersebut dan tumbuh subur di atas jaringan lain membentuk anak sebar (metastasis). Semakin besar jangkauan metastasis tumor, kanker semakin sulit disembuhkan.Kanker pada stadium metastasis inilah yang merupakan penyebab 90% kematian penderita kanker (Pecorino, 2005).
d. Untuk mencukupi kebutuhan pangan dirinya sendiri, sel kanker mampu membentuk pembuluh darah baru (neoangiogenesis) meski itu tentunya dapat mengganggu kestabilan jaringan tempat ia tumbuh. Sinyal inisiasi pada proses angiogenesis di antaranya adalah Vascular Endothelial Growth Factor (VEGF) dan Fibroblast Growth Factor (FGF). Selain itu regulator yang lain adalah angiopoietin-1, angiotropin, angiogenin, epidermal growth factor, granulocytecolony-stimulating factor, interleukin-1 (IL-1), IL-6, IL-8, PDGF. TNF-α ,kolagen, cathepsin (Kumar, et al., 2005).
e. Sel kanker memiliki kemampuan yang tidak terbatas dalam memperbanyak dirinya sendiri (proliferasi) meski seharusnya ia sudah tidak dibutuhkan dan jumlahnya sudah melebihi kebutuhan yang seharusnya. Dengan kemampuan untuk memenuhi kebutuhan sinyal pertumbuhan dan kemampuan menghindar dari mekanisme apoptosis, sel kanker memiliki kemampuan tak terbatas untuk bereplikasi (Kumar, et al., 2005).
laporan berbagai penelitian, dapat diketahui bahwa karsinogen digolongkan ke dalam 4golongan yaitu:
a. Bahan kimia, karsinogen bahan kimia melalui metabolisme membentuk gugus elektrofilik yang kurang muatan elektron, sebagai hasil antara, yang kemudian dapat berikatan dengan pusat-pusat nukleofilik pada protein, RNA dan DNA.
b. Virus, contohnya adalah pada golongan virus DNA seperti Human papilomavirus yang menyebabkan kanker penis atau vulva; Epstein Barr virus yang menyebabkan karsinoma nasofaring dan limfoma Burkitt, cytomegalovirus yang menyebaban sarkoma kaposi pada penderita AIDS, virus hepatitis B yang menyebabkan kanker hati. Golongan virus RNA yang menyebabkan kanker atau sarkoma jaringan lunak.
c. Radiasi, terutama radiasi ultraviolet dengan panjang gelombang 290 - 370 nm berkaitan dengan terjadinya kanker kulit.
d. Agen biologik, antara lain hormon estrogen yang membantu pembentukan kanker payudara dan kanker rahim (Anonim, 2007).
2.3.1 Siklus Sel
Siklus sel merupakan proses perkembangbiakan sel yang memperantarai pertumbuhan dan perkembangan makhluk hidup. Setiap sel baik normal maupun kanker mengalami siklus sel. Siklus sel memiliki dua fase utama, yakni fase S (sintesis) dan fase M (mitosis). Fase S merupakan fase terjadinya replikasi DNA kromosom dalam sel, sedangkan pada fase M terjadi pemisahan 2 set DNA kromosom tersebut menjadi 2 sel (Nurse, 2000).
dinamakan G-2 (Gap-2). Pada fase G1, sel melakukan persiapan untuk sintesis DNA. Fase ini merupakan fase awal cell cycle progression yang diatur oleh faktor ekstraselular seperti mitogen dan molekul adhesi. Penanda fase ini adalah adanya ekspresi dan sintesis protein sebagai persiapan memasuki fase S. Pada fase G2, sel melakukan sintesis lebih lanjut yang memadai untuk proses pembelahan, sehingga sel siap melakukan pembelahan pada fase M (Ruddon, 2007).
Siklus sel dikontrol oleh beberapa protein yang bertindak sebagai regulator positif dan negatif. Kelompok cyclin khususnya cyclin D, E, A dan B merupakan protein yang levelnya fluktuatif selama proses siklus sel. Cyclin bersama dengan kelompok cyclin dependent kinase (CDK), khususnya CDK 4, 6 dan 2, bertindak sebagai regulator positif yang memacu terjadinya siklus sel. Pada mamalia ekspresi kinase (CDK4, CDK2 dan CDC2/CDK1) terjadi bersamaan dengan ekspresi cyclin (D, E, A, dan B) secara berurutan seiring dengan jalannya siklus sel (G1-S-G2-M) (Nurse, 2000). Aktivasi CDK dihambat oleh regulator negatif siklus sel, yakni CDK inhibitor (CKI), yang terdiri dari Cip/Kip protein (meliputi p21, p27, p57) dan keluarga INK4 (meliputi p16, p18, p19). Selain itu, tumor suppressor protein yaitu p53 dan pRb juga bertindak sebagai protein regulator negatif (Foster, et al., 2001).
transcription gen yang diperlukan untuk fase S (di akhir G1 untuk menginisiasi fase S) dan juga di akhir G2 untuk menginisiasi mitosis (M) (Nurse, 2000).
Checkpoint pada G2 terjadi ketika ada kerusakan DNA yang akan mengaktivasi beberapa kinase termasuk ataxia telangiectasia mutated (ATM) kinase. Hal tersebut menginisiasi dua kaskade untuk menginaktivasi Cdc2-CycB baik dengan jalan memutuskan kompleks Cdc2-CycB maupun mengeluarkan kompleks Cdc-CycB dari nukleus atau aktivasi p21. Checkpoint pada fase G1 akan dapat dilalui jika (1) ukuran sel memadai; (2) ketersediaan nutrien mencukupi; dan (3) adanya faktor pertumbuhan (sinyal dari sel yang lain).
Checkpoint pada fase G2 dapat dilewati jika ukuran sel memadai, dan replikasi kromosom terselesaikan dengan sempurna, sedangkan checkpoint pada metaphase (M) terpenuhi bila semua kromosom dapat menempel pada gelendong (spindle) mitotik (Ruddon, 2007).
Checkpoint ini akan menghambat progresi siklus sel ke fase mitotik, sedangkan checkpoint pada fase M (mitosis) terjadi jika benang spindle tidak terbentuk atau jika semua kromosom tidak dalam posisi yang benar dan tidak menempel dengan sempurna pada spindle. Checkpoint tersebut bekerja dengan memonitor apakah kinetokor dan mikrotubul terhubung secara benar. Jika tidak, kohesi kromatid akan tetap berlangsung dan mikrotubul gagal untuk memendek sehingga kromatid tidak bergerak menjauh ke kutub yang berlawanan (Ruddon, 2007).
bagi timbulnya kanker. Oleh karena itu, proses regulasi siklus sel mampu berperan dalam pencegahan kanker (Ruddon, 2007).
2.3.2 Karsinogenesis
Kanker bukanlah penyakit yang datang dengan begitu saja, melainkan akibatakumulasi atau penumpukan kerusakan-kerusakan tertentu di dalam tubuh.Serangkaian proses berkembangnya kanker disebut karsinogenesis. Karsinogenesisadalah suatu proses terjadinya kanker melalui mekanisme multitahap yangmenunjukkan perubahan genetik dan menyebabkan transformasi progresif sel normalmenjadi sel malignan (ganas) (Tsao, et al., 2004). Perubahan ini diawali dari mutasi somatik satu sel tunggal yang mengakibatkan perubahan dari normal menjadi hiperplastik, displastik, dan pada akhirnya menjadi suatu keganasan atau malignansi (memiliki kemampuan metastasis atau menginvasi jaringan di sekelilingnya). Perubahan genetik ini termasuk perubahan seluler mendasar pada sel kanker yang dipengaruhi oleh beberapa gen seperti: tumor suppresor genes (pRb, p53,PTEN,E-cadherin) dan proto-oncogenes (ras, c-myc, Bcl-2). Karsinogenesis dapat dibagi menjadi empat tahap utama, yaitu tahap inisiasi, promosi, progresi, dan metastasis (Tsao, et al., 2004).
ini ada yang bersifat reaktif, mutagenik, dan mampu berikatan dengan makromolekul di dalam tubuh seperti DNA dengan ikatan irreversible. Sel yang mengalami inisiasi atau prakanker dapat kembali ke tingkat normal secara spontan, tetapi pada tingkat lebih lanjut dapat menjadi ganas (malignan) (Tsao, et al., 2004)).
Tahap karsinogenesis selanjutnya adalah promosi. Tahap ini merupakan tingkat lanjutan dari tahap inisiasi. Pada tahap ini, sel mulai mengalami hiperplastik pada inti sel (Tsao, et al., 2004). Berbeda dengan tahap inisiasi yang dapat melewati jalur germinal dan somatik, tahap promosi hanya diketahui terjadi melalui jalur somatik. Pada tahap promosi, sel-sel akan memperoleh beberapa keuntungan selektif untuk tumbuh sehingga pertumbuhannya menjadi cepat dan berubah menjadi tumor jinak. Tahap promosi tidak melibatkan perubahan struktural dari genom secara langsung, tetapi biasanya terjadi perubahan ekspresi gen yang terinisiasi (Tsao, et al., 2004)
Pada tahap progresi, kemampuan pembelahan yang tinggi menuntun terbentuknya koloni sel yang lebih besar melalui perubahan genetik lebih lanjut dan munculnya keistimewaan-keistimewaan lain seperti peningkatan mobilitas dan angiogenesis (Kumar, et al, 2005). Pada tahap ini, sel-sel tumor dikatakan sebagai sel malignan. Pada fase ini juga akan terjadi karsinoma dan metastasis melalui aktivasi onkogen dan malfungsi dari enzim topoisomerase (Pecorino, 2005).
saluran limpoid. Sel tersebut akan berinteraksi dengan sel limpoid yang digunakan sebagai inangnya. Selanjutnya, sel kanker akan masuk ke jaringan lainnya membentuk tumor sekunder dengan didukung kemampuan neoangiogenesis yang dimilikinya (Kumar, et al., 2005).
Tahap metastasis dapat berlangsung karena melemahnya ikatan antarsel yang disebabkan oleh terdegradasinya CAMs (Cell-cell Adhesion Molocules) dan E-cadherin sebagai molekul yang menjaga pertautan antarsel. Molekul-molekul tersebut diketahui sudah sangat sedikit bahkan tidak ditemukan lagi pada sel kanker, sehingga proses metastasis dapat terus terjadi (Kumar, et al., 2005). 2.3.3 Kanker payudara
Kanker payudara merupakan kanker yang menyerang jaringan epitelial payudara, yaitu membran mukosa dan kelenjar, sehingga kanker payudara tergolong pada karsinoma. Kanker payudara merupakan kanker yang paling umum diderita oleh wanita, di samping kanker serviks. Penyebab kanker payudara sangat beragam, antara lain(Torosian, 2002):
a. Kerusakan pada DNA yang menyebabkan mutasi genetik. Kerusakan ini dapat disebabkan oleh radiasi yang berlebihan.
b. Kegagalan immune surveillance dalam pencegahan proses malignan pada fase awal.
c. Faktor pertumbuhan yang abnormal.
d. Malfungsi DNA repairs seperti : BRCA1, BRCA2 dan p53.
Semua tipe jaringan pada payudara dapat berkembang menjadi kanker, namun pada umumnya kanker muncul baik dari saluran (ducts) maupun kelenjar (glands). Perkembangannya memerlukan waktu berbulan-bulan atau bertahun-tahun sampai tumor tersebut cukup besar untuk dirasakan pada payudara. Deteksi dapat dilakukan dengan mammogramsyang kadang-kadang dapat mendeteksi tumor sejak dini (Dolinsky, 2002).
Faktor resiko kanker payudara dapat dibedakan menjadi faktor yang dapat diubah (reversible) dan yang tidak dapat diubah (irreversible). Faktor-faktor yang tidak dapat diubah termasuk jenis kelamin, bertambahnya umur, ada-tidaknya riwayat keluarga menderita kanker, pernah-tidaknya menderita kanker payudara, pernah-tidaknya mendapat terapi radiasi pada bagian dada, suku bangsa Kaukasian, orang yang mengalami menstruasi pertama pada usia sangat muda (sebelum 12 tahun), yang mengalami menopause terlambat (setelah 50 tahun), yang tidak pernah melahirkan atau melahirkan di usia lebih dari 30 tahun, dan yang mengalami mutasi genetik. Dari berbagai macam faktor tersebut, 3%-10% penyebab kanker payudara diduga berkaitan dengan perubahan baik gen BRCA1
maupun gen BRCA2 (Dolinsky, 2002).
resiko tersebut. Menghindari faktor resiko tersebut dan deteksi awal adalah cara terbaik untuk mengurangi kematian berkaitan dengan kanker ini.
Peningkatan insidensi kanker payudara disebabkan oleh kegagalan terapi terhadap kanker itu sendiri. Kegagalan ini diakibatkan oleh adanya
multidrugresistance (MDR) dan terjadi hingga 71% dibandingkan dengan faktor penyebab lainnya (Mechetner, et al., 1998). Multidrug resistance atau resistensi obat ini diakibatkan oleh adanya breast cancer resistance protein (BCRP) yang salah satunya adalah P-glycoprotein (Pgp) (Imai, et al., 2005). Aktivasi Pgp dan peningkatan ekspresinya dapat menurunkan efikasi dari beberapa agen kemoterapi seperti Taxol dan Doxorubicin (Mechetner, et al., 1998). Penekanan aktivitas Pgp dan ekspresinya mampu meningkatkan efektivitas agen kemoterapi (Zhou, et al., 2006).
Selain itu, paparan estrogen endogen yang berlebihan juga dapat berkontribusi sebagai penyebab kanker payudara. Sekitar 50% kasus kanker payudara merupakan kanker yang bergantung pada estrogen dan sekitar 30% kasus merupakan kanker yang positif mengekspresi HER-2 berlebihan (Gibbs, 2000). Kedua protein tersebut selain berperan dalan metastasis, juga berperan dalam perkembangan kanker payudara (early cancer development).
onkoprotein yang berperan utama dalam sinyal pertumbuhan, misalnya Ras, Myc, dan cycD1 (Foster, et al., 2001). Aktivasi protein ini mengakibatkan adanya pertumbuhan yang berlebihan melalui aktivasi onkoprotein yang lain seperti P13K, AKT, Raf, ERK, dan MAP kinase (Hahn, et al., 2002). Di lain pihak, kompleks estrogen dengan reseptornya juga akan memacu transkripsi beberapa gen tumor suppressor, seperti BRCA1, BRCA2, dan p53. Namun, pada penderita kanker payudara (yang umumnya telah lewat masa menopause) gen-gen tersebut telah mengalami perubahan (transformed) akibat dari hiperproliferasi sel-sel payudara selama perkembangannya sehingga tidak berperan sebagaimana mestinya (Adelmann, et al., 2000, Clarke, 2001; Ingvarsson, et al., 2001).
2.3.4 Sel MCF-7
Salah satu model sel kanker payudara yang sering digunakan dalam penelitian adalah sel MCF-7. Sel ini merupakan sel kanker payudara yang mengekspresikan reseptor estrogen (ER+) dan berasal dari pleural effusionbreast adenocarcinoma seorang pasien wanita Kaukasian berumur 69 tahun, golongan darah O(Anonim, 2008). Sel ini mengekspresikan reseptor estrogen alfa (ER-α), memiliki sifat resisten terhadap doxorubicin (Zampieri, et al., 2002) dan tidak mengekspresikan caspase-3. Pada sel MCF-7, Pgp diekspresikan tinggi, sehingga sensitivitas terhadap agen kemoterapi seperti doxorubicin rendah (Wong, et al., 2006). Penurunan konsentrasi ini dapat mengurangi efektivitas senyawa kemoterapi pada sel MCF-7. Salah satu cara untuk meningkatkan sensitivitas MCF-7 adalah dengan menghambat ekspresi dan aktivasi Pgp (Zhou, et al., 2006). 2.3.5 Sel T47D
kehilangan estrogen reseptor (ER) apabila kekurangan estrogen pada jangka waktu lama selama percobaan in vitro. Sel ini berasal dari ductal carcinoma dan mengekspresikan caspase 3 (Mooney, et al., 2002). Oleh karena itu sel ini digunakan pada model untuk penelitian resistensi obat pada pasiendengan tumor payudara p53 mutan (Anonimb
2.3.6 P-glycoprotein
, 2012).
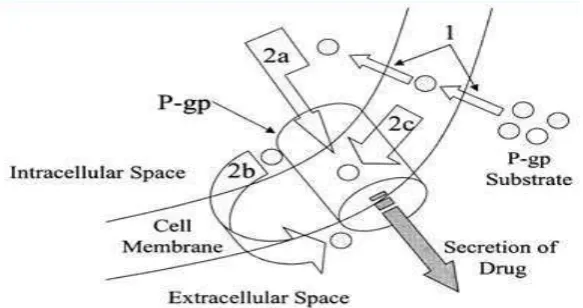
P-glycoprotein (Pgp) merupakan protein ABC-transporter pada manusia yang termasuk dalam subfamili MDR/TAP (Allen, et al., 2002) Pgp dikenal dalam beberapa sebutan yakni ABCB1, ATP-binding cassette sub-famili B member 1, MDR1, dan PGY1 (Choi, 2005). ABCD1 atau Pgp termasuk dalam
ATP-dependentefflux pumpyang memiliki substrat spesifik antara lain: obat (colchicine
dan tacrolimus), agen kemoterapi (etoposide, adrimycin dan vinblastine), lipid, steroid, xenobiotik, peptide, bilirubin, cardiac glycoside (digoxin), glucocorticoids (dexamethasone) dan agen terapi HIV tipe 1 (inhibitorprotease dan nonnucleoside reverse transcriptase) (Kitagawa, 2006). Di dalam tubuh, Pgp ini dapat ditemukan pada sel usus, hati, tubula ginjal dan capillary endothelial (Deng, et al., 2001).Dalam sistem organ, Pgp berpengaruh terhadap absorbsi, distribusi dan eliminasi obat (Matheny, et al., 2001).
oleh ATP melalui pembentukkan kompleks Pgp-ATP (Conseil, et al., 1998). Hidrolisis ATP oleh ATPase memberikan energi aktivasi pada Pgp (Choi, et al., 2005). Aktivasi Pgp akan menurunkan intakeagen kemoterapi sehingga menurunkan efikasi agen tersebut terhadap sel kanker. Pada kondisi expresi yang berlebihan, Pgp dapat menyebabkan resistensi obatterutama agen kemoterapi pada kanker payudara seperti doxorubicin (Mechetner, et al., 1998). Pgp akan mengikat doxorubicin sebagai salah satu substratnya untuk dikeluarkan dari dalam sel (Wong, et al., 2006). Pgp atau ABCD1 pertama kali diujikan sebagai multidrug resistance dan terbukti sebagai penyebab resistensi obat kemoterapi (Juliano, 1976).
Penghambatan aktivasi dan ekspresi Pgp memegang peranan penting dalam keberhasilan terapi kanker (Zhou, et al., 2006). Penghambatan aktivitas Pgp dapat melalui dua mekanisme yakni (1) penghambatan substrat Pgp secara langsung dengan berikatan pada Pgp-binding domain dan (2) penghambatan hidrolisis ATP oleh ATase melalui ikatan substrat dengan ATP (Kitagawa, 2006)
Penghambatan ini dapat dilakukan menggunakan senyawa flavonoid dan polifenol melalui dua sisi ikatan pada ATP-binding sites dan steroid interacting region dimana ATPase berikatan dengan Pgp cytosolic domain (Kitagawa, 2006).
Pgp memompa senyawa-senyawa (2a, 2b, 2c) yang termasuk substratnya untuk dikeluarkan dari dalam sel. Ekspresi berlebih dari Pgp ini dapat menyebabkan resistensi obat pada terapi kanker payudara (Matheny, et al., 2001).
Penekanan ekspresi Pgp dapat dilakukan melalui berbagai mekanisme antara lain aktivasi jalur sinyal transduksi c-Jun NH2-terminal kinase (JNK) dan inaktivasi NF-κB transcriptional factor, c-Jun NH2-terminal kinase (JNK) merupakan protein kinase yang berikatan dengan NH2-terminal yang merupakan sisi aktif pada c-Jun transcriptional factordan protein ini mampu memfosforilasi c-Jun. Fosforilasi c-Jun akan menstimulasi pembentukan ikatan dengan AP-1, suatu elemen pada gen MDR1. Pembentukan ikatan ini akan mencegah ekspresi mRNA MDR1 dan pada akhirnya akan menghambat ekspresi Pgp. Fosforilasi c-Jun tersebut dapat dilakukan oleh salvicine (quinine diterpenoid sintetik) (Zhou, et al., 2006).
Penelitian yang dilakukan oleh Deng, et al., (2001), melaporkan bahwa aktivasi NF-κB sebagai akibat adanya stimulus dari lingkungan berupa stress, paparan agen sitotoksik, heat shock, iradiasi, genotoxic stress, inflamasi, paparan sitokin dan faktor pertumbuhan dapat meningkatkan ekspresi Pgp. NF-κB yang aktif mampu berikatan dengan promoter gen MDR1 sehingga proses ekspresi Pgp dapat berjalan. Inaktivasi NF-κB mampu menghambat ekspresi Pgp (Deng, 2001). 2.3.7 Doxorubicin dan resistensinya pada kanker payudara
Doxorubicin memiliki aktivitas antineoplastik dan spesifik untuk fase S dalam siklus sel. Mekanisme aktivitas antineoplastiknya belum diketahui dengan pasti. Mekanisme aksi doxorubicin kemungkinan melibatkan ikatan dengan DNA melalui interkalasi di antara pasangan basa serta menghambat sintesis DNA dan RNA melalui pengkacauan template dan halangan sterik. Kemungkinan mekanisme yang lain adalah melibatkan ikatan dengan lipid membran sel, yang akan mengubah berbagai fungsi selular dan berinteraksi dengan topoisomerase II membentuk kompleks pemotong DNA.
Doxorubicin telah digunakan pada beberapa pengobatan jenis tumor seperti kanker payudara, esophagus, osteosarkoma, Kaposi’s sarkoma, sarkoma jaringan lunak, limfoma Hodgkin dan non-Hodgkin baik dalam aplikasi tunggal maupun kombinasi dengan beberapa agen antitumor lainnya (Chen, et al., 2006). Aplikasi doxorubicin yang telah digunakan secara klinis untuk berbagai jenis tumor ini dibatasi oleh timbulnya efek samping (Tyagi, et al., 2004).
Efek samping yang timbul segera setelah pengobatan dengan doxorubicin adalah mual, imunosupresi dan aritmia yang sifatnya revesibel serta dapat dikontrol dengan obat-obat lain. Efek samping yang paling serius akibat pengobatan dengan doxorubicin dalam jangka waktu yang lama adalah
Permasalahan yang sering timbul dalam terapi kanker terutama kanker payudara menggunakan doxorubicin adalah resistensi obat dan menjadi penyebab kegagalan terapi kanker payudara (Mechetner, et al., 1998). Resistensi ini diperantarai oleh berbagai mekanisme antara lain: mutasi pada target obat, kegagalan inisiasi apoptosis, dan pengeluaran obat oleh protein transporter pada membran sel (Notobartolo, et al., 2005). Pengeluaran obat yang disebabkan oleh adanya pompa efflux Pgp menjadi salah satu sebab utama resistensi obat ini (Mechetner, et al., 1998).
Doxorubicin termasuk obat golongan antrasiklin yang merupakan substrat Pgp (Mechetner, et al., 1998; Wong, et al., 2006). Doxorubicin akan dikenali oleh Pgp dan selanjutnya segera dikeluarkan dari dalam sel sehingga menurunkan konsentrasi efektif doxorubicin dalam sel kanker. Mekanisme pemompaan oleh Pgp sangat bergantung pada aktivasi protein tersebut dan penekanan ekspresi Pgp (Zhou, et al., 2006). Oleh karena itu, inaktivasi Pgp dan penekanan ekspresinya mampu mengatasi permasalahan resistensi sel kanker terhadap doxorubicin (Mechetner, et al., 1998; Zhou, et al., 2006).
2.3.8 Terapi Kombinasi
tersebut menuntut pengembangan cara pengobatan baru bagi kanker payudara (Tyagi, et al., 2004).
Pemanfaatan senyawa alam yang non-toksik dengan efektivitas tinggi melawan kanker dapat menjadi pilihan pengembangan terapi kombinasi dengan agen kemoterapi (Sharma, et al., 2004; Tyagi, et al., 2004). Oleh karena itu, berbagai metode dapat dilakukan untuk mengembangkan dan mengevaluasi kombinasi terapi yang tepat.
Isobologram dan combination index (CI) merupakan metode yang umum digunakan untuk mengevaluasi kombinasi obat. Metode ini dikemukakan pertama kali oleh Chou dan Talalay pada tahun 1984 (Zhao, et al., 2004).
Analisis isobologram mengevaluasi interaksi dua obat dengan jalan menentukan terlebih dahulu konsentrasi efektif (IC50) dari masing-masing obat ketika diaplikasikan sebagai agen tunggal kemudian diplotkan pada sumbu X dan Y. Garis yang menghubungkan kedua titik disebut dengan garis aditif. Selanjutnya, konsentrasi kombinasi kedua obat untuk menghasilkan efek yang sama digambarkan pada plot yang sama. Efek sinergis, aditif, atau antagonis diindikasikan oleh letak titik plot tersebut, yaitu apakah (secara berurutan) di bawah, pada, atau di atas garis aditif (Zhao, et al., 2004)
Selain dengan isobologram, interaksi antara dua obat dapat dianalisis dengan CI (combination index). Analisis CI menghasilkan suatu nilai parameter kuantitatif yang menggambarkan efikasi dari kombinasi dengan menggunakan persamaan sebagai berikut, I= (D)1/(Dx)1 + (D)2/(Dx)2
kedua senyawa untuk memberikan efek yang sama. Nilai CI kurang, sama, atau lebih dari 1 mengindikasikan efek (secara berurutan) sinergis, aditif, atau antagonis (Zhao, et al., 2004; Reynolds, et al., 2005).
Uji efek kombinasi dengan kedua metode tersebut biasanya dilakukan secara in vitro. Metode uji in vitro dapat digunakan sebagai uji praklinik awal untuk menggambarkan interaksi kombinasi, sehingga ketika dilakukan uji in vivo
hasilnya akan lebih efisien.
2.4 Uji sitotoksik menggunakan metode MTT
Uji sitotoksisitas dilakukan secara in vitro, yaituuntuk menentukan potensi sitotoksik suatu senyawa seperti obat antikanker. Toksisitas merupakan kejadian kompleks secara in vivo yang menimbulkan kerusakan sel akibat penggunaan obat antikanker yang bersifat sitotoksik. Respon sel terhadap agen-agen sitotoksik dipengaruhi oleh kerapatan sel (Kupcsik, 2011).
Metode MTT [3-(4,5-dimetiltiazol-2-il)-2,5-difenil tetrazolium bromida] adalah salah satu uji sitotoksisitas yang bersifat kuantitatif. Uji ini berdasarkan pengukuran intensitas warna (kolorimetri) yang terjadi sebagai hasil metabolisme suatu substrat oleh sel hidup menjadi produk berwarna (Kupcsik, 2011).
Pada uji ini digunakan garam MTT. Garam ini akan terlibat pada kerja enzim dehidrogenase. MTT akan direduksi menjadi formazan oleh sistem reduktase suksinat tetrazolium, yang termasuk dalam mitokondria dari sel hidup (Kupcsik, 2011).
Formazan merupakan zat berwarna ungu yang tidak larut dalam air sehingga dilarutkan menggunakan HCl 0,04 N dalam isopropanool atau 10% SDS dalam HCl 0,01 N. Intensitas warna ungu terbentuk dapat ditetapkan dengan spektrofotometri dan berkorelasi langsung dengan jumlah sel yang aktif melakukan metabolisme, sehingga berkorelasi dengan viabilitas sel. Persentase viabilitas dapat dihitung dengan persamaan sebagai berikut (Kupcik,2001).
% Viabilitas = absorbansi sel dengan perlakuan-Absorbansi mediax 100 % Absorbansi Sel-Absorbansi media
2.5 Apoptosis
Apoptosis adalah kematian sel melalui mekanisme genetik dengan kerusakan/fragmentasi kromosom atau DNA. Apoptosis dibedakan menjadi dua kelompok, yaitu:
1. Apoptosis fisiologis
tertentu (level kritis) akibat pembelahan berulang, maka sel tersebut tidak dapat melakukan pembelahan diri lagi. Selanjutnya sel akan mengalami apoptosis secara fisiologis. Pada sel ganas, pemendekan telomerase sampai pada level kritis tidak terjadi karena pada sel ganas terjadi aktivasi dari enzin ribonukleoprotein (telomerase) secara terus menerus. Enzim ini sangat berperan pada sintetis
telomeric DNA, sehingga berbagai elemen yang dibutuhkan pada pembentukan telomer dapat dibentuk secara terus menerus dan ukuran telomer pada ujung kromosom dapat dipertahankan. Oleh karena itu, sel ganas dapat bersifat immortal (Sudiana, 2011).
2. Apoptosis patologis
Apoptosis patologis adalah kematian sel karena adanya suatu rangsangan. Proses kematian sel (apoptosis) dapat melalui beberapa jalur, antara lain sebagai berikut:
a) Aktivitas p-53
Apoptosis ini dipicu oleh aktivitas p-53 karena sel yang bersangkutan memiliki gen yang cacat (gene defect) yang dipicu oleh banyak faktor, antara lain bahan kimia, radikal bebas, maupun virus (oncovirus). Gen yang cacat dapat memicu aktivitas beberapa enzim seperti PKC dan CPK-K2, dimana kedua enzim ini dapat memicu aktivitas p-53. p-53 adalah fraktor transkripsi terhadap pembentukan p-21. Peningkatan p-21 akan menekan semua CDK (Cyclin Dependent-protein Kinase) dengan cyclin, dimana siklus pembelahan sel sangat tergantung pada ikatan kompleks antara CDK dengan cyclin.
sehingga p-53 akan memicu aktivitas BAX. Protein BAX akan menekan aktivitas BCL-2 sehingga terjadi perubahan membran permeabilitas dari mitokondria. Perubahan ini mengakibatkan terjadinya pelepasan cytokrom-C ke sitosol sehingga akan mengaktivasi kaskade kaspase dan kaspase aktif ini akan mengaktifkan DNA-se. DNA-se yang aktif akan menembus membran inti dan merusak DNA, sehingga DNA sel akan terfragmentasi dan mengalami apoptosis. b) Jalur sitotoksik
Apoptosis dipicu oleh adanya sel yang memiliki gen cacat (gene defect) sehingga sel akan mengekspresiakn protein asing. Protein asing yang dhasilkan dapat bersifat imunogenik sehingga memicu pembentukan antibodi. Antibodi akan menempel di permukaan sel killer dan akan memicu pelepasan enzim yang disebut sebagai sitotoksin. Sitotoksin tersebut mengandungperforin dan granzyme, dimana perforin dapat memperforasi membran sel yang memiliki gen cacat sedangkan granzyme akan masuk ke dalam sel dan mengaktivasi kaspase kaspade. Kaspase yang aktif ini akan mengaktivasi DNA-se sehingga sel mengalami kematian (apoptosis).
c) Disfungsi mitokondria
Disfungsi mitokondria adalah gangguan ekspresi protein pada mitokondria yang tidak seimbang baik ekspresinya yang berlebihan, maupun protein yang diekspresikan adalah protein abnormal.
d) Kompleks fas dan ligan
ikatan antar fas-ligan akan mengaktifase suatu protein yang disebut FasAssociated Protein Death Domain (FADD) yang dapat mengaktivasi kaspase kaskade. Selanjutnya, kaspase yang aktif akan mengaktifkan DNA-se sehingga sel akan mengalami apoptosis (Sudiana, 2011).
2.6. Sel Vero