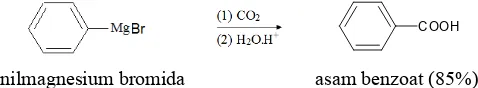MAKALAH
ASAM KARBOKSILAT DAN DERIVAT
disusun untuk memenuhi tugas mata kuliah Organik II
Disusun oleh
NAUFA MUFIDA NUR 013021211007
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
KATA PENGANTAR
Dengan nama Allah yang Maha Pengasih dan Maha Penyayang. Segala puji dan syukur bagi Allah swt yang dengan ridho-Nya saya dapat menyelesaikan makalah ini dengan baik dan lancar. Terima kasih kepada yang terlibat dalam pembuatan makalah ini yang dengan do'a dan bimbingannya makalah ini dapat terselesaikan dengan baik dan lancar.
Dalam makalah ini, saya membahas tentang ”Asam Karboksilat dan Derivat” yang saya buat berdasarkan metode bibliografi. Makalah ini diharapkan bisa menambah wawasan dan pengetahuan yang selama ini kita cari serta dapat dimafaatkan sebaik dan semaksimal mungkin.
Demikian pula makalah yang saya buat oleh karena itu saran dan kritik yang membangun tetap saya nantikan dan saya harapkan demi kesempurnaan makalah ini.
Sukabumi, 10 Maret 2014
BAB I PENDAHULUAN
A. Latar belakang
Asam karboksilat adalah asam organik yang diidentikkan dengan gugus karboksil. Asam karboksilat merupakan asam Bronsted-Lowry (donor proton). Garam dan anion asam karboksilat dinamakan karboksilat. Asam karboksilat merupakan senyawa polar, dan membentuk ikatan hidrogen satu sama lain. Pada fasa gas, Asam karboksilat dalam bentuk dimer. Dalam larutan Asam karboksilat merupakan asam lemah yang sebagian molekulnya terdisosiasi menjadi H+ dan
RCOO-.
Derivat asam karboksilat merupakan turunan asam karboksilat, dimana ditinjau dari strukturnya senyawa yang diperoleh dari hasil pergantian gugus –OH dalam rumus struktur RCOOH oleh gugus –NH2, -OR, atau –OOCR. Dalam
derivat asam karboksilat ini lebih spesifik membahas halida asam, anhidrida asam, ester, amida, dan nitril. Semua turunan asam karboksilat mempunyai gugus fungsi asil (RCO-) atau aroil (ArCO-) dan bila dihidrolisis menghasilkan asam karboksilat. Oleh karena itu adanya gugus karbonik menyebabkan turunan asam karboksilat bersifat polar, dan kepolaran ini yang berpengaruh terhadap sifat-sifat yang ada pada turunan asam karboksilat.
B. Rumusan Masalah
1. Apa yang dimaksud Asam Karboksilat dan Derivat?
2. Bagaimana reaksi khas pada Asam Karboksilat dan Derivat? 3. Dan Bagaimana sifat Asam Karboksilat dan Derivat?
C. Tujuan
BAB II PEMBAHASAN
A. ASAM KARBOKSILAT
Asam karboksilat adalah suatu senyawa organic yang mengandung gugus karboksil, -CO2H. Gugus karboksil mengandung sebuah gugus karbonil dan
sebuah gugus hidroksil; antar-aksi dari kedua gugus ini mengakibatkan suatu kereaktivan kimia yang unik untuk asam karboksilat.
datar polar elektron menyendiri
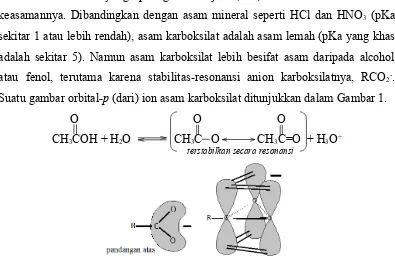
Sifat kimia yang paling menonjol (dari) asam karboksilat ialah keasamannya. Dibandingkan dengan asam mineral seperti HCl dan HNO3 (pKa
sekitar 1 atau lebih rendah), asam karboksilat adalah asam lemah (pKa yang khas adalah sekitar 5). Namun asam karboksilat lebih besifat asam daripada alcohol atau fenol, terutama karena stabilitas-resonansi anion karboksilatnya, RCO2-.
Suatu gambar orbital-p (dari) ion asam karboksilat ditunjukkan dalam Gambar 1. O O O
CH3COH + H2O CH3C O CH3C=O + H3O+
terstabilkan secara resonansi
Gambar 1. Ikatan dalam ion karboksilat, RCO2
-1. Tata Nama Asam Karboksilat
Tabel 1. Nama trivial sepuluh asam karboksilat pertama Banyakny
a atom C Struktur
Nama
trivial Terdapat di alam dan penurunan nama
1 HCO2H Format Semut (L.formica)
2 CH3CO2H Asetat Cuka (L.acetum)
3 CH3CH2CO2H Propionate Susu, mentega dan keju (Yun: protos,
pertama; pion, lemak) 4 CH3(CH2)2CO2H Butirat Mentega (L.butyrum)
5 CH3(CH2)3CO2H Valerat Akar valeria (L.valere, menjadi kuat)
6 CH3(CH2)4CO2H Kaproat Kambing (L.caper)
7 CH3(CH2)5CO2H Enantat (Yun: oenanthe, kuncup anggur)
8 CH3(CH2)6CO2H Kaprilat Kambing
9 CH3(CH2)7CO2H Pelargonat Esternya dijumpai dalam Pelargonium
Roseum, suatu Geranium
Huruf Yunani dapat digunakan dalam nama trivial asam karboksilat untuk mengacu pada suatu posisi dalam molekul relative terhadap gugus karboksil.
Br
CH3CH2CO2H CH3CH2CHCO2H
karbon β karbon α asam α-bromobutirat
atau asam 2-bromobutanoat
Kadang-kadang lebih mudah mengacu pada gugus RCO- sebagai gugus asil (acy group) dan RCO2- sebagai gugus asiloksi. Misalnya, asilasi benzene ialah
O
gugus asil gugus asiloksi gugus asetil
(Ac-)
Secara ideal struktur gugus karbonil sesuai untuk membentuk dua ikatan hydrogen antara sepasang molekul. Sepasang molekul asam karboksilat yang saling beikatan-hidrogen seringkali dirujuk sebagai dimer asam karboksilat. Karena kuatnya ikatan hydrogen ini (kira-kira 10kkal/mol untuk dua ikatan hidrogen), asam karboksilat dijumpai dalam bentuk dimer, bahkan dalam fase uap.
suatu dimer asam karboksilat ikatan hidrogen dengan H2O
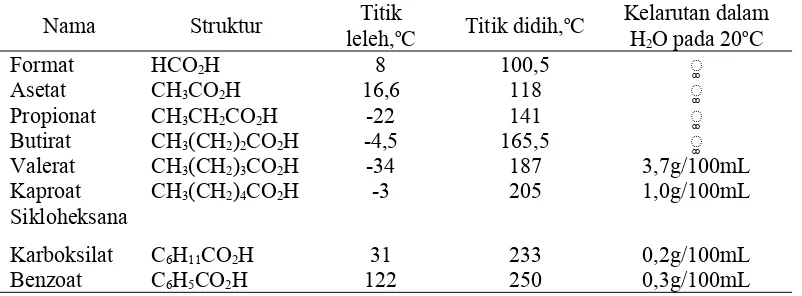
Sifat fisis asam karboksilat mencerminkan ikatan hidrogen yang kuat antara molekul-molekul asam karboksilat. Titik leleh dan titik didih relative lenih tinggi. Spektra inframerah asam-asam karboksilat juga menunjukkan efek pengikatan-hidrogen. Asam-asam yang berbobot molekul rendah larut (dalam air) dari beberapa asam karboksilat tercantum dalam table berikut:
Tabel 2. Sifat fisis beberapa asam karboksilat
Nama Struktur leleh,TitikoC Titik didih,oC
Kelarutan dalam
Karboksilat C6H11CO2H 31 233 0,2g/100mL
Benzoat C6H5CO2H 122 250 0,3g/100mL
kaproat berbau kambing (kebetulan keringan kambing memang mengandung asam kaproat). Asam valerat bukanlah asam kuat, namun berbau kuat antara mentega tengik dan keringat kambing (menarik untuk diketahui bahwa asam valerat merupakan penarik seks daric acing kawat bit gula). Anjing dapat mebedakan bau manusia karena anekaragamnya perbandingan asam karboksilat dalam keringat manusia. Bau asam karboksilat alifatik yang mempunyai sepuluh karbon atau lebih akan berkurang, agaknya karena sukar menguap.
3. Sifat Spektra Asam Karboksilat a. Spektra Inframerah
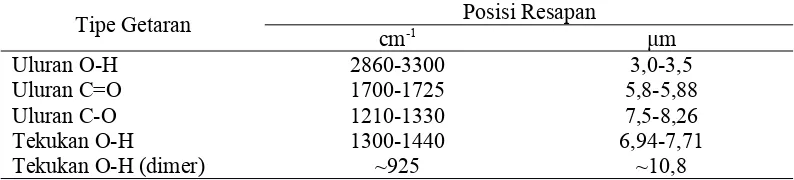
Asam karboksilat, baik secara cairan murni ataupun dalam larutan dengan konsentrasi diatas 0,01 M, berada terutama dalam bentuk dimer berikatan hidrogen, bukannya dalam bentuk monomer diskrit (discrete). Karena itu spectrum inframerah asam karboksilat adalah spectrum dari dimernya. Karena adanya ikatan hidrogen, resapan uluan OH (dari) asam-asam karboksilat sangat lebar dan intensif. Resapan OH ini mulai sekitar 3300 cm-1 (3,0 μm) dan melandai
kedalam daerah resapan karbon-hidrogen alifatik. Lebarnya pita OH asam karboksilat seringkali dapat mengaburkan resapan CH aromatic dan alifatik, maupun resapan OH atau NH lainnya didalam spectrum itu.
Resapan karbonil dijumpai pada kira-kira 1700-1725 cm-1 (5,8-5,88 μm),
dengan intensif yang cukup kuat. Konjugasi menggeser resapan ini ke frekuensi yang lebih rendah: 1680-1700 cm-1 (5,9-5,95 μm).
Gambar 2. Spektrum inframerah fenil butanoat (ilmukimia.org)
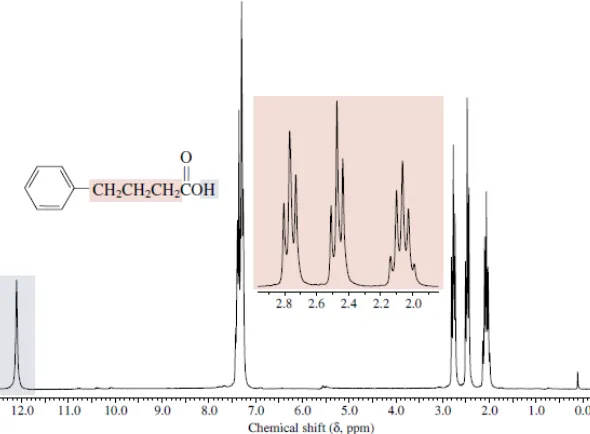
b. Spektra NMR
Dalam spektrum nmr, resapan proton asam (dari) suatu asam karboksilat Nampak sebagai suatu singlet jauh dibawah medan (δ = 10-13 ppm), diluar dari skala dari rentang spektra yang biasa. Proton alfa hanya sedikit sekali dipengaruhi oleh gugus C=O; resapannya sedikit dibawah medan (sekitar 2,2 ppm) karena efek induktif (dari) karbon karbonil yang positif parsial. Tidak terdapat pola penguraian yang unik, yang dikaitkan dengan gugus asam karboksilat tidak mempunyai tetangga proton.
Tabel 3. Resapan inframerah karakteristik untuk asam-asam karboksilat
Sejumlah besar jalur sintetik untuk mendapatkan asamkarboksilat dapat dikelompokkan dalam tiga tipe raksi: (1) hidrolisis devirat asam karboksilat; (2) reaksi oksidasi; (3) reaksi Grinard.
Tabel 4. Ringkasan sintetis laboratorium dari asam karboksilat Reaksi
Hidrolisis devirat asam karboksilat terjadi dari serangan air atau OH- pada
suatu ester yang menghasilkan suatu asam karboksilat dan alcohol adalah khas dari kelompok reaksi ini.
b. Reaksi Oksidasi
Reaksi ini mencangkup: 1. Oksidasi Alkohol Primer
Pada umunya zat pengoksidasi laboratorium mengoksidasi alkohol primer menjadi asam karboksilat.
[O]
RCH2OH RCOH
suatu alkohol primer suatu asam karboksilat
Beberapa zat pengoksidasi yang khas untuk oksidasi ini adalah: a) kalium permanganat basa: KMnO4 + −OH
b) HNO3 pekat dan panas
c) asam kromat: H2CrO4 (dibuat insitu dari CrO3 atau Cr2O7 dengan H2SO4
dalam air)
d) kromium trioksida (CrO3) yang dikomplekskan dengan piridina atau
piridina dengan HCl
Alhohol primer mula-mula dioksidasi dulu menjadi aldehida. Aldehida lebih mudah dioksidasi daripada alkohol. Oleh karena itu biasanya oksidasi tidak terhenti, melainkan terus sampai terbentuk asam karboksilat (atau anion karboksilat dalam larutan basa).
Contoh:
CH3(CH2)8CH2OH CH3(CH2)8CO2H
1-dekanol asam dekanoat 93%
CH2CH3 CH2CH3
| |
CH3(CH2)3CHCH2OH CH3(CH2)3CHCO2H
1-dekanol asam dekanoat 93%
primer menjadi aldehida adalah kompleks krom trioksida−piridina atau piridinium terpopuler, tetapi bukanlah satu-satunya reagensia yang dapat digunakan.
O
Alkena dapat dioksidasi menjadi aneka ragam produk, bergabung pada reagensia yang digunakan. Reaksi yang melibatkan oksidasi ikatan rangkap karbon-karbon dapat dikelompokkan menjadi dua gugus umum: (a) oksidasi ikatan pi tanpa memutuskan ikatan sigma, dan (b) oksidasi ikatan pi yang memutuskan ikatan sigma.
Oksidasi alkena terutama digunakan sebagai alat analitis, tetapi juga dapat elektrofilik suatu alkil benzene, yang disusul dengan oksidasi, menghasilkan asam benzoate tersubstitusi-o dan p.
N+ O -bertahap sampai terbentuk iodoform (CHI3) padat berwarna kuning.
c. Reaksi Grinard
kering)seringkali merupakan metode terpilih untuk membuat suatu asam karboksilat.
COOH
fenilmagnesium bromida asam benzoat (85%)
Berikut ini ringkasan jalur-jalur sintetik yang lazim untuk mendapatkan asam karboksilat, dipandang dari segi lain. Yakni dilihat dari apa yang terjadi pada molekul itu sebagai suatu keseluruhan. Sintesis dari suatu alkil halide lewat nitril atau reagensia Grinard menghasilkan asam karboksilat yang satu karbon lebih banyak daripada alkil halidanya.
Pemanjangan rantai:
1o RX RCN RCO
2H
RX RMgX RCO2H
5. Bagaimana Struktur Mempengaruhi Kuat Asam
Kuat asam adalah suatu istilah yang menjelaskan sejauh mana ionisasi suatu asam Bronsted dalam air. Makin besar ionisasinya,main banyak ion hidrogen yang terbentuk dan makin kuat asam itu. Kuat asam dinyatakan oleh Ka atau pKa-nya.
Reaksi suatu asam lemah dengan air bersifat reversible. Kesetimbangan terletak pada sisi persamaan, yang energinya lebih rendah. Sifat struktur apa saja yang menstabilkan anion dibandingkan dengan asam konjugasinya, akan
menambah kuat asam dengan cara menggeser letak kesetimbangan kearah sisi
H3O+ dan anionnya (A−).
Tabel 5. Harga pKa beberapa asam karboksilat
Nama Trivial Struktur pKa
asetat CH3CO2H 4,75
propionat CH3CH2CO2H 4,87
butirat CH3(CH2)2CO2H 4,81
trimetilasetat (CH3)3CCO2H 5,02
fluoroasetat FCH2CO2H 2,66
kloroasetat ClCH2CO2H 2,81
bromoasetat BrCH2CO2H 2,87
iodoasetat ICH2CO2H 3,13
dikloroasetat Cl2CHCO2H 1,29
trikloroasetat Cl3CCO2H 0,7
α-kloropropionat CH3CHClCO2H 2,8
β-kloropropionat ClCH2CH2CO2H 4,1
laktat
juga mempengaruhi kuat asam HA, adalah: a. Kelektronegatifan
Atom yang lebih besar mampu menyebar suatu muatan negative dengan baik daripada atom kecil. Penyebaran muatan akan menyebabkan penstabilan. Jadi makin besar ukuran atom yang mengikat H dalam suatu deret senyawa dalam grup mana saja dari Daftar Berkala, kestabilan anionnya akan bertambah, demikian pula kuat asamnya. Karena ukuran atom fluor yang kecil itu, HF merupakan asam yang lebih lemah daripada hidrogen halide lain, meskipun fluor lebih elektronegatif dibandingkan halogen lain.
F− Cl− Br− I−
bertambahnya jari-jari ion
HF HCl HBr HI pKa: 3,45 -7 -9 -9,5 naiknya kuat asam
c. Hibridisasi
Bertambahnya karakter s orbital hibrida (dari) karbon dalam deret sp3
sp2 sp berarti bertambahnya kelektronegativan karbon tersebut dan dengan
demikian bertambahnya polaritas ikatan CH dan bertambahnya kuat asam. Keelektronegativan yang lebih besar (dari) atom yang mengikat H juga akan menambah kestabilan anion dan dengan demikian keasaman senyawanya. Karena alas an-alasan ini, maka suatu proton alkunil lebih bersifat asam daripada proton alkenil, yang selanjutnya juga lebih bersifat asam daripadaproton sebuat alakana.
CH3CH3 CH2═CH2 CH≡CH
pKa kira-kira: ~50 ~45 ~26 naiknya kuat asam CH3CH2− CH2═CH− CH≡C−
naiknya kuat basa
d. Efek induktif
Berikut ini daftar gugus dalam urutan daya tarik menarik-elektronnya:
CH3− H− CH2═CH− C6H5− HO− CH3O− I− Br− Cl−
bertambahnya daya menarik elektron
CH3CH2CO2H CH3CO2H CH2═CHCH2CO2H C6H5CH2CO2H HOCH2CO2H ClCH2CO2H
pKa: 4,78 4,75 4,35 4,31 3,87 2,81
Gugus-gugus penarik electron tambahan akan menggandakan efek induktif. Pengaruh induktif pada kuatnya asam akan berkurang dengan makin banyaknya atom yang berada antara gugus karboksil dan gugus elektronegatif itu.
e. Stabilitas-resonansi
Alkohol, fenol dan asam karboksilat, ketiganya mengandung gugus OH. Meskipun demikian ketiga kelas senyawa ini beraneka ragam secara dramatis dalam hal kuat asamnya. Perbedaan ini dapat disebabkan langsung oleh adanya (atau tak adanya) stabilitas-resonansi anion, relative terhadap asam konjugasinya.
ROH ArOH RCO2H
pKa kira-kira: 15-19 10 5
Dalam hal alkohol, anionnya tidak terstabilkan oleh resonansi. Muatan negative suatu ion alkoksida tinggal seluruhnya pada oksigen dan tidak didelokalisasikan. Pada ujung lain (dari) skala terdapat asam karboksilat. Muatan negative ion karboksilat dibagi secara sama oleh dua atom oksigen yang elektronegatif itu. Fenol terletak ditengah, antara asam karboksilat dan alkohol dalam hal kesamaan. Oksigen suatu ion fenoksida berdekatan dengan cincin aromatik dan muatan negative itu sebagian terdelokalisasikan oleh awan pi aromatik.
suatu alkoksida: CH3CH2O− tidak ada stabilitas-resonansi
suatu fenoksida:
penyumbang utama
O ║
CH3C−O
O |
CH3C═O suatu karboksilat:
penyumbang sama besar
f. Solvasi
menambah keasaman senyawa itu dalam larutan. Misalnya, air mempunyai kemampuan yang lebih besar untuk mensolvasi ion daripada etanol. Suatu larutan asam karboksilatdalam air bersifat asam daripada larutan dalam etanol, dengan factor sekitar 105.
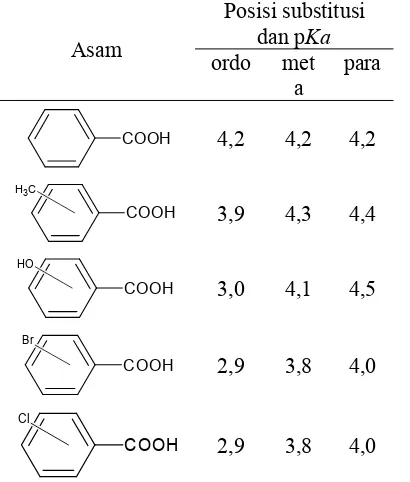
g. Kuat asam dari Asam asam benzoate tersubstitusi Tabel 6. Harga pKa untuk beberapa asam benzoat
Asam
Posisi substitusi dan pKa
ordo met a
para
COOH 4,2 4,2 4,2
COOH C
H3
3,9 4,3 4,4
COOH O
H
3,0 4,1 4,5
COOH Br
2,9 3,8 4,0
COOH
Cl
2,9 3,8 4,0
6. Reaksi Asam Karboksilat dengan Basa
Reaksi asam karboksilat dengan suatu basa akan menghasilkan garam. Suatu garam organik mempunyai banyak sifat fisis dari garam anorganik padanannya. Seperti NaCl dan KNO3, suatu garam organik meleleh pada
temperature tinggi, larut dalam air, dan tak berbau. HCO2H + Na+ OH- HCO2- Na+ + H2O
asam format natrium format
CO2H + Na+ HCO3- CO2H + Na+ HCO3
-asam sikloheksana karboksilat natrium sikloheksana karboksilat
Karena lebih asam dari asam karbonat, suatu asam karboksilat mengalami reaksi asam-basadengan natrium bi karbonat maupun basa-basa yang lebih kuat seperti NaOH. Suatu asam karboksilat dapat diekstrak dari dalam suatu campuran senyawa organik yang terlarut dalam air, dengan larutan bikarbonat. Asam itu membentuk garam natrium dan menjadi larut dalam air, sedangkan senyawa organik lain tetap tidak larut. Asam karboksilat bebas diperoleh dari larutan air dengan pengasaman.
7. Esterifikasi Asam Karboksilat
Suatu ester asam karboksilat ialah suatu senyawa yang mengandung gugus –CO2R dengan R dapat berbentuk alkil maupun aril. Suatu ester dapat dibentuk
dengan reaksi langsung antara suatu asam karboksilat dan suatu alkohol, suatu reaksi yang disebut reaksi esterifikasi. Esterifikasi berkataliskan asam dan halangan sterik dalam alkohol dan asam karboksilatnya. Kuat asam dari asam karboksilat hanya memainkan peranan kecil dalam laju pembentukan ester.
Kereaktivan alkohol terhadap esterifikasi:
ROH tersier ROH sekunder ROH primer CH3OH
bertambahnya kereaktivan
Kereaktivan asam karboksilat terhadap esterifikasi:
bertambahnya kereaktivan
Seperti banyak reaksi aldehida dan keton, esterifikasi suatu asam karboksilat berlangsung melalui serangkaian tahap protonasi dan deprotonasi. Oksigen karbonil diprotonasi, alkohol nukleofilik menyerang karbon positif, dan eliminasi air akan menghasilkan ester yang dimaksud.
O ║ RCOH suatu asam karboksilat
+ R`OH H+
OH │ R−C−OH │ OR`
O ║
RCOR` + H2O
Perhatikan bahwa dalam reaksi esterifikasi, ikatan yang terputus adalah ikatan C−O (dari) asam karboksilatlah dan bukan ikatan O−H dari sama atau ikatan C−O dari alkohol.
Reaksi esterifikasi bersifat reversible. Untuk memperoleh rendemen tinggi dari ester itu, kesetimbangan harus digeser kearah sisi ester. Suatu teknik untuk mencapai ini adalah menggunakan salah satu zat pereaksi yang murah secara berlebihan. Teknik lain ialah membuang salah satu produk dari dalam campuran reaksi (misalnya, dengan destilasi air secara azeotropik).
Dengan bertambahnya halangan sterik dalam zat-antara, laju pembentukan ester akan menurun. Rendemen esternya pun berkurang. Alasannya ialah karena esterifikasi itu merupakan suatu reaksi yang bersifat reversible dan spesi yang kurang terintangi (pereaksi) akan lebih disukai. Jika suatu ester yang meluah (bulky) harus dibuat, maka lebih baik digunakan jalur sintetik lain, seperti reaksi antara suatu alkoholdan suatu anhidrida asam atau suatu klorida asam, yang lebih relative daripada asam karboksilat dan yang bereaksi dengan alkohol secara reversibel.
Ester fenil (RCO2C6H5) umumnya tidak dibuat secara langsung dari fenol
dan asam karboksilat karena kesetimbangan lebih cenderung bergeser kesisi asam fenol daripada ke sisi ester. Ester fenil, seperti ester-ester meluah, dapat diperoleh dengan menggunakan derivate asam yang lebih relatif.
8. Reduksi Asam Karboksilat
suatu molekul organik. (keadaan oksidasi lebih tinggi berikutnya adalah dalam CO2.) Kecuali terhadap pembakaran atau oksidasi oleh reagensia yang sangat
kuat, seperti H2SO4−CrO3 panas (larutan pembersih), gugus asam karboksilat
bersifat lambat kearah reaksi oksidatif.
( 1 ) L i A l H4 ( 2 ) H2O . H+
CH3CO2H CH3CH2OH
asam asetat etanol
CO2H
( 1 ) L i A l H4 ( 2 ) H2O . H+
CH2OH
asam karboksilat benzil alkohol
9. Asam Karboksilat Polifungsional
Asam-asam dikarboksilat dan asam-asam karboksilat yang mempunyai gugus fungsional yang lain sering menunjukkan sifat kimia yang unik.
a. Keasaman asam-asam dwibasa
Suatu asam dwibasa (dibasic acid) ialah asam yang bereaksi dengan dua ekuivalenbasa (1,0 mol asam bereaksi dengan 2,0 mol basa). Istilah asam diprotic (2 proton yang bersifat asam) mungkin merupakan istilah yang lebih tepat. Pada umumnya, kimia asam karboksilat dwibasa mirip dengan kimia asam monokarboksilat, namun beberapa perbedaan akan dibahas.
Dengan asam dwibasa apa saja (anorganik maupun organik), ion hidrogen yang pertama lebih mudah dibuang daripada yang kedua. Jadi, K1 (tetapan
keasaman untuk ionisasi H+ pertama) lebih besar daripada K
2 (tetepan untuk
ionisasi H+ kedua), dan harga pK
1 lebih kecil daripada harga pK2. Selisih antara
pK1 dengan pK2 berkurang bila jarak antara gugus-gugus karboksilat bertambah
besar.
HO2CCH2CO2H + H2O HO2CCH2CO2− + H3O+
asam malonat pK1 = 2,83
HO2CCH2CO2− + H2O −O2CCH2CO2− + H3O+
pK2 = 5,69
Suatu anhidrida asam karboksilat mempunyai dua molekul asam karboksilat yang digabung menjadi satu dengan melepaskan air.
O O
Tabel 7. Harga pKa beberapa dwiasam
Nama Trivial Struktur pK1 pK2
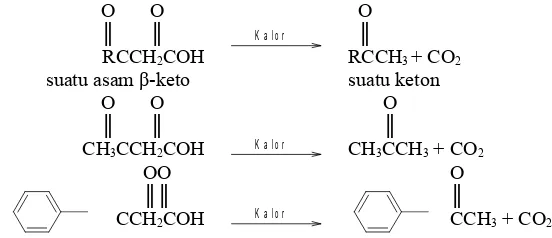
c. Dekarbosilasi asam β-keto dan β-dwiasam
Memanaskan sebagian besar asam karboksilat dengan begitu saja tidak akan menghasilkan suatu reaksi kimia. Namun suatu asam karboksilat dengan suatu gugus β-karbonil akan mengalami dekarboksilasi (kehilangan CO2) bila
dipanaskan. (temperatur tergantung menurut keperluan masing-masing senyawa). Umum:
Beberapa asam α karbonil, seperti asam oksalat, dapat juga menjalani dekarboksilasi. Dekarboksilasi asam α-keton lazim dalam system biologis dalam mana reaksi dikatalis oleh enzim.
Suatu ikatan rangkap terpencil (terisolasi) dalam suatu asam karboksilat tak jenuh bersifat bebas (tidak bergantung) pada gugus karboksil. Namun suatu ikatan rangkap terkonjugasi dan gugus karboksil, dapat bereaksi adisi-1,4. Reaksi-reaksi ini berlangsung dengan cara yang sama seperti aldehida atau keton tak jenuh-α,β.
10. Penggunaan Asam Karboksilat dalam Sintesis
Dalam banyak reaksi, halide asam atau anhidrida asam memberikan rendemen yang lebih baik; seperti misalnya esterifikasi. Namun asam itu sendiri biasanya mudah diperoleh. Oleh karena itu seorang ahli kimia harus mempertimbangkan antara waktu dan biaya terhadap semua rendemen.
O ║ R−C−OR
O ║ R−C−Cl
O ║ R−C−NH2
O O ║ ║ R−C−O−C−R suatu ester suatu halida asam suatu amida suatu anhidrida
Asam karboksilat dalam beberapa derivatnya terdapat dalam alam. Sekedar beberapa contoh: Lemak adalah trimester, lilin adalah monoester dan protein adalah poliamida. Halida asam tidak pernah dijumpai dalam alam, dan anhidrida jarang ditemui. Satu contoh anhidrida,yang terdapat dalam alam ialah kantaridin, suatu anhidrida silik yang terdapat pada lalat spanyol. Kantaridin merupakan zat iritasi dalam saluran penting. Orang yunani dan romawi kuno menggunakan lalat yang dikeringkan sebagai perangsang seks (aphrodisiac), dan juga dikenal sebagai penghilang kutil.
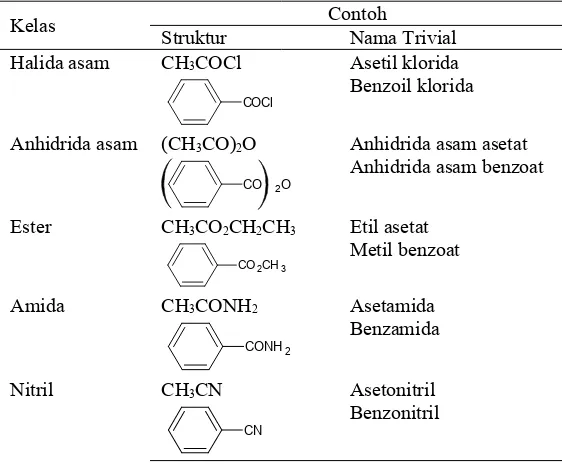
Tabel 8. Beberapa devirat asam karboksilat
Kelas Struktur ContohNama Trivial Halida asam CH3COCl Asetil klorida
COCl Benzoil klorida
Anhidrida asam (CH3CO)2O Anhidrida asam asetat
CO 2O Anhidrida asam benzoat
Ester CH3CO2CH2CH3 Etil asetat
CO2CH3 Metil benzoat
Amida CH3CONH2 Asetamida
CONH2 Benzamida
Nitril CH3CN Asetonitril
CN Benzonitril
1. Kereaktifan Derivat Asam Karboksilat
Derivat asam karboksilat mengandung gugus pergi yang terikat pada karbon asli sedangkan aldehida dan keton tidak. Biasanya reagensia mengadisi pada gugus karbonil dari keton atau aldehida, tetapi mensubtitusi untuk gugus pergi tersebut dalam derivate asam.
O
Gugus pergi yang baik merupakan suatu basa lemah.Oleh karena itu Cl
-adalah gugus pergi yang baik tetapi –OH dan –OR merupakan gugus pergi yang jelek. Kereaktifan senyawa karbonil terhadap subtitusi pada karbon karbonil dapat dianggap desebabkan oleh kebasaan gugus perginya:
O ║
−CH
3 –NH2 –OR –OCR X−
Berkurangnya kebasaan (bertambah mudahnya untuk ditukargantikan)
O O O O O O ║ ║ ║ ║ ║ ║
R−C−R RC−NH2 RC−OR` RC−OCR RC−Cl
bertambahnya kereaktivan
Klorida asam dan anhidrida asam, yang mempunyai gugus pergi yang baik, mudah diserang oleh air. Oleh karena itu, tidak diharapkan bahwa senyawa ini terdapat dalam sel tumbuhan atau hewan. Namun karena kereaktivitannya yang tinggi, derivate asam ini sangat berharga dalam sintesis senyawa organik lain. Suatu asam karboksilat yang agak tak reaktif dapat diubah menjadi salah satu derivat yang lebih aktif dan kemudian diubah menjadi keton, ester atau suatu amida.
Ester dan amida relatif stabil dalam air. Dalam lab, senyawa ini memerlukan suatu asam atau basa dan biasanya dipanaskan agar bereaksi. Dalam alam, enzim dapat mengambil alih peranan asam atau basa dan kalor.
2. Sifat Spektral Derivat Asam Karboksilat
hidrogen alifatik biasa karena berkurangnya pemerisaian oleh atom karbon karbonil yang bermuatan positif parsial. Perhatikan bahwa hidrogen α dari suatu asam klorida menunjukkan geseran kimia yang lebih besar daripada hidrogen α derivat asam lainnya. Geseran kimia yang besar ini timbul karena lebih besarnya kemampuan Cl (dibandingkan O atau N) untuk menarik rapatan electron dari Naiknya geseran kimia untuk hidrogen α
Spektra ir dari derivat asam memberikan lebih banyak informasi mengenai tipe gugus fungsional daripada yang diberikan oleh spektra nmr. Kecuali untuk nitril, sifat utama yang khusus dari spektra ir semua derivat asam karboksilat ialah absorpsi karbonil pada sekitar 1630-1840 cm-1 (5,4-6 μm). Anhidrida dan ester
juga menunjukkan absorpsi C−O dalam daerah 1050-1250 cm-1 (8-9,5 μm).
O
Absorpsi inframerah karbonil dari klorida asam dijumpai pada frequensi yang sedikit lebih tinggi daripada resapan untuk derivat asam lain. Tidak ada lagi sifat khusus lain dalam spectrum inframerah yang menandakan bahwa “inilah klorida asam.”
b) Anhidrida
Anhidrida asam karboksilat mempunyai dua gugus C═O, umunya menunjukkan peak karbonil rangkap dalam spectrum irnya. Anhidrida juga menunjukkan suatu pita uluran C−O sekitar 1100 cm-1 (9 μm).
c) Ester
Absorpsi ir karbonil dari ester alifatik dijumpai sekitar 1740 cm-1 (5,75
μm). Namun ester terkonjugasi (baik ester tak jenuh –α,β ataupun ester α−aril). Menyerap pada frequensi sedikit lebih rendah, sekitar 1725 cm-1 (5,8 μm). Ester
d) Amida
Posisi resapan gugus karbonil suatu amida beranekaragam dan bergantung pada sejauh mana pengikat – hidrogen antara molekul-molekul. Spektrum ir dari suatu amida cair murni (pengikat hidrogen maksimum) menunjukkan suatu peak yang disebut pita amida I sekitar 1650 cm-1 (6,0 μm).
Pita amida II tampak antara 1515-1670 cm-1 (6,0-6,6 μm), tepat disebelah
kanan resapan C═O. Resapan ini ditimbulkan dari tekukan NH. Oleh karena itu amida terdistribusi, atau tersier, tidak menunjukkan pita II ini.
Vibrasi uluran NH menimbulkan resapan disebelah kiri absorpsi CH alifatik pada 3125-3570 cm-1 (2,8-3,2 μm). (Kira-kira daerah ini sama dengan
daerah dimana NH amina dan OH menyerap). Amida primer (RCONH2)
menunjukkan peak rangkap dalam daerah ini. Amida sekunder (RCONHR), dengan hanya satu ikatan, menunjukkan suatu peak tunggal. Amida tersier (RCONR2), tanpa NH, tidak menunjukkan resapan dalam daerah ini.
e) Nitril
Resapan C≡N dijumpai dalam daerah ikatan rangkap tiga dari spectrum ir 2200-2300 cm-1 (4,3-4,5 μm) dan dengan intensitas antar medium ke lemah.
3. Halida Asam
Unsur halida (F,Cl,Br,I) bereaksi dengan cara sempurna karena klorida asam yang paling populer dari halida asam, maka diskusi dibatasi hanya mengenai senyawa ini.
Struktur :
R C
O
hal hal : Cl, Br, I
Tata nama Klorida Asam:
Klorida asam diberi nama menurut nama asam karboksilat induknya, dengan imbuhan asam-at diubah menjadi –il klorida.
O ║ CH3CCl
O ║ CH3CH2CCl
O ║ CH3CH2CH2CCl
IUPAC etanoil klorida propanoil klorida butanoil klorida trivial asetil klorida propionil klorida butiril klorida
Klorida asam dapat diperoleh langsung dari asam karboksilat induknya menjadi reaksi dengan ionil klorida (SOCl2) atau zat penghalogenan aktif lain,
seperti fosforus triklorida (PCl3):
O ║
RCOH + SOCl2
O ║
RCCl + SO2 + HCl
Suatu asam karboksilat Suatu klorida asam O
║
3 RCOH + PCl3
O ║
RCCl + H3PO3
Atau dapat digambarkan sebagai berikut:
OH CH3
O
C + Cl S Cl CH3 Cl O
C + HCl + SO2 asam asetat tionil klorida asetil klorida
C O
OH + PCl5
Cl O
C + POCl3 + HCl
asam benzoat benzoil klorida
Reaksi Klorida Asam:
Halida asam adalah yang paling reaktif diantara semua derivat asam karboksilat. Ion halide merupakan gugus pergi yang baik. Teikta pada karbon positif dari gugus karbonil, ion ini lebih mudah ditukargantikan daripada bila terikat pada karbon alkil. Dalam mekanisme umum dibawah ini untuk reaksi antara suatu klorida asam dan suatu nukleofil, perhatikan bahwa penukargantian Cl- bukanlah penukargantian sederhana seperti sebuah reaksi S
N2. Reaksi itu
Hidrolisis klorida asam karboksilat menghasilkan asam karboksilatnya:
Cl CH3
O
C + H2O CH3 OH O
C + HCl asetil klorida asam asetat
Meskipun semua klorida asam menjalani hidrolisis asam untuk menghasilkan asam karboksilat dan hidrolisis basa untuk mendapatkan gara-garam asam karboksilat, laju reaksinya beranekaragam. Suatu klorida asam yang memiliki gugus alkil meluah (bulky) yang terikat pada gugus karbonil akan bereaksi lebih lambat daripada klorida asam dengan gugus alkil kecil. Misalnya asetil klorida bereaksi dengan hamper meledak dengan air, namun butanoil klorida memerlukan reflux lembut.
Efek ukuran gugus alkil pada laju reaksi adalah pada kelarutan dalam air, bukannya efek karena halangan sterik. Suatu klorida asam dengan gugus alkil kecil adalah lebih mudah larut dan bereaksi dengan lebih cepat. Bertambahnya ukuran bagian alkil dari molekul menyebabkan klorida asam itu kurang dapat larut dalam air; reaksinya menjadi lebih lambat. Jika hidrolisis perbagi klorida asam dilakukan dalam suatu pelarut lambat yang melarutkan klorida asam dan air, maka laju hidrolisis ternyata hampir sama.
Reaksi dengan Alkohol. Klorida asam karboksilat bereaksi dengan alcohol atau fenol membentuk ester dengan katalis basa organik.
O Cl
CH3 O
C + CH3 C
CH3
CH3
OH piridin CH3 O
C C CH3
CH3
CH3
+ HCl
Cl
Umumnya dibuat di laboratorium. Anhidrida asam karboksilat yang umum digunakan adalah asetat anhidrida dan tersedia secara comersial.
Reaksi Anhidrida Asam: a) Hidrolisis
CH3 asetat anhidrida metanol metil asetat asam asetat
OH
Anhidrida bereaksi dengan ammonia (sangat cepat) menghasilkan suatu amida dan satu garam karboksilat.
CH3 C ditunjukkan dengan memberi awalan N dimana alkil tersebut terikat.
H C
N, N - dimetilformamida N - fenil propanamida
Sifat-sifat Fisik Amida:
d- ikatan hidrogen antara gugus-gugus amida
c) Umumnya berupa padat pada suhu kamar kecuali : formamida berbentuk cair pada TR.
Amida umumnya disintesis di laboratorium melalui beberapa cara :
c) Reaksi klorida asam dengan ammonia
CH3
Amida sangat kuat/tahan terhadap hidrolisis. Tetapi dengan adanya asam atau basa pekat, hidrolisis dapat terjadi menghasilkan asam karboksilat.
C
6. Penggunaan Derivat Asam Karboksilat dalam Sintesis
yang tidak dapat dibuat dengan rendemen yang baik dengan pemanasan RCO2H
dan R`OH dengan katalis asam, karena kesetimbangan tidak menguntungkan. Meskipun ester tidak sereaktif klorida asam atau anhidrida, mereka berguna dalam sintesis ankohol (dengan reduksi atau dengan reaksi Grinard) dan merupakan bahan awal yang berharga dalam mensintesis molekul rumit.
BAB III PENUTUP
A. Simpulan
Asam karboksilat adalah asam organik yang diidentikkan dengan gugus karboksil. Asam karboksilat merupakan asam Bronsted-Lowry (donor proton). Garam dan anion asam karboksilat dinamakan karboksilat. Asam karboksilat merupakan senyawa polar, dan membentuk ikatan hidrogen satu sama lain. Pada fasa gas, Asam karboksilat dalam bentuk dimer. Dalam larutan Asam karboksilat merupakan asam lemah yang sebagian molekulnya terdisosiasi menjadi H+ dan
RCOO-.
Derivat asam karboksilat merupakan turunan asam karboksilat, dimana ditinjau dari strukturnya senyawa yang diperoleh dari hasil pergantian gugus –OH dalam rumus struktur RCOOH oleh gugus –NH2, -OR, atau –OOCR. Dalam