BAB III
A.
IKATAN KIMIA
Ikatan Kimia
Struktur asam amino dan peptida memiliki ikatan-ikatan kimia yang mestabilkan struktur protein dan membran. Ikatan Kimia dalam Protein meliputi ikatan kovalen, ikatan hidrogen, interaksi elektrostatik, ikatan Van der Waals dan ikatan hidrofobik.
Ikatan Kovalen merupakan sharing elektro a tara ato u tuk ele gkapi kulit
elektron. Dalam ikatan karbon-karbon elektron memiliki bersama 2 atom. Ikatan bersifat non-polar yang terdiri atas :
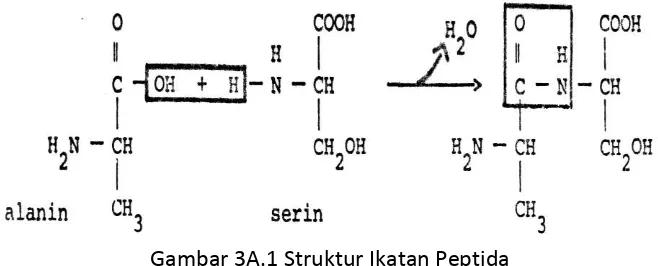
a. Pada protein terdapat ikatan antara gugus Cα asam amino yang satu dengan gugus NH2 atom Cα yang saling membentuk ikatan peptida, ikatan peptida membentuk struktur primer yang kuat.
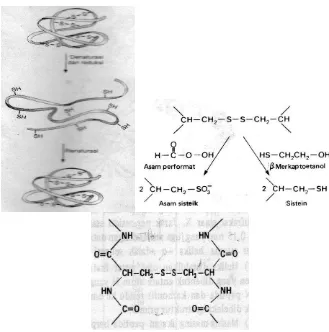
b. Ikatan Bisulfida (-S-S-) yang terbentuk pada waktu protein melipat membentuk konformasi alamiahnya serta berfungsi menstabilkan bentuk 3-dimensi.
Gambar 3A.1 Struktur Ikatan Peptida
Ikatan hidrogen merupakan ikatan yang terdapat dalam molekul air. Atom dimana hidrogen lebih terikat erat disebabkan donor hidrogen atom serta yang satunya aseptor hidrogen. Donor hidrogen meliputi atom O atau N yang terikat secara kovalen pada atom H. Akseptor hidrogen atom O dan H. Ikatan hidrogen ini tidak hanya berperan dalam molekul air, juga berperan dalam molekul protein, DNA, alkohol. Ikatan hidrogen ini menyebabkan terbentuknya heliks-α dan lipatan. Ikatan hidrogen anatara gugus amida dan gugus luar bermoleku heliks-α. Keluatannya tergantung jarak donor H dan akseptor H, paling kuat jaraknya sekitar 2,7 Ao dan 3,1 Ao. Relatif lemah, karena jumlahnya lebih berperan pada stabilitas
Gambar 3A.2 Ikatan hidrogen
Ikatan elektrostatik yaitu ikatan ionik, merupakan jembatan garam atau pasangan ion. Antara gugus bermuatan (dari rantai samping asam-amino dalam protein). Dapat saling tarik-menarik/tolak-menolak membentuk muatan bertolak menolak atau sama. Penting untuk stabilitas protein. Berperan dalam pengikatan ligan/substrat. Ikatan paling kuat pada K.cad Volum (D=1), makin polar medium, D makin meningkat, ikatan paling lemah dalam air (D = 80).
Ikatan Van der Waals, memiliki kekuatan tarik-menarik non-spesifik antara 2 atom yang berjarak 3Ao– 4Ao. Dapat disebabkan berubahnya distribusi muatan e_ desekeliling atom pada
tiap saat. Distribusi muatan e_ yang tidak sama akan menyebabkan distribusi muatan e_ yang
tidak sama pula pada atom dari dekatnya, sehingga timbul kekuatan tarik menarik/tolak menolak. Ikatan van der waals lemah dan nonspesifik, kurang penting dibandingkan ik.elektrostatik/ikatan hidrogen.
Ikatan hidrofobik merupakan ikatan non-kovalen yang menyebabkan polipeptida melipat membentuk konformasi yang alamiah. Ikatan hidrofobik ini berperan pula pada pengikatan substrat-enzim, pembentukan membran. Bukan karena tarik-manarik antara gugus non-polar, tapi lebih disebabkan oleh sifat pelarut air. Molekul air sangat tersusun rapi dan banyak ikatan hidrogen, masuknya gugus non-polar akan merusak struktur air, gugus non-polar tidak dapat mendonorkan/menerima hidrogen, sehi gga olekul air pada per ukaa ro gga berisi gugus non polar, tidak membentuk ikatan peptida. Bila usaha untuk mengatasi kehilangan
ikata hidroge air per ukaa ro gga e yesuaikan diri membentuk jaringan ik Hidrogen
Gambar 3A.3 Ikatan hidrofobik
Asam basa dan dapar
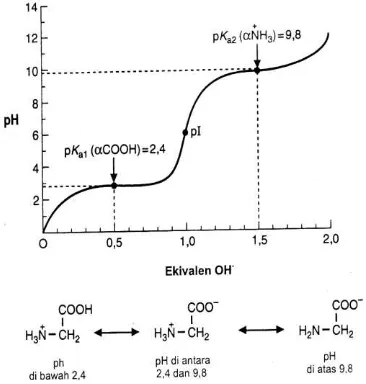
Peranan asam amino dan protein dalam sistem dapa yaitu asam amino bersifat asam karena memiliki gugus karboksil bermuatan negatif dan bersifat basa karena memiliki gugus nitrogen yang bermuatan positif.Asam amino non-polar akan bermuatan asam, dalam molekulnya mempunyai kelebihan COO- (muatan negatif) dan basa : dalam molekulnya
kelebihan NH3+ . pH dimana muatan netto molekul dalam larutan adalah nol disebut sebagai
pH isoelektrik (pI). Pada pH ini molekul disebut zwitterion tidak akan berimigrasi dalam lapangan listrik karena jumlah muatan negatif pada masing-masing molekul setara dengan jumlah muatan positif.
Gambar 3A.4 pH Isoelektrik
Gambar 3A.4 Perubahan asam amino menjadi asam dan basa
Gambar 3A. Asam amino bentuk terionisasi dan ion dipolar
Struktur sekunder dan tersier protein (protein folding)
Gambar 3A.4 Struktur sekunder dan tersier protein : protein folding
Hubungan keragaman protein dengan jumlah jenis asam amino pembentuk protein antara lain :
1. Kolagen terdiri atas 3 rantai polipeptida (tripel helik), menahan tegangan, 1/3 residu gly 2. Keratin terdiri atas phe, Ile, Val, met, Ala, sistein (ik.SH/sulfhidril) dan cys (s-s)
3. Elastin terdiri atas 1/3 Gly dan 1/3 Ala dan tidak mengandung OH-lys 4. Fibrolin terdiri atas 6 residu berulang ( Gly-Ser- Gly-Ala-Gly-Ala)
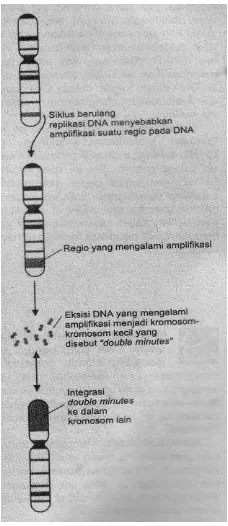
Hubungan antara protein dan gen yaitu bila gen mengalami delesi/mutasi, tidak dapat menghasilkan protein fungsional. Untuk menghasilkan protein spesifik dalam jumlah besar dengan dihasilkan banyak salinan gen, dapat dilakukan amplifikasi gen.
Hubungan kodon dan asam amino
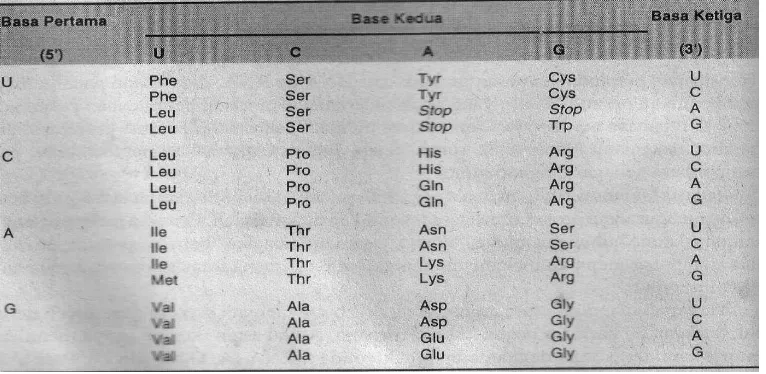
mRNA yang menentukan urutan asam amino protein dibaca dalam kodon terdiri atas 3 nukleotida yaitu U,C,A,G. Ada 61 kodon yang menentukan asam amino, ada 2 asam amino yang memiliki 1 kodon (AUG = metionin, UGG = triptofan) dan ada pula asam amino yang lain dibaca lebih dari satu kodon. Kodon pada mRNA dimulai de ga kodo ’-AUG (metionin) dan diakhiri oleh kodon stop ’-(UAG, UGA dan UAA).
Sifat umum asam amino pembentuk protein yaitu struktur asam amino standar antara lain mempunyai Cα, C mempunyai 4 gugus terdiri atas H3N, COO-, H, R (variasi). Bila ikatan asam
amino lepas akan menghasilkan air, tulang punggung membentuk ikatan peptida. R-gugus samping dan struktur primer menetukan bentuk akhir suatu 3-dimensi.
Konsep struktur protein dalam berbagai tingkat sebagai hasil interaksi antara berbaga asam amino penyusun protein di dalam molekul protein. Protein dengan fungsi berbeda, selalu memiliki urutan asam amino berbeda. Misal E.coli terdiri atas + 3.000 macam protein dan manusia memiliki + 50.000 -100.000 protein. Tiap macam protein akan mempunyai struktur unik, fungsi yang unik serta urutan yang unik.
Hubungan antara struktur dan fungsi protein yaitu modifikasi asam amino dalam protein menyebabkan modifikasi pascatranslasi antara lain :
a. Dihidroksi prolin (terdapat padakolagen yang baru disintesis, dibentuk dari hidroksilasi prolin, hidoksilasi bersifat menstabilkan kolagen, bila terganggu (defisiensi Vitamin C) menyebabkan terganggu pembentukan kolagen
b. ɣ-karboksiglutamat, terdapat dalam protrombin, protein pembekuan darah, pada Defisiensi vitamin K , terganggu karboksilasi glutamat akan menimbulkan perdarahan c. Hidroksi lisin terdapat dalam kolagen
d. d. N-metil lisin dan metil Histamin terdapat dalam protein otot
e. Desmosin dan isodesmosin terdapat dalam elastin, berasal dari 4 mol Lys dengan R membentuk piridin, memungkinkan mengikat 4 rantai polipeptida, elastin dapat direnggangkan dalam 2 arah
Asam amino bukan penyusun protein memiliki fungsi khusus. Ada > 150 asam amino terdapat dalam bentuk bebas/ berikatan dengan molekul lain, dan tidak ditemukan dalam protein. Sebagian besar derivat asam amino L-α, ada juga derivat asam amino β,ɣ,δ
a. β-ala i erupaka building Block it. Asa pa tote at merupakan bagian dari koenzim A
b. ɣ-amino butirat (GABA) merupakan hasil dekarboksilasi glutamat serta merupakan eotra s itter” dalam impuls saraf
c. Histamin hasil dekarboksilasi histidin sebagai mediator reaksi alergi
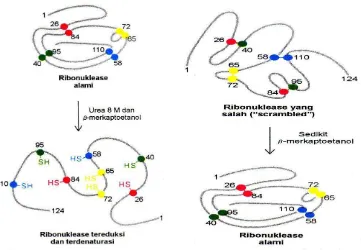
Konsep denaturasi
Protein dalam bentuk alamiah ative protei ” berada dalam bentuk yang stabil Setiap perubahan struktur protein alamiah denaturasi dapat terjadi pada struktur sekunder, tersier, kuartener desebabkan oleh :
3. Suhu 4. Asam alkali
5. Reduksi ikatan S-S
Ko sep de aturasi yaitu seng Kaotropik (Chaotropic agent), dimana urea guanidin HCl pada konsentrasi meningkat (4-8 m) menyebabkan denaturasi (mekanisme belum jelas). Diduga urea dan guanidin membentuk ikatan hidrogen tandingan dengan residu asam amino, sehingga ikatan hidrogen dalam molekul protein yang menstabilkan protein rusak, juga mengubah pelarut air, sehingga interaktif hidrofobik melemah. Denaturasi bersifat reversible sebagian atau campuran bila kadar senyawa di turunkan dengan dialisis atau penghancuran.
Ko sep de aturasi melalui detergen dan suhu, detergen yaitu SDS (sodium dodecyl sulphate) dengan struktur molekul H3C-(CH2)10-CH2OSO3_ + Na+ mempunyai ujung sangat
polar , ujung hidrofobik. SDS terikat erat pada polipeptida menyebabkan protein mempunyai muatan (-). Denaturasi oleh suhu, bila suhu meningkat mendenaturasi sebagian besar banyak protein larut. Biasanya terjadi presipitasi protein karena kerusakan struktur sekunder dan pembentukan agregat.
Denaturasi oleh asam/alkali, protein bersifat polielektrolit amfoter, sehingga perubahan pH yang mempengaruhi ikatan garam yang menguatkan struktur tersier. Denaturasi reduksi ikatan S-S, β-merkaptoetanol (R-SH) mereduksi ikatan S-S dalam protein menjadi 2 gugus (-SH).
B.
PROTEIN
Protein berasal dari yunani yaitu proteos (oleh Barselius) artinya yang utama/terpenting. Struktur kimia berupa suatu heteropolimer yang tersusun dari berbagai senyawa segolongan yaitu asam amino, terikat melalui ikatan peptida secara kovalen dan terbentuka dari hasil informasi DNA dalam sel.
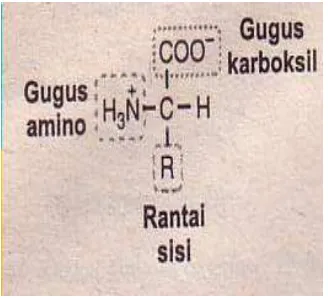
Definisi protein secara kimia, biologi dan biokimia merupakan hasil ekspresi informasi genetik. Protein memiliki komposisi C, H, N, O,S dan sebagian mengandung P, Fe, Zn, Cu. Bila protein dihidrolisi akan menghasilkan asam amino. Syarat dikatakan asam amino adalah memiliki 1 gugus karboksil (-COOH), 1 gugus amino α (-NH2), 1 gugus R-berbeda untuk tiap asam amino serta antar asam amino terdapat ikatan kovalen yang disebut ikatan peptida.
Gambar 3B.1 Struktur umum asam amino
Asam amino merupakan bahan dasar untuk membentuk protein memiliki sifat fisikokimia protein antara lain BM ratusan dalton – 1.000.000 dalton, wujud berupa larutan, koloid, emulsi dan suspensi. Protein dapat dikristalkan atau tidak dikristalkan. Kelarutan protein dipengaruhi pH/ pH isoelektrik (tiap protein berbeda-beda).
Konsep batu bata penyusun (building block) dan ikatan tulang punggung (backbone baound) dalam penyusunan protein, memiliki syarat asam amino pembuat protein antara lain :
1. Konfigurasi L merupakan syarat biologis
2. Punya kodon dalam asam amino (asam amino yang tidak punya kodon homosistein, ornitin, sitrulin)
3. Gugus asalnya harus berkarboksilat, COOH (taurin mempunyai gugus S tidak dapat membuat protein)
4. Gugus COOH dan NH2 ada di Cα (NH2 di β) tidak dapat membuat protein)
Polimerisasi 20 Asam amino dapat membentuk peptida/protein melalui ikatan antara gugus karboksil-α dengan gugus amino-α melalui ikatan peptida (ikatan amida). Unit asam amino dalam polipeptida dimana terdapat gugus NH2 bebas, residu asam amino pada ujung
Peptida pendek dinamai dengan kandungan asam aminonya, dimulai dari sebelah kiri, di residu N-terminal ke arah karboksil disebelah kanan. Rantai polipeptida terdiri dari bagian berulang yang sama rantai utama (tulang punggung) dan bagian yang berbeda pada rantai samping. Urutan asam amino pada rantai polipeptida dapat menentukan jenis protein, karena menentukan struktur dan menentukan fungsi fisiologis. Urutan asam amino spesifik/khas untuk semua jenis protein tertentu, dapat ditentukan oleh sandi genetik yang terdapat dalam DNA.
Komposisi sama, urutan asam amino berbeda maka protein terbentuk berbeda, kombinasi urutan 20 asam amino bersifat faktorial serta jenis protein yang mungkin dibentuk tidak terbatas. Subsitusi 1 asam amino menentukan fungsi biologis, bila salah maka akan berubah. Contoh struktur Hb dimana glutamin diganti alanin sama-sama struktur polar tetapi fungsi biologis berubah.
Universalisme asam amino penyusun protein sebagai salah satu fenomena universalisme dalam mahluk hidup. Ada 20 asam amino penyusun protein, dengan kodon sama dari semua sumber DNA. Misal UAA adalah asam amino X, baik untuk manusia, virus, bakteri sama.
Tabel 3B.2 Kodon asam amino
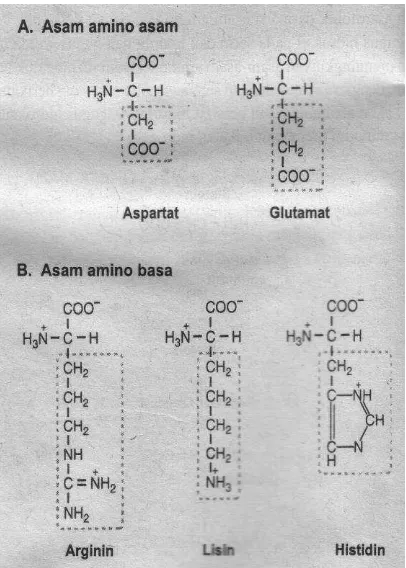
Klasifikasi asam amino, berdasarkan polaritas terdiri atas : 1. Asam amino non-polar/R-hidrofobik
2. Asam amino polar, R-tidak bermuatan
3. Asam amino R muatan (-) pada intrasel pH 6-7 4. Asam amino R muatan (+) pada intrasel pH 6-7
Asam amino non-polar/R-hidrofobik dimana asam amino dengan R-rantai hidrokarbon alifatik, asam amino dengan R Cincin aromatik dan asam amino mengandung S.
Asam amino polar, R-tidak bermuatan yaitu bersifat larut dalam air, R dapat mengadakan ikatan hidrogen dengan air, mengandung OH, mengandung gugus amida dan mengandung gugus SH. Asam amino polar terdiri atas Asam amino R muatan (-/asam) pada intrasel pH 6-7. Asam amino R muatan (+/basa) pada intrasel pH 6-7.
Gambar 3B.3 Asam amino polar
Peran protein dalam fungsi fisiologis hidup yaitu antara lain sebagai katalisis enzimatik dalam bentuk protein enzim; sebagai transporter dan molekul penyimpan yaitu dalam bentuk transferin, hemoglobin dan mioglobin; protein koordinasi gerak dalam bentuk aktin-miosin; sebagai protein penunjang mekanis dalam bentuk kolagen pembentuk tulang dan kulit; protein proteksi Imun dalam bentuk antibodi dapat mengenal benda asing dalam tubuh; protein untuk membangkitkan dan menghantar impuls saraf berupa rodopsin peka terhadap cahaya; dan pengaturan pertumbuhan dan deverensiasi berupa pengatur pembentukan hormon.
Aktivitas protein secara umum dalam bentuk interaksi protein-ligand untuk melaksanakan fungsinya sebagai protein yang mengikat bahan/zat lain (ligand). Misalnya antibodi-antigen dan enzim-substrat, ion, koenzim. Kompleks ikatan tersebut menunjukkan ada ikatan asam amino (hidrofobik dan hidrofilik) yang memiliki kemampuan berdasarkan sifat-sifat ikatan asam amino berdasarkan gugus R pada situs aktif. Hal ini merupakan prinsip untuk menentukan teknologi protein.
sampai manusia. Pada protein homolog terdapat banyak posisi asam amino ditempati asam amino yang sama pada berbagai species serta memiliki residu tetap (residu invarian).
Gambar 3B.4 Kemampuan protein saling beriktan
Hubungan protein spesifik mulai dengan tingkat perkembangan dan deferensial sel. Pada beberapa posisi terdapat residu variasi (residu variabel). Misal pada sitokrom c merupakan protein mitokondria, yang mengandung Fe dapat mentransfer e- pada reaksi
oksidasi biologi dalam eukariota.
Dasar penggunaan pengukuran protein intrasel sebagai dasar untuk mendukung atau menyingkirkan suatu diagnosis penyakit. Perubahan urutan asam amino dapat menggangguan fungsi sehingga menyebabkan penyakit. Ada > 400 penyakit genetik pada manusia disebabkan pembentukan protein yang cacat, terjadi dikarenakan perubahan 1 asam amino dalam urutan asam amino yang lazim dari suatu protein. Contoh anemia sel sabit (Sickell cell anemia), struktur Hb abnormal dewasa (HbS), pada rantai globulin β-residu ke-6 adalah glu berubah menjadi val sifat Hb berubah maka timbul penyakit.
Dasar pe aha a terjadi ya gene rearrangement” dan eksperi proteinnya yaitu pengaturan jenis dan jumlah protein dalam sel, berlangsung dalam transkripsi, pascatranskripsi, translasi dan pascatranslasi. Perubahan dalam jumlah atau struktur gen dapat mempengaruhi jumlah dan jenis protein menyebabkan gen lenyap, meningkatnya jumlah protein, gen tersusun ulang (gene rearrangement) dan modifikasi gen.
C.
ASAM NUKLEAT
Struktur Molekul
Asam nukleat merupakan salah satu makromolekul yang memegang peranan sangat penting dalam kehidupan organisme karena di dalamnya tersimpan informasi genetik. Asam nukleat sering dinamakan juga polinukleotida karena tersusun dari sejumlah molekul nukleotida sebagai monomernya. Tiap nukleotida mempunyai struktur yang terdiri atas gugus
fosfat, gula pentosa, dan basa nitrogen atau basa nukleotida(basa N).
Ada dua macam asam nukleat, yaitu asam deoksiribonukleat atau Deoxyribonucleic
Acid (DNA) dan asam ribonukleat atau Ribonucleic Acid (RNA). Dilihat dari strukturnya,
perbedaan di antara kedua macam asam nukleat ini terutama terletak pada komponen gula pentosanya. Pada RNA gula pentosanya adalah ribosa, sedangkan pada DNA gula pentosanya
e gala i kehila ga satu ato O pada posisi C o or ’ sehi gga di a aka gula ’ -deoksiribosa.
Gambar 3C.1 Struktur Ribosa dan deoksiribosa
Perbedaan struktur lainnya antara DNA dan RNA adalah pada basa N-nya. Basa N, baik pada DNA maupun pada RNA, mempunyai struktur berupa cincin aromatik heterosiklik (mengandung C dan N) dan dapat dikelompokkan menjadi dua golongan, yaitu purin dan
pirimidin. Basa purin mempunyai dua buah cincin (bisiklik), sedangkan basa pirimidin hanya
mempunyai satu cincin (monosiklik). Pada DNA, dan juga RNA, purin terdiri atas adenin(A) dan
guanin (G). Akan tetapi, untuk pirimidin ada perbedaan antara DNA dan RNA. Kalau pada DNA
basa pirimidin terdiri atas sitosin (C) dan timin (T), pada RNA tidak ada timin dan sebagai gantinya terdapat urasil (U). Timin berbeda dengan urasil hanya karena adanya gugus metil pada posisi nomor 5 sehingga timin dapat juga dikatakan sebagai 5-metilurasil.
Gambar 3C.2 Basa nitrogen
Di antara ketiga komponen monomer asam nukleat tersebut di atas, hanya basa N-lah yang memungkinkan terjadinya variasi. Pada kenyataannya memang urutan (sekuens) basa N pada suatu molekul asam nukleat merupakan penentu bagi spesifisitasnya. Dengan perkataan lain, identifikasi asam nukleat dilakukan berdasarkan atas urutan basa N-nya sehingga secara skema kita bisa menggambarkan suatu molekul asam nukleat hanya dengan menuliskan urutan basanya saja.
Nukleosida dan nukleotida
Pe o ora posisi ato C pada i i gula dilakuka e ggu aka ta da akse ’, ’,
dan seterusnya), sekedar untuk membedakannya dengan penomoran posisi pada cincin basa.
Posisi ’ pada gula aka erikata de ga posisi 9 N-9) pada basa purin atau posisi 1 (N-1) pada basa pirimidin melalui ikatan glikosidik atau glikosilik. Kompleks gula-basa ini dinamakan
nukleosida.
Di atas telah disinggung bahwa asam nukleat tersusun dari monomer-monomer berupa nukleotida, yang masing-masing terdiri atas sebuah gugus fosfat, sebuah gula pentosa, dan sebuah basa N. Dengan demikian, setiap nukleotida pada asam nukleat dapat dilihat sebagai nukleosida monofosfat. Namun, pengertian nukleotida secara umum sebenarnya adalah nukleosida dengan sebuah atau lebih gugus fosfat. Sebagai contoh, molekul ATP (adenosin trifosfat) adalah nukleotida yang merupakan nukleosida dengan tiga gugus fosfat.
Ikatan fosfodiester
Selain ikatan glikosidik yang menghubungkan gula pentosa dengan basa N, pada asam nukleat terdapat pula ikatan kovalen melalui gugus fosfat yang menghubungkan antara gugus
hidroksil OH pada posisi ’ gula pe tosa da gugus hidroksil pada posisi ’ gula pe tosa
nukleotida berikutnya. Ikatan ini dinamakan ikatan fosfodiester karena secara kimia gugus fosfat berada dalam bentuk diester.
Gambar 3C.3 Ikatan fosfodiester (P)
Oleh karena ikatan fosfodiester menghubungkan gula pada suatu nukleotida dengan gula pada nukleotida berikutnya, maka ikatan ini sekaligus menghubungkan kedua nukleotida yang berurutan tersebut. Dengan demikian, akan terbentuk suatu rantai polinukleotida yang masing-masing nukleotidanya satu sama lain dihubungkan oleh ikatan fosfodiester.
Kecuali yang berbentuk sirkuler, seperti halnya pada kromosom dan plasmid bakteri, rantai polinukleotida memiliki dua ujung. Salah satu ujungnya berupa gugus fosfat yang terikat pada
posisi ’ gula pe tosa. Oleh kare a itu, uju g i i di a aka ujung P atau ujung 5’. Ujung yang
lai ya erupa gugus hidroksil ya g terikat pada posisi ’ gula pe tosa sehi gga uju g i i
dinamakan ujung OH atau ujung 3’. Adanya ujung-ujung tersebut menjadikan rantai polinukleotida linier mempunyai arah tertentu.
Pada pH netral adanya gugus fosfat akan menyebabkan asam nukleat bermuatan
Sekuens asam nukleat
Telah dikatakan di atas bahwa urutan basa N akan menentukan spesifisitas suatu molekul asam nukleat sehingga biasanya kita menggambarkan suatu molekul asam nukleat cukup dengan menuliskan urutan basa (sekuens)-nya saja. Selanjutnya, dalam penulisan
sekue s asa ukleat ada ke iasaa u tuk e e patka uju g ’ di se elah kiri atau uju g ’ di se elah ka a . Se agai o toh, suatu sekue s DNA dapat dituliska ’-ATGACCTGAAAC- ’
atau suatu sekue s RNA dituliska ’-GGUCUGAAUG- ’.
Jadi, spesifisitas suatu asam nukleat selain ditentukan oleh sekuens basanya, juga harus dilihat dari arah pembacaannya. Dua asam nukleat yang memiliki sekuens sama tidak berarti keduanya sama jika pembacaan sekuens tersebut dilakukan dari arah yang berlawanan (yang
satu ’→ ’, seda gka ya g lai ’→ ’ .
Gambar 3C.4 Struktur tangga berpilin (double helix) DNA
Dua orang ilmuwan, J.D.Watson dan F.H.C.Crick, mengajukan model struktur molekul DNA yang hingga kini sangat diyakini kebenarannya dan dijadikan dasar dalam berbagai teknik yang berkaitan dengan manipulasi DNA. Model tersebut dikenal sebagai tangga berplilin (double helix). Secara alami DNA pada umumnya mempunyai struktur molekul tangga berpilin ini.
polinukleotida terikat satu sama lain dan saling komplementer. Artinya, begitu sekuens basa pada salah satu rantai diketahui, maka sekuens pada rantai yang lainnya dapat ditentukan.
Oleh karena basa bisiklik selalu berpasangan dengan basa monosiklik, maka jarak antara kedua rantai polinukleotida di sepanjang molekul DNA akan selalu tetap. Dengan perkataan lain, kedua rantai terse ut sejajar. Aka tetapi, jika ra tai ya g satu di a a dari arah ’ ke ’,
aka ra tai pasa ga ya di a a dari arah ’ ke ’. Jadi, kedua ra tai terse ut sejajar tetapi
berlawanan arah (antiparalel).
Gambar 3C.5 Model struktur tangga berpilin DNA
tegak lurus di dalam masing-masing rantai menjadi 3,4 nm. Namun, kondisi semacam ini hanya dijumpai apabila DNA berada dalam medium larutan fisiologis dengan kadar garam rendah seperti halnya yang terdapat di dalam protoplasma sel hidup. DNA semacam ini dikatakan berada dalam bentuk B atau bentuk yang sesuai dengan model asli Watson-Crick. Bentuk yang lain, misalnya bentuk A, akan dijumpai jika DNA berada dalam medium dengan kadar garam tinggi. Pada bentuk A terdapat 11 pasangan basa dalam setiap putaran spiral. Selain itu, ada pula bentuk Z, yaitu bentuk molekul DNA yang mempunyai arah pilinan spiral ke kiri. Bermacam-macam bentuk DNA ini sifatnya fleksibel, artinya dapat berubah dari yang satu ke yang lain bergantung kepada kondisi lingkungannya.
Gambar 3C.6 Struktur double helix
Modifikasi struktur molekul RNA
Dengan adanya modifikasi struktur molekul RNA, kita mengenal tiga macam RNA, yaitu
RNA duta atau messenger RNA (mRNA), RNA pemindah atau transfer RNA (tRNA), dan RNA
ribosomal (rRNA). Struktur mRNA dikatakan sebagai struktur primer, sedangkan struktur tRNA
dan rRNA dikatakan sebagai struktur sekunder. Perbedaan di antara ketiga struktur molekul RNA tersebut berkaitan dengan perbedaan fungsinya masing-masing.
Sifat-sifat Fisika-Kimia Asam Nukleat
Di bawah ini akan dibicarakan sekilas beberapa sifat fisika-kimia asam nukleat. Sifat-sifat tersebut adalah stabilitas asam nukleat, pengaruh asam, pengaruh alkali, denaturasi kimia, viskositas, dan kerapatan apung.
Stabilitas asam nukleat
Ketika kita melihat struktur tangga berpilin molekul DNA atau pun struktur sekunder RNA, sepintas akan nampak bahwa struktur tersebut menjadi stabil akibat adanya ikatan hidrogen di antara basa-basa yang berpasangan. Padahal, sebenarnya tidaklah demikian. Ikatan hidrogen di antara pasangan-pasangan basa hanya akan sama kuatnya dengan ikatan hidrogen antara basa dan molekul air apabila DNA berada dalam bentuk rantai tunggal. Jadi, ikatan hidrogen jelas tidak berpengaruh terhadap stabilitas struktur asam nukleat, tetapi sekedar menentukan spesifitas perpasangan basa.
Penentu stabilitas struktur asam nukleat terletak pada interaksi penempatan (stacking interactions) antara pasangan-pasangan basa. Permukaan basa yang bersifat hidrofobik menyebabkan molekul-molekul air dikeluarkan dari sela-sela perpasangan basa sehingga perpasangan tersebut menjadi kuat.
Pengaruh asam
Di dalam asam pekat dan suhu tinggi, misalnya HClO4 dengan suhu lebih dari 100ºC,
asam nukleat akan mengalami hidrolisis sempurna menjadi komponen-komponennya. Namun, di dalam asam mineral yang lebih encer, hanya ikatan glikosidik antara gula dan basa purin saja yang putus sehingga asam nukleat dikatakan bersifat apurinik.
Pengaruh alkali
Pengaruh alkali terhadap asam nukleat mengakibatkan terjadinya perubahan status
tautomerik basa. Sebagai contoh, peningkatan pH akan menyebabkan perubahan struktur
Denaturasi kimia
Sejumlah bahan kimia diketahui dapat menyebabkan denaturasi asam nukleat pada pH netral. Contoh yang paling dikenal adalah urea (CO(NH2)2) dan formamid (COHNH2). Pada
konsentrasi yang relatif tinggi, senyawa-senyawa tersebut dapat merusak ikatan hidrogen. Artinya, stabilitas struktur sekunder asam nukleat menjadi berkurang dan rantai ganda mengalami denaturasi.
Viskositas
DNA kromosom dikatakan mempunyai nisbah aksial yang sangat tinggi karena diameternya hanya sekitar 2 nm, tetapi panjangnya dapat mencapai beberapa sentimeter. Dengan demikian, DNA tersebut berbentuk tipis memanjang. Selain itu, DNA merupakan molekul yang relatif kaku sehingga larutan DNA akan mempunyai viskositas yang tinggi. Karena sifatnya itulah molekul DNA menjadi sangat rentan terhadap fragmentasi fisik. Hal ini menimbulkan masalah tersendiri ketika kita hendak melakukan isolasi DNA yang utuh.
Kerapatan apung
Analisis dan pemurnian DNA dapat dilakukan sesuai dengan kerapatan apung (bouyant density)-nya. Di dalam larutan yang mengandung garam pekat dengan berat molekul tinggi, misalnya sesium klorid (CsCl) 8M, DNA mempunyai kerapatan yang sama dengan larutan tersebut, yakni sekitar 1,7 g/cm3. Jika larutan ini disentrifugasi dengan kecepatan yang sangat
tinggi, maka garam CsCl yang pekat akan bermigrasi ke dasar tabung dengan membentuk
gradien kerapatan. Begitu juga, sampel DNA akan bermigrasi menuju posisi gradien yang sesuai
dengan kerapatannya. Teknik ini dikenal sebagai sentrifugasi seimbang dalam tingkat
kerapatan (equilibrium density gradient centrifugation) atau sentrifugasi isopiknik.
Oleh karena dengan teknik sentrifugasi tersebut pelet RNA akan berada di dasar tabung dan protein akan mengapung, maka DNA dapat dimurnikan baik dari RNA maupun dari protein. Selain itu, teknik tersebut juga berguna untuk keperluan analisis DNA karena kerapatan apung DNA ρ merupakan fungsi linier bagi kandungan GC-nya. Dalam hal ini, ρ = 1,66 + 0,098% (G+C).
Sifat-sifat Spektroskopik-Termal Asam Nukleat
Sifat spektroskopik-termal asam nukleat meliputi kemampuan absorpsi sinar UV, hipokromisitas, penghitungan konsentrasi asam nukleat, penentuan kemurnian DNA, serta denaturasi termal dan renaturasi asam nukleat. Masing-masing akan dibicarakan sekilas berikut ini.
Absorpsi UV
untuk absorpsi maksimum baik oleh DNA maupun RNA adalah atau dikataka λmaks = . Nilai i i jelas sa gat er eda de ga ilai u tuk protei ya g e pu yai λmaks = 280
nm. Sifat-sifat absorpsi asam nukleat dapat digunakan untuk deteksi, kuantifikasi, dan perkiraan kemurniannya.
Hipokromisitas
Meskipu λmaks untuk DNA dan RNA konstan, ternyata ada perbedaan nilai yang bergantung kepada li gku ga di sekitar asa erada. Dala hal i i, a sor a si pada λ A260)
memperlihatkan variasi di antara basa-basa pada kondisi yang berbeda. Nilai tertinggi terlihat pada nukleotida yang diisolasi, nilai sedang diperoleh pada molekul DNA rantai tunggal (ssDNA) atau RNA, dan nilai terendah dijumpai pada DNA rantai ganda (dsDNA). Efek ini disebabkan oleh pengikatan basa di dalam lingkungan hidrofobik. Istilah klasik untuk menyatakan perbedaan nilai absorbansi tersebut adalah hipokromisitas. Molekul dsDNA dikatakan relatif hipokromik (kurang berwarna) bila dibandingkan dengan ssDNA. Sebaliknya, ssDNA dikatakan hiperkromik terhadap dsDNA.
Penghitungan konsentrasi asam nukleat
Konsentrasi DNA dihitung atas dasar nilai A260-nya. Molekul dsDNA dengan konsentrasi
1mg/ml mempunyai A260 sebesar 20, sedangkan konsentrasi yang sama untuk molekul ssDNA
atau RNA mempunyai A260 lebih kurang sebesar 25. Nilai A260 untuk ssDNA dan RNA hanya
merupakan perkiraan karena kandungan basa purin dan pirimidin pada kedua molekul tersebut tidak selalu sama, dan nilai A260 purin tidak sama dengan nilai A260 pirimidin. Pada dsDNA, yang
selalu mempunyai kandungan purin dan pirimidin sama, nilai A260 -nya sudah pasti. Kemurnian asam nukleat
Tingkat kemurnian asam nukleat dapat diestimasi melalui penentuan nisbah A260
terhadap A280. Molekul dsDNA murni mempunyai nisbah A260 /A280 sebesar 1,8. Sementara itu,
Di atas telah disinggung bahwa beberapa senyawa kimia tertentu dapat menyebabkan terjadinya denaturasi asam nukleat. Ternyata, panas juga dapat menyebabkan denaturasi asam nukleat. Proses denaturasi ini dapat diikuti melalui pengamatan nilai absorbansi yang meningkat karena molekul rantai ganda (pada dsDNA dan sebagian daerah pada RNA) akan berubah menjadi molekul rantai tunggal.
halnya pada DNA. Denaturasi terjadi sangat cepat dan bersifat koperatif karena denaturasi pada kedua ujung molekul dan pada daerah kaya AT akan mendestabilisasi daerah-daerah di sekitarnya.
Suhu ketika molekul asam nukleat mulai mengalami denaturasi dinamakan titik leleh atau
melting temperature (Tm). Nilai Tm merupakan fungsi kandungan GC sampel DNA, dan berkisar
dari 80 ºC hingga 100ºC untuk molekul-molekul DNA yang panjang.
DNA yang mengalami denaturasi termal dapat dipulihkan (direnaturasi) dengan cara didinginkan. Laju pendinginan berpengaruh terhadap hasil renaturasi yang diperoleh. Pendinginan yang berlangsung cepat hanya memungkinkan renaturasi pada beberapa bagian/daerah tertentu. Sebaliknya, pendinginan yang dilakukan perlahan-lahan dapat mengembalikan seluruh molekul DNA ke bentuk rantai ganda seperti semula. Renaturasi yang terjadi antara daerah komplementer dari dua rantai asam nukleat yang berbeda dinamakan
hibridisasi.
Superkoiling DNA
Banyak molekul dsDNA berada dalam bentuk sirkuler tertutup atau closed-circular (CC), misalnya DNA plasmid dan kromosom bakteri serta DNA berbagai virus. Artinya, kedua rantai membentuk lingkaran dan satu sama lain dihubungkan sesuai dengan banyaknya putaran
heliks (Lk) di dalam molekul DNA tersebut.
Sejumlah sifat muncul dari kondisi sirkuler DNA. Cara yang baik untuk membayangkannya adalah menganggap struktur tangga berpilin DNA seperti gelang karet dengan suatu garis yang ditarik di sepanjang gelang tersebut. Jika kita membayangkan suatu pilinan pada gelang, maka deformasi yang terbentuk akan terkunci ke dalam sistem pilinan tersebut. Deformasi inilah yang disebut sebagai superkoiling.
Interkalator
Geometri suatu molekul yang mengalami superkoiling dapat berubah akibat beberapa faktor yang mempengaruhi pilinan internalnya. Sebagai contoh, peningkatan suhu dapat menurunkan jumlah pilinan, atau sebaliknya, peningkatan kekuatan ionik dapat menambah jumlah pilinan. Salah satu faktor yang penting adalah keberadaan interkalator seperti etidium
bromid (EtBr). Molekul ini merupakan senyawa aromatik polisiklik bermuatan positif yang
D.REPLIKASI DNA
Salah satu fungsi DNA sebagai materi genetik pada sebagian besar organisme adalah harus mampu menyimpan informasi genetik dan dengan tepat dapat meneruskan informasi tersebut dari induk kepada keturunannya, dari generasi ke generasi. Fungsi ini merupakan fungsi
genotipik, yang dilaksanakan melalui replikasi.
Mekanisme Replikasi Semikonservatif
Setiap molekul DNA yang melakukan replikasi sebagai suatu satuan tunggal dinamakan replikon. Dimulainya (inisiasi) replikasi DNA terjadi di suatu tempat tertentu di dalam molekul DNA yang dinamakan titik awal replikasi atau origin of replication (ori). Proses inisiasi ini
ditandai oleh saling memisahnya kedua untai DNA, yang masing-masing akan berperan sebagai cetakan bagi pembentukan untai DNA baru sehingga akan diperoleh suatu gambaran yang disebut sebagai garpu replikasi. Biasanya, inisiasi replikasi DNA, baik pada prokariot maupun eukariot, terjadi dua arah (bidireksional). Dalam hal ini dua garpu replikasi akan bergerak melebar dari ori menuju dua arah yang berlawanan hingga tercapai suatu ujung (terminus). Pada eukariot, selain terjadi replikasi dua arah, ori dapat ditemukan di beberapa tempat.
Replikasi pada kedua untai DNA
Proses replikasi DNA yang kita bicarakan di atas sebenarnya barulah proses yang terjadi pada salah satu untai DNA. Untai DNA tersebut sering dinamakan untai pengarah (leading strand). Sintesis DNA baru pada untai pengarah i i erla gsu g se ara ko ti yu dari uju g ’ ke uju g ’
atau ergerak di sepa ja g u tai pe garah dari uju g ’ ke uju g ’.
Pada u tai DNA pasa ga ya ter yata juga terjadi si tesis DNA aru dari uju g ’ ke uju g ’
atau bergerak di sepanjang untai DNA etaka ya i i dari uju g ’ ke uju g ’. Na u , si tesis DNA pada untai yang satu ini tidak berjalan kontinyu sehingga menghasilkan fragmen terputus-putus, yang masing- asi g e pu yai arah ’→ ’. Terjadi ya si tesis DNA ya g tidak kontinyu sebenarnya disebabkan oleh sifat enzim DNA polimerase yang hanya dapat
e yi tesis DNA dari arah ’ ke ’ serta ketidak a pua ya u tuk elakuka i isiasi si tesis
DNA.
Replikasi DNA prokariot
Replikasi DNA kromosom prokariot, khususnya bakteri, sangat berkaitan dengan siklus pertumbuhannya. Daerah ori pada E. coli, misalnya, berisi empat buah tempat pengikatan protein inisiator DnaA, yang masing-masing panjangnya 9 pb. Sintesis protein DnaA ini sejalan dengan laju pertumbuhan bakteri sehingga inisiasi replikasi juga sejalan dengan laju pertumbuhan bakteri. Pada laju pertumbuhan sel yang sangat tinggi, DNA kromosom prokariot dapat mengalami reinisiasi replikasi pada dua ori yang baru terbentuk, sebelum putaran replikasi yang pertama berakhir. Akibatnya, sel-sel hasil pembelahan akan menerima kromosom yang sebagian telah bereplikasi.
Protein DnaA membentuk struktur kompleks yang terdiri atas 30 hingga 40 buah molekul, yang masing-masing akan terikat pada molekul ATP. Daerah ori akan mengelilingi kompleks DnaA-ATP tersebut. Proses ini memerlukan kondisi superkoiling negatif DNA (pilinan kedua untai DNA berbalik arah sehingga terbuka). Superkoiling negatif akan menyebabkan pembukaan tiga sekuens repetitif sepanjang 13 pb yang kaya dengan AT sehingga memungkinkan terjadinya pengikatan protein DnaB, yang merupakan enzim helikase, yaitu enzim yang akan menggunakan energi ATP hasil hidrolisis untuk bergerak di sepanjang kedua untai DNA dan memisahkannya.
Untai DNA tunggal hasil pemisahan oleh helikase selanjutnya diselubungi oleh protein pengikat untai tunggal atau single-stranded binding protein (Ssb) untuk melindungi DNA untai tunggal dari kerusakan fisik dan mencegah renaturasi. Enzim DNA primase kemudian akan menempel pada DNA dan menyintesis RNA primer yang pendek untuk memulai atau menginisiasi sintesis pada untai pengarah.
Agar replikasi dapat terus berjalan menjauhi ori, diperlukan enzim helikase selain DnaB. Hal ini karena pembukaan heliks akan diikuti oleh pembentukan putaran baru berupa superkoiling positif. Superkoiling negatif yang terjadi secara alami ternyata tidak cukup untuk mengimbanginya sehingga diperlukan enzim lain, yaitu topoisomerase tipe II yang disebut dengan DNA girase. Enzim DNA girase ini merupakan target serangan antibiotik sehingga pemberian antibiotik dapat mencegah berlanjutnya replikasi DNA bakteri.
Seperti telah dijelaskan di atas, replikasi DNA terjadi baik pada untai pengarah maupun pada untai tertinggal. Pada untai tertinggal suatu kompleks yang disebut primosom akan menyintesis sejumlah RNA primer dengan interval 1.000 hingga 2.000 basa. Primosom terdiri atas helikase DnaB dan DNA primase.
Masing-masing bagian dimer pada kedua untai tersebut terdiri atas subunit a, yang mempunyai fungsi polimerase sesungguhnya, dan subunit e, yang mempunyai fungsi penyuntingan berupa
ekso uklease ’ ’. Selai itu, terdapat subunit b yang menempelkan polimerase pada DNA. Begitu primer pada untai tertinggal dielongasi oleh DNA polimerase III, mereka akan segera dibuang dan celah yang ditimbulkan oleh hilangnya primer tersebut diisi oleh DNA polimerase I, yang mempunyai akti itas poli erase ’ ’, ekso uklease ’ ’, da -eksonuklease
pe yu ti ga ’ ’. Ekso uklease ’ ’ e ua g pri er, seda gka poli erase aka
mengisi celah yang ditimbulkan. Akhirnya, fragmen-fragmen Okazaki akan dipersatukan oleh enzim DNA ligase. Secara in vivo, dimer holoenzim DNA polimerase III dan primosom diyakini membentuk kompleks berukuran besar yang disebut dengan replisom. Dengan adanya replisom sintesis DNA akan berlangsung dengan kecepatan 900 pb tiap detik.
Kedua garpu replikasi akan bertemu kira-kira pada posisi 180°C dari ori. Di sekitar daerah ini terdapat sejumlah terminator yang akan menghentikan gerakan garpu replikasi. Terminator tersebut antara lain berupa produk gen tus, suatu inhibitor bagi helikase DnaB. Ketika replikasi selesai, kedua lingkaran hasil replikasi masih menyatu. Pemisahan dilakukan oleh enzim topoisomerase IV. Masing-masing lingkaran hasil replikasi kemudian disegregasikan ke dalam kedua sel hasil pembelahan.
Replikasi DNA eukariot
Pada eukariot replikasi DNA hanya terjadi pada fase S di dalam interfase. Untuk memasuki fase S diperlukan regulasi oleh sistem protein kompleks yang disebut siklin dan kinase tergantung siklin atau cyclin-dependent protein kinases (CDKs), yang berturut-turut akan diaktivasi oleh sinyal pertumbuhan yang mencapai permukaan sel. Beberapa CDKs akan melakukan fosforilasi dan mengaktifkan protein-protein yang diperlukan untuk inisiasi pada masing-masing ori.
Berhubung dengan kompleksitas struktur kromatin, garpu replikasi pada eukariot bergerak hanya dengan kecepatan 50 pb tiap detik. Sebelum melakukan penyalinan, DNA harus dilepaskan dari nukleosom pada garpu replikasi sehingga gerakan garpu replikasi akan diperlambat menjadi sekitar 50 pb tiap detik. Dengan kecepatan seperti ini diperlukan waktu sekitar 30 hari untuk menyalin molekul DNA kromosom pada kebanyakan mamalia. Sederetan sekuens tandem yang terdiri atas 20 hingga 50 replikon mengalami inisiasi secara serempak pada waktu tertentu selama fase S. Deretan yang mengalami inisasi paling awal adalah eukromatin, sedangkan deretan yang agak lambat adalah heterokromatin. DNA sentromir dan telomir bereplikasi paling lambat. Pola semacam ini mencerminkan aksesibilitas
struktur kromatin yang berbeda-beda terhadap faktor inisiasi.
untai pengarah dan DNA polimerase e pada untai tertinggal. Baik DNA polimerase d maupun e mempunyai fungsi penyuntingan. Kemampuan DNA polimerase d untuk menyintesis DNA yang panjang disebabkan oleh adanya antigen perbanyakan nuklear sel atau proliferating cell nuclear antigen (PCNA), yang fungsinya setara dengan subunit b holoenzim DNA polimerase III pada E. coli. Selain terjadi penggandaan DNA, kandungan histon di dalam sel juga mengalami penggandaan selama fase S.
Mesin replikasi yang terdiri atas semua enzim dan DNA yang berkaitan dengan garpu replikasi akan diimobilisasi di dalam matriks nuklear. Mesin-mesin tersebut dapat divisualisasikan menggunakan mikroskop dengan melabeli DNA yang sedang bereplikasi. Pelabelan dilakukan menggunakan analog timidin, yaitu bromodeoksiuridin (BUdR), dan visualisasi DNA yang dilabeli tersebut dilakukan dengan imunofloresensi menggunakan antibodi yang mengenali BUdR.
Ujung kromosom linier tidak dapat direplikasi sepenuhnya karena tidak ada DNA yang dapat
e gga tika RNA pri er ya g di ua g dari uju g ’ u tai terti ggal. De ga de ikia ,
informasi genetik dapat hilang dari DNA. Untuk mengatasi hal ini, ujung kromosom eukariot (telomir) mengandung beratus-ratus sekuens repetitif sederhana yang tidak berisi informasi
ge etik de ga uju g ’ ela paui uju g ’. E zi telo erase e ga du g olekul RNA
pendek, yang sebagian sekuensnya komplementer dengan sekuens repetitif tersebut. RNA ini akan bertindak sebagai cetakan (template) bagi penambahan sekuens repetitif pada uju g ’.
E.
TRANSKRIPSI DNA
Salah satu fungsi dasar yang harus dijalankan oleh DNA sebagai materi genetik adalah fungsi fenotipik. Artinya, DNA harus mampu mengatur pertumbuhan dan diferensiasi individu organisme sehingga dihasilkan suatu fenotipe tertentu. Fungsi ini dilaksanakan melalui ekspresi gen, yang tahap pertamanya adalah proses transkripsi, yaitu perubahan urutan basa molekul DNA menjadi urutan basa molekul RNA. Dengan perkataan lain, transkripsi merupakan proses sintesis RNA menggunakan salah satu untai molekul DNA sebagai cetakan (template) nya.
Transkripsi mempunyai ciri-ciri kimiawi yang serupa dengan sintesis/replikasi DNA, yaitu
1. Adanya sumber basa nitrogen berupa nukleosida trifosfat. Bedanya dengan sumber basa untuk sintesis DNA hanyalah pada molekul gula pentosanya yang tidak berupa deoksiribosa tetapi ribosa dan tidak adanya basa timin tetapi digantikan oleh urasil. Jadi, keempat nukleosida trifosfat yang diperlukan adalah adenosin trifosfat (ATP), guanosin trifosfat (GTP), sitidin trifosfat (CTP), dan uridin trifosfat (UTP).
2. Adanya untai molekul DNA sebagai cetakan. Dalam hal ini hanya salah satu di antara kedua untai DNA yang akan berfungsi sebagai cetakan bagi sintesis molekul RNA. Untai DNA ini mempunyai urutan basa yang komplementer dengan urutan basa RNA hasil transkripsinya, dan disebut sebagai pita antisens. Sementara itu, untai DNA pasangannya, yang mempunyai urutan basa sama dengan urutan basa RNA, disebut sebagai pita sens. Meskipun demikian, sebenarnya transkripsi pada umumnya tidak terjadi pada urutan basa di sepanjang salah satu untai DNA. Jadi, bisa saja urutan basa yang ditranskripsi terdapat berselang-seling di antara kedua untai DNA.
3. Si tesis erla gsu g de ga arah ’→ ’ seperti hal ya arah si tesis DNA.
4. Gugus ’- OH pada suatu ukleotida ereaksi de ga gugus ’- trifosfat pada nukleotida berikutnya menghasilkan ikatan fosofodiester dengan membebaskan dua atom pirofosfat anorganik (PPi). Reaksi ini jelas sama dengan reaksi polimerisasi DNA. Hanya saja enzim yang bekerja bukannya DNA polimerase, melainkan RNA
polimerase. Perbedaan yang sangat nyata di antara kedua enzim ini terletak pada
kemampuan enzim RNA polimerase untuk melakukan inisiasi sintesis RNA tanpa adanya molekul primer.
Secara garis besar transkripsi berlangsung dalam empat tahap, yaitu pengenalan promoter, inisiasi, elongasi, dan teminasi. Masing-masing tahap akan dijelaskan secara singkat sebagai berikut.
Pengenalan promoter
erupaka te pat pe gikata e zi RNA poli erase di sisi ’ (upstream) dari urutan basa penyandi (gen) yang akan ditranskripsi. Tempat ini dinamakan promoter.
Inisiasi
Setelah mengalami pengikatan oleh promoter, RNA polimerase akan terikat pada suatu tempat di dekat promoter, yang dinamakan tempat awal polimerisasi atau tapak inisiasi (initiation site). Tempat ini sering dinyatakan sebagai posisi +1 untuk gen yang akan ditranskripsi. Nukleosida trifosfat pertama akan diletakkan di tapak inisiasi dan sintesis RNA pun segera dimulai.
Elongasi
Pengikatan enzim RNA polimerase beserta kofaktor-kofaktornya pada untai DNA cetakan membentuk kompleks transkripsi. Selama sintesis RNA berlangsung kompleks transkripsi akan bergeser di sepanjang molekul DNA cetakan sehingga nukleotida demi nukleotida akan
dita ahka kepada u tai RNA ya g seda g diperpa ja g pada uju g ’ ya. Jadi, elo gasi atau poli erisasi RNA erla gsu g dari arah ’ ke ’, se e tara RNA poli erase ya se diri
bergerak dari arah ’ ke ’ di sepa ja g u tai DNA etaka .
Terminasi
Berakhirnya polimerisasi RNA ditandai oleh disosiasi kompleks transkripsi atau terlepasnya enzim RNA polimerase beserta kofaktor-kofaktornya dari untai DNA cetakan. Begitu pula halnya dengan molekul RNA hasil sintesis. Hal ini terjadi ketika RNA polimerase mencapai urutan basa tertentu yang disebut dengan terminator.
Terminasi transkripsi dapat terjadi oleh dua macam sebab, yaitu terminasi yang hanya bergantung kepada urutan basa cetakan (disebut terminasi diri) dan terminasi yang memerlukan kehadiran suatu protein khusus (protein rho). Di antara keduanya terminasi diri lebih umum dijumpai. Terminasi diri terjadi pada urutan basa palindrom yang diikuti oleh beberapa adenin (A). Urutan palindrom adalah urutan yang sama jika dibaca dari dua arah yang berlawanan. Oleh karena urutan palindom ini biasanya diselingi oleh beberapa basa tertentu, maka molekul RNA yang dihasilkan akan mempunyai ujung terminasi berbentuk batang dan kala (loop) .
Inisiasi transkripsi tidak harus menunggu selesainya transkripsi sebelumnya. Hal ini karena begitu RNA polimerase telah melakukan pemanjangan 50 hingga 60 nukleotida, promoter dapat mengikat RNA polimerase yang lain. Pada gen-gen yang ditranskripsi dengan cepat reinisiasi transkripsi dapat terjadi berulang-ulang sehingga gen tersebut akan terselubungi oleh sejumlah molekul RNA dengan tingkat penyelesaian yang berbeda-beda.
Telah dikatakan di atas bahwa transkripsi merupakan proses sintesis RNA yang dikatalisis oleh enzim RNA polimerase. Berikut ini akan diuraikan sekilas enzim RNA polimerase pada prokariot, khususnya pada bakteri E.coli, promoter s70, serta proses transkripsi pada organisme tersebut.
RNA polimerase E. coli
Enzim RNA polimerase pada E. coli sekurang-kurangnya terdiri atas lima subunit, yaitu alfa (
sebagai holoenzim -masing subunit
Holoenzim RNA polimerase diperlukan
merupakan enzim inti (core enzyme) yang akan melanjutkan proses transkripsi.
Laju sintesis RNA oleh RNA polimerase E. coli dapat mencapai sekitar 40 nukleotida per detik pada suhu 37°C. Untuk aktivitasnya enzim ini memerlukan kofaktor Mg2+. Setiap berikatan
dengan molekul DNA enzim RNA polimerase E. coli dapat mencakup daerah sepanjang lebih kurang 60pb.
Meskipun kebanyakan RNA polimerase seperti halnya yang terdapat pada E. coli mempunyai struktur multisubunit, hal itu bukanlah persyaratan yang mutlak. RNA polimerase pada bakteriofag T3 dan T7, misalnya, merupakan rantai polipeptida tunggal yang ukurannya jauh lebih kecil daripada RNA polimerase bakteri. Enzim tersebut dapat menyintesis RNA dengan cepat, yaitu sebanyak 200 nukleotida per detik pada suhu 37°C.
yang identik terdapat pada RNA polimerase inti. Kedua-duanya disandi oleh gen
rpoA. Ketika bakteriofag T4 menginfeksi E.coli akan dimodifikasi melalui ribosilasi ADP suatu arginin. Hal ini berkaitan dengan berkurangnya afinitas pengikatan promoter
diduga kuat memegang peranan dalam pengenalan promoter.
sebagai pusat katalitik RNA polimerase, yang dibuktikan melalui hasil penelitian mengenai penghambatan transkripsi menggunakan antibiotik. Antibiotik rifampisin merupakan inhibitor potensial bagi RNA polimerase yang menghalangi inisiasi tetapi tidak mempengaruhi elongasi. Kelompok antibiotik ini tidak menghambat polimerase eukariot sehingga sering digunakan untuk mengatasi infeksi bakteri Gram positif dan tuberkulosis. Rifampisin telah dibuktikan
berikatan dengan subunit -mutasi yang menyebabkan resistensi terhadap
rifampisin telah dipetakan pada gen rpoB Selanjutnya,
rpoB.
mempunyai dua domain yang bertanggung jawab terhadap inisiasi dan elongasi transkripsi.
Subuni
rpoC ini mengikat dua ion Zn2+ yang diduga berpartisipasi dalam fungsi katalitik polimerase. Suatu
bat transkripsi secara
in vitro dan juga berkompetisi dengan DNA dalam pengikatan RNA polimerase. Hal ini cetakan.
E. coli 70 (disebut demikian karena
mengubah enzim tersebut menjadi holoenzim. Faktor s memegang peranan yang penting dalam pengenalan promoter tetapi tidak diperlukan untuk elongasi transkripsi. Kontribusi faktor s dalam pengenalan promoter adalah melalui penurunan afinitas enzim inti terhadap tempat-tempat nonspesifik pada molekul DNA hingga 104, disertai dengan peningkatan afinitas
terhadap promoter.
Banyak organisme prokariot, termasuk E. coli, mempunyai beberapa faktor terlibat dalam pengenalan
kelompok-RNA polimerase inti ketika sintesis kelompok-RNA mencapai panjang 8 hingga 9 nukleotida. Enzim inti tersebut kemudian akan bergerak di sepanjang molekul DNA sambil menyintesis untai RNA.
jumlah RNA polimerase inti sehingga hanya sepertiga di antara kompleks RNA polimerase yang akan dijumpai dalam bentuk holoenzim pada suatu waktu tertentu.
Promoter 70 pada E. coli
Seperti telah dikatakan di atas, promoter merupakan tempat tertentu pada molekul DNA yang mempunyai urutan basa spesifik untuk pengikatan RNA polimerase dan inisiasi transkripsi.
Meskipun demikian, faktor s yang paling umum dijumpai pada E. coli 70.
Promoter 70 terdiri atas urutan basa sepanjang 40 hingga 60 pb. Daerah antara –55 dan +20
telah diketahui merupakan daerah pengikatan RNA polimerase, sedangkan daerah antara –20 dan +20 diketahui sangat terlindung dari aktivitas nuklease oleh DNase I. Hal ini menunjukkan bahwa daerah tersebut sangat berkaitan dengan polimerase yang menghalangi akses nuklease menuju DNA. Mutagenesis promoter memperlihatkan bahwa urutan hingga lebih kurang –40 mempunyai peranan yang penting bagi fungsi promoter. Selain itu, dua urutan sepanjang 6 pb pada posisi sekitar –10 dan –35 terbukti sangat penting bagi fungsi promoter pada E. coli.
Urutan –10
Urutan yang paling lestari (konservatif) pada promoter 70, atau sering dikatakan sebagai
urutan konsensus, adalah urutan sepanjang 6 pb yang dijumpai pada promoter-promoter
berbagai macam gen pada E. coli. Urutan ini terpusat di sekitar posisi –10 jika dilihat dari tapak inisiasi transkripsi, dan dinamakan kotak Pribnow karena ditemukan oleh Pribnow pada tahun 1975. Urutan konsensus pada kotak Pribnow adalah TATAAT. Kedua basa pertama (TA) dan T yang terakhir merupakan basa-basa yang paling konservatif. Urutan heksamer ini dipisahkan sejauh 5 hingga 8 pb dari tapak inisiasi, dan urutan penyela yang memisahkan urutan -10 dengan tapak inisiasi tersebut tidaklah konservatif. Urutan –10 nampaknya merupakan urutan tempat terjadinya inisiasi pembukaan heliks oleh RNA polimerase.
Urutan -35
Selain urutan -10, terdapat pula urutan heksamer lain yang konservatif, yaitu urutan di sekitar posisi -35, yang terdiri atas TTGACA. Urutan ini akan lebih konservatif lagi pada promoter-promoter yang efisien. Tiga basa pertama (TTG) merupakan posisi yang paling konservatif. Pada kebanyakan promoter urutan -35 dipisahkan sejauh 16 hingga 18 pb dari kotak Pribnow, dan urutan penyelanya bukanlah urutan yang penting.
Tapak inisiasi transkripsi
Pada 90% di antara semua gen, tapak inisiasi transkripsi (posisi +1) berupa basa purin, dan dalam hal ini G lebih umum dijumpai daripada A. Di samping itu, basa C dan basa T sering kali mengapit tapak inisiasi sehingga terdapat urutan CGT atau CAT.
Efisiensi promoter
Sementara itu, urutan 30 basa pertama yang akan ditranskripsi juga mempengaruhi transkripsi. Urutan ini mengatur laju pelepasan promoter dari RNA polimerase, yang memungkinkan reinisiasi transkripsi dapat dilakukan oleh kompleks polimerase lainnya. Pada akhirnya hal ini akan berpengaruh terhadap laju transkripsi dan kekuatan promoter.
Pentingnya pemisahan untai DNA pada reaksi inisiasi diperlihatkan oleh pengaruh superkoiling negatif DNA cetakan yang pada umumnya akan memacu laju transkripsi. Hal ini diduga karena struktur superkoil tersebut hanya memerlukan sedikit energi untuk membuka heliks.
Beberapa urutan promoter tidak cukup mirip dengan urutan konsensus yang akan ditranskripsi dengan kuat pada kondisi normal. Sebagai contoh, promoter lac (Plac), yang memerlukan faktor
aktivasi tambahan berupa protein reseptor cAMP atau cAMP protein receptor (CPR) untuk mengikat suatu tempat pada DNA yang letaknya berdekatan dengan urutan promoter tersebut agar pengikatan RNA polimerase dan inisiasi transkripsi dapat ditingkatkan. Sejumlah promoter lainnya, misalnya untuk gen-gen yang berhubungan dengan kejut panas, mempunyai urutan konsensus tertentu yang hanya dapat dikenali oleh RNA polimerase dengan faktor .
Tahapan transkripsi pada prokariot
Seperti proses transkripsi pada umumnya, transkripsi pada prokariot berlangsung dalam empat tahap, yaitu pengikatan promoter, inisiasi, elongasi, dan teminasi. Di bawah ini akan dijelaskan pula sekilas tentang pembukaan heliks, yang terjadi antara tahap pengikatan promoter dan insiasi transkripsi.
Pengikatan promoter
Keadaan ini dikenal sebagai pengikatan longgar, dan sifatnya cukup stabil. Namun, begitu
pengurangan afinitas nonspesifik terhadap DNA hingga 20.000 kali. Sejalan dengan hal itu, pada tempat pengikatan promoter yang tepat hingga 100 kali. Dengan demikian, akan terjadi peningkatan spesifisitas holoenzim yang tajam dalam mengenali promoter.
Pada genom E. coli holoenzim dapat mencari dan mengikat promoter dengan sangat cepat. Bahkan, karena begitu cepatnya, maka proses ini tidak mungkin terjadi melalui pengikatan dan pelepasan holoenzim dari DNA secara berulang-ulang. Kemungkinan yang masuk akal hanyalah melalui pergeseran holoenzim di sepanjang molekul DNA hingga mencapai urutan promoter. Pada promoter, holoenzim mengenali urutan -35 dan -10. Kompleks awal antara holoenzim dan promoter dikenal sebagai kompleks tertutup (closed complex).
Agar pita antisens dapat diakses untuk perpasangan basa antara DNA dan RNA yang disintesis, untai ganda (heliks) DNA harus dibuka terlebih dahulu oleh enzim RNA polimerase. Pada kebanyakan gen pembukaan heliks oleh RNA polimerase akan dimudahkan oleh struktur superkoiling negatif DNA sehingga transkripsi dapat ditingkatkan. Namun, tidak semua promoter dapat diaktivasi oleh superkoiling negatif sehingga terisyaratkan bahwa perbedaan topologi DNA dapat mempengaruhi transkripsi. Hal ini mungkin karena adanya perbedaan hubungan sterik pada urutan -35 dan -10 di dalam heliks. Sebagai contoh, promoter untuk subunit enzim DNA girase justru dihambat oleh superkoiling negatif. Seperti kita ketahui, DNA girase adalah enzim yang bertanggung jawab untuk superkoiling negatif pada genom E. coli
sehingga superkoiling negatif ini dapat bertindak sebagai umpan balik yang menghambat ekspresi DNA girase.
Pembukaan awal heliks DNA akan menyebabkan pembentukan kompleks terbuka (open complex) dengan RNA polimerase. Proses ini dikenal sebagai pengikatan ketat.
Inisiasi
Berbeda dengan sintesis DNA, sintesis RNA dapat berlangsung tanpa adanya molekul primer. Oleh karena hampir semua tapak inisiasi transkripsi berupa basa G atau A, maka nukleosida trifosfat pertama yang digunakan untuk sintesis RNA adalah GTP atau ATP.
Mula-mula RNA polimerase akan menggabungkan dua nukleotida pertama dan membentuk ikatan fosfodiester di antara kedua nukleotida tersebut. Selanjutnya, sembilan basa pertama ditambahkan tanpa disertai pergeseran RNA polimerase di sepanjang molekul DNA. Pada akhir penambahan masing-masing basa ini akan terdapat peluang yang nyata terjadinya aborsi untai RNA yang baru terbentuk itu. Proses inisiasi abortif mempengaruhi laju transkripsi secara keseluruhan karena proses tersebut memegang peranan utama dalam menentukan waktu yang dibutuhkan oleh RNA polimerase untuk meninggalkan promoter dan memungkinkan RNA polimerase lainnya menginisiasi putaran transkripsi berikutnya. Waktu minimum untuk pengosongan promoter ini adalah 1 hingga 2 detik, suatu waktu yang relatif lama bila dibandingkan dengan waktu untuk tahap-tahap transkripsi lainnya.
Elongasi
Jika inisiasi berhasil, RNA polimerase melepaskan faktor s, dan bersama-sama dengan DNA dan RNA nasen (RNA yang baru disintesis), akan membentuk kompleks terner atau kompleks yang terdiri atas tiga komponen. Dengan adanya kompleks terner ini RNA polimerase dapat berjalan di sepanjang molekul DNA. Artinya, promoter akan ditinggalkannya untuk kemudian ditempati oleh holoenzim RNA polimerase berikutnya sehingga terjadi reinisiasi transkripsi.
membentuk heliks hibrid dengan pita antisens DNA sepanjang lebih kurang 12 pb. Ukuran ini ternyata tidak mencapai satu putaran heliks.
RNA polimerase E. coli bergerak dengan kecepatan rata-rata 40 nukleotida per detik. Akan tetapi, angka ini dapat bervariasi sesuai dengan urutan lokal DNA (urutan DNA yang telah dicapai oleh RNA polimerase). Tetap dipertahankannya bagian DNA yang mengalami pembukaan heliks menunjukkan bahwa RNA polimerase membuka heliks DNA di depan gelembung transkripsi dan menutup heliks DNA di belakangnya. Dengan demikian, heliks hibrid RNA-DNA harus berputar setiap kali terjadi penambahan nukleotida pada RNA nasen.
Terminasi
RNA polimerase tetap terikat pada DNA dan melangsungkan transkripsi hingga mencapai
urutan terminator (sinyal stop), yang pada umumnya berupa struktur seperti tusuk konde
(hairpin). Struktur yang terdiri atas batang dan kala (loop) ini terjadi karena RNA hasil transkripsi mengalami komplementasi diri. Biasanya, bagian batang sangat kaya dengan GC sehingga sangat stabil (GC mempunyai ikatan rangkap tiga). Di sebelah downstream ’ dari
struktur tusuk kode sering kali terdapat urutan yang terdiri atas empat U atau lebih.
Nampaknya RNA polimerase akan segera berhenti begitu struktur tusuk konde RNA disintesis. Bagian ujung RNA yang mengandung banyak U tersebut mempunyai ikatan yang lemah dengan basa-basa A pada DNA cetakan sehingga molekul RNA hasil sintesis akan dengan mudah terlepas dari kompleks transkripsi. Selanjutnya, pita DNA cetakan yang sudah tidak berikatan atau membentuk hibrid dengan RNA segera menempel kembali pada pita DNA komplemennya. RNA polimerase inti pun akhirnya terlepas dari DNA.
Terminasi menggunakan protein rho
Telah disinggung di muka bahwa selain karena adanya struktur tusuk konde, terminasi transkripsi dapat juga terjadi dengan bantuan suatu protein khusus yang dinamakan protein rho ρ . Rho merupakan protein heksamer yang akan menghidrolisis ATP dengan adanya RNA untai tunggal. Protein ini nampak terikat pada urutan sepanjang 72 basa pada RNA, yang diduga lebih disebabkan oleh pengenalan suatu struktur spesifik daripada karena adanya urutan konsensus. Rho bergerak di sepanjang RNA nasen menuju kompleks transkripsi. Pada kompleks transkripsi ini rho memungkinkan RNA polimerase untuk berhenti pada sinyal terminator tertentu. Sinyal-sinyal terminator ini, seperti halnya sinyal terminator yang tidak bergantung kepada rho, lebih dikenali oleh RNA daripada oleh DNA cetakannya. Adakalanya terminator tersebut juga berupa struktur tusuk konde tetapi tidak dikuti oleh urutan poli U.
Mekanisme transkripsi pada eukariot pada dasarnya menyerupai mekanisme pada prokariot. Namun, begitu banyaknya polipeptida yang berkaitan dengan mesin transkripsi pada eukariot menjadikan mekanisme tersebut jauh lebih kompleks daripada mekanisme pada prokariot.
Ada tiga macam kompleks RNA polimerase, yang masing-masing diperlukan untuk transkripsi tipe-tipe gen eukariot yang berbeda. Perbedaan ketiga macam RNA polimerase tersebut dapat diketahui melalui pemurnian menggunakan teknik kromatografi dan elusi pada konsentrasi garam yang berbeda. Masing-masing RNA polimerase mempunyai sensitivitas yang berbeda terhadap toksin jamur α-amanitin, dan hal ini dapat digunakan untuk membedakan aktivitasnya satu sama lain.
RNA polimerase I (RNA Pol I) mentranskripsi sebagian besar gen rRNA. Enzim ini
terdapat di dala ukleoli da tidak se sitif terhadap α-amanitin.
RNA polimerase II (RNA Pol II) mentranskripsi semua gen penyandi protein dan beberapa gen RNA nuklear kecil (snRNA). Enzim ini terdapat di dalam nukleoplasma dan sangat sensitif terhadap α-amanitin.
RNA polimerase III (RNA Pol III) mentranskripsi gen-gen tRNA, 5S rRNA, U6 snRNA dan beberapa RNA kecil lainnya. Enzim ini terdapat di dalam nukleoplasma dan agak
se sitif terhadap α-amanitin.
Di samping enzim-enzim nuklear tersebut, sel eukariot juga mempunyai RNA polimerase lainnya di dalam mitokondria dan kloroplas.
Subunit-subunit RNA polimerase pada eukariot
Ketiga RNA polimerase pada eukariot merupakan enzim berukuran besar yang terdiri atas 12 subunit atau lebih. Gen-gen yang menyandi dua subunit terbesar mempunyai homologi satu sama lain. Sementara itu, ketiga RNA polimerase eukariot membawa subunit-subunit yang mempunyai homologi dengan subunit-subunit RNA polimerase inti pada E. coli α ββ’ . Su u it
ter esar RNA poli erase eukariot e yerupai su u it β’, seda gka su u it ter esar kedua e yerupai su u it β, ya g erupaka pusat katalitik RNA poli erase E.coli. Homologi struktur ini ternyata berkaitan dengan homologi fungsional karena subunit terbesar kedua pada RNA polimerase eukariot juga mengandung tapak aktif.
Dua subunit yang sama antara RNA Pol I dan RNA Pol III, serta satu subunit lainnya yang khas
pada RNA Pol II, e perlihatka ho ologi de ga su u it α RNA poli erase E. coli. Sekurang-kurangnya ada lima subunit lainnya yang lebih kecil, yang memperlihatkan kesamaan di antara ketiga RNA polimerase eukariot. Masing-masing RNA polimerase ini juga membawa empat hingga tujuh subunit tambahan yang hanya dijumpai pada salah satu di antara ketiganya.
Aktivitas RNA polimerase eukariot
Seperti halnya RNA polimerase bakteri, masing-masing RNA polimerase eukariot mengatalisis
cetakan. Reaksi tersebut memerlukan prekursor berupa ATP, GTP, CTP, UTP, dan tidak memerlukan primer untuk inisiasi transkripsi. Namun tidak seperti pada bakteri, RNA polimerase eukariot yang dimurnikan memerlukan adanya protein inisiasi tambahan sebelum enzim ini dapat berikatan dengan promoter dan melakukan inisiasi transkripsi.
Gen-gen yang ditranskripsi oleh RNA Pol I
RNA Pol I bertanggung jawab dalam sintesis rRNA secara terus-menerus selama interfase. Sel manusia mengandung lima rumpun (cluster) gen penyandi rRNA yang terdiri atas sekitar 40 salinan dan terletak pada kromosom-kromosom yang berbeda. Masing-masing gen rRNA menghasilkan transkrip 45S rRNA yang panjangnya lebih kurang 13.000 nukleotida (nt). Transkrip ini akan terbagi menjadi sebuah 28S (5.000 nt), 18S (2.000 nt), dan 5,8S (160 nt) rRNA. Transkripsi salinan gen-gen rRNA secara berkesinambungan diperlukan untuk mencukupi produksi rRNA yang selanjutnya akan dikemas ke dalam ribosom.
Masing-masing rumpun gen rRNA dikenal sebagai daerah pengatur nukleolar (nucleolar organizer region) karena nukleolus mengandung kala (loop) DNA berukuran besar yang sesuai dengan rumpun-rumpun gen tersebut. Setelah sebuah sel dihasilkan dari mitosis, sintesis rRNA akan dimulai kembali dan nukleoli yang kecil akan muncul pada lokasi kromosomal yang ditempati oleh gen-gen rRNA. Selama sintesis rRNA berlangsung aktif, transkrip pra-rRNA dikemas di sepanjang gen-gen rRNA dan jika divisualisasikan menggunakan mikroskop elektron
aka a pak se agai ’struktur poho atal’. Di dala struktur i i transkrip-transkrip RNA dikemas dengan rapat di sepanjang molekul DNA dan masing-masing muncul tegak lurus dari DNA. Transkrip yang pendek dapat dilihat pada bagian awal gen tersebut. Transkrip akan makin bertambah panjang pada bagian-bagian berikutnya untuk kemudian menghilang ketika mencapai ujung unit transkripsi.
Promoter-promoter gen pra-rRNA pada mamalia mempunyai suatu daerah kontrol transkripsi bipartit, yang terdiri atas elemen inti atau core element dan elemen kontrol hulu atau
upstream control element (UCE), yang secara skema dapat dilihat pada Gambar 5.5. Elemen inti meliputi tapak awal transkripsi dan terbentang dari posisi -31 hingga +6, yang merupakan urutan esensial untuk transkripsi. Sementara itu, UCE mempunyai panjang sekitar 50 hingga 80 pb yang dimulai dari posisi -100. UCE bertanggung jawab untuk peningkatan transkripsi sekitar 10 hingga 100 kali bila dibandingkan dengan laju transkripsi oleh elemen inti saja.
UCE akan berikatan dengan suatu protein spesifik pengikat DNA, yang disebut dengan faktor
pengikatan hulu atau upstream binding factor (UBF). Selain dengan UCE, UBF juga berikatan