UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOLIK BUAH CABAI RAWIT PUTIH (Capsicum frutescens L.) DENGAN METODE DPPH (1,1-difenil-2-pikrilhidrazil) DAN PENETAPAN KADAR KAPSAISIN SECARA KROMATOGRAFI LAPIS TIPIS (KLT) – DENSITOMETRI
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh :
Vanny Christy Silviani
NIM : 098114068
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOLIK BUAH CABAI RAWIT PUTIH (Capsicum frutescens L.) DENGAN METODE DPPH (1,1-difenil-2-pikrilhidrazil) DAN PENETAPAN KADAR KAPSAISIN SECARA KROMATOGRAFI LAPIS TIPIS (KLT) – DENSITOMETRI
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh :
Vanny Christy Silviani
NIM : 098114068
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
vii
PRAKATA
Puji syukur kepada Tuhan Yang Maha Esa atas rahmat, kasih, dan
penyertaanNya yang selalu dilimpahkan sehingga penulis dapat menyelesaikan
penelitian dan penyusunan skripsi berjudul “Uji Aktivitas Antioksidan Ekstrak
Etanolik Buah Cabai Rawit Putih (Capsicum Frutescens L.) Dengan Metode
DPPH (1,1-Difenil-2-Pikrilhidrazil) dan Penetapan Kadar Kapsaisin secara
Kromatografi Lapis Tipis (KLT) – Densitometri”. Skripsi ini dibuat sebagai syarat
memperoleh gelar Sarjana Farmasi (S.Farm).
Penulis menyadari bahwa dalam penyelesaian skripsi tidak lepas dari
bantuan, dukungan, bimbingan, kritikan, dan saran dari berbagai pihak. Oleh
karena itu, penulis mengucapkan terima kasih kepada :
1. Ipang Djunarko, M.Sc., Apt. selaku Dekan Fakultas Farmasi Universitas
Sanata Dharma Yogyakarta.
2. Prof. Dr. C. J. Soegihardjo, Apt. selaku Dosen Pemimbing yang telah
memberikan bimbingan, saran, kritikan, dan motivasi kepada penulis selama
penelitian hingga penyelesaian skipsi.
3. Yohanes Dwiatmaka, M.Si., selaku Dosen Penguji yang memberikan arahan,
kritik, dan saran untuk skripsi ini.
4. Lucia Wiwid Wijayanti, M.Si., selaku Dosen Penguji yang memberikan
viii
5. Agustina Setiawati, M.Sc., Apt. selaku Dosen Pembimbing Akademik yang
telah memberikan nasihat dan dukungan selama penulis menyelesaikan masa
studi di Fakultas Farmasi Universitas Sanata Dharma.
6. Rini Dwiastuti, M.Sc., Apt. selaku Kepala Laboratorium Fakultas Farmasi
Universitas Sanata Dharma.
7. Seluruh staff laboratorium, terutama Mas Bimo, Mas Wagiran, Pak Parlan,
Mas Kayat atas segala bantuan yang diberikan selama penelitian skripsi.
8. Mama terkasih yang selalu mendukung penulis dengan doa, semangat, dan
cinta sehingga penulis dapat menyelesaikan pendidikan.
9. Yenny dan Christina, teman seperjuangan dalam penelitian skripsi. Terima
kasih untuk semua dukungan, kerjasama, diskusi, persahabatan, canda, dan
doa dari kalian berdua.
10.Pdt. Drs. Samuel J. Suwondo dan keluarga yang selalu memberi dukungan
kepada penulis selama menempuh pendidikan.
11.Hanna Silviani yang membantu penulis dalam menyempurnakan naskah
skripsi serta selalu mendukung penulis.
12.Teman-temanku tersayang, Adel, Rizza, Evy, Yani, Prita yang selalu
memberikan motivasi, dukungan, kerjasama, keceriaan, dan pengalaman
berharga yang tak terlupakan.
13.Sahabat-sahabat terbaikku, Amanda, Yuni, Mimi, Horior community yang
ix
14.Teman-teman FST 2009, kelas B 2009, kelompok praktikum B 2009 atas
kebersamaannya yang mengisi canda dan tawa serta motivasi selama
perkuliahan.
15.Semua pihak yang tidak dapat disebutkan satu per satu yang telah membantu
dan mendukung dari awal penelitian hingga penyelesaian skripsi.
Penulis menyadari masih banyak kekurangan dalam penulisan skripsi ini
sehingga dengan penuh kerendahan hati penulis menerima setiap kritikan dan
saran yang dapat membangun sehingga dapat memperbaiki skripsi ini. Akhir kata,
penulis berharap agar skripsi ini dapat bermanfaat bagi pembaca dan
meningkatkan pengetahuan mengenai farmasi, terutama dalam bidang bahan
alami.
Yogyakarta, 17 Januari 2013
x
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN PENULIS ... v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ... vi
xi
F. Ekstraksi ... 15
G. Spektrofotometri Visibel ... 17
H. Kromatografi Lapis Tipis ... 18
I. Densitometri ... 20
J. Validasi Metode Analisis ... 20
K. Landasan Teori ... 24
L. Hipotesis ... 25
BAB III METODOLOGI PENELITIAN... 26
A. Jenis dan Rancangan Penelitian ... 26
B. Variabel ... 26
1. Variabel bebas ... 26
2. Variabel tergantung ... 26
3. Variabel pengacau terkendali ... 26
4. Variabel pengacau tak terkendali ... 26
C. Definisi Operasional ... 27
3. Pembuatan ekstrak buah cabai rawit putih... 29
4. Penentuan aktivitas antioksidan dengan metode DPPH ... 29
a. Pembuatan larutan DPPH ... 29
b. Pembuatan larutan stok kapsaisin ... 29
c. Pembuatan larutan seri baku kapsaisin ... 29
d. Pembuatan larutan uji ... 30
e. Uji pendahuluan aktivitas antioksidan ... 30
f. Penentuan panjang gelombang maksimum ... 30
g. Penentuan operating time (OT) ... 30
xii
i. Validasi metode uji aktivitas antioksidan ... 31
j. Estimasi aktivitas antioksidan ... 32
5. Penentuan kadar kapsaisin ... 32
a. Pembuatan fase gerak ... 32
b. Pembuatan larutan stok kapsaisin ... 32
c. Pembuatan larutan seri baku kapsaisin ... 32
d. Pembuatan larutan uji ... 32
e. Penentuan kadar kapsaisin buah cabai rawit putih ... 33
F. Analisis Hasil ... 33
E. Hasil Optimasi Metode Uji Aktivitas Antioksidan ... 42
1. Penentuan panjang gelombang maksimum ... 42
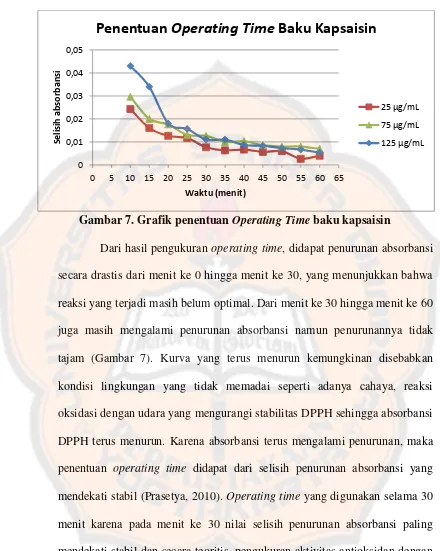
2. Penentuan operating time (OT) ... 44
F. Hasil Validasi Metode Uji Aktivitas Antioksidan ... 46
1. Spesifisitas metode uji aktivitas antioksidan ... 47
2. Akurasi metode uji aktivitas antioksidan ... 48
3. Presisi metode uji aktivitas antioksidan ... 49
4. Linearitas metode uji aktivitas antioksidan... 50
G. Hasil Estimasi Aktivitas Antioksidan dengan Radikal DPPH ... 51
H. Hasil Penetapan Kadar Kapsaisin ... 58
I. Analisis Statistik Aktivitas Antioksidan ... 64
xiii
DAFTAR TABEL
Tabel I. Kriteria akurasi yang masih dapat diterima menurut
Harmita (2004) ... 22
Tabel II. Kriteria presisi yang masih dapat diterima menurut Harmita (2004) ... 23
Tabel III. Hasil pengukuran panjang gelombang maksimum DPPH ... 43
Tabel IV. Hasil pengukuran absorbansi seri kurva baku kapsaisin yang direaksikan dengan DPPH ... 46
Tabel V. Nilai perolehan kembali (% recovery) uji aktivitas antioksidan pada baku kapsaisin ... 48
Tabel VI. Nilai CV uji aktivitas antioksidan pada baku kapsaisin ... 49
Tabel VII. Hasil aktivitas antioksidan ekstrak etanol buah cabai rawit putih ... 54
Tabel VIII. Hasil perhitungan IC50 baku kapsaisin dan ekstrak etanol buah cabai rawit putih ... 57
Tabel IX. Tingkat kekuatan aktivitas antioksidan ... 58
Tabel X. Data nilai Rf baku kapsaisin dan sampel ... 61
xiv
DAFTAR GAMBAR
Gambar 1. Struktur senyawa kapsaisin (Henderson And Slickman,
1999) ... 10 Gambar 2. Reaksi penangkapan radikal DPPH oleh antioksidan
(Prakash, Rigelhof, Miller, 2001) ... 15 Gambar 3. Penyarian dengan alat Soxhlet (Cornell University, 2011) .... 17 Gambar 4. Morfologi berbagai spesies Capsicum (Bosland, Bailey,
Iglesias-Olivas, 1996) ... 35 Gambar 5. Hasil uji pendahuluan ekstrak etanol buah cabai rawit
putih, kontrol negatif (DPPH), dan kontrol positif
(kapsaisin)... 42 Gambar 6. Gugus kromofor dan gugus auksokrom DPPH
(Witt, Lalk, Hager, dan Voigt, 2010) ... 43 Gambar 7. Grafik penentuan Operating Time baku kapsaisin ... 45
Gambar 8. Struktur senyawa kapsaisin ... 52 Gambar 9. Mekanisme penghambatan radikal bebas oleh senyawa
kapsaisin ... 53 Gambar 10. Kurva persamaan regresi linier aktivitas antioksidan
ekstrak etanol buah cabai rawit putih replikasi I ... 55 Gambar 11. Kurva persamaan regresi linier aktivitas antioksidan
ekstrak etanol buah cabai rawit putih replikasi II ... 55 Gambar 12. Kurva persamaan regresi linier aktivitas antioksidan
ekstrak etanol buah cabai rawit putih replikasi III ... 56 Gambar 13. Interaksi kapsaisin dengan fase diam silika gel 60 F254 ... 60
Gambar 14. Interaksi kapsaisin dengan fase gerak
xv
DAFTAR LAMPIRAN
Lampiran 1. Gambar buah cabai rawit putih dari Pasar Beringharjo,
Yogyakarta ... 71 Lampiran 2. Sertifikat analisis kapsaisin ... 72 Lampiran 3. Perhitungan rendemen ekstrak etanol buah cabai rawit
putih ... 73 Lampiran 4. Data penimbangan bahan untuk uji aktivitas antioksidan ... 74 Lampiran 5. Data perhitungan konsentrasi bahan untuk uji aktivitas
antioksidan ... 75 Lampiran 6. Scanning larutan pengoreksi untuk uji aktivitas
antioksidan ... 80 Lampiran 7. Optimasi metode uji aktivitas antioksidan ... 82 Lampiran 8. Data uji aktivitas antioksidan menggunakan radikal
DPPH ... 86 Lampiran 9. Perhitungan nilai IC50 baku kapsaisin dan ekstrak etanol
buah cabai rawit putih ... 89 Lampiran 10. Sistem KLT densitometri yang digunakan ... 91 Lampiran 11. Data perhitungan konsentrasi bahan untuk penetapan kadar
kapsaisin ... 92 Lampiran 12. Kromatogram baku kapsaisin ... 94 Lampiran 13. Data persamaan kurva baku kapsaisin ... 95 Lampiran 14. Kromatogram kapsaisin dalam ekstrak etanol buah cabai
rawit putih ... 96 Lampiran 15. Data dan perhitungan kadar kapsaisin dalam ekstrak
etanol buah cabai rawit putih ... 97 Lampiran 16. Uji statistik dengan SPSS 16.0 ... 98
xvi
INTISARI
Cabai rawit putih (Capsicum frutescens L.) merupakan buah yang sering
digunakan baik sebagai bahan pangan dan pengobatan. Kandungan utama dalam buah cabai rawit putih adalah kapsaisin yang memiliki gugus fenolik sehingga memiliki aktivitas antioksidan. Antioksidan dapat menangkap radikal bebas sehingga mengurangi resiko terjadinya penyakit kronis. Penelitian ini bertujuan untuk menetapkan aktivitas antioksidan yang terdapat pada ekstrak etanol buah cabai rawit putih dan menetapkan kadar kapsaisin dalam buah cabai rawit putih.
Penentuan aktivitas antioksidan dilakukan dengan metode DPPH (1,1-difenil-2-pikrilhidrazil). Prinsip metode DPPH adalah penangkapan DPPH yang merupakan radikal bebas oleh senyawa antioksidan sehingga intensitas absorbansi DPPH berkurang. Pengukuran absorbansi dilakukan dengan spektrofotometer visibel pada panjang gelombang 517,5 nm. Penetapan kadar kapsaisin menggunakan metode KLT – densitometri dengan fase diam silika gel 60 F254 dan
fase gerak toluena-kloroform-aseton (45:25:30, v/v/v).
Penurunan intensitas berkorelasi dengan kadar antioksidan. Hasil penelitian menunjukkan aktivitas antioksidan ekstrak etanol cabai rawit putih yang dinyatakan sebagai IC50 sebesar (90,02±10,16) µg/mL. Hasil analisis
kuantitatif kadar kapsaisin ekstrak etanol buah cabai rawit putih sebesar (0,1099±0,0001)% (b/b) dengan catatan metode yang digunakan belum tervalidasi.
Kata kunci : Buah cabai rawit putih (Capsicum frutescens L.), kapsaisin, radikal
xvii
ABSTRACT
White chili pepper (Capsicum frutescens L.) is a fruit that often used as
food and medicine. White chili pepper contains capsaicin which has phenolic group that has antioxidant activity. Antioxidant can scavenge free radical thereby reducing the risk of chronic diseases. This experiment aimed to determine antioxidant activity and the contents of capsaicin in ethanol extract of chili pepper fruit.
The antioxidant activity was tested by DPPH (1,1-diphenyl-2-picrylhydrazyl) method. The principle of DPPH method was scavenging DPPH as free radical by antioxidant compounds which could reduce intencity of DPPH absorbance. Absorbance was measured by visible spectrophotometer in maximum wave lenght (517,5 nm). Level of capsaicin was assayed by TLC –
densitometry and used silica gel 60 F254 as stationary phase and
toluene-chloroform-acetone (45:25:30, v/v/v) as mobile phase.
The intencity decrement is correlated with antioxidant concentration. The result of examination showed that antioxidant activity in ethanol extract of chili pepper fruit as IC50 is (90,02±10,16) µg/mL. Level of capcaicin in ethanol extract
of white variety of chili pepper fruit is (0,1099±0,0001)% (w/w) but the TLC –
densitometry method has not been validated yet.
Keywords : White chili pepper (Capsicum frutescens L.), capsaicin, free radical,
1
BAB I PENGANTAR
A. Latar Belakang
Penelitian di bidang kesehatan mengenai antioksidan semakin banyak
dilakukan untuk mencegah timbulnya penyakit yang disebabkan oleh senyawa
radikal bebas. Radikal bebas, seperti reactive oxygen species (ROS) bersifat
sangat reaktif dan dapat mengoksidasi substansi-substansi dalam tubuh sehingga
dapat menyebabkan terjadinya berbagai penyakit seperti jantung, kanker, penuaan
dini, dan penyakit degerenatif lain (Parke, 1999; Prakash, Rigelhof, dan Miller,
2001). Untuk mengatasi radikal bebas tersebut, maka diperlukan suatu senyawa
antioksidan yang dapat menangkap radikal bebas sehingga menghambat
terbentuknya penyakit yang merugikan.
Radikal bebas merupakan atom atau molekul yang hanya memiliki satu
atau lebih elektron yang tidak berpasangan sehingga bersifat sangat tidak stabil
(Fessenden dan Fessenden, 1982). Radikal bebas dapat terbentuk oleh senyawa
endogen yang dihasilkan oleh tubuh maupun senyawa eksogen. Radikal bebas
yang berasal dari senyawa endogen terbentuk dari proses metabolisme namun
hanya bersifat sementara karena akan diubah menjadi senyawa yang tidak
berbahaya. Sedangkan radikal yang terbentuk dari senyawa eksogen dapat berasal
dari radiasi sinar UV, xenobiotik, polutan (Sapakal, Shikalgar, Ghadge, Adnaik,
Naikwade, and Magdum, 2008). Saat terbentuk radikal yang berlebihan, maka
memiliki satu elektron dan bersifat sangat reaktif untuk mengambil elektron dari
senyawa lain. Reaksi radikal dapat menyebabkan terjadinya reaksi berantai
(Simex, 2008). Radikal bebas dapat mengoksidasi lipid, protein, DNA, dan asam
nukleat tak jenuh dalam tubuh untuk mencapai kestabilan elektron sehingga
menyebabkan terjadinya penyakit degeneratif (Prakash, Rigelhof, dan Miller,
2001). Oleh karena berbahayanya radikal bebas bagi tubuh, maka perlu dilakukan
penelitian mengenai senyawa antioksidan yang dapat menangkal kerja radikal
bebas.
Antioksidan adalah senyawa kimia menghambat reaksi oksidasi dengan
menyumbangkan satu elektronnya kepada senyawa radikal. Bukti penelitian
menunjukkan bahwa antioksidan dapat mengurangi resiko penyakit kronis, seperti
kanker dan jantung (Prakash, Rigelhof, dan Miller, 2001). Antioksidan merupakan
senyawa yang mampu menstabilkan, mendeaktivasi, atau memakan radikal bebas
sebelum menyerang sel dalam tubuh. Antioksidan dapat memelihara sel dan
menjaga kesehatan sehingga menghindari terjadinya penyakit-penyakit
degeneratif yang dapat menyerang sistem kesehatan. Kerja antioksidan adalah
mengurangi kapasitas radikal bebas, menghambat peroksidasi lipid, mengurangi
jumlah logam berat dengan cara khelating (Sapakal, Shikalgar, Ghadge, Adnaik,
Naikwade, and Magdum, 2008). Antioksidan dapat berasal dari senyawa alam
maupun secara sintetik. Saat ini masyarakat lebih memilih penggunaan
bahan-bahan yang alami karena resiko yang didapat lebih kecil dibandingkan dengan
senyawa-senyawa sintetik. Dengan demikian, banyak peneliti yang mempelajari
Cabai rawit (Capsicum frutescens L.) merupakan salah satu buah yang
sering digunakan masyarakat di Indonesia sebagai bahan pangan. Cabai rawit
memiliki manfaat sebagai obat sariawan, tonik, stimulan kuat untuk jantung dan
aliran darah, antirematik, antikoagulan, stomakik, karminatif, diaforetik, dan
diuretik (Sentra Informasi Ilmu Pengetahuan dan Teknologi, 2005). Menurut
Sentra Informasi Ilmu Pengetahuan dan Teknologi (2005), buah cabai rawit
memiliki tiga macam varietas, yaitu cabai rawit merah (cabai kecil), cabai rawit
putih (cabai domba), dan cabai rawit hijau (ceplik).
Di dalam buah cabai rawit terkandung berbagai macam senyawa seperti
kapsaisin, kapsantin, karotenoid, alkaloid atsiri, resin, flavonoid, minyak atsiri,
provitamin A, vitamin B1 dan vitamin C (Sentra Informasi Ilmu Pengetahuan dan
Teknologi, 2005; Howard, Talcott, Brenes, dan Villalon, 2000). Salah satu
kandungan tertinggi dalam buah cabai rawit adalah kapsaisin. Kapsaisin
merupakan senyawa yang bertanggung jawab dalam menghasilkan rasa pedas.
Kapsaisin memiliki aktvitas dalam menghambat pertumbuhan sel kanker.
Menurut Henderson dan Slickman (1999), kapsaisin memiliki aktivitas
antioksidan dengan menangkap radikal bebas. Gugus fenol pada kapsaisin yang
bertanggung jawab atas aktivitas antioksidan. Selain itu, bentuk isomer cis – trans
kapsaisin juga memiliki peran dalam menangkap radikal bebas. Karena itu, perlu
diteliti mengenai kegunaan kapsaisin sebagai antioksidan dalam buah cabai rawit
putih sehingga dapat dikembangkan sebagai salah satu free radical scavenger
Ekstraksi yang digunakan pada buah cabai rawit ini menggunakan larutan
etanol. Alasan pemilihan ekstraksi didasari pada sifat fisika kimia dari senyawa
yang akan diuji, yaitu kapsaisin yang bersifat non polar. Dengan demikian
digunakan etanol agar kapsaisin dapat terekstraksi. Pada beberapa penelitian yang
telah dilakukan, ekstraksi kapsaisin terbukti paling efektif dan menghasilkan
rendemen yang tinggi menggunakan penyarian dengan alat Soxhlet (Boonkird,
Phisalaphong, Phisalaphong, 2008; Gonzáles and Al-Tamirano, 1973) sehingga
digunakan alat Soxhlet untuk mengekstraksi buah cabai rawit putih.
Metode yang digunakan untuk uji aktivitas antioksidan buah cabai rawit
putih ini adalah metode DPPH. Metode DPPH adalah metode yang mengukur
kemampuan antioksidan dalam menghambat radikal bebas DPPH. Metode ini
digunakan untuk pengujian senyawa antioksidan yang memiliki mekanisme
dengan mendonorkan hidrogen atau mendonorkan elektron pada senyawa radikal
sehingga reaksi radikal terhenti (Prakash, Rigelhof, dan Miller, 2001). Tujuan
pengujian dengan metode DPPH adalah untuk mengetahui konsentrasi dari
senyawa antioksidan yang ekuivalen dapat memberikan 50% efek antioksidan dan
dinyatakan sebagai Inhibition Concentration 50 (IC50).
DPPH memberikan serapan yang kuat pada panjang gelombang 517 nm
karena merupakan senyawa radikal yang memiliki elektron tidak berpasangan.
Saat elektron berpasangan dengan senyawa antioksidan, maka intensitas DPPH
yang diserap akan berkurang sehingga absorbansinya turun. Keberadaan
antioksidan dapat mengubah warna DPPH yang semula ungu menjadi kuning.
karena metode ini mudah digunakan, cepat, dan menghasilkan hasil yang
reprodusibel (Dehpour, Ebrahimzadeh, Fazel, dan Mohammad, 2009).
Pada penelitian ini juga dilakukan uji kandungan kapsaisin karena
kapsaisin merupakan senyawa dalam buah cabai rawit yang memiliki aktivitas
antioksidan. Penentuan kadar kapsaisin dilakukan dengan metode kromatografi
lapis tipis (KLT) – densitometri. Penentuan kadar kapsaisin dilakukan untuk
menentukkan jumlah kapsaisin yang terdapat dalam sampel.
1. Permasalahan
a. Berapa nilai aktivitas antioksidan buah cabai rawit putih yang dinyatakan
dengan IC50 menggunakan metode DPPH?
b. Berapa kadar kapsaisin buah cabai rawit putih dengan metode
kromatografi lapis tipis – densitometri?
2. Keaslian penelitian
Penelitian mengenai uji aktivitas antioksidan pada cabai pernah
dilakukan oleh Bachtiar (2009). Penelitian yang dilakukan adalah mengamati
pengaruh suhu dan lama penyimpanan dingin terhadap kandungan vitamin C
dan aktivitas antioksidan pada cabai merah (Capsicum annum L.) dengan
menggunakan metode DPPH. Howard, Talcott, Brenes, dan Villalon (2000)
melakukan penelitian mengenai aktivitas antioksidan pada berbagai spesies
Amarowicz, Shahidi (2011) meneliti aktivitas antioksidan pada buah Jalapeno
dan Serrano Peppers menggunakan metode DPPH.
Perbedaan penelitian ini dengan penelitian yang telah dilakukan
adalah pada penelitian ini menguji aktivitas antioksidan buah cabai rawit
putih (Capsicum frutescens L.) dengan menggunakan DPPH dan menetapkan
kadar kapsaisin dengan metode kromatografi lapis tipis (KLT) – densitometri.
Sejauh penelusuran peneliti, penelitian ini belum pernah dilakukan.
3. Manfaat penelitian
a. Manfaat teoritis. Penelitian ini diharapkan dapat memberikan
perkembangan ilmu pengetahuan dalam bidang farmasi mengenai
aktivitas antioksidan buah cabai rawit putih pada radikal bebas DPPH
yang dinyatakan sebagai IC50.
b. Manfaat praktis. Penelitian ini diharapkan dapat memberikan informasi
mengenai potensi buah cabai rawit putih sebagai antioksidan alami yang
dapat dikembangkan sebagai sediaan farmasi untuk mencegah senyawa
B. Tujuan 1. Tujuan umum
Menguji aktivitas antioksidan buah cabai rawit putih dengan menggunakan
metode DPPH.
2. Tujuan khusus
a. Mengetahui nilai aktivitas antioksidan buah cabai rawit putih yang
dinyatakan sebagai IC50 dengan menggunakan metode DPPH.
b. Menetapkan kadar kapsaisin buah cabai rawit putih dengan metode
8
BAB II
PENELAAHAN PUSTAKA
A. Cabai Rawit Putih 1. Klasifikasi tanaman
Klasifikasi tanaman cabai rawit putih dalam sistematika tumbuhan
menurut Plantamor (2008) adalah sebagai berikut.
Kingdom : Plantae (Tumbuhan)
Subkingdom : Tracheobionta (Tumbuhan berpembuluh)
Super Divisi : Spermatophyta (Tumbuhan berbiji)
Divisi : Magnoliophyta (Tumbuhan berbunga)
Kelas : Magnoliopsida (Tumbuhan berkeping biji dua)
Sub Kelas : Asteridae
Ordo : Solanales
Famili : Solanaceae (Suku terung-terungan)
Genus : Capsicum
Spesies : Capsicum frutescens L.
2. Morfologi tanaman
Tumbuhan cabai rawit putih berasal dari Amerika tropik, tumbuh di
daerah kering. Perdu setahun, percabangan banyak, tinggi 50-100 cm.
Batangnya berbuku-buku atau bagian atas bersudut. Daun tunggal,
pangkal menyempit, tepi rata, pertulangan menyirip, panjang 5-9,5 cm, lebar
1,5-5,5 cm, berwarna hijau. Bunga keluar dari ketiak daun, mahkota bentuk
bintang, bunga tunggal atau 2-3 bunga letaknya berdekatan, berwarna putih,
putih kehijauan, kadang-kadang ungu. Buahnya berupa buah buni, tegak,
kadang-kadang merunduk, berbentuk bulat telur, lurus atau bengkok, ujung
meruncing, panjang 1-3 cm, lebar 2,5-12 mm, bertangkai panjang, dan
rasanya pedas. Buah muda berwarna hijau tua, putih kehijauan, atau putih,
buah yang masak berwarna merah terang (Sentra Informasi Ilmu Pengetahuan
dan Teknologi, 2005).
3. Kandungan kimia
Buah cabai rawit putih mengandung kapsaisin, kapsantin,
karotenoid, alkaloid atsiri, resin, minyak menguap, vitamin (A dan C), dan
flavonoid. Kapsaisin memberikan rasa pedas pada cabai, berkhasiat untuk
melancarkan aliran darah serta pemati rasa kulit. Biji mengandung alkaloid,
antara lain solanina, solamidina, solamargina, solasodina, solasomina, dan
steroid saponin (kapsisidin) (Sentra Informasi Ilmu Pengetahuan dan
Teknologi, 2005; Howard, Talcott, Brenes, dan Villalon, 2000).
4. Kegunaan buah cabai rawit putih
Cabai rawit memiliki manfaat sebagai obat sariawan, tonik, stimulan
karminatif, diaforetik, dan diuretik (Sentra Informasi Ilmu Pengetahuan dan
Teknologi, 2005).
B. Kapsaisin
Kapsaisin adalah senyawa yang menimbukan rasa pedas. Kapsaisin
(trans-8-methyl-N-vanillyl-6-nonenamide), senyawa alkaloid berbentuk kristal,
lipofilik, tidak berwarna, dan tidak berbau memiliki formula C18H27NO3.
Kapsaisin memiliki kelarutan di dalam lemak, minyak, dan alkohol (Escogido,
Mondragon, Tzompantzi, 2011).
Kapsaisin disintesis secara alami dari plasenta buah cabai dari kondensasi
enzimatik vanililamina dan rantai asam lemak yang diperpanjang oleh enzim fatty
acid synthase. Penelitian menunjukkan bahwa kapsaisinoid, khususnya kapsaisin
memiliki aktivitas biologi dan fisiologi yang bervariasi seperti antioksidan,
antikarsinogenik, metabolisme energi dan pengurangan akumulasi lemak, serta
antiinflamasi (Escogido, Mondragon, Tzompantzi, 2011).
Substituen pada posisi 3 dan 4 dari cincin aromatis fenolik khususnya
gugus 4-OH fenolik memiliki kemampuan aktivitas agonis. Sifat donor-akseptor
ikatan hidrogen pada gugus fenol merupakan kunci aktivitas agonis (Escogido,
Mondragon, Tzompantzi, 2011).
Kapsaisin memiliki aktivitas antioksidan dengan menangkap radikal
bebas. Gugus fenol pada kapsaisin yang bertanggung jawab atas aktivitas
antioksidan dalam mendonorkan elektron kepada radikal bebas (Henderson and
Slickman, 1999).
C. Radikal Bebas
Untuk hidup, kita memerlukan oksigen, namun oksigen juga merupakan
sumber radikal bebas. Radikal bebas tersebut beberapa di antaranya toksik
(beracun) dan sangat reaktif dapat mempercepat proses penuaan dan kematian
(Kochar and Rossell, 1990).
Radikal bebas merupakan atom atau gugus atom yang memiliki satu
elektron tidak berpasangan. Radikal bebas bersifat sangat reaktif dan berenergi
tinggi karena adanya elektron tidak berpasangan (Fessenden dan Fessenden,
1982).
Awal terjadinya radikal bebas antara lain dari proses reduksi molekul
oksigen dalam rangkaian transport dalam mitokondria atau dalam proses-proses
lain yang terjadi secara acak dari berbagai proses kimiawi dalam tubuh yang
melibatkan senyawa organik maupun inorganik. Radikal bebas yang berupa
peroksil anion ini akan bereaksi dengan dua proton (2H+) membentuk hidrogen
peroksida (H2O2) (Pratt, 1992).
Hidrogen peroksida dapat pula terbentuk dari air (H2O) yang terkena
radiasi (sinar ß maupun γ) dan karena proses-proses lain. Dengan keberadaan zat
besi (Fe2+) hidrogen peroksida tersebut mengalami serangkaian reaksi sehingga
terbentuk ini mempunyai masa paruh yang sangat pendek, tetapi tetap mempunyai
potensi besar yang dapat merusak sel. Radikal hidroksil, yang diduga dalam
kehidupan kita banyak terbentuk dianggap lebih berbahaya dibanding bentuk
radikal bebas yang lain (Pratt, 1992).
D. Antioksidan
Antioksidan didefinisikan sebagai senyawa yang dapat menunda,
memperlambat, dan mencegah proses oksidasi lipid. Dalam arti khusus,
antioksidan adalah zat yang dapat menunda atau mencegah terjadinya reaksi
antioksidasi radikal bebas dalam oksidasi lipid (Kochar and Rossell, 1990).
Antioksidan sangat beragam jenisnya. Berdasarkan sumbernya
antioksidan dibagi dalam dua kelompok yaitu antioksidan sintetik (antioksidan
yang diperoleh dari hasil sintetis reaksi kimia) dan antioksidan alami (antioksidan
hasil ekstraksi bahan alami). Antioksidan alami di dalam makanan dapat berasal
dari senyawa antioksidan yang sudah ada dari satu atau dua komponen makanan,
senyawa antioksidan yang terbentuk dari reaksi-reaksi selama proses pengolahan,
senyawa antioksidan yang diisolasi dari sumber alami dan ditambahkan ke
makanan sebagai bahan tambahan pangan (Pratt, 1992).
Berdasarkan mekanisme kerjanya, antioksidan diklasifikasikan menjadi
dua kategori, yaitu antioksidan pencegah dan antioksidan pemutus rantai.
Antioksidan pencegah bekerja dengan menghambat pembentukan reactive oxygen
species, seperti enzim katalase, peroksidase, superoksida dismutase, dan
radikal oksigen kemudian memutus rangkaian rantai reaksi radikal, contohnya
vitamin C, vitamin E, asam urat, bilirubin, polifenol, dan sebagainya. Antioksidan
pemutus rantai memiliki dua jalur reaksi. Jalur pertama merupakan jalur transfer
atom hidrogen dengan mekanisme radikal oksigen menangkap hidrogen dari
antioksidan sehingga terbentuk kompleks antioksidan-radikal yang bersifat stabil.
Jalur kedua, antioksidan mendeaktivasi radikal bebas dengan transfer elektron
tunggal. Transfer elektron tunggal sangat dipengaruhi oleh kestabilan pelarut pada
muatan tertentu (Ou, Huang, Woodill, Flanagan, and Deemer, 2002).
E. Metode DPPH
Metode yang paling sering digunakan untuk menguji aktivitas
antioksidan tanaman obat adalah metode uji dengan menggunakan radikal bebas
DPPH (1,1-difenil-2-pikrilhidrazil). Tujuan metode ini adalah mengetahui
parameter konsentrasi yang ekuivalen memberikan 50% efek aktivitas antioksidan
(IC50). Hal ini dapat dicapai dengan cara menginterpretasikan data eksperimental
dari metode tersebut. DPPH merupakan radikal bebas yang dapat bereaksi dengan
senyawa yang dapat mendonorkan atom hidrogen, dapat berguna untuk pengujian
aktivitas antioksidan komponen tertentu dalam suatu ekstrak (Dehpour,
Ebrahimzadeh, Fazel, dan Mohammad, 2009).
Karena adanya elektron yang tidak berpasangan, DPPH memberikan
serapan kuat pada 517 nm. Ketika elektronnya menjadi berpasangan oleh
keberadaan penangkap radikal bebas, maka absorbansinya menurun secara
antioksidan dapat mengubah warna larutan DPPH dari ungu menjadi kuning.
Perubahan absorbansi akibat reaksi ini telah digunakan secara luas untuk menguji
kemampuan beberapa molekul sebagai penangkap radikal bebas (Dehpour,
Ebrahimzadeh, Fazel, dan Mohammad, 2009).
Metode DPPH merupakan metode yang cepat, sederhana, dan tidak
membutuhkan biaya tinggi dalam menentukan kemampuan antioksidan
menggunakan radikal bebas 2,2-difenil-1-pikrilhidrazil (DPPH). DPPH sering
digunakan untuk menguji senyawa yang berperan sebagai free radical scavengers
atau donor hidrogen dan mengevaluasi aktivitas antioksidannya, serta
mengkuantifikasi jumlah kompleks radikal-antioksidan yang terbentuk. Metode
DPPH dapat digunakan untuk sampel yang berupa padatan maupun cairan
(Prakash, Rigelhof, Miller, 2001).
Elektron tunggal pada radikal bebas DPPH memberikan absorbansi
maksimum pada panjang gelombang 517 nm sehingga menimbulkan warna ungu.
Warna DPPH akan berubah dari ungu menjadi kuning seiring penambahan
antioksidan yaitu saat elektron tunggal pada DPPH berpasangan dengan hidrogen
dari antioksidan. Hasil dekolorisasi oleh antioksidan setara dengan jumlah
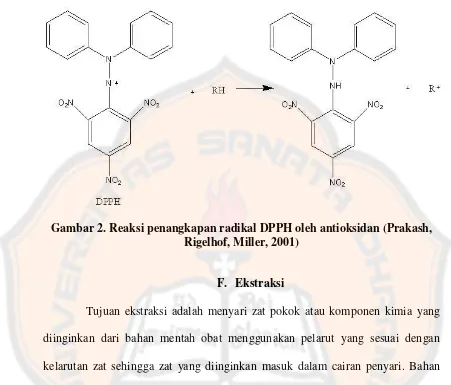
elektron yang tertangkap. Mekanisme penangkapan radikal ditunjukkan pada
Gambar 2. Reaksi penangkapan radikal DPPH oleh antioksidan (Prakash, Rigelhof, Miller, 2001)
F. Ekstraksi
Tujuan ekstraksi adalah menyari zat pokok atau komponen kimia yang
diinginkan dari bahan mentah obat menggunakan pelarut yang sesuai dengan
kelarutan zat sehingga zat yang diinginkan masuk dalam cairan penyari. Bahan
mentah yang berasal dari tumbuh-tumbuhan ataupun hewan tidak perlu diproses
lebih lanjut kecuali dikumpulkan atau dikeringkan. Tiap-tiap bahan mentah obat
disebut ekstrak, tidak mengandung hanya satu unsur saja tetapi berbagai unsur,
tergantung pada obat yang digunakan dan kondisi dari ekstraksi (Fouad, 2005).
Semakin banyak permukaan simplisia yang bersentuhan dengan penyari maka
proses ekstraksi bertambah baik ( Harborne, 1987).
Pada proses ekstraksi, pelarut yang digunakan untuk ekstraksi harus
dapat mendesak masuk ke dalam sel yang masih utuh sehingga dibutuhkan pelarut
yang dapat membuka lintasan untuk memungkinkan pelarut masuk ke bagian
molekul bahan pelarut. Kemampuan pelarut untuk mengikat zat perancah selulose
menyebabkan struktur perancah tersebut menjadi longgar, sehingga terbentuk
ruang antarmiselar, yang memungkinkan pelarut mencapai ke dalam ruang dalam
sel.Masuknya pelarut dalam intrasel menyebabkan protoplasma membengkak dan
zat yang terkandung dalam sel akan terlarut sesuai dengan kelarutannya.
Perbedaan konsentrasi larutan di dalam sel dengan cairan pengekstraksi yang baru
(tidak mengandung zat aktif) akan menyebabkan terjadinya proses difusi melalui
ruang antarmiselar. Zat di dalam sel akan keluar menuju pelarut hingga mencapai
kesetimbangan konsentrasi (Voigt, 1994).
Penyarian dengan alat Soxhlet merupakan metode ekstraksi dengan cara
mengaliri bahan yang akan diekstrak dengan pelarut yang sesuai dan selalu
diperbaharui. Bahan yang akan diekstrak dibungkus dalam suatu kantung
ekstraksi, kemudian kantung dimasukkan dalam sebuah alat ekstraksi (Soxhlet)
yang bekerja secara terus-menerus. Soxhlet diletakkan di antara labu penampung
hasil ekstraksi dan suatu pendingin aliran balik yang dihubungkan oleh suatu pipa
pipet. Dalam labu penampung hasil ekstraksi, pelarut yang ada di dalamnya
diuapkan. Melalui pipa pipet, pelarut tersebut dialirkan menuju pendingin aliran
balik dan berkondensasi sehingga pelarut menetes lagi ke bahan yang diekstraksi.
Pelarut akan tertampung dalam wadah penampung hingga mencapai tinggi
maksimal, kemudian secara otomatis pelarut ditarik ke dalam labu penampung.
Karena itu, zat yang terekstraksi akan terendam oleh bahan pelarut murni yang
Gambar 3. Penyarian dengan alat Soxhlet (Cornell University, 2011)
Keuntungan dari penyarian dengan alat Soxhlet adalah tidak
membutuhkan pelarut dalam jumlah yang banyak dan pelarut yang masuk ke
dalam bahan yang akan diekstraksi secara terus menerus diperbaharui dengan
pelarut yang tidak mengandung zat aktif (Voigt, 1994).
G. Spektrofotometri Visibel
Spektrofotometri visibel merupakan teknik spektroskopik yang memakai
sumber radiasi elektromagnetik sinar tampak (380-780 nm) dengan memakai
instrumen spektrofotometer. Distribusi elektron didalam suatu senyawa organik
secara umum yang dikenal sebagai orbital elektron pi (п), sigma (α) dan elektron
tidak berpasangan (n). Apabila pada molekul dikenakan radiasi elektromagnetik
maka akan terjadi ekstasi elektron ke tingkat energi yang lebih tinggi yang dikenal
sebagai orbital elektro anti bonding (Mulja dan Suharman, 1995).
Penerapan spektrofotometri UV-vis pada senyawa organik didasarkan
sekitar 200 ke 700 nm yang digunakan dalam eksperimen dan karenanya
memerlukan gugus kromofor dalam molekul itu (Day dan Underwood, 1999).
Kromofor merupakan gugus tak jenuh kovalen yang dapat menyerap
radiasi dalam daerah-daerah UV dan visibel, pada senyawa organik dikenal pula
gugus auksokrom, yaitu gugus jenuh yang terikat pada kromofor. Terikatnya
gugus auksokrom pada kromofor dapat mengubah panjang gelombang dan
intensitas serapan maksimum (Sastrohamidjojo, 2001).
DPPH memberikan absorbansi maksimal di daerah visibel (cahaya
tampak), sehingga untuk menganalisis penurunan absorbansi DPPH karena
adanya senyawa antioksidan dapat menggunakan spektrofotometer visibel.
Berkurangnya absorbansi dari reaksi DPPH dengan antioksidan menunjukkan
aktivitas penangkapan radikal bebas. Semakin rendah absorbansi mengindikasikan
semakin tinggi kemampuan aktivitas antioksidan (Chaisawvong and Sangsrichan,
2009).
H. Kromatografi Lapis Tipis
Kromatografi lapis tipis merupakan metode kromatografi cair terbuka
yang paling sederhana di mana fase diam berupa lapis tipis yang terdiri atas bahan
padat yang dilapisi kepada permukaan penyangga dasar yang biasanya terbuat dari
lempeng kaca, tetapi dapat pula terbuat dari plat polimer atau logam. Lapisan
pelekat pada permukaan dengan bantuan bahan pengikat, biasanya kalsium sulfat
yang menyerap, walaupun dapat pula dipakai sebagai penyangga zat cair. Fase
geraknya mengalir karena kerja kapiler (Gritter, 1991).
Fase diam pada KLT dapat berupa serbuk halus yang berfungsi sebagai
permukaan penyerap (kromatografi cair-padat) atau berfungsi sebagai penyangga
untuk lapisan zat cair (kromatografi cair-cair) empat penyerap (fase diam) yang
paling umum dipakai adalah silika gel (asam silikat), alumina (aluminium oksida),
kiselgur (tanah diatome) atau selulosa (Gritter, 1991).
Fase gerak adalah medium angkut yang terdiri atas satu atau beberapa
pelarut. Fase gerak bergerak di dalam fase diam, yaitu suatu lapisan berpori
karena ada gaya kapiler. Yang digunakan hanyalah pelarut tingkat mutu analitik
dan bila diperlukan sistem pelarut multi komponen ini harus berupa suatu
campuran sederhana yang terdiri atas maksimum tiga komponen. Angka banding
campuran dinyatakan dalam bagian volume sedemikian rupa sehingga volume
total 100 (Stahl, 1985).
Kromatografi lapis tipis (KLT) adalah teknik yang mudah digunakan
dalam memisahkan komponen dari suatu kompleks, seperti ekstrak dari jaringan
tanaman. Bila kromatografi lapis tipis dikombinasikan dengan detektor yang
tepat, KLT dapat menjadi metode kuantitatif senyawa yang memiliki pemisahan
yang baik (Gonzáles, Lara, Carbajal, and Flota, 2007).
KLT dapat digunakan untuk analisis baik secara kualitatif, kuantitatif,
maupun semi-kuantitatif. Keuntungan dari KLT adalah reprodusibilitas sampel
yang tinggi, biaya operasional yang murah, dan kemudahan identifikasi senyawa
teknik yang sering digunakan karena kemampuan sistem analisis yang sensitif dan
peningkatan kemampuan dari KLT dalam menganalisis (Turner, Subrahmanyam,
and Piletsky, 2009).
I. Densitometri
Densitometri merupakan metode analisis instrumental berdasarkan
interaksi analit dengan radiasi elektromagnetik dalam bentuk bercak pada KLT.
Densitometri dilakukan untuk analit dengan konsentrasi kecil yang memerlukan
pemisahan terlebih dahulu dengan KLT. Evaluasi bercak KLT discanning dengan
sumber sinar dalam bentuk celah. Sinar yang dipantulkan ditangkap oleh detektor
untuk diukur. Pengukuran absorbansi dapat dibuat dengan absorbansi maupun
fluorosensi (Rohman, 2009).
Kebanyakan pengukuran densitometri dilakukan dengan cara absorbansi
pada kisaran sinar UV (190-380 nm). Signal optik oleh adanya partikel pada
lempeng menghasilkan persamaan matematis yang menyatakan hubungan antara
absorbansi dengan konsentrasi analit melalui kurva kalibrasi (Rohman, 2009).
J. Validasi Metode Analisis
Validasi metode analisis merupakan penilaian terhadap parameter hasil
analisis laboratorium untuk membuktikan bahwa parameter tersebut memenuhi
syarat yang telah ditetapkan sehingga hasil analisis dapat dipercaya (Harmita,
2004). Kesahihan metode analisis diartikan sebagai suatu prosedur yang
yang diharapkan dengan accuracy dan prescision yang memadai (Mulya dan
Suharman, 1995). Pedoman-pedoman kesahihan metode analisis didukung oleh
parameter-parameter sebagai berikut.
1. Accuracy (kecermatan)
Accuracy berarti kedekatan hasil analisis yang diperoleh dengan
menggunakan metode tersebut terhadap harga yang sebenarnya. Accuracy
biasanya dinyatakan berupa persen perolehan kembali (recovery) dari
penambahan zat atau sampel yang diketahui kadarnya (Hong and Shah,
2000).
Akurasi dipengaruhi oleh sebaran galat (kesalahan) sistematik dalam
seluruh tahapan analisis, sehingga untuk mengurangi kesalahan sistematik
dapat dilakukan dengan menggunakan instrumen yang telah terkalibrasi,
menggunakan pelarut dan pereaksi yang berkualitas untuk analisis,
pengontrolan faktor-faktor yang dapat mempengaruhi hasil analisis, dan
pelaksanaan penelitian sesuai prosedur yang ditetapkan (Harmita, 2004).
Parameter kecermatan bergantung pada konsentrasi matriks sampel
dan keseksamaan metode (RSD). Rentang perolehan kembali yang diijinkan
berbeda, tergantung konsentrasi analit pada matriks. Parameter akurasi yang
Tabel I. Kriteria akurasi yang masih dapat diterima menurut Harmita (2004)
Analit pada matrik sampel, dalam % Rata-rata yang diperoleh, %
100 98-102
2. Precision (ketelitian atau keseksamaan)
Precision merupakan ukuran kedekatan masing-masing hasil analisis
dari beberapa pengukuran di bawah kondisi analisis yang sama. Menurut USP
23/NF 18, presisi diartikan sebagai derajat antara hasil uji individual ketika
prosedur diaplikasikan berulang kali dengan pengambilan sampel berulang
kali dari sampel yang homogen (Hong and Shah, 2000).
Parameter keseksamaan dilihat dari simpangan baku atau simpangan
baku relatif (koefisien variasi) dari kadar analit yang dianalisis. Secara umum,
suatu metode dikatakan seksama bila simpangan baku relatif atau koefisien
variasi 2% atau kurang. Namun parameter keseksamaan ini dapat berubah
karena dipengaruhi beberapa faktor, seperti konsentrasi analit yang dianalisis,
jumlah sampel, dan kondisi laboratorium. Rentang keseksamaan yang
Tabel II. Kriteria presisi yang masih dapat diterima menurut Harmita (2004)
Analit pada matrik sampel, dalam % RSD yang diperoleh, %
> 1 2,5
0,1 5
0,0001 (1 ppm) 16
0,0000001 (1 ppb) 32
Untuk menentukan presisi metode analisis diperlukan penentuan
berulang kali dengan prosedur yang sama. Makin kecil kadar zat yang
dianalisis dan makin panjang tahapan prosedur metode analisis akan didapat
harga simpangan relatif yang makin besar (Mulya dan Suharman, 1995).
3. Specificity (selektivitas)
Menurut USP 23/NF 18 (1995), Specificity adalah kemampuan
pengukuran analit secara akurat dan spesifik dengan kehadiran komponen lain
dalam matriks sampel. Komponen tersebut mungkin mengandung zat aktif,
ekspien, pengotor, dan produk degredasi.
Selektivitas seringkali dinyatakan sebagai derajat penyimpangan
(degree of bias) metode pada sampel yang mengandung bahan tambahan,
seperti cemaran, hasil penguraian, senyawa yang memiliki kemiripan struktur,
senyawa asing dibanding sampel yang tidak mengandung bahan tambahan
(Harmita, 2004).
4. Sensitivity (Sensitivitas)
Sensitivity metode analisis adalah kemampuan metode analisis untuk
memisahkan perbedaan kecil dalam konsentrasi analit. Ada dua faktor yang
mempengaruhi sensitivitas yaitu slope kurva baku dan keterulangan (Skoog,
5. Linearity (rentang kelurusan)
Rentang kelurusan yaitu suatu rentangan kadar yang terendah sampai
kadar tertinggi yang ditentukan dengan kadar dan direlasikan dengan serapan
pada spektrofotometri dengan koefisien korelasi yang mendekati satu (Mulya
dan Suharman, 1995).
Linearitas dinyarakan sebagai variansi di sekitar garis regresi yang
dihitung dari data hasil uji analit pada berbagai konsentrasi menggunakan
persamaan matematik. Persamaan matematik dalam penentuan linearitas
adalah melalui persamaan garis lurus dengan metode kuadrat terkecil antara
hasil uji dengan konsentrasi analit (Harmita, 2004).
K. Landasan Teori
Radikal bebas merupakan senyawa yang tidak stabil karena memiliki satu
elektron yang tidak berpasangan. Radikal bersifat sangat reaktif untuk
menstabilkan kekurangan elektronnya dengan menyerang elektron pada molekul
di sekitarnya, namun dapat menyebabkan kerusakan sel sehingga timbul
penyakit-penyakit degeneratif. Dengan demikian, diperlukan adanya senyawa yang dapat
menghambat reaksi radikal bebas yang disebut sebagai antioksidan.
Buah cabai rawit putih memiliki kandungan kapsaisin yang telah diteliti
dapat digunakan sebagai antioksidan. Kapsaisin memiliki gugus fenolik yang
dapat menangkap radikal bebas dengan cara mendonorkan atom hidrogen kepada
radikal bebas sehingga menurunkan aktivitas radikal bebas. Karena kapsaisin
Metode yang digunakan untuk menguji aktivitas antioksidan adalah
metode DPPH. DPPH merupakan radikal bebas yang memberikan serapan kuat
pada panjang gelombang 517 nm. Senyawa antioksidan akan berpasangan dengan
elektron bebas DPPH yang menyebabkan penurunan absorbansi. Dari nilai
perubahan absorbansi dapat dihitung IC50yang merupakan parameter kemampuan
(aktivitas) dari antioksidan tersebut yang dapat menghambat 50% senyawa
radikal.
Kapsaisin yang merupakan senyawa dalam cabai rawit yang
mempengaruhi aktivitas antioksidan, maka perlu ditetapkan kadar kapsaisin dalam
cabai rawit putih. Kadar kapsaisin ditetapkan secara kromatografi lapis tipis –
densitometri. Dari bercak yang dihasilkan, dapat ditetapkan kadarnya dengan
scanning bercak menggunakan densitometri.
L. Hipotesis
1. Ekstrak etanol buah cabai rawit putih mempunyai aktivitas antioksidan yang
dapat dinyatakan sebagai IC50 menggunakan metode DPPH.
2. Kadar kapsaisin dalam ekstrak etanol buah cabai rawit putih perlu ditetapkan
secara kromatografi lapis tipis – densitometri karena mempengaruhi
26
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian aktivitas antioksidan pada cabai rawit putih ini merupakan
jenis penelitian eksperimental karena adanya perlakuan terhadap subyek uji dan
menggunakan rancangan deskriptif.
B. Variabel
1. Variabel bebas pada penelitian ini adalah konsentrasi ekstrak etanol cabai
rawit putih.
2. Variabel tergantung pada penelitian ini adalah aktivitas penangkapan radikal
bebas DPPH (%IC) dan kadar kapsaisin dalam ekstrak etanol cabai rawit
putih.
3. Variabel pengacau terkendali pada penelitian ini adalah lokasi pengambilan
sampel, umur tanaman, bobot sampel tanaman yang digunakan, dan waktu
pemanenan.
4. Variabel pengacau tak terkendali pada penelitian ini adalah cuaca, curah
C. Definisi Operasional
1. Cabai rawit putih adalah buah yang belum masak dari tanaman cabai rawit
(Capsicum frutescens L.) yang didapat dari Pasar Beringharjo, Yogyakarta.
2. Ekstrak etanol buah cabai rawit putih adalah ekstrak kental yang didapat dari
penyarian buah cabai rawit putih dengan alat Soxhlet menggunakan pelarut
etanol.
3. Metode DPPH adalah metode pengujian aktivitas antioksidan dalam
menangkap radikal bebas DPPH (1,1-difenil-2-pikrilhidrazil). Reaksi DPPH
dengan senyawa antioksidan dapat menyebabkan perubahan intensitas warna
sehingga absorbansi menurun.
4. Persen inhibition concentration (%IC) adalah persen yang menyatakan
kemampuan ekstrak etanol cabai rawit putih dalam menangkap radikal bebas
DPPH.
5. Inhibition concentration 50 (IC50) merupakan nilai konsentrasi ekstrak etanol
cabai rawit putih yang dapat menangkap 50% radikal bebas DPPH.
D. Bahan dan Alat Penelitian 1. Bahan penelitian
Bahan yang digunakan pada penelitian ini, yaitu cabai rawit putih
(Capsicum frutescens L.) yang didapat dari pasar Beringharjo, Yogyakarta,
bahan kimia farmasetis berupa aquadest, bahan kualitas teknis berupa etanol
96% (Bratachem), bahan kualitas pro analitik meliputi etanol 96% (E.Merck),
(E.Merck), aseton (E.Merck), DPPH (Sigma-Aldrich), silica gel 60 F254 dan
aluminium foil.
2. Alat penelitian
Alat-alat yang digunakan pada penelitian ini, yaitu vortex,
spektrofotometer UV-VIS (Shimadzu), blender, corong Buchner, oven,
mikropipet 10 – 1000 µL; 1 – 10 mL (Socorex), neraca analitik (Ohaus),
vacuum rotary evaporator (Junke & Kunkel), waterbath (Memmet),
densitometer (Shimadzu), tabung reaksi bertutup (Schott), dan alat-alat gelas
yang lazim digunakan di laboratorium analisis (Pyrex dan Iwaki).
E. Tata Cara Penelitian 1. Determinasi buah
Determinasi buah cabai rawit putih yang digunakan berdasarkan
pengamatan morfologinya dilakukan dengan membandingkan literatur dari
Bosland, Bailey, Iglesias-Olivas (1996).
2. Pengumpulan bahan
Buah cabai rawit putih diperoleh dari Pasar Beringharjo,
3. Pembuatan ekstrak buah cabai rawit putih
Buah cabai rawit putih sebanyak 1 kg yang masih segar dibersihkan
dan dicuci kemudian dibuang bagian tangkainya. Buah cabai rawit putih
dikeringkan pada oven dengan suhu 500C, kemudian dihaluskan dengan
blender. Simplisia yang telah halus ditimbang sebanyak 25,0 g, dibungkus
menggunakan kertas saring. Simplisia dimasukkan dalam labu alas bulat
berisi 350,0 mL etanol p.a. Soxheltasi dilakukan pada suhu 700C selama 8
jam sampai didapat hasil ekstrasi yang jernih. Filtrat hasil ekstraksi
dipekatkan dengan menggunakan vacuum rotary evaporator.
4. Penentuan aktivitas antioksidan dengan metode DPPH
a. Pembuatan larutan DPPH, sebanyak 15,80 mg serbuk DPPH dilarutkan
dengan 100,0 mL etanol p.a hingga diperoleh larutan DPPH dengan
konsentrasi 0,4 mM. Larutan DPPH ditutup dengan aluminium foil dan
harus selalu dibuat baru.
b. Pembuatan larutan stok kapsaisin, sebanyak 2,50 mg kapsaisin
dimasukkan dalam labu ukur 10 mL, kemudian dilarutkan etanol p.a
hingga batas.
c. Pembuatan larutan seri baku kapsaisin, diambil sebanyak 1,0; 2,0; 3,0;
4,0; dan 5,0 mL larutan stok kapsaisin, kemudian ditambahkan etanol p.a
sampai 10,0 mL sehingga diperoleh larutan baku kapsaisin sebesar 25;
d. Pembuatan larutan uji, sejumlah 25,0 mg ekstrak buah cabai rawit putih
ditimbang kemudian ditambahkan etanol p.a sampai 25,0 mL. Dari
larutan tersebut diambil 1,0; 2,0; 3,0; 4,0 dan 5,0 mL kemudian ditambah
etanol p.a sampai 10,0 mL sehingga diperoleh larutan uji dengan
konsentrasi 100; 200; 300; 400 dan 500 µg/mL.
e. Uji pendahuluan aktivitas antioksidan, sebanyak 1,0 mL larutan DPPH
dimasukkan ke dalam masing-masing tiga tabung reaksi. Masing-masing
tabung reaksi ditambahkan 1,0 mL etanol p.a, larutan baku kapsaisin 75
µg/mL, dan larutan uji 300 µg/mL. Kemudian ditambahkan 3,0 mL
etanol p.a pada masing-masing larutan. Larutan divortex selama 30 detik.
Setelah 30 menit, perubahan warna yang terjadi diamati.
f. Penentuan panjang gelombang maksimum, pada 3 labu ukur 10 mL,
dimasukkan masing-masing 0,50; 1,0; dan 1,50 mL larutan DPPH.
Larutan ditambahkan dengan etanol p.a hingga tanda batas sehingga
konsentrasi DPPH menjadi 0,020; 0,040; dan 0,080 mM. Larutan
divortex selama 30 detik. Lalu dilakukan scanning panjang gelombang
serapan maksimum dengan spektrofotometer visibel pada panjang
gelombang 400 – 600 nm.
g. Penentuan operating time (OT), sebanyak 1,0 mL larutan DPPH
dimasukkan ke dalam masing-masing tiga labu ukur 5 mL, ditambahkan
masing-masing dengan 1,0 mL larutan baku kapsaisin 25; 75; dan 125
µg/mL. Kemudian larutan ditambahkan dengan etanol p.a hingga tanda
absorbansinya dengan spektrofotometer visibel pada panjang gelombang
517 nm setiap 5 menit selama 1 jam.
h. Penentuan aktivitas antioksidan buah cabai rawit putih,
i. Pengukuran absorbansi larutan DPPH (kontrol), pada labu ukur 5
mL, dimasukkan sebanyak 1,0 mL larutan DPPH. Larutan
ditambahkan dengan etanol p.a hingga tanda batas. Kemudian
larutan tersebut dibaca absorbansinya pada saat OT dan panjang
gelombang maksimum. Pengerjaan dilakukan sebanyak tiga kali.
Larutan ini digunakan sebagai kontrol untuk menguji larutan baku
dan larutan uji.
ii. Pengukuran absorbansi larutan pembanding dan larutan uji,
sebanyak 1,0 mL larutan DPPH dimasukkan ke dalam labu ukur 5
mL kemudian ditambah dengan 1,0 mL larutan pembanding dan
larutan uji pada berbagai seri konsentrasi yang telah dibuat.
Selanjutnya, larutan tersebut ditambah dengan etanol p.a hingga
tanda batas. Larutan tersebut kemudian divortex selama 30 detik
dan didiamkan selama OT. Larutan dibaca absorbansinya dengan
spektrofotometer visibel pada panjang gelombang maksimum hasil
optimasi. Pengujian dilakukan dengan tiga kali replikasi.
i. Validasi metode uji aktivitas antioksidan, hasil dari prosedur 4h (i) dan
(ii) divalidasi akurasi (% recovery), presisi (% CV), spesifisitas (spektra
kontrol), dan linearitas (nilai r).
Standar e iasi rata rata konsentrasi standar kapsaisin terukurS konsentrasi standar kapsaisin terukur
j. Estimasi aktivitas antioksidan, hasil dari prosedur 4h (i) dan (ii), dihitung
nilai % IC dan IC50 untuk kapsaisin dan ekstrak buah cabai rawit putih.
5. Penentuan kadar kapsaisin
a. Pembuatan fase gerak, fase gerak yang digunakan pada penelitian ini
dibuat dalam perbandingan, yaitu toluena - kloroform - aseton (45:25:30,
v/v/v). Fase gerak dituang dalam bejana kromatografi kemudian kertas
saring dimasukkan dalam bejana yang berisi fase gerak. Bejana ditutup
rapat dan dibiarkan hingga seluruh kertas saring terbasahi oleh fase
gerak.
b. Pembuatan larutan stok kapsaisin, baku kapsaisin ditimbang seksama 5,0
mg ditimbang seksama dan dimasukkan ke dalam labu takar 10 ml,
kemudian dilarutkan dengan metanol sampai tanda batas sehingga
diperoleh larutan stok kapsaisin 0,50 mg/mL.
c. Pembuatan larutan seri baku kapsaisin, larutan stok kapsaisin 0,50
mg/mL ditotolkan dengan volume 1,0; 2,0; 4,0; dan 8,0 μL pada lempeng
silika gel 60 F254 sehingga diperoleh seri kapsaisin dengan jumlah 0,5;
1,0; 2,0; dan 4,0 µg.
d. Pembuatan larutan uji, sejumlah 50,0 mg ekstrak buah cabai rawit putih
ditimbang seksama kemudian dilarutkan dengan metanol sebanyak 500,0
µL. Larutan tersebut divortex selama 10 menit dengan pemanasan di atas
menit dan disaring dengan ayakan mesh 60. Larutan uji dibuat replikasi
sebanyak tiga kali.
e. Penetuan kadar kapsaisin buah cabai rawit putih, sebanyak 10,0 μL
larutan uji ditotolkan pada lempeng silika gel 60 F254, kemudian
dikembangkan dalam bejana kromatografi yang telah dijenuhkan dengan
fase gerak toluena - kloroform - aseton (45:25:30, v/v/v). Pengembangan
dilakukan setinggi 10 cm, lempeng silika kemudian dikeluarkan dan
ditunggu hingga kering. Bercak diamati di bawah lampu UV 254 nm
kemudian dianalisis dengan densitometer pada panjang gelombang
maksimum. Bercak seri baku kapsaisin diukur AUC-nya dengan
densitometri pada panjang gelombang pengamatan yang telah diperoleh.
Puncak kromatogram dan nilai AUC yang muncul diamati. Dengan
metode regresi linear, nilai seri kadar (µg/mL) diplotkan terhadap nilai
AUC masing-masing seri larutan baku sehingga diperoleh persamaan y =
bx + a dimana y merupakan nilai respon (AUC), x merupakan
konsentrasi senyawa baku, a adalah intersept, dan b adalah slope. Kadar
kapsaisin dalam sampel ditentukan berdasarkan persamaan kurva baku
yang paling baik.
F. Analisis Hasil
Aktivitas penangkapan radikal (%) dapat dihitung dengan menggunakan
rumus :
bsorbansilarutan kontrol – bsorbansilarutan baku uji
Data aktivitas tersebut dianalisis dan dihitung nilai IC50 menggunakan
persamaan regresi linear dengan sumbu x adalah konsentrasi larutan uji maupun
larutan baku kapsaisin, sedangkan sumbu y adalah % IC, Lalu dianalisis secara
statistik untuk menentukan ada atau tidak adanya perbedaan bermakna antara IC50
larutan baku kapsaisin dan larutan uji.
Uji kadar kapsaisin total dilakukan secara kromatografi lapis tipis. Nilai
kadar tersebut didapatkan dari analisis data kromatogram dengan menggunakan
densitometer. Analisis kualitatif dilakukan dengan membandingkan nilai Rf
sampel dengan nilai Rf baku. Analisis kuantitatif yang dilakukan berdasarkan data
AUC dari baku sehingga diperoleh persamaan regresi linear y = bx + a yang
merupakan hubungan antara kadar dengan luas area yang dihasilkan. Data AUC
sampel kemudian dimasukkan dalam persamaan regresi masing-masing baku
35
BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Determinasi Buah
Determinasi buah cabai rawit putih merupakan tindakan awal yang
dilakukan dalam suatu penelitian yang menggunakan buah sebagai bahan uji.
Determinasi dilakukan untuk memastikan kebenaran identitas dari buah yang
digunakan untuk penelitian dan menghindari adanya kesalahan pengambilan
sampel. Jaminan kebenaran sampel sangat penting karena pada buah cabai terdiri
dari berbagai macam spesies dan varietas. Masing-masing spesies buah cabai
memiliki kandungan fitokimia yang berbeda. Determinasi buah dilakukan dengan
membandingkan beberapa spesies dari Capsicum yang mengacu pada Bosland,
Bailey, Iglesias-Olivas (1996).
Pembuktian determinasi buah dilakukan dengan membandingkan ciri-ciri
dari buah dengan karakteristik spesies Capsicum pada literatur, yaitu panjang
buah 2,5 – 5 cm; lebar buah 0,6 cm; bentuk buah datar (tidak bergelombang) dan
tegak lurus; rasa buah sangat pedas; dan warna buah yang kuning kehijauan pucat
saat belum masak. Morfologi buah cabai rawit putih yang digunakan sama dengan
morfologi Tabasco (Capsicum frutescens L.) seperti yang terlihat di gambar 4..
Dari hasil determinasi tanaman, telah dibuktikan bahwa buah yang digunakan
pada penelitian ini merupakan buah cabai rawit putih (Capsicum frutescens L.).
B. Hasil Pengumpulan Bahan
Buah cabai rawit putih diperoleh dari Pasar Beringharjo, Yogyakarta
pada September 2012. Pengambilan sampel pada satu tempat untuk mencegah
adanya variasi kandungan metabolit dalam sampel sehingga mengurangi faktor
pengacau yang dapat mempengaruhi hasil penelitian. Pemilihan buah cabai rawit
yang digunakan dalam penelitian ini adalah buah cabai rawit yang berwarna hijau
muda pucat hampir mendekati putih pada seluruh bagian buah dan dalam keadaan
segar. Buah cabai rawit yang digunakan adalah cabai rawit yang dipanen pagi hari
sehingga menghindari perubahan senyawa kapsaisin menjadi metabolit lain.
Pemanenan pada siang hari dapat merusak potensi senyawa antioksidan karena
radiasi UV dari sinar matahari sehingga hasil pengujian aktivitas antioksidan tidak
menunjukkan hasil yang sesungguhnya karena senyawa antioksidan sudah banyak
C. Hasil Preparasi Sampel
Buah cabai rawit putih yang telah dikumpulkan, dibersihkan, dibuang
bagian tangkai, dan dicuci untuk menghilangkan pengotor-pengotor yang ada.
Kemudian buah cabai rawit dikeringkan dengan pengovenan selama tiga hari pada
suhu 40–600C agar menghilangkan kandungan air yang terdapat di dalam
simplisia. Pengeringan simplisia dilakukan untuk mempermudah pembentukan
serbuk simplisia yang kemudian diekstraksi dengan alat Soxhlet.
Simplisia yang telah dikeringkan kemudian diblender dengan tujuan
memperkecil ukuran partikel sehingga meningkatkan jumlah senyawa dalam buah
cabai rawit putih yang terekstraksi. Semakin kecil ukuran partikel, maka luas
permukaan spesifik partikel semakin besar sehingga jumlah penyari yang kontak
dengan serbuk simplisia semakin besar. Semakin banyak pelarut kontak dengan
simplisia maka pelarut makin mudah menembus sel dan mudah menarik senyawa
dalam sel untuk keluar sehingga jumlah senyawa yang terekstraksi makin banyak
pula. Serbuk simplisia yang digunakan diayak dengan pengayak nomor 40 agar
didapat serbuk dengan ukuran yang cukup halus.
Tujuan ekstraksi adalah menarik senyawa tertentu yang diinginkan dari
dalam sel tumbuhan maupun bahan baku obat ke dalam pelarut yang memiliki
kepolaran yang sesuai sehingga senyawa tersebut larut dalam pelarut. Teknik
ekstraksi dan pelarut yang digunakan bergantung pada kandungan dan stabilitas
senyawa yang akan diekstraksi. Pada penelitian ini, senyawa yang akan
diekstraksi adalah kapsaisin yang banyak terkandung dalam buah cabai rawit
Ekstraksi yang dilakukan adalah ekstraksi padat cair, yang melibatkan
perpindahan senyawa dari padatan ke dalam cairan pengekstrak. Prinsip ekstraksi
padat cair adalah adanya kontak antara pelarut dengan suatu padatan sehingga
terjadi perpindahan massa zat aktif yang mula-mula berada dalam sel tanaman
menuju pelarut dengan atau tanpa adanya faktor luar seperti aliran pelarut ataupun
panas yang dapat mempercepat dan meningkatkan efektivitas ekstraksi (Rohman,
2009). Sampel yang digunakan adalah serbuk simplisia dari buah cabai rawit putih
yang diekstrak menggunakan etanol.
Metode ekstraksi yang digunakan pada penelitian ini adalah penyarian
dengan alat Soxhlet. Penyarian dengan alat Soxhlet merupakan metode ekstraksi
dengan pelarut yang mengalir dan menggunakan panas. Penyarian dengan alat
Soxhlet dipilih karena telah digunakan pada beberapa penelitian dan terbukti
memberikan hasil ekstraksi kapsaisin dengan rendemen yang tinggi. Keuntungan
dari penggunaan alat Soxhlet adalah pelarut yang digunakan hanya sedikit
dibanding perklorasi dan pelarut selalu baru, hasil dari penguapan secara kontinyu
sehingga hasil ekstraksi yang didapat lebih banyak dibanding ekstraksi
menggunakan maserasi karena kemungkinan terjadinya kejenuhan pelarut pada
metode maserasi.
Ekstraksi kapsaisin dilakukan dengan membasahi serbuk buah cabai
rawit putih dengan etanol. Hasil dari ekstraksi ditampung pada labu alas bulat
yang dipanaskan. Tujuan pemanasan labu alas bulat agar pelarut yang tertampung
dapat menguap dan menyari simplisia dalam tabung Soxhlet. Suhu yang
pada suhu tersebut karena memberikan rendemen hasil ekstraksi yang tinggi
(Boonkird, Phisalaphong, Phisalaphong, 2008) serta suhu 700C sudah dapat
digunakan untuk menguapkan pelarut etanol tanpa merusak senyawa kapsaisin.
Ekstraksi dengan alat Soxhlet dihentikan setelah delapan jam, yaitu saat
hasil penyarian pada tabung Soxhlet bening karena kapsaisin telah terekstraksi
sempurna. Selama delapan jam ekstraksi, penyarian dengan Soxhlet mengalami
sirkulasi pelarut sebanyak delapan kali. Hasil ekstraksi yang didapat berupa
ekstrak cair berwarna hijau muda.
Pelarut yang digunakan untuk ekstraksi adalah etanol. Etanol digunakan
pada proses ekstraksi penelitian ini karena memiliki sifat yang nonpolar sehingga
dapat digunakan untuk menyari senyawa kapsaisin yang juga bersifat nonpolar.
Metanol memiliki nilai indeks polaritas 6,6, sedangkan etanol memiliki indeks
polaritas sebesar 5,2 (Snyder, Kirkland, Glajh, 1997). Berdasarkan nilai indeks
polaritas, etanol memiliki kepolaran yang lebih rendah dibandingkan dengan
metanol, sehingga etanol akan lebih efektif dalam mengestraksi kapsasin yang
bersifat nonpolar. Pada penelitian yang telah dilakukan (Boonkird, Phisalaphong,
Phisalaphong, 2008), etanol terbukti efektif dalam mengekstraksi kapsaisin
sehingga jumlah kapsaisin yang didapat semakin banyak. Selain itu etanol 96%
lebih ekonomis pada tahap penguapan pelarut karena tidak membutuhkan energi
yang tinggi dibanding pelarut etanol lain dengan konsentrasi lebih rendah. Etanol
lebih aman digunakan karena toksisitasnya lebih rendah dibanding pelarut organik