SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh: Novianti NIM : 06 8114 107
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
ii SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh: Novianti NIM : 06 8114 107
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
PADA TIKUS JANTAN DAN AKTIVITAS
iii
PADA TIKUS JANTAN WISTAR: KAJIAN TERHADAP OR DAN AKTIVITAS ALANIN AMINOTRANSFERASE
Oleh: Novianti NIM : 068114107
Skripsi ini telah disetujui oleh
Bersukacita
sabarlah dala
bertekunlah
Serakanlah segala kekuatiran
memelihara kamu
Tuhan
Ke Hendrik, Ke Herw
v
rsukacitalah dalam pengharapan,
arlah dalam kesesakan, dan
tekunlah dalam doa.
Roma 12:12
erakanlah segala kekuatiranmu kepada -Nya, sebab Ia yang
memelihara kamu.
1 Petrus 5:7
Kupersembahkan skripsi ini untu Tuhan Yesus yang selalu menjaga, melindungi, dan
Papa dan mama, sebagai tanda kasih dan sayangku kepada kalia Ke Hendrik, Ke Herwin, dan Juliani atas doa, perhatian, dan dukungannya
Daryono Thejo atas perhatian, dukungan, dan kerjas Teman-teman Farmasi angk’ 2006 dan Almamaterku
Nya, sebab Ia yang
1 Petrus 5:7
Yang bertanda tangan di bawah ini, Nama
Nomor Mahasiswa
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma
PENGARUH PEMBERIAN PADA TIKUS JANTAN
DAN AKTIVITAS ALANIN AMINOTRANSFER
Dengan demikian, saya Dharma, hak untuk mengelolanya dalam bentuk mempublikasikannya tanpaperlu meminta izin
selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini ya Dibuat di Yogyakarta Pada tanggal : 19 Desember
Yang menyatakan
( Novianti )
vi
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma: : Novianti
Nomor Mahasiswa : 068114107
pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul:
PEMBERIAN AKUT JUS WORTEL (Daucus
JANTAN WISTAR : KAJIAN TERHADAP OR ALANIN AMINOTRANSFERASE
demikian, saya memberikan kepada Perpustakaan Universitas untuk menyimpan, mengalihkan dalam bentuk
mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, mempublikasikannya di Internet atau media lain untuk kepentingan
meminta izin dari saya maupun memberikan royalt selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini yang saya buat dengan sebenarnya. Dibuat di Yogyakarta
19 Desember 2009
mahasiswa Universitas Sanata Dharma:
pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan
aucus carota L.)
TERHADAP ORGAN HATI
vii
memberikan berkat dan anugerah-Nya, sehingga penulis dapat menyelesaikan
skripsi yang berjudul “Pengaruh Pemberian Akut Jus Wortel (Daucus carota L.)
pada Tikus Jantan Wistar: Kajian terhadap Organ Hati dan Aktivitas Alanin
Aminotransferase”. Skripsi ini disusun untuk melengkapi salah satu syarat untuk
memperoleh Gelar Sarjana Farmasi (S.Farm) Program Studi Ilmu Farmasi.
Penulis juga mengucapkan terima kasih kepada pihak-pihak yang telah
membantu penyelesaian skripsi ini, terutama kepada:
1. Ibu Rita Suhandi, M.Si., Apt., selaku Dekan Fakultas Farmasi Universitas
Sanata Dharma Yogyakarta.
2. Bapak Yosef Wijoyo, M.Si., Apt. selaku Dosen Pembimbing yang telah
memberikan pengarahan demi tercapainya penyusunan skripsi ini.
3. Ibu drh. Renny Kusumastuti M.P selaku Dosen Pendamping dalam
pengamatan histopatologi yang telah menyediakan waktu dan memberikan
banyak masukan dalam penyelesaian skripsi ini.
4. Ibu Phebe Hendra M.Si., Ph.D., Apt., selaku Dosen Penguji yang telah
memberikan banyak masukan demi kesempurnaan skripsi ini.
5. Bapak Dr. C.J. Soegihardjo, Apt., selaku Dosen Penguji yang telah
memberikan banyak masukan demi kesempurnaan skripsi ini.
6. Mama, Papa, Ke Hendrik, Ke Herwin, dan Juliani yang selalu memberi
8. Mas Parjiman, Mas
berkerja di laboratorium.
9. Pius dan Thomas yang telah membantu selama bekerja di laboratorium.
10. Riana, teman-teman
membantu penulis selama ini.
11. Semua pihak yang tidak dapat disebutkan satu per satu
Penulis menyadari bahw
kesalahan dan kekurangan.
saran dan kritik dari
penulis berharap skripsi
pengetahuan.
viii
Parjiman, Mas Heru, dan Mas Kayat yang telah membantu
berkerja di laboratorium.
Pius dan Thomas yang telah membantu selama bekerja di laboratorium.
teman kost Flourent, yang telah memberikan saran
membantu penulis selama ini.
Semua pihak yang tidak dapat disebutkan satu per satu
menyadari bahwa dalam penulisan skripsi ini masih
kekurangan. Oleh karena itu, penulis sangat mengharapkan
tik dari semua pihak demi kesempurnaan skripsi ini.
berharap skripsi ini dapat berguna bagi pembaca dan perkembangan telah membantu selama
Pius dan Thomas yang telah membantu selama bekerja di laboratorium.
memberikan saran dan selalu
ini masih banyak terjadi
mengharapkan adanya
skripsi ini. Akhir kata,
dan perkembangan ilmu
Penulis
memuat karya atau bagian
kutipan dan daftar pustaka sebagaimana layaknya karya ilmiah
ix
atau bagian karya orang lain, kecuali yang telah disebutkan
kutipan dan daftar pustaka sebagaimana layaknya karya ilmiah
Yogyakarta, 20 November 2009
Penulis
Novianti
telah disebutkan dalam
November 2009
Penulis
x
terhadap histopatologi hati, aktivitas Alanin Aminotransferase (ALT), dan melihat korelasi antara hasil pengamatan histopatologi organ hati dengan aktivitas ALT.
Penelitian ini termasuk penelitian eksperimental murni dengan rancangan acak lengkap pola searah. Tiga puluh ekor tikus jantan Wistar, berat 100-200 gram, umur 60-90 hari dibagi dalam 5 kelompok. Kelompok I sebagai kontrol negative. Kelompok ini diberi air minum 25 ml/kgBB. Kelompok II-V sebagai diberi jus wortel dengan dosis berturut-turut 1,094 g/kgBB, 2,188 g/kgBB, 4,375 g/kgBB dan 8,750 g/kgBB. Konsentrasi jus wortel adalah 35%. Penelitian ini mengamati perubahan berat badan, gejala klinis, jumlah tikus yang mati, histopatologi hati, dan aktivitas ALT. Aktivitas ALT pra perlakuan dan rasio organ hati dianalisis menggunakan Shapiro-Wilk kemudian dilanjutkan dengan One Way ANOVA atau Kruskall Wallis. Aktivitas ALT pra dan pasca perlakuan dibandingkan dengan uji paired t-test. Aktivitas ALT hari ke-1 dan ke-14 pasca perlakuan dibandingkan dengan unpaired t-test. Perubahan berat badan dianalisis menggunakan Two Way ANOVA.
Hasil penelitian menunjukkan bahwa jus wortel tidak menyebabkan kematian subjek uji (LD50 semu >8,750 g/kgBB). Pemberian jus wortel tidak menimbulkan gejala toksik. Pengamatan histopatologi hati menunjukkan bahwa jus wortel menyebabkan perubahan struktural sel hati seperti radang akut polimorfonuklear (PMN) dan nekrosis. Jus wortel tidak menyebabkan perubahan aktivitas ALT. Aktivitas ALT tidak berkorelasi dengan kerusakan sel hati dalam penelitian ini.
xi
correlation between liver histopathology and ALT activity.
The research was a true experimental with random one way research. Thirty male rats of Wistar strain, weighty 100-200 grams and age 60-90 days were divided randomly in five group of dosage. The first group was a negative control group. This group was treated with drinking water 25 ml/kgBW. Then II-V group were treated with carrot juice in each dosage 1,094 g/kgBW, 2,188 g/kgBW, 4,375 g/kgBW and 8,750 g/kgBW. Concentration of carrot juice was 35%. The research observed the change of body weight, clinical symptoms, the amount of dead rat, liver histopathology and ALT activity. The ALT activity before treatment and liver’s ratio were analyzed with Shapiro-Wilk and then continued with One Way ANOVA or Kruskall Wallis. ALT activity before and after treatment were compared with paired t-test. ALT activity at the 1st day and the 14th day after treatment were compared with unpaired t-test. The change of body weight was analyzed with Two Way ANOVA.
The result showed that carrot juice did not cause death in experimental subject (pseudo LD50 >8,750 g/kgBW). Carrot juice treatment did not make any toxic symptoms. The observation of liver’s histopathology showed that carrot juice caused structural changes at liver cell, such as PMN acute inflammation and necrosis. Carrot juice did not cause change of ALT activity. The ALT activity did not have any correlation with liver cell damage in this research.
xii
HALAMAN SAMPUL ... i
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... ... iv
HALAMAN PERSEMBAHAN ... v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI ... vi
PRAKATA... vii
PERNYATAAN KEASLIAN KARYA ... ix
INTISARI ... x
ABSTRACT... xi
DAFTAR ISI... xii
DAFTAR TABEL... xvii
DAFTAR GAMBAR ... xviii
DAFTAR LAMPIRAN... xxiii
BAB I. PENDAHULUAN A. Latar Belakang ... 1
1. Permasalahan ... 3
xiii
b. Manfaat praktis ... 7
B. Tujuan Penelitian ... 7
BAB II. PENELAAHAN PUSTAKA A. Toksisitas Akut ... 8
1. Kondisi efek toksik ... 9
2. Mekanisme aksi efek toksik... 10
3. Wujud efek toksik ... 11
4. Sifat efek toksik ... 12
5. Kekerabatan dosis respon ... 13
6. Gejala efek toksik ... 15
7. Median Lethal Dosage(LD50) ... 17
B. Wortel (Daucus carota L.)... 18
1. Sistematika tanaman ... ... 18
2. Cultivar... 18
3. Sinonim ... . 20
4. Penelaahan pustaka ... 20
a. Deskripsi ... 20
b. Kandungan kimia ... 20
c. Khasiat ... 20
5. Keterangan lain ... 21
xiv
2. Mikroskopi hati ... 25
3. Komponen penyusun ... 27
a. Enzim ... 27
b. Bilirubin ... 28
c. Protein ... 28
4. Fungsi... 28
5. Pengamatan makroskopi ... 29
6. Jenis kerusakan hati ... 29
a. Radang Polimorfonuklear (PMN)... 29
b. Degenerasi... 30
c. Perlemakan hati (Steatosis)... 31
d. Nekrosis hati ... 31
e. Kolestatis... 32
f. Sirosis... 33
E. ALT... 33
F. Landasan Teori... 35
G. Hipotesis ... 36
xv
a. Variabel bebas... 37
b. Variabel tergantung... 37
c. Variabel pengacau terkendali... 37
2. Variable pengacau tak terkendali... 37
3. Definisi operasional ... 38
C. Bahan atau Materi Penelitian ... ... 38
D. Alat atau Instrument Penelitian... 39
E. Tata Cara Penelitian... ... 39
1. Determinasi tanaman wortel (Daucus carota L.) ... 39
2. Pengelompokan hewan uji ... 39
3. Penanganan hewan uji... 40
4. Orientasi penetapan konsentrasi jus wortel (Daucus carota L.) ... 40
5. Orientasi penetapan dosis jus wortel (Daucus carota L.)... 40
6. Pemejanan jus wortel (Daucus carota L.)... 41
7. Pengamatan ... 41
8. Pengambilan darah dan pengukuran ALT ... 42
9. Pengambilan dan pemeriksaan hispatologi ... 43
F. Analisis Hasil ... ... 43
BAB IV. HASIL DAN PEMBAHASAN A. Determinasi Tanaman Wortel (Daucus carota L.) ... 45
xvi
E. Penetapan Dosis Jus Wortel (Daucus carota L.) ... 47
F. Pengamatan Gejala Klinis... 48
G. Penentuan LD 50... .... 50
H. Pemeriksaan Makroskopi Organ Hati Tikus Jantan Setelah Pemberian Jus Wortel (Daucus carota L.)... 50
I. Pemeriksaan Histopatologi Organ Hati Tikus Jantan Setelah Pemberian Jus Wortel (Daucus carota L.) ... 51
J. Pemeriksaan ALT Tikus Jantan Setelah Pemberian Jus Wortel (Daucus carota L.)... 65
K. Rasio Berat Organ Hati Tikus Jantan Setelah Pemberian Jus Wortel (Daucus carota L.)... 70
L. Perubahan Berat Badan Tikus Jantan Setelah Pemberian Jus Wortel (Daucus carota L.)... 72
M. Asupan Pakan dan Minum Tikus Jantan Setelah Pemberian Jus Wortel (Daucus carota L.)... 73
BAB V. KESIMPULAN DAN SARAN A. Kesimpulan ... 76
B. Saran ... 76
DAFTAR PUSTAKA ... 78
LAMPIRAN... 84
xvii
Tabel I. Gejala klinis dalam uji ketoksikan akut... 15
Tabel II. Klasifikasi ketoksikan suatu senyawa ... 17
Tabel III. Hasil pengamatan gejala klinis... 49
Tabel IV. Jumlah tikus jantan yang mati (% respon) selama 24 jam
setelah perlakuan ... 50
Tabel V. Keadaan makroskopi organ hati tikus jantan setelah perlakuan 51
Tabel VI. Gambaran histopatologis hati tikus jantan akibat pemejanan
jus wortel (Daucus carota L.) ... 61
Tabel VII. Aktivitas ALT tikus jantan Wistar sebelum perlakuan ... 65
Tabel VIII. Aktivitas ALT tikus jantan Wistar hari ke-1 setelah perlakuan. 66
Tabel IX. Aktivitas ALT tikus jantan Wistar hari ke-14 setelah
perlakuan ... 67
Tabel X. Perbandingan hasil pengukuran aktivitas ALT tikus jantan
Wistar sebelum perlakuan, hari ke-1, dan hari ke-14 setelah
xviii
Gambar 1. Foto purple dragon carrot (a), purple haze carrot (b), dan
solar yellow carrot(c) ... 19
Gambar 2. Foto Chantenay carrot (a), Danvers carrot (b), Imperator carrot(c), danNantes carrot(d)... 19
Gambar 3. Struktur β-karoten ... 22
Gambar 4. Penangkapan radikal peroksil (ROO●) oleh β-karoten ... 23
Gambar 5. Perlemakan organ hati... 31
Gambar 6. Kerja GPT di otot dan hati ... 34
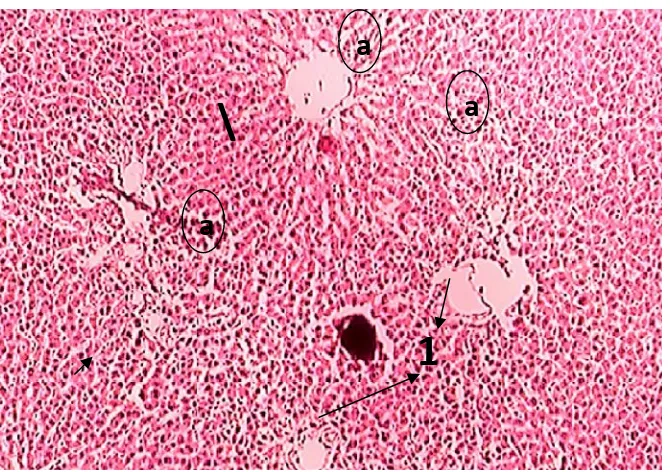
Gambar 7. Indikasi infeksi cacing ... 51
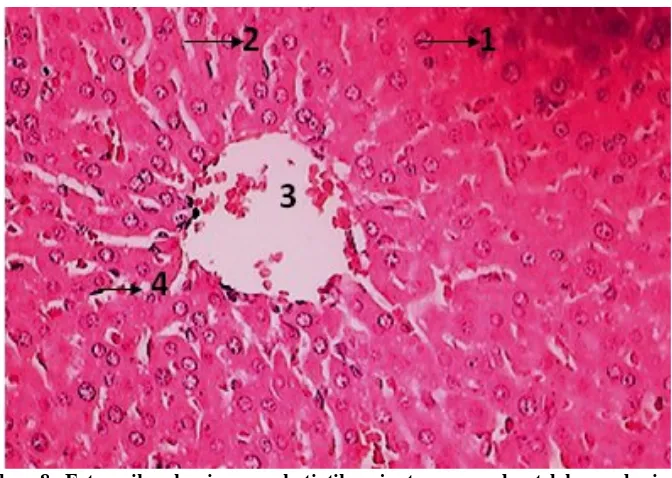
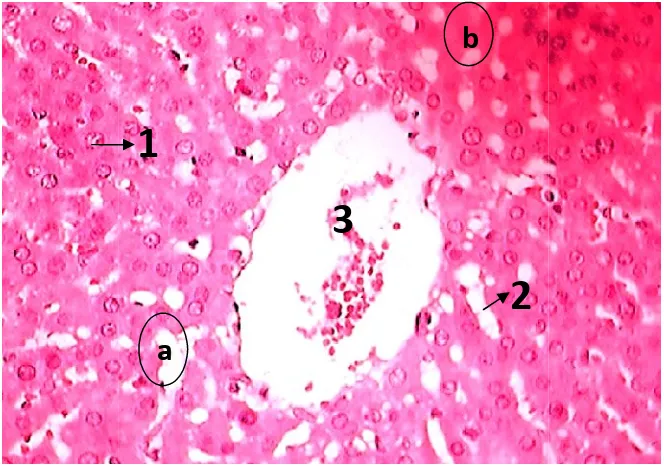
Gambar 8. Foto mikroskopi organ hati tikus jantan normal setelah pemberian air minum Aqua 25 ml/kgBB dengan pengecatan Hematoksilin-Eosin (HE), perbesaran 400x. Keterangan : (1) hepatosit; (2) sinusoid; (3) vena sentralis; (4) sel Kupffer... 52
Gambar 9. Foto mikroskopi organ hati tikus jantan hemorrhage (a) dan degenerasi hidrofik (b) setelah pemberian air minum Aqua 25 ml/kgBB dengan pengecatan HE, perbesaran 400x. Keterangan : (1) hepatosit; (2) sinusoid; (3) vena sentralis ... 53
xix
wortel 1,094 g/kgBB dengan pengecatan HE, perbesaran
400x. Keterangan : (1) hepatosit; (2) sinusoid; (3) vena
sentralis ... 54
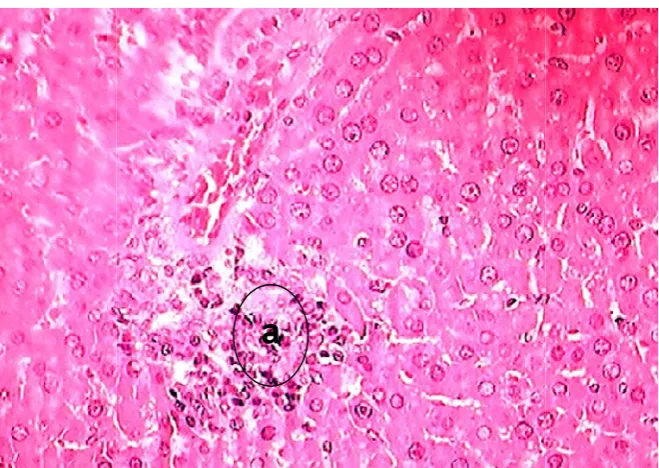
Gambar 12. Foto mikroskopi organ hati tikus jantan yang mengalami
radang akut PMN (a) setelah pemberian jus wortel 1,094
g/kgBB dengan pengecatan HE, perbesaran 400x.
Keterangan : (1) hepatosit; (2) sinusoid; (3) vena sentralis ... 55
Gambar 13. Foto mikroskopi organ hati tikus jantan yang mengalami
nekrosis (a) dan timbul jaringan ikat fibroblast (b) setelah
pemberian jus wortel 1,094 g/kgBB dengan pengecatan HE,
perbesaran 400x. Keterangan : (1) hepatosit; (2) sinusoid ... 56
Gambar 14. Foto mikroskopi organ hati tikus jantan yang mengalami
degenerasi hidrofik (a) multifokal, nekrosis (b) multifokal,
dan timbul jaringan ikat fibroblast (c) setelah pemberian jus
wortel 1,094 g/kgBB dengan pengecatan HE, perbesaran
100x. Keterangan : (1) vena sentralis... 56
Gambar 15. Foto mikroskopi organ hati tikus jantan yang mengalami
nekrosis (a), degenerasi hidrofik (b), dan peradangan akut
PMN (c) setelah pemberian jus wortel 2,188 g/kgBB dengan
pengecatan HE, perbesaran 400x. Keterangan : (1) hepatosit;
xx
pemberian jus wortel 2,188 g/kgBB dengan pengecatan HE,
perbesaran 100x. Keterangan : (1) vena porta; (2) arteria
hepatika ... 58
Gambar 17. Foto mikroskopi organ hati tikus jantan yang mengalami
nekrosis (a), degenerasi hidrofik(b), dan hemorrhage (c)
setelah pemberian jus wortel 4,375 g/kgBB dengan
pengecatan HE, perbesaran 400x. Keterangan : (1) hepatosit;
(2) sinusoid... 59
Gambar 18. Foto mikroskopi organ hati tikus jantan yang mengalami
nekrosis (a) difus dengan jaringan ikat fibroblast (b), dan
degenerasi hidrofik (c) multifokal, serta hemorrhage (d)
setelah pemberian jus wortel 4,375 g/kgBB dengan
pengecatan HE, perbesaran 100x. Keterangan : (1) vena porta 59
Gambar 19. Foto mikroskopi organ hati tikus jantan yang mengalami
nekrosis (a) dan degenerasi hidrofik (b) setelah pemberian jus
wortel 8,750g/kgBB dengan pengecatan HE, perbesaran
400x. Keterangan : (1) hepatosit; (2) vena sentralis ... 60
Gambar 20. Konversi β-karoten menjadi vitamin A... 64
Gambar 21. Grafik batang aktivitas ALT sebelum perlakuan. Keterangan:
xxi
4 (JW 8,750 g/kgBB) ... 65
Gambar 22. Grafik batang aktivitas ALT pada hari pertama setelah
perlakuan. Keterangan: Kontrol negatif (Aqua 25 ml/kgBB);
D1 = Dosis 1 (Jus Wortel (JW) 1,094 g/kgBB); D2 = Dosis 2
(JW 2,188 g/kgBB); D3 = Dosis 3 ( JW 4,375 g/kgBB); dan
D4 = Dosis 4 (JW 8,750 g/kgBB) ... 66
Gambar 23. Grafik batang aktivitas ALT pada hari ke-14 setelah
perlakuan. Keterangan: Kontrol negatif (Aqua 25 ml/kgBB);
D1 = Dosis 1 (Jus Wortel (JW) 1,094 g/kgBB); D2 = Dosis 2
(JW 2,188 g/kgBB); D3 = Dosis 3 ( JW 4,375 g/kgBB); dan
D4 = Dosis 4 (JW 8,750 g/kgBB) ... 67
Gambar 24. Grafik batang aktivitas ALT pada hari ke-0, hari ke-1 dan
hari ke-14. Keterangan: Kontrol negatif (Aqua 25 ml/kgBB);
D1= Dosis 1 (Jus Wortel (JW) 1,094 g/kgBB); D2 = Dosis 2
(JW 2,188 g/kgBB); D3 = Dosis 3 ( JW 4,375 g/kgBB); dan
D4 = Dosis 4 (JW 8,750 g/kgBB). Warna biru= hari ke-0;
warna hijau= hari ke-1; dan warna abu-abu= hari ke-14 ... 69
Gambar 25. Grafik batang rasio organ hati hari pertama setelah perlakuan.
Keterangan: Kontrol negatif = Aqua 25 ml/kgBB; Dosis 1 =
xxii
Gambar 26. Grafik batang rasio organ hati reversibilitas pada hari ke-14
setelah perlakuan. Keterangan: Kontrol negatif (Aqua 25
ml/kgBB); Dosis 1 = Jus Wortel (JW) 1,094 g/kgBB); Dosis
2 = JW 2,188 g/kgBB; Dosis 3 = JW 4,375 g/kgBB); dan
Dosis 4 = JW 8,750 g/kgBB ... 72
Gambar 27. Selisih perubahan berat badan per hari per kelompok
perlakuan. Keterangan: Kontrol negatif (Aqua 25 ml/kgBB);
Dosis 1 = Jus Wortel (JW) 1,094 g/kgBB); Dosis 2 = JW
2,188 g/kgBB; Dosis 3 = JW 4,375 g/kgBB); dan Dosis 4 =
JW 8,750 g/kgBB ... 73
Gambar 28. Selisih perubahan jumlah pakan per hari per kelompok
perlakuan. Keterangan: Kontrol negatif (Aqua 25 ml/kgBB);
Dosis 1 = Jus Wortel (JW) 1,094 g/kgBB); Dosis 2 = JW
2,188 g/kgBB; Dosis 3 = JW 4,375 g/kgBB); dan Dosis 4 =
JW 8,750 g/kgBB... 74
Gambar 29. Perubahan jumlah minum per hari per kelompok perlakuan.
Keterangan: Kontrol negatif (Aqua 25 ml/kgBB); Dosis 1 =
Jus Wortel (JW) 1,094 g/kgBB); Dosis 2 = JW 2,188
g/kgBB; Dosis 3 = JW 4,375 g/kgBB); dan Dosis 4 = JW
xxiii
Halaman
Lampiran 1. Penentuan dosis dari konsentrasi... 84
Lampiran 2. Konversi dari dosis terendah ke konsetrasi terendah ... 84
Lampiran 3. Perhitungan pemberian volume pada tikus... 84
Lampiran 4. Foto umbi wortel yang digunakan... 85
Lampiran 5. Foto jus wortel konsentrasi 35% dan 4,376% ... 85
Lampiran 6. Foto blender ... 86
Lampiran 7. Foto cara penimbangan pakan ... 86
Lampiran 8. Kondisi pemeliharaan tikus ... 87
Lampiran 9. Foto tata cara pemberian kode... 87
Lampiran 10. Foto pengambilan sampel darah... 88
Lampiran 11. Foto proses pembedahan ... 88
Lampiran 12. Pengamatan gejala klinis kontrol negatif Aqua 25 ml/kgBB . 89
Lampiran 13. Pengamatan gejala klinis dosis 1 Jus Wortel 1,094 g/kgBB .. 90
Lampiran 14. Pengamatan gejala klinis dosis 2 Jus Wortel 2,188 g/kgBB .. 91
Lampiran 15. Pengamatan gejala klinis dosis 3 Jus Wortel 4,375 g/kgBB .. 92
Lampiran 16. Pengamatan gejala klinis dosis 4 Jus Wortel 8,750 g/kgBB .. 93
Lampiran 17. Analisis statistik berat badan pra perlakuan ... 94
Lampiran 18. Analisis statistik selisih berat badan pasca perlakuan ... 95
Lampiran 19. Analisis statistik aktivitas ALT pra perlakuan ... 100
xxiv
perlakuan H1 ... 103
Lampiran 23. Analisis statistik aktivitas ALT pra perlakuan dan pasca
perlakuan H14 ... 104
Lampiran 24. Berkas pemeriksaan histopatologi... 105
1
A. Latar Belakang
Penggunaan bahan alam untuk pengobatan secara tradisional menjadi
pilihan pertama bagi masyarakat untuk menyembuhkan penyakit. Penggunaan
bahan alam dalam pengobatan biasanya menggunakan takaran yang tidak tentu,
misalnya segenggam, seruas, sebatang, helai, sejumput, yang sulit dipastikan
jumlahnya. Penggunaan obat tradisional yang tidak pasti ini dapat menimbulkan
efek samping dalam penggunaannya dalam pengobatan. Penggunaan takaran yang
lebih pasti dalam satuan gram akan mengurangi kemungkinan terjadinya efek
samping dari obat tradisional karena batas antara obat dan racun dalam obat
tradisional sangat tipis (Sari, 2006).
Wortel merupakan salah satu jenis sayuran yang digunakan untuk
konsumsi, pengobatan, maupun keperluan yang lain (Rukmana, 1995). Dalam
masyarakat, wortel dikonsumsi sebagai makanan dan minuman (dalam bentuk jus
maupun sari). Menurut penelitian yang telah dilakukan, wortel dapat digunakan
sebagai obat anti inflamasi (Hapsari, 2003), analgesik (Putra, 2003), dan sebagai
hepatoprotektif (Nuraeni, 2003). Karena dapat digunakan sebagai hepatoprotektif
maka wortel juga dimungkinkan memiliki aktivitas dalam membunuh sel normal
sehingga menimbulkan efek toksik. Di dalam wortel terdapat kandungan beta
karoten yang berfungsi sebagai antioksidan. Di sisi lain, karotenoid dapat
bahwa kadar Fe dalam hepar tikus yang diberi senyawa karotenoid ternyata lebih
tinggi (Winarsi, 2007). Menurut Halliwell dan Gutteridge (1990), Fe dapat
meningkatkan kadar radikal bebas oksi endogenus melalui reaksi Fenton. Dalam
kondisi yang terkena intensitas cahaya yang tinggi dan kadar oksigen yang tinggi,
beta karoten akan mengalami autooksidasi. Produk oksidasi dari beta karoten
adalah apo 8, 10, 12, dan 14-karotenal yang apabila tidak segera dinetralkan oleh
antioksidan lain seperti tokoferol dan vitamin C, dapat menginisiasi kerusakan sel
seperti neolpasma (Null, 2000).
Konsumsi beta karoten berlebih dapat meningkatkan mortalitas dengan
resiko relatif 1,06 (Bjelakovic, Nikolova, Gluud, Simonetti, & Gluud, 2007).
Berbeda dengan pernyataan sebelumnya, menurut penelitian yang lain, beta
karoten dapat mengurangi resiko terjadinya kanker.
Hati merupakan organ penting dalam metabolisme dan ekskresi, yang
bertugas dalam proses detoksifikasi. Hati merupakan organ yang sangat rentan
karena posisinya dalam sirkulasi cairan badan. Sebagian besar toksin masuk ke
dalam saluran gastrointestinal, dan setelah diserap toksin dibawa oleh vena portae
ke hati (Lu, 1995). Karena fungsi hati sebagai organ ekskresi sangat berhubungan
erat dengan darah maka kondisi hati biasanya dapat diketahui melalui pengujian
sampel darah melalui pengukuran aktivitas Alanin Aminotrasnferase (ALT). ALT
merupakan suatu enzim yang hanya ditemukan di hepatosit. Ketika suatu sel
mengalami kerusakan, enzim akan menyebar dan masuk ke dalam darah.
Peningkatan aktivitas ALT secara drastis menunjukkan bahwa hati mengalami
melihat pengaruh pemberian akut jus wortel (Daucus carota L.) pada tikus jantan
Wistar: kajian terhadap organ hati dan aktivitas Alanin Aminotransferase.
1. Permasalahan
Dari latar belakang, timbul permasalahan yang menarik untuk diteliti lebih
dekat, yaitu:
a. Bagaimana gejala, wujud, sifat dan mekanisme efek toksik jus wortel (Daucus
carota L.)?
b. Berapa LD50jus wortel (Daucus carota L.)?
c. Bagaimana pengaruh akut jus wortel (Daucus carota L.) terhadap keadaan
histopatologi organ hati tikus jantan Wistar?
d. Bagaimana pengaruh akut jus wortel (Daucus carota L.) terhadap aktivitas
ALT tikus jantan Wistar?
e. Bagaimana korelasi antara hasil pengamatan histopatologi organ hati dengan
aktivitas ALT ?
2. Keaslian penelitian
Dari pustaka yang ditemukan, telah banyak pengujian terhadap wortel baik
dalam bentuk jus maupun sari.
a. Antaraksi Sari Wortel (Daucus carota L.) – Parasetamol : Kajian Terhadap
Kehepatotoksikan dan Kinerja Toksikokinetika Parasetamol pada Tikus
(Wijoyo, 2001)
Pra perlakuan sari wortel efektif dalam menggeser kinerja farmakokietika
parasetamol. Semakin tinggi dosis sari wortel maka kecepatan pembentukan
b. Daya Antiinflamasi Infusa Umbi Wortel (Daucus carota L.) pada Mencit
Jantan (Hapsari, 2002)
Infusa Umbi Wortel memiliki daya anti inflamasi pada mencit jantan.
c. Efek Hepatoprotektif Air Perasan Umbi Wortel (Daucus carota L.) terhadap
Mencit Jantan yang Terinduksi CCl4(Nuraeni, 2003)
Dosis efektif air perasan umbi wortel pada mencit 20 gram terinduksi CCl4
sebesar 12,189 ml/kgBB. Efek hepatoprotektif ditandai dengan menurunnya
aktivitas ALT dan menurunnya derajat kerusakan sel hati mencit akibat
induksi CCl4.
d. Efek Analgesik Air Perasan Umbi Wortel (Daucus carota L.) pada Mencit
Putih Betina (Putra, 2003)
Air perasan umbi wortel memiliki efek analgesic pada mencit putih betina
yang ditunjukkan dengan adanya penurunan persen geliat.
e. Efek Hepatoprotektif Kombinasi Jus Wortel (Daucus carota L.) dan Apel
Hijau (Pyrus malus L.) Pada Mencit Jantan yang Terinduksi Parasetamol
(Widyaningrum, 2004)
Kombinasi Jus wortel dan apel dengan perbandingan 1:2 merupakan
kombinasi yang mampu memberikan efek hepatoprotektif yang paling baik.
f. Efek Hepatoprotektif Sari Umbi Wortel (Daucus carota L.) pada Tikus Jantan
Terinduksi Parasetamol : Kajian terhadap Lama masa Praperlakuan (Wijoyo,
2004)
Membuktikan bahwa sari wortel selama 6 hari efektif memberikan efek
g. Daya Analgesik Kombinasi Jus Wortel (Daucus carota L.) dan Apel Hijau
(Pyrus malus L.) Pada Mencit Betina (Berchmans, 2005)
Kombinasi jus yang dibuat adalah 1:1 untuk 100 ml. Kombinasi jus ini yang
memiliki daya analgesik yang paling optimum.
h. Kombinasi Sari Wortel (Daucus carota L.) dan Tomat (Lycopersicon
lycopersicum) sebagai Hepatoprotektor Mencit Terinduksi Parasetamol
(Febriyana, 2005)
Kombinasi sari wortel dan tomat memiliki efek hepatoprotektif. Kombinasi
yang paling baik, yaitu dengan perbandingan 1:1.
i. Pengaruh Pra Perlakuan Beta Karoten secara Per Oral terhadap Aktivitas
Glutation S Transferase Hati Tikus Menggunakan Substrat 1 Kloro 2, 4
Dinitobenzen (Prasojo, 2005)
Pemberian beta karoten secara per oral meningkatkan aktivitas Glutation S
Transferasehati.
j. Pengaruh Perlakuan Perasan Umbi Wortel (Daucus carota L.) secara
Subkronis terhadap Gambaran Histopatologi Hepar Tikus Jantan dan Betina
(Mayana, 2006)
Spektrum efek toksik pada hepar tikus jantan dan betina akibat pemberian
perasan umbi wortel adalah hiperemi multifokal, hemorrhage, dan degenerasi
melemak.
k. Pengaruh Perlakuan Beta Karoten secara Per Oral terhadap Aktivitas
Glutation S TransferaseKelas MU Hati Tikus dengan Substrat 1,2 Dikloro 4
Perlakuan beta karoten secara per oral dapat meningkatkan aktivitas glutation
S transferase kelas MU. Glutation S transferase kelas MU merupakan
antioksidan alami yang ada di dalam tubuh.
l. Toksisitas Akut Sari Wortel (Daucus carota L.) Kajian terhadap Organ
Lambung, Ginjal, dan Hati pada Mencit Putih Betina Galur Balb/c (Karlina,
2009)
LD50 semu>16,7 ml/kgBB. Terjadi radang pada lambung dan ginjal yang
bersifat terbalikan, serta nekrosis pada organ hati (24 jam setelah perlakuan).
Terjadi peningkatan aktivitas ALT yang bermakna tetapi tidak untuk kadar
kreatinin serum.
m. Pengaruh Pemberian Akut Jus Wortel (Daucus carota L.) Pada Tikus Jantan
Wistar: Kajian terhadap Organ Ginjal dan Kadar Kreatinin Serum (Thejo,
2009)
Ginjal mengalami hemorrhage, nekrosis tubulus dan glomerulus, namun tidak
mematikan (LD50 semu>8,750 g/kgBB). Kadar kreatinin tidak menunjukkan
adanya perubahan yang bermakna dan tidak berkorelasi dengan kondisi ginjal.
Namun, sejauh pengetahuan peneliti, belum ada penelitian tentang
pengaruh pemberian akut jus wortel (Daucus carota L.) pada tikus jantan Wistar:
3. Manfaat penelitian
a. Manfaat teoritis
Mendapat data-data ilmiah yang berguna untuk pengembangan penggunaan
jus wortel dalam pengobatan dan dapat digunakan sebagai acuan untuk
penelitian lain yang berhubungan dengan jus wortel.
b. Manfaat praktis
Jus wortel dapat berkembang menjadi salah satu cara pengobatan alami
dengan biaya yang murah serta memiliki batas keamanan yang terjamin.
B. Tujuan Penelitian
Penelitian ini betujuan untuk :
1. Mengetahui gejala, wujud, sifat dan mekanisme efek toksik jus wortel.
2. Mengetahui LD50jus wortel.
3. Mengetahui pengaruh akut jus wortel terhadap keadaan histopatologi organ
hati tikus jantan Wistar.
4. Mengetahui pengaruh akut jus wortel terhadap aktivitas ALT tikus jantan
Wistar.
5. Mengetahui korelasi antara hasil pengamatan histopatologi organ hati dengan
8
A. Toksisitas Akut
Uji toksisitas akut merupakan uji toksisitas dengan pemberian suatu
senyawa pada hewan uji pada suatu saat. Toksisitas akut dinyatakan sebagai LC50
(Median Lethal Concentrasion), LD50 (Median Lethal Dose) atau TLM (Toleran
Limit Median) yaitu besar kadar atau dosis yang dalam kondisi spesifik dapat
menyebabkan kematian setengah jumlah populasi dalam jangka waktu tertentu.
Waktu yang digunakan untuk pengamatan berkisar kurang lebih 7-14 hari,
pengamatan juga dilakukan dalam waktu 24 jam setelah pemberian dan
pengamatan tersebut meliputi (1) gejala-gejala klinis, (2) jumlah hewan uji yang
mati, dan (3) hispatologi organ (Donatus, 1990).
Nilai LD50 yang diperoleh dapat digunakan untuk:
1. Menentukan potensi toksisitas akut suatu obat;
2. Menentukan ukuran batas aman penggunaan suatu obat (safety margin,
theraupetic index), yaitu membandingkan nilai LD50dengan ED50-nya sebagai
patokan; dan
3. Sebagai pedoman atau patokan dalam menentukan dosis suatu penelitian atau
sediaan obat pada pengembangan obat-obat baru.
Harga LD50 atau LC50 serta cara pemberian, yaitu secara oral suatu
lama pengamatan tidak ditunjukkan dianggap bahwa pengamatan dilakukan
selama 24 jam (Loomis, 1978).
Berdasarkan atas peristiwa timbulnya efek toksik senyawa, dalam
toksikologi ada empat asas yang perlu diperhatikan, yaitu kondisi, mekanisme
aksi, wujud, dan sifat efek toksik (Donatus, 1990).
1. Kondisi efek toksik
Kondisi efek toksik adalah berbagai keadaan atau faktor yang dapat
mempengaruhi keefektifan absorpsi, distribusi, dan eliminasi zat beracun di dalam
tubuh, sehingga menentukan keberadaan zat kimia utuh atau metabolitnya dalam
sel sasaran serta toksisitasnya atau keefektifan antaraksinya dengan sel sasaran.
Termasuk dalam kondisi efek toksik adalah kondisi pemejanan yang meliputi
jenis pemejanan (akut, subkronis atau kronis), jalur pemejanan (intravaskuler atau
ekstravaskuler), lama dan kekerapan pemejanan, saat pemejanan dan takaran atau
dosis pemejanan, kondisi subyek atau makhluk hidup meliputi keadaan fisiologi
(misalnya berat badan, umur, suhu tubuh, kecepatan pengosongan lambung,
kecepatan alir darah, status gizi, kehamilan, genetika, jenis kelamin, irama
sirkadian, irama diurnal dan keadaan patologi (misalnya: penyakit saluran cerna,
kardiovaskuler, hati, dan ginjal) (Donatus,1990). Irama diurnal adalah fluktuasi
periodik terjadi selama siang hari. Irama sirkadian adalah fluktuasi periodik yang
kurang lebih teratur dengan lama periode (dari puncak hingga ke puncak) sekitar
2. Mekanisme aksi efek toksik
Zat beracun setelah masuk ke dalam tubuh akan mengalami distribusi
sampai ke cairan intraseluler. Oleh sebab itu, berdasarkan sifat dan tempat
kejadiannya, mekanisme aksi efek toksik zat kimia dibagi menjadi dua, yaitu
mekanisme luka intrasel dan mekanisme luka ekstrasel (Donatus, 1990).
Mekanisme luka intrasel adalah luka sel yang diawali dengan aksi
langsung zat beracun atau metabolitnya pada tempat aksi tertentu di dalam sel
sasaran. Di dalam tubuh, zat beracun mungkin berada dalam bentuk zat kimia
induk atau dalam bentuk metabolit yang reaktif, sebelum berada dalam sel
sasaran. Setelah masuk ke dalam sel sasaran, salah satu atau kedua bentuk
senyawa tersebut, kemungkinan akan berantaraksi dengan sel sasaran molekuler
yang khas atau tak khas, melalui salah satu dari beberapa mekanisme reaksi kimia
yang mungkin. Jadi dalam hal ini, zat kimia induk atau metabolit reaktif zat
beracun, akan bereaksi langsung dengan komponen-komponen molekuler sel,
melalui serangkaian reaksi kimia tertentu. Sasaran molekuler ini meliputi
membran sel (lipid, reseptor, protein, dll), inti sel (DNA), sitosol (enzim),
mitokondria (produksi energi) dan retikulum endoplasmik (sintesis protein dan
lain-lain) (Donatus, 1990).
Mekanisme luka ekstrasel terjadi secara tak langsung artinya: zat beracun
pada awalnya bereaksi di lingkungan luar sel dengan akibat terjadinya luka di
dalam sel, karenanya mekanisme ini juga disebut mekanisme tak langsung atau
sekunder. Oleh karena itu, bila zat beracun yang berada di lingkungan ekstrasel
menimbulkan perubahan struktur atau fungsi sel. Hal ini dapat terjadi bagi
kelangsungan hidup sel, dibutuhkan pasok oksigen dan unsur hara, serta
lingkungan cairan ekstrasel yang optimal berkaitan dengan komposisi elektrolit
dan asam-basa (Donatus, 1990).
3. Wujud efek toksik
Wujud efek toksik pada dasarnya merupakan perubahan biokimia,
fungsional dan struktural. Namun, tidak berarti bahwa efek toksik zat beracun
sepenuhnya dapat terpisah dengan tegas ke dalam tiga jenis wujud dasar efek
toksik itu, melainkan sering kali merupakan campuran, karena ketiganya
merupakan proses yang saling berkaitan. Kebanyakan perubahan struktural
merupakan wujud akhir dari perubahan fungsional dan atau biokimiawi. Jenis
toksik berdasarkan perubahan biokimiawi, meliputi jenis wujud efek toksik yang
berkaitan dengan respon dan perubahan atau kekacauan biokimia terhadap luka
sel, akibat antaraksi antara zat beracun dan tempat aksi tertentu, yang sifatnya
terbalikan. Termasuk dalam jenis wujud efek toksik ini, diantaranya
penghambatan respirasi sel, perubahan keseimbangan cairan elektrolit dan
gangguan pasok energi. Jenis efek toksik berdasarkan perubahan fungsional
meliputi jenis efek toksik yang berkaitan dengan antaraksi zat beracun dengan
reseptor atau tempat aktif enzim yang sifatnya terbalikkan, sehingga dapat
mempengaruhi fungsi homeostatis tertentu. Termasuk dalam jenis wujud efek
toksik ini diantaranya anoksia, gangguan pernafasan, gangguan sistem saraf pusat,
hipertensi atau hipotensi, hiper atau hipoglikemia, perubahan keseimbangan
hipertermi. Efek toksik berdasarkan perubahan struktural, meliputi jenis wujud
efek toksik yang berkaitan dengan perubahan morfologi sel yang akhirnya
terwujud sebagai kekacauan struktural. Sehubungan dengan masalah ini, terdapat
respon hispatologi dasar sebagai tanggapan terhadap adanya luka sel. Yakni
degenerasi, proliferasi dan inflamasi atau perbaikan. Degenerasi dan proliferasi
merupakan respon ekstrasel berbagai wujud atau bentuknya seperti degenerasi
melemak, nekrosis, mutagenesis, karsinogenesis, dan lain sebagainya
(Donatus,1990).
4. Sifat efek toksik
Pada dasarnya hanya terdapat dua jenis efek toksik zat beracun, yakni
terbalikkan dan tak terbalikkan. Ciri khas dari wujud efek toksik yang terbalikkan
meliputi:
a) bila kadar racun yang ada dalam tempat aksi atau reseptor tertentu telah habis,
maka reseptor tersebut akan kembali kekedudukan semula,
b) efek toksik yang ditimbulkan akan cepat kembali normal, dan
c) ketoksikan beracun bergantung pada takaran serta kecepatan absorpsi,
distribusi dan eliminasi racunnya.
Ciri khas dari wujud efek toksik yang tak terbalikkan meliputi:
a) kerusakan yang terjadi sifatnya menetap,
b) pemejanan berikutnya dengan racun akan menimbulkan kerusakan yang
sifatnya sama sehingga memungkinkan terjadinya penumpukan efek toksik,
c) pemejanan dengan takaran yang sangat kecil dalam jangka panjang akan
menimbulkan efek toksik yang seefektif dengan yang ditimbulkan oleh
pemejanan racun dengan takaran besar dalam jangka pendek (Donatus, 1990).
Toksisitas merupakan sifat relatif yang digunakan dalam membandingkan
suatu senyawa dengan senyawa lain dengan menunjuk ke suatu efek berbahaya
atas jaringan biologis tertentu (Loomis, 1978). Terjadinya efek toksik suatu
senyawa diakibatkan oleh antaraksi senyawa tersebut dengan tempat aksinya, baik
secara langsung maupun tidak langsung. Bahan-bahan yang dapat menyebabkan
kerusakan pada sistem biologis disebut sebagai racun. Bahan-bahan tersebut dapat
berasal dari sumber alam maupun sintesis (Cassaret & Doull, 1975).
5. Kekerabatan dosis respon
Konsep dasar bahwa tidak ada zat kimia yang benar-benar aman, demikian
pula bahwa tidak ada zat kimia yang seharusnya dianggap sebagai benar-benar
berbahaya. Konsep ini didasarkan atas suatu premis bahwa zat kimia apapun dapat
diijinkan untuk bersentuhan dengan mekanisme biologi tanpa menimbulkan efek
tertentu atas mekanisme biologi tersebut, asalkan kadar zat kimia tersebut
diperbolehkan bersentuhan dengan mekanisme biologi tertentu, jadi satu-satunya
faktor yang paling penting yang menentukan potensi bahaya atau amannya suatu
senyawa adalah hubungan antara zat kimia itu dan efek yang ditimbulkannya atas
mekanisme biologi tertentu (Loomis, 1978).
Bila zat kimia itu mampu menimbulkan efek yang dapat diamati, seperti
sepenuhnya sembuh dalam periode waktu tertentu, maka dosis atau kadar zat
kimia itu dapat dipilih agar dapat menimbulkan efek tersebut (Loomis, 1978).
Data respon yang dapat diamati dari suatu perbedaan toksisitas dapat digolongkan
menjadi 2 tipe, yaitu:
a) Data tipe sama sekali ada atau sama sekali tidak ada respon, biasa disebut
respon kuantal, yaitu: respon yang mana efek yang diamati hanya ada dua
kemungkinan: ada atau tidak ada respon. Misalnya pada uji toksisitas data
respon berupa kematian atau tetap hidup.
b) Data tipe bertingkat atau respon gradual, yang mana respon yang diberikan
hewan uji akan bertingkat sesuai dengan intensitas pemejanan pada hewan uji
(Loomis, 1978).
Salah satu bentuk respon dalam uji toksisitas dapat berupa kematian
hewan uji yang dipilih. Dengan demikian akan tampak bahwa terdapat sejumlah
hewan yang menunjukkan efek kematian pada dosis yang menyebabkan kematian.
Jika dosis tersebut dinaikkan atau diturunkan akan tampak adanya perbedaan
jumlah hewan yang mengalami kematian pada tiap-tiap kelompok (Loomis,
1978).
Hubungan dosis respon dapat dinyatakan juga dalam bentuk hubungan
dosis dengan kumulatif respon. Kurva tersebut dapat diubah menjadi berbentuk
linear dengan mengubah respon dalam satuan probit. Kurva hubungan dosis
respon dapat digunakan untuk mengetahui dosis yang dapat menyebabkan lima
dosis tersebut bisa disebut Median Lethal Dosage(LD50), jika dinyatakan dengan
lethal concentrasion disebut Lethal Concentrasion (LC50) (Loomis, 1978).
6. Gejala efek toksik
Pengamatan gejala klinis dimulai dengan mengamati perubahan pada kulit,
mata, membran mukosa, sistem sirkulasi, sistem saraf autonom dan sistem saraf
pusat, aktivitas somatomotor, tingkah laku, dan sebagainya. Beberapa tanda
farmakotoksik seperti tremor, convulsion, salvasi, diare, lethargy, mengantuk,
morbiditas, fasciculation, mydriasis, miosis, droppings, discharges, atau
hypotonia(Hayes, 2001).
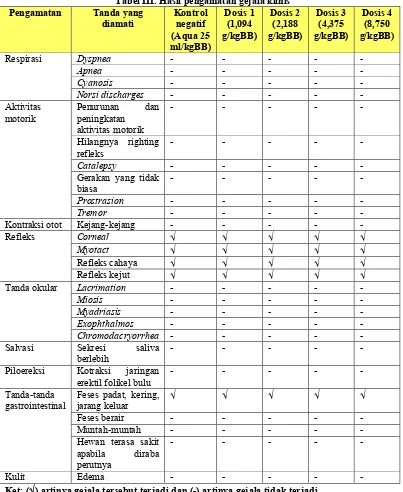
Tabel I. Gejala klinis dalam uji ketoksikan akut (Hayes, 2001) Pengamatan & pemeriksaan Tanda-tanda umum ketoksikan
Respirasi Dyspnea, Apnea, Cyanosis, dan Nostril Discharger. Aktivitas motorik Pengurangan dan peningkatan aktivitas motorik, refleks
balik badan, catalepsy, gerakan yang tidak biasa, prostrasion, dan tremor.
Convulsion Kejang-kejang
Refleks Corneal eyelid closure, Myotact, Cahaya, Refleks kejut Tanda-tanda Okular Lacrimation, Myosis, Mydriasis, Exophthalmos,
Chromodacryorrhea Salivasi Pengeluaran saliva berlebih
Piloereksi Kontraksi jaringan erektil pada folikel rambut yang menyebabkan bulu berdiri dan kasar
Tanda-tanda gastrointestinal Keadaan Feses, Vomiting, Keadaan Urin, Sakit di daerah perut dan punggung
Kulit Edema
a) Respirasi
Dyspneaadalah tanda dimana hewan uji sulit bernafas. Apneaditandai dengan
hilangnya kemampuan hewan uji untuk bernafas. Cyanosis ditandai dengan
timbulnya warna biru di sekitar hidung, ekor, dan kaki. Nostril discharges
b) Aktivitas motorik
Catalepsy ditandai dengan kecenderungan hewan berdiam pada posisi
tertentu.Prostrasion merupakan tanda dimana hewan berdiam tanpa bergerak
sama sekali (Hayes, 2001).
c) Kontraksi pada Otot
Kejang-kejang merupakan tanda dari gejala keracunan dimana otot
berkonstraksi sangat cepat dan tidak terkendali (Hayes, 2001).
d) Refleks
Corneal eyelid closure adalah tanda dari refleks menutupnya kelopak mata
ketika disentuh. Myotactadalah kemampuan hewan uji untuk menarik kembali
kaki belakang ketika ditarik. Refleks kejut meliputi refleks terhadap stimulasi
luar berupa sentuhan maupun suara (Hayes, 2001).
e) Tanda Okular
Lacrimation adalah keluarnya air mata yang berlebihan, bening ataupun
berwarna. Miosis adalah kontraksi pupil tanpa memperdulikan ada tidaknya
cahaya. Mydriasis aadalah dilatasi pupil tanpa memperdulikan ada tidaknya
cahaya. Exophthalmos ditandai dengan penonjolan bola mata yang tidak
normal. Chromodacryorrhea ditandai dengan pengeluaran air mata yang
berwarna (Hayes, 2001).
f) Tanda gastrointestinal
Feses padat dan kering menunjukkan bahwa sistem pencernaan hewan uji
sistem pencernaan. Hewan uji terasa sakit ketika di raba perutnya
menunjukkan bahwa organ hatinya mengalami kelainan (Hayes, 2001).
g) Kulit
Edema ditunjukkan dengan adanya pembengkakan cairan pada jaringan
(Hayes, 2001).
7. Median Lethal Dosage(LD50)
LD50 didefinisikan sebagai dosis tunggal suatu zat yang secara statistik
diharapkan akan membunuh 50% hewan uji. Nilai LD50sangat berguna untuk
hal-hal sebagai berikut:
a) Kegunaan pertama adalah klasifikasi zat kimia sesuai dengan toksisitas
relatifnya. Klasifikasi lazim adalah sebagai berikut:
Tabel II. Tabel klasifikasi ketoksikan suatu senyawa (Lu, 1995)
Kategori LD50
Luar biasa toksik 5 mg/kg atau kurang Sangat toksik 5-50 mg/kg
Cukup toksik 50-500 mg/kg Sedikit toksik 0,5-5 g/kg Praktis tidak toksik 5-15 g/kg Relatif kurang berbahaya > 15 g/kg
b) Kegunaan lain dari LD50adalah dalam evaluasi dampak keracunan yang tidak
disengaja; perencanaan penelitian toksisitas sub akut dan kronik pada hewan;
memberikan informasi tentang (1) mekanisme toksisitas; (2) pengaruh umur,
seks dan faktor lingkungan; (3) variasi respon antar spesies dan antar strain
hewan; memberikan informasi tentang reaktifitas suatu populasi hewan;
memberikan sumbangan bagi informasi yang dibutuhkan dalam merencanakan
pencemaran toksik serta perubahan fisik yang mempengaruhi bioavailabilitas
(Lu, 1995).
B. Wortel (Daucus carota L.)
1. Sistematika Tanaman
Dalam sistematika tanaman, tanaman wortel dapat diklasifikasikan sebagai
berikut:
Kingdom : Plantae
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledoneae
Bangsa : Umbelliflorae
Suku : Apiaceae
Marga : Daucus
Jenis : Daucus carota L. (Hutapea, 1993)
2. Cultivar
Wortel dapat dikelompokkan menjadi dua cultivar, yaitu: eastern carrot
dan western carrot. Eastern carrot biasanya berwarna kuning atau ungu,
contohnya: purple dragon carrot, purple haze carrot, dan solar yellow carrot.
a b c
Gambar 1. Foto purple dragon carrot (a), purple haze carrot(b), dan solar yellow carrot (c) (Anonim, 2009).
Western carrot biasanya berwarna orange. Contohnya: Chantenay carrot,
Danvers carrot, Imperator carrot, danNantes carrot(Anonim, 2009a)
a b
c d
Gambar 2. Foto Chantenay carrot (a), Danvers carrot (b), Imperator carrot (c), dan Nantes carrot(d) (Anonim, 2009a).
Chantenay memiliki bentuk umbi bulat panjang dengan ujung tumpul, panjang
panjang dengan ujung runcing (seperti kerucut), panjang umbi sekitar 20-30 cm,
rasa kurang manis. Nantesmemiliki bentuk umbi bulat pendek dengan panjang
5-6 cm dan bulat agak panjang 10-15 cm (Cahyono, 2002).
3. Sinonim
Tanaman wortel memiliki beberapa sinonim, yaitu : Daucus sativus,
carrot dalam Bahasa Inggris, boktel dalam bahasa Sunda, wortel dalam bahasa
Jawa, dan ortel dalam Bahasa Madura (Dalimartha, 2007).
4. Penelaahan Pustaka
a) Deskripsi
Tanaman wortel merupakan jenis tanaman rerumputan yang menyimpan
cadangan makanannya di dalam umbi. Mempunyai batang pendek, berakar
tunggang yang bentuk dan fungsinya berubah menjadi umbi bulat dan
memanjang. Umbi berwarna kuning kemerah-merahan, berkulit tipis, dan jika
dimakan mentah terasa renyah dan agak manis (Cahyono, 2002).
b) Kandungan kimia
Dalam 100 g umbi wortel mengandung 37 kkalori, protein 1,1 g, serat 0,9
g, Kalsium 36 mg, zat besi 1,2 mg, karoten 4,2 mg, tiamin 0,06 mg, riboflavin
0,05 mg, niasin 0,7 mg, dan vitamin C 8 mg (Ashari, 2006). Kandungan lain yang
terkandung dalam umbi wortel adalah saponin dan polifenol (Hutapea, 1993).
c) Khasiat
Wortel biasanya dikonsumsi dalam bentuk jus. Jus wortel memiliki banyak
manfaat, yakni: sebagai hepatoprotektif (Widyaningrum, 2004), sebagai agen
hepatitis, mencegah stroke dan rabun senja, hipoglikemia, diare, sembelit,
mengobati cacing kremi, dan asma (Dalimartha, 2007).
Wortel bersifat sebagai pembersih darah dan mendorong keluar sisa
metabolisme sel tubuh melalui ginjal sehingga dapat mencegah pengendapan
sisa-sisa metabolisme yang memicu munculnya penyakit batu ginjal dan saluran kemih
(Perry dan Metzger, 1980).
5. Keterangan lain
Terlalu banyak mengkonsumsi wortel akan membuat warna kulit menjadi
jingga kekuningan. Ini disebabkan tubuh tidak mampu menyerap karoten yang
berlebih, atau justru tubuh tidak mampu memproses karoten yang terdapat di
dalam wortel. Akibatnya warna tersebut muncul pada kulit. Sebuah studi
menunjukkan rata-rata 50 mg beta karoten sehari dapat membuat kulit berubah
warna dalam 10 hari (Thezza, 2007).
C. Beta Karoten
Beta karoten merupakan pigmen karotenoid yang terjadi secara alami pada
tanaman, biasa diperoleh dari konsumsi sayur yang berwarna hijau dan kuning.
Beta karoten merupakan prekursor vitamin A yang berperan meningkatkan efikasi
kemoterapi dan radiasi pada kultur sel kanker manusia maupun hewan uji
Beta karoten berfungsi sebagai:
1. Penangkap oksigen singlet. Hal ini menunjukkan bahwa beta karoten dapat
mengurangi efek toksik dari proses oksidasi yang terjadi secara alamiah
(Nuraeni, 2003).
2. Antioksidan. Antioksidan adalah senyawa yang dapat menyumbangkan satu
atau lebih elektron kepada radikal, sehingga aktivitas radikal tersebut dapat
diredam (Suhartono, Fujiati, & Aflanie, 2002). Beta karoten dapat
menetralkan senyawa radikal bebas yang bersifat reaktif. Senyawa radikal
bebas dapat menyebabkan kerusakan lapisan lemak pada membran sel yang
dapat menimbulkan terjadinya kanker (Nuraeni, 2003).
Gambar 3. Struktur β-karoten (Winarsi, 2007).
Karotenoid dapat mempertahankan siklus sel, meningkatkan komunikasi
sel, menghambat transformasi malignan serta memacu apoptosis dan diferensiasi.
Karotenoid tidak tidak stabil terhadap cahaya dan oksigen (Winarsi, 2007).
Di sisi lain, menurut Halliwell dan Gutteridge (1990) karotenoid dapat
berperan sebagai prooksidan, yang dimodulasi oleh Fe dalam jaringan. Ditemukan
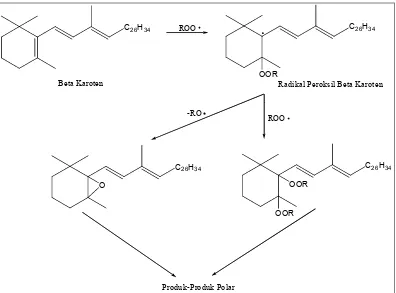
bahwa kadar Fe dalam hepar tikus yang diberi canthaxanthinternyata lebih tinggi.
C26H34 C26H34
OOR
C26H34
OOR OOR
ROO
C26H34
O
Produk-Produk Polar
Beta Karoten Radikal Peroksil Beta Karoten
ROO
-RO
Gambar 4. Penangkapan radikal peroksil (ROO●) oleh β-karoten (Kennedy & Liebler, 1992).
Ketika aktivitas prooksidan karotenoid terjadi dalam sel normal, akan dihasilkan
kerusakan oksidatif yang menekan integritas sel dan menginduksi transformasi
neoplastik. Namun, ketika bertindak sebagai prooksidan di dalam sel yang telah
mengalami transformasi, senyawa tersebut akan berpotensi sebagai antioksidan
(Masotti, Casali, & Galeotti, 1988).
Beta karoten bersifat fotooksidatif dan fotosensitif. Artinya dalam kondisi
yang terkena intensitas cahaya yang tinggi dan kadar oksigen yang tinggi maka
beta karoten akan mengalami autooksidasi. Produk oksidasi dari beta karoten
adalah apo 8, 10, 12, dan 14-karotenal yang apabila tidak segera dinetralkan oleh
antioksidan lain seperti tokoferol dan vitamin C, dapat menginisiasi kerusakan sel
memicu metabolisme asam retinoat. Akibatnya, asam retinoat di jaringan
menurun sehingga memicu terjadinya proliferasi sel dan pembentukan sel kanker
(Siems, Sommerburg, Schild, Augustin, Langhans, & Wiswedel, 2002).
Studi in vitro menunjukkan bahwa retinal dan apo karotenal memiliki
toksisitas yang tinggi. Reaksi antara produk oksidatif dengan asam amino
mengakibatkan penurunan jumlah asam amino bebas dalam sel. Hal ini akan
menyebabkan kegagalan translokasi nukleotida adenin, meningkatkan stres
oksidatif dalam mitokondria (Siems et al, 2002). Murata dan Kawanishi (2000)
menyimpulkan bahwa anion radikal superoksida yang dibentuk akibat proses
autooksidasi beta karoten yang kemudian didismutasi dengan H2O2 yang dapat
merusak DNA. Dengan terjadinya kerusakan DNA maka terjadi gangguan dalam
biosintesis protein.
Konsumsi beta karoten (25 mg/hari) atau vitamin C dan E menunjukkan
bahwa subjek yang tidak merokok atau tidak mengkonsumsi minuman keras, beta
karoten dapat sangat menurunkan resiko kanker, namun pada perokok, beta
karoten justru meningkatkan resiko kanker (Baron, Cole, Mott, Haile, Grau,
Church, Beck & Breenberg, 2003). Konsumsi beta karoten berlebih dapat
meningkatkan mortalitas dengan resiko relatif 1,06 (Bjelakovicet al,2007).
Beta karoten dikonversi menjadi vitamin A di dinding usus (Ophardt,
2003). Beta karoten dioksidasi oleh 15,15 dioksigenase menjadi dua molekul
retinal yang kemudian dioksidasi menjadi asam retinoat (Redmon, Gentlemen,
Retinol (vitamin A) diperoleh dari reduksi retinal. Asam retinoat dapat
berperan sebagai agen kemopreventif, menghambat karsinogenesis, dan sebagai
agen diferensiasi (Patrick, 2000). Kelebihan retinol atau vitamin A
(hipervitaminosis) ditandai dengan gejala, yaitu: pusing, sakit kepala, mual dan
muntah, nafsu makan menurun, kulit mengelupas, meningkatnya serum
transaminase (Anonim, 2009f).
D. Hati 1. Definisi
Hati merupakan organ terbesar yang berada di bagian kanan atas abdomen.
Di dalam hati terjadi metabolisme yang sangat kompleks. Organ ini terlibat dalam
metabolisme makanan, obat, dan toksin (Lu, 1995).
Hati mensintesis dan mengeluarkan empedu yang terdiri dari air dan lemak
(berupa garam empedu), pigmen empedu (seperti bilirubin). Empedu sangat
berperan penting dalam proses absorbsi dan ekskresi (Stine & Brown, 1996). Hati
sangat memiliki peranan penting dalam mempertahankan hidup dan berperan
hampir di seluruh fungsi metabolisme tubuh, bertanggung jawab lebih dari 500
aktivitas. Hati memiliki kapasitas cadangan yang besar, hanya memerlukan
10-20% fungsi jaringan untuk mempertahankan hidup (Price & Wilson, 1982).
2. Mikroskopi hati
Hati dibungkus oleh lapisan yang tebal, terdiri dari serabut kolagen dan
jaringan elastis yg disebut Kapsul Glisson (Anonim, 2009b). Hati memiliki 2
struktur yang dinamakan lobulus. Lobulus hati merupakan struktur silinder yang
panjang beberapa millimeter dan garis tengah 0,8 sampai 2 milimeter. Lobulus
hati dibentuk di sekitar vena sentralis dan menuju vena cava. Lobulus terdiri dari
lempeng-lempeng sel hati yang tersusun radial mengelilingi vena sentralis.
Struktur utama dalam lobus meliputi: hepatosit, vena sentralis, sinusoid, sel
Kupffer, saluran empedu (Allen, 2002). Di antara lempengan hati terdapat
kapiler-kapiler (kanal) yang dinamakan sinusoid, yang merupakan cabang dari vena porta
dan arteria hepatika. Sinusoid, tidak seperti kapiler lain, sinusoid dilapisi oleh sel
fagosit yang disebut sel Kupffer. Sel Kupffer merupakan sistem retikuloendotel,
dan fungsi utamanya adalah untuk menelan bakteri dan benda asing lain dalam
darah (Price & Wilson, 1982). Sel Kupffer berfungsi untuk membantu
pembersihan sel darah merah (Allen, 2002).
Hepatosit (sel parenkim hati) bertanggung jawab terhadap peran sentral
hati dalam memetabolisme. Sel ini terletak di antara sinusoid yang terisi darah dan
saluran empedu (Lu, 1995). Penggantian sel parenkim yang mati oleh proliferasi
sel cadangan, hanya dapat berlangsung bila sel-sel jaringan masih mampu
bertambah banyak. Sel tubuh terbagi menjadi 3 golongan berdasarkan
kemampuan untuk regenerasi: sel labil, sel stabil dan sel permanen. Sel labil dan
sel stabil dapat berproliferasi sepanjang hidupnya, sebaliknya sel permanen tidak.
Sel stabil mampu beregenerasi, tapi dalam keadaan normal tidak bertambah
banyak secara aktif, sebab masa hidupnya dapat bertahun-tahun, atau sampai
Pemulihan parenkim tidak hanya tergantung dari kemampuan sel
beregenerasi. Namun keutuhan struktur dan kerangka jaringan juga sangat
penting. Pada hati yang cedera, jika retikulum masih utuh maka akan terjadi
regenerasi sel hati yang teratur dan struktur lobulus yang normal dan fungsinya
akan pulih kembali (Robin & Kumar, 1995).
3. Komponen penyusun
a) Enzim
Enzim adalah protein yang membantu kerja sel. Beberapa enzim serum
digunakan sebagai indikator kerusakan hati. Ketika sel rusak, enzim akan
menyebar ke dalam darah akibatnya jumlah enzim dalam darah meningkat. Enzm
tertentu akan meningkat dengan nyata pada keadaan kolestatik, tetapi hanya
meningkat sedikit pada nekrosis hati (Lu, 1995). Di dalam hati terdapat beberapa
enzim yang bekerja, yakni:
1) Alanine aminotransferase (ALT) – adalah enzim yang paling banyak
ditemukan di hati dan sangat baik digunakan untuk deteksi hepatitis
(Anonim, 2009c).
2) Alkaline phosphatase(ALP) – Enzim ini dijumpai dalam konsentrasi yang
tinggi di sel hepatohilien, tulang, usus dan plasenta, sel kanker tertentu
juga memproduksi enzim ALP (Anonim, 2009c)
3) Aspartate aminotransferase (AST) – enzim yang ditemukan di hati dan
sedikit ditemukan di tempat lain, khususnya di hati dan otot lain. SGOT
4) Gamma-glutamyl transferase(GGT) – Enzim ini banyak terdapat didalam
jaringan hepatobilier, ginjal dan pankreas. Selain dijumpai pula pada
prostate dan otak. GTT digunakan untuk mengetahui adanya hepatobilier
statis, ileus obtruktif. Untuk membedakan penyakit tulang dan hati. Untuk
memantau konsumsi alkohol (Anonim, 2009c).
b) Bilirubin
Bilirubin, suatu sisa buangan dari pengrusakan sel darah, merupakan suatu
campuran yang kuning yang menyebabkan penyakit kuning dan air seni gelap
ketika jumlahnya meningkat. Kadar bilirubin dalam darah merupakan indeks
fungsi hati, tetapi relatif tidak peka. Kadar bilirubin akan menurun jika hati
mengalami kerusakan (Lu,1995).
c) Protein
Pengeluaran konsentrasi total protein dapat digunakan untuk mendeteksi
kerusakan protein di dalam hati. (Anonim, 2009c).
4. Fungsi
Hati memiliki fungsi yang sangat banyak seperti:
a) Membentuk dan mengekskresikan empedu.
Garam empedu sangat penting untuk pencernaan dan absorpsi lemak dan
vitamin yang larut lemak di usus.
b) Memetabolisme karbohidrat, protein dan lemak
Karbohidrat diubah dan disimpan dalam hati dalam bentuk glikogen. Protein
berperan dalam sintesis kolesterol, sebagian diekskresikan ke dalam empedu
sebagai kolesterol atau asam kolat.
c) Menyimpan vitamin dan mineral
Vitamin yang larut lemak dan mineral (seperti: tembaga dan besi) disimpan di
dalam hati.
d) Detoksifikasi
Hati bertanggungjawab dalam biotransformasi zat berbahaya menjadi zat yang
tidak berbahaya yang kemudian diekskresikan oleh ginjal.
e) Metabolisme steroid
Hati menginaktifkan dan mengekskresikan aldosteron, glukokortikoid,
estrogen, progesteron, dan testosteron (Price & Wilson, 1982).
5. Pengamatan makroskopi
Organ hati yang normal berwarna merah tua dengan konsistensi kenyal.
Warna kuning pucat menunjukkan bahwa terjadi perlemakan pada organ hati
(Rachmawati & Hamid, 2006).
6. Jenis kerusakan hati
Jenis efek toksik pada beberapa organel dalam sel hati mengakibatkan
berbagai jenis kerusakan hati, seperti:
a) Radang Polimorfonuklear (PMN)
Radang merupakan suatu bentuk perlawanan akut dari respon imun untuk
melawan senyawa asing. Ciri-ciri serta fungsi lekosit polimorfonuklear
(PMN), monosit atau makrofag sangatlah berbeda satu dengan yang lain.
yang dianggap sebagai pemberi komando pembunuhan, sedang monosit (MN)
rata-rata waktu paruhnya kira-kira 3 bulan. PMN hanya dapat melakukan
fagositosis terhadap partikel-partikel yang telah mengalami opsonisasi
(stimulasi fagositosis) oleh antibodi bersama dengan komplemen, dan
makrofag dapat melakukan endositosis tanpa opsonin atau dengan komplemen
jika ada opsonin (pada jalur alternatif) (Hargono, 1996).
b) Degenerasi
Degenerasi adalah perubahan sel akibat luka. Degenerasi sel
mempengaruhi sitoplasma sel. Ada beberapa tipe degenerasi, yaitu:
1) Degenerasi Albuminous
Merupakan degenerasi yang disebabkan oleh kerusakan ringan. Ditandai
dengan terjadinya pembengkakan sel dan granulasi di sitoplasma. Jika
terjadi di organ hati, maka pembengkakan sel akan meningkatkan tekanan
pembuluh kapiler darah. Bersifat terbalikan. Jika berlanjut akan berubah
menjadi degenerasi hidrofik dan nekrosis total (Hegazy, 2009)
2) Degenerasi hidrofik
Merupakan jenis degenerasi yang ditandai dengan adanya air di dalam sel
yang terlihat seperti vakuola di dalam sitoplasma (Hegazy, 2009).
3) Degenerasi melemak
Gambar 5. Perlemakan organ hati (Hegazy, 2009).
4) Degenerasi Hyaline
Ditandai dengan adanya perubahan mikroskopi pada sel yang
mengakibatkan sel menjadi homogen dan kehilangan struktur (Hegazy,
2009).
c) Perlemakan hati (Steatosis)
Perlemakan hati adalah hati mengandung berat lipid lebih dari 5%. Lesi
dapat bersifat akut dan kronis. Etionin, fosfor, tetrasiklin dapat mengakibatkan
lesi akut sedangkan etanol dapat mengakibatkan lesi kronis. Tetrasiklin
menyebabkan banyaknya butiran lemak kecil dalam sel dan etanol menyebabkan
butiran besar lemak yang menggantikan inti sel. Rusaknya pelepasan trigliserida
hati ke plasma merupakan salah satu mekanisme yang umum yang mendasari
terjadinya penimbunan lipid di hati (Lu, 1995).
d) Nekrosis hati
Nekrosis hati adalah kematian hepatosit. Biasanya nekrosis merupakan
kerusakan akut. Nekrosis hati merupakan manifestasi toksik yang berbahaya tetapi
tidak selalu kritis karena hati mempunyai kapasitas pertumbuhan kembali yang
luar biasa. Kematian sel terjadi bersamaan dengan pecahnya membran plasma.
pecah. Namun ada beberapa perubahan yang mendahului kematian sel. Perubahan
morfologik awal berupa edema sitoplasma, dilatasi retikulum endoplasma, dan
disagregasi polisom (Lu, 1995).
Radikal yang secara kovalen mengikat protein dan lipid tidak jenuh akan
menyebabkan peroksidasi lipid. Membran sel kaya akan lipid peroksida. Karena
itu, membran sel sangat rentan. Perubahan kimia dalam membran akan
menyebabkan pecahnya membran itu. Perubahan biokimia lain adalah habisnya
Adenosine Trifosfat (ATP), hilangnya ion kalsium, bergesernya keseimbangan
Na+dan K+ antara hepatosit dan darah, habisnya glutation, rusaknya sitokrom
P-450, dan hilangnya NAD dan NADP (Lu, 1995). Nekrosis dapat dibedakan atas
lokasi dan luasnya, yaitu:
1) nekrosis fokal, merupakan nekrosis pada sekelompok kecil sel parenkim
hati.
2) nekrosis zonal atau multifokal, merupakan nekrosis yang terjadi pada
sekelompok sel dalam zona sentralobuler, midzonal, dan periportal.
3) nekrosis massif atau difus, merupakan nekrosis yang terjadi pada seluruh
sel pada lobulus sel (Zimmerman, 1978).
e) Kolestatis
Kolestatis merupakan jenis kerusakan akut, namun jarang ditemukan. Jenis
kerusakan ini sangat sulit diinduksi pada hewan kecuali dengan steroid.
Mekanisme utama dari kolestatis adalah berkurangnya aktivitas ekskresi empedu
f) Sirosis
Sirosis ditandai dengan adanya septa kolagen yang tersebar di sebagian
besar hati. Kumpulan hepatosit muncul sebagai nodul yang dipisahkan oleh
lapisan berserat ini. Sirosis tampaknya berasal dari nekrosis sela tunggal karena
kurangnya mekanisme perbaikan. Kemudian keadaan ini menyebabkan aktivitas
fibroblastik dan pembentukan jaringan parut. Tidak cukupnya aliran darah ke hati
menjadi faktor pendukung sirosis (Lu, 1995).
E. ALT
Alanin Aminotransferase (ALT) disebut juga Serum Glutamic Pyruvic
Transaminase (SGPT) adalah enzim yang hanya berada di hepatosit (sel hati).
ALT adalah indikator terjadinya kerusakan hati yang paling sensitif. Enzim
berada pada pada bagian sitosol dan mitokondria hepatosit (Anonim, 2002). ALT
mendeteksi adanya kerusakan pada membran sel atau distorsi enzim (Gaskill,
Miller, Mattoon, Hoffmann, Burton & Gelens, 2005). Pada keadaan nekrosis, sel
hati akan pecah, Alanin Aminotranferase akan keluar dan masuk ke dalam
pembuluh darah. Akibatnya aktivitas enzim meningkat. Akan lebih baik jika
penetapan aktivitas ALT disertai dengan pemeriksaan histopatologi untuk
memastikan adanya nekrosis sel (Zimmerman, 1978). Pengujian ALT bertujuan
untuk melihat integritas hepatosit. ALT berfungsi mengkatalisi asam amino dalam
siklus asam sitrat (Giannini, Testa & Savarino, 2005).
ALT lebih sensitif dibanding Aspartate aminotransferase (AST) atau
pesat daripada Aspartate
kerusakan (Anonim, 2002).
Penilaian terhadap hasil
hati mengalami kerusakan
mengalami sirosis, tumor
tikus putih adalah 12,6 ± 4,40 IU/I (
Enzim ALT
sebaliknya, yang terlihat pada gambar 5
Gamba
Enzim ALT stabil
(Anonim, 2009e). Waktu
kurang dari 24 jam pada
aktivitas ALT akan meningkat p
semula 1 sampai 2 ming
Aspartate aminotransferase (AST) ketika sel hati
(Anonim, 2002). Enzim AST meningkat jika terjadi kerusakan
terhadap hasil pengukuran: jika aktivitas ALT meningkat
mengalami kerusakan akut (hepatitis). Jika peningkatan
sirosis, tumor hati, penyakit kuning yang kronis. Kadar
tikus putih adalah 12,6 ± 4,40 IU/I (Wibowo, Maslachah, Bijanti, 2009
berfungsi dalam metabolisme alanin menjadi
sebaliknya, yang terlihat pada gambar 5.
Gambar 6. Kerja ALT di Otot dan Hati (Anonim, 2009d).
ALT stabil selama 24 jam dalam penyimpanan pada
2009e). Waktu paroh dari aktivitas ALT adalah 60 jam pada
jam pada kucing. Ketika terjadi kerusakan pada
ALT akan meningkat pada 12 jam pertama dan akan kembali
sampai 2 minggu kemudian. Peningkatan aktivitas ALT
sel hati mengalami
terjadi kerusakan kronis.
meningkat drastis artinya
peningkatan sedang, hati
adar normal ALT
, 2009).
menjadi piruvat atau
(Anonim, 2009d).
n pada suhu 20-25oC
60 jam pada anjing dan
kerusakan pada jaringan hati,
dan akan kembali ke keadaan
dengan jumlah hepatosit yang rusak, yang dapat membantu dalam m