PPREPARASI DAN KARAKTERISASI CaO/Al3+-BENTONIT SEBAGAI
KATALIS PADA SINTETIS BIODIESEL DARI MINYAK JARAK PAGAR (Jatropha Curcas L)
SKRIPSI
ARIESTA FAULINA F
PROGRAM STUDI S-1 KIMIA
DEPARTEMEN KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS AIRLANGGA
PREPARASI DAN KARAKTERISASI CaO/Al3+-BENTONIT SEBAGAI
KATALIS PADA SINTETIS BIODIESEL DARI MINYAK JARAK PAGAR (Jatropha Curcas L)
SKRIPSI
Sebagai Salah Satu Syarat
untuk memperoleh Gelar Sarjana Sains Bidang Kimia Pada Fakultas Sains dan Tekhnologi
Universitas Airlangga
Oleh:
ARIESTA FAULINA F NIM. 080810503
Tanggal Lulus:
Disetujui oleh:
Pembimbing I,
Abdulloh, S.Si, M.Si
NIP.19710423 199702 1 001
Pembimbing II,
Alfa Akustia Widati, S.Si, M.Si
LEMBAR PENGESAHAN SKRIPSI
Judul : Preparasi dan Karakterisasi CaO/Al3+-Bentonit Sebagai
Katalis Pada Sintesis Biodiesel Dari Minyak Jarak Pagar (Jatropha Curcas L)
Penyusun : Ariesta Faulina F
NIM : 080810503
Pembimbing I : Abdulloh, S.Si, M.Si
Pembimbing II : Alfa Akustia Widati, S.Si, M.Si Tanggal Seminar :
Disetujui Oleh:
Pembimbing I,
Abdulloh, S.Si, M.Si NIP.19710423 199702 1 001
Pembimbing II,
Alfa Akustia Widati, S.Si, M.Si NIK. 139080770
Mengetahui,
Ketua Progam Studi S-1 Kimia
Fakultas Sains dan Teknologi Universitas Airlangga
PEDOMAN PENGGUNAAN SKRIPSI
Skripsi ini tidak dipublikasikan, namun tersedia di perpustakaan dalam lingkungan Universitas Airlangga, diperkenalkan dipakai referensi kepustakaan, tetapi pengutipan harus seijin penyusun, dan harus menyebutkan sumbernya sesuai dengan kebiasaan ilmiah.
KATA PENGANTAR
Puji syukur kehadirat Allah SWT atas segala rahmat dan hidayah-Nya, sehingga penulis dapat menyelesaikan skripsi dengan judul “ Preparasi dan Karakterisasi CaO/Al3+-Bentonit Sebagai Katalis Pada Sintesis Biodiesel
Dari Minyak Jarak Pagar (Jatropha Curcas L)”.
Penulisan skripsi ini tidak lepas dari bantuan dari berbagai pihak. Oleh karena itu, dalam kesempatan ini penulis mengucapkan terima kasih kepada: 1. Bapak Abdulloh, S.Si, M.Si selaku dosen pembimbing I yang telah
meluangkan waktunya untuk memberikan saran, nasehat dan masukan dalam penyelesaian skripsi ini.
2. Ibu Alfa Akustia Widati, S.Si, M.Si. selaku dosen pembimbing II atas bimbingan dan nasehatnya selama penyusunan skripsi ini
3. Ibu Aning Purwaningsih, S.Si, M.Si selaku dosen wali atas motivasi dan dukungan yang telah diberikan.
4. Seluruh staf pengajar atas ilmu yang telah diberikan.
5. Mama, Papa, Satria atas dukungan dan semangat baik moral maupun spiritual demi terselesaikannya skripsi ini
6. Teman-teman kimia angkatan 2008, yang selalu memberi motivasi penuh pada penulis untuk menyelesaikan skripsi ini khususnya ”KF LOVERS”.
Proposal ini disusun untuk memenuhi persyaratan akademis pendidikan sarjana dalam bidang kimia Fakultas Sains dan Teknologi Universitas Airlangga. Penulis menyadari bahwa dalam penulisan skripsi ini masih banyak kekurangan, sehingga kritik dan saran yang membangun sangat diharapkan demi kesempurnaan skripsi ini.
Fardhani, Ariesta Faulina, 2012, Preparasi dan Karakterisasi CaO/Al3+ -Bentonit sebagai Katalis dalam Sintesis Biodiesel dari Minyak Jarak Pagar ( Jatropha Curcas L). Skripsi ini di bawah bimbingan Abdulloh, S.Si, M.Si., dan Alfa Akustia Widati S.Si., M.Si., Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya
ABSTRAK
Telah dilakukan sintesis biodiesel dari minyak jarak pagar yang memiliki kadar asam lemak bebas sebesar 22,40 mgKOH/g atau 11,20% dan kadar air sebesar 0,7% menggunakan katalis CaO/Al3+-bentonit yang memiliki situs asam dan situs basa. Penggunaan CaO/Al3+-bentonit dimaksudkan untuk menghindari reaksi penyabunan bila reaksi dilakukan menggunakan CaO. Preparasi CaO/Al3+ -bentonit dilakukan melalui metode cation exchanged Al3+ pada bentonit diikuti impregnasi dengan CaO.Terbentuknya CaO/Al3+-bentonit ditunjukan oleh adanya pergeseran 2θ dan perubahan dspacing dari bentonit sintetis, Al3+-bentonit, dan CaO/Al3+-bentonit dan perubahan luas permukaan dari bentonit sintetis 23,744 m2/g menjadi 22,158 m2/g setelah dilakukan cation exchanged dengan Al3+ dan menjadi 7,494 m2/g setelah di impregnasi dengan CaO. Jumlah keasaman total setelah dilakukan cation exchanged dan impregnasi meningkat dari 0,3192 mmol/g menjadi 1,0663 mmol/g. Rentang kekuatan kebasaan antara 15,00 < H_<18,4., jumlah total situs basa sebesar 98,64 mmol/g. Hasil uji katalis CaO/Al3+-bentonit pada sintesis biodiesel menunjukkan konversi sebesar 14,81% dan perubahan bilangan dari 22,40 mgKOH/g menjadi 17,99 mgKOH/g pada reaksi selama 5 jam.
Fardhani, Ariesta Faulina, 2012, Preparation and Characterization CaO/Al3+-Bentonit As A Catalysts in the Synthesis Biodiesel of Jatropha Oil ( Jatropha Curcas L). This thesis under the guidance of Abdulloh, S.Si, M.Si., and Alfa Akustia Widati S.Si., M.Si., Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya
ABSTRACT
Biodiesel synthesis has been carried out of Jatropha oil with free fatty acid levels at 22.40 mgKOH / g or 11.20% and moisture content of 0.7% using CaO/ Al3 +-bentonite catalysts have acid sites and base sites. Use of CaO/ Al3 + -bentonite is intended to avoid the saponification reaction when the reaction was carried out using CaO. Preparation CaO/ Al3 +-bentonite through cation method Exchanged Al3 + on bentonite followed by impregnation with CaO. CaO/ Al3 + -bentonite formation indicated by the shift of the 2θ and changes dspacing of synthetic bentonite, Al3 +-bentonite, and CaO/ Al3 +-bentonite and bentonite changes in the surface area of synthetic 23.744 m2 / g to 22,158 m2 / g after the Al3 + cation Exchanged and a 7.494 m2 / g after the impregnation with CaO. Amount of total acidity after cation Exchanged and imprecnation increased from 0.3192 mmol / g to 1.0663 mmol / g and 1,0296. Basicity strength ranges between 15,00 <H_ <18.4., The total number of base sites of 100.4 mmol / g. The test results CaO/ Al3 +-bentonite catalysts in the synthesis of biodiesel showed the conversion of 14.81% and the number changes from 22.40 mgKOH / g to 17.99 mgKOH / g in the reaction for 5 hours.
DAFTAR ISI
JUDUL HALAMAN
Halaman Judul i
Lembar Persetujuan ii
Lembar Pengesahan iii
Pedoman Penggunaan Skripsi iv
2.8 Esterifikasi 21
2.9 Keasaman Katalis 23
2.10 Kebasaan Katalis 24
2.11 Gas Chromatography-Mass Spectrometry (GC-MS) 25
2.12 X-Ray Difraction (XRD) 26
2.13 Spektrofotometri FT-IR (Fourier Transform Infra Red) 28 2.14 Pengukuran Luas Permukaan dengan Metode Burneur
Emmet Teller (BET) 30
3.3 Diagram Alir Penelitian 34
3.4 Metode Penelitian 35
3.5.1 Penentuan luas permukaan katalis 36
3.5.2 Penentuan struktur katalis 36
3.5.3 Penentuan situs asam dan situs basa katalis 37 3.5.3.1 Penentuan situs asam katalis 37 3.5.3.2 Penentuan situs basa katalis 37
3.6.1 Sintesis biodiesel dari crude jatropha oil 38 3.6.2 Sintesis biodiesel dari jatropha oil 38
3.6.3 Karakterisasi biodiesel 39
3.6.3.1 Penentuan kadar air minyak jarak pagar 39
3.6.3.2 Penentuan bilangan asam 39
3.6.3.2 Analisa produk biodiesel 39
BAB 4 HASIL DAN PEMBAHASAN 41
4.1 Preparasi Katalis 41
4.1.1 Preparasi katalis Al3+-bentonit 41 4.1.2 Preparasi katalis CaO/ Al3+-bentonit 41
4.2 Karakterisasi Katalis 41
4.2.1 Luas permukaan katalis 41
4.2.2 Struktur katalis 43
4.2.3 Keasaman katalis 46
4.2.4 Kebasaan katalis 47
4.3 Sintesis dan karakterisasi biodiesel 48
4.3.1 Sintesis biodiesel dari crude jatropha oil menggunakan
katalis Cao/ Al3+-bentonit 48
4.3.2 Sintesis biodiesel dari minyak jarak pagar yang sudah mengalami reaksi esterifikasi oleh H2SO4 (Jatropha-
Oil) meggunakan katalis CaO/ Al3+-bentonit 49
4.3.3 Hasil penentuan bilangan asam 49
4.3.4 Analisa produk GC-MS biodiesel 52
4.3.4.1 Data GC-MS biodiesel dari crude jatropha oil 52 4.3.4.2 Data GC-MS biodiesel dari jatropha oil 54
BAB 5 KESIMPULAN DAN SARAN 57
5.2 Saran 58
DAFTAR TABEL
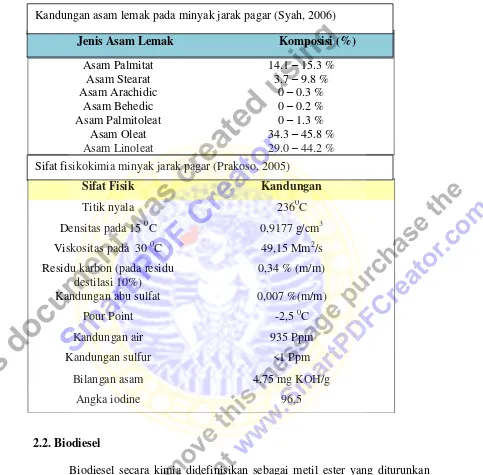
2.1 Kandungan asam lemak dan sifat fisikokimia minyak jarak
pagar 8
2.2 Perbandingan Emisi antara biodiesel dan petrodiesel 9
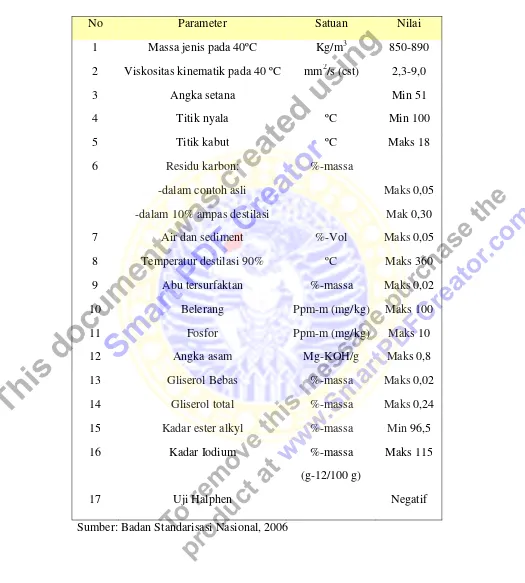
2.3 Standar mutu biodiesel menurut SNI 11
4.1 Hasil penentuan luas area dan volume total pori, menggu-
nakan BET 42
4.2 Perbandingan data XRD dari bentonit sintetis, CaO, Al3+-
Bentonit dan CaO/ Al3+- Bentonit 44
4.3 Hasil perhitungan situs basa 47
4.4 Hasil Perhitungan Bilangan Asam Biodiesel dari Crude
Jatropha Oil 50
4.5 Hasil Perhitungan Bilangan Asam Biodiesel dari Minyak Jarak
yang telah mengalami reaksi esterifikasi dengan H2SO4 51 4.6 Data waktu retensi dan luas puncak kromatogram kromatografi
gas serta senyawa yang diduga dari sampel biodiesel dari Cru-
de Jatropha Oil 53
4.7 Hasil Konversi biodiesel dari Crude Jatropha Oil 53 4.8 Data waktu retensi dan luas puncak kromatogram kromatografi
gas serta senyawa yang diduga dari sampel biodiesel dari Jatro-
pha Oil 55
DAFTAR GAMBAR
2.1 Tumbuhan jarak pagar 6
2.2 Buah dan biji jarak pagar dan struktur senyawa ester phorbol 7
2.3 Diagram energi aktivasi 12
2.4 Struktur 3 dimensi montmorillonit 14
2.5 a. Model stuktur montmorillonit menurut Hofman dan Endel 15 b. Model stuktur montmorillonit menurut Edelman dan Favajee 15 2.6 Mekanisme reaksi transesterifikasi trigliserida dengan
metanol menggunakan katalis CaO 18
2.7 Reaksi transesterifikasi menggunakan metanol 20 2.8 Mekanisme reaksi transesterifikasi dengan katalis basa 20 2.9 Mekanisme reaksi esterifikasi dengan katalis asam 22
2.10 Adsorbsi piridin dalam katalis 23
4.1 Grafik adsorbsi-desorbsi katalis CaO/Al3+-bentonit 44 4.2 Difraktogram bentonit sintetis, CaO, Al3+- Bentonit, dan
CaO/Al3+-Bentonit 45
4.3 Spektrum FT-IR Al3+-Bentonit 47
4.4 Mekanisme reaksi hidrolisis Trigliserida 50
4.5 Grafik Penentuan Bilangan Asam Biodiesel dari Minyak
DAFTAR LAMPIRAN
1. Difaktogram XRD 2. Hasil Analisa BET 3. Spektrum FT-IR 4. Hasil Analisa GC-MS
5. Pembuatan Larutan Baku Asam Oksalat dan Pembakuan KOH
6. Penentuan nilai bilangan asam pada biodiesel dari minyak jarak pagar tanpa melalui reaksi esterifikasi terlebih dahulu (Crude Jatropha Oil) 7. Penentuan nilai bilangan asam pada biodiesel dari minyak jarak pagar
melalui reaksi esterifikasi terlebih dahulu (Jatropha Oil) 8. Jumlah kadar air pada minyak jarak pagar
9. Penentuan Keasaman Total katalis
BAB I
PENDAHULUAN
1.1 Latar Belakang
Konsumsi bahan bakar di Indonesia untuk transportasi dan industri
masih menempati urutan tertinggi yaitu berturut-turut untuk transportasi dan
industri sebesar 37,7% dan 36,2% (Samiarso, 2001). Energi untuk transportasi
dan industri umumnya menggunakan bahan bakar minyak bumi. Cadangan
energi fosil kita semakin hari semakin berkurang sedangkan kebutuhannya terus
meningkat. Perkiraan ekstrem menyebutkan, ketersediaan minyak bumi di
Indonesia dengan tingkat konsumsi terus meningkat 3,5% per tahun dapat
menyebabkan persediaan minyak bumi habis dalam waktu 10-15 tahun lagi.
Setiap hari jutaan barel minyak mentah bernilai jutaan dolar dieksploitasi tanpa
memikirkan bahwa minyak tersebut berasal dari hasil evolusi alam yang
berlangsung selama ribuan tahun, bahkan jutaan tahun yang tidak dapat terulang
lagi pada masa mendatang (Syah, 2006).
Indonesia memiliki kebijakan untuk mengurangi konsumsi energi
berbasis bahan bakar minyak bumi (BBM) di Indonesia yaitu dengan
mengoptimalisasi penggunaan energi yang terbarukan (renewable) dan
mengurangi subsidi BBM. Hal ini dibuktikan dengan adanya Peraturan Presiden
Republik Indonesia Nomor 5 Tahun 2006 tentang Kebijakan Energi Nasional
untuk mengembangkan sumber energi alternatif pengganti Bahan Bakar Minyak
(BBM) dan Instruksi Presiden Nomor 1 Tahun 2006 tentang penyediaan dan
dengan hal tersebut maka perlu dilakukan upaya untuk pencarian sumber energi
alternatif yang terbarukan untuk mengganti minyak bumi. Salah satu alternatif
bahan bakar lain yang dapat terbarukan adalah biodiesel.
Biodiesel merupakan bahan bakar dari minyak nabati yang memiliki sifat
menyerupai minyak diesel/solar (Blair, 2005). Komoditas perkebunan penghasil
minyak nabati yang dapat dimanfaatkan sebagai bahan baku biodiesel cukup
banyak diantaranya minyak kelapa sawit, kelapa, dan jarak pagar. Dibanding
minyak kelapa sawit dan minyak kelapa, peluang minyak jarak pagar sebagai
biodiesel lebih besar. Hal ini karena minyak jarak pagar tidak termasuk dalam
kategori minyak makan (non edible oil). Minyak jarak pagar tidak dapat
dikonsumsi manusia karena mengandung ester phorbol yang beracun (Prakoso,
2005). Dengan demikian, pemanfaatan minyak jarak pagar sebagai bahan baku
biodiesel tidak akan mengganggu stok minyak makan nasional (edible oil).
Tanaman jarak pagar sudah dikenal oleh masyarakat tetapi hanya sebatas
sebagai tanaman pagar atau pembatas bagi petani sedangkan daunnya hanya
digunakan sebagai pakan ternak. Tanaman jarak pagar menghasilkan biji yang
memiliki kandungan minyak cukup tinggi yaitu sekitar 30-50% (Hambali et al.,
2006). Minyak yang dihasilkan dari jarak pagar sangat berpotensi untuk
dimanfaatkan sebagai bahan bakar alternatif. Akan tetapi minyak jarak pagar tidak
dapat digunakan secara langsung sebagai bahan bakar karena nilai viskositas dan
titik nyala minyak jarak pagar cukup tinggi. Nilai viskositas minyak jarak pagar
sebesar 0,9100 g/mL pada suhu 15°C dan titik nyalanya 240°C, nilai ini lebih
dan titik nyalanya 50°C (Kandpal dan Madan, 1994). Viskositas yang terlalu
tinggi membuat bahan bakar teratomisasi menjadi tetesan yang lebih besar
sehingga akan mengakibatkan deposit pada mesin dan titik nyala yang terlalu
tinggi menyebabkan penyalaan terlalu sulit sehingga membutuhkan energi yang
lebih besar untuk menyalakan (Dewajani, 2011). Oleh sebab itu, agar minyak
jarak dapat digunakan sebagai bahan bakar maka perlu dilakukan proses
transesterifikasi, sehingga dihasilkan alkil ester.
Proses transesterifikasi minyak jarak dapat dilakukan dengan
menggunakan katalis basa maupun asam. Laju reaksi transesterifikasi
menggunakan katalis asam membutuhkan suhu yang lebih tinggi dan berlangsung
lebih lambat dibandingkan dengan proses reaksi transesterifikasi menggunakan
katalis basa, karena transesterifkasi menggunakan katalis basa reaksi berlangsung
irreversible (Lee et al., 2009). Namun, reaksi transesterifikasi menggunakan
katalis basa tidak dapat digunakan pada minyak yang memiliki bilangan asam
tinggi (>4 mg-KOH/g) karena dapat menimbulkan reaksi penyabunan sehingga
menimbulkan kesulitan dalam pemisahannya diakhir reaksi (Tiwari et al., 2007).
Oleh karena itu, diperlukan suatu katalis yang dapat digunakan untuk
memproduksi biodiesel dari minyak jarak pagar yang memiliki bilangan asam
tinggi, berlangsung cepat, dan mudah proses pemisahannya. Bilangan asam dapat
diturunkan melalui reaksi esterifikasi menggunakan katalis asam, reaksi sintesis
biodiesel akan berlangsung cepat bila menggunakan katalis basa dan
pemisahannya dari produk hasil reaksi lebih mudah bila menggunakan katalis
Telah dilaporkan bahwa Al3+- Bentonit merupakan katalis asam heterogen
yang dapat digunakan untuk reaksi esterifikasi antara lain Reddy et al (2004)
melakukan reaksi esterifikasi asam suksinat dengan 1-butanol pada pelarut
toluena dan menghasilkan dibutil suksinat sebesar 94%, esterifikasi anhidrida
suksinat dan p-kresol yang menghasikan di-(p-kresil) suksinat sebesar 75%
(Reddy et al., 2005) dan esterifikasi asam stearat dengan p-kresol yang
menghasilkan p-kresil stearat sebesar 96% (Vijayakumar et al., 2011). Al3+-
Bentonit sangat efektif digunakan sebagai katalis disebabkan kation yang berada
pada lapisan bentonit dengan rasio jari-jari =6 dibandingkan dengan Ca2+ maupun
Na+ (Reddy et al., 2005). Adapun katalis basa heterogen yang telah banyak diteliti
dan dilaporkan untuk memproduksi biodiesel adalah CaO. Kouzhu et al (2008)
melaporkan penggunaan CaO pada reaksi transesterifikasi minyak kedelai
menghasilkan lebih dari 99% metil ester pada reaksi selama 2 jam. Berdasarkan
uraian tersebut diatas akan disintesis biodiesel dari minyak jarak pagar
menggunakan katalis yang memiliki situs asam dan basa atau katalis bifungsional,
yaitu CaO/Al3+-Bentonit.
1.2 Perumusan Masalah
Berdasarkan latar belakang yang telah diuraikan, maka dapat dirumuskan
masalah sebagai berikut :
1.bagaimanakah karakteristik CaO/Al3+-Bentonit, yang meliputi luas permukaan,
situs aktif (asam dan basa) dan strukturnya?
2.apakah Bentonit yang dimodifikasi menjadi CaO/Al3+-Bentonit dapat
pagar (Jatropha curcas L) dan crude Jatropha oil yang memiliki bilangan
asam lebih dari 4 mg-KOH/g?
3.berapakah jumlah konversi biodiesel yang dihasilkan dari reaksi menggunakan
katalis CaO/Al3+-Bentonit?
1.3 Tujuan Penelitian
Tujuan Penelitian ini adalah sebagai berikut :
1.menentukan karakteristik CaO/Al3+-Bentonit yang meliputi situs aktif (Asam
dan basa), luas permukaan, dan strukturnya.
2.memodifikasi Bentonit menjadi CaO/Al3+-Bentonit sebagai katalis dalam
pembuatan biodiesel dari minyak jarak pagar (Jatropha curcas L) dan crude
Jatropha oil.
3.mengetahui jumlah konversi biodiesel yang dihasilkan dari reaksi menggunakan
katalis CaO/Al3+-Bentonit?
1.4 Manfaat Penelitian
Dari penelitian ini diharapkan mampu memberikan kontribusi dalam
perkembangan ilmu pengetahuan dan teknologi, terutama dalam pemanfaatan
minyak jarak pagar sebagai alternatif pengganti Bahan Bakar Minyak (BBM)
yang ramah lingkungan dan penggunaan CaO/Al3+-Bentonit sebagai katalis
heterogen serta dapat menambah informasi dan referensi tentang pemanfaatan
BAB 2
TINJAUAN PUSTAKA
2.1 Tanaman Jarak Pagar (Jatropha curcas L)
Tanaman jarak pagar (Jatropha curcas L) merupakan tanaman semak dari
keluarga Euphorbiaceae. Tanaman ini dapat tumbuh cepat dengan ketinggian
mencapai 3-5 meter. Tanaman ini tahan kekeringan dan dapat tumbuh di tempat
dengan curah hujan 200-1500 milimeter pertahun (Syah, 2006). Pohonnya berupa
perdu dengan tinggi tanaman antara 3-6 m, bercabang tidak teratur. Batang
berkayu, silindris, bila terluka mengeluarkan getah. Daun berupa daun tunggal,
berlekuk, bersudut 3 atau 5, tulang daun menjari dengan 5 – 7. Daunnya
dihubungkan dengan tangkai daun. Panjang tangkai daun antara 4 – 15 cm
(Hambali, et al., 2006).
Gambar 2.1 Tanaman Jarak Pagar
Klasifikasi tanaman Jarak Pagar adalah sebagai berikut (Hambali et al., 2006):
Divisi : Spermatophyta
Sub divisi : Angiosspermae
Kelas : Dicotyledonae
Ordo : Euphorbiaceae
Genus : Jatropha
Spesies : Jatropha Curcas linn.
Minyak jarak pagar diperoleh dari biji dengan metode pengempaan panas
atau dengan ekstraksi pelarut. Minyak jarak pagar tidak dapat dikonsumsi
manusia karena mengandung racun yang disebabkan adanya senyawa ester forbol
(Syah, 2006). Komponen asam lemak terbanyak dalam minyak adalah oleat.
Kandungan asam lemak pada minyak jarak pagar dan sifat fisikokimia minyak
jarak pagar dapat dilihat pada Tabel 2.2
Tabel 2.1 Kandungan asam lemak dan sifat fisikokimia minyak jarak pagar
Kandungan abu sulfat 0,007 %(m/m)
Pour Point -2,5 0C
Kandungan air 935 Ppm
Kandungan sulfur <1 Ppm
Bilangan asam 4,75 mg KOH/g
Angka iodine 96,5
2.2. Biodiesel
Biodiesel secara kimia didefinisikan sebagai metil ester yang diturunkan
dari minyak/lemak alami, seperti minyak nabati, lemak hewan, atau minyak
goreng bekas (Julianti, 2006). Biodiesel dapat diperoleh melalui proses reaksi
transesterifikasi antara trigliserida yang berasal dari minyak dengan alkohol dan
bantuan katalis. Selanjutnya, alkil ester dan gliserol dihasilkan dalam reaksi
transesterifikasi (Zappi et al., 2003).
Jenis Asam Lemak Komposisi (%)
Kandungan asam lemak pada minyak jarak pagar (Syah, 2006)
Sifat fisikokimia biodiesel hampir sama dengan bahan bakar diesel. Bahan
bakar fosil memiliki kandungan sulfur, nitrogen, dan metal yang cukup tinggi dan
dapat menyebabkan hujan asam dan efek rumah kaca. Biodiesel tidak
mengandung sulfur dan benzen sehingga lebih ramah lingkungan dan mudah
terurai di alam. Kandungan energi, viskositas, dan perubahan fase relatif sama
dengan bahan bakar diesel yang berasal dari petroleum. Mesin dengan bahan
bakar biodiesel menghasilkan partikulat, hidrokarbon, dan karbon monoksida
yang lebih rendah daripada bahan bakar diesel biasa. Emisi NOx biodiesel juga
lebih rendah daripada mesin diesel dengan bahan bakar diesel (Tat et al., 2000).
Perbandingan emisi antara minyak diesel dan petrodiesel dapat dilihat pada Tabel
2.2.
Tabel 2.2 Perbandingan emisi antara biodiesel dan petrodiesel
Nama Senyawa Satuan Biodiesel Petrodiesel
SO2 Ppm 0 78
Adapun karakteristik bahan bakar diesel yang penting adalah meliputi:
1. Viskositas
Viskositas minyak yaitu mengalirnya volume minyak dalam jumlah
tertentu melalui lubang dengan diameter kecil tertentu. Semakin kecil waktu yang
2. Titik Nyala
Titik adalah titik temperatur terendah yang menyebabkan bahan bakar dapat
menyala. Penentuan titik nyala ini berkaitan dengan keamanan penyimpanan dan
penanganan bahan bakar (Dewajani, 2008).
3. Berat Jenis
Berat jenis adalah perbandingan berat dari volume sampel minyak dengan
air yang volumenya sama pada suhu tertentu (25 0C) (Apriyantono et al., 1989).
4. Angka Setana
Angka setana menunjukkan kemampuan bahan bakar untuk menyala
sendiri (Auto ignition). Angka setana yang tinggi menunjukkan bahan bakar dapat
menyala pada suhu rendah, dan sebaliknya angka setana yang rendah
menunjukkan bahwa bahan bakar baru dapat menyala pada suhu tinggi.
Penggunaan bahan bakar mesin diesel yang mempunyai angka setana tinggi dapat
mencegah terjadinya knocking karena begitu bahan bakar diinjeksikan ke dalam
silinder pembakaran maka bahan bakar akan langsung terbakar dan tidak
terakumulasi. Mesin diesel memerlukan angka setana sekitar 50 (Darmanto dan
5. Angka Asam
Angka asam yang tinggi merupakan indikator biodiesel masih
mengandung asam lemak bebas yang menyebabkan biodiesel bersifat korosif
dan dapat menimbulkan jelaga atau kerak di injektor mesin diesel. Asam lemak
dinilai sebagai penyebab salah satu masalah pada biodiesel (Dewajani, 2008).
2.3 Katalis
Katalis adalah suatu zat yang mempengaruhi laju reaksi. Katalis tidak
berpengaruh pada energi bebas (∆G0), dan juga tidak berpengaruh pada tetapan
keseimbangan (K). Umumnya kenaikan konsentrasi katalis juga menaikkan laju
reaksi, jadi katalis ikut bereaksi namun pada akhir reaksi diperoleh kembali
(Sukardjo, 2002). Pada reaksi transesterifikasi yang dijalankan tanpa
menggunakan katalis membutuhkan suhu 2500C untuk menjalankan reaksi,
dengan katalis basa, reaksi dapat berlangsung pada suhu kamar, sedangkan
dengan katalis asam suhu yang dibutuhkan 100 0C (Krick dan Othmer, 1993)..
Katalis yang sering digunakan adalah asam, basa, penukar ion.
Katalis yang digunakan dapat berupa katalis homogen atau heterogen.
Katalis homogen adalah katalis yang mempunyai fasa sama dengan fasa campuran
reaksinya, sedangkan katalis heterogen adalah katalis yang berbeda fasa dengan
campuran reaksinya. Katalis homogen lebih efektif dibandingkan dengan katalis
heterogen, tetapi pada katalis homogen katalis sukar dipisahkan dari produk dan
sisa reaktannya sedangkan katalis heterogen pemisahan antara katalis dan
produknya serta sisa reaktan mudah dipisahkan. Oleh karena mudah dipisahkan
dari campuran reaksinya dan kestabilannya terhadap perlakuan panas katalis
heterogen lebih banyak digunakan dalam industri kimia (Setyawan dan Handoko,
2003). Keuntungan lain dari katalis heterogen adalah tidak korosif, ramah
terhadap lingkungan, memiliki waktu paruh yang panjang, dan dapat memberikan
aktivitas dan selektivitas yang tinggi (Liu et al., 2008).
Suatu katalis jika sudah terpakai beberapa kali maka aktivitasnya akan
berkurang. Ini berarti bahwa kemampuannya untuk mempercepat reaksi tertentu
telah berkurang. Gejala ini dapat disebabkan oleh beberapa faktor diantaranya
oleh suhu yang terlalu tinggi katalis dapat lumer atau disenter, penyebab lain
katalis dapat bereaksi dengan kotoran yang berasal dari bahan dasar. Bila setelah
beberapa waktu, katalis turun sampai di bawah minimum yang dapat diterima,
katalis tersebut harus berhenti atau apkir. Beberapa katalis yang tidak aktif dapat
diperbaiki lagi dengan jalan reegenerasi, dalam hal ini dipergunakan uap, zat cair,
zat asam atau gas lain. Katalis sering juga diregenerasi dengan pengolahan
2.4 Bentonit
Bentonit adalah istilah perdagangan untuk sejenis lempung yang
mengandung sekitar 85% mineral montmorilonit, yaitu suatu mineral dari hasil
pelapukan, pengaruh hidrotermal, transformasi/devitrivikasi dari tufa gelas yang
diendapkan dalam air dalam suasana alkali. Fragmen sisanya umumnya terdiri
dari mineral kuarsa/kristobalit, feldspar, kalsit, gipsum, kaolinit, plagiokas, illit,
dan lain sebagainya ( Zulkarnaen et al., 1990). Gambar 2.3 menunjukkan struktur
3 dimensi dari montmorillonit.
Gambar 2.4 struktur 3 dimensi montmorillonit (sumber: wijaya, 2002)
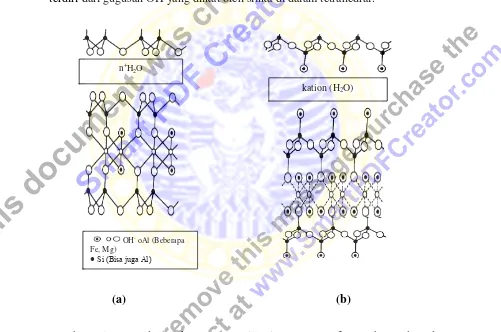
Ada dua macam teori tentang struktur montmorillonit, struktur menurut
Hofmann dan Endell serta struktur menurut Edelman dan Favajee. Kedua teori itu
menunjukkan kemiripan yakni dalam hal struktur unit sel yang dianggap simetris.
tetrahedral. Ikatan antara lapisan relatif lemah dan mempunyai ruang antara
lapisan yang dapat mengembang jika kandungan air meningkat. Perbedaan
struktur Hofman dan Endell dengan struktur menurut Edelman dan Favajee
adalah dalam penyusunan jaringan silika tetrahedral seperti pada Gambar 2.4.
Edelman dan Favajee berpendapat bahwa susunan alternatif dari silika tetrahedral
terwujud dengan ikatan Si-O-Si dengan sudut ikatan 1800, dengan bidang dasar
terdiri dari gugusan OH yang diikat oleh silika di dalam tetrahedral.
(a) (b)
Gambar 2.5 (a) Model struktur montmorillonit menurut Hofmann dan Endell, dan (b) Model struktur menurut Edelman dan Favajee (Bukka et al.,
1992)
Bentonit berdasarkan jenisnya dapat digolongkan menjadi dua jenis yaitu
tipe swelling bentonit dan nonswelling bentonit. Tipe swelling bentonit adalah tipe
bentonit yang dapat mengembang apabila dicelupkan dalam air dan tipe n+H2O
kation (H2O)
OH- oAl (Beberapa Fe, Mg)
nonswelling bentonit adalah tipe bentonit yang kurang dapat mengembang apabila
dicelupkan dalam air.
2.5 Pertukaran Kation
Bentonit berbeda dari clay lainnya karena hampir sebagian besar penyusun
bentonit adalah montmorilonit. Montmorilonit merupakan mineral lempung yang
berkonfigurasi 2:1, yang tersusun dari dua lembar silika tetrahedral dan satu
lembar alumina oktahedral. Pertukaran kation pada bentonit didasarkan pada sifat
permukaan bentonit yang bermuatan negatif, sehingga kation-kation dapat terikat
secara elektrostatik pada permukaan bentonit. Kation-kation yang terserap dapat
dipertukarkan dengan kation lain. Van Olphen (1977) mengatakan kapasitas tukar
kation (KTK) pada montmorillonit kira-kira 70 me/100 g dan luas permukaan
700-800 m2/g.
Selain itu, adanya substitusi isomorfik juga mempengaruhi pertukaran
Kation. Substitusi isomorfik merupakan pergantian kation valensi tinggi oleh
kation valensi rendah dari luar. Subtitusi ini terjadi jika jari-jari kation tidak
banyak berbeda. Adanya substitusi Si4+ oleh Al3+ atau ion Fe3+ pada kerangka
tetrahedral maupun ion Al3+ oleh Mg2+, Fe2+, Li+, Ni2+, atau Cu2+, pada kerangka
oktahedral menyebabkan penurunan muatan. Muatan negatif pada lapisan
diimbangi oleh adsorbsi kation Na+, K+. Cs+, maupun Ca2+ pada interlayer
(Alemdar, et al., 2005). Substitusi isomorfik montmorillonit terjadi pada kerangka
oktahedral. Pada kerangka oktahedral montmorillonit, terjadi penggantian satu
dari setiap enam kation Al3+ oleh kation Mg2+. Sementara pada kerangka
2.6 Kalsium Oksida (CaO)
Kalsium Oksida (CaO) adalah katalis basa yang memiliki waktu hidup
panjang (Liu et al., 2008). Nama lain dari CaO adalah lime, caustic, quicklime,
atau gamping. CaO merupakan oksida basa yang didapat dari batuan gamping
dimana terkandung kalsium oksida sedikitnya 90% dan magnesia 0-5%, kalsium
karbonat, silika, feri oksida terdapat sedikit sebagai pengotor kemurnian.
Ditinjau dari komposisinya, terdapat beberapa jenis gamping. Gamping
hidraulik didapat dari pembakaran batu gamping yang mengandung lempung,
gamping yang berkadar kalsium tinggi lebih dimanfaatkan dalam reaksi
kimia.Kalsium karbonat dan magnesium didapat dari endapan batu gamping,
marmer, kapur (Chalk), dan dolomite atau kulit kerang. Untuk tujuan penggunaan
kimia batu gamping yang lebih murni lebih disukai sebagai bahan awal. Karena
dapat menghasilkan gamping berkadar kalsium tinggi
CaO memiliki sifat higroskopis, titik lelehnya 26000C dan titik didihnya
28500C, tidak larut dalam HCl struktur kristalnya oktahedral, memiliki luas
permukaan 0,56 m2/gr (Ryu et al., 2007).
CaO biasanya digunakan sebagai mortar, industri kertas, industri pupuk,
industri semen, pemutih (Bleaching), dan sebagai katalis (Liu et al., 2008). CaO
memiliki sisi yang bersifat basa dan telah diteliti sebagai katalis basa yang kuat
untuk menghasilkan biodiesel. CaO sebagai katalis basa memiliki banyak
manfaat, misalnya aktivitas yang tinggi, kondisi reaksi yang rendah, masa katalis
yang lama, dan biaya yang murah. CaO sebagai katalis telah dilaporkan dalam
Tahap 1
terjadi saat menggunakan katalis CaO seperti ditunjukkan pada Gambar 2.5
Tahap 3
Gambar 2.6. Mekanisme reaksi transesterifikasi trigliserida dengan metanol menggunakan katalis CaO (Kouzu et al., 2008).
2.7 Transesterifikasi
Transesterifikasi adalah reaksi ester untuk menghasilkan ester baru yang
mengalami penukaran posisi asam lemak (Swern, 1982). Secara umum reaksi
transesterifikasi adalah reaksi antara trigliserida dengan alkohol.
Reaksi transesterifikasi untuk memproduksi biodiesel tidak lain adalah
reaksi alkoholisis, reaksi ini hampir sama dengan reaksi hidrolisis tetapi
menggunakan alkohol. Reaksi ini bersifat reversibel dan menghasilkan alkil ester
dan gliserol. Alkohol berlebih digunakan untuk memicu reaksi pembentukan
produk (Khan, 2002).
Alkohol yang sering digunakan dalam proses reaksi transesterifikasi
adalah metanol karena murah dan memiliki rantai karbon yang lebih pendek (Ma
RO- + BH- (1)
Gambar 2.7 Reaksi transesterifikasi menggunakan metanol (Liu et al., 2007)
Transesterifikasi memerlukan suatu katalis untuk mempercepat laju
reaksi(Dewajani, 2008). Katalis yang banyak digunakan adalah katalis basa,
namun katalis asam juga dapat digunakan terutama pada minyak nabati yang
kadar asam lemak bebasnya tinggi. Katalis basa dinilai lebih baik dari katalis
asam karena dengan katalis basa reaksi dapat berjalan pada suhu lebih rendah,
bahkan pada suhu kamar. Adapun reaksi dengan katalis asam membutuhkan suhu
R'COO CH 2
CH
H2C O -R''COO
+
BH+
R'COO CH2
CH
H2C OH
R''COO + B (4)
Gambar 2.8 Mekanisme reaksi transesterifikasi dengan katalis basa (Lee et al.,
2009)
2.8 Esterifikasi
Esterifikasi adalah reaksi asam lemak bebas dengan alkohol membentuk
ester dan air (Sari, 2009). Dengan esterifikasi, kandungan asam lemak bebas dapat
dihilangkan dan diperoleh tambahan ester. Reaksi ini berlangsung dengan
menggunakan katalis padat atau cair.
Reaksi esterifikasi bersifat reversible. Untuk memperoleh rendemen tinggi
dari ester reaksi harus digeser kearah ester. Hal ini dapat dicapai dengan
menggunakan salah satu pereaksi yang murah secara berlebihan. Sistim katalis
asam umumnya mempunyai laju reaksi yang lambat, karena itu, perbandingan
alkohol terhadap asam lemak harus tinggi (Kusmiati, 2008). Berikut adalah
R C
Gambar 2.9 Mekanisme reaksi esterifikasi dengan katalis asam (Morrison and Boyd, 1975)
Faktor- faktor yang berpengaruh pada proses reaksi transesterifikasi antara
lain:
a. Waktu Reaksi
Semakin lama waktu reaksi maka kemungkinan kontak antar zat
semakin besar sehingga akan menghasilkan konversi yang besar. Jika
kesetimbangan reaksi telah tercapai maka dengan bertambahnya waktu
reaksi tidak akan menguntungkan karena tidak memperbesar hasil.
b. Pengadukan
Pengadukan akan menambah frekuensi tumbukan antara molekul
zat pereaksi dengan zat uang bereaksi sehingga mempercepat reaksi dan
reaksi terjadi sempurna.
c. Katalisator
Katalisator berfungsi untuk mengurangi tenaga aktivasi pada suatu
reaksi sehingga pada suhu tertentu harga konstanta kecepatan reaksi
O
campuran pereaksi (McKetta dan Cunningham, 1978).
d. Suhu Reaksi
Semakin tinggi suhu yang dioperasikan maka semakin banyak
konversi yang dihasilkan.
2.9 Keasaman Katalis
Salah satu aplikasi dari analisis FT-IR adalah penentuan situs asam
Bronsted dan Lewis dari katalis dengan cara adsorbsi basa piridin. Pada spektrum
FT-IR kita dapat mengetahui letak gelombang situs asam Lewis dan Bronsted
dalam litelatur situs asam Lewis akan muncul pada sekitar gelombang 1435-1470
cm-1 dan untuk situs asam Bronstead akan muncul pada sekitar gelombang
1515-1565 cm-1 (Emeis, et al., 1993). Ikatan piridin dengan katalis dapat
digambarkan sebagai berikut.
Keasaman katalis menunjukan densitas keasaman pergram katalis. Jumlah
uap basa yang teradsorpsi oleh permukaan katalis yang kebanyakan menggunakan
gas piridin ekivalen dengan jumlah asam pada permukaan katalis. Peningkatan
keasaman total katalis karena adanya modifikasi katalis menunujukan peningkatan
jumlah situs asam Bronstead dan Lewis pada Katalis. penentuan situs asam pada
katalis dapat dilakukan dengan menggunakan rumus sebgai berikut
Jumlah Keasaman total = Jumlah Piridin teradsorb
Mrpiridin× mBentonit (g)
2.10 Kebasaan Katalis
Situs basa adalah kemampuan menerima proton atau mendonorkan
pasangan elektron (basa Lewis). Sedangkan kekuatan basa ( H_ ) dari permukaan
katalis didefinisikan sebagai kemampuan permukaan katalis untuk mengubah
suatu asam netral yang teradsorb pada basa konjugasinya, atau kemampuan
permukaan katalis untuk mendonorkan sepasang elektron untuk asam yang
tersadsorb (Tanabe et al., 1989).
Penentuan jumlah dan kekuatan situs basa dapat dilakukan dengan
menggunakan metode indikator. Indikator yang biasanya digunakan untuk
menentukan kebasaan katalis adalah indikator Hammet, Indikator universal atau
sistem pH tidak dapat digunakan dalam penentuan situs basa karena sifat basa
katalis disini merupakan basa Lewis bukan basa Arrhenius. Kekuatan situs basa
bergantung pada kemudahan pelepasan proton dari reaksi yang dikatalisis dengan
akan menghasilkan situs basa yang lemah, dan reaksi reaktan dimana proton sulit
dilepaskan akan menghasilkan situs basa yang kuat (Hattori, 1995).
Kekuatan dari situs basa ditunjukkan oleh fungsi dari[H-] dimana [BH]
adalah konsentrasi dari indikator Phenolptalein dan [B-] adalah konsentrasi dari
basa konjugat. pKBH merupakan nilai dari logaritma dari konsentrasi indikator
Phenolptalein [BH] dan ditunjukkan dengan persamaan (Kouzu, et al., 2008) :
[H-] = pKBH + log [B-]/[BH]
Untuk menentukan [H-], konsentrasi dari indikator Phenolptalein[BH] dan
konsentrasi dari basa konjugat[B-] harus diketahui. Ketika larutan BH
terdeprotonasi sebagian dalam suatu larutan, maka nilai [B-] = [BH], dan nilai dari
[H-] = pKBH. Jika nilai pKBH diketahui,maka kekuatan situs basa [H-] dapat
diketahui dengan menghitung perbandingan dari [B-]/[BH] (Yoshio, et al., 2000).
2.11 Gas Chromathography – Mass Spectrometry (GC – MS)
Kromatografi gas digunakan untuk memisahkan komponen campuran
kimia dalam suatu bahan. Komponen yang akan dipisahkan dibawa oleh suatu gas
lembam (gas pembawa) melalui kolom. Campuran cuplikan akan terbagi diantara
gas pembawa fase diam. Fase diam akan menahan komponen secara selektif
berdasarkan koefisien distribusinya, sehingga terbentuk sejumlah pita yang
berlainan pada gas pembawa. Pita komponen ini meninggalkan kolom bersama
dengan aliran gas pembawa dan dicatat sebagai fungsi waktu oleh detector (Mc
Nair et al., 1998).
Prinsip dari instrumen ini adalah menguapkan senyawa organic dan
dan diubah menjadi ion-ion bermuatan positif (ion molekul) yang dapat dipecah
menjadi ion-ion yang lebih kecil. Molekul organik mengalami proses pelepasan
satu elektron menghasilkan ion radikal yang mengandung satu electron tidak
berpasangan. Ion-ion radikal ini akan dipisahkan dalam medan magnet yang akan
menimbulkan arus ion (Satrohamidjojo, 1988).
Kromatografi gas spektroskopi masa ini biasa digunakan pada untuk
analisis kualitatif senyawa organik yang pada umumnya bersifat dapat diuapkan.
Metil ester memenuhi kriteria ini sehingga dapat dianalisis menggunakan
komatografi gas spektroskopi massa. Pemisahan yang dihasilkan dari tiap jenis
senyawa yang dianalisis bersifat khas uuntuk tiap jenis senyawa. Demikian juga
dengan metil ester, ion-ion pecahan dari metil ester diakibatkan penataan ulang
hidrogen dan pecahan satu ikatan yang dipisahkan dari gugus C=O (Cresswell et
al., 1982).
2.12 X-Ray Difraction (X-RD)
Sinar X merupakan jenis gelombang elektromagnet dengan rentang
panjang gelombangnya antara 0,5 Å – 2,5 Å Bila sinar X berinteraksi dengan
materi akan mengalami fenomena optik seperti hamburan, difraksi, pantulan,
maupun transmisi. Apabila materi bersruktur kristal, maka sinar X yang mengenai
bidang-bidang kristal akan didifraksikan/dihamburkan pada sudut tertentu (Susita
et al., 2008).
Apabila sinar X monokromatis mengenai material kristal, maka setiap
bidang kristal akan memantulkan atau menghamburkan sinar X kesegala arah.
sinar X pantulan tertentu saja. Interferensi saling memperkuat apabila sinar X
yang sefase mempunyai selisih lintasan kelipatan bulat panjang gelombang (λ).
Pernyataan ini dinamakan hukum Bragg untuk difraksi kristal, secara matematis
dapat dituliskan dalam bentuk persamaan (Whiston, 1991).
2 d sin θ = n λ
Keterangan:
d = Jarak antar bidang atom yang berhubungan (Ǻ)
θ = Sudut hamburan
n = Orde difraksi
λ = Panjang gelombang dari sinar X(Ǻ)
Dari informasi sudut hamburan (2θ) dan apabila panjang gelombang sinar
X telah diketahui maka akan dapat dihitung jarak antar bidang atom. Setelah
diketahui jarak antar bidang atom, selanjutnya dapat digunakan untuk menghitung
indeks Miller dari bidang-bidang atom maupun orientasi pertumbuhan kristal serta
parameter kisinya.
Apabila sinar X monokromatis mengenai material kristal, maka setiap
bidang kristal akan memantulkan atau menghamburkan sinar X kesegala arah.
Interferensi terjadi hanya antara sinar-sinar pantul sefase sehingga hanya terdapat
sinar X pantulan tertentu saja. Interferensi saling memperkuat apabila sinar X
yang sefase mempunyai selisih lintasan kelipatan bulat panjang gelombang (λ).
Pernyataan ini dinamakan hukum Bragg untuk difraksi kristal, secara matematis
Menurut strukturnya, materi dapat digolongkan menjadi dua yaitu
berstruktur kristal dan yang tidak berstruktur (amorf). Material amorf apabila
dikenai berkas sinar X akan dicirikan oleh spektrum yang kontinyu, tidak ada
puncak-puncak difraksi pada sudut tertentu. Sedang material kristal, apabila
dikenai berkas sinar X akan dicirikan oleh adanya spektrum yang diskrit pada
sudut hamburan tertentu. Kristal (crystals) dapat didefinisikan sebagai suatu
materi yang tersusun atas atom-atom yang tertata secara rapi, berulang (periodik)
dan membentuk pola tiga dimensi. Keteraturan atom-atom yang berulang akan
membentuk suatu kisi-kisi, yang apabila dikenai berkas sinar, atom-atom tersebut
akan berperilaku sebagai kisi difraksi. Oleh karena untuk setiap materi di alam
berstruktur kristal tertentu (artinya mempunyai bidang-bidang, jarak antar bidang,
maupun parameter kisi tertentu), dengan demikian teknik difraksi sinar X dapat
dimanfaatkan untuk deteksi unsur/senyawa yang terkandung dalam suatu materi
dari struktur kristalnya.
Struktur kristal suatu materi berhubungan erat dengan sifat-sifat materi
tersebut, misalnya sifat optik, mekanik, elektrik, maupun termal. Dengan
diketahuinya struktur kristal dari suatu materi, secara tidak langsung dapat pula
diketahui sifat-sifat materi.
2.13 Spektrofotometri FT-IR (Fourier Transform Infra Red)
Spektrofotometri infra-merah adalah sangat penting dalam kimia modern,
terutama dalam bidang kimia organik. Ia merupakan alat rutin dalam penemuan
gugus fungsional, pengenalan senyawa, dan analisa campuran. Kebanyakan
yang berbeda hanya sedikit dari satu molekul ke yang lain tergantung pada
substituen yang lain (Day dan Underwood, 1990).
Pancaran infra-merah pada umumnya mengacu pada bagian spektrum
elektromagnet yang terletak di antara daerah tampak dan daerah gelombang
mikro. Bagi kimiawan organik, sebagian besar kegunaannya terbatas di antara
4000 cm-1 dan 666 cm-1 (2,5 – 15,0 µm). Akhir-akhir ini muncul perhatian pada
daerah infra-merah dekat, 14.290 – 4000 cm-1 (0,7 – 2,5 µm) dan daerah
infra-merah jauh, 700 – 200 cm-1(14,3 – 50 µm) (Silverstein, et al., 1986).
Spektrofotometri infra-merah juga digunakan untuk penentuan struktur,
khususnya senyawa organik dan juga untuk analisis kuantitatif, seperti analisa
kuantitatif pencemaran udara, misalnya karbon monoksida dalam udara dengan
teknik non-dispersive (Khopkar, 2003).
Pada dasarnya Spektrofotometri FT-IR (Fourier Transform Infra Red)
adalah sama dengan spektrofotometri IR dispersi, yang membedakannya adalah
pengembangan pada sistim optiknya sebelum berkas sinar infra-merah melewati.
Faktor-faktor yang mempengaruhi bilangan gelombang pada
Spektrofotometri IR yaitu perubahan massa atom-atom yang ada dalam ikatan,
dan gaya ikatan. Daerah spektra IR dibagi menjadi dua, yaitu :
1. Daerah Frekuensi gugus fungsional
Terletak pada daerah radiasi 4000 – 1400 cm-1. Pita-pita absorpsi pada
daerah ini utamanya disebabkan oleh vibrasi dua atom, sedangkan frekuensinya
karakteristik terhadap massa atom yang berikatan dan konstanta gaya ikatan.
Yaitu daerah yang terletak pada 1400 – 400 cm-1. Pita-pita absorpsi pada
daerah ini berhubungan dengan vibrasi molekul secara keseluruhan. Setiap atom
dalam molekul akan saling mempengaruhi sehingga dihasilkan pita-pita absorbsi
yang khas untuk setiap molekul. Oleh karena itu, pita-pita pada daerah ini dapat
dijadikan sarana identifikasi molekul yang tak terbantahkan.
2.14 Pengukuran Luas Permukaan Dengan Metode Brunauer-Emmett-Teller (BET)
Luas permukaan (surface area) merupakan sifat yang penting dalam
aplikasi katalis. Istilah tekstur (texture) merujuk pada struktur pori partikel secara
umum meliputi luas permukaan, distribusi ukuran pori, dan bentuk pori. Dari
beberapa sifat kaitannya dengan tekstur tersebut, luas permukaan (surface area,
Sg, m2/g) merupakan parameter yang paling penting kaitannya dengan permukaan
katalis di dalam katalis heterogen. Luas permukaan total merupakan kriteria
krusial untuk katalis padat karena sangat menentukan jumlah situs aktif di dalam
katalis kaitanya dengan aktifitas katalis (Istadi, 2006).
Pengukuran luas permukaan menggunakan teknik adsorpsi fisik
menggunakan prinsip gaya Van der Waals. Isoterm keseimbangan dapat
digambarkan dimana volume yang teradsorpsi diplotkan terhadap p/p0 (p: tekanan,
p0: tekanan jenuh pada temperatur pengukuran).
Model teoritis untuk menyatakan isoterm keseimbangan dalam adsorpsi
adalah model Brunauer, Emmett, Teller yang lebih dikenal dengan BET. Teori
BET diperkenalkan tahun 1938 oleh Stephen Brunauer, Paul Hugh Emmett, dan
Teori ini menjelaskan fenomena adsorpsi molekul gas di permukaan zat
padat (melekatnya molekul gas di permukaan zat padat). Kuantitas molekul gas
yang diadsorsi sangat bergantung pada luas permukaan yang dimiliki zat pada
tersebut. Dengan demikian, secara tidak langsung teori ini dapat dipergunakan
untuk menentukan luas permukaan zat padat (Abdullah dan Khairurrijal, 2008).
Jika zat padat berupa partikel-partikel maka luas permukaan untuk zat
padat dengan massa tertentu akan semakin besar jika ukuran partikel semakin
kecil. Luas permukaan spesifik didefinisikan sebagai perbandingan luas total
pemukaan zat padat terhadap massa zat padat sehingga luas permukaan spesifik
akan semakin besar jika ukuran partikel semakin kecil. Metode BET memberikan
informasi tentang luas permukaan spesifik zat padat. Sehingga metode BET
dapat digunakan untuk memperkirakan ukuran rata-rata partikel zat padat. Untuk
material berpori, luas permukaan spesifik ditentukan oleh porositas zat padat.
Dengan demikian metode BET juga dapat digunakan untuk menentukan
porositas zat pada (Abdullah dan Khairurrijal, 2008).
Landasan utama teori BET adalah molekul dapat teradsoprsi pada
permukaan zat padat hingga beberapa lapis, dianggap bahwa tidak ada interaksi
antar molekul gas yang teradsorpsi pada permukaan zat padat, teori adsorpsi satu
lapis dari Langmuir dapat diterapkan untuk masing-masing lapis gas. Dengan
asumsi di atas, BET mendapatkan persamaan umum yang menerangkan keadaan
molekul yang teradsorpsi pada permukaan zat padat.
V
Vm
=
CP
Dalam hubungan ini, Vm adalah volume lapis tunggal, P adalah tekanan
yang terukur, P0 adalah tekananan uap jenuh cairan adsorbat, dan C adalah panas
adsorpsi dan pencairan (liquefaction) yang konstant untuk beberapa bahan dengan
nilai kurang dari 100. Persamaan (1) adalah valid hanya untuk P/P0 ≤ 0.3. Diatas
harga tersebut kondensasi cairan terjadi di mikropori hingga mesopori hingga
P/P0 mendekati satu. Dalam pengukurannya biasanya menggunakan gas nitrogen
sebagai adsorbatnya. Persamaan (1) diubah sedemikian rupa sehingga dapat
dibuat plot antara p/p0 vs p/[V(P-P0)], yang pada akhirnya Vm dan luas
permukaan (Sg) bisa ditentukan (Istadi, 2006):
P V P0-P
=
1 VmC
+
c-1
BAB III
METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan di Laboratorium Kimia Fisik dan Laboratorium
Penelitian Kimia Dasar, Departemen Kimia, Fakultas Sains dan Teknologi,
Universitas Airlangga, Surabaya. Sedangkan karakterisasi katalis dan analisis
biodiesel akan dilakukan di Intitut Tekhnologi Sepuluh November (ITS) dan
Universitas Gajah Mada (UGM). Penelitian dilaksanakan mulai bulan Januari
sampai bulan Juni 2012.
3.2 Bahan dan Alat Penelitian
3.2.1 Bahan Penelitian
Bahan yang dipergunakan adalah bentonit sintetis, Minyak jarak pagar dari
PTPN-XII Jember, AlCl3 (Merck), CaO sintetis (Merck), piridin (Merck), AgNO3,
CH3OH (Merck, 99,9 %), Asam Oksalat dari merck, KOH dari (Merck),
n-heksana, etanol (Merck, 99,9%), aquades, indikator pp.
3.2.2 Alat Penelitian
Alat-alat yang dipergunakan dalam penelitian ini adalah seperangkat alat
refluks, labu leher tiga, hot plate, furnace, magnetic stirer, oven, krus porselen,
mortar, ayakan dengan ukuran 200 mesh, erlemeyer, termometer, pipet tetes, pipet
mikro, timbangan analitik, desikator, corong pisah, seperangkat rotary vacum
evaporator, buret, klem, statif, pipet volum, labu ukur, bowl pipet, pengaduk,
Quantachrome NOVA 1000 surface area analyzer, Siemens D5005
diffractometer. FT-IR spec-troscopy.
3.4 Metode Penelitian
3.4.1 Pembuatan KOH 0,1 N
Sebanyak 6,6011 g KOH ditimbang, kemudian dilarutkan dalam gelas
beaker 100 mL sampai homogen. Larutan yang terbentuk dipindahkan kedalam
labu ukur 1000 mL secara kuantitatif kemudian ditambahkan aquades sampai
tanda batas. Campuran yang terbentuk dikocok supaya homogen
3.4.2 Pembuatan larutan baku asam oksalat 0,1 N
Sebanyak 0,63 g asam oksalat ditimbang dengan teliti, kemudian
dimasukkan kedalam gelas beker 100 mL. Kemudian asam oksalat dilarutkan
dengan aquades sedikit demi sedikit sampai larut homogen. Larutan yang sudah
terbentuk dipindahkan kedalam labu ukur 100 mL secara kuantitatif dan
ditambahkan aquades sampai tanda batas. Campuran yang terbentuk dikocok
supaya homogen.
3.4.3 Pembuatan larutan AlCl3 0,5 M
Sebanyak 13,143 g AlCl3 anhidrat dilarutkan kedalam 200 mL aquades.
Penambahn aquades dilakukan sedikit demi sedikit dan dilakukan didalam lemari
asam AlCl3 sangat reaktif terhadap penambahan air.
3.4.4 Preparasi katalis Al3+-bentonit
Sebanyak 5 g bentonit sintetis dilarutkan kedalam larutan AlCl3 0,5 M.
campuran kemudian distirer selama 24 jam (Reddy et al., 2007), setelah itu
campuran disaring. Setelah disaring endapan dicuci dengan aquades sampai bebas
dari Cl- (diuji dengan AgNO
endapan dikeringkan dalam oven selama 4 jam pada suhu 150 0C. Setelah kering
endapan digerus sampai halus dan diayak pada ayakan 200 mesh.
3.4.5 Preparasi katalis CaO/Al3+-bentonit
Sebanyak 5 g katalis Al3+-bentonit yang telah selesai dibuat dicampur
dengan 1,25 g CaO (Soetaredjo et al., 2010). Campuran dilarutkan dalam aquades,
setelah dilarutkan campuran distirer selama 1 jam. Setelah 1 jam campuran
disaring kemudian endapan dikalsinasi pada suhu 200 0C selama 4 jam. Endapan
yang telah dikalsinasi kemudian digerus dan diayak pada ayakan 200 mesh.
3.5 Karakterisasi Katalis
3.5.1 Penentuan luas permukaan katalis
Analisis luas permukaan padatan katalis, volume pori total dan rerata
jari-jari pori menggunakan Gas Sorbtion Analyzer NOVA-1000, Quantachrome Corp
metode Brunauer-Emmet-Teller (BET).
3.5.2 Penentuan Struktur Katalis
Penentuan struktur katalis dengan menggunakan metode XRD, metode
XRD banyak digunakan untuk mengidentifikasi dan mengarakterisasi material
yang digunakan sebagai katalis, karena banyak material katalis yang berbentuk
kristal. Teknologi XRD ini juga memiliki kemampuan untuk mengidentifikasi dan
menentukan besarnya bagian fasa dalam padatan, film tipis, dan sample multi
fasa. XRD menggunakan radiasi sinar Cu-Kα (λ= 1.54056). Tabung X-ray
3.5.3 Penentuan Situs Asam dan Basa katalis 3.5.3.1 Penentuan Situs Asam katalis
Sebanyak 0,5 g Al3+-Bentonit, dimasukkan dalam kurs porselen kemudian
dipanaskan pada suhu 100 0C (Reddy et al., 2007). Setelah itu dimasukkan
kedalam desikator yang telah divakumjmkan. Kedalam desikator tersebut, dialiri
10 ml piridin yang dipanaskan. Kemudian, dibiarkan selama 24 jam dan
ditimbang. Untuk menghilangkan gas piridin yang terserap, maka katalis dioven
kembali pada suhu 115 0C selama 1 jam (Reddy et al, 2007). Besarnya situs asam
dapat diketahui dengan menimbang katalis sebelum dialiri gas piridin dan setelah
dialiri gas piridin dengan metode gravimetri dengan rumus sebagai berikut:
Jumlah Keasaman total = Jumlah Piridin teradsorbMr
piridin× mBentonit (g)
Kemudian Katalis yang telah dialiri gas piridin dilakukan uji FT-IR untuk
mengetahui letak situs asam Lewis dan Bronstead.
3.5.3.2 Penentuan situs basa katalis
Situs basa ditentukan dengan metode indikator. 0,005 g Katalis
didispersikan kedalam 5 mL larutan toluena dan diamati sampai ada perubahan
warna indikator. Indikator yang digunakan dalam penentuan ini adalah sebagai
berikut : Bromothymol biru (pKBH= 7,2), Phenolphetalin (pKBH= 9,3),
2,4-dinitroanilin (pKBH= 15,0) dan 4-nitroanilin (pKBH= 18,4). Sedangkan jumlah
situs basa diukur melalui titrasi menggunakan phenolphetalin (Kouzu, et al.,
2008). Untuk jumlah situs basa dari katalis CaO/Al3+-Bentonit dilakukan dengan
3.6 Sintesis dan Karakterisasi Biodiesel
3.6.1 Sintesis biodiesel dari Crude Jatrhopa Oil (CJO)
Sebanyak 9,6192 g metanol dan 0,5 g CaO/Al3+-bentonit direfluks selama
30 menit pada suhu 80 0C diatas hot plate. Setelah itu sebanyak 8,6187 g minyak
jarak pagar dimasukkan kedalam campuran metanol dan CaO/Al3+-bentonit
sambil tetap dipanaskan pada suhu 80 0C. Reaksi dilakukan dalam berbagai
variasi waktu antara 1-5 jam. Setelah reaksi campuran disentrifugasi untuk
memisahkan produk dengan katalis. Setelah itu larutan dicuci dengan air untuk
memisahkan biodiesel dengan gliserol, sehingga terbentuk dua lapisan, lapisan
atas berwarna bening merupakan produk dari biodiesel.
3.6.2 Sintesis biodiesel dari Jatrohopa Oil
Sebanyak, 9,6192 g metanol dan 0,1 g H2SO4 direfluks selama 30 menit
pada suhu 80 0C diatas hot plate. Setelah itu sebanyak 8.6187 g minyak jarak
pagar dimasukkan kedalam campuran metanol dan H2SO4 sambil tetap
dipanaskan pada suhu 80 0C. Reaksi dilakukan selama 3 jam.
Tahap berikutnya Sebanyak, 9,6192 g metanol dan 0,5 g CaO/Al3+
-bentonit direfluks selama 30 menit pada suhu 80 0C diatas hot plate. Setelah itu
sebanyak 8.6187 g minyak jarak pagar yang telah mengalami reaksi esterifikasi
terlebih dahulu dimasukkan kedalam campuran metanol dan CaO/Al3+-bentonit
sambil tetap dipanaskan pada suhu 80 0C. Reaksi dilakukan dalam berbagai
variasi waktu antara 1-5 jam. Setelah reaksi campuran disentrifugasi untuk
memisahkan biodiesel dengan gliserol, sehingga terbentuk dua lapisan, lapisan
atas berwarna bening merupakan produk dari biodiesel.
3.6.3 Karakterisasi Biodiesel
3.6.3.1 Penentuan kadar air minyak jarak pagar
5 gr minyak jarak pagar ditimbang dalam kurs porselen yang telah
diketahui beratnya kemudian dioven 105°C selama 3 jam. Setelah 3 jam minyak
didinginkan dalam desikator, setelah dingin ditimbang bertanya sampai konstan.
Untuk menghitung kadar air dalam minyak jarak menggunakan rumus:
Kadar air=Berat awal-Berat akhirBerat awal x 100%
3.6.3.2 Penentuan bilangan asam
Sebanyak 1 g metil ester (Biodiesel) dimasukkan dalam labu titrasi
kemudian ditambahkan 5 mL etanol dan 5 mL n-heksana dan 3 tetes indikator pp.
Kemudian campuran tersebut dititrasi dengan KOH 0,1 N. campuran dititrasi dari
tidak berwarna sampai berwarna merah jambu,warna bertahan selama 30 detik.
Kemudian bilangan asam dapat ditentukan dengan memasukkan data kedalam
rumus (Baig dan Ng, 2010):
Bilangan Asam =
3.6.3.3 Analisisa produk biodiesel
Sebanyak 0,5 g senyawa biodiesel dapat dilarutkan dalam 5ml metil
heptadekanoat kemudian dianalisa dengan GC-MS. Dari GC-MS kandungan
senyawa dan konversi biodiesel dapat diketahui. untuk mengukur konversi
Konversi Biodiesel (C) = ∑A-AA is
is
x
Cis xVis
m x 100%
Keterangan:
∑A = Total peak area C14:0 – C24:1
Ais = Luas area puncak standart internal
Cis = Konsentrasi Internal standart (mg/ml)
Vis = Volume internal standart (ml)
BAB 4
HASIL DAN PEMBAHASAN
4.1 Preparasi Katalis
4.1.1 Preparasi katalis Al3+-Bentonit
Bentonit yang digunakan pada penelitian ini adalah bentonit sintetis yang
diperoleh dari Sigma Aldrich. Sebanyak 5gr bentonit sintetis direndam dalam
larutan AlCl3 0,5 M selama 24 jam pada suhu 80°C sambil direfluks. Perendaman
pada proses ini bertujuan untuk proses pertukaran kation dimana ion Al3+ akan
masuk pada struktur interlayer bentonit untuk menggantikan ion Ca2+.
Hasil dari perendaman bentonit tersebut berupa suspensi yang kemudian
disaring untuk memisahkan endapan dengan larutannya. Endapan yang
didapatkan merupakan Al3+-bentonit yang masih mengandung sisa ion Cl-. Untuk
mendapatkan Al3+-bentonit yang bebas Cl- maka dilakukan pencucian Cl- dengan
menggunakan aquadem. Untuk menguji Al3+-bentonit bebas dari ion Cl-, air bekas
pencucian diuji dengan larutan AgNO3, jika air sudah tidak mengandung endapan
AgCl maka Al3+-bentonit sudah bebas dari ion Cl-. Setelah Al3+-Bentonit bebas
dari ion Cl-, Al3+-bentonit dikeringkan pada suhu 150°C selama 4 jam untuk
menghilangkan kandungan airnya.
4.1.2 Preparasi katalis CaO/Al3+-Bentonit
Katalis CaO/Al3+-bentonit dibuat dengan menambahkan Al3+-bentonit
dengan CaO perbandingan berat 4:1 (Soetaredjo et al., 2010). Selanjutnya katalis
Al3+-Bentonit dan CaO direndam dalam aquades dan diaduk selama 1 jam.
Endapan yang didapatkan merupakan CaO/Al3+-bentonit kemudian dikalsinasi
pada suhu 200°C selama 4 jam. Hasil endapan yang terbentuk berwarna abu-abu
lebih muda dari pada katalis Al3+-Bentonit Setelah dingin katalis CaO/Al3+
-Bentonit digerus dan diayak menggunakan ayakan 200 mesh. Katalis yang
terbentuk dilakukan pengayakan 200 mesh untuk mendapatkan ukuran partikel
yang seragam dengan luas permukaan yang besar.
4.2 Karakterisasi Katalis 4.2.1 Luas permukaan katalis
Analisa Luas permukaan dengan metode BET ini bertujuan untuk
mengetahui luas area, dan volume total pori,. Penentuan luas area, volume total
pori disajikan dalam Tabel 4.1 berikut.
Tabel 4.1 Hasil penentuan luas area dan volume total pori, menggunakan metode BET
Katalis Luas Permukaan (m2/g) Pori (10Volume Total -2 cc/g)
Bentonit sintetis 23,744 12,40
Al3+- Bentonit 36,836 11,00
CaO/Al3+-
Bentonit 7,494 4,759
Dari Tabel 4.1 diketahui bahwa luas permukaan katalis CaO/Al3+-
Bentonit lebih kecil daripada luas permukaan dari bentonit sintetis dan Al3+-
Bentonit namun lebih besar daripada luas permukaan CaO. Penyusutan luas
permukaan ini disebabkan karena proses preparasi katalis, proses kalsinasi dan
penggumpalan oksida logam di permukaan katalis sehingga menyebabkan
Gambar 4.1 Grafik adsorbsi-desorbsi katalis CaO/Al3+-Bentonit
Gambar 4.1 diatas menunjukan grafik isotherm adsorbsi-desorbsi N2
katalis CaO/Al3+-Bentonit mempunyai loop histeresis. Adanya loop histeresis
menunjukan bahwa CaO/Al3+-bentonit termasuk dalam tipe IV, yang merupakan
padatan mesopori. Data ini juga didukung dengan data ukuran pori yang
menyatakan bahwa CaO/Al3+-bentonit memiliki ukuran pori sebesar 127,018 Ǻ
dimana, ukuran pori antara 20-500 Ǻ tergolong dalam material mesopori.
4.2.2 Struktur katalis
Penentuan struktur katalis dengan menggunakan metode XRD dilakukan
dan CaO/Al3+- bentonit. Analisa XRD dilihat dari perbandingan perubahan d
spacing
dan harga 2θ dari bentonit sintetis, CaO, Al3+- bentonit dan CaO/Al3+- bentonit.
Pada difraktogram bentonit sintetis, terdapat puncak pada 2θ= 7,03554, 19,79788,
29,48867 puncak tersebut sesuai dengan puncak monmorillonit seperti yang
dilaporkan oleh Wijaya, et al., 2002. Pada difaktogram CaO terdapat puncak pada
2θ= 32,24350 dan 37,38915 yang menyatakan refleksi khas dari CaO dan 2θ pada
47,16288 yang merupakan puncak Ca(OH)2 serta 2θ= 47,55610 dan 43,15040
yang merupkan puncak dari CaCO3, hal ini yang sesuai dengan penelitian dari
Nakatami et al., 2009, Ngamcharussrivichai et al., 2010, dan Tang, et al., 2011.
Berikut tabel perbandingan difraktogram XRD dari bentonit sintetis, Al3+-
Bentonit dan CaO/Al3+- Bentonit.
Tabel 4.2 Perbandingan data XRD dari bentonit sintetis, CaO, Al3+- Bentonit dan CaO/Al3+- Bentonit
Dari Tabel 4.2 dapat dilihat bahwa terdapat pergeseran dspacing dan 2θ dari
bentonit sintetis, CaO, Al3+- bentonit dan CaO/Al3+- bentonit. Hal ini menunjukan
bahwa terdapat perbedaan struktur sebelum dan setelah modifikasi bentonit. Data
ini didukung dengan perbandingan difraktogram antara bentonit sintetis, Al3+
Gambar 4.2 Difraktogram bentonit sintetis, CaO, Al3+- Bentonit, dan CaO/Al3+
-Bentonit
Pada difraktogram Al3+- Bentonit diatas dapat diamati bahwa terdapat
puncak khas dari monmorillonit masih terlihat yakni pada 2θ= 5,8748 akan tetapi
setelah dilakukan modifikasi harga 2θ monmorilonit dari katalis CaO/Al3+-
bentonit bergeser menjadi 5,84745 dan nilai dspacing meningkat. Peningkatan
dspacing ini dikarenakan kemampuan swelling pada saat pertukaran ion,
lapisan-lapisan silikat pada montmorillonit akan terbuka semakin lebar karena
kation-kation yang ada tertukar oleh kation-kation yang lebih besar (Cool, et al., 1998).
Pada katalis CaO/Al3+-bentonit, terlihat puncak khas CaO pada 2θ= 39,
38267. Hal ini menunjukan bahwa CaO telah berikatan dengan Al3+-bentonit.
Difaktogram pada Gambar 4.1 menunjukan bahwa modifikasi katalis dengan
cation exchanged Al3+ dan impregnasi dengan CaO tidak merubah struktur dari
monmorillonit yang ditunjukan dengan masih munculnya puncak khas CaO/Al3+
- Bentonit
Al3+- Bentonit
bentonit sintetis