ASAI BAKTERI POTENSIAL PROBIOTIK DARI IKAN GURAMI
(Osphronemus gouramy Lac) DALAM MENGHAMBAT
PERTUMBUHAN Aeromonas hydrophila
(Assay of Potential Probiotic Bacteria from Gurami (Osphronemus gouramy Lac) in Inhibition Growth of Aeromonas hydrophila)
Ernawati Butar Butar1, Dwi Suryanto2, Maragunung Dalimunthe3, Ied Hidayani Parinduri4
1Mahasiswa Program Studi Manajemen Sumberdaya Perairan, Fakultas Pertanian, Universitas Sumatera Utara, Medan, Indonesia 20155
(Email: ernabebe@ymail.com)
2Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan, Indonesia 20155
3Dinas Kelautan dan Perikanan Provinsi Sumatera Utara, Medan, Indonesia 20155 4Laboratorium Mikrobiologi, Stasiun Karantina Ikan Pengendalian Mutu dan
Keamanan Hasil Perikanan Kelas I Medan II, Belawan, Indonesia 20414 ABSTRACT
The bacteria in fish can be found on the surface of body and the digestive tract. Some bacteria in digestive tract contribute to feed digestion by produces enzymes. Probiotics have been used to influences feed digestion and to inhibition potential pathogenic bacteria in fish. In this study, isolation of potential probiotic bacteria from gourami stomach and intestine and assay of potential probiotic to inhibition Aeromonas hydrophila has been conducted. Bacteria isolation was conducted using Tryptic Soy Agar (TSA) Media. Starch Agar (SA) and Skim Milk Agar (SMA) media to hydrolyze starch and casein tests. The result showed 17 isolates hydrolyzed starch and casein. In addition, the isolates indicated to inhibit A. hydrophila. Morphological and biochemical tests showed 4 isolate of potential probiotic bacteria in the stomach and intestine of gourami (Osphronemus gouramy), were Bacillus cereus, Bacillus firmus, Bacillus coagulans, and Micrococcus sp.. B.cereus was more potential and dominate in the stomach and intestines.
Keywords: A. hydrophila, B. cereus, B. firmus, B. coagulans, Micrococcus sp., O. gouramy, Potential Probiotic.
PENDAHULUAN
Ikan gurami merupakan salah satu komoditi perikanan air tawar yang banyak diminati oleh masyarakat, baik konsumen maupun para pembudidaya. Ikan gurami banyak disukai konsumen karena rasanya yang lezat dan gurih, sedangkan oleh para pembudidaya karena memiliki harga jual yang lebih tinggi dibandingkan komoditi
perikanan air tawar lainnya. Pada kondisi lingkungan yang optimal pertumbuhan ikan ditentukan oleh jumlah dan mutu pakan yang dikonsumsi. Pakan yang dikonsumsi untuk dapat digunakan dalam proses biosintesis yang menghasilkan pertumbuhan harus melalui proses pencernaan dan penyerapan pada saluran pencernaan terlebih dahulu.
Dengan demikian kondisi saluran pencernaan memegang peranan penting dalam mengubah pakan (senyawa komplek) menjadi nutrien (senyawa sederhana) sebagai bahan baku dalam proses biosintesis tersebut (Yandes dkk., 2003).
Bakteri pada ikan dapat dijumpai pada permukaan tubuh dan saluran pencernaan. Sebagian bakteri bersifat patogen, sedangkan sejumlah bakteri lainnya menguntungkan bagi ikan karena membantu pencernaan, mensintesis vitamin-vitamin serta mendekomposisi materi organik di perairan (Irianto, 2005). Hal ini diduga karena adanya peran bakteri probiotik. Prinsip dasar kerja probiotik adalah dengan memanfaatkan kemampuan mikroba untuk mempermudah penyerapan oleh saluran pencernaan ikan (Feliatra dkk., 2004).
Dalam saluran pencernaan ikan terdapat bakteri yang menghasilkan enzim pencernaan yang dapat merombak nutrien makro yang masuk melalui pakan untuk kebutuhan bakteri itu sendiri dan memudahkan diserap oleh ikan (Gatesoupe, 1999). Mekanisme pertahanan terhadap penyakit diduga mampu menghambat bakteri patogen. Beberapa penelitian telah dilakukan untuk memperoleh kandidat yang paling efektif sebagai agen biokontrol yang diaplikasikan dalam bentuk probiotik (Irianto, 2003). Moriaty (1998) menyebutkan probiotik adalah bakteri yang dimasukkan dengan berbagai macam cara ke dalam saluran pencernaan dan tetap hidup untuk memperbaiki kesehatan.
Probiotik adalah mikroba hidup menguntungkan pada makhluk hidup, yang bermanfaat untuk memperbaiki keseimbangan mikroba di dalam saluran pencernaan (Afrianto dan Liviawaty, 2005) dan memberikan pengaruh positif terhadap fisiologi dan
kesehatan inangnya. Senyawa-senyawa racun yang dihasilkan pada metabolisme bakteri probiotik seperti asam laktat, hidrogen peroksida, bakteriosin yang bersifat antimikroba dan antibiotik mampu menekan pertumbuhan bakteri patogen (Yulinery dkk., 2006).
Mengingat informasi dan penelitian mengenai identifikasi bakteri yang potensial sebagai probiotik pada ikan gurami (Osphronemus gouramy) sebagai ikan air tawar masih sangat terbatas, perlu dilakukan isolasi bakteri probiotik yang terdapat pada lambung dan usus ikan tersebut karena usus merupakan tempat utama masuknya makanan dan organ ini dikolonisasi oleh mikroba yang berperan atau berkontribusi pada proses pencernaan makanan dan fungsi imun. Tujuan dari penelitian ini adalah untuk mengetahui bakteri potensial probiotik yang terdapat pada lambung dan usus ikan gurami melalui hidrolisis uji pati (amilum) dan kasein (protein), mengetahui bakteri potensial probiotik yang mendominasi pada lambung dan usus ikan gurami dan untuk mengetahui apakah bakteri potensial probiotik yang didapatkan mampu menghambat pertumbuhan bakteri patogen Aeromonas hydrophila.
METODE PENELITIAN Isolasi dan Identifikasi Bakteri Potensial Probiotik
Bakteri potensial probiotik diisolasi dari bagian saluran pencernaan ikan yaitu lambung dan usus. Ikan dibedah untuk diambil bagian lambung dan usus, lalu dimasukkan ke dalam larutan fisiologis NaCl 0,9%. Selanjutnya, lambung dan usus dihancurkan atau dihaluskan dengan menggunakan stomacher. Sampel yang telah dihaluskan,
kemudian dilakukan seri pengenceran hingga 10-3. Pengenceran 10-1, 10-2dan 103 masing-masing diambil 1 ml kemudian dimasukkan ke dalam cawan petri yang telah berisi media Tryptic Soy Agar (TSA) dan diratakan dengan menggunakan teknik cawan sebar kemudian diinkubasi dengan posisi cawan terbalik selama 24 – 48 jam pada temperatur 35ºC.
Setelah koloni tumbuh di masing-masing media, kemudian koloni yang berbeda dari warna, bentuk, tepian dan elevasi dipilih dan dikultur kembali pada media TSA dengan menggunakan teknik cawan goresan kuadran beberapa tahap hingga diperoleh isolat yang murni, kultur diinkubasi dengan posisi cawan terbalik selama 24 – 48 jam pada suhu 35ºC (Darmayasa, 2008).
Uji hidrolisis pati (amilum) dan kasein (protein) dilakukan terhadap seluruh isolat murni yang didapatkan. Uji ini bertujuan sebagai seleksi terhadap seluruh isolat untuk mendapatkan isolat bakteri yang potensial probiotik. Selanjutnya dilakukan pengamatan secara makroskopik dan mikroskopik dengan pewarnaan Gram, serta serangkaian uji biokimia untuk identifikasi spesies bakteri yang ada dalam sampel ikan. Pengamatan karakter makroskopik koloni bakteri meliputi ukuran, pigmentasi (warna koloni), bentuk karakter mikroskopik meliputi ukuran, warna, dan bentuk bakteri. Uji biokimia meliputi uji KOH, uji katalase, uji oksidase, uji indol, uji motilitas, uji oksidatif fermentatif (O/F), uji citrate, uji triple sugar iron Agar (TSIA), uji Motil Indol dan Ornithin (MIO), uji Lysin Iron Agar (LIA), uji urease, uji gelatin, uji Methyl Red, dan uji Voges Proskauer serta uji gula-gula sebagai uji tambahan seperti uji glukosa, uji manitol, uji sorbitol, uji
laktosa, uji sukrosa, uji inositol, uji rafinosa, uji arabinosa dan uji maltosa.
Identifikasi bakteri dilakukan menggunakan buku Manual for the Identification of Medical Bacteria oleh Cowan and Steels (1974) dan Bergey`s Manual of Determinative Bacteriology oleh Holt dkk., (1994).
Pembuatan Stok Kultur
Sebelum pengujian tiap isolat disiapkan dahulu stok kultur pada media miring. Hal ini dilakukan sebagai stok untuk uji penghambatan dan uji biokimia. Stok kultur disiapkan dengan cara menggores satu ose dari tiap isolat bakteri yang tumbuh di kultur pemurnian, dalam bentuk media miring dengan komposisi media sama seperti media isolat murni. Kultur diinkubasi selama 24 jam pada suhu 370C (Sianturi, 2008).
Uji Hidrolisis Pati (Amilum)
Koloni bakteri yang tumbuh diambil satu ose dan digores pada cawan petri yang mengandung media Starch Agar, dan diinkubasi selama 24 – 48 jam pada suhu 370C. Kemudian dilakukan uji iodin dengan cara meneteskan iodin pada permukaan agar yang berisi isolat, bila terdapat zona bening pada media mengindikasikan enzim amilase diproduksi oleh isolat sehingga di daerah tersebut amilum sudah dihidrolisis (Cappucino, 1983). Uji Hidrolisis Kasein (Protein)
Koloni bakteri yang tumbuh diambil satu ose dan digores pada cawan petri yang mengandung media Skim Milk Agar (SMA), dan diinkubasi selama 24 jam pada suhu 370C. Skim Milk Agar merupakan media yang mengandung protein atau kasein yang dapat dipecah oleh mikroorganisme proteolitik menjadi senyawa nitrogen terlarut sehingga pada koloni bakteri
dikelilingi area bening, yang menunjukkan bahwa mikroba tersebut mempunyai aktivitas proteolitik (Fardiaz, 1992).
Uji Penghambatan Bakteri A.
hydrophila
Metode yang digunakan adalah metode teknik cawan sebar (spread plate). A. hydrophila serta isolat-isolat yang positif uji hidrolisis pati (amilum) maupun kasein (protein) disuspensikan hingga kekeruhannya sama dengan larutan suspensi Mc Farland yaitu 108 CFU/ml. A. hydrophila diisolasi ke dalam cawan petri dengan teknik cawan sebar. Kertas cakram yang telah direndam dalam suspensi bakteri potensial probiotik diletakkan diatas sebaran A. hydrophila dalam cawan petri. Kultur diinkubasi pada suhu 350C selama 24 jam. Pengamatan dilakukan terhadap zona bening yang terbentuk disekitar cakram.
HASIL DAN PEMBAHASAN Hasil
Bakteri Potensial Probiotik Pada Lambung dan Usus Ikan Gurami
Dari penelitian yang telah dilakukan, diperoleh 17 isolat bakteri, yaitu 12 isolat bakteri dari hasil isolasi pada lambung dan 5 isolat bakteri dari hasil isolasi pada usus. sehingga
Identifikasi Bakteri Potensial Probiotik dari Ikan Gurami
Isolat-isolat bakteri potensial probiotik yang ditemukan dari hasil isolasi lambung dan usus dari ikan gurami (O. gouramy) dapat dilihat dari morfologi koloni meliputi tepian, elevasi dan warna koloni yang dapat dilihat pada Tabel 1. Berdasarkan Tabel 1 dapat dijelaskan bahwa ke-17 jenis bakteri memiliki kemiripan pada tepian dan elevasi, sedangkan 1 jenis
bakteri lainnya memiliki perbedaan pada warna yaitu kuning.
Tabel 1. Morfologi Koloni Isolat Bakteri Potensial Probiotik Pada Ikan Gurami
Media Kode Isolat
Koloni
Tepian Elevasi Warna TSA LI1a Licin Cembung Putih TSA LI1e Siliat Datar Putih TSA LI1f Licin Cembung Putih TSA LI1g Licin Cembung Putih TSA LI1j Licin Cembung Putih TSA LI2e Licin Cembung Putih TSA LI3a Siliat Datar Putih TSA LI3b Siliat Datar Putih TSA LI4b Licin Cembung Kuning TSA LI5b Siliat Datar Putih TSA LI5d Siliat Datar Putih TSA LI5e Siliat Datar Putih TSA UI1f Siliat Datar Putih TSA UI3c Licin Cembung Putih TSA UI4g Licin Cembung Putih TSA UI5c Licin Cembung Putih TSA UI5e Siliat Datar Putih Pengamatan morfologi pada sel isolat dilakukan dengan pewarnaan Gram dan uji Biokimia untuk identifikasi bakteri potensial probiotik. Pewarnaan Gram dilakukan secara mikroskopik dengan perbesaran 100x dan diperoleh hasil bahwa ke-17 isolat bakteri berwarna ungu yang merupakan Gram positif karena mampu mengikat garam A atau Kristal violet. Satu dari 17 isolat bakteri tersebut berbentuk kokus, sedangkan 16 isolat lainnya berbentuk basil atau batang.
Hasil pengamatan morfologi sel baik pewarnaan Gram dan uji biokimia dari ke-17 isolat bakteri dapat dilihat pada Tabel 2, Tabel 3, Tabel 4 dan Tabel 5. Hasil uji biokimia dari ke-17 bakteri yang diperoleh diidentifikasi dengan menurut Bergey`s manual of determinative bacteriology oleh Holt dkk., (1994) dan buku Manual for the identification of medical bacteria oleh Cowan and Steels (1974).
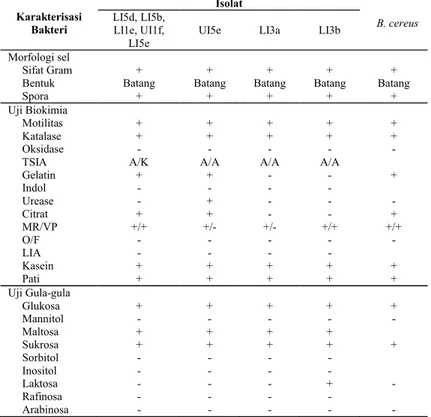
Tabel 2. Karakterisasi Bakteri pada Kode Isolat LI5d, LI5b, LI1e, UI1f, LI5e, UI5e, LI3a dan LI3b
Keterangan: (+) positif, (-) negatif, O (Oksidatif), F (Fermentatif), V (Variabel), (A) Acid, (K) Alkali Table 3. Karakterisasi Bakteri pada Kode Isolat LI1g dan LI2e
Karakterisasi
Bakteri LI1g, LI2eIsolat B. firmus Morfologi sel
Sifat Gram + +
Bentuk Batang Batang
Spora + + Uji Biokimia Motilitas - + Katalase + + Oksidase - TSIA A/K Gelatin + + Indol - Urease - Citrat - MR/VP +/- O/F - LIA - Kasein + v Pati + + Uji Gula-gula Glukosa + + Mannitol + + Maltosa Sukrosa Sorbitol Inositol Laktosa Rafinosa Arabinosa -
-Keterangan: (+) positif, (-) negatif, O (Oksidatif), F (Fermentatif), V (Variabel), (A) Acid, (K) Alkali Karakterisasi Bakteri Isolat B. cereus LI5d, LI5b, LI1e, UI1f,
LI5e UI5e LI3a LI3b
Morfologi sel
Sifat Gram + + + + +
Bentuk Batang Batang Batang Batang Batang
Spora + + + + +
Uji Biokimia
Motilitas + + + + +
Katalase + + + + +
Oksidase - - - -
TSIA A/K A/A A/A A/A
Gelatin + + - - + Indol - - - Urease - + - - Citrat + + - - + MR/VP +/+ +/- +/- +/+ +/+ O/F - - - - LIA - - - Kasein + + + + + Pati + + + + + Uji Gula-gula Glukosa + + + + + Mannitol - - - - Maltosa + + + + Sukrosa + + + + + Sorbitol - - - Inositol - - - Laktosa - - - + Rafinosa - - - Arabinosa - - - -
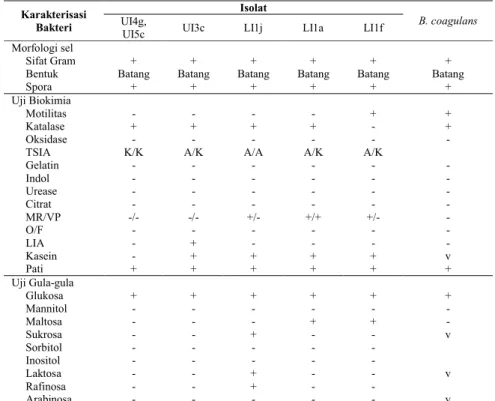
-Table 4. Karakterisasi Bakteri pada Kode Isolat UI4g, UI5c, UI3c, LI1j, LI1a dan LI1f Karakterisasi Bakteri Isolat B. coagulans UI4g,
UI5c UI3c LI1j LI1a LI1f
Morfologi sel
Sifat Gram + + + + + +
Bentuk Batang Batang Batang Batang Batang Batang
Spora + + + + + +
Uji Biokimia
Motilitas - - - - + +
Katalase + + + + - +
Oksidase - - -
TSIA K/K A/K A/A A/K A/K
Gelatin - - - Indol - - - Urease - - - Citrat - - - MR/VP -/- -/- +/- +/+ +/- O/F - - - LIA - + - - - Kasein - + + + + v Pati + + + + + + Uji Gula-gula Glukosa + + + + + + Mannitol - - - Maltosa - - - + + Sukrosa - - + - - v Sorbitol - - - - Inositol - - - - Laktosa - - + - - v Rafinosa - - + - Arabinosa - - - v
Keterangan: (+) positif, (-) negatif, O (Oksidatif), F (Fermentatif), V (Variabel), (A) Acid, (K) Alkali Tabel 5. Karakterisasi Bakteri pada Kode Isolat LI4b
Keterangan: (+) positif, (-) negatif, O (Oksidatif), F (Fermentatif), V (Variabel), (A) Acid, (K) Alkali Karakterisasi
Bakteri Isolat BakteriLI4b Micrococcus sp. Morfologi sel
Sifat Gram + +
Bentuk kokus kokus
Uji Biokimia Motilitas - Katalase + + Oksidase - v TSIA A/A Gelatin - Indol - Urease - + O/F - O LIA + MR/VP +/+ Kasein Pati + Uji Gula-gula Glukosa + + Mannitol - v Maltosa - v Sukrosa - v Sorbitol Inositol Laktosa - v Rafinosa Arabinosa
-Berdasarkan hasil karakterisasi dan identifikasi ke-17 isolat bakteri yang telah dilakukan, diperoleh hasil bahwa isolat dengan kode LI1e, LI3a, LI3b, LI5b, LI5d, LI5e, UI1f dan UI5e mirip dengan Bacillus cereus. Isolat dengan kode LI1g dan LI2e mirip dengan bakteri Bacillus firmus. Isolat dengan kode isolat LI1a, LI1f, LI1j, UI3c, UI4g, dan UI5c mirip dengan bakteri Bacillus coagulans, dan isolat dengan kode isolat LI4b mirip dengan Micrococcus sp..
Hidrolisis Pati (Amilum) dan Kasein (Protein) Pada Isolat Bakteri
Uji hidrolisis pati (amilum) dan kasein (protein) terhadap isolat bakteri dilakukan merupakan tahap awal dalam seleksi seluruh isolat bakteri untuk mendapatkan kandidat bakteri yang potensial probiotik. Kemampuan isolat-isolat bakteri dalam menghidrolisis pati (amilum) dan kasein (protein) dapat dilihat pada Tabel 6.
Tabel 6. Kemampuan Isolat Kandidat Probiotik Menghidrolisis Pati dan Kasein Kode Isolat Hidrolisis Pati/Amilum Kasein LI1a + + LI1e + + LI1f + + LI1g + + LI1j + + LI2e + + LI3a + + LI3b + + LI4b + -LI5b + + LI5d + + LI5e + + UI1f + + UI3c + + UI4g + -UI5c + -UI5e + +
Indikasi Penghambatan Bakteri
Aeromonas hydrophila
Isolat-isolat bakteri yang mampu menghidrolisis pati (amilum) dan kasein (protein) selanjutnya diuji tantang dengan bakteri Aeromonas hydrophila untuk mengetahui adanya indikasi penghambatan terhadap bakteri A. hydrophilla. Uji tersebut bertujuan untuk memastikan bahwa ke-17 isolat merupakan isolat bakteri potensial probiotik pada ikan gurami (O. gouramy) karena menunjukkan indikasi penghambatan A. hydrophilla.
(a) (b) (c)
(d) (e) (f)
Gambar 1. Hidrolisis Pati (a) B. cereus, (b) B. firmus, (c) B. coagulans, (d) Micrococcus sp. dan Hidrolisis Kasein (e) B.
coagulans dan B. firmus dan (f) B. cereus dan Micrococcus sp.
Zona Bening
Zona Bening Zona Bening
Zona Bening
Pembahasan
Bakteri Potensial Probiotik Pada Lambung dan Usus Ikan Gurami
Isolasi dilakukan pada lambung dan usus ikan karena lambung dan usus merupakan saluran pencernaan yang memegang peranan penting dalam mengubah pakan (senyawa kompleks) menjadi senyawa sederhana. Dari hasil isolasi dan pemurnian didapatkan 17 isolat bakteri, yaitu 12 isolat bakteri dari lambung dan 5 isolat dari hasil isolasi usus. Menurut Gatesoupe (1999), di dalam saluran pencernaan ikan terdapat bakteri yang menghasilkan enzim pencernaan yang dapat merombak nutrient makro yang masuk melalui pakan dan memudahkan diserap oleh ikan.
Probiotik akan berpengaruh terhadap kecepatan fermentasi pakan dalam saluran pencernaan, sehingga akan sangat membantu proses penyerapan makanan dalam pencernaan ikan. Fermentasi pakan mampu menguraikan senyawa kompleks menjadi sederhana sehingga siap digunakan ikan dan sejumlah mikroorganisme mampu mensintesa vitamin dan asam-asam amino yang dibutuhkan oleh hewan akuatik (Fuller, 1989). Beberapa bakteri telah terbukti membentuk spora untuk melaksanakan seluruh siklus hidup, sporulasi dan perkecambahan di saluran pencernaan sehingga pembentukan spora atau perkecambahan dapat terjadi di saluran usus (Angert, 1998).
Isolasi bakteri probiotik dari saluran pencernaan telah dilakukan oleh peneliti terdahulu, antara lain isolasi dan karakterisasi bakteri berpotensi probiotik pada ikan kembung (Rastrelliger sp.) oleh Safrida dkk., (2012) dan Yulfizar (2013), isolasi dan identifikasi bakteri probiotik dari ikan kerapu macan (Ephinephelus
fuscogatus) oleh Feliatra dkk., (2004), antagonis bakteri probiotik yang diisolasi dari usus dan lambung ikan kerapu bebek (Cromileptes Altivelis) terhadap bakteri patogen oleh Feliatra dkk., (2012) dan hasil isolasi dari saluran pencernaan patin (Anggriani dkk., 2012).
Suplementasi pakan dengan bakteri probiotik meningkatkan pencernaan dan penyerapan protein pada saluran percernaan karena meningkatnya aktivitas protease usus (Macey dan Coyne, 2005). Aplikasi probiotik ditampilkan untuk meningkatkan keseimbangan mikroba usus, sehingga menyebabkan peningkatan penyerapan makanan dan mengurangi masalah patogen dalam saluran pencernaan (Parker, 1974). Identifikasi Bakteri Potensial Probiotik dari Ikan Gurami
Berdasarkan hasil pengamatan koloni dari ke-17 isolat bakteri potensial probiotik pada Tabel 2, diketahui bahwa morfologi koloni pada ke-17 isolat memiliki kemiripan pada tepian dan elevasi, dimana terdapat 8 isolat bakteri yang memiliki tepian siliat dan elevasi cembung serta berwarna putih. Ke-8 isolat bakteri tersebut berasal dari isolasi lambung sebanyak 6 isolat dengan masing-masing kode isolat LI1e, LI3a, LI3b, LI5b, LI5d, dan LI5e serta 2 isolat dari hasil isolasi usus dengan kode isolat UI1f dan UI5e.
Delapan isolat bakteri lainnya memiliki morfologi koloni yang sama yaitu dengan ciri tepian licin, elevasi cembung dan koloni berwarna putih. Kedelapan isolat bakteri potensial probiotik tersebut berasal dari isolasi lambung dan usus, masing-masing sebanyak 5 isolat dari lambung dengan kode isolat bakteri LI1a, LI1f, LI1g,
LI1j, LI2e dan 3 isolat dari usus dengan kode isolat UI3c, UI4g serta UI5c. Satu dari 17 isolat yang berasal dari isolasi lambung ikan gurami dengan kode isolat LI4b memiliki warna koloni yang berbeda yaitu kuning dengan tepian licin dan elevasi yang cembung.
Morfologi koloni yang diamati pada isolat bakteri meliputi bentuk, tepian, elevasi dan warna koloni. Hasil pengamatan menunjukkan bahwa warna koloni dari isolat bakteri potensial probiotik adalah putih dan kuning. Menurut Hidayat dkk., (2006), bentuk koloni dari suatu bakteri dipengaruhi oleh umur dan syarat pertumbuhan tertentu.
Hasil pewarnaan Gram dari ke-17 isolat menunjukkan bahwa 16 isolat memiliki bentuk sel basil atau batang dan 1 isolat bakteri berbentuk kokus. Seluruh isolat bakteri merupakan Gram positif. Hasil tersebut menunjukkan bahwa bakteri potensial probiotik didominasi oleh bakteri Gram positif. Hasil ini tidak berbeda dengan hasil penelitian terdahulu oleh Wardani dkk., (2013) yang melakukan Inventarisasi bakteri yang berpotensi sebagai probiotik dari usus ikan bandeng (Chanos chanos) dengan menemukan bakteri potensial probiotik dari bakteri Gram positif jenis Lactobacillus dam Micrococcus.
Bentuk sel didominasi oleh basil yaitu sebanyak 16 isolat, sedangkan 1 isolat lain berbentuk kokus. Bentuk-bentuk sel merupakan cara untuk melihat karakteristik dari suatu bakteri yaitu berbentuk bulat, batang dan koma (James dkk., 2008).
Dari ke-17 isolat bakteri yang diperoleh, ditemukan 8 isolat bakteri dengan kode LI1e, LI3a, LI3b, LI5b, LI5d, LI5e, UI1f dan UI5e memiliki ciri morfologi koloni yang sama yaitu tepian siliat, elevasi cembung dan koloni berwarna putih. Ke-8 isolat
bakteri tersebut berasal dari isolasi lambung sebanyak 6 isolat dengan masing-masing kode isolat LI1e, LI3a, LI3b, LI5b, LI5d, dan LI5e serta 2 isolat dari hasil isolasi usus dengan kode isolat UI1f dan UI5e. Hasil uji biokimia ke-8 isolat bakteri tersebut (Tabel 2) menunjukkan bahwa 5 isolat bakteri dengan kode LI5d, LI5b, LI1e, UI1f dan LI5e merupakan Bacillus
cereus. Hasil uji biokimia pada 3 isolat
lainnya dengan kode UI5e, LI3a dan LI3b ditemukan terdapat sedikit perbedaan hasil uji biokimia pada urease, citrat VP, dan gelatin. Namun hasil uji tersebut tetap mengarah pada bakteri Bacillus cereus.
Bakteri B. cereus merupakan merupakan bakteri gram positif yang terlibat dalam pembusukan makanan. Dari hasil penelitian terdahulu, menunjukkan bahwa Bacillus membentuk spesies yang umumnya ditemukan dalam usus hewan dan serangga. Bacillus umumnya diisolasi dari ikan dan krustasea, serta udang dan ditemukan dalam mikroflora insang, kulit dan saluran pencernaan (Cutting, 2006).
B. cereus ditemukan memiliki bentuk koloni dengan tepian seperti cambuk atau siliat, elevasi rata dan berwarna putih. Menurut Holt dkk., (1994), B. cereus memiliki koloni besar, kasar, datar, tidak teratur dengan tepian seperti cambuk, putih dengan penampilan berbintik-bintik. Variasi lain yaitu tipis dan menyebar, kasar, halus dan padat.
Hasil penelitian menunjukkan bahwa dari 17 isolat yang ditemukan, 2 isolat bakteri dengan kode isolat LI1g dan LI2e teridentifikasi sebagai B.
firmus. Setelah dilakukan uji biokimia
pada ke-2 isolat bakteri tersebut (Tabel 3) terdapat perbedaan hasil uji biokimia pada motilitas. Namun hasil uji tersebut tetap mengarah pada bakteri B. firmus.
Bakteri B. firmus merupakan bakteri potensial probiotik yang berhasil diisolasi dari lambung. Berdasarkan hasil penelitian tentang skrining isolat Bacillus dari saluran pencernaan ayam, diperoleh data bahwa B. firmus merupakan bakteri yang berhasil diidentifikasi dan merupakan jenis bakteri probiotik yang dapat bertahan hidup dalam usus dan menguntungkan dengan membentuk spora probiotik yang toleran terhadap kondisi saluran pencernaan dan mampu berasosiasi dengan usus (Barbosa, dkk., 2005).
Hasil penelitian menunjukkan bahwa 6 dari 17 isolat bakteri yang diperoleh teridentifikasi sebagai B.
coagulans. Enam isolat bakteri tersebut
memiliki kode isolat LI1a, LI1f, LI1j, UI3c, UI4g, dan UI5c. Setelah dilakukan uji biokimia (Tabel 4), isolat dengan kode UI4g dan UI5c menunjukkan terdapat sedikit perbedaan hasil uji biokimia pada motilitas, sedangkan isolat dengan kode UI3c, LI1j, LI1a dan LI1f menunjukkan sedikit perbedaan pada hasil uji motilitas, katalase, LIA, VP, dan maltosa. Namun hasil uji tersebut tetap mengarah pada bakteri B.
coagulans.
Bakteri B. coagulans yang berhasil diisolasi dari lambung dan usus sebanyak 6 isolat yang masing-masing 3 isolat berasal dari lambung dan usus. Bakteri B. coagulans merupakan bakteri probiotik yang memiliki ketahanan spora pada lingkungan asam. Dengan demikian, spora B. coagulans kemungkinan bisa bertahan hidup di pH lambung dan usus, di mana sporulasi bisa terjadi (Vecchi dan Drago, 2006).
Menurut Hatmanti (2000), jenis Bacillus sp. menunjukkan bentuk koloni yang berbeda-beda pada medium agar. Warna koloni pada
umumnya putih sampai kekuningan atau putih suram, tepi koloni bermacam-macam namun pada umumnya tidak rata, permukaannya kasar dan tidak berlendir, bahkan ada yang cenderung kering berbubuk, koloni besar dan tidak mengkilat. Bentuk koloni dan ukurannya sangat bervariasi tergantung dari jenisnya.
Menurut Pelczar dkk. (1976), Bacillus spp. membentuk endospora, merupakan gram positif, bergerak dengan adanya flagel peritrikus, dapat bersifat aerobik atau fakultatif anaerobik serta bersifat katalase positif. Selain itu setiap jenis juga menunjukkan kemampuan dan ketahanan yang berbeda dalam kondisi lingkungannya, misalnya ketahanan terhadap panas, asam dan kadar garam (Hatmanti, 2000).
Hasil penelitian ditemukannya 1 isolat bakteri Micrococcus sp. yang berasal dari isolasi lambung. Setelah dilakukan uji biokimia pada isolat dengan kode LI4b (Tabel 5), terdapat sedikit perbedaan hasil uji biokimia pada urease, O/F, dan VP. Namun hasil uji tersebut tetap mengarah pada bakteri Micrococcus sp.
Bakteri Micrococcus sp. yang berhasil diisolasi merupakan salah satu bakteri potensial probiotik. Hal ini sesuai dengan Rhman, dkk (2009), yang menyatakan bahwa Micrococcus sp. merupakan bakteri yang juga memiliki kemampuan antibakteri terhadap beberapa bakteri lain. Micrococcus spp. umumnya dikenal sebagai mikroflora kulit normal dan aktivitas antibakteri jarang dilaporkan terhadap patogen yang berbeda.
Menurut Holt dkk. (1994), bakteri Micrococcus sp. merupakan Gram+ dan biasanya jarang motil, tidak berspora, aerobik, biasanya koloni bercorak dari kuning atau merah, kemoorganotrof, dengan metabolisme
pernapasan, sering memproduksi sedikit atau tidak ada asam dari karbohidrat. Biasanya tumbuh pada media yang sederhana. Katalase positif dan kadang oksidase positif, meskipun sangat jarang.
Hidrolisis Pati (Amilum) dan Kasein (Protein) Pada Isolat Bakteri
Prinsip dasar kerja probiotik adalah pemanfaatan kemampuan mikroorganisme dalam memecah atau menguraikan rantai panjang karbohidrat, protein dan lemak yang menyusun pakan yang diberikan. Kemampuan ini diperoleh karena adanya enzim-enzim khusus yang dimiliki oleh mikroba untuk memecah ikatan tersebut. Menurut Effendi (2002), pemecahan molekul-molekul kompleks menjadi molekul sederhana jelas akan mempermudah pencernaan lanjutan dan penyerapan oleh saluran pencernaan pada ikan. Di sisi lain, mikroorganisme pelaku pemecah ini mendapat keuntungan berupa energi yang diperoleh dari hasil perombakan molekul kompleks tersebut.
Uji hidrolisis pati (amilum) dilakukan untuk mengetahui kemampuan bakteri dalam menguraikan karbohidrat. Hidrolisis dari pati dapat terjadi dengan bantuan enzim amilase yang akan mengubah amilum menjadi maltosa. Uji hidrolisis pati ditandai dengan terbentuknya zona bening setelah diteteskan iodin pada isolat bakteri. Hal ini terjadi karena molekul pati merupakan molekul yang larut dalam air dan memberikan warna biru apabila tercampur dengan larutan iodin dan akan membentuk zona bening apabila menghidrolisis pati.
Uji hidrolisis protein dilakukan untuk mengetahui kemampuan bakteri dalam menguraikan protein dengan menghasilkan enzim protease. Uji ditandai dengan terbentuknya zona
bening disekeliling bakteri yang ditanam pada media Skim Milk Agar atau media susu skim yang mengandung kasein yang dapat dipecah oleh mikroorganisme proteolitik.
Protease merupakan enzim yang digunakan secara luas pada industri pakan ternak. Salah satu fungsi protease yaitu berperan dalam degradasi protein menjadi asam amino, sehingga menjadikan pakan ternak lebih mudah diserap oleh pencernaan hewan ternak. Penggunaan enzim pada pakan ternak ditujukan untuk mengurangi faktor-faktor antinutrisi dalam pakan, meningkatkan daya cerna pakan, meningkatkan ketersediaan zat-zat gizi tertentu, serta mengurangi masalah polusi kotoran ternak (Badriyah dan Ardyati, 2013).
Dari hasil penelitian diperoleh bahwa isolat bakteri potensial probiotik berasal dari genus Bacillus sp. dan Micrococcus sp. melalui uji yang telah dilakukan. Uji hidrolisis pati bertujuan untuk mengetahui kemampuan bakteri dalam menguraikan amilum dan kasein untuk mengetahui kemampuan bakteri dalam menguraikan protein. Bacillus sp. merupakan salah satu jenis bakteri yang memiliki kemampuan untuk menghasilkan protease (Baehaki, 2011) dan merupakan jenis bakteri yang terdapat dihampir semua tempat termasuk di dalam saluran pencernaan (Susanti, 2002).
Menurut Fardiaz (1992), Bacillus sp. mempunyai sifat dapat mensekresikan enzim protese, lipase dan amilase. Jenis dari marga Bacillus spp. mempunyai kemampuan enzimatik yang berbeda-beda dalam menghasilkan enzim, diantaranya dalam menghasilkan enzim amilase, protease, dan lipase (Rahayu, 1990).
Indikasi Penghambatan Bakteri
Aeromonas hydrophilla
Dari hasil penelitian dengan uji penghambatan bakteri Aeromonas hydrophila, diperoleh hasil bahwa ke-17 isolat yang dapat menghidrolisis pati (amilum) dan kasein (protein) mampu menghambat pertumbuhan bakteri A. hydrophila. B. cereus, B. firmus, B. coagulans dan Micrococcus sp. menunjukkan indikasi penghambatan terhadap bakteri A. hydrophila. Murillo dan Villamil (2011), melaporkan B. cereus dan B. subtilis memiliki aktivitas antibakteri yang kuat terhadap Vibrio alginolyticus dan A. hydrophila. Namun aktivitas penghambatan yang kuat tidak jelas ditemukan pada uji in vivo.
B. firmus dan B. coagulans merupakan jenis Bacillus yang juga ditemukan potensial probiotik pada ikan gurami. B. firmus dan B. coagulans memiliki zona bening yang menunjukkan adanya indikasi penghambatan pertumbuhan A. hydrophila. Feliatra dkk., (2012), menemukan efektifitas bakteri probiotik melalui antagonis bakteri probiotik terhadap bakteri patogen pada ikan. Bakteri B. cereus memberikan respon positif yaitu terbentuknya hambatan pada pertumbuhan bakteri Aeromonas sp dan vibrio sp, respon terlihat dengan terbentuknya zona yang terputus oleh adanya pertumbuhan bakteri B. cereus. Lusiastuti dan Taukhid (2010), menjelaskan bahwa B. firmus merupakan bakteri probiotik
yang mampu menghambat
pertumbuhan A. hydrophila sebagai bakteri patogen pada ikan air tawar.
Dari ke-17 isolat, 1 isolat merupakan jenis Micrococcus sp. yang juga memiliki indikasi penghambatan A. hydrophila. Dengan demikian Micrococcus sp. merupan bakteri yang potensial probiotik pada ikan gurami
karena menghambat pertumbuhan A. hydrophila. Osman, dkk. (2010), menyatakan bahwa Micrococcus sp. merupakan bakteri yang bermanfaat karena memiliki peran dalam pengendalian penyakit, promotor pertumbuhan dan juga meningkatkan parameter fisiologis seperti aliran darah di antara ikan nila. Selain itu, memiliki efek antagonis terhadap patogen A. hydrophila secara in vitro serta mendukung pertumbuhan dan tingkat kelangsungan ikan nila pada uji secara in vivo.
Menurut Abd El-Rhman dkk., (2009) micrococcus luteus yang diisolasi dari gonad dan saluran pencernaan ikan nila menunjukkan aktivitas antimikroba terhadap A. hydrophila dan ditemukan memiliki kemampuan probiotik yang baik untuk meningkatkan pertumbuhan ikan nila dengan penambahan pada pakan, serta memiliki kemampuan untuk mengurangi flora mikroba patogen dan meningkatkan adsorpsi makanan dalam usus. Chabrillon dkk., (2005) melaporkan kemampuan probiotik yang baik dari Micrococcus dalam jangka waktu memiliki kemampuan antagonis terhadap Vibrio harveyi. Irianto dan Austin (2003) berhasil menggunakan M. luteus secara in vitro sebagai probiotik dari ikan salmon (Oncorhynchus mykiss) terhadap infeksi Aeromonas salmonicida.
Walaupun zona hambat probiotik tidak luas dan hanya menunjukkan indikasi penghambatan, tetapi itu sudah memberikan indikasi bahwa bakteri-bakteri tersebut mempunyai kemampuan menghambat pertumbuhan patogen yang nantinya dapat diteliti lebih mendalam tentang uji penggunaan bakteri tersebut secara langsung pada ikan (in vivo).
KESIMPULAN DAN SARAN Kesimpulan
1. Bakteri potensial probiotik yang didapatkan dari isolasi lambung dan usus ikan gurami (O. gouramy) yaitu B. cereus, B. firmus, B. coagulans dan Micrococcus sp. 2. Bakteri potensial probiotik yang
didapatkan dan mendominasi adalah B. cereus sebanyak 8 isolat yang masing-masing 6 isolat berasal dari lambung dan 2 isolat berasal dari usus.
3. Isolat bakteri potensial probiotik yang berhasil diidentifikasi
menunjukkan indikasi
penghambatan terhadap A. hydrophila.
Saran
Identifikasi isolat bakteri potensial probiotik dilakukan berdasarkan karakterisasi secara manual, sehingga perlu dilakukan identifikasi secara molekuler atau Polimeration Chain Reaction (PCR) dan penelitian lebih lanjut terhadap ikan uji secara in vivo dengan pemberian isolat bakteri potensial probiotik pada media air ikan.
DAFTAR PUSTAKA
Abd El-Rhman, A.M., Y. A. Khattab., dan A. M. Shalaby. 2009. Micrococcus luteus and Pseudomonas Species as Probiotics for Promoting the Growth Performance and Health of Nile Tilapia, Oreochromis niloticus. Journal Fish Shellfish Immunology. 27:175-80.
Afrianto, E. dan E. Liviawaty. 2005. Pakan Ikan. Kanisius, Yogyakarta.
Angert, E. R., and R. M. Losick. 1998. Propagation by Sporulation in the Guinea Pig Symbiont
Metabacterium polyspora. Proc. Natl. Acad. Sci. USA 95:10218–10223.
Anggriani, R., Iskandar dan A. Taofiqurohman. 2012. Efektifitas Penambahan Bacillus sp. Hasil Isolasi dari Saluran Percernaan Ikan Patin pada Pakan Komersial Terhadap Kelangsungan Hidup dan Pertumbuhan Benih Ikan Nila Merah (Oreochromis niloticus). Jurnal Perikanan dan Kelautan. 3(3): 75-83.
Aryati, Y dan H. Supriyadi. 2004. Eksplorasi Bakteri Probiotik Sebagai Antibakteri Untuk Penanggulangan Penyakit Streptococcosis. Pusat Riset Perikanan Budidaya, Jakarta. Badriyah, B. I dan T. Ardyati. 2013.
Deteksi Aktivitas Proteolitik Isolat Asal Ampas Tahu pada Substrat Bekatul. Jurnal Biotropika. 1(3).
Baehaki, A., Rinto., dan A. Budiman. 2011. Isolasi dan Karekterisasi Protease dari Bakteri Tanah Rawa Indralaya, Sumatera Selatan. Jurnal Teknologi dan Industri Pangan. 22(1): 10-16. Barbosa, T. M., C. R. Serra., R. M. L.
Ragione., M. J. Woodward., dan A. O. Henriques. 2004. Screening for Bacillus Isolates in the Broiler Gastrointestinal Tract. Journal American Society for Microbiology. 71(2): 968 -978.
Cappucino J. G. 1983. Microbiology: A Laboratory Manual. Addison Wesley Publishing Company. Chabrillon, M., R. M. Rico., S. Arijo.,
P. Diazrosales., M. C. Balebona., dan M. A. Morinigo. 2005. Interactions of Microorganisms Isolated from Gilthead Sea Bream, Sparus
aurata L. on Vibrio harveyi a Pathogen of Farmed Senegalese Sole Solea senegalensis (Kaup). Journal Fish Disease. 28:531-537.
Claus, D. dan R.C.W. Berkeley. 1986. Genus Bacillus di Dalam: Sneath PHA et al., eds. Bergey's Manual of Systematic Bacteriology. Volume ke- 2. Baltimore: Lippincott Willians & Wilkins.
Cowan, S. T and Steel. 1974. Manual for the Identification of Medical Bacteria. Second Edition. Cambridge University Press. Cambridge.
Cutting, S. 2006. Bacterial Spore Formes as Probiotics. Journal Research and Development. 14(6).
Darmayasa I.B.G. 2008. Isolasi dan Identifikasi Bakteri Pendegradasi Lipid (Lemak) pada Beberapa Tempat Pembuangan Limbah dan Estuari DAM Denpasar. Jurnal Bumi Lestari. 8(2): 122-127. Effendi, I. 2002. Probiotik untuk
Pencegahan Penyakit Biota Laut. Fakultas Perikanan dan Ilmu Kelautan Universitas Riau, Riau.
Fardiaz, D. 1992. Mikrobiologi Pangan I. Gramedia. Jakarta.
Feliatra., I. Efendi., dan E. Suryadi. 2004. Isolasi dan Identifikasi Bakteri Probiotik dari Ikan Kerapu Macan (Ephinephelus fuscogatus) dalam Upaya Efisiensi Pakan. Jurnal Natur Indonesia 6(2): 75-80.
Feliatra., Y. Fitria., dan Nursyirwani. 2012. Antagonis Bakteri Probiotik yang Diisolasi dari Usus dan Lambung Ikan Kerapu Bebek (Cromileptes Altivelis) Terhadap Bakteri
Patogen. Fakultas Perikanan dan Ilmu Kelautan Universitas Riau. Jurnal Perikanan Dan Kelautan. 17(1): 16-25.
Fuller, R. 1989. A Review, Probiotics in Man and Animals. Journal of Applied Bacteriology. 66(5): 365-367.
Gatesoupe, F.J. 1999. The Used of Probiotics in Aquaculture. Journal Aquaculture 180: 147-165.
Hadioetomo, R. S. 1993. Mikrobiologi Dasar Dalam Praktek Teknik dan Prosedur Dasar Laboratorium. Penerbit Gramedia, Jakarta.
Hatmanti, A. 2000. Pengenalan Bacillus Spp.. Jurnal Oseana. 25(1): 31-41.
Hidayat, N., M.C. Padaga, S. Suhartini. 2006. Mikrobiologi Industri. Penerbit Andi, Yogyakarta. Holt, J. G., N. R. Kreig., P. H. A.
Sneath., dan J. T. Staley. 1994. Bergey’s Manual of Determinative Bacteriology. Williams and Wilkins Company, United States of America Baltimore.
Irianto, A. 2003. Probiotik Akuakultur. Gadjah Mada University Press, Yogyakarta.
Irianto, A. 2005. Patologi Ikan Teleostei. Gadjah Mada University Press, Yogyakarta. Irianto, A. dan B. Austin. 2003. Use of
Dead Probiotic Cells to Control Furunculosis in Rainbow Trout,
Oncorhynchus mykiss
(Walbaum). Journal Fish Disease. 26:59-62.
James, J., C. Baker, dan H. Swain. 2008. Prinsip-prinsip Sains untuk Keperawatan. Erlangga, Jakarta.
Lusiastuti, A.M., dan Taukhid. 2010. Seleksi Kandidat Probiotik Anti Aeromonas hydrophila untuk Pengendalian Penyakit Ikan Air Tawar. Balai Riset Penelitian Budidaya Air Tawar.
Macey, B.M. dan V. E. Coyne. 2005. Improved Growth Rate and Disease Resistance of Farmed Haliotis Midae Through Probiotic Treatment. Journal Aquaculture. 245: 249-261. Moriarty, D.J.W. 1998. Control of
Luminous Vibrio Species in Penaeid Aquaculture Ponds. Journal Aquaculture. 351 – 358. Murillo, I dan L. Villamil. 2011.
Bacillus Cereus and Bacillus Subtilis Used as Probiotics in Rotifer (Branchionus plicatilis) cultures. Journal Aquaculture Research and Development. 31(7).
Osman, H.A.M., T. B. Ibrahim., W. Solimani., dan O. Aboud. 2010. Improvement Growth and Immune Status Using a Potential Probiotic Bacteria Micrococcus among Culured Oreochromis niloticus. Journal Science New York. 3(10): 5-11. Parker, R. B. 1974. Probiotics, the
Other Half of the Antibiotics Story. Journal Animal and Nutrition Health. 29: 4-8.
Rahayu, K. 1990. Enzim Mikroba. Departemen Pendidikan dan Kebudayaan, PAU Pangan dan Gizi. Institut Pertanian Bogor, Bogor.
Safrida, Y. D., C. Yulfizar dan C. N. Devira. 2012. Isolasi dan Karakterisasi Bakteri Berpotensi Probiotik pada Ikan Kembung (Rastrelliger sp.). Jurnal Depik. 1(3): 200-203.
Sianturi, D. C. 2008. Isolasi Bakteri dan Uji Aktivitas Amilase Termofil Kasar dari Sumber Air Panas Penen Sibirubiru Sumatera Utara. Tesis. Sekolah Pascasarjana. Universitas Sumatera Utara.
Susanti, E.V.H. 2002. Isolasi dan Karakterisasi Protease dari Bacillus subtilis 1012M15. Program Studi Kimia Universitas Sebelas Maret, Surakarta. Jurnal Biodiversitas. Vecchi, E. D., dan L. Drago.2006.
Lactobacillus Sporogenes or Bacillus Coagulans: Misidentification or Mislabelling?. International Journal Of Probiotics and Prebiotics. 1(1): 3-10.
Yandes, Z., R. Affandi., dan I. Mokoginta. 2003. Pengaruh Pemberian Selulosa Dalam Pakan Terhadap Kondisi Biologis Benih Ikan Gurami (Osphronemus gouramy Lac). Jurnal Ikhtiologi Indonesia. 3(1).
Yulfizar, C. 2013. Isolasi dan Identifikasi Bakteri Probiotik pada Rastrelliger sp.. Jurnal Biospecies. 6(2): 1-7.
Yulinery, T., E. Yulianto, dan N. Nurhidayat. 2006. Uji Fisiologis Probiotik Lactobacillus sp. Mar 8 yang Telah Dienkapsulasi dengan Menggunakan Spray Dryer untuk Menurunkan Kolesterol. Jurnal Biodiversitas. 7(2): 118-122.