Pada bab ini anda akan mempelajari tentang kromatografi gas, instrumentasi dari kromatografi gas, penerapan dari kromatografi gas, fase diam cair dan fase diam padatan pada kromatografi gas,
dan aplikasi komatografi gas dalam berbagai bidang. Sumber gambar:
http://www.diabloanalytical.com/wp-content/uploads/2012/06/gc-columns.png
Tujuan Pembelajaran
1. Mengetahui definisi dan klasifikasi kromatografi. 2. Mengetahui instrumentasi dari kromatografi gas. 3. Mengetahui penerapan dari kromatografi gas.
4. Mengetahui fase diam cair dan fase diam padatan pada kromatografi gas.
5. Mengetahui aplikasi komatografi gas dalam berbagai bidang.
emisahan campuran-campuran dari komponen-komponennya adalah hal yang penting dalam semua cabang kimia dan tidak kalah pentingnya dalam bidang lain dimana teknik-teknik kimia digunakan untuk memecahkan berbagai macam masalah. Jadi dampak dari suatu teknik pemisahan yang ampuh dan serbaguna akan dirasakan oleh seluruh ilmu pengetahuan modern. Dalam ketelitian ini, ketelitian kromatografi jarang sekali ditekankan. Dengan menggunakan metode kromatografi, dalam banyak kasus pemisahan dituntaskan jauh lebih cepat dan lebih efektif daripada sebelumnya, dan banyak pemisahan-pemisahan yang tak pernah dilakukan teknik-teknik lainnya telah berhasil.
P
Terobosan yang tidak tetandingi dalam biokimia misalnya, dalam pengertian kita tentang struktur dan fungsi enzim dan protein-protein lainnya berasal langsung dari penerapan kromatografi ke penelitiian biologi. Menghitung polusi air dan udara, menentukan pestisida pada buah-buahan dan sayur-sayuran, mengidentifikasi dan mengklasifikasi bakteri, memantau gas-gas dalam pernafasan selama pembiusan, mencari senyawa-senyawa organik dan makhluk hidup di planet lain. Menentukan jalur-jalur metabolisme dan mekanisme kerja obat-obatan semuanya berderet dalam daftar panjang penelitian berdasarkan kromatografi.
Perkembangan teoritis memampukan pemahaman menyeluruh tentang proses kromatografi dan dengan demikian menjelaskan faktor-faktor yang menentukan kinerja kolom muncul pertama kali dalam
KROMATOGRAFI
GAS
kaitannya dengan kromatografi gas. Namun, kepastian dari pemahaman ini telah terbukti, dengan penyesuaian yang cocok, sama-sama berguna dalam pemahaman kromatografi di mana fasa bergeraknya adalah sutu cairan. Jadi, telah dimulai sekitar tahun 1968 sebuah revolusi dalam kromatografi cair yang menjanjikan kecepatan dan efisiensi baru dalam pemisahan-pemisahan senyawa-senyawa yang tak mudah menguap (non volatil) yang mana dalam keduanya itu tidak dimiliki oleh kromatografi gas.
Karena nilainya yang sangat penting dalam bidang banyak penelitian, kromatografi merupakan suatu bidang yang sangat maju dengan pesat. Perkembangan terus berlanjut, beberapa diantaranya adalah munculnya detektor-detektor yang lebih baik, bahan pengisi kolom yang baru, antarmuka dengan instrumen lain yang disempurnakan (seperti spektrometer massa) yang bias mengidentifikasi komponen-komponen yang terpisah, teknik pemrosesan data yang baru berdasarkan pada komputer, dan model matematis baru yang memberikan wawasan tambahan baru pada sifat proses tersebut.
5.1 PENGERTIAN KROMATOGRAFI GAS
Kromatografi adalah suatu metode pemisahan fisik di mana komponen-komponen yang dipisahkan didistribusikan di antara dua fasa, salah satu fasa tersebut adalah suatu lapisan stasioner dengan permukaan yang luas, yang lainnya sebagai fluida yang mengalir lembut di sepanjang landasan stasioner.
Fasa stasioner dapat berupa cairan maupun padatan, sedangkan fasa bergerak biasa berupa cairan maupun gas. Jadi semua jenis kromatografi yang diketahui diorganisir jadi satu dalam empat kategori seperti yang ditunjukkan pada tabel 5.1.
Tabel 5.1 Empat kategori kromatografi
FASA
Fasa
bergerak Cair Gas Cair Gas
Contoh-contoh Kromatografi asli Twsett, dengan larutan petroleumeter dan kolom CaCO3 Kromatografi pertukaran ion Kromatografi gas-padat, atau GSC Kromatografi partisi pada kolom silica gel Kromatografi kerta
Kromatografi gas-cair atau GLC
Dalam semua teknik kromatografi, zat-zat yang terlarut dipisahkan bermigrasi sepanjang kolom (atau, seperti dalam kromatografi kertas atau lapis tipis, ekivalen fiksik kolom) dan tentu saja dasar pemisahan terletak dalam laju perpindahan yang berbeda untuk larutan yang berbeda. Kita boleh menganggap laju perpindahan sebuah zat terlarut sebagai hasil dari dua faktor, yang satu cenderung menggerakkan zat terlarut itu dan yang lain menahannya. Dalam proses asli Tswett, kecendrungan zat-zat terlarut untuk menyerap pada fasa padat menahan pergerakan mereka, sementara kelarutannya dalam fasa cair bergerak cenderung menggerakkan mereka. Perbedaan yang kecil antara dua zat terlarut dalam kekuatan adsorpsi dan dalam interaksinya dengan pelarut yang bergerak menjadi dasar pemisahan bila molekul-molekul zat terlarut itu berulang kali menyebar di antara dua fasa itu keseluruh panjang kolom.
Banyaknya macam-macam kromatografi yang salah satunya adalah kromatografi gas, yang merupakan metode kromatografi pertama yang dikembangkan pada zaman instrument dan elektronika. Kromatografi gas metode yang tepat dan cepat untuk memisahkan campuran yang sangat rumit. Waktu yang dibutuhkan beragam, mulai dari beberapa detik untuk campuran yang sederhana sampai berjam-jam untuk campuran yang mengandung 500-1000 komponen. Metode ini sangat baik untuk analisis senyawa organik yang mudah menguap (volatil).
Kromatografi gas adalah proses pemisahan campuran menjadi komponen-komponennya dengan menggunakan gas sebagai fase bergerak yang melewati suatu lapisan serapan (sorben) yang diam.
Kromatografi gas fase gerak dan fase diamnya di antaranya :
1. Fase gerak adalah gas dan zat terlarut terpisah sebagai uap. Pemisahan tercapai dengan partisi sampel antara fase gas bergerak.
2. Fase diam berupa cairan dengan titik didih tinggi (tidak mudah menguap) yang terikat pada zat padat penunjangnya.
Kromatografi gas termasuk dalam salah satu alat analisa (analisa kualitatif dan analisa kuantitatif), kromatografi gas dijajarkan sebagai cara analisa yang dapat digunakan untuk menganalisa senyawa-senyawa organik. Ada 2 jenis kromatografi gas, yaitu :
1. Kromatografi gas–cair (KGC) yang fase diamnya berupa cairan yang diikatkan pada suatu pendukung sehingga solut akan terlarut dalam fase diam.
2.Kromatografi gas-padat (KGP), yang fase diamnya berupa padatan dan kadang-kadang berupa polimerik.
Dalam kedua hal ini sebagai fasa bergerak adalah gas (hingga keduanya disebut kromatografi gas), tetapi fasa diamnya berbeda. Meskipun kedua cara tersebut mempunyai banyak persamaan. Perbedaan antara kedunya hanya tentang cara kerja. Pada kromatografi gas padat (KGP) terdapat adsorbsi dan pada kromatografi gas cair (KGC) terdapat partisi (larutan). Kromatografi gas padat (KGP) digunakan sebelum tahun 1800 untuk memurnikan gas. Metode ini awalnya kurang berkembang. Penemuan jenis-jenis padatan baru sebagi hasil riset memperluas penggunaan metode ini. Kelemahan metode ini mirip dengan kromatografi cair padat. Sedangkan kromatografi gas cair sering disebut oleh para pakar kimia organik sebagai kromatografi fasa uap. Pertama kali dikenalkan oleh James dan Martin pada tahun 1952. Metode ini paling banyak digunakan karena efisien, serba guna, cepat dan peka. Cuplikan dengan ukuran beberapa mikrogram sampel dengan ukuran 10 gram masih dapat dideteksi. Komponen cuplikan harus mempunyai tekanan
Fase diam merupakan salah satu komponen yang penting dalam proses pemisahan dengan kromatografi karena dengan adanya interaksi dengan fase diamlah terjadi perbedaan waktu retensi (tR) dan terpisahnya komponen senyawa analit.
Fase diam dapat berupa bahan padat atau porous (berpori) berbentuk molekul kecil atau cairan yang umumnya dilapiskan pada padatan pendukung.
5.2 PRINSIP KERJA KROMATOGRAFI GAS
Kromatografi gas mempunyai prinsip yang sama dengan kromatografi lainnya, tapi memiliki beberapa perbedaan misalnya proses pemisahan campuran dilakukan antara stasionary fase cair dan gas fase gerak dan pada oven temperatur gas dapat dikontrol sedangkan pada kromatografi kolom hanya pada tahap fase cair dan temperatur tidak dimiliki.
Kromatografi gas merupakan teknik pemisahan yang mana
solute-solute yang mudah menguap (dan stabil terhadap panas) bermigrasi
melalui kolom yang mengandung fase diam dengan suatu kecepatan yang tergantung pada rasio distribusinya. Pemisahan pada kromatografi gas didasarkan pada titik didih suatu senyawa dikurangi dengan semua interaksi yang mungkin terjadi antara solute dengan fase diam. Selain itu juga penyebaran cuplikan di antara dua fase. Salah satu fase ialah fase diam yang permukaannya nisbi luas dan fase yang lain yaitu gas yang mengelusi fase diam. Fase gerak yang berupa gas akan mengelusi solute dari ujung kolom lalu menghantarkannya ke detector. Prinsip utama pemisahan dalam kromatografi gas adalah berdasarkan perbedaan laju migrasi masing-masing komponen dalam melalui kolom. Komponen-komponen yang terelusi dikenali (analisa kualitatif) dari nilai waktu retensinya (Tr).
Gas pembawa (biasanya digunakan Helium, Argon atau Nitrogen) dengan tekanan tertentu dialirkan secara konstan melalui kolom yang berisi fase diam. Selanjutnya sampel diinjeksikan ke dalam injektor
(Injection Port) yang suhunya dapat diatur. Komponen- komponen dalam sampel akan segera menjadi uap dan akan dibawa oleh aliran gas pembawa menuju kolom. Komponen- komponen akan teradopsi oleh fase diam pada kolom kemudian akan merambat dengan kecepatan berbeda sesuai dengan nilai Kd masing-masing komponen sehingga terjadi pemisahan.
Komponen yang terpisah menuju detektor dan akan terbakar menghasilkan sinyal listrik yang besarnya proporsional dengan komponen tersebut. Sinyal lau diperkuat oleh amplifier dan selanjutnya oleh pencatat (recorder) dituliskan sebagai kromatogram berupa puncak. Puncak konsentrasi yang diperoleh menggambarkan arus detektor terhadap waktu.
Secara sederhana prinsip kromatografi gas adalah udara dilewatkan melalui nyala hidrogen (hydrogen flame) selanjutnya uap organik tersebut akan terionisasi dan menginduksi terjadinya aliran listrik pada detektor, kuantitas aliran listrik sebanding dengan ion.
5.3 INSTRUMENTASI KROMATOGRAFI GAS
Dalam kromatografi gas, gas yang dapat digunakan sebagai fase gerak dan zat padat atau zat cair digunakan sebagai fase diam. Gas digunakan sebagai fase gerak karena sifatnya yang bergerak ke mana saja dan tidak mau diam. Untuk memahami bagaimana proses kromatografi gas berlangsung, perhatikanlah diagram alat kromatografi gas dalam gambar 5.1.
(a)
(b)
Gambar 5.1 (a) Diagram alat GC, (b) Intsrumen GC keseluruhan
Mekanisme kerja kromatografi gas adalah sebagai berikut. Gas dalam silinder baja bertekanan tinggi dialirkan melalui kolom yang berisi fase diam. Cuplikan berupa campuran akan dipisahkan, biasanya dalam bentuk larutan, disuntikkan gas pembawa ke dalam aliran gas tersebut. Kemudian cuplikan dibawa oleh gas pembawa ke dalam kolom dan di dalam kolom terjadi proses pemisahan. Komponen-komponen campuran yang telah terpisah satu persatu meninggalkan kolom. Suatu detektor diletakkan di ujung kolom untuk mendeteksi jenis maupun jumlah tiap komponen campuran. Hasil pendeteksian direkam dengan rekorder dan dinamakan kromatogram yang terdiri dari beberapa peak. Jumlah peak yang dihasilkan menyatakan jumlah komponen (senyawa) yang terdapat di dalam campuran. Bila suatu kromatogram terdiri 5 peak maka terdapat 5 senyawa 5 kompenen dalam campuran tersebut. Sedangkan luas peak bergantung kepada kuantitas suatu komponen dalam campuran. Karena peak-peak dalam kromatogram berupa segitiga maka luasnya dapat dihitung berdasarkan tinggi dan lebar peak tersebut. Berikut ini akan dibahas komponen-komponen instrumentasi kromatografi gas.
5.3.1 Gas Pembawa
Gas pembawa sebagai fase gerak yang dapat digunakan dalam instrumen kromatografi gas adalah gas yang bersifat inert (tidak bereaksi) dengan cuplikan maupun fase diam, murni, mudah didapat dan murah harganya, dapat mengurangi difusi dari gas dan cocok untuk detektor
yang digunakan. Gas-gas yang biasa digunakan adalah gas helium, argon, nitrogen dan hidrogen. Karena gas disimpan dalam silinder baja bertekanan tinggi maka gas tersebut akan mengalir dengan sendirinya secara cepat sambil membawa komponen-komponen campuran yang akan atau yang sudah dipisahkan. Dengan demikian gas tersebut disebut juga gas pembawa (gas carrier). Oleh karena gas pembawa mengalir dengan cepat maka pemisahan dengan teknik kromatografi gas hanya memerlukan waktu beberapa menit saja.
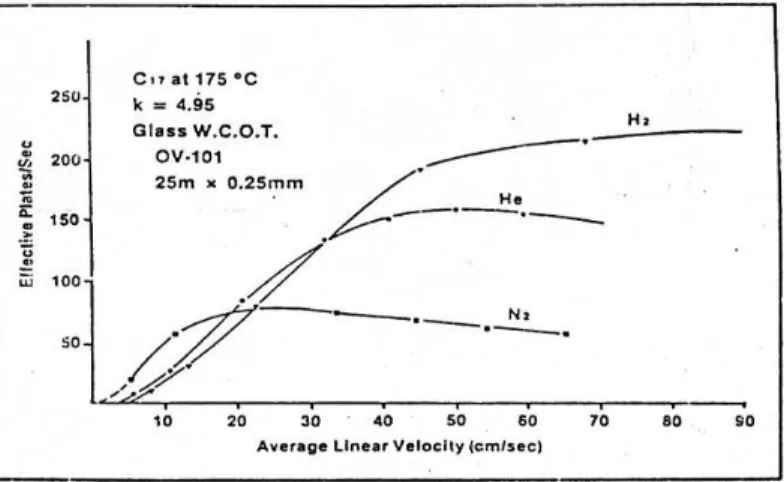
Karakteristik 3 jenis gas pembawa hidrogen, helium dan nitrogen diperlihatkan gambar 5.2.
Gambar 5.2 Karakteristik gas pembawa hidrogen, helium dan nitrogen
Ketika gas pembawa hampir memberikan harga HETP yang sama tapi pada kecepatan alir yang berbeda. Gas N2 memerlukan kecepatan alir yang lambat (10 cm/detik) untuk mencapai kinerja (efisiensi) yang optimum dengan HETP minimum. Sementara H2 dan He dapat dialirkan lebih cepat untuk memperoleh efisiensi yang optimum, 25 cm/detik untuk gas He dan 35 cm/detik untuk H2. Berdasarkan gambar di atas terlihat bahwa kinerja H2 berkurang sedikit demi sedikit dengan kenaikan kecepatan alir. Sedangkan kinerja N2 berkurang secara drastis dengan kenaikan laju alir. Hal ini berarti bahwa H2 dapat memberikan resolusi yang hampir sama dengan yang lain pada laju alir yang lebih cepat.
Oleh karena solut berdifusi lebih cepat melalui H2 dan He daripada melalui N2 maka H2 dan He memberikan resolusi yang lebih baik pada
fase gerak dan fase diam maka semakin kecil pula faktor transfer massa. Difusi solut yang cepat dalam H2 dan He membantu mempercepat kesetimbangan di antara fase gerak dan fase diam sehingga meningkatkan efesiensi atau menurunkan harga HETP. Dalam hal efisiens, H2 merupakan pilihan gas pembawa yang baik. Kalau percobaan dilakukan pada tekanan tetap, kecepatan alir akan berkurang ketika suhu dinaikkan. Keuntungan lain gas pembawa H2 adalah memberikan efisiensi relatif lebih stabil dengan perubahan kecepatan alir. Akan tetapi, H2 mudah meledak bila berkontak dengan udara. Oleh karena itu, He banyak digunakan sebagai pengganti H2.
Kotoran yang terdapat dalam gas pembawa dapat merusak kolom secara perlahan karena fase diam bereaksi dengan kotoran tersebut. Oleh karena itu, gas berkualitas tinggi harus digunakan untuk merawat kolom dari kerusakan untuk menghilangkan kotoran dalam gas pembawa, biasanya gas dialirkan melalui saringan yang disebut molecular seive untuk menghilangkan air dan hidrokarbon.
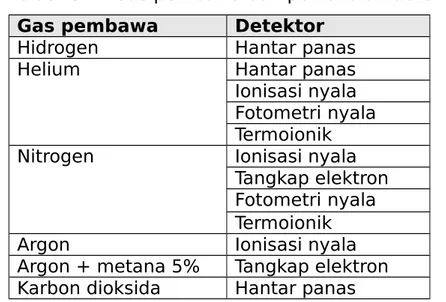
Penggunaan gas dengan berbagai jenis detektor diringkas dalam tabel 5.2 sebagai berikut:
Tabel 5.2. Gas pembawa dan pemakaian detektor
Gas pembawa Detektor
Hidrogen Hantar panas
Helium Hantar panas
Ionisasi nyala Fotometri nyala Termoionik Nitrogen Ionisasi nyala
Tangkap elektron Fotometri nyala Termoionik
Argon Ionisasi nyala
Argon + metana 5% Tangkap elektron Karbon dioksida Hantar panas
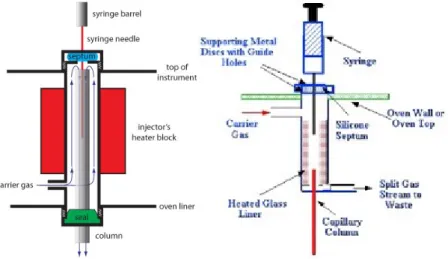
5.3.2 Pemasukan Cuplikan
Cuplikan yang dapat dianalisis menggunakan kromatografi gas dapat berupa zat cair atau gas. Dengan syarat cuplikan tersebut mudah
menguap dan stabil (tidak rusak pada kondisi operasional). Di tempat pemasukan cuplikan terdapat pemanas yang suhunya dapat diatur untuk menguapkan cuplikan. Suhu tempat penyuntikan cuplikan biasanya 50⁰ C di atas titik didih cuplikan. Bila cuplikan rusak pada suhu tersebut maka cuplikan tersebut tidak dapat dianalisis dengan teknik kromatografi gas. Jumlah cuplikan yang disuntikkan ke dalam aliran fase gerak sekitar 5µL.
Tempat pemasukan cupllikan cair ke dalam pak kolom biasanya terbuat dari tabung gelas di dalam blok logam panas. Cuplikan disuntikkan dengan bantuan alat suntik melalui karet septum kemudian diuapkan di dalam tabung gelas. Gas pembawa meniup uap cuplikan melalui kolom kromatografi. Untuk kolom analitik memerlukan antara 0,1-10 µL cuplikan cair sedangkan kolom preparatif memerlukan antara 20-1000 µL. Cuplikan berbentuk gas dapat dimasukkan dengan bantuan alat suntik gas
(gas-tight syrinnge) atau kran gas (gas-sampling valve). Kolom analitik
biasanya memerlukan 0,5-1 µL sedangkan kolom preparatif dapat menampung sampai 1 µL gas. Untuk jenis kolom terbuka diperlukan alat pemasukan cuplikan yang lebih rumit seperti diperlihatkan dalam gambar 5.3.
Gambar 5.3 Pemasuk cuplikan
Alat pemasukan cuplikan untuk kolom terbuka mengandung pipa gelas dan gelas wool yang secara perlahan dapat terkontaminasi oleh cuplikan yang tidak menguap dan dapat terurai. Oleh karena itu, bagian ini
Alat pemasukan cuplikan untuk kolom terbuka dikelompokkan ke dalam 2 kategori yaitu injeksi split (split injection) dan injeksi splitless (splitless injection). Injeksi split dimaksudkan untuk mengurangi volume cuplikan yang masuk ke kolom. Volume cuplikan yang masuk ke kolom hanya 0,1-10% dari 0,1-2 µL, sementara sisanya dibuang.
Berdasarkan gambar 5.3. di atas, cuplikan disuntikkan melalui septum ke dalam daerah penguapan cuplikan sementara kran 1 ditutup. Gas pembawa dari pengontrol aliran meniup cuplikan ke dalam gelas wool sehingga terjadi penguapan sempurna dan pencampuran yang baik terjadi. Selanjutnya pada split point, sebagian cuplikan memasuki kolom dan sisanya dibuang melalui kran 2. Bagian cuplikan yang dibuang melalui kran 2 dikontrol oleh pengatur tekanan. Bila suhu injektor terlalu tinggi maka penguraian cuplikan dapat terjadi sehingga beberapa komponen hilang dan komponen baru terbentuk. Jenis injeksi split tidak berguna untuk analisis renik karena kebanyakan cuplikan dibuang. Untuk keperluan analisis kuantitatif yang baik dan untuk analisis renik maka injeksi jenis
splittless lebih cocok. Dalam hal ini, larutan encer cuplikan dalam pelarut
yang mudah menguap disuntikkan ke dalam tempat pemasukan cuplikan dengan keadaan kran 1 dan 2 tertutup. Suhu kolom mula-mula 20-25oC lebih rendah dari titik didih pelarut sehingga berkondensasi pada permulaan kolom. Ketika solut terperangkap oleh kabut pelarut maka
solut-solut tersebut terkumpul pada permulaan kolom yang akan
membentuk peak tajam. Sebagian pelarut (dan cuplikan) yang masih berbentuk uap dekat septum akan menyebabkan tailing (pelebaran peak). Oleh karena itu, setelah 20-60 detik kran 1 dibuka untuk mengeluarkan uap dekat septum. Dengan injeksi splitless, kebanyakan cuplikan (sekitar 80%) masuk ke dalam kolom. Alternatif lain untuk mengkondensasi solut pada permulaan kolom disebut perangkap dingin (cold trapping). Suhu kolom mula-mula 150oC lebih rendah dari titik didih dielusi secara cepat tapi solut dengan titik didih tinggi masih tetap sebagai kumpulan kabut. Pada pemansan kolom, pemisahan solut-solut dengan titik didih tinggi terjadi.
Teknik injeksi pada kolom (on-column injection) digunakan untuk cuplikan yang dapat terurai pada pemanasan di atas titik didihnya selama injeksi. Larutan cuplikan dimasukkan langsung ke dalam kolom tanpa melalui injeksi panas. Suhu kolom mula-mula mendekati titik didih pelarut yang mudah menguap untuk mengkondensasi dan mengumpulkan
solut-solut. Proses kromatografi terjadi ketika suhu kolom dinaikkan.
5.3.3 Kolom
Dalam kromatografi gas, kolom merupakan tempat terjadinya proses pemisahan. Untuk kromatografi gas dikenal 2 jenis kolom yaitu jenis pak (packed column) dan jenis terbuka (open tubular column). Jenis pak terbuat dari stainless steel sedangkan jenis kolom terbuka terbuat dari pipa kapiler. Ke dalam kolom jenis pak diisi zat pendukung dan fasa diam yang menempel pada zat pendukung.
a. Kolom Pak (Packed Column)
Kolom pak terbuat dair stainless steel atau gelas dengan garis tengah 3-6 mm dan panjang 1-5 m. Kolom diisi oleh serbuk zat padat halus atau zat padat sebagai zat pendukung yang dilapisi zat cair kental yang sukar menguap sebagai fase diam. Jenis kolom pak ini lebih disukai untuk tujuan preparatif karena dapat menampung jumlah cuplikan yang banyak.
Gambar 5.4 Kolom pak b. Kolom Terbuka (Open Tubular Column)
Kolom terbuka (kolom kapiler) jika dibandingkan dengan kolom pak maka kolom terbuka lebih kecil dan lebih panjang. Diameter kolom terbuka berkisar antara 0,1-0,7 mm dan panjangnya berkisar antara 15-100 m. Jenis kolom ini disebut juga dengan kolom kapiler. Untuk mempermudah penyimpanan, biasanya kolom terbuka dibentuk spiral dengan garis
tengah 18 cm. Kolom terbuka bisa memiliki panjang hingga 100 m yang mana ini disebabkan bagian dalam kolom tidak terhalang oleh fase diam. Akan tetapi, kolom terbuka tidak dapat menampung volume cuplikan yang banyak.
Gambar 5.5 Kolom terbuka
Manfaat dari kolom terbuka yang panjang ini diharapkan kolom akan menjadi lebih efisien. Juga dengan bertambahnya panjang kolom maka perbedaan waktu retensi senyawa satu terhadap senyawa lainnya akan bertambah yang akan memberi dampak pada peningkatan selektivitas. Ada 3 faktor yang mempengaruhi resolusi yaitu efisiensi, selektivitas dan retensi. Dengan menggukan kolom terbuka maka faktor-faktor ini akan bertambah keuntungan lain penggunaan kolom terbuka adalah waktu analisis lebih pendek daripada penggunaan kolom pak karena fase gerak tidak mengalami hambatan ketika melewati kolom.
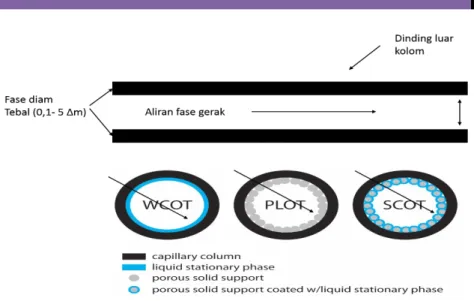
Kolom terbuka terdiri dari 3 jenis yaitu untuk wall-coated open
tubular column (wcot), fase diam cairan kental dilapiskan secara merata
pada dinding kolom. Dengan campuran support-cated open tubular
column (scot), partikel zat padat pendukung seperti silika atau aluminium
ditempelkan pada dinding dalam kolom. Partikel pendukung ini terlebih dahulu dilapisi zat cair kental sebagai fasa diam untuk meningkatkan luas permukaan.
Gambar 5.6 Kolom kapiler
Dengan bertambahnya luas permukaan berarti jenis scot mempunyai volume fasa diam yang lebih besar daripada wcot sehingga memungkinkan untuk menampung volume cuplikan yang besar. Dengan kata lain jenis scot ini lebih cocok untuk analisis renik (konsentrasi analit yang sangat kecil). Selain itu, peningkatan volume fase diam pada jenis scot ini menyebabkan bertambah besarnya faktor kapasitas sehingga memberikan resolusi yang lebih baik. Oleh karena itu rancangan jenis kedua ini, lebih disukai. Pada rancangan ketiga, porous-layer open
tubular column (plot), partikel zat padat yang ditempelkan pada dinding
dalam kolom bertindak sebagai fasa diam.
Jenis kolom terbuka berupa pipa kapiler yang umumnya terbuat dari gelas yang bahan dasarnya silika, SiO2 yang mempunyai sedikit gugus silanol (Si-O-H). Gugus silanol ini dapat berikatan dengan solut menghasilkan peak tailing (peak yang melebar ke belakang), seperti terlihat pada gambar di bawah, terutama kalau fase diamnya sudah mengalami erosi. Peak tailing ini menyebabkan rendahnya efisiensi.
Gambar 5.7 Kromatogram dengan peak tailing
Berikut perbedaan antara kolom atau pack dan kolom kapiler diringkas dalam tabel 5.3 sebagai berikut:
Tabel 5.3. Perbandingan kolom kemas dan kolom kapiler
Parameter Kolom
kemas
Kolom kapiler
Tabung Baja tahan
karat (stainless
steel)
Silika (SiO3) dengan kemurnian yang sangat tinggi (kandungan logam < 1 ppm) Panjang 1-5 m 5-60 m diameter dalam 2-4 mm 0,10-0,53 mm Jumlah lempeng/meter 1000 5000 Total lempeng 5000 300.000 Tebal lapisan film 10 mikron 0,05-1 mikron
Resolusi Rendah Tinggi
Kecepatan alir (ml/menit)
10-60 0,5-1,5
Kapasitas 10 μg/puncak < 100 ng/puncak
c. Zat Padat Pendukung
Kolom pak mengandung zat cair kental yang sukar menguap yang dilapiskan pada partikel yang tidak bereaksi (inert) yang disebut zat padat pendukung. Zat padat pendukung harus berupa partikel halus, kuat dan berbentuk sama serta memiliki luas permukaan besar. Kebanyakan zat padat pendukung terbuat dari tanah diatomaceus, silika yang berasal dari rangka alga. Secara ideal, zat padat pendukung tidak boleh
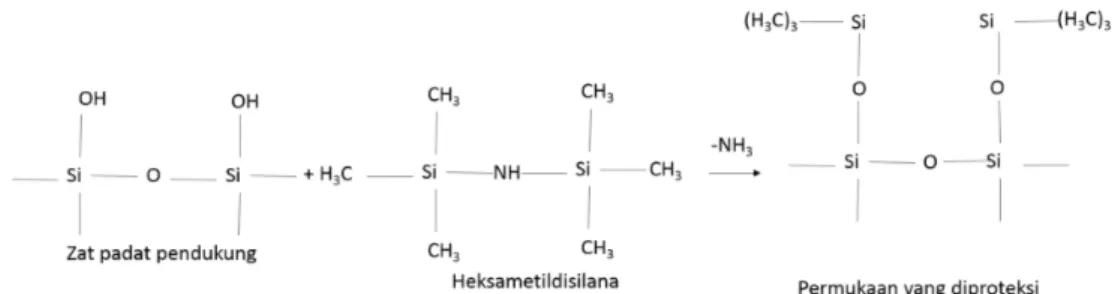
berinteraksi dengan solut tapi tidak ada zat pendukung yang betul-betul inert. Silanisasi dengan heksametildisilana atau diklorodimetilsilana (CH3)3SiCl2 cara yang banyak digunakan untuk mengurangi interaksi partikel silika dengan solut polar reaksi silanisasi diperhatikan sebagai berikut:
Bila solut berikatan dengan sangat kuat dengan silanol maka, alternatif, teflon dapat digunakan sebagai zat pendukung. Teflon merupakan polimer yang sangat inert dengan struktur:
Ukuran partikel yang sama menurunkan faktor difusi Eddy sehingga meningkatkan efisiensi. Juga ukuran partikel yang kecil mengurangi waktu yang diperlukan oleh solut untuk berkesetimbangan sehingga meningkatkan efisiensi. Akan tetapi partikel yang sangat kecil menurunkan tekanan yang lebih besar untuk mengalirkan fase gerak melewati kolom. Ukuran partikel zat pendukung dinyatakan dalam satuan mesh yang berhubungan dengan ukuran saringan. Misalnya, partikel berukuran 100/200 mesh akan lolos pada saringan 100 mesh tapi tertahan pada saringan 200 mesh.
d. Fase diam
Fase diam sering digunakan dalam kromatografi gas berbentuk zat cair kental yang sukar menguap. Dengan demikian jenis kromatografi ini disebut kromatografi partisi gas-cair. Berbagai jenis zat cair sebagai fase diam dapat dilihat pada tabel 5.4 sebagai berikut:
Fase Diam Cair Suhu Maksimum (oC) Skualan 100 350 (Mixed Hidrocarbons) Apiezon 257-300 (tergantun g dari tipe apiezon) 175 250 250
Mentil Penil Silicon QV-17 300 190 180 200 275
250
276
150
Jumlah fase diam yang digunakan dinyatakan dalam persen zat padat pendukung. Jumlah yang umum berkisar antara 2-10%. Jika fase diam melebihi 30% dari zat padat pendukung maka efisiensi kolom mulai berkurang. Kerugian lainnya adalah faktor kapasitas bertambah besar atau waktu retensi lebih lama. Demikian pula bila jumlah fase diam kurang dari 2% maka permukaan zat padat pendukung tidak tertutup semuanya sehingga solut polar berikatan terlalu kuat dengan zat pendukung. Selain zat cair, beberapa zat padat dapat digunakan sebagai fase diam seperti alumina (Al2O3) untuk memisahkan hidrokarbon.
5.3.4 Detektor
Berbagai jenis detektor dapat digunakan untuk mendeteksi komponen-komponen yang telah terpisahkan di dalam kolom kromatografi gas. Jenis detektor ini meliputi detektor daya hantar panas (thermal
detektor penangkap elektron (electron capture detector), detektor fotometri nyala (flame photometric detector), detektor nyala alkali (alkali
flame detector) dan detektor spektroskopi massa. Setiap detektor
mempunyai karakteristik tersendiri seperti terlihat pada tabel 5.5 sebagai berikut:
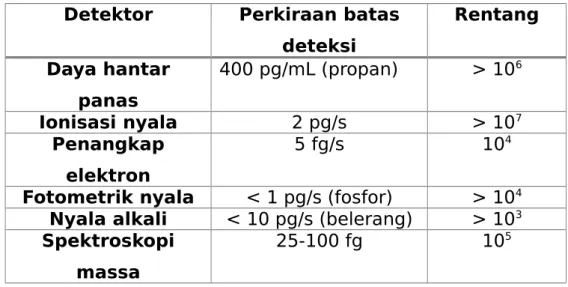
Tabel 5.5 Karakteristik detektor
Detektor Perkiraan batas
deteksi Rentang Daya hantar panas 400 pg/mL (propan) > 106 Ionisasi nyala 2 pg/s > 107 Penangkap elektron 5 fg/s 104
Fotometrik nyala < 1 pg/s (fosfor) > 104
Nyala alkali < 10 pg/s (belerang) > 103
Spektroskopi massa
25-100 fg 105
a. Detektor Daya Hantar Panas (Thermal Conductivity Detector,
TCD)
Detektor jenis ini mengukur kemampuan zat dalam memindahkan panas dari daerah panas ke daerah yang dingin. Semakin besar daya hantar panas maka semakin cepat pula panas dipindahkan.
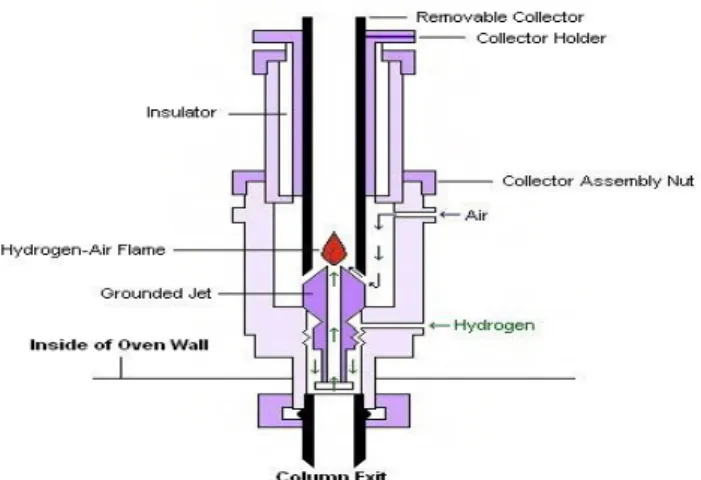
Gambar 5.8 Detektor daya hantar panas
Detektor ini terdiri dari filamen panas tungstein-rhenium yang ditempatkan pada aliran gas yang datang dari arah kolom kromatografi. Tahanan listrik filamen akan naik bila suhu filamen naik. Selama gas
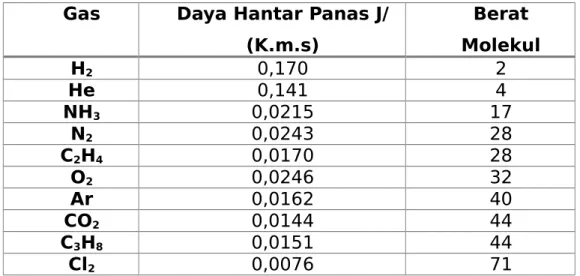
begitu pula sinyal yang dikeluarkannya. Ketika solut keluar dari kolom maka daya hantar panas aliran gas menjadi menurun sehingga kecepatan pendinginan filamen oleh aliran gas berkurang secara proporsional. Filamen menjadi lebih panas, tahanan bertambah dan perubahan keluaran sinyal teramati. Oleh karena itu, detektor bergantung pada perubahan daya hantar panas aliran gas maka sebaiknya daya hantar solut dan gas pembawa berbeda jauh. Berdasarkan tabel 5.6 di bawah ini bahwa H2 dan He mempunyai daya hantar panas paling tinggi dan umumnya daya hantar panas berkurang dengan naiknya berat molekul. Oleh karena itu, gas H2 dan He merupakan gas pembawa yang tepat bila detektor daya hantar panas digunakan.
Tabel 5.6 Gas pembawa untuk detector daya hantar panas
Gas Daya Hantar Panas J/
(K.m.s) Berat Molekul H2 0,170 2 He 0,141 4 NH3 0,0215 17 N2 0,0243 28 C2H4 0,0170 28 O2 0,0246 32 Ar 0,0162 40 CO2 0,0144 44 C3H8 0,0151 44 Cl2 0,0076 71
Secara teknis, gas pembawa dibagi menjadi 2 aliran, sebagian dialirkan melalui kolom dan sebagian lagi dialirkan ke filamen pembanding. Tahanan filamen diukur dengan membandingkannya terhadap filamen pembanding. Kepekaan detektor daya hantar panas berbanding terbalik dengan kecepatan aliran gas. Hal ini berarti bahwa detektor lebih peka pada kecepatan lebih rendah dan kecepatan akan berubah kalau kecepatan aliran berubah. Kepekaan juga meningkat dengan perbedaan suhu yang besar di antara filamen dan sekeliling blok.
Diagram detektor ionisasi nyala diperlihatkan dalam gambar 5.9 berikut ini:
Gambar 5.9 Detektor ionisasi nyala
Solut yang keluar dari kolom dicampur H2 dan udara kemudian dibakar pada nyala di bagian dalam detektor. Atom karbon senyawa organik dapat menghasilkan radikal CH yang selanjutnya menghasilkan ion CHO+ dalam nyala hidrogen udara.
CHO+ yang dihasilkan dalam nyala bergerak ke katoda yang berada di atas nyala. Arus yang mengalir di antara anoda dan katoda diukur dan diterjemahkan sebagai sinyal pada rekorder. Detektor ini jauh lebih peka dari pada detektor daya hantar panas. Kepekaan detektor ionisasi nyala akan lebih meningkat kalau N2 digunakan sebagai gas pembawa.
c. Detektor Penangkap Elektron (Electron Capture Detector, ECD)
Detektor penangkap elektron mengukur kehilangan sinyal ketika analit terelusi dari kolom kromatografi. Sebagai gas pembawa yang diguanakan N2 kering atau 5% metana dalam argon. Alternatif lain, menambahkan N2 bila H2 atau He sebagai gas pembawa. Gas nitrogen yang memasuki detektor diionisasikan oleh elektron berenergi tinggi (sinar beta) yang diemisikan dari radioaktif 63Ni atau 3H. Elektron yang terbentuk ditarik ke anoda dan menghasilkan sejumlah kecil arus. Bila molekul analit yang mempunyai afinitas elektron yang tinggi memasuki detektor maka sebagian elektron ditangkap sehingga arus yang mengalir ke anoda berkurang. Detektor ini terutama peka terhadap molekul senyawa yang mengandung halogen, karbonil terkonjugasi, nitril, nitro, dan organologam.
Akan tetapi, detektor ini tidak peka terhadap hidrokarbon, alkohol dan keton. Gas pembawa harus betul-betul kering karena air menurunkan kepekaan detektor.
Gambar 5.10 Detektor penangkap elektron d. Detektor Fotometri Nyala
Detektor fotometri nyala merupakan fotometer emisi optik yang berguna untuk mendeteksi senyawa-senyawa yang mengandung fosfor atau belerang seperti pestisida dalam polutan udara. Solut yang terelusi memasuki nyala hidrogen udara seperti dalam detektor ionisasi nyala. Fosfor dan belerang tereksitasi ke tingkat energi yang lebih tinggi yang kemudian melepaskan energi dalam bentuk cahaya. Cahaya yang dibebaskan oleh fosfor terjadi pada panjang gelombang 536 nm dan belerang terjadi pada panjang gelombang 394 nm yang dapat diisolasi dengan filter dan dideteksi dengan tabung fotomultiflier.
Gambar 5.11 Detektor fotometri nyala e. Detektor Nyala Alkali
Detektor ini merupakan modifikasi detektor ionisasi nyala yang selektif peka terhadap fosfor dan nitrogen. Detektor ini penting sekali untuk analisis obat-obatan. Ion yang dihasilkan ketika unsur ini berkontak dengan gelas yang mengandung Rb2SO4 pada ujung pembakar membentuk arus yang dapat diukur. Gas N2, He atau H2 dapat digunakan sebagai gas pembawa untuk cuplikan yang mengandung fosfor tetapi N2 tidak dapat digunakan untuk cuplikan yang mengandung nitrogen.
f. Detektor Spektroskopi Massa
Detektor jenis ini merupakan jenis detektor paling terkenal dan mutakhir dalam kromatografi gas. Spektrofotometer massa disambungkan dengan keluaran kromatografi gas. Ketika gas solut memasuki spektrofotometer massa maka molekul senyawa organik ditembaki dengan elektron berenergi tinggi sehingga molekul tersebut pecah menjadi molekul-molekul menjadi yang lebih kecil. Pecahan molekul terdeteksi berdasarkan massanya yang digambarkan sebagai spektra massa. Setiap komponen campuran yang telah terpisahkan dengan kromatografi gas akan tergambar dalam satu spektra massa. Contoh, kalau cuplikan terdiri dari 3 komponen maka akan dihasilkan tiga spektra massa. Kombinasi kromatografi gas dan spektroskopi massa ini dikenal dengan sebutan GC-MS.
Beberapa sifat detektor yang digunakan dalam kromatografi gas ditunjukkan oleh tabel 5.7 sebagai berikut:
Tabel 5.7 Jenis-jenis detektor, batas deteksi, jenis sampel-
sampelnya dan kecepatan alir gas pembawa Jenis detector Jenis sampel Batas deteksi
Kecepatan alir (mL/menit) Gas pembawa H2 Udara Hantar panas Senyawa umun 5-100 ng 15-30 - -Ionisasi nyala Hidrokarbon 10-100 pg 20-60 30-40 200-500 Penangkap electron Halogen organik, pestisida 0,05-1 pg 30-60 -
-fosfor nitrogen organik dan Fosfat organik Fotometri nyala (393 nm) Senyawa-senyawa sullfur 10-100 pg 20-40 50-70 60-80 Fotometri nyala (526 nm) Senyawa-senyawa fosfor 1-10 pg 20-40 120-170 100-150 Fotoionisas i Senyawa-senyawa yang terionisasi dengan UV 2 pg C/detik 30-40 - - Konduk-tivitas elektrolitik Halogen,N,S 0,5 pg Cl 2 pg S 4 pg N 20-40 80 -Fourier Transform-infra merah (FT-IR) Senyawa-senyawa organik 1000 pg 3-10 - -Selektif massa Sesuai untuk senyawa apapun 10 pg-10 ng 0,5-30 -
-Emisi atom Sesuai untuk elemen apapun 0,1-20 pg 60-70 - -5.3.5 Recorder
Recorder berfungsi sebagai pengubah sinyal dari detektor yang diperkuat melalui elektrometer menjadi bentuk kromatogram. Dari kromatogram yang diperoleh dapat dilakukan analisis kualitatif dan kuantitatif. Analisis kualitatif dengan cara membandingkan waktu retensi sampel dengan standar. Analisis kuantitatif dengan menghitung luas area maupun tinggi dari kromatogram (Hendayana, 2001 dalam Frayekti 2013).
Sinyal analitik yang dihasilkan detektor dikuatkan oleh rangkaian elektronik agar bisa diolah oleh rekorder atau sistem data. Sebuah rekorder bekerja dengan menggerakkan kertas dengan kecepatan tertentu. Pada bagian atas kertas tersebut dipasangkan pena yang digerakkan oleh sinyal keluaran detektor sehingga posisinya akan berubah-ubah sesuai dengan dinamika keluaran penguat sinyal detektor. Hasil rekorder adalah sebuah kromatogram berbentuk peak-peak dengan pola yang sesuai dengan kondisi sampel dan jenis detektor yang digunakan. Hasil akan direkam sebagai urutan puncak-puncak; setiap puncak mewakili satu senyawa dalam campuran yang melalui detektor. Sepanjang anda mengontrol secara hati-hati kondisi dalam kolom, anda dapat menggunakan waktu retensi untuk membantu mengidentifikasi senyawa yang tampak, tentu saja anda atau seseorang lain telah menganalisa senyawa murni dari berbagai senyawa pada kondisi yang sama.
Gambar 5.12 Peak hasil recorder
Rekorder biasanya dihubungkan dengan sebuah elektrometer yang dihubungkan dengan sirkuit pengintregrasi yang bekerja dengan menghitung jumlah muatan atau jumlah energi listrik yang dihasilkan oleh detektor. Elektrometer akan melengkapi peak-peak kromatogram dengan data luas peak atau tinggi peak lengkap dengan biasnya.
Sistem data merupakan pengembangan lebih lanjut dari rekorder dan elektrometer dengan melanjutkan sinyal dari rekorder dan elektrometer ke sebuah unit pengolah pusat (CPU,Central Procesing Unit).
Ada 8 cara kerja pada kromatografi gas, yaitu :
1. Cuci jarum suntik dengan aseton dengan mengisi jarum suntik, mendepak sepenuhnya dari aseton limbah ke kertas handuk. Cuci 2-3 kali.
2. Tarik beberapa sampel Anda ke dalam jarum suntik. Anda mungkin perlu untuk menghilangkan gelembung udara di dalam tabung suntik oleh plunyer bergerak cepat ke atas dan ke bawah sementara jarum dalam sampel. Biasanya 1-2 mL sampel disuntikkan ke dalam GC. Boleh saja memiliki gelembung udara kecil dalam jarum suntik. Namun, Anda tidak ingin menyuntikkan sebagian besar udara atau puncak Anda akan terlalu kecil pada tabel perekam.
3. Pastikan tabel perekam dan diatur ke kecepatan grafik yang sesuai (Arrow A). Mengatur baseline menggunakan nol pada tabel perekam (Arrow B). Dengan pena di tempat, menyalakan bagan (Arrow D), pastikan pena ke bawah (yang menandai kertas) dan kertas bergerak. 4. Suntikkan sampel Anda baik ke kolom A atau kolom B sesuai instruksi.
Pegang tingkat jarum suntik dan mendorong jarum sepenuhnya ke injector. Setelah Anda tidak dapat lagi melihat jarum, dengan cepat mendorong pendorong dan kemudian tarik jarum suntik injeksi keluar dari pelabuhan.
Injeksi Catatan:
Injektor sangat panas, jadi berhati-hatilah untuk tidak menyentuh perak disk. Jarum akan melewati septum karet, sehingga Anda akan merasa beberapa perlawanan. Untuk beberapa GC kita itu, kolom tidak menyelaraskan benar dalam injector, sehingga jarum hits bagian depan kolom logam. Jika Anda merasa bahwa Anda mendorong terhadap logam, menarik jarum keluar dari injector dan coba lagi, mungkin di sudut yang sedikit berbeda. Jarum harus benar-benar menghilang ke dalam injeksi untuk injeksi yang tepat sampel ke kolom GC. Suntikkan dengan cepat untuk hasil terbaik. Jangan ragu untuk menyuntikkan jarum setelah benar diposisikan di pelabuhan injeksi. Lepaskan jarum
suntik segera setelah injeksi. (Pelaksanaan catatan C dan D membantu untuk memastikan bahwa semua sampel memasuki GC kolom di sekitar waktu yang sama.)
5. Tandai waktu injeksi Anda pada tabel perekam. Ini dapat dilakukan dengan menyesuaikan nol tepat setelah sampel disuntikkan. Hal ini nyaman bagi satu orang untuk menyuntikkan sampel sementara pasangan laboratorium menandai waktu injeksi di bagan perekam. 6. Bersihkan jarum suntik Anda segera setelah injeksi. Jarum suntik sering
tersumbat dengan cepat dan harus diganti jika mereka tidak dibersihkan setelah setiap penggunaan.
7. Catatan pengaturan perekam grafik Anda selama berlangsung. Anda perlu mengetahui kecepatan grafik dan pengaturan skala penuh.
8. Catatan pengaturan GC selama Anda berlangsung. Sebuah tombol di bagian tengah bawah GC dapat diubah untuk membaca kolom (atau oven) suhu, suhu detektor dan suhu injektor pelabuhan dalam °C. Jembatan saat ini ditampilkan dalam mA. Perhatikan bahwa ada dua skala pada layar. Berhati-hati untuk membaca skala yang tepat!
Dalam pengoperasian kromatografi gas dikenal dua mode operasional, yaitu:
1. Mode operasi isothermal
Pada pengukuran dengan menggunakan mode operasi isotermal, suhu kolom dijaga tetap selama pengukuran berlangsung. Pengukuran dengan cara ini dapat dilakukan apabila analit yang ingin dipisahkan memiliki titik didih yang tidak berdekatan.
2. Mode operasi suhu terprogram (programming suhu)
Pada pengukuran dengan cara ini, suhu kolom divariasikan selama pengukuran berlangsung. Peningkatan suhu kolom pada analisis menggunakan kromatografi gas dikenal sebagai gradien suhu. Gradien suhu adalah perubahan suhu per satuan waktu, bukanlah peningkatan suhu per panjang kolom. Pengukuran dengan mode operasi ini
meningkatkan analit yang memiliki titik didih yang berdekatan untuk saling memisah dengan baik, sehingga diperoleh peak yang tidak saling bertumpukan.
5.5 KELEBIHAN DAN KEKURANGAN KROMATOGRAFI GAS 5.5.1 Kelebihan dari GC adalah sebagai berikut :
1) Waktu analisis singkat dan ketajaman pemisahan yang tinggi.
2) Dapat menggunakan kolom lebih panjang untuk menghasilkan efisiensi pemisahan yang tinggi.
3) Gas mempunyai viskositas yang rendah.
4) Kesetimbangan pertisi antara gas dan cairan berlangsung cepat sehingga analisis relative cepat dan sensitifitasnya tinggi.
5) Pemakaian fase cair memungkinkan kita memilih dari sejumlah fase diam yang sangat beragam yang akan memisahkan hampir segala macam campuran.
5.5.2 Kekurangan dari GC adalah sebagai berikut:
1) Teknik Kromatografi gas terbatas untuk zat yang mudah menguap. 2) Kromatografi gas tidak mudah dipakai untuk memisahkan campuran
dalam jumlah besar. Pemisahan pada tingkat mg mudah dilakukan, pemisahan pada tingkat gram mungkin dilakukan, tetapi pemisahan dalam tingkat pon atau ton sukar dilakukan kecuali jika ada metode lain.
3) Fase gas dibandingkan sebagian besar fase cair tidak bersifat reaktif terhadap fase diam dan zat terlarut.
4) Titik uap sampel yang terlalu tinggi melebihi suhu maksimal pada kolom, mengakibatkan kerusakan pada instrument. Analisis kemudian dilanjutkan pada HPLC. (Nugroho, dkk, 2012)
5.6 PENERAPAN KROMATOGRAFI GAS
Kromatografi gas telah banyak dimanfaatkan sebagai suatu teknik analisis materi terutama untuk senyawa-senyawa yang mudah menguap.
Kromatografi gas digunakan pada sejumlah besar senyawa-senyawa dalam berbagai bidang. Dalam senyawa organik dan anorganik, senyawa logam, karena persyaratan yang digunakan adalah tekanan uap yang cocok pada suhu saat analisa dilakukan. Berikut akan kita lihat beberapa kegunaan kromatografi gas pada bidang-bidangnya adalah :
1. Polusi udara
Kromatografi gas merupakan alat yang penting karena daya pemisahan yang digabungkan dengan daya sensitivitas dan pemilihan detektor GLC menjadi alat yang ideal untuk menentukan banyak senyawa yang terdapat dalam udara yang kotor, KGC (kromatografi gas cair) dipakai untuk menentukan alkil-alkil timbal, hidrokarbon, aldehid, keton, SO, HS, dan beberapa oksida dari nitrogen dan lain-lain.
2. Klinik
Di klinik kromatografi gas menjadi alat untuk menangani senyawa-senyawa dalam klinik seperti : asam-asam amino, karbohidrat, CO dan O dalam darah, asam-asam lemak dan turunannya, trigliserida-trigliserida, plasma steroid, barbiturate, dan vitamin.
3. Bahan-bahan pelapis
Digunakan untuk menganalisa polimer-polimer setelah dipirolisa, karet dan resin-resin sintesis.
4. Minyak Atsiri
Digunakan untuk pengujian kualitas terhadap minyak permen, jeruk sitrat dan lain-lain.
5. Bahan makanan
Digunakan dengan KLT ( kromatografi lapis tipis ) dan kolom-kolom, untuk mempelajari pemalsuan atau pencampuran, kontaminasi dan pembungkusan dengan plastik pada bahan makanan, juga dapat dipakai untuk menguji jus, aspirin, kopi dan lain-lain.
6. Sisa-sisa pestisida
KGC ( kromatografi gas cair ) dengan detektor yang sensitif dapat menentukan atau pengontrolan sisa-sisa pestisida yang diantaranya senyawa yang mengandung halogen, belerang, nitrogen, dan fosfor.
7. Perminyakan
Perusahaan minyak bumi seperti Pertamina telah menggunakan teknik kromatografi gas untuk analisis komponen-komponen yang terdapat dalam minyak bumi baik secara kualitatif maupun secara kuantitatif.
Kromatografi gas dapat digunakan untuk memisahkan dan mengidentifikasi hasil-hasil dari gas-gas hidrokarbon yang ringan.
8. Bidang farmasi dan obat-obatan
Kromatografi gas digunakan dalam pengontrolan kualitas, analisa hasil-hasil baru dalam pengamatan metabolisme dalam zat-zat alir biologi. 9. Bidang kimia/ penelitian
Digunakan untuk menentukan lama reaksi pada pengujian kemurnian hasil.
5.7 APLIKASI KROMATOGRAFI GAS DALAM SUATU PENELITIAN KIMIA
Dalam penelitian juga seringkali digunakan analisis kromatografi gas. Beberapa contoh dalam jurnal, yaitu :
1. Analisis asam valproat dalam plasma secara kromatografi gas (Susanti, Ani, dkk, 2010).
2. Validasi Metode Kromatografi Gas - Spektrometri Massa untuk Analisis Residu Pestisida Triadimefon dalam Kubis (Ratnasari, D., Riesta. P., dan Noor. E.N.S, 2010).
3. Identifikasi melamin derivatif dalam sampel susu bubuk dengan Kromatografi Gas – Spektrometri Massa (Identification of melamine derivative in powdered milk samples by gas chromatography - mass spectrometry) (Amzad, M.H dkk, 2009).
4. Analisis validasi kromatografi Gas - Spektrometri massa tentang pemurnian senyawa cannabinoids dari urin dengan logam kalsium polimer β-siklodekstrin (Validated gas chromatographic –mass spectrometric analysis of urinary cannabinoids purified with a calcium-hardened β-cyclodextrin polymer) (Yeon, J.M dkk, 2008).
5. Analisis Obat flunitrazepam pada radiasi paparan UV dengan menggunakan kromatografi gas – spektrometri massa (Gas Chromatography - Mass Spectrometric Analysis of Forensic Drug Flunitrazepam upon Exposure to UV Irradiation) (Sampson,L., Brandon W., dan Hervey J.M.H, 2013 ).
6. Analisis etanol dalam hair tonic dan hair spray secara kromatografi gas (Rejeki, 2010).
7. Analisis cemaran pestisida dalam air dengan cara kromatografi gas (Yuliastuti, 1997).
8. Penentuan kadar asam linoleat pada tempe secara kromatografi gas (Iskandar, 2010).
9. Analisis headspace (metode injeksi headspace) kromatografi gas dari pelarut sisa dengan menggunakan ec-5 kolom (Head space gas chromatography analysis ofresidual-solventsby using ec-5 column) (Puranik dkk, 2012).
10. Komposisi Asam Lemak oleh kromatografi gas – spektrometri massa (GC-MS) dan parameter fisikokimia yang penting pada minyak biji tomat (Fatty Acids Composition by Gas Chromatography–Mass Spectrometry (GC-MS) and most important physical- chemicals parameters of Tomato Seed Oil) (Botinestian dkk, 2012).
Berikut ini akan dijelaskan cara kerja dan hasil dari penelitian tersebut :
A. Analisis Asam Valproat dalam Plasma secara Kromatograf
Gas
1.Tujuan : untuk memperoleh kondisi analisis optimum untuk analisis
asam valproat dalam plasma in vitro secara kromatografi gas dan memperoleh metode ekstraksi optimum untuk analisis asam valproat dalam plasma in vitro secara kromatografi gas
2. Alat
a. Kromatografi Gas Shimadzu model GC 17A yang dilengkapi dengan detektor ionisasi nyala (FID)
b. Kolom kapiler CBP-10 dengan panjang 50 meter dan diameter dalam 0,25 mm
c. Pemroses data Class GC Solution, dan integrator CBM 102,
microsyringe 5 μL .(Hamilton Co, Nevada)
d. Sentrifugator (TGL-16)
e. Mikropipet 100 dan 1000 μL (Soccorex) f. Alat vortex g. Microtube h. Blue tip i. Yellow tip j. Lemari pendingin k. Timbangan analitik
l. Alat-alat gelas yang umum digunakan dalam analisis kuantitatif
b. Metanol p.a (Merck)
c. Kloroform p.a (Merck)
d. n-heksan p.a (Merck)
e. Dietil eter p.a (Merck)
f. HCl (Merck)
g. Aquadest
h. Plasma darah (Palang Merah Indonesia)
4. Prosedur Kerja
Penelitian ini pertama kali dilakukan dengan membuat larutan Induk Natrium Divalproat. Untuk mencari kondisi analisis optimum, dibuat larutan induk natrium divalproat 100 ppm. Untuk itu dilakukan :
1. Pemilihan laju alir gas pembawa untuk analisis asam valproate secara kromatografi gas, kemudian dilakukan modifikasi laju alir menjadi 1,0 dan 1,5 mL/menit. Suhu injektor dan detektor yang digunakan adalah 250°C.
2. Elusi dilakukan dengan suhu kolom terprogram 80°C sampai
100°C dengan kenaikan suhu 5°C per menit.
3. Suhu kolom ditahan selama 1 menit lalu dinaikkan sampai 150°C dengan kenaikan suhu 2°C permenit. Diperoleh waktu retensi, lalu dihitung faktor ikutan, jumlah pelat teoritis dan HETP.
4. Dilakukan pemilihan suhu awal kolom untuk analisis asam valproat secara kromatografi gas. Elusi dilakukan dengan suhu kolom terprogram dari suhu awal sampai 100ºC dengan kenaikan suhu 5°C per menit.
5. Suhu kolom ditahan selama 1 menit lalu dinaikkan sampai 150°C dengan kenaikan suhu 2ºC permenit. Diperoleh waktu retensi, lalu dihitung faktor ikutan, jumlah plat teoritis dan HETP.
6. Melakukan pemilihan pelarut organik untuk ekstraksi asam valproat dalam plasma.
7. Dilakukan pemilihan waktu vorteks untuk analisis asam valproat dalam plasma. Pemilihan waktu sentrifugasi untuk analisis asam valproat dalam plasma. Waktu sentrifugasi selama 5, 10, 15, dan 20 menit untuk analisis asam valproat dalam plasma dipilih, dengan kecepatan sentrifugasi 3000 rpm.
8. Sebanyak 1,0 µL lapisan organik diambil lalu disuntikkan ke kromatografi gas. Kemudian dihitung luas area dari masing-masing waktu sentrifugasi.
a. Uji Kesesuaian
b. Pengukuran LLOQ (Lower Limit of Quantification)
5. Hasil Dan Pembahasan
Pemilihan Laju Alir Gas Pembawa untuk Analisis Asam Valproat dengan Kromatografi Gas. Penelitian ini menggunakan kolom kapiler yang memiliki diameter kecil sehingga laju alir yang digunakan memiliki rentang antara 0,2– 2 ml/menit. Untuk semua elusi, suhu injektor dan detektor diatur pada suhu 250ºC. Suhu injektor dan detektor diatur pada suhu 250ºC. Berdasarkan literatur, laju alir gas pembawa yang digunakan sebesar 20 ml/menit. Namun, dalam penelitian ini digunakan variasi laju alir gas pembawa, yaitu 1,0 ml/menit, 1,5 ml/menit, dan 2,0 ml/menit. Pertimbangan variasi laju alir gas pembawa adalah diameter kolom yang digunakan. Pertimbangan penetapan suhu injektor adalah suhu injektor harus diatur lebih tinggi daripada suhu kolom maksimum.
Kondisi optimum terpilih adalah yang memberikan nilai lempeng teoritis (N) besar, ukuran efisiensi kolom (HETP) kecil, faktor ikutan (Tf) yang mendekati satu, waktu retensi yang tidak terlalu lama, serta pada kromatogram plasma blanko tidak ada puncak yang mengganggu pada waktu retensi asam valproat. Kondisi alir yang dipilih adalah laju alir sebesar 1,0 ml/ menit karena memberikan nilai N terbesar dan HETP terkecil. Data selengkapnya dapat dilihat Gambar 5.13
Gambar 5.13 Kromatogram larutan natrium divalproat 100 μg/mL
dengan laju alir gas He 1,0 mL/menit (a) 1,5 mL/menit (b) dan 2,0 mL/menit (c)
Gambar 5.14 Kurva hubungan waktu sentrifugasi & luas area larutan Natrium divalproat 100 μg/mL dlm plasma
Analisis Residu Pestisida Triadimefon dalam Kubis
1. Tujuan : untuk menentukan harga parameter validasi KG-SM untuk
analisis residu triadimefon dalam kubis. Parameter validasi yang dilakukan dalam penelitian ini adalah selektifitas, linearitas, LOD dan LOQ, akurasi dan presisi.
2. Alat
a. KG-SM (KG Agilent Technologies 6890 N, kolom kapiler Agilent 19091j-413 HP-5 30,0 m x 320 µm x 0,25 µm; SM Agilent Technologies 5973 Inert Mass Selective Detector; Autosampler
Injector AgilentTechnologies 7683 Series G2613A)
b. Timbangan mikro (Microgram Balance Mettler Toledo AB204-S) c. Mikropipet (Thermo Scientific FJ76476)
d. Sonikator (Sakura US – 10E)
3. Bahan
a. Triadimefonp.a (Sigma-Aldrich; 99.8 %) b. Aseton p.a (Merck; > 99.5 %)
c. Etilasetat p.a (Mallinckrodt; 99.9 %)
d. Na2SO4 anhidrat p.a (Riedel-de Haen; > 99 %) e. NaCl p.a (Merck; > 99.9 %)
f. Kubis (seluruh bagian daun kubis)
4. Prosedur Kerja
a. Metode Ekstraksi Sampel Kubis b. Kondisi Percobaan
Kondisi KG-SM temperatur inlet 280°C, kecepatan gas pembawa 1,3 mL/menit, suhu oven (suhu awal 75°C selama 3 menit kemudian dinaikan 25°C/menit sampai 180°C, dinaikan lagi 5°C/menit sampai 300°C kemudian dipertahankan selama 3 menit), suhu detektor 250°C,
splitless injector dan digunakan mode EI (electron impact).
c. Parameter Validasi
Parameter validasi yang akan ditentukan adalah selektivitas, linearitas, LOD dan LOQ, akurasi, presisi. Penentuan akurasi dilakukan dengan menambahkan larutan standar konsentrasi 20 ppm ke dalam matriks kubis dan dibuat enam kali replikasi. Selanjutnya hasil ekstraksi disuntikkan 1,0 µL ke dalam KG-SM. Harga % recovery dihitung dengan membandingkan konsentrasi triadimefon yang terdeteksi dengan konsentrasi triadimefon yang sebenarnya. Presisi ditentukan dengan
yang dihasilkan pada tahap akurasi.
5. Hasil Dan Pembahasan
Harga parameter validasi yang diperoleh dalam penelitian ini adalah sebagai berikut :
a. Selektivitas
Kromatogram tersebut menunjukan bahwa tidak ada puncak-puncak pengganggu di waktu retensi triadimefon (tR = 12,75 menit). Kromatogram hasil ekstraksi matriks kubis dengan penambahan larutan baku triadimefon. Kromatogram tersebut menunjukan adanya puncak di waktu retensi triadimefon tR = 12,74 menit dan diperoleh harga derajat keterpisahan (Rs) triadimefon dengan puncak terdekat yang memiliki tR = 12,59 menit adalah 1,97. Data tersebut menunjukan bahwa puncak triadimefon terpisahkan dengan baik dari komponen-komponen lain dalam matriks kubis. Hal ini menunjukan bahwa metode ini bersifat selektif, karena nilai Rs>1,5-2,0 (Yuwono dan Indrayanto, 2005).
b. Linearitas
Tabel 5.8 Data luas area triadimefon dalam berbagai konsentrasi
Konsentrasi larutan baku
triadimefon (ppm) Luas area
10,10 2324110 15,15 3506111 20,20 4773479 30,30 7769647 35,35 8904877 Persamaan regresi : y = 266961,8282 x – 476247,0233 r = 0,9990 Vxo = 2,43 %
Diketahui bahwa nilai rtabel (α = 0,05; n = 5) = 0,878
Harga r yang diperoleh lebih besar dari r tabel (α = 0,05; n = 5) = 0,878 dan harga Vxo yang diperoleh juga dibawah 5 %. Hasil data
tersebut menunjukan bahwa hubungan antara konsentrasi triadimefon terhadap luas area triadimefon terbukti linier (AOAC, 2002).
c. LOD dan LOQ ( Limit of Detection dan Limit of Quantification )
Berdasarkan hasil perhitungan, maka diperoleh hasil bahwa nilai LOD triadimefon 0,03 ppm dan LOQ 0,09 ppm. Penelitian lain yang dilakukan oleh Alder et al., tahun 2006 diperoleh hasil bahwa LOQ triadimefon yang dianalisis menggunakan KG–SM sebesar 0,1 ppm. Perbedaan LOQ ini dapat disebabkan oleh sensitivitas alat, kondisi KG– SM, dan juga aliran listrik pada saat analisis. Data LOQ ini digunakan untuk memastikan bahwa konsentrasi analit yang akan dianalisis pada KG–SM dapat terdeteksi.
d. Akurasi dan Presisi
Tabel 5.9 Data hasil penentuan akurasi (% recovery) dan presisi
(RSD) triademefon dalam sampel kubis Replika si Kadar Sebenarnya (ppm) Kadar Diperoleh (ppm) % recovery 1 20,20 14,96 74,06% 2 20,21 15,53 76,88% 3 20,22 16,39 81,14% 4 20,23 14,73 72,92% 5 20,24 15,93 78,86% 6 20,25 14,97 74,11% Rata-Rata 76,33% SD 3,21 RSD 4,20%
Hasil % recovery dan RSD tersebut menunjukan bahwa perolehan kembali konsentrasi triadimefon dalam kubis yang telah melalui proses ekstraksi dan dianalisis dengan KG-SM adalah 76,33% ± 4,20% dari konsentrasi triadimefon yang sebenarnya dalam kubis.
C. Identifkasi Melamin Derivatif dalam Sampel Susu Bubuk dengan Kromatograf Gas – Spektrometri Massa (Identifcation
Chromatography - Mass Spectrometry)
1. Tujuan : untuk menggambarkan ekstraksi sederhana dan metode
identifikasi melamin dalam sampel susu bubuk dengan menggunakan GC-MS dan membangun sidik jari kromatografi melamin dalam sampel.
2. Kimia dan Reagen
a. Sampel standar melamin b. Asetonitril (GC grade) c. Air (GC grade)
d. Dietilamina (GC grade)
e. Semua bahan kimia lainnya adalah dari tingkatan analitis atau tingkatan kelas
3. Prosedur Kerja
a. Pengambilan sampel b. Ekstraksi Melamin
c. GC-MS Instrumen dan Program
Analisis ekstraksi kasar GC-MS sampel bubuk dilakukan dengan menggunakan Varian GC-MS (Model Varian CP 3800, USA) yang dilengkapi dengan VF-5 leburan silika kolom kapiler (30 m x 0,25 id ketebalan mm film 0,25 µm, Varian, USA). Untuk deteksi GC-MS, digunakan sistem ionisasi elektron dengan energi ionisasi dari 70 eV. Gas helium digunakan sebagai gas pembawa pada tingkat rendah konstan 1 ml/menit. Injektor dan massa suhu garis pengiriman yang ditetapkan masing-masing sebesar 250 dan 300oC. Suhu oven diprogram dari 100oC ke 200oC di 10oC/menit, dan kemudian ditahan selama 1 menit dan akhirnya dinaikkan menjadi 300oC di 10oC/menit. Sampel encer (1/100v/v, di media piridin) dari 0,2 ml secara manual disuntikkan dalam cara split. Identifikasi senyawa diekstrak secara kasar didasarkan pada waktu penyimpanan GC di kolom kapiler VF-5 dan pencocokan komputer dari spektrum massa dengan standar (Mainlab, Replib dan data Arahan sistem GC-MS).
d. Identifikasi puncak Melamin
4. Hasil dan Pembahasan
Dalam Percobaan ini, semua sampel yang diuji (12 sampel) dikumpulkan dari kota Dhaka. Sampel susu dikumpulkan dalam kemasan aluminium foil yang disegel.
Metode modifikasi GC-MS diterapkan untuk analisis melamin ada dalam sampel susu bubuk. Dalam penelitian ini, metode yang diprogram digunakan untuk pengujian simultan penanda otentik. Standar ini ditetapkan dalam satu GC-MS. Standar ini diselesaikan dan dielusi pada 14,47 menit, sehubungan dengan melamin (Gambar. 3.3.1).
Gambar 5.15 Kromatogram penanda referensi, melamin.
Penanda referensi tidak ada dalam profil kromatografi dari berbagai merek sampel susu bubuk bila dianalisis dengan GC-MS (Gambar 3.3.2).
Puncak melamin dinyatakan dengan perbandingan waktu retensi dengan standar referensi.
Gambar 5.16 Kromatogram khas dari berbagai merek sampel susu
D. Analisis Validasi Kromatograf Gas - Speektrometri Massa tentang Pemurnian Senyawa Cannabinoids dari Urin dengan Logam Kalsium Polimer β-Siklodekstrin (Validated Gas Chromatographic – Mass Spectrometric Analysis of Urinary Cannabinoids Purified with A Calcium-Hardened β-Cyclodextrin Polymer)
1. Tujuan : Untuk analisis kuantitatif THC, 11-OH-THC, dan THC-COOH
dalam urin manusia menggunakan logam kalsium polimer βCD.
2. Alat dan Bahan
a. THC, 11-OH-THC, THC-COOH dan THC-COOH-d9 (Standar Internasional)
b. N-Metil-N-trifluorotrimetilsilil asetamida (MSTFA) c. Amonium iodida (NH4I)
d. Ditioeritritol (DTE) e. β-Siklodextrin (CD) f. Epiklorohidrin
g. Larutan gliserol α-50% h. HPLC grade
i. Larutan persediaan standar acuan cannabinoid disiapkan di 10mgL-1 dalam metanol
j. Larutan kerja terbuat dari metanol pada konsentrasi 10-1000 gL-1 k. Sampel urine yang digunakan untuk kalibrasi dan kualitas control
(QC) disusun oleh obat keras-bebas urine dengan larutan kerja
3. Prosedur Kerja
a. Sintesis dipolimerisasi oleh bubuk β-siklodekstrin b. Kromatografi Gas - Spektrometri Massa
Analisis GC-MS dilakukan dengan menggunakan cara pemantauan ion (SIM) menggunakan Agilent 6890 ditambah gas kromatografi dilengkapi dengan 2-Ultra kapiler kolom (25 m x 0,2 mm id, Ketebalan film 0,33 m; teknologi Agilent; Palo Alto, CA) dan dihubungkan dengan Agilent 5973 NMSD. Energi elektron dari 70 eV dan digunakan suhu sumber ion dari 2300C. Setiap sampel (2 µL) disuntikkan dalam mode split (10 : 1) pada 2800C, menggunakan Kondisi GC berikut: suhu oven awal 2000C meningkatkan produksinya untuk 2400C di 80C min-1, dan kemudian ke 3100C di 100C min-1 dan ditahan selama 5 menit. Helium digunakan sebagai gas pembawa pada
tekanan kepala kolom dari 173 kPa (kolom aliran : 0,80C min-1 pada suhu oven 2000C).
c. Persiapan Sampel d. Metode Validasi e. Aplikasi forensic
4. Hasil dan Diskusi a. Analisis GC-MS
Penggunaan kondisi GC-MS yang dijelaskan, THC, 11-OH-THC, THCCOOH dan THC-COOH berhasil dipisahkan sebagai Derivatif TMS dalam waktu 14 menit dalam mode SIM. Perwakilan SIM kromatogram untuk urin tajam pada konsentrasi 2 µgL-1 dengan masing-masing cannabinoid disajikan pada Gambar 2. Identifikasi Puncak langsung dan dicapai dengan menggunakan tiga ion karakteristik. Ion kuantitatif pada m/z 386 untuk THC dan m/z 371 untuk 11-THC, dan THC-COOH digunakan. Dalam kasus THC, fragmen kurang intenspada m/z 386 dipilih untuk meningkatkan selektivitas bukan intens yang paling puncak (m/z 371), karena gangguan urin.
Gambar 5.17 Deteksi tampilan untuk analisis cannabinoids sebagai turunan trimetilsilil diperoleh dari (A) kosong dan urin (B) a urine teknik spiking sample di konsentrat urin
Pada pembahasan yang terpisah, perangkap steroid oleh logam βCD, dan menemukan bahwa estrogen terhidroksilasi lebih efektif dan ditangkap dari steroid lainnya, yang menunjukkan bahwa ikatan hidrogen terjadi antara hidroksil fenolik estrogen dan exteriorhydroxyls βCD. Hal ini sebelumnya telah dilaporkan bahwa ikatan hydrogen berperan dalam pengikatan estrogen terhidroksilasi oleh Resin βCD. Selain itu, cannabinoids memiliki cincin fenolik, dan telah dilaporkan untuk membentuk stabil "melintang" kompleks dengan βCD, dan lebih jauh lagi, yang memiliki rantai samping alkil dari cannabinoid.
Gambar 5.18 Total kromatogram ion Perbandingan cannabinoids
diekstrak awalnya dengan tetrahidrofuran dan kemudian diekstraksi dengan menggunakan n- heksana dan dietil eter .
E. Analisis Obat flunitrazepam pada radiasi PaparanUV dengan menggunakan kromatograf gas – spektrometri massa (Gas Chromatography-Mass Spectrometric Analysis of Forensic Drug Flunitrazepam Upon Exposure to UV Irradiation)
1. Tujuan : untuk mengamati perubahan substansial dalam pola GC
melibatkan beberapa puncak GC dalam kondisi radiasi UV.
2. Alat dan Bahan
a. Flunitrazepam (1 mg/mL dalam metanol) b. Metanol (HPLC grade, 99,9%)
c. Radiasi UV pengobatan flunitrazepam radiasi UV terbukti dengan sumber cahaya UV (Blak-Ray B-100AP High Intensity UV Lamp, 100 W, 365 nm)
d. Larutan metanol flunitrazepam terkena di bawah sinar UV untuk 0, 10, 20, 30, 40, 50, dan 60 menit. Jarak antara sinar UV dan flunitrazepam sampel adalah 20 cm untuk meminimalkan efek dari kemungkinan suhu tinggi yang di hasilkan oleh lampu UV. Kontrol menggunakan larutan metanol di bawah kondisi yang sama yaitu terkontaminasi potensial dan gangguan percobaan dilakukan dan diperiksa oleh GC- MS
3. Hasil dan Pembahasan
Pengaruh radiasi UV pada flunitrazepam
sinar UV. Dengan tidak adanya radiasi UV, puncak GC tunggal pada 13,1 menit diamati. Setelah pengobatan sinar UV, lebih dari sepuluh puncak GC yang diamati (Gambar 3.5.1, panel bawah), menunjukkan fotosensitifitas dari flunitrazepam terhadap radiasi UV. Delapan puncak GC pada 1,84, 3,23, 4,50, 5,62, 6,63, 7,62, 8,98, dan 11,0 menit menunjukkan waktu retensi singkat dari flunitrazepam, menunjukkan bahwa radiasi UV menyebabkan beberapa komponen yang lebih rendah dari titik didih flunitrazepam. Kami juga menemukan tiga kemungkinan yang lebih tinggi komponen titik didih pada 14,0, 18,7, dan 20,2 menit.
Gambar 5.19 (Panel atas) menunjukkan kromatografi gas khas flunitrazepam dalam larutan metanol sebelum dan setelah
pengobatan sinar UV dan (panel bawah) menunjukkan fotosensitifitas dari flunitrazepam terhadap radiasi UV
Gambar 5.20 menunjukkan spektrum massa puncak GC pada 13,1 menit, yang menunjukkan sinyal besar di massa untuk mengisi rasio (m/z) 65, 75, 109, 119, 170, 183, 210, 238, 266, 286, 312 , dan 313. Puncak GC di 13,1 menit diidentifikasi sebagai flunitrazepam oleh perpustakaan data massa menggunakan Xcalibur 2.2 software. Fitur spektral massa khas flunitrazepam adalah 238, 266, 285, 312, dan 313 [25]. M/z 313 ditugaskan ke puncak ion molekul flunitrazepam. M/z 285 puncak mungkin karena hilangnya CO (313-28 = 285), dan m/z 266 puncak dapat dihasilkan dengan menghapus dari H dan NO2 (313-46-1
= 266). M/z 238 puncak dapat ditugaskan untuk kehilangan HNO2CO fragmen (313-75 = 238).
Gambar 5.20 Spektrum massa puncak GC pada 13,1 menit
F. Analisis Etanol dalam Hair Tonic dan Hair Spray secara Kromatograf Gas
1. Tujuan:
untuk menetapkan kadar etanol dalam hair tonic dan hair spray secara kromatografi gas.
2. Metode
Metode analisis kuantitatif yang digunakan dalam penelitian ini adalah baku internal. Penelitian diawali denganmencari kondisi analisis yang sesuai. Kondisi analisis terpilih kemudian digunakan untuk analisis kuantitatif. Persamaankurva kalibrasi digunakan untuk menetapkan kadar etanol dalam sampel hair tonic dan hair spray.
3. Cara Kerja
a) Analisis Kualitatif Etanol dalam Sampel
b) Analisis Kuantitatif Etanol dalam Sampel Pembuatan larutan standar etanol 10%
e) Pencarian kondisi analisis f) Pembuatan kurva kalibrasi
g) Penetapan kadar etanol dalam sampel
Sebanyak 10,0 μl larutan hasil penyarian sampel hair tonic dan hair
spray diinjeksikan pada kromatografi gas dengan menggunakan kondisi
terpilih. Replikasi dilakukan sebanyak lima kali. Perhitungan kadar sampel menggunakan regresi linier.
4. Hasil dan Pembahasan
a) Pembuatan kurva kalibrasi
Data kurva kalibrasi dapat dilihat pada gambar 3.6.1 Persamaan kurva kalibrasi yang diperoleh yaitu y= 0,5921x-1,9297. Persamaan ini kemudian digunakan untuk menghitung kadar etanol dalam sampel hair
tonic dan hair spray.
Gambar 5.21 Kurva kalibrasi konsentrasi etanol dan 2 butanol vs PAR
b) Penetapan kadar etanol dalam sampel
Hasil analisis etanol terhadap sampel menunjukkan bahwa seluruh sampel memberikan hasil yang positif mengandung etanol. Kadar etanol dalam hair tonic adalah 15,2365%v/v dan dalam sampel hair spray adalah 17,2528% v/v.
Kadar yang didapatkan semua memenuhi syarat yaitu tidak lebih dari 40% pada sediaan kosmetik 40% karena dapat menimbulkan iritasi dan mengeringkan kulit jika melebihi persyaratan tersebut (Wasitaatmadja, 1997).
G. Analisis Cemaran Pestisida Dalam Air Dengan Cara Kromatograf Gas