I. PENDAHULUAN A. Judul
Lemak B. Tujuan
Mengenal beberapa sifat lemak
II. TINJAUAN PUSTAKA
bentuk cis dan trans yang terkandung di dalam asam lemak tidak jenuh (Sartika, 2008).
Menurut Mantogomery (1993), lemak merupakan senyawa organik yang sukar larut dalam pelarut organik seperti eter, benzena, dan kloroform. Lemak yang merupakan kelompok ikatan organik ini terdiri atas unsur-unsur Carbon (C), Hidrogen (H), Oksigen (O) yang mempunyai sifat dapat larut dalam zat-zat pelarut tertentu (zat pelarut lemak). Dalam tubuh manusia, lemak berfungsi sebagai komponen struktural membran sel, sebagai bentuk penyimpanan energi, sebagai bahan bakar metabolik, dan sebagai agen pengemulsi.
Lemak adalah salah satu komponen makanan multifungsi yang sangat penting untuk kehidupan. Selain memiliki sisi positif, lemak juga mempunyai sisi negatif terhadap kesehatan. Fungsi lemak dalam tubuh antara lain sebagai sumber energi, bagian dari membran sel, menjaga keseimbangan suhu tubuh, pelindung organ-organ tubuh serta pelarut vitamin A, D, E, dan K (Sartika, 2008).
Menurut Sudarmadji (1989), lemak dan minyak merupakan senyawa organik yang sangat penting terdapat dalam makanan, karena dapat langsung dicerna dalam tubuh manusia menjadi sumber energi. Lemak dan minyak tidak hanya dikenal sebagai sumber makanan manusia, tapi merupakan bahan baku lilin, margarin, detergen, kosmetik, obat-obatan, dan bahan pelumas, yang diolah dengan proses yang berbeda.
minyak akan bertambah dengan bertambahnya panjang rantai karbon (Deman, 1997).
Lemak tersusun dari asam-asam lemak dan suatu polihidroksi (gliserol). Asam lemak adalah asam karboksilat rantai panjang yang dapat mengandung ikatan rangkap (tidak jenuh) dan jenuh. Lemak yang mengandung ikatan rangkap dinamakan minyak. Lemak dan minyak berfungsi sebagai cadangan energi metabolit. Konsumsi lemak tak jenuh, seperti minya kelapa sawit dapat mengurangi kadar kolesterol dalam tubuh. Lemak dan minyak dapat dihidrolisis dengan suatu basa alkali membentuk sabun (Suhardjo dan Kusharto, 1992).
Menurut Lehninger (1998), asam lemak adalah asam organik berantai panjang yang mempunyai atom karbon dari 4 sampai 24. Asam lemak mempunyai gugus karboksil tunggal dan ekor hidrokarbon non polar yang panjang yang menyebabkan kebanyakan lipid bersifat tidak larut di dalam air dan tampak berminyak atau belemak. Asam lemak tidak terdapat secara bebas atau berbentuk tunggal di dalam sel atau jaringan, tetapi terdapat dalam bentuk yang terikat secara kovalen pada berbagai kelas lipida yang berbeda, asam lemak dapat dibebaskan dari ikatan ini oleh hidrolisis kimia atau enzimatik.
Asam lemak tidak jenuh yaitu asam lemak yang mempunyai ikatan tidak jenuh (rangkap) baik tunggal maupun ganda. Asam lemak tidak jenuh bersifat mudah rusak apabila terkena panas. Asam lemak yang bersifat jenuh yaitu asam lemak dengan rantai tunggal. Asam lemak jenuh biasanya terdapat dalam minyak atau lemak yang berasal dari hewan (Moehji,1992).
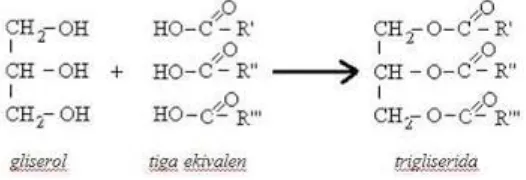
Gambar 1. Struktur Trigliserida
Pada proses pembentukannya, trigliserida merupakan proses kondensasi satu molekul gliserol dengan tiga molekul asam-asam lemak (umumnya ketiga asam lemak berbeda-beda) yang membentuk satu molekul trigliserida dan tiga molekul air.
Gambar 2. Pembentukan Trigliserida
Kalau R1 = R2 = R3 maka trigliserida yang terbentuk adalah trigliserida sederhana (simple triglycerida) sebaliknya kalau berbeda-beda adalah trigliserida campuran (mixet triglycerida) (Sudarmadji, 1989).
Sabun adalah bahan yang digunakan untuk mencuci dan mengelmusi, terdiri dari dua komponen utama yaitu asam lemak dengan rantai karbon C16 dan sodium atau potasium. Sabun merupakan pembersih yang dibuat dengan reaksi kimia antara kalium atau natrium dengan asam lemak dari minyak nabati atau lemak hewani. Sabun yang dibuat dengan NaOH dikenal dengan sabun keras, sedangkan sabun yang dibuat dengan KOH dikenal dengan sabun lunak (Zulkifli dan Estiasih, 2014).
bagian kepala bersifat hidrofilik dan bagian ekor bersifat hidrofobik. Karena sifat ilmiah sabun mampu mengangkat kotoran (biasanya lemak) dari badan atau pakaian. Sabun merupakan senyawa garam dari asam-asam lemak tinggi, seperti natrium stearat, C17H35COONa+. Aksi pencucian dari sabun banyak dihasilkan dari
kekuatan pengemulsian dan kemampuan menurunkan tegangan permukaan air. Konsep ini dapat di pahami dengan mengingat kedua sifat dari anion sabun (Achmad, 2004).
Menurut Naomi, dkk. (2013), sabun dihasilkan melalui reaksi saponifikasi. Saponifikasi merupakan proses hidrolisis basa terhadap lemak dan minyak, dan reaksi saponifikasi bukan merupakan reaksi kesetimbangan. Hasil mula-mula dari penyabunan adalah karboksilat karena campurannya bersifat basa. Setelah campuran diasamkan, karboksilat berubah menjadi asam karboksilat.
Saponifikasi merupakan salah satu pemurnian secara fisik. Saponifikasi dilakukan dengan menambahkan basa pada minyak yang akan dimurnikan. Penambahan basa pada proses saponifikasi akan bereaksi dengan lemak bebas membentuk sabun yang mengendap dengan membawa serta lendir, kotoran, dan sebagian zat warna. Saponifikasi adalah suatu proses untuk memisahkan asam lemak bebas dari minyak atau lemak dengan cara mereaksikan asam lemakbebas dengan basa atau pereaksi lainnya sehingga membentuk sabun (soap stock) (Zulkifli dan Estiasih, 2014).
Sabun membersihkan dengan bertindak sebagai emulsi. Cara kerja sabun yakni pada bagian hidrofob (tidak mudah larut dalam air) molekul sabun masuk ke dalam lemak, sedangkan ujungnya yang bermuatan negatif ada di bagian luar. Oleh karena adanya gaya tolak antara muatan listrik, maka kotoran akan terpecah menjadi partikel-partikel kecil dan membentuk emulsi. Dengan demikian kotoran mudah terlepas dari kain atau benda lain (Poedjiadi, 2005).
mencucinya karena struktur kimianya. Bagian akhir dari rantai (ionnya) yang bersifat hidrofil (senang air) sedangkan rantai karbonnya bersifat hidrofobik (benci air). Rantai hidrokarbon larut dalam partikel minyak yang tidak larut dalam air. Ionnya terdispersi atau teremulsi dalam air sehingga dapat dicuci.
Menurut Marsidi (2001), air sadah adalah istilah yang digunakan pada air yang mengandung kation penyebab kesadahan. Pada umumnya kesadahan disebabkan oleh adanya logam-logam atau kation-kation yang bervalensi 2, seperti Fe, Sr, Mn, Ca, dan Mg, tetapi penyebab utama dari kesadahan adalah kalsium (Ca) dan magnesium (Mg). Pada air sadah, sabun menjadi kurang efektif karena salah satu bagian dari molekul sabun diikat oleh unsur Ca/Mg.
Uji sifat lemak terbagi menjadi 5 bagian yaitu:
1. Pembuatan garam
Gambar 3. Reaksi saponifikasi 2. Hidrolisa sabun
Dengan adanya air, lemak dapat terhidrolisis menjadi gliserol dan asam lemak. Reaksi ini dipercepat oleh basa, asam, dan enzim-enzim. Hidrolisis sangat mudah terjadi dalam lemak dengan asam lemak rendah (lebih kecil dari C14) (Winarno, 1992). Dengan proses hidrolisa, lemak akan terurai menjadi asam lemak dan gliserol. Proses ini dapat berjalan dengan menggunakan asam, basa, dan enzim tertentu. Dalam proses hidrolisa, lemak atau minyak akan diubah menjadi asam-asam lemak bebas dan gliserol. Reaksi hidrolisa dapat mengakibatkan kerusakan minyak atau lemak terjadi karena terdapatnya sejumlah air dalam minyak atau lemak tersebut (Ketaren, 2008).
3. Emulsi lemak
minyak tadi tetap tersuspensi di dalam air. Senyawa ini molekul-molekulnya, mempunyai afinitas terhadap kedua cairan itu. Daya afinitasnya harus parsial dan tidak sama terhadap kedua cairan itu. Menurut Hart, dkk. (2003), bahwa apabila pada suatu bahan yang diujikan terdapat lemak maka akan mengalami emulsi dengan sempurna yang ditunjukan dengan adanya endapan (emulsi). Menurut Poedjiadi (1994), bahwa sabun digunakan sebagai bahan pembersih kotoran terutama kotoran yang bersifat lemak atau minyak karena sabun dapat mengemulsikan lemak atau minyak.
4. Ketidakjenuhan lemak
Reagensia permanganat merupakan uji bayer untuk ketidakjenuhan dalam senyawa yang tak diketahui strukturnya. Larutan uji (KMnO4) berwarna
ungu. Ketika reaksi berjalan, warna ungu menghilang dan nampak endapan MnO2 coklat (Fessenden dan Fessenden, 1982). Pada uji bayer ini
dilakukan dengan mencampurkan larutan KMnO4. Hasil yang positif
adalah hilangnya warna ungu dari larutan kalium permanganat (Wilbraham, 1992).
5. Pembuatan asam minyak
Pada proses pembuatan asam minyak, akan dihasilkan pula asam minyak dapat dibentuk dari pereaksian sabun dengan suatu senyawa asam tertentu. Misalnya saja dengan menambahkan larutan asam klorida yang merupakan larutan asam kuat. Beda halnya dengan minyak yang berwujud cair, asam minyak memiliki wujud yng berupa padatan, sehingga asam minyak dapat dengan mudah dibedakan dari minyak berdasarkan identifikasi penampakannya. Pada proses pembuatan asam minyak akan dihasilkan pula suatu produk sampingan berupa garam (Hadi dan Purba, 1991).
A. Alat dan Bahan
Alat : Bahan :
1. Tabung reaksi 1. Larutan CH3COOH 5%
2. Rak tabung reaksi 2. Larutan CaCl2 1%
3. Pipet tetes 3. Larutan MgSO4 1%
4. Pro pipet 4. Larutan Pb asetat 1%
5. Pipet ukur 5. Larutan sabun
6. Vortex 6. Aquades
7. Gelas beker 7. Indikator Phenolphtalein
8. Plat tetes 8. Minyak
9. Gelas ukur 9. Larutan Eter
10. Indikator universal 10. Larutan KMnO4 0,1 N
11. Gelas pengaduk 11. HCl pekat 12. Kertas lakmus 13. Kertas label
B. Cara Kerja
1. Pembentukan garam
Larutan sabun diambil sebanyak 30 ml lalu dimasukkan ke dalam gelas beker. pH pada larutan sabun diperiksa dengan kertas lakmus. Jika pH pada larutan sabun sudah netral, maka larutan sabung langsung dimasukkan ke dalam 3 tabung reaksi sama rata. Apabila pH larutan sabun belum netral, maka larutan sabun ditambah larutan CH3COOH 5%
sampai pH nya netral.
Larutan sabun dengan pH netral dimasukkan ke 3 tabung reaksi. Larutan sabun sebanyak 5 ml dimasukkan ke masing-masing tabung reaksi. Pada tabung pertama, larutan sabun ditambah 7 tetes larutan CaCl2
1%. Tabung kedua, ditambah 7 tetes larutan MgSO4 1%. Tabung ketiga
ditambah 7 tetes Pb asetat 1%. Perubahan yang terjadi pada masing-masing larutan diamati.
2. Hidrolisa sabun
Larutan sabun sebanyak 10 ml dimasukkan ke dalam tabung reaksi. Kemudian ditambahkan 5 ml aquades dan ditambah indikator PP sebanyak 3 tetes. Tabung reaksi divortex. Perubahan yang terjadi pada larutan diamati.
Pada tabung reaksi pertama, ditambah aquades sebanyak 2 ml dan ditambah 5 tetes minyak lalu didiamkan. Pada tabung reaksi kedua, ditambah 2 ml aquades kemudian ditambah 5 tetes minyak dan ditambah 2 ml larutan sabun lalu didiamkan. Perubahan yang terjadi pada larutan diamati.
4. Sifat ketidakjenuhan lemak
Minyak sebanyak 2 ml dan larutan eter sebanyak 5 ml dimasukkan ke dalam tabung reaksi. Lalu tabung reaksi divortex. Setelah divortex, ditambahkan larutan KMnO4 0,1 N sebanyak 3 tetes. Perubahan pada
larutan diamati.
5. Pembuatan asam minyak
Larutan sabun sebanyak 5 ml dimasukkan ke tabung reaksi. Kemudian ditambah larutan HCl pekat sebanyak 3 ml. Tabung reaksi divortex lalu didiamkan sampai terbentuk 2 lapisan.
IV. HASIL DAN PEMBAHASAN A. Hasil
Berdasarkan percobaan pembentukan garam yang telah dilakukan, didapatkan hasil yang dapat dilihat pada tabel 1.
LARUTAN WARNA ENDAPAN GARAM
AWAL AKHIR
MgSO4 Putih keruh Putih keruh +
Pb asetat Putih keruh Putih keruh ++
Berdasarkan percobaan hidrolisa sabun yang telah dilakukan, didapatkan hasil yang dapat dilihat pada tabel 2.
LARUTAN SABUN WARNA
AWAL AKHIR
Ditambah phenolphtalein Bening Ungu. Ada buih warna putih
Berdasarkan percobaan ketidakjenuhan lemak yang telah dilakukan, didapatkan hasil yang dapat dilihat pada tabel 3.
LARUTAN SABUN WARNA
AWAL AKHIR
Ditambah KMnO4 Bening kekuningan Bening kekuningan. Ada endapan cokelat.
Berdasarkan pecobaan emulsi lemak yang telah dilakukan, didapatkan hasil yang dapat dilihat pada tabel 4.
MINYAK WARNA EMULSI KETERANGAN
1. Aquades 2 ml + 5 tetes minyak
Bening Ada Ada emulsi,
bentuk cekung 2. Aquades 2 ml +
5 tetes minyak + 2 ml larutan
sabun
Putih keruh Ada Ada emulsi
sedikit, bentuk menggumpal
LARUTAN WARNA KETERANGAN Sabun + HCl pekat Putih keruh Terbentuk 2 lapisan
B. Pembahasan
Percobaan pembentukan garam adalah percobaan pertama yang dilakukan. Tujuan dari percobaan ini adalah untuk mengetahui reaksi pembentukan garam. Langkah pertama yang dilakukan pada percobaan ini yaitu larutan sabun dimasukkan ke gelas beker lalu pH larutan sabun ditentukan dengan kertas lakmus. Apabila larutan sabun belum mencapai pH netral, maka langkah selanjutnya ditambahkan larutan CH3COOH sedikit demi sedikit
hingga pH menjadi netral. Tujuan dari penambahan CH3COOH yaitu untuk
menetralkan larutan sabun yang bersifat basa. Pencampuran larutan sabun dengan asam asetat (CH3COOH) dilakukan karena garam akan bercampur
dengan larutan yang bersifat non-polar. Larutan sabun dengan pH netral diperlukan supaya tidak mengganggu reaksi pembentukan garam.
Larutan sabun dengan pH netral dimasukkan ke 3 tabung reaksi. Pada tabung reaksi pertama ditambahkan CaCl2 1%, tabung kedua ditambah MgSO4 1% dan tabung ketiga ditambahkan Pb asetat 1%. Fungsi dari ketiga larutan tersebut yaitu sebagai larutan pembentuk garam yang berfungsi mengekstrasi asam lemak pada larutan sabun.
Sebelum ditetesi CaCl2 1% sebanyak 7 tetes, larutan berwarna putih keruh.
Setelah ditetesi CaCl2 1% warna larutan tetap putih keruh. Setelah larutan
didiamkan, terdapat endapan garam yang banyak (+++). Endapan berasal dari pembentukan ikatan Ca+ dengan larutan sabun. Endapan yang terbentuk
pada tabung reaksi pertama menunjukkan adanya pembentukan garam. Reaksi yang terjadi adalah:
2C17H35COONa + CaCl2 2 NaCl + Ca (C17H35COO)2
Pada tabung reaksi kedua, sebelum ditetesi 7 tetes larutan MgSO4 1 %
larutan berwarna putih keruh. Setelah ditetesi larutan MgSO4 larutan tidak
berubah warna dan terbentuk endapan yang sedikit (+) dibandingkan dengan kedua larutan lainnya. Reaksi yang terjadi adalah :
Pada tabung reaksi ketiga, sebelum ditetesi 7 tetes larutan Pb asetat 1% larutan berwarna putih keruh. Setelah ditetesi larutan Pb asetat 1% tetap berwarna putih keruh dan terbentuk endapan yang sedang (++). Reaksi yang terjadi adalah :
2C17H35COONa + Pb(CH3COOH)2 2CH3COONa+Pb(C17H35COO)2
Ketika menambahkan 7 tetes larutan CaCl2, MgSO4, dan Pb asetat endapan
yang terbentuk di ketiga tabung reaksi belum terlalu terlihat. Tetapi ketika ditambah kembali 7 tetes CaCl2, MgSO4, dan Pb asetat lalu divortex, endapan
baru jelas terlihat.
Diantara ketiga tabung reaksi, yang paling banyak menghasilkan endapan adalah tabung reaksi yang ditetesi larutan CaCl2. Endapan yang terbentuk
mengindikasi kelarutannya. Semakin banyak endapannya maka semakin rendah kelarutannya, begitu pula sebaliknya. Tabung didiamkan sebentar hingga terbentuk endapan bertujuan agar larutan dapat bereaksi dengan baik.
Percobaan kedua adalah hidrolisa sabun. Percobaan ini bertujuan untuk mengetahui proses hidrolisa sabun. Fungsi dari penambahan akuades ini adalah sebagai pelarut polar yang memisahkan antara air sabun dan lemak yang terlarut di dalamnya, dapat memutuskan ikatan rangkap, membuat larutan sabun semakin tidak jenuh serta sebagai pengencer. Fungsi dari indikator phenolphtalein (PP) yaitu sebagai indikator untuk membuktikan bahwa larutan tersebut bersifat basa atau tidak. Sebelum larutan ditambah indikator PP, larutan berwarna bening. Setelah ditambah indikator PP dan divortex, larutan berubah warna menjadi ungu dan muncul buih berwarna putih. Dengan munculnya warna pink, artinya terdapat basa dalam larutan (Day dan Underwood, 1989). Pada percobaan hidrolisa sabun ini juga dilakukan pengocokan dengan vortex yang bertujuan agar larutan yang terdapat di dalam tabung reaksi tercampur secara merata dan larutan dapat berubah warna secara sempurna. Reaksi yang terjadi adalah :
RCOONa + H2O RCOO- + NaOH
RCOO + H2O RCOOH + OH
Percobaan ketiga adalah ketidakjenuhan lemak. Percobaan ini bertujuan untuk mengetahui sifat ketidakjenuhan lemak. Larutan yang digunakan pada percobaan ini adalah eter, KMnO4, minyak. Fungsi dari larutan eter yaitu sebagai pelarut non-polar untuk melarutkan minyak. Fungsi penambahan KMnO4 adalah untuk oksidator yang memecah ikatan rangkap lemak (lemak
tak jenuh) menjadi ikatan tunggal (asam lemak jenuh).
Larutan pada percobaan ketidakjenuhan lemak sebelum ditambah KMnO4
berwarna bening kekuningan. Setelah ditambah KMnO4 tetap berwarna
bening kekuningan dan terdapat endapan berwarna cokelat. Endapan tersebut adalah MnO2 sebagai indikasi adanya sifat ketidakjenuhan lemak, karena dari
ikatan tak jenuh mampu dioksidasi oleh KMnO4 menjadi ikatan tunggal yang
menghasilkan MnO4. Selain itu fungsi dari pengocokan yang dilakukan
dengan vortex agar larutan benar-benar bercampur, sehingga minyak terlarut dalam eter. Reaksi yang terjadi adalah:
CH3(CH2)7CH=CH(CH2)7COOH CH3(CH2)7CH-CH(CH2)7COOH
CH CH
Pada percobaan ketidakjenuhan lemak sudah sesuai dengan teori. Karena, menurut Fessenden dan Fessenden (1982), reagensia permanganat merupakan uji bayer untuk ketidakjenuhan dalam senyawa yang tak diketahui strukturnya. Larutan uji (KMnO4) berwarna ungu. Ketika reaksi berjalan,
warna ungu menghilang dan nampak endapan MnO2 coklat.
hidrokarbon larut dalam partikel minyak yang tidak larut dalam air. Ionnya terdispersi atau teremulsi dalam air sehingga dapat dicuci.
Pada tabung reaksi pertama yang berisi aquades sebanyak 2 ml dan 5 tetes minyak sebelum didiamkan berwarna bening. Setelah didiamkan beberapa saat pada larutan terbentuk emulsi yang berbentuk cekung. Pada tabung reaksi kedua yang berisi aquades sebanyak 2 ml, 5 tetes minyak, dan 2 ml larutan sabun sebelum didiamkan larutan berwarna putih keruh. Setelah didiamkan beberapa saat pada larutan terbentuk emulsi yang sedikit dan bentuknya menggumpal. Reaksi yang terjadi adalah:
C17H35COO- + OH- C17H35COOH + OH
-Percobaan yang kelima adalah pembuatan asam minyak. Larutan yang digunakan adalah larutan sabun dan HCl pekat. Percobaan ini bertujuan untuk mengetahui proses pembutan asam minyak. Penambahan lautan HCl pekat ini bertujuan untuk memisahkan minyak dengan sabun atau untuk memutuskan ikatan rangkap pada asam minyak. Ion Cl- dari HCl akan berikatan dengan
ion Na+ dari larutan sabun. Pengocokan dengan vortex bertujuan untuk
menghomogenkan larutan supaya rantai rangkap asam minyak benar-benar putus, selain itu untuk membebaskan asam-asam lemak dari garam-garamnya. Setelah divortex, pada larutan akan terbentuk dua lapisan. Lapisan atas merupakan lemak yang teremulsi dan lapisan bawah adalah larutan HCl. Pendiaman larutan selama beberapa saat bertujuan agar larutan membentuk emulsi yang nantinya akan terlihat. Saat sabun ditambah asam kuat akan menghasilkan asam lemak dan garam. Reaksi kimianya adalah :
V. KESIMPULAN
Berdasarkan percobaan Lemak yang dilakukan, maka dapat ditarik kesimpulan bahwa:
1. Dilihat dari sudut pandang kimiawi, sabun merupakan garam dari asam lemak yang memiliki rantai panjang. Garam ini terbentuk bila lemak atau minyak dipanaskan dengan alkali sehingga gugus ester dari lemak tersebut dapat terkonversi menjadi gliserol dan garam asam lemak.
2. Dengan proses hidrolisa, lemak akan terurai menjadi asam lemak dan gliserol. Proses ini dapat berjalan dengan menggunakan asam, basa, dan enzim tertentu.
4. Ketidakjenuhan lemak diujikan melalui percobaan, dimana membentuk endapan MnO2 yang merupakan indikasi adanya asam leak menjadi jenuh
dengan ikatan tunggal.
5. Proses pembuatan asam minyak, akan dihasilkan pula asam minyak dapat dibentuk dari pereaksian sabun dengan suatu senyawa asam tertentu.
VI. DAFTAR PUSTAKA
Achmad, R. 2004. Kimia Lingkungan Edisi 1. Andi Offset, Yogyakarta.
Almatsier, S, 2002. Prinsip Dasar Ilmu Gizi. Gramedia Pustaka Utama, Jakarta.
Chang, R. 2005. Kimia Dasar: Konsep-konsep Inti Jilid I. Erlangga, Jakarta. Day, R.A. dan Underwood, A.L. 1989. Analisis Kimia Kuantitatif. Erlangga,
Jakarta.
Deman, J.M., 1997, Kimia Makanan. Penerbit ITB, Bandung.
Fessenden, R.J., and Fessenden, J.S. 1982. Kimia Organik Jilid 2. Erlangga, Jakarta.
Fessenden, R. J dan J. S. Fessenden. 1986. Kimia Organik. Erlangga, Jakarta Hadi, S., dan Purba, M. 1991. Ilmu Kimia Karbon. Erlangga, Jakarta.
Hart, H., Craine, L.E., Hart, D.J. 2003. Kimia Organik Suatu Kuliah Singkat. Erlangga, Jakarta.
Ketaren, S. 2008 . Pengantar Teknologi Minyak dan Lemak Pangan. Universitas Indonesia Press, Jakarta.
Lehninger.1998. Dasar-dasar Biokimia. Erlangga, Jakarta. Mantogomery, R. 1993. Biokimia. UGM Press Yogyakarta.
Marsidi, R. 2001. Zeolit untuk Mengurangi Kesadahan Air. Jurnal Teknologi Lingkungan. 2(1):1-10.
Naomi, P., Gaol, A.M.L., dan Toha, M.Y. 2013. Pembuatan Sabun Lunak dari Minyak Goreng Bekas Ditinjau dari Kinetika Reaksi Kimia. Jurnal Teknik Kimia. 19(2):42-48.
Permono, A. 2001. Pembuatan Sabun Mandi Padat. Swadaya, Jakarta. Poedjiadi, A. 1994. Dasar-dasar Biokimia. UI Press, Jakarta.
Poedjiadi, A. 2005. Sains Teknologi Masyarakat. PT. Remaja Rosda Karya, Bandung.
Sari, T.I., Kasih, J.P., dan Sari, T.J.N. 2010. Pembuatan Sabun Padat dan Sabun Cair dari Minyak Jarak. Jurnal Teknik Kimia. 17(1):28-33.
Sartika, R.A.D. 2008. Pengaruh Asam Lemak Jenuh , Tidak Jenuh dan Asam Lemak Trans terhadap Kesehatan. Jurnal Kesehatan Masyarakat Nasional. 2(4):154-160.
Sudarmadji, S. 1989. Analisa Bahan Makanan dan Pertanian. Liberty, Yogyakarta.
Suhardjo., Kusharto, C.M. 1992. Prinsip-prinsip Ilmu Gizi. Kanisius, Yogyakarta.
Wilbraham, C. 1992. Pengantar Kimia Organik dan Hayati. Penerbit ITB, Bandung.
Winarno, F.G. 1984. Kimia Pangan dan Gizi. Gramedia, Jakarta. Winarno, F. G. 1992. Kimia Pangan dan Gizi. Gramedia, Jakarta
Zulkifli, M., dan Estiasih, T. 2014. Sabun dari Salisilat Asam Lemak Minyak Sawit: Kajian Pustaka. Jurnal Pangan dan Agroindustri. 2(4):170-177.
Gambar 1. Hasil uji pembuatan garam (CaCl2) Gambar 2. Pembuatan garam (Pb
asetat)
Gambar 3. Hasil uji pembuatan garam MgSO4 Gambar 4. Pembuatan asam minyak