1 BB Biogen , Jl. Tentara Pelajar No. 3 A Bogor Boris@indo.net.id (* Penulis untuk korespondensi)
Induksi Kalus dan Regenerasi Tunas Padi Varietas Fatmawati
Callus Induction and Shoot Regeneration of In Vitro Rice Var. Fatmawati Endang G Lestari1* dan Rosa Yunita1
Diterima 13 November 2007 /Disetujui 12 Maret 2008
ABSTRACT
Efficiency of shoot regeneration from rice callus explant is an important factor, particularly for the purpose of plant genetic improvement such as somaclonal variation, transformation and in vitro selection. In the attempt of gaining shoot regeneration, callus induction and shoot regeneration experiments were conducted in the Biological Cell and Tissue Culture Laboratory, Indonesian Center for Agricultural Biotechnology and Genetic Resources Research and Development. Mature seed was used as an explant. The media formulation for calli induction was MS + 2.4-D (1, 3, 5 and 7 mg/l ) + prolin (0 and 100 mg/l ) and hydrolyzed casein 3000 mg/l. The media for shoot regeneration was (1) MS + BA (1.2 and 3 mg/l ) + IAA 0.8 mg/l + prolin 100 mg/l, and (2) MS + BA 2 mg/l + IAA 0.8 mg/l + zeatin (0.1; 0.2 and 0.3 mg/l). The result showed that the embryogenic calli could be produced from MS + 2.4-D 3 mg/l + hydrolyzed casein 3000 mg/l treatment and the best media for shoot induction was MS + BA 2 mg/l + IAA 0.8 mg/l + zeatin 0.2 mg/l. The obtained plantlets were successfully acclimatized in the greenhouse.
Key words: Embryogenic calli, rice, shoot regeneration
PENDAHULUAN
Produksi kalus yang mempunyai struktur embriogenik dan mampu diregenerasikan merupakan faktor penting dalam kultur jaringan, khususnya dalam transformasi, induksi keragaman somaklonal dan seleksi
in vitro (Meneses et al., 2005; Lutts et al., l999). Kalus padi dari golongan Indica pada umumnya lebih sulit diregenerasikan dibandingkan Japonica sehingga untuk mendapatkan tingkat keberhasilan regenerasi tunas yang tinggi diperlukan formulasi media yang kompleks (Saharan et al., 2004).
Keberhasilan regenerasi tunas dari kalus selain dipengaruhi oleh media kultur dan genotipe tanaman, kondisi fisiologi eksplan juga menjadi faktor penentu. Dari berbagai sumber eksplan yang digunakan, embrio zigotik merupakan eksplan yang terbaik karena memiliki daya totipotensi atau kemampuan regenerasi tertinggi di antara sumber eksplan lainnya (Maggioni et al., l989). Kalus yang baru terbentuk berpeluang menghasilkan tunas lebih tinggi dibandingkan kalus yang telah disubkultur berkali-kali atau mengalami periode kultur yang panjang, dan telah mengalami perlakuan radiasi atau seleksi, karena kalus yang baru terbentuk, kandungan poliamin atau senyawa yang berperan dalam sistem regenerasi masih tinggi (Chiatante et al., 1998; Biswas et al., 2002). Dalam memacu pembentukan tunas biasanya dilakukan dengan memanipulasi dosis auksin dan sitokinin (Poonsapaya
et al., l989).
Pada tanaman jenis monokotil, zat pengatur tumbuh golongan auksin dengan konsentrasi 1-10 mg/l berperan dalam menghambat proses diferensiasi sel sehingga pembentukan organ dapat dihambat dan hanya menghasilkan kalus. Zat pengatur tumbuh 2.4-D merupakan golongan auksin yang sering digunakan untuk menginduksi pembentukan kalus embriogenik pada serealia, 2.4-D berperan dalam memacu hipermethilasi pada DNA, sehingga pembelahan sel selalu dalam fase mitosis, dengan demikian maka pembentukan kalus menjadi optimal (Meneses et al., 2005).
Penambahan kasein hidrolisat kedalam media yang sudah mengandung 2,4-D dapat memacu pembentukan kalus yang embriogenik karena kasein hidrolisat merupakan sumber N di dalam media. Asam amino merupakan senyawa organik kompleks sebagai sumber N organik yang cepat diambil oleh tanaman daripada N anorganik (Gunawan, 1988). Selain kasein hidrolisat, pemberian asam amino glutamin atau arginin pada media yang sudah mengandung auksin dapat pula meningkatkan keberhasilan pembentukan kalus embriogenik karena di dalam kloroplas, asam amino dapat berperan sebagai prekursor untuk pembentukan asam nukleat dan proses selular lainnya (Gunawan, l988).
Regenerasi tanaman dapat dilakukan melalui jalur organogenesis yaitu melalui diferensiasi sel somatik, bukan dari sel embrionik yang terjadi selama embriogenesis dan embriogenesis somatik melalui
pembentukan embrio somatik (Purnamaningsih, 2006; Zhang dan Lemaux, 2004). Regenerasi tanaman melalui jalur organogenesis, ada dua macam yaitu organogenesis langsung dan tidak langsung. Pada organogenesis langsung, tunas dapat terbentuk dari potongan organ seperti daun atau batang dan akar, sedangkan pada organogenesis tidak langsung, tunas yang terbentuk melalui tahapan pembentukan kalus. Proses yang terjadi dalam organogenesis meliputi respon sel somatik terhadap zat pengatur tumbuh, diikuti dengan inisiasi dan perkembangan tunas baru dari sel yang respon (Zhang dan Lemaux, 2004).
Tujuan penelitian adalah mendapatkan formulasi media untuk induksi kalus embriogenik dan regenerasi tunas dari kalus padi varietas Fatmawati.
BAHAN DAN METODE
Penelitian dilakukan di laboratorium Biologi Sel dan Jaringan BB-Biogen dari Agustus 2006 – Mei 2007. Percobaan terdiri dua tahap yaitu (1) pembentukan kalus embriogenik, (2) regenerasi tunas.
Induksi Kalus
Bahan tanaman untuk induksi kalus adalah benih padi yang sudah masak dari varietas Fatmawati. Media yang digunakan untuk induksi kalus adalah media dasar MS + vitamin grup B terdiri atas (piridoksin HCl 0.5 mg/l; asam nikotinat 0.5 mg/l; thiamin 0.1 mg/l, myo inositol 100 mg/l dan glisin 0.2 mg/l). Zat pengatur tumbuh yang ditambahkan adalah 2.4-D (0, 1, 3, 5, dan 7 mg/l) + 3 g/l kasein hidrolisat (CH) + prolin (0 dan 100 mg/l). Media dipadatkan dengan menambahkan agar swallow sebanyak 7.5 g/l. Sebagai sumber energi ditambahkan sukrosa sebanyak 30 g/l. Sterilisasi media menggunakan otoklaf dengan tekanan 121 psi selama 15 menit.
Biji dikupas kulitnya kemudian disterilisasi berturut-turut menggunakan alkohol 70% selama 5 menit, kloroks 30% 10 menit, kloroks 20% selama 12 menit kemudian dibilas menggunakan aquades steril 3 kali dan terakhir direndam selama 5 menit dalam larutan betadin. Embrio zigotik diisolasi di dalam laminar flow dari biji yang sudah disterilisasi selanjutnya ditanam pada media perlakuan untuk induksi kalus. Dalam satu botol ditanam 20 eksplan embrio zigotik dan masing-masing perlakuan terdiri 10 botol. Botol yang telah ditanami eksplan selanjutnya diletakkan di dalam rak kultur dalam keadaan gelap. Peubah yang diamati adalah persentase eksplan berkalus, diameter kalus dan warna kalus.
Regenerasi Tunas
Bahan yang digunakan sebagai eksplan adalah kalus embriogenik, ukuran kalus ± 2-4 mm. Media untuk regenerasi tunas terdiri dari beberapa kombinasi antara sitokinin dan auksin yaitu (1) media dasar MS + BA (1.2 dan 3 mg/l) + IAA 0.8 mg/l + prolin (0 dan 100 mg/l) dan, (2) BA 2 mg/l + IAA 0.8 mg/l + zeatin (0.1; 0.2 dan 0.3 mg/l). Media dibuat padat dengan menambahkan agar swalow sebanyak 7.5 g/l. Botol yang telah ditanami eksplan kemudian diletakkan di dalam rak kultur dengan intensitas penyinaran sebesar 1000 lux dan lama penyinaran 16 jam dalam sehari. Masing-masing perlakuan terdiri dari 10 botol dan masing-masing botol terdiri atas 5 eksplan kalus. Peubah yang diamati yaitu jumlah eksplan meng-hasilkan spot hijau dan jumlah eksplan bertunas.
HASIL DAN PEMBAHASAN
Induksi Kalus Embriogenik
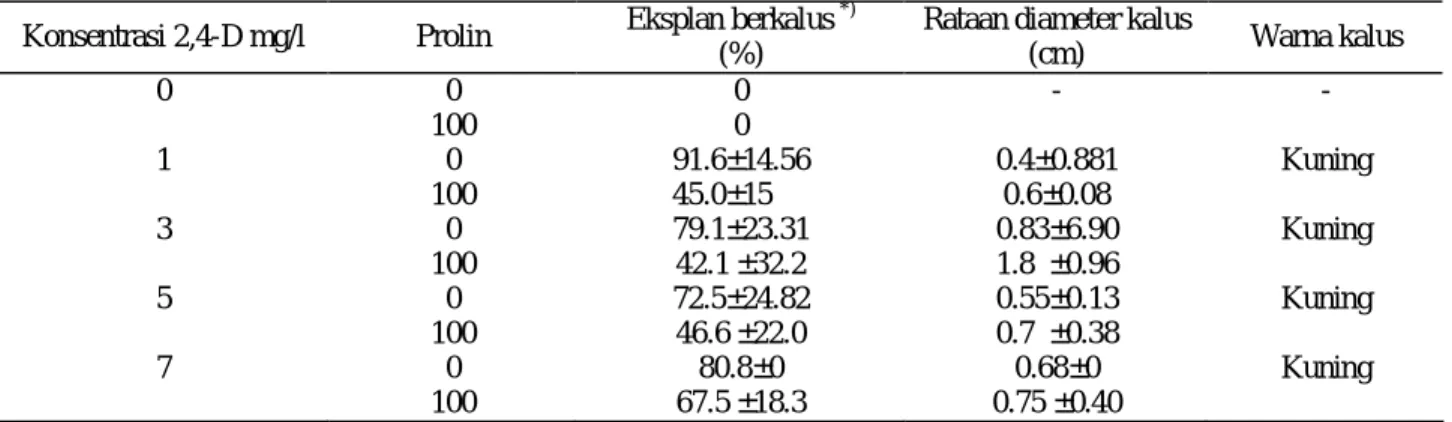
Eksplan embrio zigotik pada umumnya mulai membengkak membentuk kalus pada minggu ke-2 setelah tanam, kalus yang terbentuk berasal dari skutelum yaitu merupakan lapisan sel didalam embrio (He dan Lazzer, 2001). Eksplan yang ditanam pada media tanpa pemberian 2.4-D tidak menghasilkan kalus sedangkan eksplan yang ditanam pada media yang mengandung 2.4-D dapat menghasilkan kalus. Pada media dengan pemberian 2.4-D 3 mg/l kalus yang dihasilkan lebih cepat dengan rataan diameter kalus yang paling besar dibanding perlakuan lainnya yaitu 0.83 cm. Sedangkan penggunaan 2.4-D sampai 7 mg/l menyebabkan diameter kalus menurun (Tabel 1).
Pada induksi kalus padi IR64, Towuti dan Gajahmungkur diperoleh hasil yang sama bahwa media terbaik untuk induksi kalus adalah media dasar MS +2.4-D 3 mg/l + CH 3 g/l (Lestari, 2005). Pada media dengan pemberian 2.4-D 3 mg/l dan CH 3 g/l tersebut kalus yang dihasilkan berwarna putih kekuningan berbentuk bulatan-bulatan dan mudah dipisahkan (remah) sehingga disebut bersifat embriogenik. Menurut Peterson and Smith (l991) kalus yang embriogenik adalah yang berwarna putih kuning, mengkilat dan remah (mudah dipisahkan membentuk fragmen), sedangkan kalus yang non embriogenik pada umumnya berwarna kuning kecoklatan, agak pucat dan lembek berair sehingga sulit dipisahkan.
Penambahan prolin100 mg/l pada media yang sudah mengandung 2.4-D 3 mg/l, menghasilkan kalus dengan diameter lebih besar, selain itu warna kalus lebih kuning dan mudah pecah (remah) (Tabel 1).
Tabel 1. Pengaruh 2.4-D dan prolin pada induksi kalus padi var. Fatmawati pada 6 MST
Konsentrasi 2,4-D mg/l Prolin Eksplan berkalus
*)
(%)
Rataan diameter kalus
(cm) Warna kalus 0 0 100 0 0 - - 1 0 100 91.6±14.56 45.0±1500. 0.4±0.881 0.6±0.08 Kuning 3 0 100 79.1±23.31 42.1 ±32.2 0.83±6.90 1.8 ±0.96 Kuning 5 0 100 72.5±24.82 46.6 ±22.0 0.55±0.13 0.7 ±0.38 Kuning 7 0 100 80.8±0 67.5 ±18.3 0.68±0 0.75 ±0.40 Kuning
*) angka dalam kurung (data/total eksplan) Regenerasi Tunas
Regenerasi tunas diinduksi dari kalus yang baru terbentuk (± 4 MST). Pada minggu ke-4 setelah ditanam pada media untuk regenerasi maka kalus tampak
berubah warna dari kuning menjadi kehijauan dan kemudian membentuk spot atau nodul-nodul berwarna hijau bakal tunas (Tabel 2).
Tabel 2. Regenerasi tunas dari kalus yang berumur 4 minggu, pada media MS + BA + 0.8 mg/l IAA, prolin 100 mg/l Konsentrasi BA
(mg/l) Prolin
Kalus berwarna kuning + spot hijau (%) *)
Kalus berwarna hitam (%) *) Kalus bertunas (%) 1 0 100 43.3 48 56.6 52 0 20 2 0 100 40 43 60 58 5 22 3 0 100 0 23 100 76 0 9
*) angka dalam kurung (data/total eksplan)
Pembentukan spot hijau dan pembentukan tunas pada media dengan penambahan prolin lebih baik dibandingkan dengan media tanpa prolin (Tabel 2). Pada media yang mengandung BAP 2 mg/l, tanpa penambahan prolin 100 mg/l diperoleh hanya 5% kalus bertunas, sedangkan pada media dengan penambahan prolin maka kalus bertunas meningkat menjadi 22% (Tabel 2). Selain itu ketiadaan prolin menyebabkan kalus yang terbentuk cepat berubah menjadi kecoklatan dan akhirnya menjadi hitam seperti yang terjadi pada pemberian BA 3 mg/l, dimana semua kalus menjadi hitam dan mati. Hasil penelitian Lestari dan Mariska (2003) juga menunjukkan bahwa prolin mampu meningkatkan regenerasi tunas pada kalus yang telah diberi perlakuan radiasi. Prolin merupakan asam amino yang banyak digunakan untuk meningkatkan proses embriogenesis, selain prolin senyawa asam amino lainnya adalah asparagin (Purnamaningsih, 2002). Tanda bahwa kalus yang diregenerasikan dapat membentuk tunas antara lain terjadinya perubahan warna dari kecoklatan atau dari kuning menjadi putih kekuningan selanjutnya menjadi kehijauan, perubahan warna tersebut merupakan tanda adanya morphogenesis (George, l993). Perubahan warna ini umumnya terjadi pada minggu ke dua setelah subkultur.
Tidak semua spot hijau yang terbentuk dapat menghasilkan tunas, pada pemberian BA 1 mg/l, maka rata-rata spot berwarna hijau yang dihasilkan sebesar 48% namun kalus yang bertunas hanya 20% (Tabel 2). Spot berwarna hijau pada kalus umumnya menjadi coklat dan mati apabila tidak segera disubkultur pada media baru, atau terjadi dediferensiasi dimana massa sel terus membelah dan tidak terorganisasi. Kemungkinan yang menyebabkan kalus dengan spot hijau tidak beregenerasi adalah terjadi ketidak seimbangan kembali antara zat pengatur tumbuh auksin dan sitokinin yang ada di dalam sel dengan di luar sel (Thorpe, 1994).
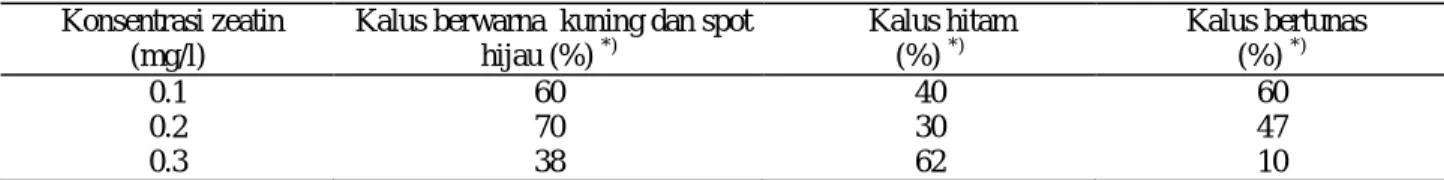
Pada media yang mengandung zeatin, respon kalus lebih baik dibanding perlakuan sebelumnya yaitu tanpa zeatin. Hal ini ditunjukkan dengan presentase kalus yang menghasilkan spot berwarna hijau dan pem-bentukan tunas yang lebih tinggi (Tabel 3). Pemberian zeatin sebesar 0.1 mg/l dapat menginduksi kalus bertunas sebesar 67% hasil tersebut paling tinggi dibandingkan pemberian zeatin 0.2 dan 0.3 mg/l. Pada media dengan pemberian zeatin tersebut tunas yang dihasilkan sudah menghasilkan akar sehingga dapat langsung diaklimatisasi.
Tabel 3. Pembentukan tunas pada media MS + BA 2 mg/l + IAA 0.8 mg/l + setelah 8 minggu. Konsentrasi zeatin
(mg/l)
Kalus berwarna kuning dan spot hijau (%) *) Kalus hitam (%) *) Kalus bertunas (%) *) 0.1 60 40 60 0.2 70 30 47 0.3 38 62 10
*) angka dalam kurung (data/total eksplan)
Dalam proses organogenesis peranan sitokinin sangat menentukan, namun demikian hanya sel-sel yang kompeten saja yang mampu menghasilkan tunas, beberapa hasil penelitian menunjukkan bahwa kombinasi sitokinin dan auksin lebih efektif dalam memacu pembentukan tunas (Gaba, 2004). Kombinasi auksin (IAA 0.1 mg/l) dan sitokinin (BA 3 mg/l) untuk memacu pembentukan tunas dari kalus padi telah dihasilkan juga oleh Edi (2004) pada perlakuan seleksi
in vitro untuk mendapatkan ketenggangan terhadap Al dan pH rendah. Dalam hal ini pemberian zeatin 0.2 mg/l pada media MS yang sudah mengandung BA 3 mg/l dan IAA 0.1 mg/l dapat memacu regenerasi tunas pada varietas Gajahmungkur, Cirata dan Jatiluhur. Formulasi yang sama digunakan Lestari (2005) untuk meregenerasikan kalus varietas padi lain yaitu Towuti dan IR64. Penggunaan auksin (NAA) dan sitokinin (BA) untuk organogenesis tanaman “spinach” juga dilakukan oleh Mitra dan Mukherjee (2001). Namun demikian tidak semua kombinasi sitokinin dan auksin dapat memacu pembentukan tunas, pada tanaman
Alocasia micholitziana adanya auksin (NAA sebesar
50 µm) dalam media yang mengandung BA sebesar 0-50 µm tidak dapat memacu pembentukan tunas, pada tanaman tersebut media terbaik untuk multiplikasi adalah media dasar MS + BA 10 mg/l (Thao et al., 2003).
Kemampuan kalus untuk menghasilkan tunas, selain dipengaruhi adanya zat pengatur tumbuh maka ukuran kalus yang dipindahkan ke media regenerasi juga menjadi faktor penentu. Pada kultur antera kalus yang berukuran 2-3 mm merupakan kalus yang terbaik untuk dipindahkan ke medium regenerasi, sedangkan kalus yang berukuran kurang dari 2 mm akan sulit beregenerasi atau mati (Yoshida, 1995). Demikian pula pada penelitian ini bahwa pada kalus dengan ukuran antara 3-4 mm merupakan eksplan terbaik untuk diregenerasikan, apabila terlalu besar maka umur kalus sudah lebih dari 4 minggu sehingga kemampuan regenerasinya sudah berkurang, namun apabila terlalu kecil maka sel akan mati.
Pada penelitian ini tunas terbentuk secara organogenesis tidak langsung yaitu tanpa melalui tahapan embriogenesis, dari satu sel atau sekumpulan sel terorganisasi menjadi tunas. Plantlet yang dihasilkan berhasil diaklimatisasi di rumah kaca menggunakan larutan Yoshida, persentase keberhasilan mencapai
100% apabila panjang akar mencapai 5 cm dan jumlahnya lebih dari 3 buah.
KESIMPULAN
Pada padi var. Fatmawatiformulasi media terbaik untuk induksi kalus embriogenik adalah media dasar MS + 2.4-D 3 mg/l + kasein hidrolisat 3 g/l. Sedangkan formulasi media terbaik untuk memacu regenerasi tunas adalah BA 2 mg/l + IAA 0.8 mg/l dan zeatin 0.2 mg/l.
DAFTAR PUSTAKA
Biswas, B., Chowdhurry, A. Bhattacharya, B. Mandal. 2002. In vitro screening for increases drought tolerance in rice. In vitro Cell. Dev Biol-Plant. 38: 525-530.
Chiatante, D.L., Maiuro, G.S. Scippa. l998. Tolerance of meristematic root cells to water stress and quantitative variations of proteins at different sub cellular levels. In J.A. Bryant and D. Chiatante (Eds.) Plant Cell Proliferation and its Regulation in Growth and Development. John Wiley and Sons Ltd.
Edi, S. 2004. Peningkatan ketenggangan terhadap alumunium dan pH rendah pada tanaman padi melalui keragaman somaklonal dan iradiasi sinar gamma. (Disertasi). Sekolah Pasca Sarjana, Institut Pertanian Bogor.
Gaba, V.P. 2004. Plant growth regulators in plant tissue culture and development. In Plant Development and Biotechnology. Trigiano, R.N., D.J. Gray (Eds.). CRC Press New York. 358 hal.
George, E. F. 1993. Plant Propagation by Tissue Culture. Part 2 In Practice. Exegeticts Lim. England. 1361 p.
Gunawan, L. 1988. Teknik Kultur Jaringan Tumbuhan. Laboratorium Kultur Jaringan Tumbuhan. PAU Bioteknologi. Institut Pertanian Bogor. 304 hal. He, G.Y., P.A. Lazzer. 2001. Improvement of somatic
embryogenesis and plant regeneration from durum wheat (Triticum turgidum var durum Derf)
scutellum and inflorescence culture. Euphytica. 119 (3)369-376.
Lestari, E.G., I. Mariska. 2003. Pengaruh berbagai formulasi media terhadap regenerasi kalus padi indica. Prosiding Seminar Hasil Penelitian Rintisan dan Bioteknologi Tanaman, 257 hal.
___________. 2005. Seleksi In vitro untuk ketahanan terhadap kekeringan pada tanaman padi. (Disertasi). Sekolah Pasca Sarjana. Institut Pertanian Bogor.
Lutts, S., J.M. Kinet., J. Bouharmont. 1999. Improvement of rice callus regeneration in presence of NaCl. Plant Cell, Tissue and Organ Culture. 57: 3-11.
Maggioni, L., M.C. Lusrdi, E. Lupotto. l989. Effect of culture condition callus induction and plant regeneration from mature and immature embryos of rice varieties (Oryza sativa L.). J. Genet Breed. 43:99-106.
Meneses, A., D. Flores, M. Munoz, G. Arrieta, A.M. Espinosa. 2005. Effect of 2.4-D, Hydric stress and light on indica rice (Oryza sativa) somatic embryogenesis. Rev Biol Trop (Int J) 53(3-4): 361-368.
Mitra, S.K., K.M. Mukherjee. 2001. Direct organogenesis in Indian spinach. Plant Cell Tissue and Organ Culture. 67:191-194.
Peterson, G., R. Smith. l991. Effect of abscicic acid and callus size on regeneration of American and international rice varieties. Plant Cell Rep 10: 35-38.
Purnamaningsih, P. 2002. Regenerasi tanaman melalui embriogenesis somatik dan beberapa gen yang mengendalikannya. Buletin Agrobio 5(2): 51-58. __________. 2006. Induksi kalus dan optimasi
regenerasi empat varietas padi melalui kultur in vitro. J. Agrobiogen. 2 (2): 74-80.
Poonsapaya, P., M.W. Nabors, W. Kersi, M. Vajrabhaya. l989. A comparison of methods for callus culture and plant regeneration of RD 25 rice (Oryza sativa L.) in vitro laboratories. Plant Cell, Tissue and Organ Culture. 16:175-186.
Saharan, V.R., C. Yadav, N.R. Yadav, B.P. Chapagain. 2004. High frequency plant regeneration from desiccated calli of indica rice (Oryza sativa). African J. of Biotech. 3 (5): 256-259.
Thao, N.T.O., Y. Ozaki, H. Okubo. 2003. Callus induction and plantlet regeneration in ornamental
Alocasia micholitziana. Plant Cell, Tissue and Organ Culture.73:285-289.
Thorpe, T.A., R.R. Patel. 1984. Clonal propagation adventitious buds. In I.K Vasil (Ed.) Cell Culture and somatic Cell Genetic of Plants. 1( 49-58). Laboratory Practical and Their Application. Acad Press Inc London.
Yoshida, T. 1995. Relationship between callus size and plant regeneration in rice (Oryza sativa L.) anther culture. JARQ. 29:143-147.
Zhang, S., P.G. Lemaux. 2004. Molecular aspect of in vitro shoot organogenesis. In Plant Development and Biotechnology. Trigiano, R.N., D.J.Gray (Eds.). CRC Press New York. 358 p.