BAB II
TINJAUAN PUSTAKA
2.1 Biologi Spons Laut
Spons adalah hewan yang termasuk Filum Porifera. AmirdanBudiyanto (1996) menjelaskan bahwa filum Porifera terdiri dari tiga kelas, yaitu: Calcarea, Demospongiae, dan Hexactinellida. Kelas Calcarea adalah kelas spons dengan spikula tersusun dari kalsium karbonat dan tidak mengandung spongin. Sebagian besar spons kelas ini bentuknya kecil-kecil, berwarna putih keabu-abuan dan ada beberapa jenis berwarna kuning, merah muda dan hijau. Elemen kerangka dari kelas Calcarea berbentuk spikula ‘triaxon’ dan tidak ada perbedaan antara megasklera dan mikrosklera. Beberapa jenis spons ini yang umum adalah Sycon gelatinosum (berbentuk silinder berwarna coklat muda), Clathrina sp. dan Leucetta sp. Spons dari kelas ini juga sedikit jumlahnya, lebih kurang hanya 10% dari jumlah semua hewan spons yang ada di laut.
Kelas Demospongiae adalah kelompok spons yang paling banyak jumlahnya di antara Porifera lainnya. Hampir 75% jenis spons yang dijumpai di laut adalah dari kelas Demospongiae. Spons dari kelas ini tidak memiliki spikula ‘triaxon’ (spikula kelas Hexactinelidae), tetapi spikulanya berbentuk ‘monoaxon’ dan ‘tetraxon’ yang mengandung silikat. Beberapa jenis spons kelas ini ada yang tidak mengandung spikula tetapi hanya mengandung serat-serat kolagen atau spongin saja. Sedangkan kelas Hexactinellida merupakan spons gelas. Spons kelas Hexactinellida terdiri dari silikat dan tidak mengandung spongin. Kebanyakan spons dari kelas ini belum banyak dikenal, karena sulit mendapatkan dan hanya terdapat di laut dalam yaitu sekitar < 500 m (Amir dan Budiyanto, 1996).
Spons merupakan hewan multiseluler paling primitif yang telah ada selama 700-800 juta tahun. Sebanyak 15.000 jenis spesies spons ditemukan di lautan sedangkan hanya 1 % spons hidup di air tawar (Belarbi et al., 2003). Spons merupakan hewan sesil
dan dikenal dengan istilah ‘filter feeders’ yaitu aktif menghisap dan menyaring air melalui seluruh permukaan tubuhnya. Dinding luarnya (pinakodermis) mengandung pori-pori (ostia). Melalui ostia inilah air dan materi-materi kecil yang terkandung di dalamnya dihisap dan disaring oleh sel-sel berbulu cambuk atau sel kolar (choanocytes), kemudian air tersebut dipompakan keluar melalui lubang tengah (oskulum) (Taylor et al., 2007). Sistem tersebut dinamakan dengan istilah sistem ‘aquiferous’ (Belarbi et al., 2003). Sistem ini terletak di lapisan mesofil spons yaitu diantara lapisan bagian luar dan dalam serta terdiri atas struktur saluran yang saling terhubung (Kennedy et al., 2008).
Spons memiliki fungsi jaringan dan organ yang masih sangat sederhana. Hewan ini hidup menetap pada suatu habitat pasir, batu-batuan dan pada karang-karang mati di dalam laut. Spons dapat hidup dengan baik pada arus air yang kuat, karena aliran air tersebut menyediakan kumpulan nutrisi dan oksigen. Nutrisi spons terdiri dari detritus organik seperti bakteri, zooplankton dan phytoplankton yang kecil-kecil yang secara efektif ditangkap oleh sel-sel bulu cambuk (Amir dan Budianto, 1996).
Interaksi antara spons dengan mikroorganisme dapat terjadi dalam beberapa bentuk. Ada mikroorganisme yang berperan sebagai sumber makanan bagi spons, patogen/parasit, dan ada yang membentuk simbiosis mutualisme. Sekitar 40% dari spons mengandung mikroorganisme yang bersimbiosis dengan spons. Organisme sesil seperti spons sangat mengandalkan produksi bahan kimia dari tubuhnya untuk melindungi diri dari gangguan predator ataupun kompetitor (Taylor et al., 2007)
Keberlangsungan spons laut sangat dipengaruhi oleh faktor fisik, kimiawi, dan biologis lingkungannya. Amir dan Budiyanto (1996) melaporkan spesimen yang berada di lingkungan yang terbuka dan berombak besar cenderung pendek pertumbuhannya atau juga merambat. Sebaliknya spesimen dari jenis yang sama pada lingkungan yang terlindung atau pada perairan yang lebih dalam dan berarus tenang, pertumbuhannya cenderung tegak dan tinggi. Pada perairan yang lebih dalam spons cenderung memiliki tubuh yang lebih simetris dan lebih besar sebagai akibat dari lingkungan yang lebih stabil apabila dibandingkan dengan jenis yang sama yang hidup pada perairan yang dangkal.
Diameter oskula spons juga dipengaruhi oleh suhu, ombak, kekeruhan, sedimen, tekanan dan kecepatan arus air. Spons yang berada di lingkungan yang keruh dan berarus keras, oskulanya cenderung berada di puncak permukaan tubuh atau kadangkala menyerupai cerobong. Predator dan kompetitor juga dapat mempengaruhi morfologi dari spons. Beberapa jenis dari Opisthobranchia, Prosobranchia dan Echinodermata dikenal memangsa spons. Sehingga secara evolusi, spons akan beradaptasi untuk menghindar dari predator-predator tersebut, misalnya berubah menjadi spons pengebor. Spons juga berkompetisi dengan alga dan karang dalam hal mendapatkan cahaya. Pada lingkungan yang agak gelap (mungkin terhalang atau di perairan yang agak dalam), spons berhasil mendapatkan cahaya, misalnya secara evolusi spons berhasil tumbuh di antara sel-sel alga dan karang dengan bentuk tubuh bercabang ( Amir dan Budiyanto, 1996).
Spons juga sangat sensitif terhadap perubahan lingkungan sekitarnya. Suatu lingkungan yang sangat asam akan membuat spons mengalami dehidrasi. Spons juga sangat sensitif pada perubahan temperatur (Belarbi et al., 2003).
2.2 Spons dan Bakteri Yang Bersimbiosis
Sebagian besar mikroba ditemukan pada mesohil spons (Bruck et al., 2008). Bakteri dapat juga bertahan dalam matriks ekstraseluler dan di sisi dalam archaeocyte. Beberapa penelitian yang telah dilakukan membuktikan bahwa ada beberapa jenis mikroorganisme yang bersimbiosis dengan spons. Abdullah (2006) menyatakan bahwa terdapat bakteri, mikrofungi dan ragi pada sponges Axinella sp. yaitu bakteri Alteromonas, Bacillus, Halomonas dan mikrofungi Aspergilus. Belarbi et al., (2003) juga menjelaskan bahwa spons bersimbiosis dengan jenis mikroorganisme seperti archaea, bakteri, sianobakteri, dan mikroalga.
Analisis yang dilakukan untuk mengetahui keragaman bakteri yang bersimbiosis dengan spons dapat dilakukan melalui analisis filogenetik dan Restriction Fragment
Length Polymorphisms. Berdasarkan hasil analisis, diperoleh adanya keragaman bakteri yang berasosiasi dengan spons Craniella austrialiensis yaitu diperoleh bakteri jenis alpha, beta dan gamma-Proteobakteri, Firmicutes, Bacteroidetes dan Actinobacterium (Li and Liu, 2006). Melalui analisis molekuler, terdapat juga bakteri jenis Acidobacteria, γ-proteobakteri dan δ-proteobakteri dari spons Chondrilla nucula di dua daerah Mediterania yaitu laut Ligurian dan laut Adriatik (Thiel et al., 2007).
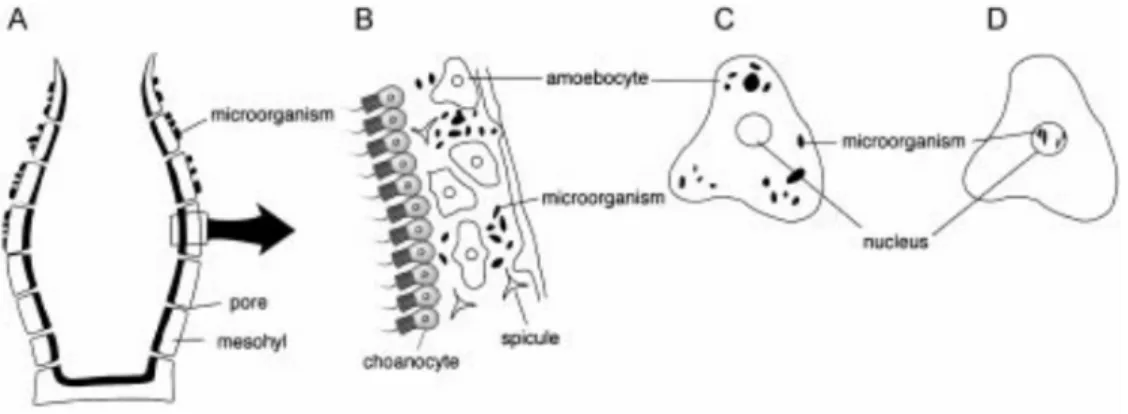
Bakteri yang bersimbiosis dengan spons dapat terletak di bagian ekstraseluler dan intraseluler. Pada bagian ekstraseluler terdiri atas 2 bagian yaitu ekstraseluler eksosimbiosis dan ekstraseluler endosimbiosis (Lee et al., 2001).
Gambar 2.1 Skema hubungan simbiosis antara spons dengan mikroorganisme, (a) ekstraseluler eksosimbiosis; (b) ekstraseluler endosimbiosis; (c) simbiosis intraseluler; (d) simbiosis intranukleus. (Lee et al., 2001)
Tabel 2.1 Spons dengan bakteri simbionnya.
No Spons Bakteri Simbion
2 Antartic sponge Pseudomonas aeruginosa (B) 3 Aplysina sp. Arthrobacter sp. (B) 4 Aplysina sp. Bacillus sp. (B) 5 Aplysina sp. Micrococcus sp. (B) 6 Aplysina sp. Pseudoalteromonas sp. (B) 7 Aplysina sp. Vibrio sp. (B)
8 Cenarchaeum symbiosum Archeon
9 Dysidea herbaceae Cyanobacterium
10 Dysidea herbaceae Oscillatoria spongeliae (C)
11 Dysidea sp. Vibro sp. (B)
12 Halochondria okadai Alteromonas sp. (B)
13 Halochondria panacea Antarcticum vesiculatum(B) 14 Halochondria panacea Pseudomonas insolita(B) 15 Halochondria panacea Rhodobacter sp. (B)
16 Halochondria panacea Psychroserpens burtonensis(B)
17 Homophymia sp. Pseudomonas sp. (B)
18 Hyatella sp. Vibrio sp. (B)
19 Rhopaloeides odorabile β-Proteobacteria(B) 20 Rhopaloeides odorabile γ-Proteobacteria(B) 21 Rhopaloeides odorabile Cytophaga sp. (B) 22 Rhopaloeides odorabile Green sulfur bacteria
23 Sigmadocia symbiotica Ceratodictyon spongiosum (R)
24 Suberea creba Pseudomonas sp. (B)
25 Tedania ignis Micrococcus sp. (B) 26 Theonella swinhoei δ-Proteobacteria(B)
27 Theonella swinhoei Aphanocapsa feldmanni (C) 28 Theonella swinhoei Filamentous bacteria 29 Theonella swinhoei Unicelluler bacteria
30 Verongia sp. Aeromonas sp. (B)
31 Verongia sp. Pseudomonas sp. (B)
32 Xestospongia sp. Micrococcus luteus(B) A, Actinomycetes; B, Bacteria; C, Cyanobacteria; D, Dinoflagellate.
Mikroorganime yang bersimbiosis dengan spons merupakan sumber makanan spons dan mikroorganisme memakai tubuh spons yang berpori-pori sebagai inangnya untuk tempat hidup dan perlindungan (Lee et al., 2001).
2.3 Aktivitas Senyawa Bioaktif Bakteri yang Bersimbiosis dengan Spons
Spons adalah salah satu biota laut yang menghasilkan senyawa bioaktif. Senyawa bioaktif yang dihasilkan oleh spons laut telah banyak diketahui manfaatnya. Spons juga merupakan sumber berbagai macam produk alami seperti senyawa sitotoksin, agen antifouling, antibiotik, antiinflamasi dan antivirus. Mikroorganisme yang bersimbiosis dengan spons dapat menjadi sumber berbagai produk alami (Lee et al., 2001).
Spons memiliki potensi sebagai sumber metabolit tertentu. Sumber metabolit tersebut merupakan senyawa bioaktif yang memiliki banyak fungsi. Salah satunya adalah sebagai penghasil senyawa antikanker dan sitotoksin (Belarbi et al, 2003). Spons Discodermia dissoluta (Theonellidae) juga memiliki metabolit sekunder yang berpotensi sebagai antikanker (Bruck et al., 2008).
Flemer et al., (2011) juga menemukan 237 bakteri yang diisolasi dari spons Suberites carnosus (Demospongiae) dan Leucosolenia sp. (Calcarea). Sebanyak 50% isolat dari spons S. carnosus memiliki fungsi sebagai antibakteri dan 15% isolat dari Leucosolenia sp. berfungsi sebagai antijamur. Aktivitas antibakteri paling banyak ditemukan pada genus bakteri Pseudovibrio dan Spongiobacter. Sedangkan aktivitas antijamur ditemukan pada jenis Pseudoalteromonas, Bacillus dan Vibrio.
Organisme bentik laut seperti spons, juga seringkali hidup berasosiasi dengan bakteri yang menghasilkan senyawa antimikroba. Nocardiopsis dassonvillei MAD08 yang ditemukan dari spons Dendrilla nigra menunjukkan 100% aktivitas sebagai antimikroba terhadap bakteri patogen multidrug resistant (Selvin et al., 2009). Sebanyak 32 (45,71%) dan 20 (29,41%) isolat yang berasal dari bagian mesohil dan permukaan Jaspis sp. menunjukkan kemampuan antimikroba, karena mampu menghambat pertumbuhan Staphylococcus aureus, Vibrio harveyii, Escherichia coli, Pseudomonas aerogenosa, EPEC K-11, Candida albicans, dan Candida tropicalis (Abubakar et al., 2011).
Potensi antibiotik telah banyak ditemukan dari sumber daya laut khususnya spons. Ekstrak isolat bakteri Aplysina sp. dan Sarcophyton sp. berpotensi sebagai antibakteri terhadap bakteri E. coli dan S. aureus (Tinambunan et al., 2012). Ginting et al. (2010) menemukan bahwa adanya aktivitas antibakteri isolat bakteri yang diisolasi dari spons Acanthostrongylophora sp. Terhadap bakteri patogen Vibrio cholerae, Staphylococcus aureus, dan Bacillus substilis. Selain itu, terdapat 62 (85%) dari 73 isolat bakteri Pseudovibrio spp yang berasal dari spons Polymastia boletiformis, Axinella dissimilis dan Haliclona simulans memiliki aktivitas sebagai antibakteri terhadap bakteri patogen Escherichia coli, Salmonella enterica serotype Thyphimurium, Staplylococcus aureus yang resisten terhadap meticilin dan Clostridium difficile (Halloran et al., 2011).
Pada spons Gelliodes carnosa juga ditemukan berbagai macam bakteri dan sebagian besar berpotensi sebagai antibakteri terhadap Bacillus substilis (Lie et al., 2011). Demikian pula dengan penelitian yang dilakukan oleh Radjasa et al. (2008) menunjukkan bakteri Arthrobacter sp. yang bersimbiosis dengan spons Haliclona sp. di laut Jawa Utara menunjukkan aktivitas antibakteri terhadap bakteri Escherichia coli dan Proteus sp.
Penelitian yang dilakukan oleh Nofiani et al. (2012) juga menemukan adanya aktivitas antibakteri dari ekstrak metanol bakteri yang berasosiasi dengan spons dari Pulau Lemukutan Kalimantan Barat terhadap bakteri Staphylococcus aureus, Salmonella sp. dan Bacillus substilis. Aktivitas antibakteri dari mikroorganisme yang bersimbiosis dengan spons ditunjukkan juga dengan skrining antibakteri beberapa ekstrak bakteri yang diisolasi dari spons Theonella sp., Aaptos sp., Melophlus sarassinorum, Callyspongia sp., Ircinia sp., Stylissa flabeliformes, Lisoclinum sp. dan Clathria sp. asal Barang Lompo Makassar. Hasil yang diperoleh menunjukkan bahwa dari 75 isolat, terdapat 60 isolat bakteri yang berpotensi mengandung substansi aktif antibakteri terhadap bakteri patogen Staphylococcus aureus, Bacillus subtilis dan Vibrio eltor. Persentase jumlah koloni tertinggi (100%) bakteri penghambat terhadap bakteri patogen diperoleh dari spons Aaptos sp., Melophlus sarassinorum dan Callyspongia sp., selanjutnya sebesar 90% dari spons Clathria sp. (Murniasih dan Rasyid, 2010).
Dash et al. (2009) telah berhasil mengisolasi lima bakteri yang berasosiasi dengan spons yang memiliki potensi sebagai antibakteri. Kelima isolat diekstraksi menggunakan pelarut dengan polaritas yang berbeda (n-Heksana dan etil asetat). Selain sebagai antibakteri, ekstrak bakteri yang berasosiasi dengan spons juga memiliki fungsi sebagai anti larva (Dash et al., 2009). Aktivitas antiplasmodial juga ditemukan dari ekstrak etil asetat bakteri yang berasosiasi dengan spons Clathria vulpina (Inbaneson dan Ravikumar, 2012).
Salah satu metabolit sekunder yang memiliki kemampuan sebagai antimikroba adalah tropodithietic acid (TDA). TDA dihasilkan oleh bakteri Pseudovibrio sp. D323 Selain TDA, bakteri ini juga menghasilkan fenol namun tidak menimbulkan aktivitas antibakteri secara langsung. Adanya TDA yang dihasilkan oleh bakteri simbion Pseudovibrio sp. D323 menyebabkan spons yang ditumpanginya terhindar dari koloni bakteri patogen (Penesyan et al., 2011).
Tabel 2.2 Spons dengan senyawa bioaktif yang dihasilkan serta keterangan bioaktivitasnya
No
Spons
Senyawa bioaktif
Bioaktifitas
1
Acanthella sp.
Kalihinol-A
Antibiotik
2
Agelas dispar
Aminozooanemonin Antibakteri
3
Agelas dispar
Pyridinebetaine A
Antibakteri
4
Agelas mauritiana
Sceptrin
Antimikroba
5
Agelas nakamurai
Ageliferine
Antibakteri
6
Agelas nakamurai
Debromosceptrin
Antibakteri
7
Agelas nakamurai
Nakamuric acid
Antibakteri
8
Agelas sp.
Agelasine F
Antituberkulosis
9
Agelas sp.
Agelasine I
Antimikroba
10
Corticium sp.
Meridine
Antijamur
11
Cymbastela sp.
Agelastatin C, D
Insektisida
12
Discodermia kiiensis
Discodermin A
Antimikroba
13
Discodermia sp.
Discobahamins
Antijamur
14
Dysidea sp.
Furodysinin
Antiparasit
15
Fascaplysinopsis reticulate
β- Carbolium salt
Antiparasit
16
Hamacantha sp.
Hamacanthin
Antijamur
17
Hyrtios erecta
Heteronemin
Antiparasit
18
Lanthella basta
Bastadin
Antimikroba
19
Jaspis sp.
Bengamides
Antitumor
20
Jaspis sp.
Bengazoles
Antiparasit
22
Jaspis sp.
Psammaplin
Antibakteri
23
Jaspis wondoensis
Wondosterols
Antimikroba
24
Leucetta cf. chagosensis
Isonaamiine D
Antijamur
25
Notodoris citrina-Leucetta Naamidines
naamines
Antiparasit
26
Pachastrissa sp.
Bengamides
Antijamur
27
Pachastrissa sp.
Bengazoles
Antijamur
28
Poecillastra wondoensis
Wondosterols
Antimikroba
29
Psammaplysilla crassa
Purealin
Antiparasit
30
Psammaplysilla purpurea
Aeroplysinin I
Antiparasit
31
Psammaplysilla purpurea
Bastadin
Antimikroba
32
Suberea creba
Aeroplysinin I
Antibakteri
33
Suberea creba
Dibromoverongiaqui
nol
Antibakteri
(Lee et al., 2001).
2.4
Antimikroba
Senyawa antimikroba merupakan senyawa alami maupun kimia sintetik
yang dapat membunuh atau menghambat pertumbuhan mikroorganisme. Senyawa
yang dapat membunuh organisme (bakteri) disebut bakterisidal. Bahan kimia yang
tidak membunuh namun dapat menghambat pertumbuhan organisme (bakteri)
disebut bakteriostatik (Madigan et al., 2009).
Antimikroba dapat diklasifikasikan menjadi bakteriostatik, bakteriosidal, dan bakteriolisis. Bakteriostatik secara berkala sebagai penghambat sintesis protein dan berfungsi sebagai pengikat ribosom. Bakteriosidal mengikat kuat pada sel target dan tidak hilang melalui pengenceran yang tetap akan membunuh sel. Sel yang mati tidak hancur dan tetap memiliki jumlah sel yang konstan. Beberapa bakteriosidal merupakan bakteriolisis, yakni membunuh sel dengan terjadi lisis pada sel dan mengeluarkan komponen sitoplasmanya. Lisis dapat menurunkan jumlah sel dan juga kepadatan kultur. Senyawa bakteriolitik termasuk dalam senyawa antibiotik yang menghambat sintesis dinding sel, seperti penicillin, dan senyawa kimia seperti detergen yang dapat menghancurkan membran sitoplasma (Madigan et al. 2009). Menurut Pelczar dan Chan (2008), secara umum cara kerja zat antimikroba yaitu:
1) Menyebabkan kerusakan dinding sel
Struktur dinding sel dapat rusak dengan cara menghambat pembentukannya atau mengubahnya setelah selesai terbentuk.
2) Terjadinya perubahan permeabilitas sel
Membran sitoplasma mempertahankan bahan-bahan tertentu di dalam sel serta mengatur aliran keluar masuknya bahan-bahan lain. Membran memelihara integritas komponen komponen selular. Kerusakan pada membran ini akan mengakibatkan terhambatnya pertumbuhan sel atau matinya sel.
3) Mengakibatkan perubahan molekul protein dan asam nukleat
Hidupnya suatu sel bergantung pada terpeliharanya molekul-molekul protein dan asam nukleat dalam keadaan alamiahnya. Suatu kondisi atau substansi yang mengubah keadaan ini, yaitu mendenaturasikan protein dan asam-asam nukleat dapat merusak sel tanpa dapat diperbaiki kembali. Suhu tinggi dan konsentrasi pekat beberapa zat kimia mengakibatkan kaogulasi (denaturasi) ireversibel (tidak dapat balik) komponen-komponen selular yang vital ini.
4) Melakukan penghambatan terhadap kerja enzim
Setiap enzim dari beratus-ratus enzim berbeda-beda yang ada di dalam sel merupakan sasaran potensial bagi bekerjanya suatu penghambat. Banyak zat kimia telah diketahui dapat mengganggu reaksi biokimiawi. Penghambatan ini dapat mengakibatkan terganggunya metabolisme atau matinya sel.
DNA, RNA dan protein memegang peranan penting di dalam proses kehidupan normal sel. Hal itu berarti bahwa gangguan apapun yang terjadi pada pembentukan atau pada fungsi zat-zat tersebut dapat mengakibatkan kerusakan total pada sel.
Respon tiap mikroorganisme terhadap antimikroba berbeda-beda. Bakteri
memiliki tingkat sensitivitas yang berbeda dimana umumnya bakteri Gram-positif
lebih rentan dibandingkan dengan bakteri Gram-negatif yang secara alami lebih
resisten. Target penting antibiotik terhadap bakteri yaitu ribosom, dinding sel,
membran sitoplasma, enzim biosintesis lemak, serta replikasi, dan transkripsi
DNA (Madigan et al., 2009). Kriteria kekuatan antibakteri menurut David dan
Stout (1971) adalah sebagai berikut.
1. Diameter zona hambat 10 – 20mm
: Daya hambat kuat
2. Diameter zona hambat 5 - 10 mm
: Daya hambat sedang
3. Diameter zona hambat 0 - 5 mm
: Daya hambat lemah
Berdasarkan hasil penelitian yang telah dilakukan oleh Tinambunan et al., (2012) dihasilkan bahwa ekstrak isolat A23 yang berasosiasi dengan spons memiliki aktifitas antibakteri pada konsentrasi 10% dengan daya hambat yang kuat terhadap S. aureus dan E. coli dengan zona hambat 18 mm dan 17 mm. Konsentrasi hambat minimum dari ekstrak isolat A23 yang masih menunjukkan aktifitas antibakteri terdapat pada konsentrasi 0,05% dengan daya hambat terhadap S. aureus 9 mm dan E. coli 11,33 mm. Suatu senyawa antibakteri dikatakan mempunyai aktifitas yang tinggi terhadap mikroba apabila nilai konsentrasi hambat minimumnya rendah tetapi mempunyai daya hambat yang besar. Suatu bahan dikatakan mempunyai aktifitas antibakteri apabila diameter hambat yang terbentuk lebih besar atau sama dengan 6 mm.
2.5 Isolasi Komponen Aktif Antibakteri
Komponen aktif antibakteri dapat diisolasi melalui proses ekstraksi. Berk
(2009) menyatakan bahwa ekstraksi adalah suatu proses pemisahan komponen
yang diinginkan dari suatu bahan. Isolasi komponen aktif dari suatu bahan dapat
dibedakan menjadi dua kelas berdasarkan proses pemisahan komponen aktifnya,
yaitu :
1. Ekstraksi padatan-cairan (Solid-liquid extraction) yaitu proses ekstraksi yang
memisahkan komponen dari suatu bahan pada fase padat menggunakan
bantuan pelarut. Contoh : ekstraksi garam dari bebatuan menggunakan air
sebagai pelarut, ekstraksi larutan kopi dari gilingan biji kopi dalam produksi
ekstrak biji kopi, ekstraksi minyak dari biji-bijian yang mengandung minyak,
ekstraksi protein dari dari kedelai dalam produksi protein kedelai (isolated
soybean protein), dan sebagainya.
2. Ekstraksi cairan-cairan (Liquid-liquid extraction) yaitu proses ekstraksi yang
memisahkan komponen dari suatu campuran larutan tertentu menggunakan
pelarut yang berbeda. Contoh : pemisahan penicillin dari larutan fermentasi
pada butanol, ekstraksi terpenoid teroksigenasi dari minyak esensial jeruk
menggunakan etanol sebagai pelarut, dan lain sebagainya.
Isolasi komponen antibakteri dari spons pada penelitian ini dilakukan menggunakan metode ektraksi padatan-cairan (Solid-liquid extraction). Berk (2009) menyatakan bahwa ekstraksi padatan-cairan ini dapat dilakukan dengan cara bertingkat yakni menggunakan berbagai pelarut dengan tingkat kepolaran yang berbeda, baik secara berkelanjutan (kontinu) maupun semi-kontinu. Ekstraksi bertingkat atau ekstraksi bertahap merupakan ekstraksi yang dilakukan beberapa kali dengan jenis pelarut berbeda. Ekstraksi ini menggunakan pelarut yang lebih sedikit dan hasilnya akan lebih efektif dibandingkan ekstraksi satu kali dengan semua pelarut sekaligus (Nur dan Adijuwana 1987). Proses ekstraksi bertingkat yang diawali dengan pelarut non polar (n-heksana) terlebih dahulu untuk menghilangkan lemak yang terdapat pada sampel, dilanjutkan dengan pelarut semipolar (etil asetat) untuk mendapatkan fenolat dan terakhir polar (metanol).