SKRIPSI
PEMURNIAN DAN KARAKTERISASI ENZIM KERATINASE DARI Bacillus sp. BE-1
Oleh :
Bernand Setia Agustinus F24060386
2010
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
SKRIPSI
PEMURNIAN DAN KARAKTERISASI ENZIM KERATINASE DARI Bacillus sp. BE-1
Oleh :
BERNAND SETIA AGUSTINUS F24060386
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
2010
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Pemurnian dan Karakterisasi Enzim Keratinase dari Bacillus sp. BE-1
Nama : Bernand Setia Agustinus NIM : F24060386
Menyetujui :
Dosen Pembimbing 1, Dosen Pembimbing 2,
(Dr. Ir. Adil Basuki Ahza, MS) (Prof. Dr. Ir. Maggy T. Suhartono) NIP : 19521021.197903.1.1001 NIP : 19530507.197701.2.001
Mengetahui : Ketua Departemen,
(Dr. Ir. Dahrul Syah, MSc.) NIP : 19650814.199002.1.001
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 17 Agustus 1988, sebagai anak pertama dari dua bersaudara dari pasangan Sabar Simanjuntak dan Melva Sianturi. Penulis memiliki seorang adik perempuan bernama Lasmaya Simanjuntak. Pendidikan penulis dimulai dari tahun 1994 - 2000 di SD Negeri Pekayon 10 Jakarta, kemudian melanjutkan pendidikan di SLTP Negeri 184 Jakarta hingga tahun 2003. Tahun 2006 penulis berhasil menyelesaikan pendidikannya di SMA Negeri 98 Jakarta. Penulis diterima sebagai mahasiswa Institut Pertanian Bogor (IPB) pada tahun 2006 melalui jalur Undangan Seleksi Masuk IPB (USMI). Setelah melalui masa Tingkat Persiapan Bersama (TPB) selama satu tahun, penulis berhasil diterima sebagai mahasiswa di Departemen Ilmu dan Teknologi Pangan (ITP), Fakultas Teknologi Pertanian IPB. Penulis mengambil program studi mayor teknologi pangan dan minor manajemen fungsional.
Selama mengikuti perkuliahan, penulis pernah menjadi salah satu Kepala Divisi di Food Processing Club (FPC) HIMITEPA periode 2008 - 2009. Selain itu, penulis juga menjadi pengajar di SMP Ciampea pada tahun 2007-2009. Tahun 2008-2009 penulis menjadi salah satu tim produksi mie jagung Mie Nusantara produksi SEAFAST IPB. Penulis juga pernah menjadi asisten praktikum mata kuliah Praktikum Teknik Pangan. Pelatihan dan workshop yang pernah diikuti penulis adalah pelatihan tenaga pengajar se-Kota Bogor, pelatihan produksi mie jagung, workshop Sorghum sebagai Pangan Nasional.
BERNAND SETIA AGUSTINUS. F24060386. Pemurnian dan Karakterisasi Enzim Keratinase dari Bacillus sp. BE-1. Di bawah bimbingan Dr. Ir. Adil Basuki Ahza, MS dan Prof. Dr. Maggy T. Suhartono
RINGKASAN
Keratin adalah protein fibrous tak larut yang merupakan komponen utama pada kulit, rambut, bulu dan kuku. Keratin memiliki stabilitas tinggi dan ketahanan yang ekstrim terhadap degradasi oleh enzim proteolitik seperti pepsin, tripsin dan papain. Keratinase merupakan enzim yang dapat mendegradasi keratin menjadi komponen-komponen yang lebih sederhana. Sumber enzim keratinase yang digunakan dalam penelitian ini adalah Bacillus sp. BE-1. Penelitian ini bertujuan untuk mempelajari pemurnian keratinase dari isolat Bacillus sp. BE-1 melalui kromatografi interaksi hidrofobik dan kromatografi filtrasi gel serta menganalisa beberapa karakteristik dari enzim keratinase yang dihasilkan.
Isolat Bacillus sp. BE-1 yang memperlihatkan zona bening diinokulasikan pada media Luria Bertani Broth untuk memperoleh kultur starter. Produksi enzim dilakukan dengan menginokulasikan kultur starter ke dalam media produksi dan diinkubasi pada suhu 370C selama 2 hari dengan kecepatan 100 rpm. Supernatan bebas sel dari keratinase (ekstrak enzim kasar) diperoleh dengan sentrifugasi dingin selama 10 menit pada kecepatan 10000 rpm. Selanjutnya protein dalam supernatan bebas sel diendapkan dengan penambahan 50% (b/v) ammonium sulfat.
Kromatografi interaksi hidrofobik dilakukan dengan mengalirkan ekstrak enzim yang telah didialisis ke dalam kolom kromatografi yang berisi matriks gel
Butyl Sepharose FF yang telah disetimbangkan dengan 30% amonium sulfat
dalam 50 mM buffer Tris-Cl pH 8,0. Elusi terhadap sampel enzim secara berurutan menggunakan 30, 15, dan 0% amonium sulfat dalam buffer yang sama. Seluruh fraksi yang diperoleh kemudian diuji aktivitasnya. Fraksi dengan aktivitas keratinase tertinggi diaplikasikan ke dalam kolom kromatografi filtrasi gel yang berisi matriks Sephacryl S-200H dan telah disetimbangkan dengan 50 mM bufer
Tris-Cl pH 8,0. Elusi sampel menggunakan bufer yang sama. Seluruh fraksi diuji aktivitasnya untuk memperoleh fraksi-fraksi dengan aktivitas keratinase tertinggi. Fraksi enzim dengan aktivitas tertinggi digunakan untuk mengetahui karakteristik enzim terhadap penambahan beberapa senyawa kimia dan untuk menentukan dugaan berat molekul enzim keratinase yang dihasilkan menggunakan metode zymografi.
Hasil penelitian menunjukkan bahwa ekstrak enzim kasar yang dihasilkan memiliki aktivitas 0,0698 U/mg. Setelah diendapkan dengan ammonium sulfat, aktivitas enzim meningkat menjadi 0,63 U/mg. Proses dialisis enzim meningkatkan aktivitas enzim menjadi 0,74 U/mg. Proses pemurnian dengan kromatografi interaksi hidrofobik meningkatkan aktivitas enzim menjadi 4,7 U/mg. Pemurnian selanjutnya dengan kromatografi filtrasi gel menghasilkan fraksi enzim dengan aktivitas tertinggi sebesar 35,9 U/mg. Tingkat kemurnian enzim yang dihasilkan berturut-turut dari proses presipitasi, dialisis, kromatografi interaksi hidrofobik, dan kromatografi filtrasi gel adalah 9, 11, 67, dan 515 kali.
Hasil karakterisasi menunjukkan bahwa enzim keratinase yang dihasilkan dihambat secara total oleh EDTA. Penambahan Mn2+ dapat secara signifikan meningkatkan aktivitas enzim keratinase tersebut sebesar 41 kali dan Mg2+ sedikit meningkatkan aktivitas enzim tersebut sebesar 3 kali. Hal-hal tersebut menunjukkan bahwa enzim ini termasuk protease logam. Penambahan senyawa pereduksi seperti DTT, SDS, dan BMT dapat meningkatkan aktivitas enzim pada konsentrasi senyawa pereduksi yang bervariasi. Konsentrasi 1 mM DTT meningkatkan aktivitas enzim sebesar 2,4 kali. Konsentrasi 2 mM BMT dapat meningkatkan aktivitas enzim sebesar 16,8 kali. Konsentrasi 1 mM SDS meningkatkan aktivitas enzim sebesar 2,7 kali.
Hasil zymogram menunjukkan bahwa enzim keratinase yang dimurnikan terdiri dari 2 molekul protein dengan berat molekul >97 kDa dan 82 kDa. Penambahan Mn2+ maupun Mg2+ pada enzim murni tersebut tetap menunjukkan berat molekul yang sama. Sementara penambahan EDTA (2 mM) maupun PMSF (3 mM) mengakibatkan tidak munculnya pita protein pada gel zymogram. Hal ini memperjelas adanya pengaktifan enzim oleh kation seperti Mn2+ dan Mg2+ serta penghambatan enzim oleh EDTA (2 mM) dan PMSF (3mM).
PURIFICATION AND CHARACTERIZATION OF
KERATINASE ENZYME FROM Bacillus sp. BE-1
Bernand S. Agustinus1, Adil B. Ahza2, dan Maggy T. Suhartono2
1, 2 Department of Food Science and Technology, Faculty of Agricultural Engineering, Bogor Agricultural University, Dramaga-Bogor 16002, Indonesia.
Abstract
The keratinase studied in this research is an extracellular protease produced by Bacillus sp. BE-1. Feather meal substrates were prepared from native chicken feather, treated by sodium hydroxide at temperature of 1000C for 15 minutes to render crude keratinase extract. The crude keratinase was then purified by 2 steps of coloumn chromatography which are Hydrophobic Interaction Chromatography (HIC) and Gel Filtration Chromatography (GFC). Butyl Sepharose (HIC) increased keratinase activity to 67-fold. Further purification using Sephacryl S200-HR (GFC) increased keratinase activity up to the range of 116-515 fold. The highest specific activity of the keratinase was 35,9 U/mg with feather meal as substrate. This keratinase can be completely inhibited by ethylene diamine tetra acetic acid (EDTA). Additon of Mn2+ increased this keratinase activity significantly (about 51-fold) while Mg2+ increased the activity slightly (about 3-fold). Zymogram analysis resulted in that the purified keratinase consisted of two proteases with molecular weight 82 kDa and >97 kDa.
i KATA PENGANTAR
Segala pujian dan rasa syukur tertinggi penulis persembahkan kepada Tuhan Yesus Kristus yang telah menolong penulis untuk dapat menyelesaikan skripsi ini.
Skripsi disusun berdasarkan penelitian yang dilaksanakn di Laboratorium Mikrobiologi dan Biokimia PAU dengan judul Pemurnian dan Karakterisasi Enzim Keratinase dari Bacillus sp. BE-1 yang telah dilaksanakan dari bulan November 2009 hingga April 2010 di Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, IPB.
Pada kesempatan ini, penulis ingin menyampaikan rasa terima kasih yang tak terhingga kepada:
1. Dr. Ir. Adil Basuki Ahza, MS, sebagai dosen pembimbing akademik yang telah banyak membari bimbingan dan dukungan selama penulis menjalani pendidikan dan selama penulis melakukan tugas akhir sampai penulisan skripsi ini.
2. Prof. Dr. Ir. Maggy T Suhartono, sebagai dosen pembimbing akademik yang telah banyak membari bimbingan dan dukungan selama penulis menjalani pendidikan dan selama penulis melakukan tugas akhir sampai penulisan skripsi ini.
3. Dr. Suliantari, selaku dosen penguji yang telah bersedia meluangkan waktu untuk menguji, membimbing, dan member saran kepada penulis.
4. Papa, mama, dan adik yang selalu mendukung penulis.
5. Teman-teman (terutama Desi, Molly, Desna, Cipta, Dion, Dimas, Abdi, Agus, Arius, Heni, Zulfahnur, Laras, Sadek, Zega, Septi, Sandra, Yenni, dan Yua) yang telah mendukung penulis selama ini.
6. Warga Laboratorium Mikrobiologi dan Biokimia PAU (Bu Sri, Bu Emma, Bu Ika, Bu Eni, dan Pak Ace) yang telah banyak sekali membantu, mengajari, dan membimbing penulis selama melaksanakan penelitian.
ii 7. Teman-teman ITP 43.
8. Seluruh dosen ITP dan IPB periode 2006/2007 hingga 2009/2010.
Semoga skripsi hasil penelitian akhir ini dapat memberikan banyak manfaat bagi yang membutuhkannya. Akhirnya kritik dan saran sangat penulis harapkan demi perbaikan tulisan selanjutnya. Penulis juga mohon maaf atas segala kesalahan dan kekurangan dalam skripsi ini.
Bogor, 28 Juni 2010
iii DAFTAR ISI
Halaman
KATA PENGANTAR ………... i
DAFTAR ISI ………... iii
DAFTAR TABEL ……….. v
DAFTAR GAMBAR ……….. vi
DAFTAR LAMPIRAN ……….. vii
I. PENDAHULUAN ……….... 1
A. LATAR BELAKANG ……….. 1
B. TUJUAN PENELITIAN ……….. 2
C. MANFAAT PENELITIAN ……….. 2
II. TINJAUAN PUSTAKA ………... 3
A. BACILLUS ……….. 3
B. PROTEASE ………... 4
C. KERATIN ……… 5
D. PEMURNIAN ENZIM ………... 6
E. KARAKTERISTIK BIOKIMIAWI ENZIM PROTEASE ………….... 7
F. ELEKTROFORESIS DAN ZYMOGRAM ……… 8
III. METODOLOGI PENELITIAN ………. 9
A.BAHAN DAN ALAT ………... 9
1. Bahan ………... 9
2. Alat ………... 9
B.METODE PENELITIAN ……… 10
1. Penyegaran isolat dan pembuatan kultur starter ………. 10
2. Produksi enzim keratinase ………... 10
3. Ekstraksi dan pemurnian enzim keratinase ……….10
3.1. Presipitasi ………. 10
3.2. Dialisis ………. 11
3.3. Kromatografi interaksi hidrofobik ………... 11
iv
4. Karakterisasi enzim ……… 12
4.1. Efek aktivasi/inhibisi enzim oleh beberapa senyawa tertentu.. 12
4.2. Pendugaan berat molekul enzim ……….. 12
C. METODE ANALISIS ……… 13
1. Uji aktivitas keratinolitik ……….... 13
2. Uji kadar protein ………. 14
IV. HASIL DAN PEMBAHASAN ……….. 15
A. PRODUKSI ENZIM ……….. 15
B. PEMURNIAN ENZIM ……….. 16
C. KARAKTERISASI ENZIM ……….. 22
1. Pengaruh Beberapa Senyawa terhadap Aktivitas Enzim ………….. 22
2. Pendugaan Berat Molekul Enzim dengan Metode zymografi …….. 28
V. KESIMPULAN DAN SARAN ………. 32
A. KESIMPULAN ……….. 32
B. SARAN ………... 32
DAFTAR PUSTAKA ……… 33
v DAFTAR TABEL
Tabel 1. Hasil tahap-tahap pemurnian keratinase dari Bacillus sp. BE-1 …… 16 Tabel 2. Hasil pengujian pengaruh penambahan senyawa-senyawa pereduksi
terhadap aktivitas enzim keratinase ……… 24 Tabel 3. Hasil pengujian pengaruh penambahan senyawa-senyawa kation
divalen terhadap aktivitas enzim keratinase ………... 25 Tabel 4. Hasil pengujian pengaruh penambahan EDTA dan PMSF terhadap
aktivitas enzim keratinase ……….. 27 Tabel 5. Data molekul protein standar untuk zymogram ………. 29
vi DAFTAR GAMBAR
Gambar 1. Hasil analisis fraksi-fraksi pemurnian kromatografi
Butyl sepharose-FF ………..19
Gambar 2. Hasil analisis fraksi-fraksi pemurnian kromatografi
Sephacryl S-200HR ……… 21
Gambar 3. Grafik pengaruh penambahan beberapa senyawa terhadap
aktivitas enzim keratinase ……….. 23 Gambar 4. Kurva standar penanda berat molekul untuk zymogram ………… 30 Gambar 5. Hasil zymogram standar, enzim keratinase murni, enzim
keratinase murni dengan penambahan Mn2+, enzim keratinase murni dengan penambahan Mg2+, enzim keratinase murni dengan penambahan PMSF dan enzim keratinase murni dengan penambahan EDTA ………... 31
vii DAFTAR LAMPIRAN
Lampiran 1. Komposisi media pertumbuhan dan media produksi ………….. 38 Lampiran 2. Komposisi larutan buffer ………. 39 Lampiran 3. Kurva standar BSA untuk pengukuran kadar protein ………….. 40 Lampiran 4. Metode prehidrolisis bulu ayam ………... 42 Lampiran 5. Metode pembuatan substrat bulu ………...………... 43 Lampiran 6. Metode analisis aktivitas keratinase ………... 44 Lampiran 7. Kurva standar tirosin untuk pengukuran aktivitas keratinase ….. 45 Lampiran 8. Komposisi gel dan pereaksi untuk zymogram ………. 47 Lampiran 9. Data hasil pemurnian kromatografi Butyl sepharose FF ……….. 49 Lampiran 10. Data hasil pemurnian kromatografi Sephacryl S-200HR ………. 50
1 I. PENDAHULUAN
A. LATAR BELAKANG
Setiap tahun industri peternakan menghasilkan jutaan ton limbah bulu yang komponen utamanya (90%) merupakan protein keratin (Santos, et al., 1996). Pemanfaatan limbah bulu tersebut saat ini baru sebatas konversi limbah bulu menjadi pakan hewan berupa protein yang dapat dicerna yang dijadikan sebagai pakan hewan setelah melalui beberapa perlakuan fisik seperti perlakuan dengan suhu tinggi dan aplikasi tekanan (Gupta dan Ramnani, 2006).
Perlakuan fisik berupa suhu dan tekanan tinggi dapat merusak asam-asam amino esensial seperti metinonin, lisin, dan triptofan di dalamnya sehingga produk pakan yang dihasilkan memiliki kualitas nutrisi yang rendah serta daya cerna yang rendah. Hal ini mendorong pengembangan aplikasi enzim keratinase mikroba sebagai cara alternatif untuk menghidrolisis bulu menjadi pakan ternak yang kaya nutrisi (Onifade, et al., 1998).
Proses pengolahan kulit hewan juga menghadapi masalah yang berhubungan dengan bulu yaitu saat harus menghilangkan bulu dari kulit yang akan diproses lebih lanjut. Metode konvensional untuk penghilangan bulu di industri kulit biasanya menggunakan kapur atau sodium sulfit. Cara tersebut menimbulkan masalah karena dapat menimbulkan polusi yang berpotensi membahayakan kesehatan pekerja di bagian pembuangan limbah (Nilegaonkar, et al., 2007).
Saat ini berkembang pula pengembangan keratinase untuk produksi
biodegradable film dan coating dalam aplikasinya sebagai edible film pada
produk pangan pertanian. Struktur keratin dimodifikasi secara kimia dan dihidrolisis untuk menghasilkan dispersi stabil yang dapat digunakan untuk produksi biodegradable film dan coating (Gupta dan Ramnani, 2006).
Keratinase juga potensial untuk diaplikasikan pada industri detergen. Keratinase memiliki kemampuan mengikat dan menghidrolisis substrat yang kuat seperti keratin bulu. Kemampuan tersebut sangat penting dan diperlukan
2 dalam mendegradasi substrat protein yang terikat pada permukaan yang sulit sekalipun. Keratinase juga dapat membantu menghilangkan noda pada kerah pakaian yang umumnya sulit dihilangkan. Keratinase juga bahkan dapat digunakan sebagai bahan tambahan dalam krim pencerah kulit karena sifatnya yang menstimulasi pemecahan keratin (Gupta dan Ramnani, 2006).
Pengembangan enzim protease pendegradasi keratin bulu telah menghasilkan enzim keratinase yang berasal dari beberapa spesies mikroorganisme seperti Bacillus pumilus (Huang, et al., 2002), Bacilus
licheniformis RG-1 (Gupta dan Ramnani, 2006), Bacilus licheniformis PWD-1
(Lin, et al., 1992); Stenotrophomonas sp. (Yamamura, et al., 2002),
Lysobacter NCIMB 9497 (Allpress, et al., 2002) Pengembangan enzim untuk
mendegradasi bulu masih terus dilakukan untuk memperoleh enzim yang lebih ekonomis dan dapat mendegradasi bulu tanpa merusak produk yang diolah (Xie, et al., 2009).
B. TUJUAN PENELITIAN
Penelitian ini ditujukan untuk: (1) memperoleh hasil ekstraksi (fraksi enzim murni) keratinase yang berasal dari bakteri Bacillus sp. BE-1, (2) mendapatkan karakter keratinase yang dihasilkan terhadap logam tertentu (Mg2+, Mn2+, Ca2+), agen pereduksi (DTT, BMT, urea, SDS) serta inhibitor protease (EDTA dan PMSF), dan (3) memperoleh hasil dugaan berat molekul keratinase yang dihasilkan.
C. MANFAAT PENELITIAN
Hasil pemurnian dan karakterisasi keratinase dari Bacillus sp.BE-1 dapat memberikan alternatif enzim keratinase dengan karakteristik khususnya yang dapat digunakan dalam aplikasinya untuk industri.
3 II. TINJAUAN PUSTAKA
A. BACILLUS
Bacillus merupakan genus bakteri yang memiliki bentuk sel batang. Ukuran sel bakteri ini umumnya berkisar antara 0,3-2,2 µm x 1,27-7,0 µm. Sebagian besar sel bakteri ini bersifat motil dengan flagelum sebagai alat pergerakannya. Bakteri ini juga memiliki kemampuan untuk membentuk endospora (pembentukan spora di dalam sel vegetatif). Spora merupakan struktur yang dibentuk oleh bakteri saat menghadapi lingkungan ekstrim dengan kondisi yang tidak memungkinkan bagi sel untuk berkembang. Dalam bentuk spora, bakteri ini berada pada kondisi istirahat (laten). Setelah kondisi lingkungan menguntungkan dan memungkinkan bagi bakteri untuk bertumbuh, endospora akan bertumbuh menjadi sel biasa (sel vegetatif). Kemampuan membentuk spora ini memungkinkan bakteri ini untuk dapat hidup di banyak tempat termasuk tanah, debu dan udara (Pelczar, et al., 2007).
Kandungan air yang sangat rendah pada endospora bila dibandingkan dengan sel vegetatifnya membuat endospora berbentuk sangat padat dan sangat refraktil bila dilihat di bawah mikroskop. Pengamatan endospora di bawah mikroskop dapat dilakukan dengan melakukan pewarnaan menggunakan pewarna hijau malakit. Pengamatan di bawah mikroskop akan memperlihatkan warna hijau pada endospora dan warna merah muda pada sel vegetatif. Hal ini terjadi karena bakteri penghasil spora tahan terhadap pewarnaan. Oleh karena itu, setelah diwarnai oleh suatu warna, misalnya hijau malakit, spora bakteri akan mengikat kuat senyawa pewarna. Untuk pewarnaan selanjutnya, misalnya dengan safranin (merah muda), sel spora tidak dapat menerimanya karena sudah terikat kuat dengan pewarna pertama (hijau malakit) sehingga warna bakteri spora adalah hijau. Sementara sel vegetatif dapat mengikat warna tetapi dapat luntur setelah dilunturkan karena ikatannya tidak kuat. Setelah pewarnaan selanjutnya dengan safranin, sel vegetatif mudah mengikat warna kembali. Oleh karena itu, hasil
4 pewarnaan akhir adalah merah muda dari safranin (Prescott, et al., 2002).
Ciri umum berikutnya dari bakteri ini adalah bakteri ini termasuk dalam kelompok bakteri gram positif. Dinding sel bakteri gram positif mengandung lipid dalam persentase yang jauh lebih sedikit daripada bakteri gram negatif. Pengamatan bakteri gram positif di bawah mikroskop dapat dilakukan dengan melakukan pewarnaan gram menggunakan kompleks pewarna ungu kristal-yodium. Bakteri gram positif akan tampak sebagai sel berwarna ungu sementara bakteri gram negatif akan tampak sebagai sel berwarna merah muda. Hal ini disebabkan terekstraknya lipid pada dinding sel bakteri gram negatif karena perlakuan dengan etanol sehingga permeabilitas dinding sel bakteri gram negatif meningkat. Hal tersebut membuat kompleks ungu kristal-yodium yang memasuki dinding sel selama langkah awal proses pewarnaan gram terekstraksi keluar sehingga warna ungu kristal-yodium hilang pada proses pewarnaan bakteri gram negatif dan digantikan oleh warna merah muda dari safranin (pewarna kedua). Sementara bakteri gram positif yang memiliki dinding sel dengan kandungan lipid yang rendah akan mengecil ukuran pori-pori dinding selnya selama perlakuan dengan etanol. Ukuran pori-pori yang mengecil membuat permeabilitas dinding sel berkurang dan menghalangi kompleks warna ungu kristal-yodium untuk terekstraksi keluar dari dinding sel (Prescott, et al., 2002).
B. PROTEASE
Protease merupakan salah satu enzim ekstraseluler yang dihasilkan oleh mikroba untuk mengkatalisa reaksi-reaksi pemecahan substrat menjadi molekul-molekul yang lebih sederhana sehingga dapat masuk ke dalam sel. Enzim protease atau proteolitik merupakan golongan enzim yang termasuk dalam kelas hidrolase yang artinya berperan sebagai katalis dalam reaksi pemecahan protein dengan adanya air. Enzim ini terdiri dari proteinase yang mengakatalisis hidrolisis molekul protein menjadi fragmen-fragmen besar polipeptida dan peptidase yang mengkatalisis hidrolisis fragmen polipeptida menjadi asam-asam amino (Naz, 2002).
5 Berdasarkan pH untuk aktivitasnya, enzim protease dibagi menjadi protease asam, netral dan alkali. Klasifikasi yang lebih terinci dikemukakan oleh Naz (2002) dengan protease terbagi dalam empat golongan yaitu golongan serin (EC. 3.4.21), sistein (EC. 3.4.22), asam (EC. 3.4.23), dan logam (EC. 3.4.24).
Protease serin bekerja sebagai endopeptidase dengan asam amino serin terdapat pada sisi aktifnya. Dengan berat molekul sekitar 25-30 kD, protease ini stabil pada kondisi alkali dengan pH optimum 9.0-11.0, membutuhkan ion Ca2+, dihambat oleh Diisopropil Fluorofosfat (DFP) dan Fenil Metil Sulfonil Fluorida (PMSF). Golongan ini banyak dimanfaatkan oleh industri detergen karena aktivitas proteolitiknya yang tinggi walaupun spesifitasnya rendah.
Protease sistein memiliki kemampuan menghidrolisis peptida dan dihambat oleh pereaksi sulfidril. Enzim ini mencakup enzim dari tumbuhan tingkat tinggi seperti papain dari papaya (EC. 3.4.4.10), ficin dari daun ara (EC. 3.4.4.12), dan bromelain dari nanas (EC. 3.4.4.24). Enzim ini stabil pada suhu tinggi dengan suasana pH netral dan terdenaturasi pada pH<4.
Protease asam ini mencakup enzim pepsin dan renin. Jenis enzim ini memiliki kestabilan pada suhu tinggi hingga mencapai 600C dan dapat bekerja optimal pada pH rendah (pH 2) pada kebanyakan substrat. Hal ini dapat menguntungkan pada proses yang membutuhkan kondisi higienis.
Protease logam terbagi atas tiga golongan utama yaitu protease logam netral yang mempunyai pH optimum sekitar 7 dan biasanya mengandung atom logam Zn, protease logam alkalis yang aktif pada kondisi alkalis yaitu pH 7-9 dengan ukuran molekul yang lebih besar dari protease logam netral, dan protease miksobakter jenis I dan II dengan pH optimum 8.5-9.0. Jenis protease ini dihambat oleh keberadaan EDTA.
C. KERATIN
Keratin adalah protein fibrous tak larut yang merupakan komponen utama pada kulit, rambut, bulu dan kuku. Keratin memiliki stabilitas tinggi dan ketahanan yang ekstrim terhadap degradasi oleh enzim proteolitik
6 seperti pepsin, tripsin dan papain. Stabilitas keratin bergantung pada struktur kuat protein oleh jembatan disulfida, interaksi hidrofobik dan ikatan hidrogen (Xie, et al., 2009).
Berdasarkan struktur sekundernya, keratin telah diklasifikasikan sebagai α (α-helix pada rambut dan wool) dan β (β-sheet pada sutera). Keratin juga dibagi menjadi keratin keras dan lembut berdasarkan kandungan sulfurnya. Keratin keras seperti pada bulu hewan, rambut, dan kuku memiliki jumlah ikatan disulfida yang banyak dan strukturnya kuat serta tidak fleksibel. Keratin lembut seperti pada kulit memiliki jumlah ikatan disulfida yang sedikit dan strukturnya lebih fleksibel (Gupta dan Ramnani, 2006).
Jembatan sistin sebagai struktur penting keratin menghambat kerja enzim proteolitik dalam memecah jaringan keratin. Oleh karena itu, pemutusan ikatan disulfida ini penting untuk memungkinkan enzim bekarja menghidrolisa protein (Allpress, et al., 2002).
D. PEMURNIAN ENZIM
Tahapan umum untuk isolasi dan pemurnian enzim ekstraseluler biasanya dimulai dengan pemisahan enzim dari sel-sel mikroorganisme dan pengendapan enzim dengan garam (salting out). Umumnya garam yang digunakan adalah (NH4)2SO4 karena memiliki beberapa kelebihan seperti
efektivitasnya dalam proses salting out, dapat bekerja baik pada berbagai pH, kelarutannya yang tinggi, panas yang dihasilkan dari pelarutannya rendah, dan harganya yang murah (Scopes, 1981). Setelah pengendapan enzim pada larutan bebas mikroba, proses dilanjutkan dengan beberapa langkah pemurnian berikutnya yang sebagian besar merupakan metode pemisahan secara fisik dan kimia (Kumar, 2002).
Metode yang sering digunakan dalam pemisahan enzim dari protein lainnya adalah dengan kromatografi kolom. Pemurnian enzim dengan kromatografi kolom merupakan cara yang paling efektif dibandingkan dengan semua cara pemisahan yang lain.
7 dalam empat kelompok yaitu:
a. Kromatografi adsorpsi yang bekerja berdasarkan perbedaan polaritas komponen-komponen sampel.
b. Kromatografi pertukaran ion yang melakukan pemisahan berdasarkan perbedaan jenis muatan adsorben dan komponen sampel.
c. Kromatografi filtrasi gel yang memisahkan molekul-molekul berdasarkan ukurannya.
d. Kromatografi afinitas yang memisahkan komponen-komponen sampel berdasarkan interaksi biokimia antara komponen sampel dengan ligan yang terikat pada matriks adsorben.
E. KARAKTERISTIK BIOKIMIAWI ENZIM PROTEASE
Salah satu karakteristik yang membedakan enzim dengan katalis sintetik adalah seringnya enzim berinteraksi dangan kofaktor yakni senyawa nonprotein yang berkombinasi dengan protein inaktif lainnya (apoenzim) untuk memberikan kompleks katalitik yang aktif. Terdapat dua macam kofaktor yaitu kofaktor logam seperti Zn2+, Mg2+, Fe2+, Cu2+ dan koenzim yang berupa molekul organik kompleks seperti tiamin pirofosfat, FAD dan koenzim A (Page, 1989).
Jenis kation yang telah diketahui dapat mengaktifkan enzim adalah Na+, K+, Rb+, Cs+, Mg2+, Ca2+, Zn2+, Cd2+, Cr3+, Cu3+, Mn2+, Fe2+, Co2+, Ni2+, Al3+, dan H+ (Page, 1989).
Inhibitor merupakan senyawa yang cenderung menurunkan kecepatan reaksi yang dikatalis oleh enzim. Ikatan inhibitor dengan enzim dapat mengubah kemampuan enzim dalam mengikat substrat sehingga aktivitas enzim menurun (Page, 1989).
Protease logam membutuhkan logam sebagai kofaktor untuk melakukan fungsi katalitiknya. Adanya senyawa pengkelat logam seperti Etilen Diamin Tetra Asetat (EDTA) merupakan inhibitor bagi protease logam (Naz, 2002). Senyawa ini mampu mengkelat berbagai ion logam yang berada di lingkungan, baik yang dibutuhkan maupun yang tidak dibutuhkan oleh enzim.
8 Menurut Polgár (1990), aktivitas protease serin dapat dihambat oleh senyawa yang bereaksi dengan gugus –OH pada serin di sisi aktifnya seperti DFP (diisopropil fluorofosfat) dan PMSF (Phenil Metil Sulfonil Fluorida).
F. ELEKTROFORESIS DAN ZYMOGRAM
Elektroforesis adalah teknik pemisahan fraksi-fraksi zat berdasarkan migrasi partikel bermuatan atau ion-ion makromolekul di bawah pengaruh medan listrik karena adanya perbedaan ukuran, muatan atau sifat kimia molekul (Naz, 2002). Berdasarkan pemisahan tersebut, teknik ini dapat digunakan untuk menentukan berat molekul, mendeteksi kemurnian dan kerusakan protein, menetapkan titik isoelektrik protein serta memisahkan spesies-spesies molekuler yang berbeda secara kuantitatif dan kualitatif.
Beberapa jenis elektroforesis yang dikenal antara lain elektroforesis kertas, elektroforesis selulosa sitrat dan elektroforesis gel. Jenis yang terakhir ini adalah yang paling banyak digunakan untuk analisa protein dan asam nukleat. Di antara berbagai metode elektroforesis, menurut Bollag dan Edelstein (1991), elektroforesis gel poliakrilamida (PAGE) merupakan metode yang paling banyak digunakan karena memiliki kapasitas pemisahan yang tinggi, berbiaya rendah, reproducible, dan cepat.
Zymogram merupakan salah satu teknik elektroforesis yang berbasis SDS-PAGE (sodiumdodecyl sulfate - polyacrylamide gel electrophoresis) yang menggunakan substrat di dalam gel poliakrilamidanya untuk mendeteksi aktivitas enzim. Gel kemudian direnaturasi dengan Triton X-100 dan diinkubasi dalam buffer yang sesuai untuk aktivitas enzim. Gel zymogram diwarnai dengan Coomassie Brilliant Blue dan area bening menandakan adanya aktivitas enzim yang mendegradasi substrat (Beurden dan Hoff, 2005).
9 III. METODOLOGI PENELITIAN
A. BAHAN DAN ALAT
1. Bahan
Bahan-bahan yang dibutuhkan adalah tripton, NaCl, ekstrak khamir, agar, K2HPO4, KH2PO4, bulu ayam, NH4Cl, MgCl2.6H2O, HCl,
air destilata, air bebas ion, NaOH, Folin ciochalteau, TCA (asam trikloroasetat), Na2CO3, etanol 96%, alkohol 70%, asam fosfat, asam
asetat glasial, metanol, gel butyl sepharose FF, (NH4)2SO4, gel sephacryl
S-200HR, PEG, Coomassie Brilliant Blue R-250, Coomassie Brilliant
Blue G, MgCl2, MnCl2, CaCl2, DTT (dithiothreitol), BMT
(β-merkaptoetanol), SDS (sodiumdodesilsulfat), urea, EDTA (etilendiamintetraasetat), PMSF (fenilmetilsulfonilflorida), l-tirosin, tris, gelatin, akrilamida, bis-akrilamida, ammonium persulfat (APS), marker
Low Molecular Weight (Bio-Rad), dan glisin.
2. Alat
Alat-alat yang digunakan adalah cawan petri, erlenmeyer, gelas piala, botol semprot, sudip, aluminium foil, jarum ose, plastik tahan panas, otoklaf, gelas ukur, sarung tangan lateks, masker, plastik wrap, pembakar spiritus, kapas, saringan, neraca analitik, inkubator, labu ukur,
refrigerator, kolom kromatografi, oven, tabung reaksi, rak tabung reaksi, fraction collector, mikropipet, mikrotip, tabung eppendorf, magnetic stirrer, blender, sentrifus, waterbath, spektrofotometer, pH meter, kuvet,
kertas saring Whatman No.1, pipet tetes, laminar flow, Hamilton
10 B. METODE PENELITIAN
1. Penyegaran isolat dan pembuatan kultur starter
Penyegaran isolat dilakukan dengan menumbuhkan sebanyak satu ose kultur Bacillus BE-1 pada media pertumbuhan Bacillus sp.BE-1 yang mengandung 0,05% K2HPO4, 0,04% KH2PO4, 0,05% NaCl, dan 1%
tepung bulu ayam (modifikasi Macedo et al. 2005) pada kondisi aseptis. Media tersebut kemudian diinkubasi pada suhu 370C selama 3 hari. Koloni terpisah yang membentuk area bening di sekitarnya diambil sebanyak satu ose dan ditumbuhkan pada media Luria Bertani Broth yang terdiri dari 1% tripton, 1% NaCl, dan 1% ekstrak khamir. Media tersebut kemudian diinkubasi pada suhu 370C selama semalam. Kultur ini digunakan sebagai starter untuk proses produksi enzim.
2. Produksi enzim keratinase
Kultur starter diinokulasikan ke dalam media produksi. Volume kultur starter yang ditambahkan ke dalam media produksi adalah sebanyak 10% dari volume media produksi. Komposisi media produksinya adalah 0,05% NH4Cl; 0,05% NaCl; 0,03% K2HPO4; 0,01% MgCl2; 6 H2O dan 1
% tepung bulu ayam (modifikasi Lin et al. 1992). Kondisi produksinya adalah pH 7.5, suhu 37oC, agitasi 100 rpm dan lama produksi dua hari. Pada hari ketiga dilakukan penyaringan untuk memisahkan tepung bulu dari cairan media berisi bakteri dan sentrifugasi agar diperoleh filtrat bebas sel (ekstrak enzim kasar) untuk diuji aktivitasnya.
3. Ekstraksi dan pemurnian enzim keratinase
3.1. Presipitasi
Langkah awal pemurnian enzim adalah presipitasi enzim yaitu mengendapkan filtrat bebas sel dengan 50% (b/v) ammonium sulfat atau 73% kejenuhan selama 12 jam. Hasilnya kemudian disentrifus dengan kecepatan 10000 rpm selama 30 menit. Endapan
11 tersebut dilarutkan dalam 50mM buffer Tris-Cl pH 8 untuk kemudian diuji aktivitasnya.
3.2. Dialisis
Endapan protein yang telah dilarutkan dalam 50mM buffer Tris-Cl pH 8 kemudian didialisis dengan membran dialisis (cut off 12kDa) dalam buffer yang sama. Hasil dialisis kemudian dipekatkan dengan meletakkan kantong dialisis di atas serbuk polietilen glikol (PEG) selama beberapa menit.
3.3. Kromatografi interaksi hidrofobik
Sebanyak 20 ml matriks Butyl sepharose FF dialirkan ke dalam kolom kromatografi berukuran 10/20. Matriks disetimbangkan dengan 30% amonium sulfat dalam 50 mM buffer Tris-Cl pH 8,0. Elusi secara berurutan menggunakan 30, 15, dan 0% amonium sulfat dalam buffer yang sama. Seluruh fraksi yang diperoleh kemudian diuji aktivitasnya. Fraksi dengan aktivitas keratinase tertinggi diaplikasikan ke dalam kolom kromatografi filtrasi gel yang berisi matriks Sephacryl S-200HR.
3.4. Kromatografi filtrasi gel
Sebanyak 40 ml matriks Sephacryl S-200HR dialirkan ke dalam kolom kromatografi berukuran 10/40 dan disetimbangkan menggunakan 50 mM bufer Tris-Cl pH 8,0. Elusi sampel menggunakan bufer yang sama. Seluruh fraksi diuji aktivitasnya untuk memperoleh fraksi-fraksi dengan aktivitas keratinase tertinggi.
12 4. Karakterisasi enzim
4.1. Efek aktivasi/inhibisi enzim oleh beberapa senyawa tertentu
Karakterisasi enzim dilakukan dengan menguji efek logam dan beberapa senyawa lainnya seperti EDTA dan PMSF terhadap aktivitas keratinolitik dari enzim keratinase yang diperoleh. Karakterisasi dilakukan terhadap enzim hasil pemurnian kromatografi filtrasi gel (kromatografi dengan matriks gel
Sephacryl S-200HR). Senyawa-senyawa yang diujikan berupa
larutan BMT, DTT, urea, SDS, EDTA, PMSF, MnCl2, CaCl2, dan
MgCl2. Setiap senyawa ditambahkan pada sampel enzim murni
pada konsentrasi 1, 2, dan 3 mM. Setiap sampel kemudian diuji aktivitasnya.
4.2. Pendugaan berat molekul enzim
Deteksi berat molekul berdasar aktivitas enzim secara in-situ dilakukan dengan teknik analisis zymografi (Bressollier et al. 1999).
Pembuatan gel
Proses ini menggunakan Bio-Rad Mini-Protean Apparatus (Bio-Rad, USA). Cetakan gel berupa dua lempeng kaca dihimpitkan dan di antaranya terdapat pemisah (spacer) pada bagian tepi kaca. Larutan gel pemisah dibuat dengan komposisi tertentu (Lampiran 8) kemudian dimasukkan ke dalam ruang di antara kedua lempeng kaca. Setelah gel pemisah mengeras, larutan gel penahan diisikan pada ruang di atasnya. Air destilata dipipetkan ke atasnya agar permukaan atas gel menjadi rata. Sisir pencetak sumur segera dimasukkan ke bagian gel penahan tersebut sebelum gel mengeras.
13 Pelarian sampel
Larutan buffer elektroforesis dimasukkan ke dalam alat elektroforesis diikuti dengan lempeng kaca berisi gel yang telah tercetak baik. Sampel dan marker yang sebelumnya telah dilarutkan dalam buffer sampel diisikan ke masing-masing sumur. Elektroforesis dilakukan pada tegangan 70 volt dan arus 35 mA selama 3 jam dalam ruang dingin (2-40C) untuk mencegah penurunan aktivitas enzim. Setelah elektroforesis, gel direnaturasi dengan 2,5% (v/v) Triton X-100, dilanjutkan inkubasi dalam 50 mM Tris-Cl (pH 8.0) pada suhu 550C selama 12 jam. Gel kemudian diwarnai menggunakan CoomassieBrilliant Blue R-250.
Kelebihan warna dapat dihilangkan dengan merendam gel dalam larutan peluntur selama beberapa menit.
C. METODE ANALISIS
Analisis yang dilakukan terhadap enzim yang telah diperoleh terdiri dari uji aktivitas keratinolitik dan uji kadar protein.
1. Uji aktivitas keratinolitik
Aktivitas keratinase dianalisis berdasarkan metode Walter (1984) yang telah dimodifikasi dengan menggunakan substrat 1% tepung bulu ayam. Sampel yang akan diuji dicampurkan dengan 50 mM buffer Tris-Cl pH 8 dan substrat tepung bulu ayam. Campuran ini kemudian diinkubasi pada suhu 550C selama 30 menit. Hasilnya lalu ditambahkan dengan TCA dan diinkubasi pada suhu 370C selama 20 menit dan disentrifus pada kecepatan 10000 rpm selama 10 menit. Filtrat hasil sentrifus kemudian dicampurkan dengan folin-ciochalteau dan Na2CO3
lalu diinkubasi pada suhu 370C selama 20 menit. Hasilnya dibaca absorbansinya dengan spektrofotometer pada panjang gelombang 578 nm.
14 2. Uji kadar protein
Uji kadar protein menggunakan pereaksi Bradford (modifikasi Bollag dan Edelstein, 1991) yang diukur serapan sinarnya pada panjang gelombang 595 nm.
Hasil kadar protein ini akan digunakan untuk mengukur aktivitas enzimatis spesifik dari sampel.
Aktivitas spesifik = aktivitas enzimatis kadar protein
15 IV. HASIL DAN PEMBAHASAN
A. PRODUKSI ENZIM
Produksi enzim keratinase dilakukan dengan menumbuhkan kultur starter Bacillus sp. BE-1 dalam media produksi yang komposisinya disajikan pada Lampiran 1. Media produksi yang telah ditambahkan kultur starter tersebut kemudian diinkubasi selama dua hari pada suhu 370C. Kultur
starter dibuat dengan menumbuhkan satu ose isolat Bacillus sp. BE-1 ke
dalam media Luria Bertani Broth lalu diinkubasi selama semalam. Volume kultur starter yang ditambahkan ke dalam media produksi adalah sebanyak 10% dari volume media produksi.
Produksi enzim menghasilkan larutan keruh dengan substrat bulu ayam yang sudah berkurang drastis jumlahnya dibandingkan dengan sebelum inkubasi. Hal ini menandakan bahwa sebagian besar substrat bulu telah terdegradasi oleh enzim ekstraseluler yang dihasilkan oleh mikroba yang telah ditumbuhkan pada media produksi.
Larutan hasil produksi tersebut masih mengandung berbagai macam enzim dan protein sehingga masih harus diberikan serangkaian perlakuan lanjut untuk memperoleh enzim yang diinginkan. Proses berikutnya adalah perlakuan gaya sentrifugasi pada larutan hasil produksi sehingga dihasilkan supernatan jernih yang telah bebas sel mikroba. Larutan supernatan jernih ini kemudian disebut sebagai ekstrak enzim kasar.
Pengujian aktivitas keratinolitik (kemampuan mendegradasi substrat keratin) yang dilakukan pada ekstrak enzim kasar menghasilkan nilai aktivitas sebesar 0,0698 U/mg. Nilai ini akan menjadi patokan perbandingan bagi kelipatan peningkatan nilai aktivitas keratinolitik (tingkat kemurnian) fraksi-fraksi enzim pada tahap-tahap pemurnian selanjutnya.
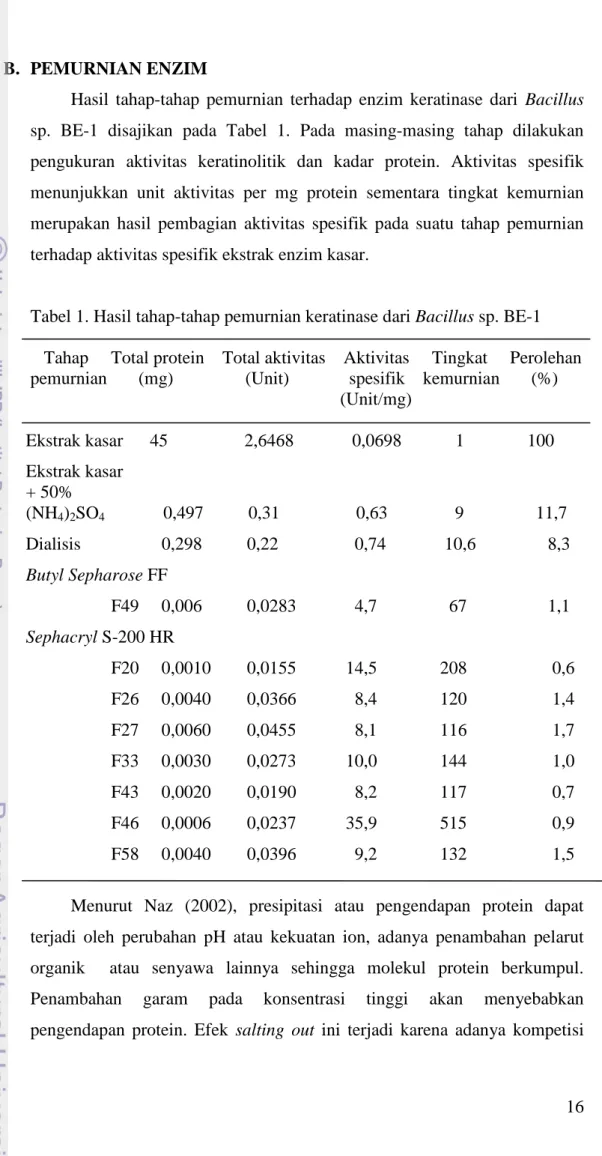
16 B. PEMURNIAN ENZIM
Hasil tahap-tahap pemurnian terhadap enzim keratinase dari Bacillus sp. BE-1 disajikan pada Tabel 1. Pada masing-masing tahap dilakukan pengukuran aktivitas keratinolitik dan kadar protein. Aktivitas spesifik menunjukkan unit aktivitas per mg protein sementara tingkat kemurnian merupakan hasil pembagian aktivitas spesifik pada suatu tahap pemurnian terhadap aktivitas spesifik ekstrak enzim kasar.
Tabel 1. Hasil tahap-tahap pemurnian keratinase dari Bacillus sp. BE-1
Tahap Total protein Total aktivitas Aktivitas Tingkat Perolehan pemurnian (mg) (Unit) spesifik kemurnian (%)
(Unit/mg) Ekstrak kasar 45 2,6468 0,0698 1 100 Ekstrak kasar + 50% (NH4)2SO4 0,497 0,31 0,63 9 11,7 Dialisis 0,298 0,22 0,74 10,6 8,3 Butyl Sepharose FF F49 0,006 0,0283 4,7 67 1,1 Sephacryl S-200 HR F20 0,0010 0,0155 14,5 208 0,6 F26 0,0040 0,0366 8,4 120 1,4 F27 0,0060 0,0455 8,1 116 1,7 F33 0,0030 0,0273 10,0 144 1,0 F43 0,0020 0,0190 8,2 117 0,7 F46 0,0006 0,0237 35,9 515 0,9 F58 0,0040 0,0396 9,2 132 1,5
Menurut Naz (2002), presipitasi atau pengendapan protein dapat terjadi oleh perubahan pH atau kekuatan ion, adanya penambahan pelarut organik atau senyawa lainnya sehingga molekul protein berkumpul. Penambahan garam pada konsentrasi tinggi akan menyebabkan pengendapan protein. Efek salting out ini terjadi karena adanya kompetisi
17 antara protein dan garam dalam interaksinya dengan molekul air. Pada konsentrasi garam yang tinggi, tidak ada cukup molekul air yang tersedia untuk melarutkan protein karena mayoritas molekul air berinteraksi lebih kuat dengan garam dibandingkan dengan protein. Hal ini membuat interaksi antar protein lebih kuat daripada interaksi protein-air yang akhirnya menyebabkan agregasi molekul-molekul protein sehingga protein mengendap.
Garam yang digunakan dalam penelitian ini adalah ammonium sulfat (NH4)2SO4 karena beberapa kelebihan yang dimiliki seperti efektivitasnya
dalam proses salting out, dapat bekerja baik pada berbagai pH, kelarutannya yang tinggi, panas yang dihasilkan dari pelarutannya rendah, dan harganya yang murah (Scopes, 1981).
Penambahan garam dilakukan dilakukan sedikit demi sedikit pada suhu rendah sambil diaduk. Pengadukan dengan bantuan stirrer pada kecepatan rendah untuk menghindari denaturasi protein yang ditandai dengan kemunculan buih (Bollag dan Edelstein, 1991).
Ekstrak enzim kasar yang telah ditambahkan ammonium sulfat didiamkan selama 12 jam (semalam) pada suhu 40C. Selama proses ini molekul-molekul protein akan beragregasi. Agar diperoleh endapan protein yang sempurna, dilakukan sentrifugasi pada kecepatan 10000 rpm selama 30 menit pada suhu 40C.
Endapan protein yang telah didapatkan segera dilarutkan kembali dengan buffer fosfat dalam volume yang minimum. Terhadap fraksi ini dilakukan analisis aktivitas keratinolitik dan kadar protein. Hasil analisis menunjukkan bahwa terjadi peningkatan kemurnian enzim keratinase sebesar 9 kali dari ekstrak enzim kasar (filtrat bebas sel). Dalam fraksi ini masih terdapat banyak protein selain enzim keratinase.
Proses pemurnian dilanjutkan dengan dialisis untuk menghilangkan molekul garam dan ion pengganggu lainnya yang dapat mempengaruhi kestabilan enzim. Metode ini dapat membuat terjadinya pertukaran pelarut enzim dengan buffer yang masuk ke dalam dialisat. Ukuran kantong dialisis harus memungkinkan pertukaran tersebut namun tetap harus dapat
18 menghalangi lolosnya protein dari kantong dialisis (Bollag dan Edelstein, 1991). Dalam penelitian ini digunakan kantong dialisis berukuran 12 kD.
Hasil dialisis menunjukkan bahwa terjadi peningkatan tingkat kemurnian enzim sebesar 10,6 kali dari ekstrak enzim kasar. Hingga tahap ini terjadi peningkatan aktivitas spesifik sehingga tingkat kemurnian enzim semakin tinggi. Terjadinya pengenceran oleh larutan buffer yang menggantikan garam di dalam kantong memungkinkan penurunan konsentrasi protein.
Tahap pemurnian selanjutnya adalah aplikasi sampel hasil dialisis ke dalam kolom kromatografi Butyl sepharose FF. Kromatografi ini menggunakan prinsip interaksi hidrofobik. Protein termasuk enzim umumnya memiliki sisi hidrofobik. Garam ammonium sulfat dengan konsentrasi tinggi yang ditambahkan di awal proses (30%) memberikan kondisi bagi terjadinya interaksi hidrofobik antara matriks gel Butyl
sepharose dengan enzim. Penurunan konsentrasi garam dalam elusi
berikutnya (15% dan 0%) membuat lepasnya secara berturut-turut kumpulan enzim dari matriks gel Butyl sepharose. Pada tiap tahap elusi (30%, 15%, dan 0% garam) muncul puncak-puncak protein yang harus dianalisis aktivitas keratinolitiknya untuk memperoleh fraksi yang paling banyak mengandung enzim keratinase (fraksi dengan aktivitas keratinolitik paling tinggi).
Hasil analisis terhadap fraksi-fraksi yang keluar dari kolom interaksi hidrofobik tersebut disajikan pada Gambar 1. Analisis yang dilakukan meliputi penentuan kadar protein secara kasar dengan pengukuran absorbansi pada panjang gelombang 280 nm serta analisis aktivitas keratinolitik.
19 Gambar 1. Hasil analisis fraksi-fraksi pemurnian kromatografi Butyl
sepharose-FF
Terlihat dari Gambar 1 bahwa muncul 3 puncak protein pada pengukuran absorbansi pada panjang gelombang 280 nm. Puncak aktivitas enzim keratinase tertinggi (fraksi ke-49) muncul pada daerah puncak protein yang ketiga atau yang terakhir. Puncak ini merupakan puncak yang muncul setelah konsentrasi garam ammonium sulfat 0% (setelah fraksi ke-39). Garis putus-putus pada Gambar 1 di atas menunjukkan konsentrasi garam yang turun dari 30% ke 15% dan 0%. Aktivitas spesifik dari fraksi dengan aktivitas enzim keratinase tertinggi tersebut adalah 4,7 U/mg dengan tingkat kemurnian enzim 67 kali dari ekstrak enzim kasar.
Data tersebut menunjukkan bahwa enzim tersebut awalnya terikat kuat dengan matriks gel Butyl sepharose karena interaksi hidrofobik yang terjadi antara enzim dan matriks gel yang telah dikondisikan dengan konsentrasi garam ammonium sulfat 30%. Setelah konsentrasi garam diturunkan hingga
20 0%, enzim tersebut tidak lagi terikat ke matriks gel sehingga enzim keluar dari kolom kromatografi.
Fraksi ke-49 hasil pemurnian dengan Butyl sepharose tersebut menunjukkan aktivitas cukup tinggi dengan tingkat kemurnian 67 kali dari ekstrak enzim kasar. Namun hal tersebut belum cukup untuk menunjukkan bahwa fraksi tersebut telah benar-benar murni hanya berisi enzim keratinase sebab protein lainnya ada juga yang memiliki sisi hidrofobik yang dapat terikat kuat pada matriks gel berisi garam 30% dan lepas dari matriks gel setelah konsentrasi garam diturunkan hingga 0% (Allen, 1981). Oleh karena itu, masih dilakukan tahapan pemurnian berikutnya untuk memperoleh fraksi enzim keratinase yang lebih murni untuk digunakan dalam analisis-analisis berikutnya.
Tahapan pemurnian selanjutnya adalah aplikasi fraksi enzim hasil kromatografi Butyl sepharose ke dalam kolom kromatografi Sephacryl S-200HR. Kromatografi ini menggunakan prinsip filtrasi gel. Pemisahan terjadi berdasarkan berat molekul dari enzim atau protein. Protein atau enzim yang memiliki berat molekul lebih tinggi akan terpisah dari protein atau enzim yang memiliki berat molekul lebih rendah (Allen, 1981). Gel yang digunakan dalam penelitian ini adalah Sephacryl S-200HR.
Seluruh fraksi enzim yang diperoleh dari hasil kromatografi Sephacryl tersebut dianalisis kadar proteinnya berdasarkan pengukuran absorbansi pada panjang gelombang 280 nm. Aktivitas keratinolitik dari setiap fraksi juga dianalisis untuk memperoleh fraksi dengan kandungan enzim keratinase yang memiliki kemurnian paling tinggi.
Hasil analisis protein dan aktivitas keratinolitik dari fraksi-fraksi pemurnian kromatografi Sephacryl tersebut disajikan pada Gambar 2.
21 Gambar 2. Hasil analisis fraksi-fraksi pemurnian kromatografi Sephacryl
S-200HR
Terlihat dari Gambar 2 bahwa muncul 7 puncak yang merupakan fraksi-fraksi hasil pemurnian kromatografi Sephacryl yang mengandung enzim keratinase dengan tingkat kemurnian tertinggi. Fraksi-fraksi tersebut adalah fraksi ke-20, 26, 27, 33, 43, 46, dan 58 dengan aktivitas tertinggi pada fraksi ke-46. Tingkat kemurnian enzim keratinase pada fraksi ke-46 adalah 35,9 kali dibandingkan dengan ekstrak enzim kasar.
Banyaknya puncak yang muncul dengan aktivitas keratinolitik yang bervariasi menunjukkan bahwa enzim hasil pemurnian yang diperoleh dari tahap sebelumnya (kromatografi Butyl sepharose) belum benar-benar murni. Masih banyak protein lainnya yang bercampur dengan enzim keratinase pada setiap fraksi yang diperoleh. Tahap pemurnian kromatografi Sephacryl bertujuan untuk meningkatkan tingkat kemurnian enzim keratinase yang
22 dapat diperoleh dalam satu fraksi pemurnian. Inilah yang tampak dari fraksi ke-46 hasil pemurnian kromatografi Sephacryl yang memiliki aktivitas keratinolitik sebesar 35,9 U/mg atau 515 kali dari aktivitas keratinolitik ekstrak enzim kasar.
Hasil tersebut juga menunjukkan bahwa ada beberapa molekul enzim keratinase berbeda yang muncul dengan berat molekul yang bervariasi dalam tahapan pemisahan ini karena kemunculannya yang tersebar pada fraksi-fraksi awal maupun akhir. Hal ini didasari pada prinsip bahwa kromatografi filtrasi gel memisahkan protein berdasarkan berat molekulnya. Fraksi protein dengan berat molekul lebih tinggi akan muncul lebih dahulu diikuti dengan fraksi-fraksi berikutnya yang mengandung protein dengan berat molekul lebih rendah.
Fraksi ke-46 yang memiliki aktivitas keratinolitik paling tinggi akan digunakan dalam analisis-analisis berikutnya, yaitu analisis pengaruh penambahan beberapa senyawa (logam (Mg2+, Mn2+, Ca2+), agen-agen pereduksi (DTT, BMT, urea, SDS), dan inhibitor protease (EDTA dan PMSF) terhadap aktivitas enzim serta pendugaan berat molekul enzim keratinase yang diperoleh.
C. KARAKTERISASI ENZIM
Karakteristik biokimiawi enzim perlu diketahui agar enzim dapat bekerja dengan optimal. Karakteristik biokimiawi enzim yang dianalisis dalam penelitian ini meliputi pengaruh penambahan beberapa senyawa (logam (Mg2+, Mn2+, Ca2+), agen-agen pereduksi (DTT, BMT, urea, SDS), dan inhibitor protease (EDTA dan PMSF) terhadap aktivitas enzim serta pendugaan berat molekul enzim keratinase yang diperoleh dengan metode zymografi.
1. Pengaruh beberapa senyawa terhadap aktivitas enzim
Hasil pengujian dari pengaruh penambahan beberapa senyawa terhadap aktivitas enzim disajikan pada Gambar 3.
23 Gambar 3. Grafik pengaruh penambahan beberapa senyawa terhadap
aktivitas enzim keratinase
Senyawa yang diujikan pengaruhnya terhadap aktivitas enzim dalam penelitian ini adalah senyawa pereduksi, kation divalen dan inhibitor protease.
Analisis pengaruh senyawa-senyawa pereduksi terhadap aktivitas enzim keratinase dilakukan dengan menambahkan senyawa DTT (dithiothreitol), BMT (betamerkaptoetanol), urea, dan SDS (sodiumdodesilsulfat) pada enzim keratinase murni yang dihasilkan. Hasil pengujian tersebut disajikan pada Tabel 1.
Hasil analisis menunjukkan bahwa enzim keratinase yang diuji dapat meningkat aktivitasnya oleh penambahan DTT pada konsentrasi 1 mM. Konsentrasi DTT yang lebih tinggi justru menghilangkan aktivitas enzim. BMT juga dapat meningkatkan aktivitasnya baik pada konsentrasi 1, 2, maupun 3 mM. SDS meningkatkan aktivitas enzim pada konsentrasi 1 dan 2 mM. Konsentrasi SDS yang lebih tinggi justru menghilangkan aktivitas enzim. Penambahan urea pada konsentrasi 1 maupun 2 mM menghambat aktivitas enzim keratinase yang diuji.
24 Senyawa
yang ditambahkan
Konsentrasi
(mM) Asp Asp – Abl
Aktivitas spesifik (U/mg) Aktivitas relatif terhadap kontrol DTT kontrol 1 2 3 0,25 0,277 0,188 0,136 0,019 0,046 0 0 15,0351 36,1782 0 0 1 2,4 0 0 BMT kontrol 1 2 3 0,25 0,29 0,349 0,381 0,019 0,059 0,22 0,1535 15,0351 46,3582 252,9342 242,2186 1 3,1 16,8 16,1 Urea kontrol 1 2 3 0,25 0,245 0,2235 0,2015 0,019 0,014 0,0035 0 15,0351 11,1197 7,2435 0 1 0,74 0,48 0 SDS kontrol 1 2 3 0,25 0,282 0,238 0,228 0,019 0,0051 0,0018 0,0005 15,0351 40,0936 35,6300 1,3704 1 2,67 2,37 0,09
Tabel 2. Hasil pengujian pengaruh penambahan senyawa-senyawa pereduksi terhadap aktivitas enzim keratinase
DTT, BMT, SDS, dan urea merupakan senyawa-senyawa pereduksi. Menurut Cai, et al. (2008), enzim keratinase tidak dapat mendegradasi substrat bulu secara in vitro tanpa adanya bantuan dari agen pereduksi. Penyebab pasti hal ini masih belum diketahui. Akan tetapi, mekanisme yang paling mungkin terjadi adalah reduksi ikatan disulfida oleh agen pereduksi. Dengan demikian keberadaan agen pereduksi dapat meningkatkan aktivitas enzim keratinase dalam memecah substrat keratin bulu.
25 urea dapat meningkatkan aktivitas enzim keratinase. Peningkatan aktivitas paling signifikan terjadi pada penambahan BMT dengan konsentrasi 2 mM. Penambahan tersebut meningkatkan aktivitas enzim sampai 16,1 kali dari aktivitas enzim murni. Peningkatan aktivitas enzim oleh SDS juga penting untuk diperhatikan mengingat enzim umum digunakan dalam industri detergen (Cai, et al., 2008).
Pengaruh positif penambahan senyawa pereduksi terhadap aktivitas enzim keratinase telah banyak dipublikasikan sebelumnya (Böckle et al., 1995; Bressollier et al., 1999; Ignatova et al., 1999; Riffel, et al., 2003; Nam et al., 2002; Gradišar et al., 2005).
Pengujian pengaruh senyawa-senyawa kation divalen terhadap aktivitas enzim dilakukan dengan menambahkan CaCl2, MnCl2, dan
MgCl2 pada enzim keratinase murni yang dihasilkan. Hasil pengujian
tersebut disajikan pada Tabel 3.
Senyawa yang ditambahkan
Konsentrasi
(mM) Asp Asp – Abl
Aktivitas spesifik (U/mg) Aktivitas relatif terhadap kontrol Ca2+ kontrol 1 2 3 0,25 0,2655 0,221 0,195 0,019 0,0345 0,001 0 15,0351 27,1728 2,3492 0 1 1,81 0,16 0 Mn2+ kontrol 1 2 3 0,25 0,404 0,535 0,573 0,019 0,173 0,315 0,3455 15,0351 135,6291 617,0654 556,8733 1 9,02 41,04 37,04 Mg2+ kontrol 1 2 3 0,25 0,275 0,2375 0,247 0,019 0,044 0,0175 0,0195 15,0351 34,6120 34,6512 38,5666 1 2,3 2,3 2,57
Tabel 3. Hasil pengujian pengaruh penambahan senyawa-senyawa kation divalen terhadap aktivitas enzim keratinase
26 Penambahan beberapa senyawa kation divalen (Ca2+, Mn2+, Mg2+) menunjukkan bahwa enzim keratinase dalam penelitian ini diaktifkan baik oleh Ca2+, Mn2+, maupun Mg2+. Ketiga jenis kation ini mengaktifkan enzim tersebut dalam konsentrasi yang berbeda. Ca2+ mengaktifkan enzim pada konsentrasi 1 mM dan menghambat aktivitas enzim pada konsentrasi yang lebih tinggi. Mn2+ mengaktifkan enzim baik pada konsentrasi 1, 2, maupun 3 mM. Mg2+ juga mengaktifkan enzim baik pada konsentrasi 1, 2, maupun 3 mM.
Peningkatan yang signifikan (41 kali) pada aktivitas enzim setelah penambahan Mn2+ pada konsentrasi 2 mM menunjukkan bahwa ion logam tersebut sangat dibutuhkan dalam aktivitas enzimatis keratinase yang dihasilkan oleh Bacillus sp. BE-1 dalam penelitian ini. Sementara enzim keratinase dari Bacillus pumilus meningkat aktivitasnya sebesar 1,26 kali setelah penambahan Mn2+ pada konsentrasi 10 mM (Kumar, 2002).
Menurut Brandelli, et al. (2010), kation divalen seperti Ca2+ , Mn2+ dan Mg2+ dapat meningkatkan aktivitas enzim dengan berperan sebagai jembatan garam atau jembatan ion yang menstabilkan enzim pada konformasi aktifnya dan dapat juga melindungi enzim dari denaturasi akibat suhu tinggi. Cai, et al. (2008) juga menyatakan bahwa Ca2+ , Mn2+ dan Mg2+ merupakan senyawa-senyawa yang umumnya meningkatkan aktivitas keratinase.
Enzim keratinase dari Bacillus sp. P7 (Brandelli, et al., 2010) juga diaktifkan oleh Ca2+ , Mn2+ dan Mg2+ meskipun pada konsentrasi yang berbeda dengan enzim keratinase dalam penelitian ini. Begitu pula dengan keratinase dari Streptomyces sp. (Tatineni, et al., 2007).
Analisis pengaruh inhibitor protease pada aktivitas enzim dilakukan dengan manambahkan EDTA (etilendiamintetraasetat) dan PMSF (fenilmetilsulfonilfluorida) pada enzim keratinase murni yang dihasilkan. Hasil pengujian tersebut disajikan pada Tabel 4.
27 Senyawa
yang ditambahkan
Konsentrasi
(mM) Asp Asp – Abl
Aktivitas spesifik (U/mg) Aktivitas relatif terhadap kontrol EDTA kontrol 1 2 3 0,25 0,2445 0,2185 0,1875 0,019 0,0135 0 0 15,0351 10,7282 0 0 1 0,71 0 0 PMSF kontrol 1 2 3 0,25 0,2695 0,223 0,189 0,019 0,0385 0,003 0 15,0351 30,3051 6,2646 0 1 2,02 0,42 0
Tabel 4. Hasil pengujian pengaruh penambahan EDTA dan PMSF terhadap aktivitas enzim keratinase
Hasil analisis pengaruh penambahan EDTA dan PMSF pada enzim menunjukkan bahwa penambahan EDTA menghambat aktivitas enzim pada konsentrasi 1 mM dan menghilangkan secara total aktivitas enzim pada konsentrasi yang lebih tinggi. Penambahan PMSF justru meningkatkan aktivitas enzim pada konsentrasi 1 mM dan menghambat aktivitas enzim pada konsentrasi yang lebih tinggi.
EDTA merupakan senyawa yang dapat mengkelat logam (Wang,
et al., 2008). Logam yang dikelat oleh EDTA mencakup logam yang
dibutuhkan maupun yang tidak dibutuhkan oleh enzim dalam aktivitasnya. Aktivitas enzim turun oleh keberadaan EDTA karena sifat EDTA yang mengkelat logam sehingga menyebabkan perubahan konformasi enzim.
Penghambatan aktivitas enzim oleh EDTA (inhibitor
metalloprotease) dan peningkatan aktivitas enzim oleh
senyawa-senyawa logam menunjukkan bahwa enzim keratinase yang dianalisis dalam penelitian ini termasuk jenis protease logam (metalloprotease) (Brandelli, et al., 2010).
28 Enzim keratinase dari Lysobacter NCIMB 9497 (Allpress, et al., 2002) juga dihambat oleh EDTA. Begitu pula dengan enzim keratinase dari Chryseobacterium indologenes TKU014 (Wang, et al., 2008),
Bacillus cereus MCM B-326 (Nilegaonkar, et al., 2007), dan Microbacterium sp. kr10 (Thys dan Brandelli, 2006).
2. Pendugaan berat molekul enzim dengan metode zymografi
Metode zymografi yang dilakukan dalam penelitian ini menggunakan substrat protein gelatin. Substrat gelatin dibutuhkan untuk menjadi substrat yang akan didegradasi oleh sampel enzim sehingga molekul enzim yang dipisahkan oleh gel elektroforesis akan tampak sebagai pita bening hasil degradasi substrat oleh enzim.
Gel yang digunakan juga mengandung 8% poliakrilamida pada gel pemisah (separating gel) dan 4% poliakrilamida pada gel penahan (stacking gel). Konsentrasi poliakrilamida pada gel penahan umumnya memang lebih kecil daripada konsentrasi poliakrilamida pada gel pemisah sehingga membuat ukuran pori pada gel penahan lebih besar daripada ukuran pori pada gel pemisah. Dengan demikian pada gel penahan, sampel enzim tidak akan bergerak tetapi akan menumpuk dan terkonsentrasi. Oleh sebab itu gel penahan digunakan sebagai tempat dicetaknya sumur untuk memasukkan sampel dan mengkonsentrasikan sampel enzim yang akan membentuk pita tajam pada gel pemisah (Puspita, 2007).
Menurut (Puspita, 2007), gel poliakrilamida diperoleh dengan cara polimerisasi akrilamida dengan adanya sejumlah cross-linking agent metilena bis-akrilamida dan ammonium persulfat (APS) sebagai katalisator. Radikal bebas yang terbentuk dari pelarutan ammonium persulfat dalam air akan bereaksi dengan akrilamida membentuk akrilamida aktif yang dapat bereaksi satu sama lain membentuk polimer. SDS akan mendenaturasi dan menyelimuti protein enzim sehingga menjadi bermuatan negatif dan dapat bergerak ke elektroda positif. Air akan mengeluarkan sisa SDS sekaligus membilas permukaan gel
29 pemisah dari akrilamida yang tidak terpolimerisasi.
Buffer elektroforesis ditambahkan ke dalam wadah elektroforesis setelah sampel dimasukkan ke masing-masing sumur pada gel. Buffer elektroforesis yang mengandung urea, glisin, dan tris-Cl tersebut berfungsi sebagai pembawa aliran listrik di samping juga mempertahankan pH. Elektroforesis dilakukan pada suhu dingin untuk menghindari kerusakan enzim. Waktu yang diperlukan untuk proses elektroforesis dipengaruhi oleh arus listrik yang digunakan. Semakin besar arus listrik yang digunakan maka semakin singkat waktu elektroforesis yang dibutuhkan. Arus listrik yang digunakan dalam penelitian ini adalah 35 mA dengan tegangan 70 volt.
Pewarnaan dilakukan dengan cara melepaskan gel untuk direndam dalam larutan pewarna yang mengandung Coomassie Brilliant Blue. Kelebihan warna dapat dihilangkan dengan merendam gel dalam larutan peluntur. Berat molekul pita yang terbentuk dapat ditentukan dengan membandingkan dengan pita-pita protein standar. Protein standar yang digunakan adalah protein Low Molecular Weight (LMW) dengan 5 molekul protein yang memiliki berat molekul berbeda (Tabel 5) sehingga dihasilkan kurva standar seperti yang disajikan pada Gambar 4.
Molekul protein BM Log BM Jarak (cm) Rf (cm) 97000 4.986772 0.7 0.14 66000 4.819544 1.6 0.32 45000 4.653213 2 0.4 30000 4.477121 2.5 0.5 20100 4.303196 3.6 0.72
30 Gambar 4. Kurva standar penanda berat molekul untuk zymogram
Hasil zymogram terhadap enzim keratinase hasil pemurnian menunjukkan 2 pita protein dengan berat molekul masing-masing >97 kDa dan 82 kDa. Setelah enzim hasil pemurnian tersebut ditambahkan dengan senyawa Mn2+ maupun Mg2+, pita protein yang dihasilkan tetap menunjukkan berat molekul yang sama, yaitu >97 kDa dan 82 kDa. Hasil zymogram pada enzim hasil pemurnian yang ditambahkan dengan EDTA maupun PMSF pada konsentrasi masing-masing 2 mM dan 3 mM tidak menghasilkan pita protein.
Penambahan senyawa kation Mn2+ dan Mg2+ pada konsentrasi yang optimum untuk meningkatkan aktivitas enzim yang diuji membuat zymogram menghasilkan pita-pita protein yang lebih jelas. Sementara penambahan EDTA maupun PMSF pada konsentrasi masing-masing 2 mM dan 3mM tidak menunjukkan adanya pita-pita protein pada hasil zymogram. Hal ini disebabkan adanya pengaruh penghambatan aktivitas enzim keratinase yang diuji pada konsentrasi EDTA dan PMSF masing-masing 2 dan 3 mM.
31 a b c d e f
Gambar 5. Hasil zymogram standar (a), enzim keratinase murni (b), enzim keratinase murni dengan penambahan Mn2+ (c), enzim keratinase murni dengan penambahan Mg2+ (d), enzim keratinase murni dengan penambahan PMSF (e), dan enzim keratinase murni dengan penambahan EDTA (f)
32 V. KESIMPULAN DAN SARAN
A. Kesimpulan
Enzim keratinase yang diproduksi oleh Bacillus sp. BE-1 memiliki kemampuan mendegradasi keratin bulu. Proses pemurnian dengan kromatografi kolom interaksi hidrofobik gel sepharose FF menghasilkan enzim keratinase dengan aktivitas yang meningkat sebesar 67 kali (4,7U/mg) dibandingkan dengan aktivitas ekstrak kasar enzim (0,07U/mg). Proses pemurnian selanjutnya dengan kromatografi kolom filtrasi gel sephacryl S-200HR menghasilkan enzim keratinase dengan aktivitas yang meningkat bervariasi antara 116-515 kali dengan aktivitas tertinggi sebesar 35,9U/mg. EDTA dapat menghambat secara total aktivitas enzim keratinase ini. Penambahan Mn2+ dapat secara signifikan meningkatkan aktivitas enzim keratinase tersebut sebesar 51 kali dan Mg2+ sedikit meningkatkan aktivitas enzim tersebut sebesar 3 kali. Hal-hal tersebut menunjukkan bahwa enzim ini termasuk protease logam. Hasil analisis zymogram menunjukkan bahwa keratinase yang dihasilkan terdiri dari dua molekul protease dengan bobot molekul masing-masing sebesar 82 kDa dan >97 kDa.
B. Saran
Analisis lebih mendalam untuk mengetahui berat molekul enzim keratinase murni Bacillus sp.BE-1 secara lebih akurat perlu dilakukan agar proses pemurnian dapat lebih disempurnakan. Analisis terhadap spesifitas dan stabilitas suhu enzim keratinase yang dihasilkan juga perlu dilakukan untuk aplikasi enzim di industri.
33 DAFTAR PUSTAKA
Allen, G. 1981. Laboratory Techniques in Biochemistry and Molecular Biology. Elsevier/North-Holland Biomedical Press, Amsterdam.
Allpress, J.D., Mountain, G., dan P.C. Gowland. 2002. Production, purification, and characterization of an extracellular keratinase from Lysobacter NCIMB 9497. Letters in Applied Microbiology 34, 337-342.
Beurden, S. dan V. Hoff. 2005. Zymographic techniques for the analysis of matrix metalloproteinases and their inhibitors. Biotechniques 38, 78-83.
Böckle, B., Galunsky, B., Muller, R., 1995. Characterization of a keratinolytic serine protease from Streptomyces pactum DSM 40530. Appl. Environ. Microbiol. 61(10), 3705-3710.
Bollag, D. M. dan Edelstein, S. J. 1991. Protein Methods. Wiley-Liss, Inc., New York.
Brandelli, A., Corrêa, A., dan Daroit, D.. 2010. Characterization of a keratinase produced by Bacillus sp. P7 isolatd from an Amazonian environment. International Biodeterioration and Biodegradation 64, 1-6.
Bressollier P, Letourneau F, Urdaci M, dan B. Verneuil. 1999. Purification and characterization of a keratinolytic serine proteinase from Streptomyces
albidoflavus. Appl. Environ. Microbiol. 65(6), 2570-2576.
Cai, C., Chen, J., Qi, J., Yin, Y., Zheng, X. 2008. Purification and characterization of keratinase from a new Bacillus subtilis strain. Journal of Zhejiang University SCIENCE B 9, 713-720.
34 Gradišar, H., Friedrich, J., Krizaj, I., dan R. Jerala. 2005. Similarities and specificities of fungal keratinolytic proteases: comparison of keratinases of
Paecilomyces marquandii and Doratomyces microspores to some known
proteases. Applied and Environmental Microbiology 71, 3420-3426.
Gupta, R dan P. Ramnani. 2006. Microbial keratinases and their prospective applications: an overview. Appl. Microbiol. Biotechnol. 70, 21-33.
Huang, Q., Peng, Y., Li, X., Wang, H., dan Y. Zhang. 2002. Purification and characterization of an extracellular alkaline serine protease with dehairing function from Bacillus pumilus. Current Microbiology 46, 169-173.
Ignatova, Z., Gousterova, A., Spassov, G., dan P. Nedkov. 1999. Isolation and partial characterization of extracellular keratinase from a wool degrading thermophilic actinomycete strain Thermoactinomyces candidus. Canadian Journal of Microbiology 45, 217-222.
Kumar, C.G. 2002. Purification and characterization of a thermostable alkaline protease from alkalophilic Bacillus pumilus. Letters in Applied Microbiology 34, 13-17.
Lin X., Lee C. G., Casale E. S., dan J. C. H. Shih. 1992. Purification and characterization of a keratinase from a B. licheniformis strain. Appl. Environ. Microbiol. 58, 3271-3275.
Macedo, et al. 2005. Novel keratinase from Bacillus subtilis S14 exhibiting remarkable dehairing capabilities. Appl. Environ. Microbiol. 1, 594-596.
Nam, G.W., Lee, D.W., Lee, H.S., Lee, N.J., Kim, B.C., Choe, E.A., Hwang, J.K., Suhartono, M.T., dan Y.R. Pyun. 2002. Native feather degradation by
Fervidobacterium islandicum AW-1, a newly isolated keratinase producing