Laporan Praktikum Nama : Linda Trivana
Kimia Analitik 1 NRP : G44080075
Kelompok : B-Siang Asisten : Yuyun Yunita Hari, tanggal : Selasa, 11 Mei 2010 PJP : Zulhan A, S.Si
Penentuan Kadar Vitamin C dengan Titrasi Iodometri Langsung
Prinsip Teori
Standardisasi adalah suatu usaha untuk menentukan konsentrasi yang tepat dari calon larutan baku. Standardisasi secara titrasi menggunakan bahan penstandardisasi haruslah suatu bahan baku primer, yakni suatu bahan yang konsentrasi larutannya dapat langsung ditentukan dari berat bahan sangat murni yang dilarutkan dan volume larutan yang terjadi. Syarat-syarat yang diperlukan untuk bahan baku primer, yaitu sangat murni, mudah diperiksa kemurniannya (diketahui macam dan jumlah pengotornya), stabil, berat ekivalen yang tinggi untuk mengurangi kesalahan penimbangan dan dalam titrasi akan bereaksi menurut syarat-syarat reaksi titrasi (Harjadi 1986).
Oksidireduktometri merupakan teknik titrasi yang berdasarkan reaksi reduksi-oksidasi yang melibatkan perpindahan elektron atau perubahan bilangan oksidasi (Harvey 2000). Titrasi redoks dapat dibedakan menjadi beberapa cara berdasarkan pemakaiannya, yaitu iodometri tidak langsung dengan Na2S2O3 sebagai titran, iodometri langsung dengan I2
sebagai titran, suatu oksidator kuat sebagai titran (KMnO4, K2Cr2O7, Ce (IV)), dan suatu
reduktor kuat sebagai titran (Harjadi 1986). Vitamin C merupakan senyawa pereduksi sehingga akan mereduksi setiap iod yang ditambahkan dalam titrasi. Penentuan kadar vitamin C dilakukan dengan metode iodometri langsung. Titrasi ini menggunakan I2 sebagai titran dan
amilum sebagai indikator. Jumlah penambahan iod dalam konsentrasi yang telah diketahui akan sebanding dengan gram vitamin C yang terkandung dalam contoh.
Tujuan Percobaan
Melatih melakukan analisis ion logam dengan titrasi pembentukan kompleks (komplekometri/kelatometri) dan menentukan konsentrasi Mg dan Ca.
Prosedur Percobaan Standardisasi EDTA
Sebanyak 10 ml larutan CaCO3 (jika asam netralkan dengan NaOH) ditambah 0,5 ml
larutan penahan (pH 10), 2-3 tetes indicator erio-T, lalu dititrasi dengan EDTA sampai warna berubah dari merah ke biru (dekat titik akhir, titrasi harus benar-benar berhati-hati, tetes terakhir harus jelas menunjukkan lenyapnya “shade” kemerah-merahan yang terakhir. Jika dilakukan baik-baik, titik akhir tajam sekali dan dapat digunakan untuk mikrotitrasi yang memakai larutan EDTA encer sekali, misalnya 0,001M. Titrasi dilakukan triplo.
Sebanyak 10 ml larutan sampel yang mengandung Mg2+ ditambahkan 1-2 ml larutan
buffer pH 10, dan 2-3 tetes indikator erio-T. Titrasi larutan tersebut dengan EDTA 0,01M sampai warna berubah dari merah ke biru. Titrasi dilakukan sebanyak triplo.
Titrasi berganti untuk penentuan Ca
Sebanyak 10 ml larutan sampel yang mengandung Ca2+ ditambahkan 1-2 ml larutan
buffer pH 10, 1 ml larutan Mg-EDTA, dan 2-3 tetes indikator erio-T. Titrasi larutan tersebut dengan EDTA 0,01M sampai warna berubah dari merah ke biru. Titrasi dilakukan sebanyak triplo.
Titrasi kembali untuk penentuan Ca
Sebanyak 10 ml larutan sampel yang mengandung Ca2+ ditambahkan 1-2 ml larutan
buffer pH 10, dan 2-3 tetes indikator erio-T. Tambahkan EDTA berlebih yaitu 20 ml. Titrasi kelebihan EDTA menggunakan larutan Mg2+ yang telah ditentukan konsentrasinya sampai
terjadi perubahan warna dari biru ke merah. Titrasi dilakukan sebanyak triplo. Hasil Percobaan
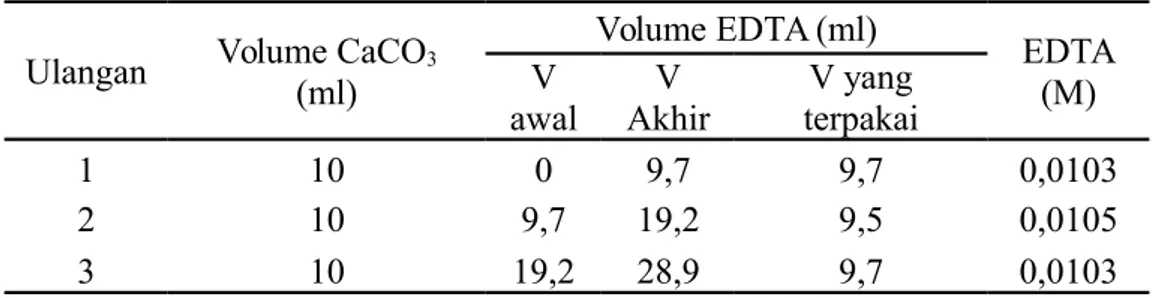
Tabel 1 Standardisasi EDTA
Ulangan Volume CaCO3
(ml) Volume EDTA (ml) EDTA (M) V awal V Akhir V yang terpakai 1 10 0 9,7 9,7 0,0103 2 10 9,7 19,2 9,5 0,0105 3 10 19,2 28,9 9,7 0,0103
Reaksi yang terjadi adalah Ca2+ + [H
3(Erio T)]→Ca2+ + [Ca(Erio T)]- + 3H+
Ca2+ + [H
2(EDTA)]2-→ [Ca(EDTA)]2- + 2H+
[H2(EDTA)]2- + [Ca(Erio T)]-→[Ca(EDTA)]2- + [H2(Erio T)]
-[H2(Erio T)]- pada pH 10→[H(Erio T)]2- (biru)
Indikator yang digunakan Eriochrome Black T Perubahan warna: Merah menjadi biru
Contoh Perhitungan:
Rerata normalitas EDTA
= 0,0104 N
1,22 x 10-4N
% Ketepatan=
= (1- = 96%
Tabel 2 Titrasi Langsung Penentuan Mg
Ulangan
Volume Sampel 1 (ml) Volume EDTA (ml)
[Ca2+] (mg/l) mengandung Ca V awal V Akhir V yang terpakai 1 10 28,0 36,4 8,4 349,44 2 10 36,4 44,8 8,4 349,44 3 10 19,7 28,2 8,5 353,60 Ulangan
Volume Sampel 2 (ml) Volume EDTA (ml)
[Mg2+] (mg/l) mengandung Mg V awal V Akhir V yang terpakai 1 10 0 9,2 9,2 232,59 2 10 9,3 18,7 9,4 237,65
3 10 18,7 28 9,3 235,13 Reaksi yang terjadi adalah
2Mg2+ + H
3Er→Mg2+ + MgEr- + 3H+
Mg2+ + [H
2(EDTA)]2-→ [Mg(EDTA)]2- + 2H+
[H2(EDTA)]2- + MgEr-→[Mg(EDTA)]2- + H2Er
-H2Er- pada pH 10→HEr2- (biru)
Indikator yang digunakan Eriochrome Black T Perubahan warna: Merah menjadi biru
Contoh Perhitungan:
Perhitungan konsentrasi Ca2+ (ulangan 1 pada sampel 1)
[Ca2+] = = 349,44 Rerata konsentrasi Ca2+ = 350,83 2,40 Varian = SD2 = 5,76
Perhitungan konsentrasi Mg2+ (ulangan 1 pada sampel 2) [Mg2+] = = 232,59 Rerata konsentrasi Mg2+ = 235,12 2,53 Varian = SD2 = 6,4009
Tabel 3 Titrasi berganti untuk penentuan Ca
mengandung Ca awalV AkhirV terpakaiV yang
1 10 29,1 38 8,9 370,24
2 10 38 46,7 8,7 361,92
3 10 28,2 36,8 8,6 357,76
Ulangan
Volume Sampel 2 (ml) Volume EDTA (ml)
[Mg2+] (mg/l) mengandunng Mg V awal V Akhir V yang terpakai 1 10 10,3 19,7 9,4 237,65 2 10 19,7 29,2 9,5 240,18 3 10 0,5 10,3 9,8 247,76
Reaksi yang terjadi adalah 2Ca2+ + H
3Er→Ca2+ + CaEr- + 3H+
Ca2+ + [H
2(EDTA)]2-→ [Ca(EDTA)]2- + 2H+
[H2(EDTA)]2- + CaEr-→[Ca(EDTA)]2- + H2Er
-H2Er- pada pH 10→HEr2- (biru)
Indikator yang digunakan Eriochrome Black T Perubahan warna: Merah menjadi biru
Contoh Perhitungan:
Perhitungan konsentrasi Ca2+ (ulangan 1 pada sampel 1)
[Ca2+] =
= 370,24
Rerata konsentrasi Ca2+
6,35 Varian = SD2 = 40,3225
Perhitungan konsentrasi Mg2+ (ulangan 1 pada sampel 2)
[Mg2+] = = 237,65 Rerata konsentrasi Mg2+ = 241,86 5,26 Varian = SD2 = 27,6676
Tabel 4 Titrasi kembali untuk penentuan Ca
Ulangan Volume Sampel 1 (ml) Volume Mg (ml) [Ca2+] (mg/l)) V awal V Akhir V yang terpakai 1 10 0 11,4 11,4 376 2 10 1,7 13,4 11,7 364 3 10 13,4 25 11,6 368
Ulangan Volume Sampel 2 (ml) Volume Mg (ml) [Mg2+] (mg/l) V awal V Akhir V yang terpakai 1 10 25 35,8 10,8 0,0789 2 10 35,8 47 11,2 0,0879 3 10 11,4 22 10,6 0,0795
Reaksi yang terjadi: Ca2+ + [H
2(EDTA)]2-→ [Ca(EDTA)]- + 2H+ + [H2(EDTA)]
2-[Ca(EDTA)]- + H
3Er→(CaEr)- + 3H+ + (EDTA)]4- + HEr
2-[H2(EDTA)]2- + Mg2+→[Mg(EDTA)]2- + 2H+
Indikator yang digunakan Eriochrome Black T Perubahan warna: Biru menjadi Merah
Contoh Perhitungan:
Perhitungan konsentrasi Ca2+ (ulangan 1 pada sampel 1)
[Ca2+] =
Rerata konsentrasi Ca2+
= 369,33
6,11 Varian = SD2 = 37,3321
Perhitungan konsentrasi Mg2+ (ulangan 1 pada sampel 2)
[Mg2+] =
= 243,10
Rerata konsentrasi Mg2+
7,42 Varian = SD2 = 55,0564
Contoh Perhitungan: (Uji T Titrasi Berganti terhadap Titrasi Kembali) Konsentrasi Ca2+
Uji T = Rerata1 – Rerata2 x √(n1 x n2/n1 + n2)
Simpangan baku titrasi berganti = 363,31 – 369,33 x √(3 x 3/ 6) 6,35
= 0,4740
T tabel α(0,05) = 4,30 (Harvey 2000) t hitung < t table
Maka metode yang dibandingkan tidak berbeda signifikan Perhitungan Uji F
Contoh Perhitungan: (Uji F Titrasi Berganti terhadap Titrasi Kembali) Konsentrasi Ca2+
Uji F = Varian2/ Varian3
= 40,3224 / 37,3321 = 1,0801
F hitung < F table
Maka metode yang dibandingkan tidak berbeda signifikan Pembahasan
Titrasi kompleksometri yaitu titrasi berdasarkan pembentukan persenyawaan kompleks (ion kompleks atau garam yang sukar mengion). Kompleksometri merupakan jenis titrasi dimana titran dan titrat saling mengkompleks, membentuk hasil berupa kompleks. Titrasi kompleksometri juga dikenal sebagai reaksi yang meliputi reaksi pembentukan ion-ion kompleks ataupun pembentukan molekul netral yang terdisosiasi dalam larutan. Persyaratan mendasar terbentuknya kompleks demikian adalah tingkat kelarutan tinggi (Khopkar 2002). Keunggulan EDTA adalah mudah larut dalam air, dapat diperoleh dalam keadaan murni sehingga EDTA banyak dipakai dalam percobaan kompleksometri, namun karena adanya sejumlah tidak tentu air, sebaiknya EDTA distandardisasikan dahulu misalnya dengan menggunakan larutan kadmium (Harjadi 1993). Percobaan ini EDTA distandardisasi dengan larutan baku CaCO3 dan menggunakan indikator erio-T, titrasi dilakukan dengan tiga kali
ulangan. Konsentrasi rata-rata EDTA dari tiga kali ulangan adalah 0,0104 M dengan %ketelitian 98,83% dan ketepatan 96%. Nilai persen ketelitian dan ketepatan yang tinggi menunjukkan kerja yang dilakukan dengan baik.
Penentuan kadar Mg menggunakan prinsip titrasi langsung. Percobaan ini menggunakan larutan buffer dengan pH 10. Larutan buffer ini berfungsi mencegah terjadinya perubahan pH yang diakibatkan oleh terbentuknya ion H+. Ion H+ selalu terjadi selama titrasi
pada titrasi kompleksometri akibat ion logam yang bereaksi dengan Na2H2Y. Titrasi dilakukan
dengan penambahan indikator erio-T dan larutan EDTA 0,01 M sebagai titran untuk menentukan titik akhir titrasi. Indikator erio-T merupakan salah satu indikator logam range pH 7-11 (Khopkar 2002). Ion magnesium (II) jika direaksikan dengan indikator erio-T (rumus singkat dari H3In dan H2In) akan didapatkan kompleks MgIn- yang berwarna merah.
Kompleks ini kurang stabil jika dibandingkan dengan kompleks Mg-EDTA sehingga dengan demikian jika dalam larutan yang mengandung kompleks MgIn- ditambahkan larutan EDTA,
maka ion magnesium akan segera terikat pada EDTA, sedangkan ion indikator akan lepas dan kembali berwarna biru pada pH 7-11. Konsentrasi EDTA yang digunakan dapat mempengaruhi penentuan kadar Mg, karena besar konsentrasi tersebut sama dengan berat larutan logam tersebut yang nantinya akan berpengaruh di dalam proses perhitungan kadar Mg. Penentuan konsentrasi Mg dengan titrasi langsung yang dilakukan tiga kali ulangan dan titik akhir titrasi ditunjukkan oleh perubahan warna dari merah ke biru. Konsentrasi rata-rata Mg2+ dari ketiga ulangan tersebut adalah 235,12 .
Penentuan kadar Ca menggunakan penambahan larutan Mg-EDTA yang berfungsi sebagai masking agent. masking agent adalah larutan yang dapat menyembunyikan logam akibat kompleks yang kuat. Kompleks yang kuat kadangkala terbentuk dengan erio-T pada titrasi langsung, jika sebaliknya kompleks logam indikator adalah lemah, maka EDTA dapat ditambahkan berlebih dan dititrasi balik dengan larutan standar. Larutan Mg-EDTA ditambah pada larutan Ca2+ akan diperoleh Ca(EDTA)
2 dan Mg2+ bebas yang kemudian dapat
membentuk komplek berwarna dengan erio-T yang dititrasi dengan larutan EDTA, oleh karena itu pada saat penambahan EDTA harus diperhatikan pH larutan maupun masking agent nya. Penambahan larutan Mg-EDTA juga untuk mempertajam warnanya dan indikator erio-T digunakan untuk menunjukkan titik akhir titrasi. Indikator erio-T merupakan salah satu indikator logam range pH 7-11, setelah itu dilakukan penambahan larutan EDTA 0,01 M sampai perubahan warna dari merah ke biru. Konsentrasi EDTA yang digunakan dapat mempengaruhi penentuan kadar Ca, karena besar konsentrasi tersebut sama dengan berat
larutan logam tersebut yang nantinya akan berpengaruh di dalam proses perhitungan kadar Ca. Konsentrasi rata-rata Ca2+ dari ketiga ulangan tersebut adalah 363,31 dengan titrasi
berganti dan 369,33 dengan titrasi kembali.
Ion kalsium dengan erio-T juga akan menghasilkan kompleks CaIn- tetapi kurang
stabil dibandingkan kompleks Mg-EDTA. Ini berarti dalam larutan hanya mengandung ion kalsium (II), maka perubahan warna akan terjadi jauh sebelum titik akhir tercapai. Untuk mengatasi kesulitan ini maka kedalam larutan ditambahkan sedikit ion magnesium (II). Ion ini akan mengikat indikator dan akan bereaksi dengan EDTA jika semua ion kalsium telah bereaksi dengan EDTA. Apabila sampel tidak mengandung Mg, maka Mg-EDTA perlu ditambahkan agar indikator erio-T menghasilkan titik akhir lebih tajam, karena Ca tidak membentuk kelat yang kuat dengan erio-T.
Uji T (uji kenormalan) digunakan untuk menilai apakah data atau hasil penetapan yang diperoleh dapat dikatakan sama atau tidak dengan sebenarnya. Uji F (uji ragam) digunakan untuk mengetahui apabila metode yang dibandingkan memiliki ketelitian/ nilai ragam yang sama atau tidak. Uji T dan uji F dilakukan untuk membandingkan titrasi berganti dengan titrasi kembali. Apabila T hitung < T tabel dan F hitung <F tabel berarti metode yang dibandingkan tidak berbeda signifikan, apabila T hitung > T tabel dan F hitung > F tabel berarti metode yang dibandingkan berbeda signifikan. Nilai dari T tabel dengan α = 0,05 adalah 4,30. Nilai dari F tabel dengan α = 0,05 adalah 9,277. Nilai uji T maupun uji F untuk titrasi langsung terhadap titrasi berganti dan titrasi kembali serta titrasi berganti terhadap titrasi kembali memiliki T hitung < T tabel dan F hitung < F tabel, sehingga metode yang dibandingkan tidak berbeda signifikan untuk setiap konsentrasi Ca2+.
Simpulan
Titrasi kompleksometri yaitu titrasi berdasarkan pembentukan persenyawaan kompleks (ion kompleks atau garam yang sukar mengion). Kompleksometri merupakan jenis titrasi dimana titran dan titrat saling mengkompleks, membentuk hasil berupa kompleks. Indikator yang digunakan titrasi kompleksometri adalah erio-T yang merupakan salah satu indikator logam range pH 7-11 dan digunakan untuk menunjukkan titik akhir titrasi serta menggunakan larutan buffer yang berfungsi mencegah terjadinya perubahan pH yang diakibatkan oleh terbentuknya ion H+. Konsentrasi EDTA yang digunakan dapat
mempengaruhi penentuan kadar Ca dan Mg, karena besar konsentrasi tersebut sama dengan berat larutan logam tersebut yang nantinya akan berpengaruh di dalam proses perhitungan kadar Ca dan Mg. Metode titrasi berganti dan titrasi kembali tidak berdeda signifikan dalam penentuan kadar Ca.
Daftar pustaka
Khopkar. 2002. Konsep Dasar Kimia Analitik. UI Press. Jakarta. Harjadi W.1990. Ilmu Kimia Analitik Dasar. Jakarta : Gramedia.