PRAKTIKUM PEMBUATAN LARUTAN BUFFER ASETAT
FAKULTAS TEKNOLOGI INDUSTRI PERTANIAN
UNIVERSITAS PADJADJARAN
HENDI KUSWENDI (240210160049)
Departemen Teknologi Industri Pangan Universitas Padjadjaran, Jatinangor Jalan Raya Bandung-Sumedang Km. 21, Jatinangor, Sumedang 40600 Telp. (022)
7798844, 779570 Fax. (022) 7795780 Email: hendi@mail.unpad.ac.id
ABSTRACT
Chemistry reaction in labaoatory and food industry many involve buffer
solution. Some chemistry reaction happen in alkali or acid reaction. For this
practical learn about how to make buffer solution with various pH
, be sides we learn too about calculation solution buffer method be based on henderson-hasselbatch method. Acid and salt volume can calculate with henderson-hasselbatch method. In this practical, my grup failed make solution buffer with ph 5,4, from 7,25 ml CH3COOHand
42,75 ml CH3COONa.3H2 O. My grup just make pH 4,77, less pH 0, 77 from literature. Totality, all grup in this practical filed make solution buffer based on loterature, this problem result mistake from practical tool (pH meter), temperature, and technical failed from indivudial student.Keywords:
Buffer, Calibrating,
Henderson-Hasselbatch method,pH, pH meter
PENDAHULUAN
Di alam, fungsi larutan penyangga (Buffer) sangat beragam, misalnya pada kasus air laut. Air laut merupakan campuran berbagai macam larutan garam yang dapat mempengaruhi pH. Namun, pada kenyataannya campuran tersebut dapat mempertahankan harga pH, walaupun air sungai yang mengalir ke laut tidak bersifat basa atau asam.
Reaksi-reaksi kimia di laboratorium dan bidang industri pangan banyak menggunakan larutan penyangga. Reaksi kimia tertentu ada yang harus berlangsung pada suasana asam atau suasana basa. (Fitriana, A dkk, 2014)
Larutan penyangga (buffer) disebut juga larutan penahan adalah larutan yang mempunyai sifat dapat menyangga/menahan pH larutan tersebut dari pengaruh penambahan sedikit asam, sedikit basa atau
pengenceran (Winarti dkk, 2006). Larutan penyangga
merupakan campuran asam lemah dengan basa konjugasinya atau campuran basa lemah dengan asam konjugasinya (Utami, 2011). Pada praktikum ini, dilakukan pembuatan larutan buffer dan pengujian kestabilannya. Larutan buffer yang dibuat dan diuji kestabilannya adalah larutan buffer asetat yang merupakan campuran dari CH3COOH dan CH3COONa. Pada campuran CH3COOH dengan CH3COONa yang membentuk larutan penyangga adalah CH3COOH yang bersifat asam lemah dengan CH3COO– yang berasal dari CH3COONa. CH3COO– adalah basa konjugasi dari CH3COOH (Septiani, 2012).
dilakukan perbandingan antara perhitungan teoritis larutan buffer dengan yang sebenarnya jika diukur dengan alat pH meter.
METODOLOGI
Alat
Alat yang digunakan pada praktikum kali ini diantaranya: beaker glass, magnetic stirrer, labu ukur 1 L, pH meter, pipet tetes, ruang asam.
Bahan
Bahan yang digunakan pada praktikum kali ini diantaranya: Aquades, CH3COOH, CH3COONa.3H2O
Prosedur
Pembuatan Larutan A
Pertama dimasukan sedikit akuades ke dalam labu ukur 1 L, dipipet 12 ml asam asetat glasial, tepatkan dengan akuades hingga tanda tera, kemudian dihomogenkan.
Pembuatan Larutan B
Pertama disiapkan 27 gr CH3COONa.3H2O, dilarutkan dengan akuades, selanjutnya dimasukan kedalam labu ukur 1 liter, tepatkan dengan akuades dan di homogenkan.
Pembuatan Buffer Acetat
Pertama, lautan A dan B yang sudah di buat di masukan kedalam beaker glass sebanyak yang sudah ditentukan, kemudian di stirrer, larutan A dan B
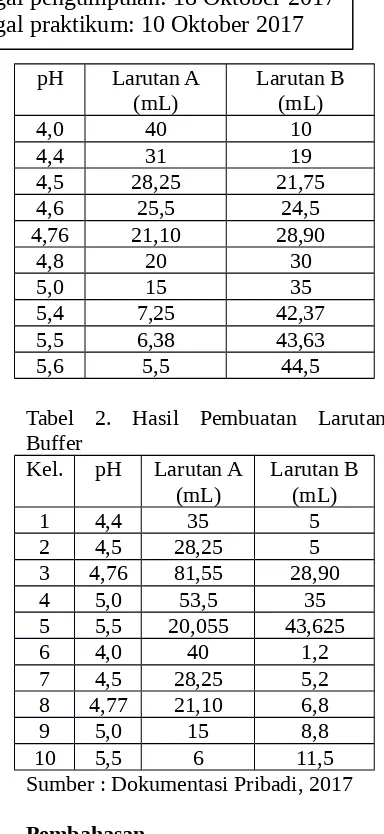
Berdasarkan hasil praktikum, didapatkan tabulasi data sebagai
Sumber : Dokumentasi Pribadi, 2017
Pembahasan
Dalam sistem biologis, buffer sangat diperlukan untuk mempertahankan kestabilan metabolisme sistem tersebut, Pasangan asam basa konjugasi (buffer) asam karbonat, H2 CO3 yaitu HCO3-, sedangkan H2PO4 yaitu HPO4-2, keduanya berfungsi dalam membantu menjaga pH darah selalu konstan. Perubahan pH yang kecil saja dapat merusak sistem metabolisme. (Fitriana A dkk, 2014). Hal ini berhubungan dengan enzim yang terdapat pada sistem biologis, dimana setiap enzim memiliki pH optimum dan pH diluar optimum akan berakibat buruk terhadap penurunan kecepatan katalitik dan pada akhirnya mempengaruhi sistem tersebut secara keseluruhan. Pada sistem biologis manusia terdapat dua sistem buffer yaitu buffer fosfat dan buffer bicarbonate. Buffer bicarbonate berperan dalam menjaga kestabilan pH pada sistem sodium asetat(CH3COONa). Sebelum membuat larutan buffer, terlebih dahulu menghitung berapa gram garam (asam/basa konjugatnya) dan berapa mililiter larutan asam/basa lemah yang diperlukan untuk membuat
larutan
larutan buffer dengan pH 5,4. Dari
hasil perhitungan, diketahui untuk
membuat larutan buffer asetat
dengan pH 5,4 sebanyak 50 ml
dibutuhkan
7,25 ml larutan CH3COOH dan 42,75 ml larutan CH3COONa.3H2 O. Selanjutnya larutan buffer asetat dibuat dan diukur pH nya dengan menggunakan pH-meter untuk memastikan pH larutan buffer tersebut. Namun, pada kenyataan dilaboratorium kelompok kami hanya dapat membuat larutan buffer asetat dengan pH 4,77. pH yang terbentuk berbeda 0,77 dengan tinjauan pustaka. Secara umum, semua kelompok mendapatkan hasil yang tidak sesuai dengan tinjauan pustaka.Hal ini kemungkinan besar adalah Jadi ujung pH meter harus berada pada pH netral, yaitu 7. Maka, diperlukan sebuah kalibrasi, kalibrasi biasanya dilakukan dengan beberapa cara, bisa dengan kalibrasi satu titik, dua titik, atau multi titik. kalibrasi dengan satu titik, yaitu pada sekitar pH yang diukur, Jika sistem nertal dikalibrasi dengan dengan buffer standar pH 7,00, untuk asam dengan ph 4,01, dan basa dengan 10,01. Sedangkan dengan teknik dua titik, apabila sistem bersifat basa digunakan 2 buffer standar yaitu pH 7,00 dan 10,01, dan jika asam berupa pH 4,01 dan 7,00, kalibrasi dengan teknik 2 titik ini lebih di utamakan. Kalibrasi dengan tiga titik dilakukan dengan tiga buffer standar. (Tahir, 2008).
kenyataannya angka sesekali berubah sehingga menimbulkan keraguan.
Prinsip kerja utama pH meter adalah terletak pada sensor probe berupa elektrode kaca (glass electrode) dengan jalan mengukur jumlah ion H3O+ di dalam larutan. Ujung elektrode kaca adalah lapisan kaca setebal 0,1 mm yang berbentuk bulat (bulb). Bulb ini dipasangkan dengan silinder kaca non-konduktor atau plastik memanjang, yang selanjutnya diisi dengan larutan HCl (0,1 mol/dm3). Di dalam larutan HCl, terendam sebuah kawat elektrode panjang berbahan perak yang pada permukaannya terbentuk senyawa setimbang AgCl. Konstannya jumlah
Selain faktor alat, ketidaksesuaian hasil praktikum juga dapat disebabkan akibat adanya perbedaan temperatur, temperatur berpengaruh terhadap larutan buffer. Koltfff dan Takelenburg menyatakan istilah koefisien temperatur pH yaitu perubahan pH akibat pengaruh temperatur. pH buffer asetat akan meningkat dengan naiknya temperatur sedangakan buffer borat-natrium sebaliknya akan mengalami penurunan pH. (Martin, 1990) .
Untuk mengetahui nilai pH pada larutan buffer dapat juga dilakukan melalui menggunakan perhitungan rumus. Perhitungan nilai pH larutan
buffer disesuaikan dengan komponen penyusun larutan buffer tersebut berdasarkan persamaan Henderson-Hasselbatch. Larutan buffer yang terdiri atas campuran asam lemah dengan
Ca = konsentrasi asam lemah Cg = konsentrasi garamnya Ka = tetapan ionisasi asamlemah
Larutan buffer yang terdiri atas campuran basa lemah dengan garamnya (larutannya akan selalu mempunyai pH > 7), digunakan rumus:
[OH-] = K
b . Cb/Cg pOH = pKb + log Cg/Cb dimana:
Cb = konsentrasi basa lemah Cg = konsentrasi garamnya Kb = tetapan ionisasi basa lemah
Selain untuk mengetahui nilai pH, rumus diatas juga dapat digunakan dalam penentuan banyaknya asam lemah dan garam atau basa lemah dan garam yang diperlukan untuk membuat larutan buffer pada pH tertentu.
.
KESIMPULAN
ataupun karena bahan yang digunakan kualitasnya sudah tidak baik atau sudah rusak.
DAFTAR PUSTAKA
Fitriana, A. 2014.dkk. Kimia untuk SMA XI.CV.HaKa MJ.Solo Martin, A., dkk. 1990. Farmasi Fisika,
Edisi III.UI Press. Jakarta
Petr, V.2004.The Glass pH Electrode.available at: https://www.googlw.co.id/amp/s/a rtikel-teknologi.com/prinsip-kerja-ph-meter/amp/ (diakses pada 17 Oktober 2017.pukul 20.16)
Tahir, I. 2014.Arti Penting Kalobrasi Pada Proses Pengukuran Analitik:Aplikasi Pada Penggunaan pH Meter dan Spektrometer UV-Vis.available at:
https://www.researchgate.net/Publ
ication/237627554_ ARTI
-_Penting_Kalobrasi_Pada_Roses_ Pengukuran_Analitik:Aplikasi_Pa da_Penggunaan_Phmeter_Dan_S
pektrometer Uv-Vis (Diakses
pada tanggal 17 Oktober 2017, pukul 20.00)