Penyusun :
Fransiska Maria C., S. Farm., Apt.
Ika Puspita Dewi, S.Farm., Apt.
Diana Holidah, M.Farm., Apt.
Laboratorium Farmakologi & Toksikologi
Bagian Farmasi Klinik
Fakultas Farmasi
Universitas Jember
2012
PETUNJUK PRAKTIKUM
TOKSIKOLOGI
BAB I PENDAHULUAN I.1.TUJUAN
Mahasiswa mampu mengenali lingkup, tata tertib, tata cara pembuatan laporan, dan sistem penilaian praktikum toksikologi.
I.2. LINGKUP PRAKTIKUM
Praktikum toksikologi merupakan bagian dari mata pelajaran toksikologi. Karena itu, praktikum ini diberikan dengan tujuan agar para mahasiswa mampu lebih memahami berbagai teori dasar toksikologi yang telah mereka peroleh, di samping mampu memahami asas umum uji toksikologi dan menjalankan beberapa teknik uji toksikologi.
Praktikum ini erat kaitannya dengan pokok bahasan faktor-faktor yang mempengaruhi ketoksikan, tolok ukur ketoksikan (kualitatif dan kuantitatif), terapi antidot, dan uji toksikologi (tak khas dan khas) dalam mata kuliah toksikologi. Untuk itu, para mahasiswa dilatih menjalankan praktek beberapa lingkup uji toksikologi, yakni uji ketoksikan akut, uji ketoksikan subkronis, uji keteratogenikan, dan uji daya antidot.
I.3. TATA TERTIB
Agar para mahasiswa dapat menjalankan praktikum toksikologi sesuai dengan tujuan yang dicanangkan, seharusnya para mahasiswa memperhatikan tata tertib berikut:
a. Sepuluh menit sebelum waktu praktikum dimulai, mahasiswa sudah berada di tempat praktikum untuk absensi dan mempersiapkan peralatan yang diperlukan. b. Mahasiswa harus mengenakan jas praktikum
c. Mahasiswa harus manyerahkan tugas atau laporan praktikum sebelumnya.
d. Mahasiswa harus mendengarkan dan mengikuti petunjuk yang diberikan oleh pembimbing.
e. Mahasiswa menjalankan praktikum dengan tenang, hati-hati, dan penuh perhatian. f. Mahasiswa tidak meninggalkan praktikum tanpa seijin pembimbing.
g. Dilarang makan dan minum di dalam laboratorium
h. Setelah praktikum selesai, mahasiswa harus membersihkan peralatan yang digunakan dan mengembalikan ke tempat semula, serta mengesahkan laporan sementara kepada pembimbing.
I.4. TATA CARA PEMBUATAN LAPORAN
Laporan praktikum toksikologi dibuat secara tertulis, mengikuti urutan tata tulis sebagai berikut: (1) pendahuluan yang berisi tujuan dan landasan teori percobaan terkait; (2) tata cara percobaan yang berisi bahan dan alat serta cara kerja; (3) analisis hasil yang berisi cara analisis kualitatif dan kuantitatif terhadap data tolok ukur kualitatif dan kuantitatif yang diperoleh, serta analisis statistik yang digunakan; (4) hasil dan pembahasan yang berisi ulasan tentang hasil percobaan yang diperoleh bila dibandingkan dengan hasil teoritis atau laporan sejenis, kesulitan yang dialami selama melakukan percobaaan, saran-saran untuk memperbaiki kesalahan atau mengatasi kesulitan yang dihadapi dan (5)kesimpulan.
Laporan tertulis tersebut diberi sampul yang berisi judul percobaan, golongan dan nama serta nomor mahasiswa anggota kelompok.
I.5. SISTEM PENILAIAN
Nilai praktikum toksikologi terdiri dari nilai tes atau tugas prapraktikum (25%), laporan atau diskusi hasil praktikum (35%), dan tes atau diskusi pascapraktikum (responsi) (40%).
BAB II
TATA CARA PENGAMBILAN SAMPEL BIOLOGIS
II.1.TUJUAN
Mahasiswa mengenal tata cara pengambilan sampel biologis.
II.2 PENDAHULUAN
Cuplikan hayati yang sering diambil dalam uji toksikologi meliputi darah, urin, dan berbagai organ tubuh seperti lambung, usus, hati, limpa, pankreas, ginjal, uterus, ovarium, testis, jantung, paru, tiroid, dan otak.
II.2.1 Pengambilan darah
Dilakukan dengan cara sebagai berikut: a. Pegang mencit
b. Ambil pipa kapiler dan siapkan tabung penampung darah berheparin.
c. Tusukkan kapiler perlahan-lahan pada vena optalmikus yang terdapat di sudut mata. d. Putar kapiler perlahan-lahan sampai darah keluar.
e. Tampung darah yarg keluar pada tabung.
f. Setelah volume darah yang diperoleh dianggap cukup, cabut pipa kapiler dan bersihkan sisa darah yang terdapat di mata dengan kapas steril.
g. Simpan darah di almari es 20˚C, sampai penetapan dikerjakan.
II.2.2 Pengorbanan hewan uji
Sebelum pengambilan berbagai organ tubuh, hewan uji biasanya dikorbankan terlebih dahulu. Ada beberapa cara pengorbanan mencit, yakni cara kimia (eter atau karbondioksida dalam wadah khusus, atau suntikan pentobarbital Na 135-180 mg/kg BB) dan cara fisik (dislokasi leher). Pengorbanan mencit cara fisik, dapat dikerjakan sebagai berikut :
a. Pegang mencit
b. Tempatkan suatu penahan (misal pensil) pada tengkuk mencit, seperti pada gambar c. Tarik ekor mencit dengan kuat sampai tulang leher terasa terlepas.
Cara fisik lain yang sering dikerjakan ialah dengan mengganti fungsi pensil dengan tangan.
II.2.3 Pengambilan organ
Dilakukan dengan cara berikut:
a. Korbankan mencit dengan cara fisik.
b. Tempatkan mencit pada meja atau tempat bedah/fiksasi.
c. Terlentangkan mencit, rentangkan keempat kakinya dan tancap dengan jarum. d. Basahi dengan air di daerah di sekitar perut.
e. Angkat kulit perut dengan pinset, kemudian potong dengan gunting tepat di bawah pinset.
f. Lanjutkan pemotongan ke arah kiri dan kanan, serong ke atas menuju pangkal kaki depan, dan serong ke bawah menuju pangkal kaki belakang. Dengan cara demikian, sekarang terlihat isi perut dan rongga dada, meliputi usus, hati, dan diafragma.
g. Selanjutnya, angkat seluruh bagian usus dan rentangkan. Potong lambung, duodenum, jejenum, dan ileum. Bersihkan isi lambung dan usus tersebut, kemudian masukkan ke dalam pot yang berisi formalin 10%.
h. Berikutnya buka rongga dada, pisahkan hati yang melekat. Balikkan hati dan potong pada jaringan ikatnya. Bersihkan dengan air dan masukkan pot berformalin 10%. i. Setelah hati terambil, akan terlihat limfa, pankreas, dan ginjal. Potong limfa dan
pankreas yang melekat di bawah limfa. Ambil pula ginjal yang menyerupai biji kopi. Uterus, ovarium atau testis dapat diambil dari bawah perut. Bersihkan dan masukkan pot berformalin.
j. Dalam rongga dada terdapat jantung dan paru di bawah tulang rusuk. Buka tulang rusuk, potong jantung dan ambil parunya, masukkan ke dalam pot berformalin. k. Berikutnya buka kulit di atas rongga dada sampai pangkal trakea. Kelenjar tiroid
terlekat pada pangkal trakea tersebut (jumlah dua, warna lebih bening). Pengambilan tiroid dapat dilakukan dengan memotong pangkal trakea yang mengandung tiroid, atau kelenjar tiroidnya saja. Bungkus tiroid dengan kertas perkamen sebelum dimasukkan ke dalam pot berformalin.
l. Terakhir pengambilan otak. Untuk itu, buka kulit kepala, kemudian potong pangkal lehernya sampai terlihat medula spinalisnya. Lanjutkan pemotongan pada garis tengah batok kepala. Ambil tulang tengkorak ke arah kiri dan kanan. Segera terlihat otak besar dan kecil berwarna putih di bawah tulang tengkorak. Dengan hati-hati ambil keseluruhan otak dari rongga kepala, masukkan ke dalam pot berformalin.
BAB III
ASAS UMUM UJI TOKSIKOLOGI III. l. TUJUAN
Mahasiswa mampu memahami jenis uji toksikologi dan berbagai faktor yang dapat mempengaruhi kesahihan (validitas) uji toksikologi.
III. 2. PENDAHULUAN
Untuk keperluan penapisan spektrum efek toksik suatu senyawa, diperlukan serangkaian uji toksikologi. Dan tentunya agar masing-masing jenis uji toksikologi yang dikerjakan kesahihannya dapat diandalkan, perlu dilakukan pengendalian terhadap aneka faktor yang dapat mempengaruhi kesahihan itu. Karena itu, sebelum menjalankan praktek uji toksikologi, selayaknya para mahasiswa paham terlebih dahulu terhadap aneka jenis uji toksikologi dan berbagai faktor yang mungkin dapat mempengaruhi kesahihan hasil ujinya.
Pemahaman terhadap jenis uji toksikologi, berguna sekali untuk mendapatkan pengetahuan tentang sasaran dan luaran masing-masing jenis uji, dan pemahaman terhadap aneka ragam faktor yang mungkin mempengaruhi uji toksikologi bermanfaat sekali sebagai sumber pengetahuan tentang berbagai ubahan yang perlu diperhatikan dalam merancang dan menjalankan suatu uji toksikologi, utamanya berkaitan dengan upaya mengecilkan berbagai kesalahan yang mungkin timbul atau membesarkan kesahihan hasil uji.
Uraian berikut akan memberikan gambaran kepada para mahasiswa tentang penggolongan uji toksikologi serta berbagai faktor yang perlu diperhatikan sebelum menjalankan uji toksikologi.
III. 3. PENGGOLONGAN UJI TOKSIKOLOGI
Uji toksikologi dibagi menjadi dua golongan, yakni uji ketoksikan tak khas dan uji ketoksikan khas.
Dimaksud dengan uji ketoksikan tak khas ialah uji toksikologi yang dirancang untuk mengevaluasi keseluruhan atau spektrum efek toksik suatu senyawa pada aneka ragam jenis hewan uji. Termasuk dalam uji ketoksikan tak khas meliputi uji ketoksikan akut, subkronis, dan kronis. Beda antara ketiga jenis uji tersebut terletak pada sifat dan lama pemberian atau pemejanan senyawa uji, serta sasaran dan luaran ujinya.
Uji ketoksikan akut, dikerjakan untuk menemukan potensi ketoksikan akut (kisaran
dosis letal atau toksik) suatu senyawa yang diberikan atau dipejankan kepada subjek uji dengan takaran atau dosis tunggal. Selain itu, uji ini juga digunakan untuk menemukan spektrum efek toksik senyawa atas beberapa fungsi vital tubuh, utamanya yang berkaitan dengan penyebab kematian seperti gerak, perilaku, dan pernapasan.
Berbeda dengan uji ketoksikan akut, uji ketoksikan subkronis dan kronis, pada dasarnya dikerjakan untuk menentukan spektrum efek toksik senyawa atas semua organ dan kelenjar tubuh, setelah pemberian takaran atau dosis berulang sampai tiga bulan (subkronis), dan lebih dari tiga bulan atau pada dasarnya sepanjang umur subyek uji (kronis). Selain itu, kedua uji ini juga untuk menentukan apakah spektrum efek toksik yang timbul berkerabat dengan takaran atau dosis senyawa uji, dan sejauh mana ketimbalbalikan (reversibilitas) spektrum efek toksik tersebut.
Dimaksud dengan uji ketoksikan khas ialah uji toksikologi yang dirancang untuk mengevaluasi secara rinci efek toksik yang khas suatu senyawa atas fungsi organ atau kelenjar tertentu pada aneka ragam subyek atau hewan uji. Termasuk dalam uji ketoksikan khas ini meliputi uji potensiasi, uji reproduksi, uji kemutagenikan, uji kekarsinogenikan, uji kulit dan mata, serta uji perilaku.
Uji potensiasi dikerjakan untuk menentukan kemungkinan peningkatan efek toksik
suatu senyawa dengan hadirnya senyawa lain. Misalnya untuk mengevaluasi ketoksikan sediaan obat kombinasi. I
Uji reproduksi, dibagi lagi menjadi tiga segmen, yakni uji kesuburan (fertilitas), uji
keteratogenikan, dan uji pranatal serta pascanatal. Pada dasarnya, uji reproduksi ini dikerjakan untuk menentukan apakah suatu senyawa dapat mempengaruhi kapasitas reproduksi subyek atau hewan uji tertentu, meliputi efek atas kesuburan, efek embriotoksik, dan efek teratogenik (cacat bawaan) sampai generasi ketiga subyek uji.
Uji kemutagenikan dikerjakan untuk menentukan pengaruh suatu senyawa atas
sistem kode genetik. Dengan demikian, uji ini dapat digunakan untuk mengevaluasi kemungkinan suatu senyawa menyebabkan perubahan, luka, atau cacat hayati yang sifatnya menurun.
Uji kekarsinogenikan dikerjakan untuk menentukan kemampuan suatu senyawa
dalam menimbulkan tumor atau kanker pada aneka ragam jenis hewan uji, baik jangka pendek atau jangka panjang.
Uji kulit dan mata, pada dasarnya dikerjakan untuk menentukan pengaruh setempat
suatu senyawa bila bersentuhan langsung dengan kulit atau mata. Efek toksik setempat tersebut, dapat berupa iritasi primer, korosi, sensitisasi kutan, fototoksis, dan fotoalergi. Karena itu, termasuk uji kulit dan mata meliputi uji iritasi primer kulit, uji sensitisasi kutan, dan uji fototoksik serta uji fotoalergi.
Uji perilaku, dikerjakan untuk menentukan pengaruh suatu senyawa atas keaktifan
lokomotor subyek atau hewan uji tertentu. Untuk itu terdapat beberapa jenis uji, yakni uji roda berputar, uji lapangan terbuka, uji sangkar hewan piaraan, uji sangkar rumit, dan uji khas. Pada dasarnya, semua jenis uji perilaku ini, bermanfaat guna mengetahui pengaruh atau efek toksik suatu senyawa atas sistem syaraf pusat atau otak.
Hasil yang diperoleh dari serangkaian uji toksikologi, baik tak khas maupun khas, selanjutnya secara keseluruhan bermanfaat sebagai dasar evaluasi keamanan praklinik, dan lebih jauh untuk memperkirakan resiko penggunaan suatu senyawa oleh atau pemejanannya pada diri manusia. Karena itu, hasil uji toksikologi harus memiliki kesahihan yang tinggi. Upaya ke arah itu dapat dicapai, utamanya bila para mahasiswa mampu memahami aneka ragam faktor atau ubahan yang dapat mempengaruhi kesahihan uji toksikologi.
III. 4. ANEKA RAGAM FAKTOR PENENTU KESAHIHAN UJI TOKSIKOLOGI
Dalam menjalankan uji toksikologi apa pun, terlibat beberapa kegiatan utama, yakni memberikan atau memejankan sediaan bahan/senyawa uji pada beberapa kelompok subyek uji tertentu melalui jalur pemberian tertentu, mengamati langsung perubahan patologis dan atau mengambil cuplikan hayati guna mendapatkan data tolok ukur kualitatif dan kuantitatif, menganalisis atau mengolah kedua jenis data tersebut guna memperoleh hasil uji yang berupa informasi tentang ketoksikan sedian uji, mengevaluasi hasil uji guna memperoleh
kesimpulan yang berupa perkiraan batas aman dan risiko penggunaan atau pemejanannya pada manusia.
Bila disimak daur atau sistem uji toksikologi di atas, terlihat ada beberapa komponen sistem yang saling terkait dalam mendukung keberhasilan uji toksikologi. Dengan perkataan lain, keabsahan hasil uji toksikologi, ditentukan oleh kecermatan dalam mempersiapkan dan menerapkan masing-masing komponen itu. Bila demikian, dapat dinyatakan bahwa beberapa komponen sistem uji toksikologi, utamanya aneka tata cara yang terkait dengan penyiapan dan penerapan rancangan uji, sediaan uji, subyek uji, pengamatan dan pengambilan cuplikan hayati, analisis data, evaluasi hasil uji, dan penarikan kesimpulan, merupakan faktor penentu kesahihan uji toksikologi.
III. 4. 1. Rancangan uji
Secara keseluruhan, rancangan uji merupakan faktor yang sangat menentukan kesahihan uji toksikologi. Karena keberhasilan uji toksikologi, tak akan lepas dan ketepatan pemilihan dan penerapan metodologi, sesuai dengan tujuan masing-masing jenis uji toksikologi yang telah ditetapkan. Dan dalam memilih metodologi, seharusnya telah dipertimbangkan berbagai segi yang berkaitan dengan pengelompokan subyek uji, pemilihan subyek dan penentuan jumlahnya, keterubahan (variabilitas) antar subyek, keterubahan dalam subyek, keterubahan waktu, dan keterubahan karena perlakuan. Selain itu, pilihan metode analisis statistik yang akan diterapkan pun, sebenarnya telah melekat pada rancangan uji yang digunakan. Dengan demikian, kekeliruan dalam memilih dan menerapkan suatu rancangan uji, jelas besar sekali pengaruhnya terhadap kesahihan uji toksikologi yang dikerjakan.
III. 4. 2. Faktor sediaan uji
Sebelum sediaan uji diberikan atau dipejankan pada subyek uji tertentu, tentunya timbul beberapa pertanyaan yang terkait dengan bentuk sediaan, stok sediaan, jalur pemberian, besar takaran atau dosis, volume pemberian, kekerapan dan lama pemberian, serta saat pemberian.
Untuk keperluan uji toksikologi, bentuk sediaan uji sedapat mungkin diusahakan sebagai larutan, agar dapat diberikan atau dipejankan melalui semua jenis jalur pemberian. Penggunaan suspensi atau emulsi, sebaiknya dihindari, kecuali bila pemberiannya melalui oral.
Untuk keperluan tersebut di atas, informasi tentang kelarutan bahan uji, akan membantu sekali dalam proses menyiapkan bentuk sediaan uji. Bila bahan uji larut dalam air, buat sediaan larutan dalam air atau garam fisiologis. Bila kelarutan bahan uji dalam air terbatas, buat sediaan larutan dalam minyak nabati (misal minyak jagung) atau dalam pelarut organik (misal propilenglikol 40-50% dalam air atau garam fisiologis). Dan, bila bahan uji tidak larut dalam air, buat sediaan suspensi dalam tragakan, CMC, atau tilosa 0,1 -1% (untuk pemberian oral). Cara lain yang dapat disarankan, tingkatkan kelarutan bahan uji dengan suatu polimer, biasanya polivinilpirolidon (PVP) BM 10.000-30.000
Utamanya untuk bahan uji yang berupa obat tradisional, cara peningkatan kelarutan di atas, dapat dikerjakan sebagai berikut (Chung dkk, 1985):
a. Ekstrak tak larut dalam air, larutkan dalam metanol, etanol, atau aseton (misal 10 mg ekstrak dalam 1000 ml pelarut).
b. Larutkan PVP lebih kurang 4-5 kali berat ekstrak dalam pelarut yang digunakan pada butir a sesedikit mungkin.
c. Campur hasil pada butir a dan butir b di atas.
d. Ambil pelarutnya dengan cara evaporasi dengan alat evaporator. Pertama kali dengan kecepatan putaran yang lambat, berikutnya dengan kecepatan penuh. Hasil akhir butir d ini, merupakan produk yang larut dalam air.
Untuk bahan uji yang berupa zat kimia murni, biasanya kelarutannya dalam air dapat ditingkatkan dengan melarutkannya dalam larutan PVP-30.000 5-10%. Penyiapan bentuk sediaan bahan uji seoptimal mungkin, utamanya bermanfaat dalam upaya memelihara kehomogenan sediaan uji, sehingga besar masukan bahan uji pada subyek uji, dapat selalu dipertahankan keajegannya.
Penyiapan stok sediaan uji, juga perlu dipertimbangkan masak-masak, utamanya untuk keperluan uji toksikologi yang berjangka panjang. Idealnya, stok sediaan uji dibuat sekaligus, secukupnya untuk perlakuan selama masa penelitian berlangsung, agar keseragaman besar dosis yang diberikan pada subyek uji, dapat selalu dipertahankan. Untuk itu setelah digunakan, stok sediaan perlu disimpan dalam almari pendingin -20˚C. Namun perlu dicatat, pendinginan hanya mencegah pembusukan dan timbulnya jamur, tetapi tidak dapat menjamin tercegahnya peruraian zat aktif yang terkandung di dalam sediaan. Karena itu, kecuali stabilitas zat akfif dalam sediaan uji terkait untuk masa penelitian tertentu telah ditegaskan, stok sediaan uji lebih baik selalu dibuat baru.
Pilihan jalur pemberian, juga perlu diperhatikan. Dalam hal ini, yang perlu diingat ialah bahwa hasil uji toksikologi akan dimanfaatkan untuk memperkirakan keamanan dan risiko penggunaan bahan uji pada diri manusia. Karena itu, jalur pemberian terpilih, harus melibatkan jalur pemberian sediaan uji yang disarankan untuk manusia. Selain itu, yang lebih penting, teknik pemberiannya jangan sampai keliru. Perubahan patologis atau kematian hewan uji, dapat terjadi karena teknik pemberian yang keliru, sehingga memungkinkan terjadinya kesalahan dalam menginterpretasi dan mengevaluasi hasil uji.
Pada umumnya, besar takaran atau dosis yang diberikan pada subyek atau hewan uji dalam uji toksikologi melibatkan tiga peringkat dosis atau lebih, yang berkisar dari dosis terendah yang sama sekali tidak menimbulkan efek toksik yang berarti, sampai dengan dosis tertinggi yang melibatkan efek toksik yang berarti pada sekelompok hewan uji. Dan khusus untuk obat, dosis terendah yang diberikan, sebaiknya meliputi dosis terapi manusia. Hal ini dapat diperhatikan dengan beberapa cara. Pertama, berdasarkan harga ED50, senyawa uji
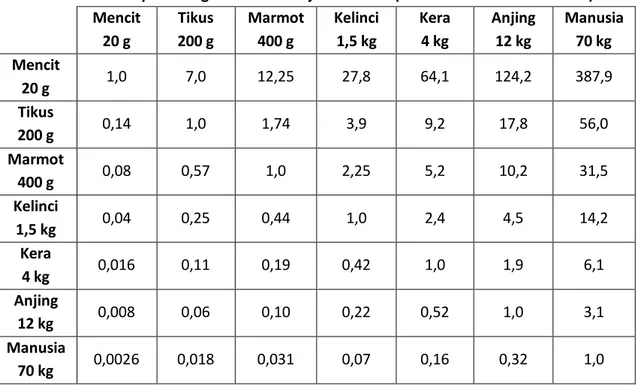
dari hasil uji farmakologi dengan hewan uji dan jalur pemberian yang sama. Kedua, berdasarkan harga LD, senyawa uji pada hewan uji yang sama (5-10% LD,50 intravena). Ketiga, berdasarkan kelipatan dosis yang disarankan untuk digunakan pada manusia (biasanya 2-10 kali dosis manusia). Dan keempat, mengikuti tabel konversi perhitungan dosis antar jenis hewan, berdasarkan nisbah (ratio) luas permukaan badan mereka, seperti terlihat pada tabel III.1.
Tabel III.1. Konversi perhitungan dosis antar jenis hewan (Laurence & Bacharach 1964) Mencit 20 g Tikus 200 g Marmot 400 g Kelinci 1,5 kg Kera 4 kg Anjing 12 kg Manusia 70 kg Mencit 20 g 1,0 7,0 12,25 27,8 64,1 124,2 387,9 Tikus 200 g 0,14 1,0 1,74 3,9 9,2 17,8 56,0 Marmot 400 g 0,08 0,57 1,0 2,25 5,2 10,2 31,5 Kelinci 1,5 kg 0,04 0,25 0,44 1,0 2,4 4,5 14,2 Kera 4 kg 0,016 0,11 0,19 0,42 1,0 1,9 6,1 Anjing 12 kg 0,008 0,06 0,10 0,22 0,52 1,0 3,1 Manusia 70 kg 0,0026 0,018 0,031 0,07 0,16 0,32 1,0 Contoh perhitungan :
Dosis terapi parasetamol untuk orang berat 70 kg adalah 500 mg. Berapa perkiraan untuk tikus?
Jawab :
Lihal label III.1.,
konversi dosis manusia (70 kg) ke tikus (200 g) = 0, 018
Dosis terapi parasetamol-tikus (200 g) = 0,018 X 500 mg = 9 mg/200 g BB = 45 mg/kg BB
Perlu dicatat, besar takaran dosis yang diberikan, hendaknya selalu dikaitkan dengan batas volume maksimum yang dapat diterima oleh subyek atau hewan uji.
Tabel III.2. Volume maksimal larutan sediaan uji yang dapat diberikan pada beberapa hewan uji (Ritschel, 1974)
Jenis hewan uji Volume maksimal (ml) sesuai jalur pemberian
i.v i.m i.p s.c p.o
Mencit (20-30 g) 0,5 0,05 1,0 0,5 – 1,0 1,0 Tikus (100 g) 1,0 0,1 2 – 5 2 – 5 5,0 Hamster (50 g) - 0,1 1 – 2 2,5 2,5 Marmot (250 g) - 0,25 2 – 5 5,0 10,0 Kelinci (2,5 kg) 5 – 10 0,5 10 – 20 5 – 10 20,0 Kucing (3 kg) 5 – 10 1,0 10 – 20 5 – 10 50,0 Anjing (5 kg) 10 - 20 5,0 20 - 50 10,0 100,0
Pada dasarnya, volume pemberian disarankan tidak melebihi setengah kali volume maksimal yang boleh diberikan pada hewan uji, utamanya untuk pemberian berulang dalam jangka panjang seperti pada uji ketoksikan subkronis, kronis, dan kekarsinogenikan. Bahkan untuk mencit dan tikus, volume pemberian disarankan tidak melebihi 0,005 ml/g BB. Hal ini didasarkan pada perkiraan bahwa harga LD50 air dan garam fisiologis, kurang lebih
berturut-turut 0,04 ml/g dan 0,068 ml/g BB. Dan yang lebih penting, bila pemberian sediaan uji melalui jalur oral, volume yang diberikan pada sekelompok hewan uji sama besarnya.Dalam hal ini, agar dosis yang diberikan besarnya sama, buatlah variasi kadar sediaan uji (keseragaman dosis disesuaikan dengan variasi kadar sediaan uji). Bila pemberian sediaan uji melalui jalur parenteral, volume yang diberikan pada sekelompok hewan uji dapat bervariasi sesuai dengan berat badan masing-masing. Dalam hal ini, kadar sediaan uji dibuat sama (keseragaman dosis disesuaikan dengan variasi volume pemberian). Tabel III.2. memuat batas volume maksimum yang boleh diberikan pada hewan uji.
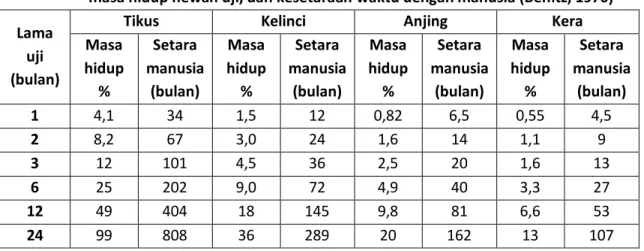
Kekerapan, lama, dan saat pemberian sediaan uji juga perlu dipertimbangkan masak-masak. Untuk keperluan uji toksikologi, pada umumnya sediaan uji diberikan dengan kekerapan sekali sehari, kecuali untuk kasus-kasus tertentu dapat diberikan lebih dari sekali sehari. Lama pemberian sediaan uji, disesuaikan dengan masing-masing jenis uji toksikologi. Namun, perlu diperhatikan bahwa lama pemberian sediaan uji pada hewan uji ada kaitannya dengan lama perkiraan penggunaannya pada manusia. Tabel III.3. memuat kekerabatan antara lama pemberian, masa hidup hewan dan kesetaraannya dengan manusia. Selain itu perbedaan kekerapan dan lama pemberian dapat mengakibatkan perbedaan wujud efek toksik yang ditimbulkan. Demikian pula halnya dengan saat pemberian, juga berpengaruh terhadap wujud efek toksik yang ditimbulkan oleh sediaan uji. Hal ini utamanya berkaitan dengan irama diurnal, irama sirkadian dan kerentanan suatu organ terhadap ketoksikan senyawa uji. Karena itu, pemberian sediaan uji seharusnya dilakukan pada waktu yang sama (berkaitan dengan jam biologis, pagi, siang, sore, malam) atau tepat pada masa kritis perkembangan organ (misalnya stadium organogenesis masa bunting, dalam uji keteratogenikan).
Tabel III. 3. Kekerabatan waktu antara pemberian/pemejanan senyawa pada hewan uji, masa hidup hewan uji, dan kesetaraan waktu dengan manusia (Benitz, 1970) Lama
uji (bulan)
Tikus Kelinci Anjing Kera
Masa hidup % Setara manusia (bulan) Masa hidup % Setara manusia (bulan) Masa hidup % Setara manusia (bulan) Masa hidup % Setara manusia (bulan) 1 4,1 34 1,5 12 0,82 6,5 0,55 4,5 2 8,2 67 3,0 24 1,6 14 1,1 9 3 12 101 4,5 36 2,5 20 1,6 13 6 25 202 9,0 72 4,9 40 3,3 27 12 49 404 18 145 9,8 81 6,6 53 24 99 808 36 289 20 162 13 107
III. 4. 3. Faktor subyek uji
Subyek uji yang digunakan untuk uji toksikologi adalah hewan uji sehat. Meskipun demikian, hasil ujinya tidak akan dimanfaatkan untuk mengevaluasi ketoksikan senyawa uji pada hewan uji yang bersangkutan, melainkan untuk memperkirakan batas aman dan resiko penggunaan atau pemejanan pada manusia. Selain itu, analisis hasil uji toksikologi, melibatkan analisis statistik, sehingga untuk memenuhi kebermaknaan statistik tertentu, diperlukan jumlah hewan uji yang memadai. Dan tentunya, masing-masing hewan uji memiliki keterbatasan dalam hal penerimaan terhadap masukan senyawa uji. Bila demikian, beberapa hal yang perlu dipertimbangkan dengan seksama dalam kaitannya dengan subyek uji meliputi pemilihan, kondisi, jumlah, dan keterbatasan ukuran hewan uji yang akan digunakan.
Pemilihan hewan uji, idealnya harus dipilih yang semirip mungkin dengan manusia, utamanya dalam hal absorpsi, distribusi, metabolisme, dan ekskresi terhadap senyawa uji. Hal ini dilakukan untuk memperkecil keterubahan respon antar jenis dan dalam satu jenis hewan uji terhadap efek senyawa uji. Suatu hal yang sulit dikerjakan, apalagi bila bahan ujinya berupa obat tradisional yang mengandung aneka ragam zat aktif. Karena itu, pada umumnya hewan uji yang digunakan sebagai subyek uji toksikologi lebih dari dua jenis hewan. Hal ini disarankan dengan asumsi bahwa bila wujud efek toksik suatu senyawa diperlihatkan pada beberapa jenis hewan uji, kemungkinan besar juga akan terwujud pada diri manusia.
Kondisi hewan uji yang akan digunakan, benar-benar harus berada dalam keadaan sehat. Bila tidak, niscaya perkembangan patologis yang terjadi selama uji toksikologi berlangsung, sulit dievaluasi sumber penyebabnya, berasal dari senyawa uji atau kondisi bawaan hewan ujinya. Karena itu, pemeliharaan dan penanganan hewan uji sebelum dan selama masa uji berlangsung harus benar-benar diperhatikan.
Jumlah hewan uji yang akan digunakan, juga harus dipertimbangkan. Hal ini berkaitan dengan kebermaknaan statistik sebagai salah satu landasan penarikan kesimpulan hasil uji dan prinsip ekstrapolasi kejadiaanya pada diri manusia. Karena itu jumlah hewan uji yang digunakan harus disesuaikan dengan metode statistika yang akan diterapkan untuk masing-masing jenis uji toksikologi.
Keterbatasan ukuran hewan uji berkaitan degan keragaman berat, luas permukaan badan, kapasitas organ, dan volume cairan badan antar jenis hewan uji. Keberagaman tersebut tentunya berpengaruh terhadap daya terima maupun kerentanan hewan uji terhadap masukan dan ketoksikam senyawa uji. Karena itu volume pemberian dosis pada hewan uji harus disesuaikan dengan batas volume maksimum yang boleh diberikan pada hewan uji tertentu, sebagaimana telah diuraikan pada bab sebelumnya. Bila tidak, interpretasi dan evaluasi terhadap perkembangan patologis yang terjadi selama masa uji sulit ditegaskan penyebabnya.
III. 4.4. Faktor pengamatan dan pengambilan cuplikan
Dalam uji taksikologi, upaya mendapatkan data tolok ukur kualitatif maupun kuantitatif memerlukan aneka ragam pengamatan langsung terhadap aneka perubahan yang terjadi pada diri hewan uji (misal gejala klinis) maupun pengambilan aneka ragam cuplikan hayati (misal darah, urin, organ). Kondisi patologis yang disimpulkan, mungkin tidak sesuai dengan kondisi yang sebenarnya, karena tidak diikutinya tata cara baku pengamatan dan
pengambilan cuplikan hayati. Karena itu, ketaatan terhadap tata cara baku pengamatan ma-upun pengambilan cuplikan untuk masing-masing jenis uji toksikologi merupakan suatu keharusan.
III. 4.5. Faktor analisis hasil, evaluasi hasil, dan penarikan kesimpulan
Bagaimanapun cermatnya kita mengendalikan berbagai faktor yang terkait dengan rancangan uji, sediaan uji, subyek uji, serta pengamatan dan pengambilan cuplikan hayati, tetapi bila tata cara analisis hasil, evaluasi hasil, dan penarikan kesimpulan baik secara kualitatif maupun kuantitatif tidak dikerjakan dengan seksama sesuai dengan kriteria baku dan tujuan masing-masing jenis uji toksikologi, kesahihan hasil ujinya menjadi kurang andal. Suatu hal yang perlu dicermati oleh para mahasiswa.
Telah dipaparkan aneka ragam faktor yang dapat mempengaruhi kesahihan uji toksikologi. Karena itu, sebelum para mahasiswa memulai praktikum, sebaiknya mau mempelajari aneka ragam faktor tersebut dan mampu menerapkannya dalam praktek sesungguhnya.
III. 5. PUSTAKA ACUAN
Benitz, K.F. 1970. Measurement of Chronic Toxicity. In. Paget, G.E. (Ed.). Methods in
Toxicology. Blackwell Scientific Publications: Oxford.
Chung, K.S., Lec, E.B. & Walter, D.P. 1985. Laboratory Manual. Regional Workshop on the
people antivertility evaluation of natural products. Natural Products Research
Institute-Seoul National University : Seoul.
Donatus, I.A. 1990. Toksikologi Pangan. Edisi I. PAU Pangan dan Gizi Universitas Gadjah Mada : Yogyakarta.
Laurence, D.R. & Bacharach, A.L. 1964. Evaluation of Drug Activities. Pharmacometrics Loomis, T.A. 1978. Essentials of Toxicology. 3rd ed. Lee & Febiger: Philadelphia. atau Edisi
terjemahan (Imono Argo Donatus, alih bahasa). Toksikologi Dasar. Edisi III. Ikip Press : Semarang.
Ritschell, W.A. 1974. Laboratory Manual of Biopharmaceutics. Drug Intelligence Publications : Hamilton.
World Health Organization. 1966. Principles for Pre-clinical Testing of Drug Safety, WHO
Technical Report Series, 341:3-22
World Health Organization. 1978. Environmental Health Criteria 6 : Principles and Method
BAB IV PERCOBAAN I UJI KETOKSIKAN AKUT
IV. 1. TUJUAN
Mahasiswa mampu memahami tujuan, sasaran, tata cara pelaksanaan, luaran, dan manfaat uji ketoksikan akut suatu obat.
IV. 2. PENDAHULUAN
Ketoksikan akut adalah derajat efek toksik suatu senyawa yang terjadi dalam waktu singkat setelah pemberiannya dalam dosis tunggal. Batasan waktu singkat disini ialah rentang waktu selama 24 jam selama pemberian senyawa. Bila demikian, uji ketoksikan akut dapat ditakrifkan sebagai uji ketoksikan suatu senyawa yang diberikan atau dipejankan de-ngan dosis tunggal pada hewan uji tertentu, dan pengamatannya dilakukan selama masa 24 jam.
Tujuan utama uji ketoksikan akut suatu obat ialah untuk menetapkan potensi ketoksikan akut, yakni kisaran dosis letal atau dosis toksik obat terkait pada satu jenis hewan uji atau lebih. Selain itu, uji ini juga ditujukan untuk menilai berbagai gejala klinis yang timbul, adanya efek toksik yang khas, dan mekanisme yang memerantarai terjadinya kematian hewan uji.
Jadi, dalam uji ketoksikan akut, data yang dikumpulkan berupa tolok ukur ketoksikan kuantitatif (kisaran dosis letal/toksik) dan tolok ukur ketoksikan kualitatif (gejala klinis, wujud, dan mekanisme efek toksik).
Tolok ukur kuantitatif yang paling sering digunakam untuk menyatakan kisaran dosis letal atau toksik, berturut-turut adalah dosis letal tengah (LD50) atau dosis toksik tengah
(TD50).Yakni, suatu besaran yang diturunkan secara statistik, guna menyatakan dosis tunggal
suatu senyawa yang diperkirakan dapat mematikan atau menimbulkan efek toksik yang berarti pada 50% hewan uji. Terdapat tiga metode yang paling sering digunakan untuk menghitung harga LD, yakni metode grafik Lithfield & Wilcoxon, metode kertas grafik probit logaritma Miller dan Tainter, dan metode rata-rata bergerak Thompson-Weil, yang pada dasarnya didasarkan pada kekerabatan antara peringkat dosis dan % jumlah hewan yang menunjukkan respon.
Pada dasarnya uji ketoksikan akut suatu obat merupakan salah satu mata rantai uji toksikologi dalam kaitannya dengan penilaian keamanan obat terkait bila digunakan oleh manusia. Jadi, hasil uji ketoksikan akut, terutama potensi ketoksikannya (LD50),
bersama-sama dengan hasil uji potensi keefektifan (ED50), bermanfaat sekali untuk
mengevaluasi batas aman dan indeks terapi (LD50/ED50) obat terkait. Selain itu, pengetahuan
tentang potensi ketoksikan akut juga dapat dimanfaatkan untuk merancang uji ketoksikan subkronis/kronis, maupun untuk memperkirakan dosis awal atau dosis terapi penelitian yang lain (5-10% LD50).
Berikut ini para mahasiswa akan diperkenalkan pada tata cara pelaksanaan baku uji ketoksikan akut suatu obat.
IV.3. TATA CARA PELAKSANAAN Pemilihan hewan uji
Hewan uji yang digunakan sekurang-kurangnya dua jenis hewan, lebih disarankan empat jenis, terdiri dari roden dan nirroden. baik jantan maupun betina, satu galur, dewasa sehat, dan beratnya seragam (variasi yang diperbolehkan lebih kurang 10%).
Pengelompokan hewan uji
Sejumlah hewan uji terpilih, selanjutnya diadaptasikan di laboratorium paling tidak selama satu minggu. Penimbangan berat badan dilakukan satu hari sebelum perlakuan. Kemudian hewan uji dibagi menjadi beberapa kelompok, sesuai dengan jumlah peringkat dosis senyawa uji yang akan diberikan, ditambah satu kelompok kontrol negatif. Masing-masing kelompok uji paling tidak terdiri lima ekor hewan.
Tata cara pemberian/pemejanan dosis sediaan uji
Sedapat mungkin senyawa uji dipersiapkan sebagai sediaan larutan. Dosis sediaan uji yang diberikan, paling tidak terdiri dari empat peringkat dosis, berkisar dari dosis terendah yang tidak atau hampir tidak mematikan seluruh hewan uji, sampai dengan dosis tertinggi yang mematikan seluruh atau hampir seluruh hewan uji (kisaran dosis diperkirakan menyebabkan 10 - 90% kematian hewan pada masa akhir uji).
Peringkat dosis terendah sampai tertinggi yang dipilih sebaiknya merupakan interval logaritma yang ajeg (kelipatan tetap). Untuk mempermudah penetapan peringkat dosis seyogyanya dilakukan dahulu orientasi dengan interval log 0,6 atau antilognya (kelipatan tetap = 4). Bila peringkat dosis terendah dan tertinggi sudah ditemukan, selanjutnya peringkat dosis antaranya ditetapkan berdasarkan faktor interval atau kelipatan tetap yang lebih sesuai. Namun, bila yang diuji adalah obat tradisioanl (jamu), lebih baik dicoba dahulu dosis tertinggi tepat pada batas volume maksimum yang boleh diberikan pada hewan uji, karena pada umumnya sulit ditemukan harga LD50 aktual jamu.
Sediaan uji diberikan pada hewan uji paling tidak melalui jalur yang akan digunakan oleh manusia. Dalam hal ini, WHO (1966) menyarankan tiga atau lebih jalur pemberian. Dan kekerapan pemberian hanya sekali selama masa uji.
Pengamatan
Masa pengamatan dilakukan selama 24 jam, kecuali pada kasus-kasus tertentu dapat selama 7 – 14 hari.
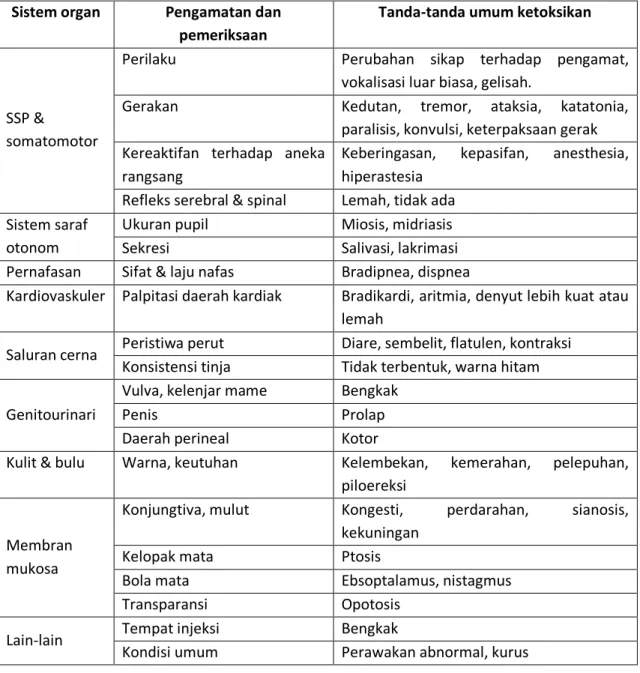
Kriteria pengamatan meliputi : (a) pengamatan fisik terhadap gejala-gejala klinis (Tabel IV.1.), (b) perubahan berat badan, (c) jumlah hewan yang mati pada masing-masing kelompok uji, dan (d) histopatologi seluruh hewan.
Analisis dan evaluasi hasil
Data gejala-gejala klinis yang tampak pada fungsi vital, secara kualitatif dipakai untuk mengevaluasi mekanisme penyebab kematian. Data hasil pemeriksaan histopatologi digunakan untuk mengevaluasi spektrum efek toksik. Data jumlah hewan yang mati pada masing-msing kelompok secara kuantitatif digunakan untuk menghitung harga LD50
mengikuti salah satu tata cara yang telah disebutkan dalam pendahuluan. Bila sampai dengan batas volume maksimal yang boleh diberikan pada hewan uji, dosis yang diberikan tidak menimbulkan kematian hewan uji (sering dijumpai pada pengujian obat tradisional), maka dosis tertinggi tersebut dinyatakan sebagai LD50 semu (LD0)
Dari harga LD50 yang diperoleh, selanjutnya potensi ketoksikan akut senyawa uji dapat digolongkan menjadi :
Sangat tinggi, bila LD50 ≤ 1 mg/kg Tinggi = 1 – 50 mg/kg Sedang = 50 – 500 mg/kg Sedikit toksik = 500 – 5000 mg/kg Hampir tidak toksik = 5 – 15 g/kg Relatif tidak berbahaya ≥ 15 g/kg
IV.4. PERCOBAAN
Uji ketoksikan akut parasetamol
a. Kelas dibagi menjadi empat kelompok.
b. Masing-masing kelompok mendapatkan empat ekor mencit
c. Masing-masing mencit diberi suspensi parasetamol secara per oral dengan dosis 125 mg/kgBB, 250 mg/kgBB, 500 mg/kgBB dan 1000 mg/kgBB.
d. Amati gejala-gejala klinis yang timbul
e. Catat jumlah mencit yang mati dalam waktu 24 jam
f. Gunakan data seluruh kelompok untuk menghitung harga LD50
IV. 5. PUSTAKA ACUAN
Balazs, T. 1970. Measurement of Acute Toxicity. In Paget, GE.(Ed.). Methods in Toxicology. Blackwell Scientific Publications Oxford
Donatus, I.A. 1990. Toksikologi Pangan (Bab VI & VIII), Edisi I. PAU Pangan dan Gizi Universitas Gadjah Mada Yogyakarta
Tallarida, R.J. & Murray, R.B. 1981. Manual of Pharmacologic Calculations with Computer
Programs. Springer-Veflag:New York
Timbrell, J.A. 1989. Introduction to Toxicology (chapter 11). Taylor & Francis: London
Turner, R.A. 1965. Screening Methods in Pharmacology (Calipter 5). Academic Press: New York
Weil, C.S. 1952, Tables for Convenient Calculation of Median Effective Dose (LD50 or ED50)
and Intructions in Their use. Biometrics : 8, 249-262
World Health Organization (WHO). 1966. Principles for Preclinical Testing Of Drug Safety WHO Technical Report Series. No 341. WHO: Geneva.
World Health Organization. 1978. Environmental Health Criteria 6:Principles and Methods for
Tabel IV. 1. Pemeriksaan fisik dalam uji ketoksikan akut pada roden.
Sistem organ Pengamatan dan
pemeriksaan
Tanda-tanda umum ketoksikan
SSP &
somatomotor
Perilaku Perubahan sikap terhadap pengamat, vokalisasi luar biasa, gelisah.
Gerakan Kedutan, tremor, ataksia, katatonia, paralisis, konvulsi, keterpaksaan gerak Kereaktifan terhadap aneka
rangsang
Keberingasan, kepasifan, anesthesia, hiperastesia
Refleks serebral & spinal Lemah, tidak ada Sistem saraf
otonom
Ukuran pupil Miosis, midriasis Sekresi Salivasi, lakrimasi Pernafasan Sifat & laju nafas Bradipnea, dispnea
Kardiovaskuler Palpitasi daerah kardiak Bradikardi, aritmia, denyut lebih kuat atau lemah
Saluran cerna Peristiwa perut Diare, sembelit, flatulen, kontraksi Konsistensi tinja Tidak terbentuk, warna hitam Genitourinari
Vulva, kelenjar mame Bengkak Penis Prolap Daerah perineal Kotor
Kulit & bulu Warna, keutuhan Kelembekan, kemerahan, pelepuhan, piloereksi
Membran mukosa
Konjungtiva, mulut Kongesti, perdarahan, sianosis, kekuningan
Kelopak mata Ptosis
Bola mata Ebsoptalamus, nistagmus Transparansi Opotosis
Lain-lain Tempat injeksi Bengkak
BAB V PERCOBAAN II UJI KETOKSIKAN SUBKRONIS
V. 1. TUJUAN
Mahasiswa mampu memahami tujuan, sasaran, tata cara pelaksanaan, luaran, dan manfaat uji ketoksikan subkronis suatu obat.
V.2. PENDAHULUAN
Uji ketoksikan subkronis adalah uji ketoksikan suatu senyawa yang diberikan dengan dosis berulang pada hewan uji tertentu, selama kurang dari tiga bulan. Uji ketoksikan subkronis suatu obat, utamanya diajukan untuk mengungkapkan spektrum efek toksik obat terkait dan jenis organ yang terkena, maupun kekerabatan antara dosis dan spektrum efek toksik. Selain itu, sering kali uji ini juga ditujukan untuk mengevaluasi keterbalikan (reversibilitas) spektrum efek toksik yang terjadi.
Pada dasarnya, uji ketoksikan subkronis atau sering kali juga dikenal sebagai uji ketoksikan subakut, meliputi efek toksik (wujud dan sifat) suatu obat yang mungkin timbul selama lebih kurang 10% masa hidup hewan uji, yang pada akhirnya dapat disetarakan dengan kejadian yang mungkin timbul ketika obat terkait digunakan oleh manusia (lihat tabel III.3). Hal ini perlu dikerjakan mengingat pemakaian obat sering kali memerlukan waktu yang relatif panjang, bahkan mungkin sepanjang masa hidup si pemakai. Selain itu, dengan uji ketoksikan subkronis, memungkinkan terliputnya wujud dan sifat efek toksik yang munculnya lambat dan tak dapat terliput pada uji ketoksikan akut.
Seperti telah diketahui, wujud efek toksik suatu senyawa mungkin berupa perubahan (kekacauan) biokimia, fungsional, atau struktural. Karena itu, data yang diperlukan untuk mengevaluasi ketoksikan subkronis, berupa tolok ukur kualitatif dan kuantitatif yang terkait dengan tiga perubahan tersebut. Untuk itu diperlukan berbagai pemeriksaan dan pengamatan yang mencakup perkembangan patologi, gejala dan tanda klinis, sistem hematologi, fungsi organ secara biokimia, dan morfologi organ.
Selain sebagai dasar evaluasi batas aman pemakaian suatu obat, hasil uji ketoksikan subkronis bermanfaat sekali bagi panduan perancangan uji ketoksikan kronis, keteratogenikan, maupun farmakokinetika dosis berulang, utamanya berkaitan dengan pemilihan hewan uji dan peringkat dosis. Di samping itu juga bermanfaat sebagai panduan bagi para klinisi dalam menjalankan uji klinik obat terkait, utamanya berkaitan dengan efek toksik yang seharusnya dilacak dan berbagai tolok ukur klinis yang harus dikembangkan, agar uji kinik dapat berlangsung seoptimal mungkin dengan risiko seminimal mungkin.
Berbagai uraian di atas menunjukkan bahwa dalam uji ketoksikan kronis, terlibat aneka tata cara pemeriksaan dan pengamatan. Karena itu kecermatan dalam mempersiapkan dan melaksanakan tata cara pengujian serta kecermatan dalam menganalisis data uji maupun menginterpretasi dan mengevaluasi hasil uji, sungguh merupakan faktor yang besar sekali pengaruhnya atas kesahihan hasil uji ketoksikan subkronis.
Berikut ini para mahasiswa akan diperkenalkan pada tata cara pelaksanaan uji ketoksikan subkronis.
V.3. TATA CARA PELAKSANAAN Pemilihan hewan uji
Uji ketoksikan subkronis berlangsung cukup lama dan hasilnya akan diekstrapolasikan pada manusia. Karena itu, pemilihan hewan uji seharusnya didasarkan pada kemiripan pola absorpsi, metabolisme, dan ekskresi antara hewan uji dan manusia. Kalau tidak, hewan yang memperlihatkan respons terhadap efek farmakologi obat terkait. Selain itu, hewan yang tidak mudah terjangkiti penyakit spontan, serta hewan yang penanganan maupun pemeliharaannya dalam lingkungan baru termasuk mudah, juga pertu dipertimbangkan.
Untuk keperluan uji ketoksikan subkronis suatu obat sekurang-kurangnya dikerjakan pada satu atau dua jenis hewan yang sehat, satu galur, baik jantan maupun betina. Hewan uji yang paling banyak digunakan adalah tikus (roden) dan anjing (nirroden).
Tabel V. 1. Panduan umum masa pemberian dalam uji toksikologi (WHO)
Masa pemberian pada manusia Masa pemberian pada lebih dari satu jenis hewan
yang disarankan
Dosis tunggal atau beberapa dosis Paling tidak 2 minggu Sampai 4 minggu 13 – 26 minggu
Lebih dari 4 minggu Paling tidak 26 minggu (tidak termasuk uji kekarsinogenikan)
Tabel V. 2. Panduan masa pemberian obat uji pada masing-masing uji ketoksikan tak khas di Jepang
Masa penerapan klinis
Kekerapan atau masa pemberian Ketoksikan akut Ketoksikan subkronis Ketoksikan kronis
Sekali Sekali 28 hari Tidak perlu Satu minggu atau kurang Sekali 90 hari Tidak perlu Lebih dari satu minggu sampai 4 minggu Sekali 28 hari 6 bulan Lebih dari 4 minggu Sekali 90 hari 1 tahun
Kriteria pengamatan meliputi :
a. Berat badan masing-masing hewan uji ditimbang pada hari ke nol, dan seterusnya paling tidak setiap 7 hari sekali.
b. Masukan makanan dan minuman untuk masing-masing hewan atau kelompok hewan uji, ditimbang atau diukur paling tidak 7 hari sekali.
c. Berbagai gejala klinis umum diperiksa melalui pengamatan fisik seperti pada tabel IV.1. setiap hari. Saat penampakan gejala klinis dan wujud gejala klinis dicatat.
d. Pemeriksaan hematologi (jumlah sel darah merah, sel darah putih, kadar hemoglobin, volume korpuskuli, protein total), paling tidak diperiksa dua kali, yakni pada awal dan akhir masa uji coba.
e. Pemeriksaan fungsi organ secara biokimia dikerjakan melalui pemeriksaan kimia darah (kadar sodium, potasium, klorida, kalsium, karbon dioksida, SGPT, SGOT, alkali fosfatase serum, gula darah, protein total, dan albumin) dan analisis urin (pH, bobot jenis, protein
total, volume urin, sedimen, glukosa, keton, bilirubin, bersih kreatinin), paling tidak diperiksa dua kali, pada awal dan akhir masa uji.
f. Pada akhir masa uji, beberapa hewan uji pada masing-masing kelompok dikorbankan, ambil semua organ mengikuti tata cara baku pengambilan cuplikan hayati dan buat preparat histologi mengikuti tata cara pengecatan hematoksilin-eosin, guna pemeriksaan morfologi (histopatologi) organ. Sebaiknya beberapa organ penting seperti hati dan ginjal, juga ditimbang terlebih dahulu sebelum dibuat preparat histologi.
g. Bila selama masa uji terdapat hewan yang sekarat atau mati, harus dilakukan pemeriksaan histopatologi seperti pada butir f.
h. Untuk uji keterbalikan (reversibilitas), yakni guna menentukan sifat efek toksik yang terjadi, paling tidak beberapa hewan uji pada kelompok peringkat dosis terendah dan tertinggi setelah masa uji berakhir (perlakuan dihentikan), dilanjutkan dengan pengamatan ulang (butir a-f) selama 2 – 4 minggu.
Analisis dan evaluasi hasil
a. Data penimbangan berat hewan uji ditabelkan, kemudian dihitung purata kenaikan berat perhari (PKBP). Data PKBP antar kelompok perlakuan selanjutnya dianalisis secara statistik mengikuti metode analisis varian pola searah.
b. Data masukan makanan dan minuman ditabelkan, kemudian perbedaan purata harian antar kelompok perlakuan dianalisis secara statistik, analisis varian pola searah. c. Data gejala-gejala klinis dianalisis secara kualitatif.
d. Data pemeriksaan hematologi dibuat grafik dan ditabelkan. Kemudian perbedaan purata masing-masing komponen sistem hematologi dianalisis secara statistik mengikuti metode analisis varian split-plot, diikuti dengan analisis Duncan's new
multiple range test.
e. Demikian pula data analisis urin dianalisis seperti pada butir d.
f. Data pemeriksaan histopatologi organ dianalisis secara kualitatif berdasarkan perubahan morfologi yang terjadi dibandingkan dengan kelompok kontrol negatif. g. Data uji keterbalikan dianalisis secara kualitatif untuk menyatakan sifat efek toksik
yang terjadi termasuk kategori timbal balik atau takterbalikkan.
Temuan dari perubahan perkembangan berat badan, masukan makanan dan minuman, serta gejala-gejala klinis, digunakan untuk mengevaluasi status kesehatan dan perkembangan patologi hewan uji akibat perlakuan sediaan senyawa uji. Dan hasil pemeriksaan hematologi serta analisis urin, dipakai untuk mengevaluasi adanya perubahan fungsional sistem organ sebagai perwujudan efek toksik senyawa uji. Berikutnya perubahan morfologi sel jaringan organ dan kelenjar yang ditemukan dari pemeriksaan histopatologi, digunakan untuk mengevaluasi perubahan struktural sel organ atau kelenjar terkait sebagai perwujudan efek dan sifat toksik senyawa uji.
Berdasarkan atas berbagai temuan dan evaluasi di atas akhirnya spektrum efek toksik (wujud dan sifat) senyawa uji pada hewan uji terkait dapat ditegaskan. Selain itu, berdasarkan atas kekerabatan antara peringkat dosis senyawa uji dan wujud efek toksik yang terjadi, dapat ditegaskan batas aman pemakaian obat terkait.
V. 4. PERCOBAAN
Uji ketoksikan kronis parasetamol
a. Kelas dibagi menjadi empat kelompok.
b. Masing-masing kelompok mendapatkan tiga ekor mencit (kontrol, perlakuan I dan perlakuan II).
c. Kelompok kontrol, mencit diberi larutan CMC Na 1% selama 28 hari.
d. Kelompok perlakuan, masing-masing mencit perlakuan diberi suspensi parasetamol secara per oral dengan dosis 250 mg/kgBB (dosis hepatotoksik) dan 65 mg/kgBB (dosis terapi) selama 28 hari.
Pengamatan
a. Lakukan penimbangan BB mencit setiap 1 minggu.
b. Setelah perlakuan selama 28 hari, ambil cuplikan darah mencit melalui intrakardial atau melalui vena optalmikus yang terdapat di sudut mata, kemudian tampung dalam vial.
c. Pemeriksaan kadar SGOT dan SGPT dalam serum dilakukan dengan penambahan larutan pereaksi sejumlah tertentu yang dihomogenkan kemudian diamati dengan menggunakan spektrofotometer.
d. Bandingkan kadar SGOT dan SGPT dari mencit kontrol, mencit dengan perlakuan parasetamol dosis hepatotoksik dan dosis terapi.
V.5. PUSTAKA ACUAN
Anonim. 1984. Supplements Toxicity Test Guideline. In Anonim. Drug Approval and Licensing
Procedures in Japan. Yakugyo Jiho : Tokyo.
Benitz, K.F. 1970, Measurement of Chronic Toxicity. In Paget, G.E. (Ed.). Methods in
Toxicology. Blackwell Scientific Publications: Oxford.
Chaudhary, M., Tamta, A., and Sehgal, R. 2009. Sub-Chronic Toxicity Study of Fixed Dose
Combination of Ofloxacin in Mus Musculuc Mice. The Open Toxicology Journal (3) :
24-29
Donatus, I.A. 1990. Toksikologi Pangan (Bab III, IV, V, VI, VIII). Edisi 1.PAU Pangan & Gizi Universitas Gadjah Mada : Yogyakarta.
Linawati, Y., Apriyanto, A., Susanti, E., Wijayanti., Donatus, I.A.2006. Efek Hepatoprotektif
Rebusan Herba Putri-Malu (Mimosa pigra, L.) pada TIkus Terangsang Parasetamol,
Laboratorium Farmakologi dan Toksikologi Fakultas Farmasi Universitas saanata Dharma : Yogyakarta. Diakses dari www.usd.ac.id/06/publ_dosen/far/yunita.pdf Loomis, T.A. 1978 (Edisi terjemahan, Alih Bahasa Imono Argo Donatus) Toksikologi Dasar
(Bab XIII). Edisi 3. Ikip Press: Semarang.
Timbrell, J.A. 1989, Iniroduction to Toxicology (Chapter 3 & 11). Taylor & Francis : London. World Health Organization (WHO). 1966. Principle for Pre-clinical Testing of Drug
Safety. WHO Technical Report Series. No. 341. WHO: Geneva.
World Health Organization (WHO). 1975. Guidelines for Evaluation of Drugs for Use in Man. WHO Technical Report Series. No. 563. WHO: Geneva.
World Health Organization (WHO). 1978. Environmental Health Criteria 6: Principles and
BAB VI PERCOBAAN III UJI KETERATOGENIKAN
VI. 1. TUJUAN
Mahasiswa mampu memahami tujuan, sasaran, tata cara pelaksanaan, luaran, dan manfaat uji keteratogenikan suatu obat.
V1. 2. PENDAHULUAN
Bagaimanapun wanita hamil tidak bebas dari penyakit sehingga penggunaan suatu obat terkadang merupakan suatu keharusan. Bahkan, wanita hamil yang sehat pun terkadang menggunakan sesuatu obat, baik obat modern atau atau tradisional, utamanya sebagai upaya menjaga kesehatan si ibu selama masa kehamilannya. Agar obat yang digunakan oleh si ibu tidak membahayakan diri si janin yang dikandungnya, maka keamanan obat terhadap diri janin harus ditegaskan. Untuk itu perlu dilakukan beberapa uji reproduksi terhadap obat yang kemungkinan besar akan digunakan oleh wanita hamil, yang salah salu di antaranya adalah uji keteratogenikan.
Uji keteratogenikan merupakan salah satu jenis uji ketoksikan khas. Tepatnya, adalah uji ketoksikan suatu obat yang diberikan/dipejankan selama masa organogenesis hewan bunting. Uji ini ditujukan untuk menentukan apakah suatu obat dapat menyebabkan kelainan atau cacat bawaan pada diri janin yang dikandung oleh hewan bunting dan apakah cacat tersebut berkerabat dengan dosis obat yang diberikan. Dengan demikian uji keteratogenikan bermanfaat sekali sebagai landasan evaluasi batas aman dan risiko penggunaan sesuatu obat oleh wanita hamil utamanya berkaitan dengan cacat bawaan janin yang dikandungnya.
Sebagaimana tersirat dalam takrif uji keteratogenikan di atas, pada dasarnya terdapat beberapa kegiatan utama dalam pelaksanaan ujinya, yakni pengawinan (pembuntingan) hewan uji terpilih, penegasan masa kebuntingan, penetapan masa organogenesis (pembentukan organ), pemberian/pemejanan obat uji pada masa organogenesis tersidik, pemeriksaan dan pengamatan tolok ukur kualitatif dan kuantitatif kelainan atau cacat bawaan pada masa kelahiran normal, dan akhirnya analisis serta evaluasi hasil. Kecermatan dalam mengelola berbagai kegiatan tersebut, jelas merupakan penentu kesahihan hasil ujinya.
Berikut ini, para mahasiswa akan diperkenalkan pada tata cara pelaksanaan baku uji keteratogenikan sesuatu obat.
V1.3. TATA CARA PELAKSANAAN Pemilihan hewan uji
Hewan uji yang digunakan paling tidak terdiri dari dua jenis hewan, roden dan nirroden. Beberapa hal perlu diperhatikan dalam pemilihan hewan uji ini, yakni berkaitan dengan umur, berat badan, keperawanan, keteraturan daur estrus, periode laktasi pendek, jumlah anak, dan kerentanan terhadap teratogen. Hal yang terakhir ini dapat diketahui dengan cara memejani hewan bunting dengan senyawa uji yang dosisnya setara dengan harga LD50nya. Bila kemudian ditemukan kematian pada seluruh janin yang dikandungnya,
dapat dikatakan hewan tersebut peka terhadap teratogen. Berdasarkan kajian terhadap berbagai laporan pelaksanaan uji keteratogenikan, hewan uji yang disarankan dapat dipilih adalah mencit dan tikus (roden) dan kelinci (nirroden) yang masih perawan dan daur estrusnya teratur.
Pengelompokan hewan uji
Hewan uji terpilih, setelah diadaptasikan dengan suasana laboratorium selama satu minggu, kemudian dikelompokkan sesuai dengan peringkat dosis yang diberikan, ditambah satu atau dua kelompok kontrol negatif dan jika perlu satu kelompok kontrol positif. Masing-masing kelompok tersebut paling tidak terdiri dari 20-30 ekor hewan untuk mencit dan tikus atau 12 ekor untuk kelinci. Perlu dicatat di sini, hewan uji yang dikelompokkan tersebut, daur estrusnya telah diperiksa keteraturannya.
Pemeriksaan daur estrus
Sebelum hewan uji dikawinkan, dilakukan pemeriksaan daur estrus dengan cara usap vagina sebagai berikut :
a. Siapkan larutan fisiologis (NaCl 0,9%)
b. Pegang tikus atau mencit dengan cara lazim menggunakan tangan kiri sehingga berada dalam posisi punggung di bawah.
c. Dengan tangan kanan ambil pipet tetes yang telah berisis larutan fisiologis secukupnya. d. Masukkan pipet tetes ke liang vagina dengan hati-hati. Kemudian tekan karet agar
larutan fisiologis masuk ke liang vagina. Dalam keadaan pipet tetap tertekan, tunggu sebentar. Selanjutnya, lepaskan tekanan pipet agar larutan fisiologis tadi tersedot kembali ke dalam pipet. Larutan fisiologis yang tersedot tersebut agak keruh (cairan apus vagina).
e. Letakkan kembali hewan uji dalam kandang. f. Teteskan cairan apus vagina pada gelas obyek.
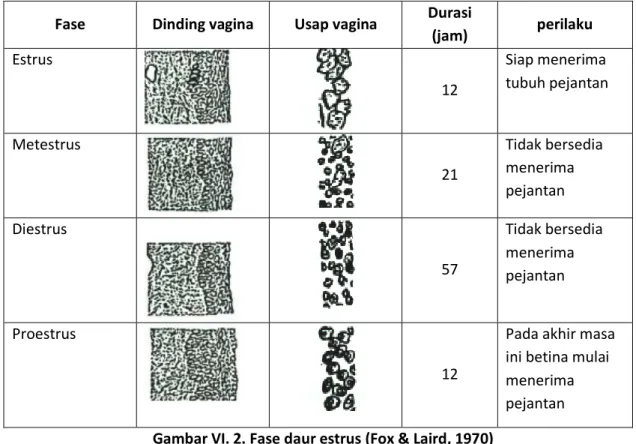
g. Amati tipe-tipe sel epitel apus vagina di bawah mikroskop. Bentuk sel yang mungkin ditemukan pada apus vagina terlihat pada gambar VI. 1. Dan berdasarkan temuan tipe sel tersebut, selanjutnya dapat ditegaskan fase daur estrus yang sedang dialami oleh hewan uji, dengan kriteria seperti tersaji pada gambar VI. 2.
h. Mencit atau tikus yang daur estrusnya berlangsung selama 4-5 hari, dinyatakan sebagai memiliki daur estrus yang teratur. Hewan uji yang menunjukkan daur estrus teratur dipersiapkan untuk dikawinkan guna pengujian keteratogenikan obat. Pemeriksaan daur estrus tersebut sebaiknya dilakukan dua kali.
Pengawinan dan penetapan masa bunting
Hewan uji yang memiliki daur estrus teratur, selanjutnya dikawinkan dengan pejantan dengan cara seperti berikut:
Hewan yang sedang berada dalam fase proestrus pada pagi hari, sore harinya dimasukan dalam satu kandang dengan pejantannya (jam 5-6 sore merupakan waktu yang paling disenangi). Pagi hari berikutnya, betina dipisahkan dari pejantan dan diperiksa apus vaginanya secara mikroskopis, seperti cara pemeriksaan daur estrus. Bila dalam apus vagina terlihat adanya sperma, berarti telah terjadi perkawinan.
Hari ke nol masa bunting hewan uji dihitung sejak ditemukannya sperma dalam apus vagina. Bergantung pada hewan ujinya, selanjutnya masa organogenesis dan masa kelahiran normal dapat ditetapkan seperti terlihat pada tabel VI.1.
Gambar VI. 1. Tipe sel vagina. N = sel epitel berinti, C = sel epitel cornified, L = leukosit
Fase Dinding vagina Usap vagina Durasi
(jam) perilaku Estrus 12 Siap menerima tubuh pejantan Metestrus 21 Tidak bersedia menerima pejantan Diestrus 57 Tidak bersedia menerima pejantan Proestrus 12
Pada akhir masa ini betina mulai menerima pejantan
Gambar VI. 2. Fase daur estrus (Fox & Laird, 1970)
Tabel VI.1. Masa bunting dan masa organogenesis beberapa hewan
Jenis hewan Masa bunting (hari) Masa organogenis (hari
ke)
Mencit 19 6 – 15 Tikus 21 7 – 17 Kelinci 30 - 35 6 - 18
Tata cara pemberian dosis sediaan uji
Untuk keperluan uji ketratogenikan, dosis yang diberikan paling tidak terdiri dari tiga peringkat dosis. Dosis teratogenik umumnya terletak antara dosis letal terhadap induk atau semua janin dan dosis yang tidak menimbulkan efek teratogenik. Dosis teratogenik ini
kemungkinan setara dengan dosis subtoksik pada uji ketoksikan subkronis dengan hewan uji yang sama. Dosis teratogenik juga dapat ditentukan dari harga LD50 senyawa uji pada induk
(antara 1/4 - 1/3 LD50 induk). Apabila terdapat kesulitan dalam menentukan harga LD50 induk
(sering dijumpai pada pengujian obat tradisional), dosis teratogenik dapat dicari secara tentatif (misal 1x, 2x, 4x dan seterusnya dari dosis terapi untuk manusia). Dari ketiga peringkat dosis, dosis tertinggi yang digunakan tidak boleh memperlihatkan efek negatif pada induk, misal sedasi. Dan dosis terendahnya, harus meliputi dosis terapi.
Jalur pemberian sediaan uji paling tidak harus meliputi jalur klinis manusia. Peringkat dosis sediaan uji diberikan dengan kekerapan sekali sehari selama masa organogenesis hewan uji terkait (lihat tabel VI.1.)
Pemeriksaan dan pengamatan
Masa pengamatan dimulai sejak diakhirinya masa bunting hewan uji, yakni 12-14 jam sebelum waktu kelahiran normal, melalui bedah seisar yang caranya sebagai berikut : a. Siapkan peralatan yang lazim digunakan untuk melakukan anestesi dengan eter. b. Lakukan anestesi terhadap hewan uji, setelah hewan ditimbang beratnya.
c. Setelah hewan teranestesi, ambil dan letakkan pada papan fiksasi serta lakukan pembedahan sebagaimana cara lazim pengambilan cuplikan hayati sampai terlihat uterus yang berisi janin.
d. Keluarkan uterus dan korpora luteanya. Kemudian pisahkan (potong) uterus dari korpora lutea dan induk dikorbankan.
e. Sayat dinding uterus secara longitudinal guna mengeluarkan janin yang ada di dalamnya. f. Janin yang terambil kemudian dipisahkan dari plasenta dan masing-masing dibersihkan dari lendir atau selaput yang menyelimutinya. Tempat bekas plasenta pada uterus disebut tempat implantasi.
g. Kumpulkan janin, plasenta, uterus, dan korpora lutea pada tempat terpisah guna pemeriksaan dan pengamatan selanjutnya.
Kriteria pengamatan yang diperlukan meliputi biometrika janin atau jabang bayi, gros morfologi, histopatologi dan kelainan rangka. Termasuk biometrika janin meliputi angka kematian, angka resorpsi, angka cacat, berat plasenta dan berat janin. Untuk mendapatkan biometrika tersebut diperlukan data kuantitatif yang meliputi (a) jumlah korpora lutea pada kedua ovarium (b) jumlah seluruh jabang bayi yang terdapat dalam uterus (c) jumlah jabang bayi yang lahir hidup dan yang mati dan (d) jumlah jabang bayi yang lahir cacat.
Termasuk gros morfologi meliputi pengamatan adanya cacat makroskopis pada tubuh jabang bayi. Dalam hal ini yang diamati ialah : kelengkapan dan kelainan tangan, kaki, telinga, mata, bibir, celah langit dan adanya kongesti.
Termasuk histopatologi meliputi pengamatan terhadap adanya cacat mikroskopis (selular) pada aneka jaringan dan organ jabang bayi. Untuk itu beberapa jabang bayi masing-masing induk diambil cuplikan organnya dimasukkan formalin 10% guna pembuatan preparat histologi mengikuti cara pengecatan hematoksilin-eosin.
Termasuk kelainan rangka meliputi pemeriksaan terhadap sistem rangka tubuh (skeletal). Untuk itu beberapa jabang bayi masing-masing induk dipersiapkan untuk pembuatan preparat skeletal mengikuti teknik pewarnaan alizarin’S seperti berikut :
(a) jabang bayi difiksasi dengan etanol absolut selama 2 hari, (b) isi rongga perut dan rongga dada dikeluarkan, (c) jabang bayi dimaserasi dengan KOH 1% selama 2 hari sampai dagingnya mengelupas dan nampak transparan (setiap hari larutan KOH diganti 2 kali), (d)
masukkan jabang bayi transparan ke dalam alizarin’S 0,1% dalam KOH 1% selama 10 menit, (e) bilas dengan KOH 1% sampai warna ungu pada selaput transparan hilang, (f) masukkan jabang bayi yang telah diwarnai itu berturut-turut ke dalam campuran KOH-gliserin (3:1, 2:2, 1:3) masing-masing selama 1 hari dan, (g) akhirnya masukkan ke dalam gliserin murni serta disimpan untuk pemeriksaan.
Pemeriksaan dilakukan dengan kaca pembesar. Data yang dikumpulkan berupa (a) purata penulangan sternum, vertebrata, dan rusuk (b) prosentase janin yang mempunyai penulangan pada karpal dan tarsal (c) prosentase kelainan rangka sumbu jabang bayi.
Analisis dan evaluasi hasil
a. Buat tabel biometrika yang berisi purata berat, panjang, jumlah kematian (jumlah korpora lutea – jumlah jabang bayi hidup), jumlah resorpsi awal (jumlah korpora lutea – jumlah jabang bayi), jumlah resorpsi akhir (jumlah tempat implantasi – jumlah jabang bayi), jumlah cacat makroskopis dan berat plasenta.
b. Perbedaan jumlah kematian dan jumlah cacat antar kelompok perlakuan dianalisis secara statistik menggunakan metode Khi kuadrat, sedang data biometrika lainnya dengan analisis varian pola searah taraf kepercayaan 95%.
c. Buat tabel data histopatologi (cacat makroskopis). Selanjutnya perbedaan antar kelompok perlakuan dianalisis dengan metode Khi kuadrat taraf kepercayaan 95%. d. Buat tabel data pemeriksaan kelainan skeletal. Selanjutnya perbedaan antar kelompok
perlakuan dianalisis secara statistika mengikuti tata cara Mann-Whitney, taraf kepercayaan 95%.
e. Berdasarkan hasil analisis kuantitatif di atas, selanjutnya potensi keteratogenikan obat uji dapat dievaluasi. Demikian pula kekerabatannya dengan dosis obat uji. Selain itu secara kualitatif, wujud dan sifat cacat makroskopis, mikroskopis, maupun skeletal, juga dapat dievaluasi.
IV. 4. PERCOBAAN
Uji Teratogenik Alkohol pada Tikus Putih Pemeriksaan siklus estrus pada tikus
a. Kelas dibagi menjadi 4 kelompok
b. Masing-masing kelompok melakukan pemeriksaan apus vagina untuk menentukan siklus estrus tikus (lihat petunjuk V1.3)
c. Amati tipe-tipe sel epitel vagina tikus.
Bedah Sesar untuk pengamatan Keteratogenikan
a. Kelas dibagi menjadi 4 kelompok
b. Lakukan bedah sesar pada tikus untuk mengakhiri masa bunting (lihat petunjuk V1.3)
c. Amati biometrika janin dan gros morfologinya.
V. 5. PUSTAKA ACUAN
Donatus, I.A., 1990, Toksikologi Pangan (Bab III, IV, V VI, VIII), Edisi I, PAU Pangan & Gizi Universitas Gadjah Mada : Yogyakarta
Delahunt, C.S., 1970, Detection of Teratogenic Actions, In Paget G.E., (Ed), Methods in
Fox, R.R., & Laird, C.W. 1970, Sexual Cycles, In. Hafes, E.S.E (Ed), Reproduction and Breeding Techniques for Laboratory Animals, Lea & Febiger : Philadelphia
Mitruka, B.M., Rawnsley, H.M. & Vadehra, D.V, 1976, Animal for Medical Reseach, Models
for the Study of Human Disease (Chapter 13), John Wiley & Sons : New York
Palmer, A.K. 1978, The Design of Subprimate Animal Studies, In Wilson, J.G. & Fraser, F.C., (Eds), Handbook of Teratology Vol. 4. Plenum Press : New York
Palmer, A.K., 1977, Reproductive Toxicology Studies and Their Evaluation. In Ballantyne, B. (Ed). Current Approaches in Toxicology, John Wright & Sons Limited : Bristol
World Health Organization (WHO), 1967, Principles for the Testing of Drugs for
BAB VII PERCOBAAN IV
DAYA TERAPI ANTIDOT SODIUM NITRIT DAN SODIUM THIOSULFAT
VII. 1. TUJUAN
Mahasiswa mampu memahami tujuan, sasaran, dan strategi terapi antidot, berdasarkan contoh kemampuan sodium nitrit dan sodium tiosulfat menawaracunkan sianida.
VII.2. PENDAHULUAN
Dimaksud dengan terapi antidot ialah suatu tata cara yang secara khusus ditujukan untuk membatasi intensitas efek toksik zat kimia atau untuk menyembuhkan efek toksik yang ditimbulkannya sehingga bermanfaat untuk mencegah bahaya selanjutnya. Bila disimak takrif tersebut mengandung makna bahwa tujuan terapi antidot ialah membatasi penyebaran racun di dalam tubuh, sedang sasaran terapinya berupa penurunan atau penghilangan intensitas efek toksik.
Intensitas efek toksik suatu senyawa bergantung pada keberadaan (besar kadar dan lama tinggal) senyawa terkait di tempat aksinya. Di mana keberadaan tersebut ditentukan oleh keefektifan absorpsi, distribusi, dan eliminasi senyawa terkait. Bila demikian upaya membatasi penyebaran racun tentunya harus dikaitkan dengan ketiga proses tersebut. Karena itu, strategi terapi antidot di antaranya melibatkan penghambatan absorpsi dan distribusi, serta peningkatan eliminasi racun terkait.
Sianida merupakan racun yang poten yang juga dikenal sebagai racun mitokondria. Sianida yang memejani tubuh dapat bereaksi dengan komponen besi dalam sitokrom oksidase mitokondria, sehingga enzim tersebut menjadi tak aktif. Padahal sistem enzim tersebut diperlukan sekali bagi berlangsungnya metabolisme aerob. Karena itu, wujud keracunan sianida diawali oleh peristiwa hipoksia, yang kemudian berakibat timbulnya kejang, hilangnya kesadaran, sianosis, kegagalan pernafasan, dan dengan cepat dapat menimbulkan kematian.
Metode khas yang digunakan sebagai sarana terapi antidot keracunan sianida ialah dengan injeksi sodium nitrit atau sodium thiosulfat. Karena itu dalam percobaan ini, para mahasiswa diperkenalkan pada keefektifan kedua zat antidot tersebut dalam membatasi penyebaran racun sianida di dalam tubuh, sebagai sarana pemahaman terhadap strategi terapi antidot.
VII.3. TATA CARA PERCOBAAN VII. 3. 1. Bahan
Tikus putih, larutan sodium nitrit 2%, larutan sodium thiosulfat 25%, larutan fisiologis (salin 0,9%), larutan kalium sianida 1,5%.
VII. 3. 2. Alat
Spuit dan jarum injeksi, pengukur waktu, alat gelas, sarung tangan tebal
VII. 3. 3. Pengelompokan dan perlakuan terhadap hewan uji.
2. Masing-masing kelompok mendapatkan lima ekor tikus, dengan perlakuan sebagai berikut:
Tikus I
Disuntik subkutan larutan sianida 1,5 % dosis 15 mg/kg BB.
Kemudian catat saat mulainya timbul gejala sianosis, hilang kesadaran, kejang, kegagalan pernapasan.
Tikus II
Disuntik larutan sianida seperti kelompok I.
Kemudian pada saat gejala sianosis mulai nampak, suntik intra peritoneal dengan larutan sodium nitrit 2% dosis 20 mg/kgBB
Catat saat timbulnya kejang, kegagalan pernafasan dan kematian.
Tikus III
Diperlakukan sama seperti Tikus II. Bedanya, penyuntikan larutan sodium nitrit dilakukan pada saat gejala kejang mulai nampak. Kemudian catat saat timbulnya kematian.
Tikus IV
Disuntik larutan sianida seperti Tikus I.
Kemudian pada saat gejala sianosis mulai nampak, suntik intra peritoneal dengan larutan thiosulfat 25% dosis 125 mg/kgBB.
Catat saat timbulnya kejang, kegagalan pernafasan dan kematian.
Tikus V
Diperlakukan sama seperti Tikus IV.
Bedanya penyuntikan larutan thiosulfat dilakukan pada saat mulai nampak gejala kejang. Kemudian catat saat timbulnya kematian.
Catatan : gejala sianosis ditandai dengan timbulnya warna biru pada daerah sekitar mulut, leher, pantat, mata, perut.
VII. 3. 4. Analisis dan evaluasi hasil
Buatlah tabel yang berisi data purata waktu yang diperlukan untuk timbulnya gejala sianosis, kejang, kegagalan pernafasan dan kematian setelah perlakuan masing-masing kelompok.
Perbedaan waktu untuk masing-masing gejala antar kelompok perlakuan, hitung secara statistik mengikuti tata cara analisis variasi pola searah taraf kepercayaan 95%. Bila memungkinkan analisis statistika dilanjutkan dengan uji Tukey atau uji lain yang sejenis.
VII. 4. Pustaka Acuan
Donatus, I.A. 1990. Toksikologi Pangan (Bab IV, VI, VII). Edisi I. PAU Pangan dan Gizi Universitas Gadjah Mada: Yogyakarta.
Dreistbach, R.H. 1980. Handbook of Poisoning (Chapter 16). 10th ed. Lenge Medical Publications-Marugen Asia (Pte)Ltd : Pasir Panjang.
Lommis, T.A. 1978. (Edisi terjemahan, Alih Bahasa Imono Argo Donatus). Toksikologi Dasar (Bab XI). Edisi III. Ikip press: Semarang.