PROFIL PERTUMBUHAN KALUS DAUN LEMBAGA BIJI
TANAMAN JATROPHA CURCAS PADA MEDIA WHITE
DENGAN MENGGUNAKAN TEKNIK KULTUR
JARINGAN
SKRIPSI
Diajukan Untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh :
Christophorus Aditya Nugraha NIM: 028114135
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
HALAMAN PERSEMBAHAN
“Pergilah ke Rakyat, mulailah dari apa yang
mereka punya, bekerjalah bersama mereka,
hasilkanlah sesuatu yang berguna bagi mereka,
dan apabila mereka sudah mendapatkan atas apa
yang mereka butuhkan, biarlah mereka yang
berkata : “kami sudah bekerja dan menghasilkan
sesuatu bagi kami”
(Mao Tse)
“Jika anda berpikir ke depan, taburlah benih. Jika
anda berpikir 10 tahun ke depan, tanamlah
sebatang pohon. Jika anda berpikir 100 tahun ke
depan, didiklah Rakyat.”
(Kuan Tsu)
”Sesungguhnya segala sesuatu yang tidak kamu
lakukan untuk salah seorang dari yang paling
hina ini, kamu tidak melakukannya juga untuk
Aku.” Sebab, Iman tanpa perbuatan itu kosong.
INTISARI
Tanaman jarak pagar (Jatropha curcas) di Indonesia saat ini masih belum digunakan secara luas untuk bahan pengobatan. Masyarakat Indonesia sering menggunakan tanaman ini sebagai antiseptik, laksatif dan purgatif. Penelitian ini bertujuan untuk memperoleh informasi tentang golongan terpenoid antara kalus hasil budidaya in-vitro dengan biji dari tanaman asalnya.
Penelitian ini merupakan penelitian non-eksperimental deskriptif dengan rancangan acak lengkap pola searah. Eksplan yang berasal dari daun lembaga biji tanaman Jatropha curcas ini ditumbuhkan pada media White dengan penambahan zat pangatur tumbuh yakni Naphthaleneacetic acid (NAA) : Benzylaminopurine (BAP) (2:2). Pengamatan dilakukan terhadap waktu inisiasi kalus, ukuran bobot kalus basah awal dan akhir, grafik pertumbuhan dan hasil KLT kalus dengan biji tanaman asalnya.
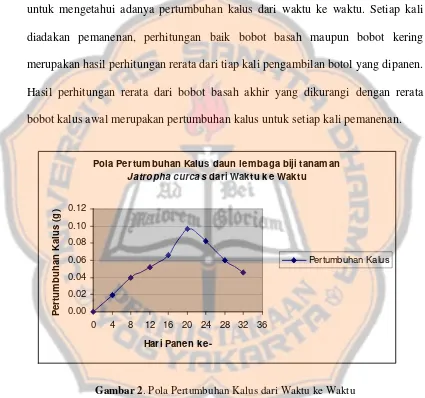
Hasil penelitian menunjukkan bahwa waktu inisiasi kalus pada media White dengan konsentrasi zat pengatur tumbuh 2 : 2 (NAA : BAP) yakni 4 hari. Pada hari ke-20 terjadi pertumbuhan maksimum kalus dimana hal ini juga memperlihatkan fase stasioner. Kandungan air dalam kalus menunjukkan peningkatan saat waktu tanam dan mulai tetap pada hari ke-4 hingga ke-32. Kalus daun lembaga yang berasal dari biji tanaman Jatropha curcas memiliki bercak kromatografi lapis tipis yang sama dengan biji tanaman asalnya dengan menggunakan teknik multiple elution sebanyak 3 kali dengan harga Rf pada kalus sebesar 0,275.
Kata kunci : Jatropha curcas, kalus, kultur jaringan.
ABSTRACT
In Indonesia, at present “jarak pagar” (Jatropha curcas) still widely used as a medicine yet. Indonesian people used this plant as an antiseptic, lacsative and also purgative. The goal of this research is to get some information about the comparison of terpenoid between callus from in-vitro cultivation and seed from the original plant.
This research was a non-experimental descriptive observation using complete randomly arrangement. And then, the explant from cotyledon of Jatropha curcas seed was planted at White medium with concentration of growth hormone 2: 2 for Naphthalene acetic acid: Benzylaminopurine. The variable of observation for this research are time of initiate callus, weight of callus after planted and after harvest and also Thin Layer Chromatography profile of callus and seed from the plant.
The result shows that the time of initiate callus in White medium with the concentration of NAA and BAP (2: 2) are 4 days. At the 20th day there was maximum growth of callus, and it means the stationer phase. The callus water contains get increased when planting and then get stationer from day 4th till 32nd days. The callus from cotyledon of Jatropha curcas has Thin Layer Chromatography spot which is similar with the seed from the plant using multiple elution technique at 3 times with Rf about 0,275.
Keyword : Jatropha curcas, callus, tissue culture.
KATA PENGANTAR
Syukur dan terima kasih ke Hadirat Sang Pencipta atas segala rahmat
tuntunan dan pendampingan serta kasih yang telah dilimpahkan kepada penulis
sehingga dapat menyelesaikan skripsi yang berjudul “Profil Pertumbuhan Kalus Daun Lembaga Biji Tanaman Jatropha Curcas Pada Media White Dengan Menggunakan Teknik Kultur Jaringan” sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi.
Penelitian hingga tahap penulisan skripsi ini tidak akan dapat selesai,
tanpa bantuan serta doa dari beberapa pihak. Oleh karena itu, penulis
mengucapkan terima kasih kepada :
1. Keluarga besar terutama BAPAK dan IBU atas segala doa, nasehat dan
pengorbanannya yang telah mendorong dan menyemangati. Bayu dan Topan
atas doa, pengertian, bantuan dan selalu mengingatkan hingga penulis mampu
menyelesaikan skripsi ini.
2. Bapak Ignatius Yulius Kristio Budiasmoro, M.Si., selaku Dosen Pembimbing
Skripsi yang telah meluangkan waktu untuk memberikan banyak masukan
pengetahuan, kesabaran dan diskusi dalam membimbing selama penelitian dan
penulisan skripsi ini.
3. Ibu Christine Patramurti, M.Si., Apt., selaku Dosen Penguji Skripsi yang telah
bersedia menguji dan memberikan saran demi kesempurnaan skripsi ini.
4. Ibu Erna Tri Wulandari, M.Si., Apt., selaku Dosen Penguji Skripsi yang telah
bersedia menguji dan memberikan saran demi kesempurnaan skripsi ini.
5. Seluruh dosen (khususnya Bpk. Yohanes Dwiatmaka, M.Si., Bpk Dr. Sabikis
dan Bpk Dr. Pudjono, S.U., Apt.) dan karyawan (terutama Bpk Kasiran)
Fakultas Farmasi atas bimbingan selama 4 tahun ini.
6. Seluruh laboran Fakultas Farmasi, terutama laboran Laboratorium Biologi
(Mas Sigit, Mas Wagiran, Mas Andri dan Mas Sarwanto) atas segala bantuan
dan dukungannya selama ini.
7. Teman-teman seperjuangan yang penelitiannya di Laboratorium Kultur
Jaringan (Pak Eko, Vicky, Dony, Melisa dan Ancol). Vero, Mina, Ratna dan
Christin yang telah bersedia membagikan pengetahuan selama penelitian
8. Tjun Liong S.Farm., dan Valentino Dhiyu Asmoro, S.Farm., yang telah ambil
bagian dalam proses dan dinamika melalui diskusi dan debat selama di
Fakultas Farmasi serta seluruh teman-teman kelompok E angkatan 2002 atas
kebersamaan dan bekerjasamanya dalam segala hal dan teman-teman kelas C
yang lain.
9. Sahabat dan teman yang selalu mengingatkan dan mengajarkan arti
kedewasaan dan perjuangan. Heni (atas segala dukungan, perhatian dan kasih
sayang serta telah memberi “warna dan rasa” hidupku). Tedy, Mbatu, Okhi
dan Yoyo (yang telah mengajariku arti sebuah perjuangan untuk berbuat bagi
sesama). Teman-teman BEMU 2005, Insadha 2004 dan seluruh civitas
akademika Universitas Sanata Dharma (yang telah mendewasakanku untuk
mengerti apa arti sebuah kepemimpinan), Bayu, Sumin, Bani, Felix dan Ibu
Bapak kost (yang telah bersedia berbagi keceriaan selama berada di kost).
10.Bangsa dan Negara Republik Indonesia atas keindahan alam, keanekaragaman
hayati dan masyarakat yang plural serta para Pahlawan Nasional (Bung Karno,
Ki Hajar Dewantara, Tan Malaka, Rm. Magunwijaya dll) yang telah
memberikan inspirasi bagiku.
11.Semua pihak yang tidak dapat disebutkan satu persatu yang telah mendukung,
membantu dan mendoakan penulis sehingga dapat menyelesaikan skripsi ini.
Semoga Hyang Maha Kuasa selalu memberikan dan membalas rahmat kasih,
kebaikan dan ketulusan yang telah dirasakan penulis selama ini.
Dalam penelitian dan penulisan Skripsi ini masih banyak kekurangan yang
masih harus diperbaiki. Maka dari itu, penulis masih mengharapkan banyak
masukan saran dan kritik demi kesempurnaan karya skripsi ini sehingga dapat
lebih bermanfaat bagi masyarakat luas.
Yogyakarta, 10 Februari 2007
Penulis.
DAFTAR ISI
Halaman
HALAMAN JUDUL………. i
HALAMAN PERSETUJUAN PEMBIMBING……… ii
HALAMAN PENGESAHAN……… iii
HALAMAN PERSEMBAHAN………. iv
PERNYATAAN KEASLIAN KARYA………. v
INTISARI………... vi
ABSTRACT………. vii
KATA PENGANTAR………... viii
DAFTAR ISI………... xi
DAFTAR TABEL………... xvi
DAFTAR GAMBAR……….. xvii
DAFTAR LAMPIRAN……….. xviii
BAB I. PENGANTAR A. Latar Belakang………... 1
B. Permasalahan………... 2
C. Keaslian Penelitian………... 3
D. Manfaat Penelitian………... 3
E. Tujuan Penelitian………... 4
BAB II. PENELAHAAN PUSTAKA A. Tanaman Jatropha curcas………... 5
1. Nama daerah……… 5
2. Nama ilmiah……… 5
3. Morfologi……… 5
4. Kandungan kimia………... 7
5. Khasiat dan Kegunaan………... 8
B. Terpenoid ………... 10
C. Kultur Jaringan Tanaman………12
1. Kultur jaringan……… 12
2. Kalus………... 14
3. Eksplan……….... 15
4. Menabur eksplan………. 16
5. Sub kultur………... 18
6. Pertumbuhan kalus……….. 18
D. Media Kultur Jaringan………. 19
1. Unsur makro………... 20
2. Unsur mikro……… 21
3. Vitamin………... 22
4. Zat pengatur tumbuh dan hormon...………... 23
5. Bahan pemadat media………... 25
6. Sukrosa……….... 26
7. Lingkungan………... 26
E. Sterilisasi ………... 28
F. Kromatografi Lapis Tipis………... 31
1. Fase diam……… 32
2. Fase gerak………... 33
3. Penempatan cuplikan………... 33
4. Elusi……… 34
5. Deteksi……… 34
6. Penilaian kromatografi…..………... 35
G. Keterangan Empiris.……… 37
BAB III. METODOLOGI PENELITIAN A. Jenis dan Rancangan Penelitian………. 38
B. Definisi Operasional….……….. 38
C. Bahan dan Alat……….……….. 39
1. Bahan……….. 39
2. Alat………... 41
D. Tata Cara Penelitian….……….. 42
1. Determinasi tanaman……….. 42
2. Pemilihan eksplan………... 42
3. Pengumpulan bahan……… 42
4. Pembuatan stok………... 43
5. Pembuatan media……….... 44
6. Sterilisasi………. 45
7. Penanaman eksplan………... 46
8. Inisiasi kalus……….... 47
9. Subkultur………. 47
10.Pemanenan kalus………. 48
11.Analisis pertumbuhan kalus……….... 48
12.Pembuatan serbuk………... 49
13.Uji KLT ekstrak kalus daun lembaga dan biji tanaman Jatropha curcas.. 50
E. Analisis Hasil……….. 51
BAB IV. HASIL PENELITIAN DAN PEMBAHASAN A. Determinasi Tanaman Jatropha curcas…...……… 52
B. Penentuan Eksplan………... 52
C. Waktu Inisiasi Kalus..……….. 55
D. Deskripsi Kalus……….... 57
E. Subkultur……….. 59
F. Analisis Profil Pertumbuhan Kalus……….. 60
1. Pola pertumbuhan kalus………... 60
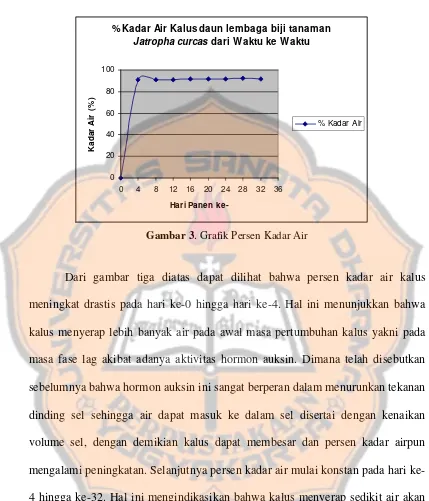
2. Persen kadar air...………... 62
G. Pengeringan dan Pembuatan Serbuk……….... 64
H. Kromatografi Lapis Tipis………... 66
BAB V. KESIMPULAN DAN SARAN A. Kesimpulan……….. 76
B. Saran………... 76
DAFTAR PUSTAKA………... 78
LAMPIRAN………... 81
BIOGRAFI PENULIS………... 89
DAFTAR TABEL
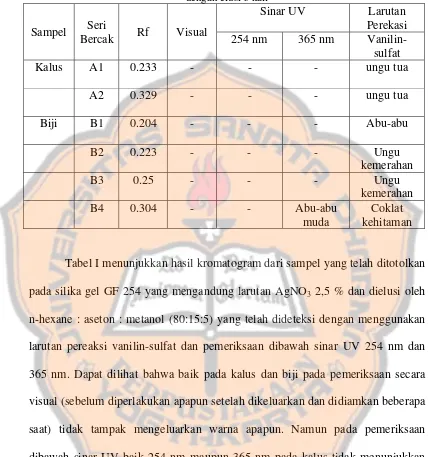
Halaman Tabel I. Data kromatografi lapis tipis dengan fase gerak
n-hexane : aseton : methanol (80:15:5) dan fase diam silika
gel GF 254 yang dicelupkan pada larutan AgNO3 2,5%
di semprot dengan reagen vanillin-sulfat... 70
Tabel II. Data kromatografi lapis tipis dengan fase gerak
n-hexane : aseton : methanol (80:15:5) dan fase diam silika
gel GF 254 yang dicelupkan pada larutan AgNO3 2,5%
di semprot dengan reagen antimon-triklorida ... 72
DAFTAR GAMBAR
Halaman
Gambar 1. Foto pertumbuhan kalus dari waktu ke waktu………. 58
Gambar 2. Pola pertumbuhan kalus dari waktu ke waktu……….. 60
Gambar 3. Persen kadar air………..………... 63
Gambar 4. Struktur isoprene………... 68
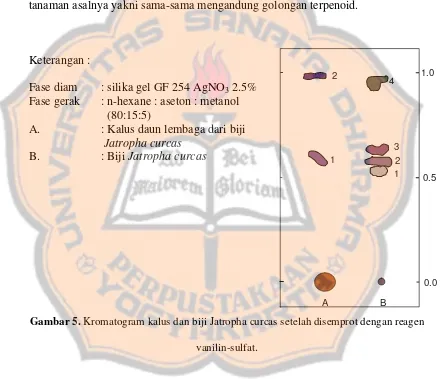
Gambar 5. Kromatogram kalus dan biji Jatropha curcas setelah di semprot dengan reagen vanillin-sulfat……….. 74
Gambar 6. Kromatogram kalus dan biji Jatropha curcas setelah di semprot dengan reagen antimon-triklorida………... 75
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat determinasi tanaman……….……….….. 81
Lampiran 2. Foto-foto hasil penelitian……….……. 82
Lampiran 3. Komposisi media white……….….... 86
Lampiran 4. Hasil penimbangan pemanenan kalus dari hari ke hari... 87
Lampiran 5. Persen kadar air... 88
BAB I PENGANTAR
A. Latar Belakang
Penelitian ini merupakan bagian dari rangkaian besar penelitian untuk
mengeksplorasi budidaya tanaman Jatropha curcas khususnya dengan
menggunakan metode kultur jaringan. Pengembangan budidaya tanaman Jatropha
curcas ini dilakukan dalam rangka penggunaannya sebagai tanaman obat.
Jatropha curcas berpotensi menghasilkan jenis metabolit sekunder yang
bermanfaat dalam bidang farmasi salah satunya yakni terpenoid yang dapat
digunakan sebagai bahan anti-bakteri (Roberto Can Aké, dkk, 2004). Masyarakat
Indonesia biasanya menggunakan daun tanaman ini untuk penyakit eksim, jamur
dan mencegah masuk angin bagi bayi.
Untuk membudidayakan kalus tanaman Jatropha curcas yang nantinya
dapat menghasilkan terpenoid yang diharapkan, maka digunakan dua macam ZPT
yakni Naphthaleneacetic acid (NAA) dan Benzylaminopurine (BAP) merupakan
golongan hormon sintetis (zat pengatur tumbuh) dimana NAA mempunyai fungsi
untuk menginisiasi dan BAP untuk mendorong pertumbuhan kalus. NAA
merupakan golongan ZPT auksin sedangkan BAP adalah golongan ZPT sitokinin.
NAA dan BAP mempunyai kelebihan dibandingkan dengan ZPT golongan auksin
dan sitokinin yang lain, diantaranya yaitu NAA dan BAP relatif tahan terhadap
pemanasan terutama saat proses sterilisasi media, sifat kimia NAA dan BAP stabil
terhadap penguraian yang dilakukan oleh enzim-enzim yang dikeluarkan oleh sel
(Hendaryono dan Wijayani, 1994).
Profil pertumbuhan kalus merupakan salah satu parameter untuk
mengetahui fase pertumbuhan dari kalus yang sedang dikulturkan yakni fase lag,
eksponensial dan penuaan (George dan Sherrington, 1984). Pengolahan kultur
kalus dengan menggunakan sistem bioreaktor memerlukan profil pertumbuhan
kalus untuk mengetahui waktu yang tepat saat pemanenan ataupun penggantian
media kultur sehingga metabolit sekunder yang dihasilkanpun dalam keadaan
optimal (Misawa, M., 1994). Dalam dunia kefarmasian, teknik kultur jaringan
sangat bermanfaat dalam produksi metabolit sekunder yang bernilai ekonomi
dengan cara mengambil metabolit sekunder yang dihasilkan dengan melakukan
pada suatu bioreaktor dimana sistem ini dapat menghasilkan sejumlah besar
metabolit sekunder dalam waktu yang singkat (Hendaryono dan Wijayani, 1994).
Biji tanaman ini mengandung banyak terpenoid (Sinaga, 2005) sehingga
daun lembaga biji digunakan sebagai eksplan untuk dikembangkan secara kultur
jaringan. Media White merupakan medium dasar dengan konsentrasi
garam-garam mineral yang rendah dimana tanaman berkayu lebih suka media yang
berkonsentrasi rendah (Rao dan Lee cit Katuuk, 1979).
B. Perumusan Masalah Permasalahan dalam penelitian ini adalah :
1. Apakah potongan daun lembaga dari biji tanaman Jatropha curcas dapat
2. Seperti apakah profil pertumbuhan kalus daun lembaga dari biji tanaman
Jatropha curcas dalam media White dengan konsentrasi tertentu
Naphthaleneacetic acid (NAA) dan Benzylaminopurine (BAP) ?
3. Apakah kalus daun lembaga yang berasal dari biji tanaman Jatropha curcas
mengandung golongan terpenoid yang sama dengan biji tanaman asalnya?
C. Keaslian penelitian
Sejauh pengamatan peneliti hingga penelitian ini disusun, belum ada
penelitian tentang profil pertumbuhan kalus daun lembaga dari biji tanaman
Jatropha curcas L. pada media White dengan menggunakan teknik kultur
jaringan.
D. Manfaat penelitian 1. Manfaat teoritis
Dengan dilakukannya penelitian ini diharapkan hasilnya dapat membantu
pengembangan ilmu farmasi khususnya mengenai kultur kalus daun lembaga dari
biji tanaman Jatropha curcas untuk menghasilkan metabolit sekunder yang
diinginkan yakni golongan terpenoid.
2. Manfaat praktis
Penelitian ini diharapkan dapat menjadi salah satu sarana informasi untuk
memproduksi metabolit sekunder daun lembaga dari biji tanaman Jatropha curcas
secara cepat dan efisien dengan menggunakan teknik kultur jaringan yakni dengan
E. Tujuan Penelitian 1. Tujuan umum
Penelitian ini dilakukan untuk mengembangkan teknik kultur jaringan
pada daun lembaga dari bijitanaman Jatropha curcas.
2. Tujuan khusus
Berdasarkan pada latar belakang dan permasalahan yang ada, maka tujuan
dari penelitian ini adalah :
a. Mengetahui bahwa daun lembaga dari biji tanaman Jatropha curcas dapat
membentuk kalus dengan teknik kultur jaringan.
b. Mengetahui bentuk profil pertumbuhan kalus daun lembaga dari biji tanaman
Jatropha curcas dalam media White dengan konsentrasi tertentu
Naphthaleneacetic acid (NAA) dan Benzylaminopurine (BAP)
c. Membandingkan hasil KLT kalus daun lembaga yang berasal dari biji tanaman
Jatropha curcas dengan biji tanaman asalnya untuk mengetahui kesamaan
BAB II
PENELAAHAN PUSTAKA
A. Uraian Tanaman Jatropha curcas L. 1. Nama daerah
Nawaih nawas (Aceh); Jarak kosta (Melayu); Jirak (Minangkabau); Jarak
gundul, Jarak iri, Jarak pager, Jarak cina (Jawa); Bintalo (Gorontalo); Bindalo
(Buwol, Sulawesi); Malate, Maka male (Seram) (Sinaga, 2005).
2. Nama ilmiah
Tanaman Jatropha curcas termasuk dalam familia Euphorbiacea. Genus
dari tanaman ini adalah Jatropha L. (Anonim, 2005a).
3. Morfologi
Jatropha curcas sangat baik untuk beradaptasi pada daerah dengan
kondisi yang kering atau kurang subur. Pertumbuhan Jatropha curcas yang baik
justru pada daerah yang panas yaitu pada daerah tropis. Jatropha curcas ini
mempunyai toleransi yang tinggi terhadap kondisi iklim dan tidak sensitif
terhadap lama waktu penyinaran matahari. Tanaman ini merupakan spesies yang
sangat mudah untuk beradaptasi, namun ketangguhan tanaman ini berasal dari
kemampuannya untuk dapat tumbuh pada lahan kritis dan kondisi iklim yang
kering (Anonim, 2005a).
Tanaman Jatropha curcas merupakan tanaman perdu atau pohon kecil,
bercabang-cabang tidak teratur, tinggi sekitar 1–7 meter. Batangnya berkayu,
silindris, bercabang, berkulit licin, memiliki tonjolan-tonjolan bekas tangkai daun
yang gugur. Bila dipatah-patahkan atau terluka, batangnya akan mengeluarkan
getah putih, kental dan agak keruh (Sinaga, 2005).
Tanaman ini merupakan tanaman berdaun tunggal, tersebar di sepanjang
batang. Permukaan atas dan bawah daun berwarna hijau, tetapi permukaan bawah
lebih pucat dari permukaan atas. Daun lebar, berbentuk jantung atau bulat telur
melebar, dengan panjang dan lebar hampir sama, yaitu sekitar 5–15 cm. Helai
daun bertoreh, berlekuk bersudut 3 atau 5. Pangkal daun berlekuk dan ujung dari
pangkal daun meruncing. Tulang daun menjari dengan 5–7 tulang utama. Tangkai
daun panjang, sekitar 4–15 cm (Sinaga, 2005).
Tanaman ini mempunyai bunga majemuk bentuk malai, berwarna kuning
kehijauan, berkelamin tunggal, berumah satu. Baik bunga jantan maupun betina
Jatropha curcas ini tersusun dalam rangkaian berbentuk cawan, muncul di ujung
batang atau di ketiak daun. Jatropha curcas memiliki bunga dengan kelopak 5
buah berbentuk bulat telur, panjang sekitar 4 mm. Benang sari dari tanaman
Jatropha curcas mengelompok pada pangkal, warna kuning. Jatropha curcas
pada tangkai putik berukuran pendek berwarna hijau, dan kepala putik
melengkung keluar berwarna kuning. Mahkota pada putik Jatropha curcas
berjumlah 5 buah, berwarna agak keunguan (Sinaga, 2005).
Buah Jatropha curcas ini berupa buah kotak berbentuk bulat telur,
diameter 2–4 cm, berwarna hijau ketika masih muda dan kuning jika sudah
masak. Buah tanaman ini terbagi menjadi 3 ruang, masing-masing ruang berisi
Ketika biji Jatropha curcas sudah masak ditandai dengan adanya
perubahan warna dari hijau menjadi kuning, sekitar 2 hingga 4 bulan dari masa
fertilisasi. Lapisan kulit yang tipis hitam tersebut didalamnya terdapat biji
Jatropha curcas (Anonim, 2005b), tiap buah terdapat 3 biji, berbentuk elips,
ruang biji berbentuk segitiga elips, 1.5-2 x 1-1.1 cm (Anonim, 2005a). Biji
berbentuk bulat telur memanjang agak bengkok. Sisi cekung dibagi dua di tengah
oleh rafe. Panjang 1.5 cm sampai 2 cm, diameter 10 mm hingga 12 mm. Pada
pangkal biji terdapat tonjolan seperti karunkula. Kulit luar biji (testa) agak rapuh,
warna hitam, tidak rata, agak kasar. Kulit dalam (tegmen) berwarna putih, tipis
berkerut dan beralur-alur. Inti biji berwarna putih sampai kekuning-kuningan.
Lembaga berupa selaput tipis yang lebar, terdapat di antara keping biji (Anonim,
1995a).
4. Kandungan kimia
Pada genus Jatropha secara keseluruhan mempunyai senyawa metabolit
sekunder lainnya yakni lignan, diterpen, triterpen dan peptida siklik (Roberto et
all, 2004). Tanaman Jatropha curcas mengandung bahan kimia diantaranya
triakontranol, kaempesterol, stigmasterol, iteksin, dan asam sianida (HCN). Pada
daun tanaman ini mengandung saponin, flavonoida, tannin, terpenoid dan
senyawa polifenol. Sedangkan batang tanaman ini mengandung sponin,
flavonoida, tannin dan senyawa–senyawa polifenol. Getah Jatropha curcas
mengandung tannin 11–18 persen. Pada bagian biji tanaman Jatropha curcas
mengandung berbagai senyawa alkaloid, saponin, terpenoid dan sejenis protein
5. Khasiat dan kegunaan
Berdasarkan jurnal yang diacu dalam penelitian ini dikatakan bahwa
terpenoid yang berasal dari daun dan akar tanaman jarak dapat digunakan sebagai
bahan anti-bakteri (Roberto Can Aké, dkk, 2004). Bagian dari akar, batang, daun
dan buah dari tanaman ini sudah digunakan secara luas pada pengobatan
tradisional di banyak daerah belahan Afrika barat. Biji dari Jatropha curcas sudah
digunakan sebagai bahan purgatif, anti-helmantik, dan baik digunakan untuk
mengatasi penyakit kulit, asam urat, ascites dan paralisis. Minyak dari biji
tanaman ini sudah digunakan sebagai bahan tambahan pada terapi penyakit
rematik, gatal-gatal dan penyakit parasit kulit serta terapi pada demam, jaundice
dan gonorrhoea, sebagai diuretik dan larutan penyegar mulut. Pada beberapa
daerah tertentu di Afrika, masyarakat mengunyah biji untuk mendapatkan efek
laksatif. Biji Jatropha curcas juga sudah mulai disarankan dalam pengobatan
sebagai bahan chemotherapeutic yang tersedia pada dosis non-letal (Adam, 1974).
Keadaan ini mungkin dilaporkan karena biji Jatropha curcas mempunyai aktivitas
anti-helmantik. Terdapat laporan dari Gabon bahwa 1-2 buah biji cukup untuk
mempunyai aktivitas sebagai bahan purgatif; bila dosis ditingkatkan maka dapat
mengakibatkan kematian (Anonim, 2003). Penyebab kematian diantaranya
disebabkan oleh adanya senyawa toksik yakni cursin dengan cara merusak
dinding pembuluh darah (Perry dan Metzger, 1980).
Getah dari Jatropha curcas diaplikasikan secara langsung pada luka dan
bahan pembalut luka serta sebagai bahan astrigen untuk membersihkan mulut,
cara dikunyah. Getah mempunyai daya antibiotik melawan Candida albicans,
Escherichia coli, Klebsiella pneumoniae, Staphylococcus aureus dan
Streptococcus pyrogens. Selain itu juga mempunyai efek sebagai bahan
anti-koagulasi pada darah (Anonim, 2005a). Getah dari Jatropha curcas mengandung
sebuah alkaloid yang dikenal dengan sebutan jatrophine, dimana dipercayai
mempunyai efek anti-kanker. Juga digunakan secara eksternal pada penyakit kulit
dan rematik serta luka terbuka pada daerah tertentu (Anonim, 2006b). Getah juga
digunakan secara topikal untuk bee dan wasp stings (Duke, 1983).
Ekstrak metanol dari daun Jatropha curcas menghasilkan perlindungan
pada kultur sel lymphoblastoid manusia melawan efek sitopatik dari plasma HIV.
Infusa daun digunakan sebagai bahan diuretik, untuk mandi, terapi batuk, dan
sebagai terapi konvulsan serta penangkal serangan penyakit. Daun juga digunakan
untuk terapi jaundice, demam, sakit rematik, cacingan dan pertumbuhan janin
yang buruk pada ibu hamil. Daun memproduksi getah yang mempunyai efek
haemostasis; daun ini digunakan untuk membungkus luka. Di Ghana, abu bakaran
daun diaplikasikan melalui injeksi rektal untuk terapi haemorrhoids (Anonim,
2005a).
Akar dari Jatropha curcas memperingan pembengkakkan akibat tetanus
dan rasa sakit akibat luka, disentri dan jaundice. Dilaporkan bahwa akar
digunakan sebagai bahan anti-bisa dari gigitan ular. Akar juga digunakan dalam
bentuk sediaan dekok yang mempunyai fungsi sebagai cairan penyegar mulut
digunakan untuk mengobati penyakit skabies, cacing pita dan eksim (Duke,
1983).
B. Terpenoid
Terpen merupakan senyawa hasil kondensasi linear asam asetat dengan
dua atom karbon. Asam asetat melalui berbagai cara akan menjadi asam malonat
yang akhirnya akan menjadi beberapa senyawa terpen. Senyawa ini banyak
terdapat dalam berbagai jenis tanaman sebagai komponen minyak atsiri. Terpen
merupakan senyawa hidrokarbon jenuh atau tidak jenuh dengan jumlah atom
karbon (C) kelipatan 5 (Soemarno cit. Mursyidi, 1990).
Menurut Soemarno (cit. Mursyidi, 1990), istilah terpen kemudian diganti
dengan terpenoid mengingat senyawa hidrokarbon tersebut mempunyai gugus
fungsional yang mengandung atom O dan diketahui bahwa biosintetik terpenoid
merupakan polimerisasi senyawa isopren. Terpenoid biasanya digolongkan
menjadi :
1. Monoterpenoid dengan jumlah atom C = 10.
2. Seskuiterpenoid dengan jumlah atom C = 15.
3. Diterpenoid dengan jumlah atom C = 20.
4. Sesterpenoid dengan jumlah atom C = 25.
5. Triterpenoid dengan jumlah atom C = 30.
6. Tetraterpenoid dengan jumlah atom C = 40.
Secara kimia, terpenoid umumnya larut dalam lemak dan terdapat di
sel kelenjar khusus pada permukaan daun, sedangkan karotenoid terutama
berhubungan dengan kloroplas didalam daun dengan kromoplas di dalam daun
bunga (petal). Biasanya ekstraksi terpenoid dari jaringan tanaman dilakukan
dengan cara memakai petroleum eter, eter atau kloroform dan dapat dipisahkan
secara kromatografi pada silika gel atau alumina. Pemeriksaan golongan terpenoid
dilakukan dengan cara dilakukan penyemprotan dengan asam sulfat pekat dan
kemudian diteruskan dengan pemanasan (Harbone, 1987).
Banyak jenis macam terpenoid sudah diidentifikasi dan diketahui peran
aktif dalam berbagai macam tanaman. Sifat yang cukup kelihatan yaitu dalam
mengatur pertumbuhan. Dua dari golongan utama pengatur tumbuh ialah
seskuiterpenoid absisin dan giberelin yang mempunyai kerangka dasar
diterpenoid. Selain itu golongan karotenoid juga turut berperan bagi tanaman
yakni sebagai pigmen pembantu pada fotosintesis. Golongan terpenoid lain yang
turut membantu tanaman yakni mono- dan seskuiterpen dimana berfungsi untuk
memberi bau dan wangi khas yang sudah diketahui (Harbone, 1987).
Masih dalam dugaan bahwa terpenoid ini turut berperan pada antaraksi
antara tanaman dengan hewan, misalnya sebagai alat komunikasi dan pertahanan
pada serangga. Pada suatu terpenoid tertentu yang tidak mudah menguap telah
diimplikasikan sebagai hormon kelamin pada fungus (Harbone, 1987). Terpenoid
diminati untuk diteliti lebih jauh yakni untuk mengetahui sejauh mana peran
terpenoid sebagai pelindung terhadap serangga yang pada akhirnya dapat
Pada golongan diterpenoid, perhatian besar telah diberikan kepada
segolongan ester diterpenoid rumit yang diisolasi dari tanaman sekeluarga
Euphorbiaceae yang mempunyai aktivitas sebagai antimikrobial, anti tumor
karena efek sitotoksiknya (Roberto et all, 2004), antileukimia dan senyawa
pengiritasi kulit kuat yang pada akhirnya juga sangat bermanfaat sebagai bahan
penelitian sebagai kontrol positif terhadap proses iritasi kulit dan tentunya juga
tingkat iritasi ini telah di standarisasi terlebih dahulu (Robinson, 1991).
Manusia telah melakukan penelitian dan pengembangan terpenoid dalam
rangka untuk meningkatkan taraf kesehatan masyarakat terutama digunakan
sebagai tanaman obat-obatan. Diantaranya telah menunjukkan berbagai macam
aktivitas fisiologis manusia yakni gangguan menstruasi, malaria, kerusakan hati,
fungisida, patukan ular, diabetes dan sebagainya (Robinson, 1991).
C. Kultur Jaringan Tanaman 1. Kultur jaringan
Jenis pembiakan secara vegetatif yang paling mutakhir dan terus
dikembangkan adalah kultur jaringan. Menurut Suryowinoto (1991) cit Katuuk
(1989), kultur jaringan dalam bahasa asing disebut sebagai tissue culture, weefsel
cultuus atau gewebe kultur. Kultur adalah budidaya dan jaringan adalah
sekelompok sel yang mempunyai bentuk dan fungsi yang sama. Maka, kultur
jaringan adalah membudidayakan suatu jaringan tanaman menjadi tanaman kecil
atau planlet yang mempunyai sifat seperti induknya dalam lingkungan aseptis.
oleh Schleiden dan Schwann, yaitu bahwa sel mempunyai kemampuan autonom
yaitu kemampuan tiap sel untuk tumbuh tanpa harus berdiferensiasi namun tiap
sel tadi secara otomatis terkarakterisasi untuk tumbuh menjadi organ baru bagi
tanaman; bahkan memiliki kemampuan totipotensi (Hendaryono dan Wijayani,
1994) yakni kemampuan tiap sel, darimana saja bagian sel itu diambil dan apabila
diletakkan dalam lingkungan yang sesuai akan dapat tumbuh menjadi tanaman
yang sempurna (Suryowinoto, 1991 cit Hendaryono dan Wijayani 1994). Kultur
jaringan merupakan salah satu jenis pembiakan vegetatif dan termasuk dalam
kultur in vitro (Katuuk, 1989).
Dari teori sel Schleiden dan Schwann, umumnya kemampuan totipotensi
ini lebih banyak dimiliki oleh bagian tanaman yang juvenil, muda, dan banyak
dijumpai pada daerah-daerah meristem tanaman (Santoso dan Nursandi, 2002).
Sebab, jaringan meristem keadaannya selalu membelah, sehingga diperkirakan
mempunyai zat hormon yang mengatur pembelahan (Hendaryono dan Wijayani,
1994).
Macam-macam jenis kultur jaringan yang telah berkembang dan
digunakan secara luas saat ini antara lain : kultur meristem yaitu budidaya
jaringan dengan menggunakan eksplan dari jaringan muda atau meristem; kultur
pollen yaitu kultur jaringan dengan menggunakan eksplan dari pollen atau benang
sari; kultur protoplas yaitu kultur jaringan dengan menggunakan eksplan dari
protoplas, dimana protoplas itu sendiri yakni sel hidup yang telah dihilangkan
dinding selnya; kultur kloroplas yaitu kultur jaringan dengan menggunakan
membuat varietas baru); Silangan protoplas/fusi protoplas yaitu menyilangkan dua
macam protoplas menjadi satu, kemudian dibudidayakan sampai menjadi tanaman
kecil yang mempunyai sifat baru (Hendaryono dan Wijayani, 1994).
Budidaya meristem atau embrio bertujuan untuk menumbuhkan kalus dari
eksplan yang ditanam. Eksplan merupakan potongan jaringan atau organ yang
dikulturkan (Hendaryono dan Wijayani, 1994; Katuuk, 1989 ).
Beberapa keunggulan pembiakan vegetatif melalui kultur jaringan adalah
dapat memperbanyak dengan cepat kultivar hibrida baru yang berasal dari satu sel
untuk kegunaan komersil, dapat menciptakan tanaman baru bebas dari penyakit
yang disebabkan oleh virus, dapat memperbanyak tanaman yang sukar
diperbanyak dengan memakai biji, dapat memperoleh tanaman induk yang sama
sifat genetiknya dalam jumlah yang banyak, dan dapat menghasilkan tanaman
baru sepanjang tahun (Katuuk, 1989).
2. Kalus
Kalus sebenarnya adalah proliferasi massa jaringan yang belum
terdiferensiasi. Massa sel ini terbentuk pada seluruh permukaan irisan eksplan,
sehingga semakin luas permukaan irisan eksplan semakin cepat dan semakin
banyak kalus yang terbentuk. Dengan pengambilan metabolit sekunder dari kalus,
biasanya malah dapat diperoleh kandungan lain yang lebih banyak jenisnya,
karena seringkali timbul zat-zat terpenoid atau persenyawaan-persenyawaan
lainnya yang sangat berguna khususnya dalam bidang pengobatan (Hendaryono
dan Wijayani, 1994). Teknik kultur jaringan dicirikan oleh kondisi kultur aseptik,
Pengatur Tumbuh), serta kondisi ruang kultur yang suhu dan pencahayaannya
terkontrol (Yustina, 2003).
Kumpulan sel pada kalus ini belum diketahui jelas apa fungsinya. Kalus
yang terbentuk ini diharapkan terjadi morfogenesis dengan cara pengkulturan
yang berulang-ulang dari media lama ke media yang baru. Teknik pemindahan
eksplan ini disebut subkultur (Hendaryono dan Wijayani, 1994; Katuuk, 1989).
Benzilaminopurin (kelompok sitokinin) dan Naftalen Asam Asetat
(kelompok auksin sintesis) merupakan dua kelompok ZPT yang sering
ditambahkan dalam media kultur. Penggunaan bersama kedua jenis ZPT ini dapat
memberikan pengaruh interaksi terhadap diferensiasi jaringan. Kombinasi ZPT
antara sitokinin group dengan auksin group dengan metode Mohr merupakan
kunci keberhasilan dalam kultur jaringan. Metode ini bertujuan untuk mengetahui
berapa dosis kombinasi ZPT auksin dan sitokinin yang dapat memberikan
pertumbuhan yang paling baik terhadap eksplan yang digunakan (Hendaryono dan
Wijayani, 1994).
3. Eksplan
Eksplan adalah bagian tanaman yang sesuai, yang kemudian dijadikan
semacam benih untuk membentuk pertumbuhan selanjutnya (Wetherell, 1982).
Besarnya ukuran eksplan yang ditanam dalam beberapa kasus menentukan
terbentuknya kalus atau tidak. Eksplan yang berukuran kecil akan cenderung
kalus, sedangkan eksplan yang ukurannya lebih besar potensial untuk
Menurut Soegihardjo (1990), bahan eksplan dapat dipilih sebagai berikut
dengan tumbuhan yang dimaksud :
a. Gymnospermae : tunas kecambah steril atau bagian floem
b. Graminal : lembaga, mesokotil, akar atau bagian batang
c. Dicotyledoneae : kecambah steril (akar, hipokotil, keping biji), batang, umbi
dan daun
d. Zingiberaceae dapat digunakan rimpang muda yang bertunas atau biji.
Menurut George dan Sherington (1984), semakin besar eksplan yang
digunakan maka semakin besar kemungkinan eksplan akan terkontaminasi oleh
mikroorganisme. Oleh karena itu perlu dicari ukuran eksplan yang minimun dan
efektif. Eksplan yang terlalu kecil tidak akan tumbuh secepat eksplan yang
ukurannya terlalu besar. Biasanya eksplan yang terlalu kecil daya tahannya
kurang. Ukuran yang paling baik adalah jika sel berjumlah sekitar 20.000-25.000
buah (Thorpe cit. Katuuk, 1989).
Macam eksplan, ukuran, umur dan cara pembudidayaan akan
mempengaruhi berhasil tidaknya kultur jaringan tanaman dan apakah
morfogenesis akan dapat diimbas dari kultur jaringan tanaman tersebut. Aturan
sederhana yang mungkin dapat digunakan sebagai pegangan adalah bahwa kita
harus menggunakan tanaman sumber eksplan yang sehat dan tumbuh kuat,
memilih jaringan yang muda dan menggunakan eksplan yang cukup besar
4. Menabur eksplan
Menabur eksplan dilakukan didalam laminar air flow dengan kondisi
aseptik. Sebelum kita bekerja di dalam laminar air flow ini, semua perhiasan yang digunakan seperti cincin, jam tangan dan sebagainya harus dilepas, dan tangan
harus dibasuh dahulu dengan alkohol 70%. Dalam menabur eksplan, pekerja harus
menggunakan masker penutup mulut atau hidung (Hendaryono dan Wijayani,
1994).
Penanaman eksplan atau penaburan eksplan dilakukan secara aseptik pada
media padat dan ditekan pelan-pelan agar terjadi persinggungan yang baik antara
eksplan dan media. Selanjutnya media ditutup dengan penutup botol media
erat-erat untuk mencegah penguapan dan inkubasi dilakukan ditempat gelap dengan
penyinaran pada suhu (25±3)0C (Dixon, 1985).
Untuk eksplan yang berupa daun diletakkan telungkup atau telentang,
tetapi berdasarkan pengalaman posisi terbaik adalah bagian dorsal menghadap ke
atas atau ditelungkupkan. Untuk batang atau tunas yang melekat di batang
(cabang) ditancapkan atau diletakkan horisontal. Eksplan yang berupa kepingan
atau irisan tipis dapat diletakkan sedemikian rupa sehingga bagian permukaan
yang luas melekat erat pada media (Soegihardjo, 1990).
Beberapa hari kemudian akan terbentuk kalus pada permukaan eksplan.
Terbentuknya kalus karena pembelahan sel yang cepat dari sel-sel tanaman. Kalus
juga terbentuk karena adanya luka dari bagian tanaman (George dan Sherrington,
5. Subkultur
Menurut Hendaryono dan Wijayani (1994) sub kultur adalah usaha untuk
mengganti media tanam kultur jaringan dengan media yang baru, sehingga
kebutuhan nutrisi untuk pertumbuhan kalus atau protokormus dapat dipenuhi.
Dengan pertumbuhan kalus pada tempat yang tertutup, lama kelamaan akan dapat
menyebabkan terjadinya akumulasi dari metabolit toksis serta dapat menyebabkan
pengeringan dalam media sehingga dapat pecah. Cara pemindahan dilakukan
dengan cara memindahkan kalus ke media baru (segar) dalam keadaan aseptik
(Soegihardjo, 1989).
Subkultur dilakukan setiap 4 minggu untuk media yang tersedia 30 ml.
Pada dasarnya pemindahan kalus sangat beragam tergantung dari kecepatan
pertumbuhan kalus (Soegihardjo, 1989).
6. Pertumbuhan kalus
Mulai dari waktu subkultur atau penaburan inokulum, ada tiga tahap
perkembangan dari kalus, yaitu induksi pembelahan sel, tahap pembelahan sel
aktif dan tahap pembelahan sel lambat atau sel berhenti membelah. Laju
pertumbuhan kalus biasanya ditetapkan secara kuantitatif dengan parameter
indeks pertumbuhan atau pertambahan bobot kalus basah. Pertambahan bobot
kalus basah merupakan selisih antara bobot kalus basah pada periode tertentu
dikurangi bobot kalus mula-mula atau bobot inokulum.
Selanjutnya dari kurva pertumbuhan kalus yang menyatakan hubungan
antara pertumbuhan bobot kalus basah dengan umur kalus dapat diketahui
a. fase lag, yaitu fase dimana belum terjadi pertumbuhan kalus secara nyata. Ini
terjadi beberapa waktu setelah kalus di subkultur serta merupakan masa
adaptasi kalus dengan media yang baru. Pada fase ini pertambahan bobot
kalus hanya sedikit dan hampir terlihat mendatar pada kurva.
b. fase eksponensial, yaitu fase dimana mulai terjadi pertumbuhan kalus.
Pertambahan bobot kalus mulai terlihat nyata dan diikuti fase linier dimana
pertumbuhan kalus terus menaik secara eksponensial seperti garis lurus ke atas
dan berhenti.
c. fase penuaan, yaitu fase dimana pertumbuhan kalus mulai menurun dan
menjadi berhenti. Kalus tidak dapat tahan hidup pada fase ini dalam waktu
yang lama. Sel-sel mulai mati media pertumbuhan kelebihan muatan dan
nutrien telah habis digunakan, sehingga kematian sel menjadi lebih cepat
(George dan Sherrington, 1984).
D. Media Kultur Jaringan
Nutrisi atau unsur- unsur yang dibutuhkan oleh jaringan tanaman
dikelompokkan menjadi dua, yaitu :
a. Garam-garam anorganik yang dibedakan lagi menjadi dua, yaitu unsur makro
(unsur yang dibutuhkan dalam jumlah besar) dan unsur mikro (unsur yang
dibutuhkan dalam jumlah sedikit tetapi harus tersedia).
Jenis- jenis yang termasuk unsur makro adalah Nitrogen, Fosfor, Kalium,
Sulfur, Kalsium, dan Magnesium. Sedangkan unsur mikro meliputi Klor,
b. Garam- garam organik yang terdiri dari sukrosa, vitamin, dan zat pengatur
tumbuh (ZPT).
1. Unsur makro
Kegunaan masing-masing unsur makro yang diperlukan bagi tumbuhan
untuk dapat bertahan hidup dan mendukung pertumbuhannya akan dijabarkan
berikut ini :
a. nitrogen (N). Nitrogen berpengaruh dalam menaikkan daya tumbuh tanaman.
Unsur ini sangat penting dalam proses pembentukan klorofil, terpenoid, asam inti,
beberapa hormon tumbuhan serta asam amino. Bila tanaman kekurangan nitrogen,
akan terlihat pada warna daun yang ada yakni menguning, sedangkan bila terlalu
banyak menyebabkan perkembangan vegetatif akan lebih besar daripada
perkembangan buah. Sumber nitrogen pada media kultur berasal dari amonium
(NH4+) dan yang paling penting nitrat (NO3-). Jumlah amonium yang digunakan
berkisar 2-8 mM sedang nitrat sekitar 25-40 mM.
b. fosfor (P). Dalam jaringan meristematik serta daerah yang cepat pertumbuhan
biasanya banyak terdapat fosfor. Terlalu banyak fosfor dalam media dapt
menghambat pertumbuhan eksplan. Hal ini disebabkan oleh adanya persaingan
penyerapan unsur lainnya seperti seng (Zn), besi (Fe) dan tembaga (Cu). Sumber
fosfor dalam media diberikan dalam bentuk natrium hidrofosfat (NaH2PO4.H2O)
atau kalium hidrofosfat (KH2PO4).
c. potasium (K). Potas adalah unsur yang berguna untuk pembelahan sel, sintesa
karbohidrat dan protein, pembuatan klorofil serta untuk mereduksi nitrat. Potas
melebihi lagi. Bentuk ikatan potasium yang banyak digunakan dalam media kultur
yakni KNO3 dan KH2PO4.
d. magnesium (Mg). Magnesium adalah elemen utama dalam molekul klorofil.
Selain itu magnesium bekerja sebagai aktivator enzim. Dalam media kultur sering
diberikan dalam bentuk MgSO4.7H2O.
e. belerang (S). Belerang terdapat dalam beberapa molekul protein, berguna
untuk perkembangan akar. Belerang diberikan dalam bentuk MgSO4.7H2O atau
{Ca(NO3)2.4H2O}.
2. Unsur mikro
Kegunaan masing-masing unsur mikro yang diperlukan bagi tumbuhan
untuk dapat bertahan hidup dan mendukung pertumbuhannya akan dijabarkan
berikut ini :
a. besi (Fe). Besi berperan dalam sintesis klorofil. Dalam media kultur zat besi
terlebih dahulu dicampurkan dengan EDTA (Asam Etilen Diamin Tetraasetik).
Zat besi tidak boleh dicampurkan secara langsung ke dalam media dikarenakan
sifat zat besi yang tidak mudah larut sehingga dapat menimbulkan endapan.
b. mangan (Mn). Pada tanaman yang tumbuh di tanah, kekurangan mangan dapat
menyebabkan klorotik (tanaman berwarna pucat) dan sering menunjukkan
bintik-bintik hitam yang tidak lain adalah kematian setempat. Dalam media kultur
jaringan, unsur ini berguna untuk membentuk membran kloroplas.
c. boron (B). Memegang peranan penting dalam perombakan gula. Media kultur
yang kekurangan boron dapat mengakibatkan sintesa sitokinin dalam media
d. seng (Zn). Seng merupakn unsur yang penting dalam pembentukan protoplas.
Tanaman yang berkecukupan seng mampu memproduksi auksin IAA endogenous.
e. kobalt (Co). Kegunaan kobalt dalam kultur jaringan adalah untuk
pembentukan asam inti dan juga untuk mengikat unsur nitrogen.
f. tembaga (Cu). Tembaga berperan dalam proses konversi energi.
g. yodium (I). Unsur yodium tidak terlalu diperlukan dalam media, namun sering
digunakan. Beberapa asam amino sering juga mengandung yodium.
h. molibdenum (Mo). Zat ini berguna dalam proses pengikatan nitrogen dari
atmosfer menjadi nitrat dengan bantuan bakteri pengikat N. Selain itu juga
berguna dalam proses pembentukan klorofil. Bila diberikan secara berlebihan
dapat merusakkan jaringan tanaman.
3. Vitamin
Walaupun dalam jumlah kecil, pemberian vitamin dalam media kultur
merupakan suatu keharusan lantaran tanaman yang dikulturkan tersebut belum
mampu untuk membuat vitaminnya sendiri. Adapun jenis vitamin yang sering
diberikan : thiamin HCl dimana berfungsi sebagai koenzim yang membantu daur
asam organik dalam proses respirasi; nicotinamida yaitu suatu koenzim yang
menjadi aktif dalam reaksi cahaya; myo-inositol adalah alkohol gula; asam
panthothenik adalah suatu jenis vitamin B yang bekerja aktif sebagai koenzim dan
berfungsi dalam metabolisme zat lemak; vitamin B6 adalah koenzim yang
membantu reaksi kimia dalam proses metabolisme; choline sebagai terpenoid
yang ada dalam vitamin B kompleks dan riboflavin dimana dikenal dengan
4. Zat pengatur tumbuh (ZPT) dan hormon
Terdapat sebuah perbedaaan antara hormon dan zat pengatur tumbuh.
Moore (1989) (cit. Santoso dan Nursandi 2004) mencirikan atau membedakan zat
tersebut yakni :
a. hormon tanaman adalah senyawa organik dan bukan merupakan nutrisi yang
aktif dalam jumlah kecil (< 1mM) yang disintesis pada bagian tertentu, umumnya
ditranslokasikan ke bagian lain tanaman di mana senyawa tersebut menghasilkan
suatu respon secara biokimia, fisiologis dan morfologis.
b. zat pengatur tumbuh (ZPT) adalah senyawa organik dan bukan merupakan
nutrisi yang dalam konsentrasi rendah (<1 mM) mampu mendorong, menghambat
atau secara kualitatif mengubah pertumbuhan dan perkembangan tanaman.
Selain dari zat makanan pertumbuhan dan perkembangan tumbuhan diatur
oleh hormon tumbuh. Tidak semua sel yang dikulturkan dapat memproduksi
sendiri hormon pengatur tumbuhnya. Eksplan yang terlalu kecilpun juga belum
mampu untuk memproduksi hormon tumbuhnya. Berikut ini akan diberikan
keterangan mengenai beberapa zat pengatur tumbuh yang telah dikenal :
a. golongan auksin. Auksin merupakan hormon tumbuhan yang diproduksi
secara alamiah oleh tumbuhan. Pada pemberian auksin dengan kadar yang relatif
tinggi, kalus cenderung ke arah pembentukan primordia akar. Pengaruh auksin
terhadap perkembangan sel menunjukkan adanya indikasi bahwa auksin dapat
meningkatkan tekanan osmotik, meningkatkan sintesa protein, meningkatkan
permeabilitas sel terhadap air dan melunakkan dinding sel yang diikuti dengan
dengan kenaikan volume sel. Dengan adanya kenaikan sintesa protein, maka dapat
digunakan sebagai sumber tenaga dalam pertumbuhan (Hendaryono dan
Wijayani, 1994). Pengaruh auksin dalam mikropropagasi antara lain adalah untuk
menginduksi pertumbuhan kalus, pembentukan klorofil serta morfogenesis
(Katuuk, 1989). Mekanisme kerja dari auksin yang dapat merangsang
pertumbuhan yaitu auksin merangsang sekresi H+. Ion K+ diambil masuk ke
dalam sel untuk mengimbangi pengeluaran H+ yang menurunkan potensial air
dalam sel sehingga mengakibatkan pengembangan sel. Jenis auksin sintetik yang
sudah ada diantaranya NAA (a-naphtalene acetic acid), 2.4-D (2.4
Dichlorophenoxy acetic acid), IBA (3-indole butyric acid), PCPA
(P-chlorophenoxy acetic acid), IAA (3-indole acetic acid). IAA adalah juga hormon
tumbuhan yang disintesis oleh tumbuhan itu sendiri (hormon alami).
b. Sitokinin. Dalam alam terbuka, sitokinin diantaranya berfungsi mengatur
pertumbuhan melalui pembelahan sel, membantu mengawasi perkecambahan biji
dan menunda penuaan. Sedangkan pada kultur jaringan sitokinin berfungsi
mengatur pertumbuhan serta morphogenesis. Pemberian sitokinin dengan kadar
yang relatif tinggi, differensiasi kalus akan cenderung ke arah pembentukan
primordia batang atau tunas (Hendaryono dan Wijayani, 1994). Sitokinin
diproduksi didalam akar, namun demikian penambahan di dalam media masih
tetap diperlukan. Jika yang akan dikulturkan yakni akar, maka sebaiknya sitokinin
tidak ditambahkan. Sebaliknya apabila eksplan yang akan dikulturkan adalah
pucuk tunas dimana produksi sitokininnya sedikit, maka diperlukan penambahan
amino purine), BA (benzyl adenin) dan FAP (N6-furfurylamino purine) (Katuuk,
1989).
5. Bahan pemadat media
Media tanam dalam kultur jaringan adalah tempat dimana eksplan tumbuh.
Media tanam sangat mutlak keberadaannya karena pada media ini terdapat semua
zat yang diperlukan untuk menjamin pertumbuhan eksplan (Hendaryono dan
Wijayani, 1994). Eksplan yang dikulturkan harus selalu bersinggungan dengan
medianya, tetapi tidak boleh tenggelam sehingga aerasinya baik. Media tanam
tersebut dapat berbentuk cair atau padat. Pada media padat diperlukan bahan
pemadat media. Idealnya, bahan pemadat media harus dapat disterilkan dengan
autoklaf dan gel yang terbentuk ini tidak dapat dicerna oleh enzim-enzim tanaman
serta tidak bereaksi dengan komponen media yang lainnya (Yusnita, 2003).
Zat pemadat media yang sering digunakan yakni berupa agar-agar. Agar
adalah berupa campuran polisakarida dari galaktosa yang diekstrak dari ganggang
laut. Umumnya dapat membentuk gel atau memadat pada suhu 40-450C dengan
titik cair 80-900C. Bentuk cair atau padat dari agar dapat bersifat balik (Yusnita,
2003). Menurut Katuuk (1989) agar memiliki sifat dapat mengikat air. Dengan
semakin tinggi konsentrasi dari agar tadi maka makin kuat dalam mengikat air.
Kepekatan agar yang terlalu tinggi mengakibatkan sulitnya bagi eksplan untuk
mengambil sumber hara yang terlarut dalam media. Kepekatan yang biasa
digunakan yaitu berkisar antara 0.6-0.8%. media yang kurang kadar garam dan
dan hormonnya. Penggunaan agar biasanya sebanyak 8-10 g/l air suling
(Hendaryono dan Wijayani, 1994).
6. Sukrosa
Sukrosa adalah sumber energi yang diperlukan untuk induksi kalus
(Hendaryono dan Ari, 1994), karena dalam kondisi in-vitro tanaman tidak bersifat
autotrof. Hal ini disebabkan botol tempat tumbuh kultur bukan ditempat yang
ideal untuk mendukung proses pertumbuhan yakni proses fotosintesis karena
ditempatkan di tempat yang gelap (Pierik, 1987).
Konsentrasi sukrosa optimum yang sering digunakan dalam proses
pengkulturan berkisar 2-3% atau 20.000-30.000 mg/l (Yusnita, 2003). Tetapi
konsentrasi sukrosa ini juga tergantung pada tipe dan umur eksplan (Pierik, 1987). 7. Lingkungan
Bagi tanaman yang hidup in-vitro, 5 faktor lingkungan utama yang harus
dipenuhi ialah cahaya, suhu, pH, kelembaban dan wadah/botol kultur.
a. cahaya. Cahaya sangat penting bagi kehidupam mikroorganisme. Bagi tanaman
in-vitro cahaya berperan dalam pertumbuhan dan perkembangan yang disebut
fotomorfogenesis. Sehubungan dengan fotosintesis, cahaya belum begitu terlalu
penting bagi kultur jaringan tanaman. Pertumbuhan sel kultur jaringan yang
teratur pada dasarnya tidak dihambat oleh cahaya, malah sebaliknya pembelahan
sel mula-mula pada eksplan serta pertumbuhan jaringan kalus acapkali
dihambat/dibatasi oleh persoalan cahaya.
b. suhu. Pada umumnya kultur jaringan memerlukan suhu sebesar 25-300C.
serta jenis eksperimen yang dilakukan. Suhu yang rendah dapat mempengaruhi
perkembangan embrio.
c. pH. Keasaman dan kebasan media juga merupakan faktor lingkungan eksplan
yang sangat menentukan. Pada umumnya pH yang paling disukai untuk
pertumbuhan sel adalah antara 5-6. Tetapi menurut penelitian dilaporkan bahwa
walaupun sudah diatur, pH akan turun sebanyak 0.5 sesudah autoklaf. Kultur
menjadi asam disebabkan oleh pembentukan asam-asam organik.
d. kelembaban. George dan Sherrington (1984) melaporkan bahwa dalam
penelitian Lane tentang kelembaban relatif, dia menemukan pertumbuhan tidak
normal yang menyebabkan matinya sel. Hal ini bisa terjadi bila kelembaban
dalam botol turun sampai 95%.
e. wadah/botol kultur. Ukuran wadah kultur biasanya juga mempengaruhi
pertumbuhan serta morfogenesis in-vitro. Hal ini barangkali disebabkan oleh
perbedaan konsentrasi CO2 yang tersedia, etilen, gas lain yang berada dalam
wadah (Katuuk, 1989).
Beberapa media dasar yang pada umumnya diberi nama sesuai dengan
nama penemunya, antara lain adalah :
a. Medium dasar Murashige dan Skoog (MS) : digunakan untuk hampir semua
macam tanaman, terutama tanaman herbaceus. Media ini mempunyai konsentrasi
garam-garam mineral yang tinggi dan senyawa N dalam bentuk NO3- dan NH4+.
b. Medium dasar B5 atau Gamborg : digunakan untuk kultur susupensi sel
c. Medium dasar White : Medium ini merupakan medium dasar dengan
konsentrasi garam-garam mineral yang rendah.
d. Medium Vacin Went (VW) : digunakan khusus untuk medium anggrek.
e. Medium dasar Nitsch dan Nitsch : digunakan untuk kultur tepungsari (pollen)
dan kultur sel.
f. Medium dasar Schenk dan Hildebrandt : digunakan untuk kultur jaringan
tanaman monokotil.
g. Medium dasar Woody Plant Medium (WPM) : digunakan untuk tanaman yang
berkayu.
h. Medium dasar N6 : digunakan untuk tanaman serelia terutama padi
(Hendaryono dan Wijayani, 1994).
E. Sterilisasi
Pekerjaan yang paling berat dalam kultur jaringan yakni menciptakan serta
memelihara kondisi aseptis. Jalan yang paling baik untuk mengatasi kehadiran
mikrobial adalah dengan menciptakan semua yang berhubungan dengan kegiatan
kultur jaringan bebas mikrobial, mulai dari material tanaman, perlengkapan,
lingkungan hingga pada cara kerja. Alat maupun teknik aseptik ada
bermacam-macam :
1. Sterilisasi basah
Cara sterilisasi panas basah adalah dengan menggunakan uap air. Alat yang
digunakan pada sterilisasi ini adalah autoklaf. Alat ini biasanya digunakan
proses pengkulturan. Hampir semua mikroba mati sesudah diberi uap air
dengan suhu 1210C selama 10-20 menit. Lama sterilisasi ada aturannya yakni
media 20-75 ml selama 15-20 menit dengan suhu 1210C, media 75-500 ml
selama 20-25 menit dengan suhu 1210C, media 500-5000 ml selama 25-35
menit dengan suhu 1210C dan peralatan gelas/kertas selama 30 menit dengan
suhu 1300C. Manfaat mensterilkan dengan menggunakan autoklaf adalah
prosesnya cepat, sederhana serta sanggup membasmi virus tertentu. Namun
selain itu ada kekurangan yakni dapat menurunkan pH sekitar 0.3-0.5 unit,
dapat merusak substansi yang mudah menguap, bila pemanasan terlau tinggi
gula akan membatu sehingga dapat menjadi racun dalam media.
2. Sterilisasi panas kering
Untuk mensterilkan dengan suhu tinggi dan kering dipakai oven. Biasanya
oven digunakan untuk mensterilkan alat-alat yang tidak mudah terbakar
misalnya bahan yang terbuat dari bahan gelas atau logam. Namun tidak semua
alat dari bahan logam harus disterilkan dengan cara ini, alat-alat seperti mata
pisau serta skapel tidak dapat disterilkan dengan cara ini sebab dapat merusak
ketajaman pisau/alat. Biasanya sterilisasi untuk suhu 1600C memerlukan
waktu 45 menit, 1700C selama 18 menit, 1800C selama 7.5 menit dan 1900C
selama 1.5 menit. Suhu harus selalu tetap di kontrol karena pada suhu 1700C
kertas mulai hancur.
3. Sterilisasi memakai nyala
Instrumen yang telah disterilkan dari oven, dikeluarkan dari bungkusnya
nyala, baru boleh dipakai. Setelah beberapa saat instrumen harus dicelupkan
ke dalam etanol kemudian dibakar. Perlakuan ini berjalan terus selama
kegiatan inokulasi yang berlangsung di dalam kotak transfer.
4. Ultra filtrasi
Beberapa komponen dalam media tanaman tidak stabil dan dapat terurai pada
suhu yang tinggi. Bahan itu meliputi protein, vitamin, asam amino serta sari
tanaman. Untuk sterilisasi, bahan ini ditapis dengan filter. Ayakan mempunyai
lobang dengan ukuran bermacam-macam 0.2-1.0 mikron. Hasil filtrasi
kemudian dituang dalam media.
5. Bahan kimia
Bahan kimia digunakan untuk membasmi mikrobial. Biasanya bahan kimia
yang digunakan hanya untuk mensterilkan bagian permukaan saja meliputi
material tanaman, instrumen, tangan pekerja serta ruangan/kotak transfer.
Bahan yang biasa dipakai :
a. Alkohol digunakan untuk mensterilkan material tanaman, instrumen,
permukaan ruang dan kotak kultur. Untuk material tanaman dipakai alkohol
tujuh puluh persen.
b. Kalsium hipoklorida (Ca(OCl)2) merupakan salah satu bahan pencuci yang
paling efektif dan kurang merusakkan jaringan.
c. H2O2 adalah bahan pencuci yang baik karena sifatnya yang mudah terurai,
sehingga material tanaman hanya dibilas satu kali saja.
d. Sublimat (HgCl2) adalah bahan yang sangat beracun baik bagi tanaman,
6. Cahaya
Ruang dan kotak transfer sukar untuk disterilkan hanya dengan menggosok
alkohol atau bahan kimia pada permukaan. Untuk itu dipakai lampu
germicidal dengan sinar ultraviolet. Keterbatasan menggunakan sinar
ultraviolet yakni untuk bagian yang tidak terkena cahaya maka tidak bisa
disterilisasi, sinar ultraviolet hanya mampu mematikan bentuk bakteri dan
jamur bukan untuk spora (Katuuk, 1989).
F. Kromatografi Lapis Tipis
Teknik identifikasi dan pemisahan senyawa fisikokimia yang paling
banyak dipakai adalah teknik kromatografi. Selain menggunakan teknik
kromatografi kertas (KKt), cara terbaik untuk memisahkan dan mengidentifikasi
senyawa fenol sederhana adalah dengan kromatografi lapis tipis (KLT). Kelebihan
KLT adalah keserbagunaan, kecepatan, dan kepekaannya (Harborne, 1987).
Senyawa fenol dideteksi setelah hidrolisis jaringan tanaman (segar atau
kering) dalam suasana asam, basa, atau setelah pemekatan ekstrak tanaman
(Harborne, 1987). Senyawa yang dipisahkan berupa larutan, ditotolkan pada fase
diam dalam bentuk bercak atau garis. Fase diam yang terdiri atas bahan butiran
halus, ditempatkan pada pelat penyangga gelas atau logam. Campuran akan
dipisahkan berupa larutan akan ditotolkan dan menghasilkan bercak. Fase diam
ini kemudian diletakkan dalam bejana tertutup rapat yang berisi larutan
kapiler (pengembangan), dan bercak pemisahan dideteksi dengan pereaksi-
pereaksi yang lazim untuk senyawa yang dimaksud (Stahl, 1985).
1. Fase diam
Lapisan dibuat dari salah satu fase diam yang khusus digunakan untuk
kromatografi lapis tipis yang dihasilkan oleh berbagai perusahaan. Dua sifat yang
penting dari fase diam adalah besar partikel serta homogenitasnya, karena adesi
terhadap penyokong sangat tergantung pada mereka. Partikel yang butirannya
sangat besar tidak akan memberikan hasil yang baik dan salah satu alasan untuk
menaikkan hasil pemisahan adalah menggunakan fase diam yang butirannya
halus. Sebelum digunakan lapisan disimpan dalam lingkungan yang tidak lembab
serta bebas dari uap laboratorium (Sastrohamidjojo, 2002).
Kebanyakan fase diam yang digunakan adalah silika gel. Silika gel yang
digunakan kebanyakan diberi pengikat (binder), yang dimaksudkan untuk
memberi kekuatan pada lapisan, serta menambah adesi pada gelas penyokong.
Pengikat yang paling sering digunakan yaitu kalsium sulfat. Tetapi biasanya
dalam perdagangan, silika gel telah diberi pengikat dan diberikan nama dengan
kode silika gel G (Sastrohamidjojo, 2002).
Untuk memisahkan terpena berdasarkan jumlah ikatan rangkap ialah
menggunakan plat KLT silika gel yang waktu penyaputannya menggunakan
bubur silika gel yang dibuat dengan larutan 2.5% AgNO3 dalam air, sebagai
2. Fase gerak
Pada kromatografi lapis tipis, fase gerak biasanya terdiri dari atas satu atau
beberapa pelarut. Fase ini bergerak terhadap fase diam, yaitu suatu lapisan
berpori, karena ada gaya kapiler. Pelarut yang digunakan harus mempunyai
kualitas analitik dan bila diperlukan, sistem pelarut multikomponen ini harus
berupa suatu campuran sesederhana mungkin dengan maksimum tiga komponen
(Stahl, 1969).
Pada saat penggunaan fase gerak campuran beberapa pelarut organik
sebaiknya mempunyai kepolaran yang serendah mungkin. Salah satu alasan
penggunaan itu untuk mengurangi serapan dari setiap komponen dari campuran
pelarut. Pelarut mempunyai sifat kepolaran yang tinggi dalam campuran akan
mengakibatkan perubahan sistem menjadi sistem partisi dan campuran larutan
fase gerak dapat dikatakan baik jika dapat memberikan kekuatan bergerak sedang
(Sastrohamidjojo, 2002).
3. Penempatan cuplikan
Penotolan sampel pada kromatografi lapis tipis menggunakan alat
mikropipet berujung runcing. Pada penotolan sampel diusahakan sedekat mungkin
dengan lempeng. Pelarut yang digunakan untuk melarutkan cuplikan sedapat
mungkin larutan yang mudah menguap dan mempunyai polaritas rendah. Garis
akhir dapat dibuat dengan menandai lapisan dengan jarak rambat fase gerak
4. Elusi
Bila sampel telah ditotolkan, lapisan kemudian dimasukkan ke dalam
bejana kromatografi yang sebelumnya telah dijenuhi dengan uap pelarut fase
gerak yang digunakan. Lempeng fase diam dicelupkan dalam fase gerak sedalam
kira-kira 0.5-1.0 cm. Bejana kromatografi ditutup rapat untuk meyakinkan
homogenitas atmosfer dalam bejana, maka dinding dalam bejana dilapisi dengan
lembaran kertas saring yang ujungnya direndam dalam fase gerak
(Sastrohamidjojo, 2002).
Dalam kromatografi lapis tipis terdapat dua metode pengembangan yaitu :
a. Pengembangan sinambung, yakni membiarkan bagian atas lempeng menjulur
keluar melalui sebuah celah pada tutup bejana kromatografi. Bila fase gerak telah
mencapai celah itu maka akan terjadi penguapan yang sinambung, mengakibatkan
aliran pelarut yang tetap pada lempeng (Anonim, 1995b).
b. Pengembangan berulang, yakni setelah dilakukan pengembangan kemudian
dikeringkan lalu dikembangkan lagi pada sistem pelarut yang sama ataupun yang
berbeda hingga didapatkan pemisahan yang baik. Ini sangat berguna pada
pemisahan senyawa yang mempunyai perbedaan polaritas (Moffat, 1986).
5. Deteksi
Pada kromatografi lapis tipis, bercak dari senyawa umumnya tidak
berwarna sehingga untuk menentukan bercak tersebut dapat dilakukan secara
fisika dan kimia.
a. Fisika. Metode-metode fisika yang sering digunakan meliputi fluoresensi sinar
berfluoresensi maka bercak akan terlihat di bawah sinar ultraviolet. Namun jika
senyawa tersebut tidak berfluoresensi ditentukan dengan indikator fluoresensi
pada fase diam sehingga pada bercak akan terlihat hitam sedangkan tempat yang
tanpa bercak berfluoresensi (Stahl, 1969).
b. Kimia. Metode kimia yang sering digunakan untuk mendeteksi bercak pada
kromatografi lapis tipis dengan menyemprotkan suatu pereaksi kimia.
Senyawa-senyawa organik dapat dilakukan dengan penyemprotan H2SO4 pekat. Untuk
pembentukan warna yang optimal diperlukan suhu 2000C kurang lebih selama 10
menit, noda yang akan teramati berwarna hitam. Cara ini efektif untuk
menentukan bercak tetapi tidak baik untuk identifikasi (Sastrohamidjojo, 2002).
6. Penilaian kromatografi
Jarak pengembangan senyawa pada kromatografi lapis tipis biasanya
dinyatakan dengan angka Rf atau hRf .
Jarak rambat bercak Rf =
Jarak rambat fase gerak
Angka Rf berjarak antara 0.00-1.00 dan hanya dapat ditentukan dua desimal.
Sedangkan hRf ialah angka Rf dikalikan faktor 100 menghasilkan nilai berjarak
0-100.
Dalam mengidentifikasi bercak pada pelat kromatogram lazimnya
menggunakan harga Rf (retardation factor). Rf didefinisikan sebagai jarak yang
ditempuh oleh senyawa dibagi dengan jarak yang ditempuh oleh garis depan
Faktor-faktor yang dapat mempengaruhi harga Rf dalam kromatografi
lapis tipis adalah :
a. sifat dari penyerap serta derajat aktivitasnya.
b. tebal serta kerataan lapisan; ketidakrataan lapisan penyerap akan
menyebabkan aliran pelarut menjadi tidak rata pada daerah plat sehingga harga Rf
juga tidak sama.
c. kemurnian fase gerak; pelarut yang tidak murni akan memberikan pemisahan
yang tidak baik. Demikian pula jika fase gerak yang digunakan berupa campuran,
maka perbandingan yang dipakai harus diperhatikan.
d. kejenuhan bejana kromatografi; pemisahan yang dilakukan dalam bejana yang
mempunyai kejenuhan tidak sama mengakibatkan harga Rf tidak sama.
e. suhu; pemisahan sebaiknya dikerjakan pada suhu tetap, hal ini untuk
mencegah perubahan-perubahan dalam komposisi pelarut yang disebabkan oleh
penguapan atau perubahan fase. Jumlah cuplikan yang berlebihan memberikan
tendensi noda berbentuk ekor yang akan mengakibatkan kesalahan harga Rf.
f. kesetimbangan; pada bejana kromatografi yang tidak jenuh dengan uap pelarut
akan menyebabkan pada saat pengembangan untuk permukaan pelarut yang
cekung dan ini akan mengakibatkan fase gerak lebih cepat merambat pada bagian
tepi daripada bagian tengah. Hal ini mengakibatkan kesalahan dalam penentuan
G. KETERANGAN EMPIRIS
Penelitian tentang profil pertumbuhan kalus daun lembaga dari biji
tanaman Jatropha curcas L. pada media White dengan menggunakan teknik
kultur jaringan ini diharapkan dapat memberikan gambaran mengenai daun
lembaga dari biji tanaman Jatropha curcas yang dapat membentuk kalus dengan
teknik kultur jaringan, bentuk profil pertumbuhan kalus daun lembaga dari biji
tanaman Jatropha curcas dalam media White dengan konsentrasi tertentu
Naphthaleneacetic acid (NAA) dan Benzylaminopurine (BAP) serta
membandingkan hasil KLT kalus daun lembaga yang berasal dari biji tanaman
Jatropha curcas dengan biji tanaman asalnya untuk mengetahui kesamaan
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian profil pertumbuhan kalus daun lembaga biji tanaman Jatropha
curcas pada media White dengan menggunakan teknik kultur jaringan ini,
termasuk dalam jenis penelitian non-eksperimental deskriptif dengan rancangan
acak lengkap pola searah yakni subjek uji tidak mendapatkan perlakuan selama
penelitian dan setiap sampel mempunyai kesempatan yang sama untuk dilakukan
pencuplikan dimana sifat penelitian ini adalah melaporkan (mendeskripsikan)
hasil data yang ada selama penelitian.
B. Definisi Operasional
1. Daun lembaga yang digunakan dalam penelitian ini adalah daun lembaga dari
biji yang terdapat di dalam buah tanaman Jatropha curcas yang berusia ± 2
bulan dari saat berbunga, bagian yang dipergunakan adalah daun lembaga tidak
termasuk mata tunasnya. Daun lembaga inilah sebagai subjek uji penelitian.
2. Inisiasi kalus adalah terbentuknya kalus pertama kali yang ditandai dengan
bintik putih pada pinggir eksplan.
3. Bobot kalus basah awal adalah hasil pengurangan bobot media + botol + kalus
dengan bobot botol + media pada saat subkultur.
4. Bobot kalus kering adalah bobot kalus pada saat pemanenan dan sudah
mengalami proses pengeringan di dalam oven pada suhu 40-500C, sampai