Delta Oktaviana
Lab. Kimia Fisika Jurusan Kimia Universitas Negeri Semarang Gedung D8 Lt 2 Sekaran Gunungpati Semarang, Indonesia kode pos 50229
[email protected], 085727804110
ABSTRAK
Pada praktikum persamaan arhenius dan energi aktivasi ini bertujuan untuk mempelajari pengaruh suhu terhadap laju reksi dan menghitung energi aktivasi (Ea) dengan menggunakan persamaan arhenius. Untuk percobaan kali in metode yang digunakan adalah dengan variasii suhu 400C, 360C, 320C, 280C, dan 240C. Setelah melakukan percobaan dengan menggunakan variasi sistem pada suhu dari kedua larutan didapatkan grafik linier yang menggambarkan hubungan 1/T dengan ln K menurut persamaan persamaan y = -23364x - 410242 dengan R2 = 0,9833 Dari grafik ln K dan 1/T diperoleh Ea = 233644 J/mol, ln A= -410242 dan A =12,9245. Maka dari hasil percobaan disimpulkan bahwa pada suhu yang semakin meningkat maka waktu yang diperlukan untuk bereaksi semakin sedikit atau suhu berbanding terbalik dengan waktu. Temperatur berpengaruh pada laju reaksi, jika suhu semakin tinggi maka laju reaksijuaga akan semakin cepat.
Kata kunci : laju reaksi, energi aktivasi, temperatur
ABSTRACT
In the practice of Arrhenius equation and the activation energy is aimed to study the effect of temperature on the rate of correcting and calculating the activation energy (Ea) by using the Arrhenius equation. For the experiment time in the method used is to variasii temperature of. 400C, 360C, 320C, 280C, dan 240C.
After experimenting with using a variation of the system at the temperature of the two solutions obtained linear graph depicting the relationship 1 / T with ln K according to the equation equation y = -23364x - 410 242 with R2 = 0.9833 From
the graph ln K and 1 / T obtained Ea = 233 644 J / mol, ln A = -410 242 and A = 12.9245. Then from the experimental results concluded that the temperature is increasing the time needed to react the less or the temperature is inversely proportional to time. Temperature affects the rate of reaction, if the temperature gets higher, the rate reaction will be faster
PENDAHULUAN
Dalam kinetika, suatu reaksi berlangsung melalui beberapa tahap. Diawali dengan tumbukan antar partikel reaktan. Setelah reaktan bertumbukan, maka akan terjadi penyusunan ulang ikatan dalam senyawa reaktan menjadi susunan ikatan yang berbeda ( membentuk senyawa produk ).
Dalam keadaan transisi kompleks, memiliki campuran antara produk dan reaktan yang cenderung kurang stabil, karena produk yang terbentuk dapat membentuk reaktan kembali. Keadaan ini memiliki energi yang cukup tinggi, karena sistem tidak stabil. Proses untuk mencapai keadaan transisi kompleks membutuhkan energi yang disuplai dari luar sistem. Energi inilah yang disebut dengan energi aktivasi. Pada reaksi endoterm ataupun eksoterm, keduanya memiliki energi aktivasi yang positif, karena keadaan transisi kompleks memiliki tingkat energi yang lebih tinggi dari reaktan.
Dalam penyusunan ini, akan ada pemutusan ikatan dan pembentukan ikatan yang baru, yang membutuhkan sejumlah energi. Ketika beberapa ikatan reaktan putus dan beberapa ikatan baru terbentuk, tercapailah suatu keadaan dimana dalam sistem terdapat sejumlah reaktan dan produk. Keadaan ini kita sebut sebagai transisi kompleks.
Energi aktivasi adalah energi minimum yang dibutuhkan oleh suatu reaksi kimia agar dapat berlangsung. Energi aktivasi memiliki simbol Ea dengan E menotasikan energi dan a yang ditulis subscribe menotasikan aktivasi. Kata aktivasi memiliki makna bahwa suatu reaksi kimia membutuhkan tambahan energi untuk dapat berlangsung.
Pada reaksi endoterm, energi yang diperlukan untuk memutuskan ikatan dan sebagainya disuplai dari luar sistem. Pada reaksi eksoterm, yang membebaskan energi, ternyata juga membutuhkan suplai energi dari luar untuk mengaktifkan reaksi tersebut.
Pada tahun 1889 Arrhenius mengusulkan sebuah persamaan empirik yang menggambarkan pengaruh suhu terhadap konstanta laju reaksi. Persamaan yang diusulkan adalah :
K=A e
Ea RT
Ea = energi aktivasi
Persamaan tersebut dalam bentuk logaritma dapat ditulis :
lnK=lnA−(RTEa)
lnK=−RT xEa T1+lnA
Persamaan tersebut analog dengan persamaaan garis lurus, yang sering disimbolkan dengan y = mx +c, maka hubungan antara energi aktivasi suhu dan laju reaksi dapat dianalisis dalam bentuk grafik ln k vs 1/T dengan gradien –(Ea/RT) dan intersep ln A.
Jika suatu reaksi memiliki reaktan dengan konsentrasi awal adalah a, dan pada konsentrasi pada waktu t adalah a-x, maka dapat ditulis dalam persamaan
k t=ln(a−ax)
Setelah reaksi berlangsung 1/n bagian dari sempurna, x=a/n dan
k= 1 t1/nln(
1 1−1/n)
Beberapa faktor yang mempengaruhi energi aktivasi adalah sebagai berikut : 1. Suhu
Fraksi molekul-molekul mampu untuk bereaksi dua kali lipat dengan peningkatan suhu sebesar 10oC . Hal ini menyebabkan laju reaksi berlipat ganda.
2. Faktor frekuensi
Dalam persamaan ini kurang lebih konstan untuk perubahan suhu yang kecil. Perlu dilihat bagaimana perubahan energi dari fraksi molekul sama atau lebih dari energi aktivasi
3. Katalis
Katalis akan menyediakan rute agar reaksi berlangsung dengan energi aktivasi yang lebih rendah.
Percobaan panas pelarutan asam borat dan asam oksalat ini dilakukan di laboratorium kimia fisik jurusan kimia fakultas matematika dan ilmu pengetahuan alam Universitas Negeri Semarang pada tanggal 20 Oktober 2015
Alat
Alat-alat yang digunakan dalam percobaan ini yaitu tabung reaksi besar sebanyak 10 buah, gelaas piala 600ml, pipet ukur 10ml sebanyak 1 buah dan pipet ukur 5ml sebanyak 1 buah. Es batu, termometer, laku ukur 100ml, 50ml, 20ml, 10ml dan terakhir stopwatch
Bahan
Bahan-bahan yang digunakan dalam percobaan ini adalah aquades, larutan H2O2 0,04M, larutan Na2S2O3 0,04M, larutan KI 0,1M dan larutan amilum 1%
Cara Kerja
Dari percobaan yang telah dilakukan, diperoleh data sebagai berikut.
Siste m
Suhu Awal oC Suhu Akhir oC
Suhu Rata-rata
oC
Waktu (s)
1 40 oC 41 oC 40,5 oC 08.64
2 36 oC 37,5 oC 36,75 oC 09.74
3 32 oC 32 oC 32 oC 12.10
4 28 oC 30 oC 29 oC 16.48
5 24 oC 23 oC 23,5 oC 19.74
Tabel 1. Hasil pengukuran suhu campuran dan waktu yang diperlukan
mgrek H2O2 = M . V . val
= 0,04 x 5 x 2 = 0,4 mgrek
mgrek KI = M . V . val
= 0,1 x 10 x 1 = 1 mgrek
mgrek Na2S2O3 = M . V . val
= 0,001 x 1 x 1 = 0,001 mgrek (pereaksi pembatas)
Mgrek H2O2 bereaksi = mgrek Na2S2O3
kedua larutan hingga terbentuk warna biru untuk pertama kalinya dan mencatat waktunya dengan stopwatch. Waktu ketika terjadi perubahan warna ini yang digunakkan sebagai waktu reaksi. Waktu reaksi ini digunakan untuk menghitung nilai K dan ln K, serta suhu campuran yang terbentuk akan digunakan untuk menghitung 1/T dengan menggunakan persamaan Arrhenius. Setelah memperoleh harga dari masing-masing variabel dapat diperoleh suatu grafik persamaan Arrhenius dengan hubungan antara 1/T pada sumbu x dan ln K pada sumbu Y.
Energi aktivasi dapat ditentukan dengan mengolah data dari grafik hubungan 1/T dan ln k berdasar persamaan Arrhenius yang didapat dar dasar teori. Maka praktikan dapat melakukan percobaan berulang dengan mengukur ln k reaksi dari temperatur yang bervariasi untuk memperoleh data yang akan diolah dalam persamaan tersebut.
Penambahan larutan H2O2 berfungsi sebagai oksidator, yaitu mengubah I- menjadi I2. I- kemudian berikatan dengan Na2S2O3 yang berfungsi sebagai reduktor, I2 berubah kembali menjadi I- yang selanjutnya berikatan dengan larutan amilum. Larutan amilum dalam percobaan ini digunakan sebagai indikator adanya I2. I2 akan bereaksi dengan amilum setelah Na2S2O3 pada campuran habis bereaksi dan hal ini dijadikan sebagai waktu akhir reaksi, waktu dimana muncul warna biru pertama kali (waktu awal reaksi saat kedua tabung dicampur). Larutan amilum yang digunakan dibuat sesaat sebelum percobaan karena larutan ini mudah rusak. H2O2 berfungsi sebagai oksidator yang akan menjadi H2O sedangkan KI sebagai penghasil I2 jika direaksikan dengan H2O2. Reaksi yang diukur adalah reaksi hidrogen peroksida dengan ion iodida. Dalam hal ini, hidrogen peroksida dicampurkan bersamaan dengan iodide, ion tiosulfat dan amilum.
berlangsung pada temperatur yang lebih tinggi. Pada temperatur yang lebih tinggi, ion-ion pereaksi akan memiliki energi kinetik yang lebih besar. Berdasarkan teori tumbukan, energi kinetik yang lebih besar akan membuat tumbukan antar partikel akan menjadi lebih sering, sehingga reaksi akan lebih cepat berlangsung.
Reaksi yang terjadi :
2H2O2 2H2O + O2
I2 + 2S2O32- 2I- + S4O6
2- 2H2O2 + 2I- + S4O62- I2 + 2H2S2O3 + 2O2
Dari percobaan diperoleh untuk suhu 40°C, waktu yang diperlukan yaitu 8 sekon, suhu 36°C = 9 sekon, 32°C = 12 sekon, suhu 28°C = 16 sekon, suhu 24°C = 19 sekon
Perubahan warna yang terjadi akan semakin cepat apabila reaksi berlangsung pada temperatur yang lebih tinggi atau suhu berbanding terbalik dengan waktu. Perubahan suhu umumnya mempengaruhi harga tetapan laju k. Jika suhu dinaikan maka harga k akan meningkat dan sebaliknya. Dari harga k tersebut maka akan dapat dihitung energi aktivasi. Pada temperatur yang lebih tinggi, ion-ion pereaksi akan memiliki energi kinetik yang lebih besar. Berdasarkan teori tumbukan, energi kinetik yang lebih besar akan membuat tumbukan antar partikel akan menjadi lebih sering, sehingga reaksi akan lebih cepat berlangsung.
Disini terlihat adanya penambahan energi kinetik partikel yang dilakukan dengan menaikkan temperatur reaksi, inilah energi yang diberikan dari luar sistem untuk mencapai kondisi transisi seperti yang dijelaskan teori.
Rerata Suhu K
Rata-rata Suhu
Waktu t=... dt
K ln K 1/T
309,75 oK 36,75 oC 9 0,0110 -4,50090 0,003228
305 oK 32 oC 12 0,0090 -4,79149 0,003278
302 oK 29 oC 16 0,0083 -5,08320 0,003311
296,5 oK 23,5 oC 19 0,0062 -5,25909 0,003372
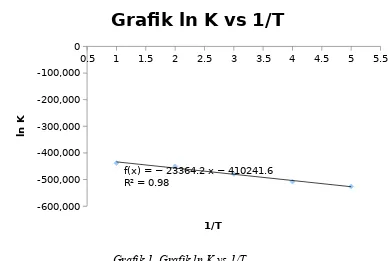
Tabel 2. Nilai ln K dan 1/T
1. Menghitung 1/T
a. T = 40˚C = 313 oK 1/T = 1/313 = 0,003194 b. T = 36,5˚C = 309,75 oK 1/T = 1/309,75 = 0,003228 c. T = 33,5˚C = 305 oK 1/T = 1/305 = 0,003278 d. T = 31˚C = 302 oK 1/T = 1/302 = 0,003311 e. T = 28,5˚C = 296,5 oK 1/T = 1/296,5 = 0,003372
2. Menghitung nilai ln K
a. t = 8 dt K=9,09. 10
−4
0,0091.8 =0,0125 ln K = - 4,38203
b. t = 9 dt K=9,09. 10
−4
0,0091.9 =0,0110 ln K =
-4,50090
c. t = 12 dt K=9,09. 10
−4
0,0091.12=0,0083 ln K = -4,79149
d. t = 16 dt K=9,09. 10
−4
0,0091.16=0,0062 ln K = -5,08320
e. t = 19 dt K=9,09. 10
−4
0.5 1 1.5 2 2.5 3 3.5 4 4.5 5 5.5
-600,000 -500,000 -400,000 -300,000 -200,000 -100,000 0
f(x) = − 23364.2 x − 410241.6 R² = 0.98
Grafk ln K vs 1/T
1/T
ln
K
Grafik 1. Grafik ln K vs 1/T
Berdasarkan persamaan garis y= mx + c dari kurva diperoleh persamaan Y = -23364x - 410242 dengan R2 = 0,9833
Dari persamaan maka gradiennya m= -Ea/R = -23364
Ea = -(m x R) = -(-23364 x 8,314) = 194248,296 J/mol = 194,248296 kJ/mol Intersep = lnA = - 410242
A = 12,9245
Berdasarkan grafik diatas diketahui bahwa grafik yang menunjukkan hubungan konstanta laju reaksi dan suhu tidak berbentuk garis lurus atau linear, melainkan terjadi penyimpangan pada suhu lebih dari 40oC. Hal ini dimungkinkan karena jika suhunya lebih dari 40oC maka amilum yang ada pada larutan akan rusak atau rusak sebagian , sehingga ion iodide yang terbentuk dari perubahan yodium tidak dapat terdeteksi dengan baik.
Kesimpulan
Pada percobaan ini didapatkan grafik linier yang sesuai dengan teori dengan persamaan. y = -23364x - 410242, Ea = 233644 J/mol, ln A=-410242 dan A=12,9245. Grafik linier ini menggunakan variasi 1 / T pada sumbu X dan ln K pada sumbu Y.
Dari grafik linier dapat diketahui bahwa semakin kecil harga ln K maka harga 1 / T rata-rata semakin besar. Ini membuktikan bahwa semakin tinggi temperatur maka energi aktivasinya akan semakin kecil dan semakin sedikit waktu yang diperlukan sehingga akan memperbesar harga laju reaksi. Hal ini sesuai dengan teori dimana energi aktivasi berbanding terbalik dengan laju reaksi. Semakin besar energi aktivasi maka laju reaksinya semakin lambat karena energi minimum untuk terjadi reaksi semakin besar.
Saran
Sebelum melakukan percobaan, sebaiknya praktikan hendaknya melakukan persiapan secara matang dan saat melaksanakan percobaan, praktikan sebaiknya lebih teliti dalam melakukan pengamatan serta ketika percobaan berlangsung hendaknya praktikan harus lebih hati-hati. Selain itu, Sebaiknya praktikan benar-benar menguasai materi praktikum dan alur kerja praktikum sehingga kesalahan dalam pelaksanaan praktikum minim dan hasil praktikum yang diperoleh maksimal.
Daftar Pustaka
Vogel. 1994. Kimia Analisis Kuantitatif Anorganik. Jakarta : Penerbit Buku Kedokteran (EGC).
Castellan GW. 1982. Physichal Chemistry. Third Edition. New York : General Graphic Services.
Atkins PW. 1999. Kimia Fisika. “Ed ke-2 Kartahadiprodjo Irma I, penerjemah;Indarto Purnomo Wahyu, editor. Jakarta : Erlangga. Terjemahan dari : Physichal Chemistry.