FAKTOR – FAKTOR YANG MEMPENGARUHI LAJU
REAKSI
Oleh:
Kelompok CARL BOSCH
Ida Bagus Komang Krisnadewanta,dkk
SMA NEGERI 1 SINGARAJA
DATA KELOMPOK
Judul :
Kelompok : Kelompok Carl Bosch
Ketua Kelompok : Nama : Ida Bagus Komang Krisnadewanta
NIS : 12631
Kelas : XI MIA 2
No : 14
Anggota Kelompok :
Nama : Made Ayu Puspa Mahendrayani NIS : 12654
Kelas : XI MIA 2 No : 02
Nama : Ni Luh Ika Baktyarina NIS : 12663
Kelas : XI MIA 2 No : 10
Nama : Ketut Irwan Riswandi NIS : 12630
Kelas : XI MIA 2 No : 12
Faktor – Faktor yang memperngaruhi Laju reaksi
DAFTAR ISI
2.2 Keguanaan Alat dan Bahan...2
2.3 Variabel Percobaan...2
2.4 Rancangan Percobaan...2
2.5 Prosedur kerja...2
3. HASIL PENGAMATAN...2
3.1 Grafik hubungan Suhu dengan Laju Reaksi...2
3.2 Pembahasan...2
Kegunaan Alat dan Bahan...2
Variabel Percobaan...2
HASIL PENGAMATAN...2
Grafik hubungan Suhu dengan Laju Reaksi...2
KESIMPULAN...2
PENUTUP...2
DAFTAR PUSTAKA...2
KATA PENGANTAR
Puji dan Syukur kami panjatkan ke Hadirat Tuhan Yang Maha Esa, karena berkat limpahan Rahmat dan Karunia-nya sehingga kami dapat menyusun makalah ini dengan baik dan tepat pada waktunya. Dalam makalah ini kami membahas mengenai Faktor –faktor yang mempengaruhi Laju Reaksi.
Makalah ini dibuat dengan berbagai observasi, percobaan dan beberapa bantuan dari berbagai pihak tertentu untuk membantu menyelesaikan tantangan dan hambatan selama mengerjakan makalah ini. Oleh karena itu, kami mengucapkan terima kasih yang sebesar-besarnya kepada semua pihak yang telah membantu dalam penyusunan makalah ini.
Kami menyadari bahwa masih banyak kekurangan yang mendasar pada makalah ini. Oleh karena itu kami mengundang pembaca untuk memberikan saran serta kritik yang dapat membangun kami. Kritik konstruktif dari pembaca sangat kami harapkan untuk penyempurnaan makalah selanjutnya.
Akhir kata semoga makalah ini dapat memberikan manfaat bagi kita semua.
Singaraja, 22 Oktober 2014
KEGIATAN 1
1.
PENGANTAR
Dalam kehidupan kita sehari-hari tidak pernah terlepas dari makanan. Kita sangat membutuhkan makanan karena makanan merupakan sumber energi bagi kita untuk melakukan segala aktivitas dalam hidup. Oleh karena itu, kita selalu berusaha membuat persediaan makanan yang cukup agar bisa kita konsumsi dalam jangka waktu yang lama. Usaha yang biasa kita lakukan yaitu dengan mengawetkan makanan yang disimpan. Pernahkan anda berpikir, mengapa kita sering mengawetkan makanan tersebut dengan menyimpannya dalam lemari es atau pada tempat yang memiliki suhu di bawah 0ºC? Contoh lainnya yaitu penglihatan terhadap tanda silang di bawah gelas kimia. Percobaan ini dilakukan sebanyak tiga kali. Percobaan pertama dilakukan pada suhu 15ºC, percobaan kedua dilakukan pada suhu kamar, percobaan ketiga dilakukan pada suhu 40ºC, dan percobaan keempat dilakukan pada suhu 50ºC. Laju reaksi tersebut dilihat dari waktu yang diperlukan sampai tanda silang di bawah gelas kimia tidak terlihat, yakni saat sejumlah molaritas tertentu dan zat produk terbentuk.
1.1 Rumusan Masalah
Bagaimana pengaruh suhu terhadap kecepatan laju reaksi?
1.2 Hipotesis
Semakin tinggi suhunya, makanya kecepatan laju reaksinya semakin cepat.
1.3 Tujuan Percobaaan
1.4 Manfaat Percobaan
Siswa dapat mengetahui bagaimana hubungan antara suhu dengan kecepatan laju reaksi.
2.
RANCANGAN PERCOBAAN
2.1 Alat dan bahan
Alat
Gelas kimia (Gambar 1)
Gelas ukur (Gambar 2)
Pipet tetes (Gambar 3)
Stopwatch (Gambar 4)
Masker (Gambar 5)
Jas Lab (Gambar 6)
Sarung tangan (Gambar 7)
Alat tulis (Gambar 8)
Tanda silang (Gambar 9)
Kaki tiga
Termometer
Bahan
Larutan Natrium tiosulfat ( Na2S2O3 ) 10 mL
Larutan Asam klorida (HCl) 10 mL
2.2 Keguanaan Alat dan Bahan
Gelas kimia, sebagai tempat terjadinya reaksi atau tempat percampuran kedua larutan serta media pembakaran
Gelas ukur, mengukur larutan yang diperlukan
Pipet tetes, membantu memindahkan zat dari wadah yang satu ke wadah yang lain dalam jumlah yang sangat kecil yaitu setetes demi tetes.
Stopwatch, mengukur waktu yang diperlukan dalam reaksi
Masker, melindungi agar hal-hal yang tidak seharusnya terhirup masuk ke tubuh kita
Jas lab, sebagai alat proteksi diri di laboratorium
Sarung tangan, melindungi tangan dari bahaya larutan atau reaksi
Tanda silang, membantu percobaan
Larutan Natrium tiosulfat ( Na2S2O3 ) dan Larutan Asam klorida (HCl),
sebagai objek percobaan
Kaki tiga, untuk menopang gelas kimia saat pembakaran Larutan Natrium tiosulfat ( Na2S2O3 )
Termometer, untuk mengukur suhu larutan
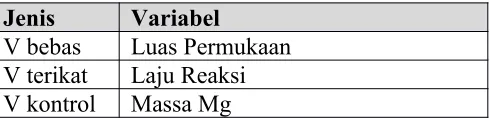
2.3 Variabel Percobaan
Jenis Variabel
Variabel bebas Suhu
Variabel terikat Selang waktu yang dibutuhkan (Laju reaksi)
Variabel kontrol Volume larutan dan jumlah Molar larutan
2.4 Rancangan Percobaan
Buatlah tanda silang pada selembar kertas
Panaskan Larutan Natrium tiosulfat ( Na2S2O3 ) di gelas kimia dengan suhu
yang ditentukan (30o ,45o ,60o )
Letakkan larutan tersebut diatas tanda silang
Masukkan larutan HCl (10mL) ke gelas kimia tersebut. Reaksi akan mengakibatkan pengaburan pengelihatan terhadap tanda silang.
Catat suhu yang diingikan serta lama reaksinya
3. HASIL PENGAMATAN
No. Suhu (Co) Waktu (s) Laju Reaksi (s-1)
1 30o 16.25 0.0062
2 45o 10.05 0.099
3 60o 5.8 0.172
3.1 Grafik hubungan Suhu dengan Laju Reaksi
30 45 60
Pada umumnya reaksi akan berlangsung lebih cepat bila suhu dinaikkan. Dengan menaikkan suhu berarti dengan tidak sengaja kita menaikkan energi kinetik dari molekul-molekul zat yang bereaksi. Sehingga akan lebih banyak molekul yang memiliki energi sama atau lebih besar dan tumbukan yang terjadi akan semakin banyak dengan kata lain molekul-molekul yang bereaksi menjadi lebih aktif mengadakan tabrakan. Dengan frekuensi tumbukan yang semakin besar, maka kemungkinan terjadiya tumbukan efektif yang mampu menghasilkan reaksi juga semakin besar.
Dengan menaikkan suhu, maka hal ini akan memperbesar energi potensial sehingga ketika bertumbukan akan menghasilkan energi.
4.
KESIMPULAN
Suhu merupakan salah satu factor yang mempengaruhi laju reaksi. Bedasarkan percobaan yang telah dilakukan sebelumnya, maka diputuskan bahwa hubungan suhu dengan laju reaksi adalah semakin tinggi suhu maka semakin cepat laju reaksi yang berlangsung karena ketika suhu meningkat gerak kinetik molekul mempercepat, sebaliknya semakin rendah suhu maka semakin lambat gerak kinetik molekul sehingga laju reaksi berlangsung lebih lama.
KEGIATAN 2
1.
PENGANTAR
Dalam kehidupan sehari-hari kita sering menemukan bahwa kayu yang dibelah menjadi serpihan kayu akan lebih cepat terbakar daripada kayu yang dibiarkan dalam bentuk kubus besar. Mengapa hal tersebut bisa terjadi? Hal tersebut menunjukkan bahwa suatu reaksi yg sama dapat berlangsung dengan laju yang berbeda, bergantung pada keadaan zat pereaksi. Hal ini erat kaitannya dengan luas permukaan bidang sentuh suatu zat yang bereaksi. Pengaruh luas permukaan bidang sentuh terhadap laju reaksi dapat diamati dari reaksi yang melibatkan pereaksi dalam bentuk padatan.
Rumusan Masalah
Apakah luas permukaan mempengaruhi laju reaksi suatu zat?
Hipotesis
Luas permukaan mempengaruhi laju reaksi suatu zat
Tujuan
Manfaat
Siswa dapat mengetahui bagaimana hubungan antara luas permukaan dengan kecepatan laju reaksi
RANCANGAN PERCOBAAN
Alat dan Bahan
Gelas Kimia (gambar 1)
Gelas Ukur (gambar 2)
Pipet Tetes (gambar 3)
Stopwatch (gambar 4)
Sarung Tangan Latex (gambar 7)
Masker (gambar 5)
Jas Lab (gambar 6)
Alat Tulis (gambar 8)
( potongan kecil ) dan Mg (pita) dengan massa yang sama
HCl ( 1 M)
Kegunaan Alat dan Bahan
Gelas Kimia (Erlenmeyer) : Tempat terjadinya reaksi Kimia, untuk menjaga keamanan dari semua kemungkinan yang bisa terjadi.
Gelas Ukur : Untuk mengukur volume dari zat – zat yang akan digunakan untuk membuktikan kegiatan 4.
Pipet Tetes (Drop Pipette) : Pipet tetes Pipet tetes berfungsi untuk membantu memindahkan cairan dari wadah yang satu ke wadah yang lain dalam jumlah yang sangat kecil yaitu setetes demi tetes.
Masker : untuk melindungi mata dan wajah dari kecelakaan sebagai akibat dari tumpahan bahan kimia, uap kimia, dan radiasi
Stopwatch : sebagai alat yang digunakan untuk mengukur lamanya waktu yang diperlukan dalam suatu reaksi atau mengukur waktu terjadinya reaksi.
Jas lab : sebagai alat proteksi diri di laboratorium
Sarung tangan : melindungi tangan dari bahaya larutan atau reaksi
Variabel Percobaan Mg ( potongan kecil ) Lebih Cepat Mg (pita) Lebih Lambat
Prosedur Kerja
a. Pertama masukkan Mg ( potongan kecil ) ke dalam larutan HCl ( 1 M ) bersamaan dengan itu siapkan stopwatch. Sambil Mg dimasukkan ke dalam larutan , tekan tombol stopwatch dan amati.
b. Amati hingga reaksi tersebut selesai ditandai dengan hilangnya Mg, secara bersamaan klik kembali stopwatch . dan amati waktu yang dibutuhkan untuk reaksi tersebut.
c. Lakukan hal yang sama untuk Percobaan Mg ( pita ) dengan larutan HCl ( 1 M ).
2 Serpihan / potongan Mg
Banyak 129,2
1 129,2
Analisis Data
Tentukan persamaan reaksi antara CaCO3 dan HCl ! CaCO3 + 2 HCl → CaCl2 + H2O + CO2
Bandingkan luas permukaan bidang sentuh dari kedua bentuk CaCO3!
Zat padat yang berupa serbuk mempunyai permukaan yang lebih luas dibandingkan dengan zat padat yang berupa kepingan, karena dalam bentuk serbuk walaupun ukurannya kecil tetapi dengan jumlah yang banyak sehingga luas permukaan bidang tumbukan antar zat semakin besar.
Buatlah grafik hubungan antara massa CaCO3 (bentuk & ukuran/luas permukaan berbeda) dengan laju reaksi .
Berdasarkan grafik di atas, bagaimanakah pengaruh luas permukaan bidang sentuh terhadap laju reaksi?
Zat padat yang berupa serbuk mempunyai permukaan yang lebih luas dibandingkan dengan zat padat yang berupa kepingan, karena dalam bentuk serbuk walaupun ukurannya kecil tetapi dengan jumlah yang banyak sehingga luas permukaan bidang tumbukan antar zat semakin besar.
KESIMPULAN
Luas permukaan mempengaruhi laju reaksi suatu zat
KEGIATAN 3
PENGANTAR
Kandungan oksigen dalam udara terbuka hanya sekitar 20%. Jika serabut besi dibakar di udara terbuka, akan dihasilkan nyala merah sedikit demi sedikit. Namun ketika serabut besi tersebut dimasukkan ke dalam erlenmeyer yang berisi oksigen murni, maka serabut besi akan terbakar dengan hebat atau dengan kata lain teroksidasi menjadi Fe3O4 dengan cepat. Mengapa hal tersebut dapat terjadi? Hal tersebut
berkaitan dengan konsentrasi oksigen di udara maupun dalam erlenmeyer. Seperti yang telah kita pelajari pada pertemuan sebelumnya, konsentrasi (dalam molar) merupakan jumlah mol zat terlarut dalam satu liter larutan. Laju reaksi pada larutan dengan konsentrasi tinggi akan berbeda dengan konsentrasi rendah.
Suatu percobaan pengaruh konsentrasi terhadap laju reaksi dilakukan dengan mereaksikan HCl 1 M dengan natrium tiosulfat (Na2S2O3) pada konsentrasi 0,1 M; 0,2
M; 0,3 M; dan 0,4 M. Reaksi antara HCl dan Na2S2O3 menghasilkan belerang (S)
berwarna kuning yang dapat menutupi tanda silang di bawah gelas kimia. Laju reaksi tersebut dilihat dari waktu yang diperlukan sampai tanda silang di bawah gelas kimia tidak terlihat, yakni saat sejumlah molaritas tertentu dan zat produk terbentuk
Rumusan Masalah
Bagaimana pengaruh kosentrasi zat terhadap kecepatan laju reaksi?
1.2 Hipotesis
Semakin besar kosentrasi pereaksinya, maka kecepatan laju reaksinya semakin cepat.
Tujuan Percobaaan
Manfaat Percobaan
Siswa dapat mengetahui bagaimana hubungan antara kosentrasi zat dengan kecepatan laju reaksi
RANCANGAN PERCOBAAN
Alat dan bahan
Gelas kimia (Gambar 1)
Gelas ukur (Gambar 2)
Pipet tetes (Gambar 3)
Stopwatch (Gambar 4)
Masker (Gambar 5)
Jas Lab (Gambar 6)
Sarung tangan (Gambar 7)
Alat tulis (Gambar 8)
Tanda silang (Gambar 9)
Larutan Natrium tiosulfat ( Na2S2O3 ) 0.1 M, 0.2 M (10mL)
Larutan Asam klorida (HCl) 1M (5mL)
Kegunaan alat dan bahan
Gelas kimia, sebagai tempat terjadinya reaksi atau tempat percampuran kedua larutan serta media pembakaran
Gelas ukur, mengukur larutan yang diperlukan
Pipet tetes, membantu memindahkan zat dari wadah yang satu ke wadah yang lain dalam jumlah yang sangat kecil yaitu setetes demi tetes.
Stopwatch, mengukur waktu yang diperlukan dalam reaksi
Masker, melindungi agar hal-hal yang tidak seharusnya terhirup masuk ke tubuh kita
Jas lab, sebagai alat proteksi diri di laboratorium
Sarung tangan, melindungi tangan dari bahaya larutan atau reaksi
Alat tulis, untuk mencatat data yang diperoleh bedasarkan hasil percobaan
Larutan Natrium tiosulfat ( Na2S2O3 ) dan Larutan Asam klorida (HCl),
sebagai objek percobaan
Variabel Percobaan
Jenis Variabel
Variabel bebas Kosentrasi Zat
Variabel terikat Selang waktu yang dibutuhkan (Laju reaksi)
Variabel kontrol Volume larutan dan suhu larutan
Rancangan Percobaan
Kosentrasi Zat (M) (variable bebas)
Laju reaksi (s-1)
(variable terikat)
0.1 0.0112
0.2 0.0278
Prosedur kerja
buatlah tanda silang dengan tinta spidol hitam
masukkan 10 ml larutan HCL 1 M ke dalam gelas kimia dan letakkan diatas tanda silang
tambahkan 5 ml larutan dengan konsentrasi 0,1 M, 0,2 M, 0,3 M dan 0,4 M secara bergantian. reaksi tersebut akan menghasilkan endapan belerang yang dapat menutup penglihatan
catat waktu yang diperlukan reaksi untuk menutup tanda silang
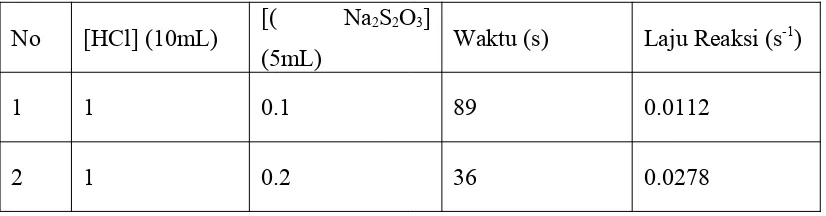
HASIL PENGAMATAN
No [HCl] (10mL) [( Na2S2O3]
(5mL) Waktu (s) Laju Reaksi (s
-1)
1 1 0.1 89 0.0112
2 1 0.2 36 0.0278
Persamaan reaksi
Grafik hubungan Suhu dengan Laju Reaksi
Na
2S
2O
3+ HCl
NaCl
2+ H
2S
2O
30.1 0.2
Pembahasan
Berdasarkan gambar dibawah dapat dilihat bahwa konsentrasi pereaksi berkaitan dengan jumlah partikel zat yang terlibat dalam tumbukan. Bila pereaksi bertambah, maka jumlah partikel-partikel yang bertumbukan akan semakin banyak/meningkat. Dengan demikian jarak antara partikel.zat tersebut menjadi lebih dekat dan jumlah tumbukkan efektif juga akan meningkat. Hal ini berarti terjadi peningkatan laju suatu reaksi. Dan sebaliknya, jika konsentrasi berkurang, maka tumbukan akan sedikit dan laju reaksi juga akan berkurang.
KESIMPULAN
Kesimpulan:
Suatu zat yang bereaksi mempunyai konsentrasi yang berbeda-beda. Konsentrasi menyatakan pengaruh kepekatan atau zat yang berperan dalam proses reaksi. Semakin besar nilai konsentrasi, maka laju reaksi akan semakin cepat. Hal ini dikarenakan zat yang konsentrasinya besar mengandung jumlah partikel yang lebih banyak, sehingga partikel-partikelnya tersususn lebih rapat dibanding zat yang konsentrasinya rendah. Partikel yang susunannya lebih rapat, akan sering bertumbukan dibanding dengan partikel yang susunannya renggang, sehingga kemungkinan terjadinya reaksi makin besar.
KEGIATAN 4
PENGANTAR
Peningkatan laju reaksi melalui peningkatan suhu sering tidak efektif atau tidak dapat dilakukan. Pada kehidupan industri atau di masyarakat, peningkatan laju reaksi sering dilakukan dengan menambahkan zat lain yang tidak mengalami pengurangan ketika reaksi telah selesai. Zat ini disebut sebagai katalis.
Suatu percobaan pengaruh katalis terhadap laju reaksi dilakukan dengan reaksi dekomposisi H2O2 dengan dan tanpa MnO2. Reaksi ini menghasilkan gas O2 yang
ditandai dengan munculnya gelembung-gelembung gas. Gelembung-gelembung gas yang terbentuk, menunjukkan laju dari reaksi tersebut. Buatlah rumusan masalah berdasarkan percobaan tersebut!
Rumusan Masalah
Bagaimanakah pengaruh Katalis terhadap Laju Reaksi ?
Hipotesis
Ada pengaruh Katalis terhadap Laju Reaksi. Jika Laju sebuah reaksi ditambahkan Katalis, maka reaksi tersebut akan terjadi lebih cepat atau dapat dikatakan bahwa Laju Reaksinya lebih cepat, nilai Lajunya besar.
Tujuan Percobaan
RANCANGAN PERCOBAAN
Stopwatch (Gambar 4)
Masker (Gambar 5)
Jas Lab (Gambar 6)
Alat Tulis (Gambar 8)
Sarung Tangan Latex (Gambar 7
Bahan
Hidrogen Peroksida ( H2O2 )
Mangan II Oksida ( MnO2 )
Kegunaan Alat dan Bahan
Gelas Kimia (Erlenmeyer) : Tempat terjadinya reaksi Kimia, untuk menjaga keamanan dari semua kemungkinan yang bisa terjadi.
Gelas Ukur : Untuk mengukur volume dari zat – zat yang akan digunakan untuk membuktikan kegiatan 4.
Pipet Tetes (Drop Pipette) : Pipet tetes Pipet tetes berfungsi untuk membantu memindahkan cairan dari wadah yang satu ke wadah yang lain dalam jumlah yang sangat kecil yaitu setetes demi tetes.
Masker : untuk melindungi mata dan wajah dari kecelakaan sebagai akibat dari tumpahan bahan kimia, uap kimia, dan radiasi
Stopwatch : sebagai alat yang digunakan untuk mengukur lamanya waktu yang diperlukan dalam suatu reaksi atau mengukur waktu terjadinya reaksi.
Jas lab : sebagai alat proteksi diri di laboratorium
Sarung tangan : melindungi tangan dari bahaya larutan atau reaksi
Zat Kimia Hidrogen Peroksida ( H2O2 ) dan Mangan II Oksida
( MnO2 ) : berfungsi sebagai zat yang direksikan untuk membuktikan pengaruh katalis.
Variabel Kerja
Percobaan ini melibatkan berbagai variabel, seperti variabel bebas (variabel yang sengaja diubah-ubah), variabel terikat (variabel yang berubah akibat pemanipulasian variabel bebas), dan variabel kontrol (variabel yang sengaja dikontrol/disamakan agar tidak mempengaruhi hasil percobaan).
Tabel 1. Jenis Variabel
Jenis Variabel
V bebas Penambahan Zat V terikat Kecepatan Laju Rekasi V kontrol Volume
Selanjutnya, buatlah desain percobaan berdasarkan variabel percobaan yang telah Anda tentukan dengan melengkapi tabel di bawah ini!
Tabel 2. Desain/Rancangan Percobaan
Penambahan Zat (Variabel Bebas)
Kecepatan Laju Reaksi (Variabel Terikat)
Penguraian Hidrogen Peroksida H2O2
H2O2 + MnO2
Prosedur Kerja
1) Siapkan Alat dan Bahan yang diperlukan.
2) Masukan zat H2O2 ke dalam tabung Erlenmeyer, dan biarkan di udara terbuka
agar zatnya mengurai.
4) Selanjutnya masukan lagi H2O2 ke dalam tabung Erlenmeyer, tapi kali ini
masukan juga MnO2 yang berfungsi sebagai Katalis.
5) Lalu catat waktu yang diperlukan untuk penguraian H2O2 dengan memasukan
MnO2 yang berfungsi sebagai Katalis.
6) Lalu Bandingkan bagaimana perbedaan antara penguraian Hidrogen Peroksida H2O2 tanpa Katalis, dan Hidrogen Peroksida H2O2 dengan Katalis.
HASIL PENGAMATAN
Tabel 3. Cepat Lambatnya Gelembung Gas O2 yang Terbentuk
No Larutan Pengamatan Keterangan
1 H2O2 Tidak ada Perubahan Tidak terjadi perubahan
(penguraiannya terjadi sangat lambat) 2 H2O2 + MnO2 Muncul gelembung –
gelembung gas, MnO2 tidak
bereaksi
H2O2 terurai dengan ditandai
munculnya gelembung – gelembung gas, tetapi MnO2
tetap atau tidak ikut bereaksi
Analisis Data
Tuliskan persamaan reaksi dari percobaan di atas!
H2O2(l)→ H2(g)+O2(g)
H2O2H2(g)+O2(g)
Apakah fungsi penambahan MnO2? Untuk mempercepat laju penguraian H2O2
Apakah terjadi perubahan dengan MnO2 sebelum dan setelah terjadi reaksi?
MnO2 tetap (tidak ikut bereaksi) sebelum dan setelah terjadi reaksi
Berdasarkan data hasil pengamatan, bagaimanakah pengaruh katalis terhadap laju reaksi?
Penambahan MnO2 hanya mempercepat reaksi penguraian dari H2O2 , tetapi tidak ikut
bereaksi. Jadi, penambahan suatu zat Katalis berfungsi untuk mempercepat laju reaksi tanpa ikut bereaksi.
KESIMPULAN
KESIMPULAN
Laju reaksi adalah kecepatan reaksi kimia yang berlangsung per satuan waktu. Laju reaksi menyatalan molaritas zat terlarut dalam reaksi yang dihasilkam dari tiap detik reaksi. Laju reaksi ini terjadi karena di pengaruhi dari beberapa faktor yaitu :
Luas Permukaan Sentuh atau Bidang
Luas permukaan sentuh memiliki peranan yang penting di dalam laju reaksi, karena jika suatu luas permukaan sentuh itu besar maka laju reaksi akan semakin cepat. Sebaliknya jika semakin kecil luas permukaan benda kecil, maka laju reaksi juga akan melambat, hal ini dikarenakan kecilnya tumbukan yang terjadi antar partikel.
Suhu
Suhu berperan dalam mempengaruhi laju reaksi, karena apabila suhu pada suatu pada suatu reaksi tinggi maka laju reaksi juga semakin cepat. Hal ini dikarenakan partikel semakin aktif bergerak, sehingga tumbukan yang terjadi semakin serin. Sebaliknya jika suhu pada suatu reaksi itu rendah maka laju reaksi semakin kecil, karena partikel tifak aktif bergerak dan tumbukan jarang terjadi.
Katalis
Katalis berfungsi untuk memungkinkan reaksi berlangsung lebih cepat. Katalis dibedakan menjadi dua, yaitu katalis homogen dan heterogen. Katalis heterogen adalah katalis yang ada dalam fase berbeda dengan reaksi yang di katalisnya, sedangkan katalis homogen adalah katalis yang ada dalam fase yang sama dengan reaksi yang di katalisnya.
Molaritas
Hubungan molaritas dengan laju reaksi adalah semakin besar molaritas suatu zat maka semakin cepat suatu reaksi berlangsung, sebaliknya jika molaritas suatu zat kecil, maka laju reaksi berjalan lebih lambat.
Konsentrasi
PENUTUP
DAFTAR PUSTAKA
Karodalnet .2011 .Fungsi Stopwatch .http://karodalnet.blogspot.com/2011/08/fungsi-stopwatch.html. Diakses pada tanggal 14 Oktober 2014, pukul 20.00 WITA. Mengutip “alat yang digunakan untuk mengukur lamanya waktu yang diperlukan dalam suatu reaksi atau mengukur waktu terjadinya reaksi.”.
Anonim. 2013. Fungsi Peralatan Laboratorium. http://ladangbelajarku.blogspot.com/ 2012/09/fungsi-peralatan-laboratorium-yang.html. Diakses pada tanggal 14 Oktober 2014, pukul 21.40 WITA. Mengutip “Gelas Kimia (Erlenmeyer) : Tempat terjadinya reaksi Kimia, untuk menjaga keamanan dari semua kemungkinan yang bisa terjadi.
Gelas Ukur : Untuk mengukur volume dari zat – zat yang akan digunakan untuk membuktikan kegiatan 4.”
Anonim .2011 . ALAT PELINDUNG DIRI (APD) DI LABORATORIUM
.http://kusnadish.blogspot.com/2010/11/alat-pelindung-diri-apd-di-laboratorium.html. Diakses pada tanggal 14 Oktober 2014, pukul 21.53 WITA. Mengutip “Pipet Tetes (Drop Pipette) : Pipet tetes Pipet tetes berfungsi untuk membantu memindahkan cairan dari wadah yang satu ke wadah yang lain dalam jumlah yang sangat kecil yaitu setetes demi tetes.
Masker : untuk melindungi mata dan wajah dari kecelakaan sebagai akibat dari tumpahan bahan kimia, uap kimia, dan radiasi”