3 SITOTOKSISITAS PROTEIN KAPANG LAUT
Xylaria psidii
KT30 TERHADAP Sel Chang dan Sel HeLa
Pendahuluan
Latar belakang
Kanker leher rahim atau disebut juga kanker serviks adalah sejenis kanker yang 99,7% disebabkan oleh human papilloma virus (HPV) onkogenik, yang menyerang leher rahim. Jumlah kematian akibat kanker serviks di dunia diperkirakan lebih dari 300.000 per tahun, dan banyak dari mereka yang meninggal adalah ibu-ibu muda. Tingkat morbiditas kanker leher rahim di
Indonesia menempati posisi pertama dibandingkan dengan kanker yang lain (Canavan dan Doshi 2000).
Kanker leher rahim terjadi jika sel-sel yang ada di daerah tersebut membelah secara tak terkendali dan menjadi abnormal. Jika sel-sel tersebut terus membelah, maka akan terbentuk suatu massa jaringan yang disebut tumor. Tumor dapat bersifat jinak atau ganas. Jika tumor tersebut menjadi ganas, maka keadaannya disebut sebagai kanker leher rahim (Lio 2006).
Pengobatan kanker yang umum dilakukan saat ini adalah dengan cara kemoterapi. Kemoterapi adalah terapi kimia dengan menggunakan zat-zat kemoterapi untuk menekan pertumbuhan kanker. Zat-zat kimia yang digunakan dapat dari hasil sintesis kimia, semisintetik, fitokimia, bioaktif hewan dan dari mikroorganisme (Taneja et al. 2005).
Metode kemoterapi dilakukan dengan cara memberikan obat dalam bentuk senyawa kimia untuk membunuh sel-sel kanker dalam tubuh pasien. Kemoterapi dapat diberikan melalui mulut atau injeksi, kadang-kadang dapat juga langsung pada bagian tubuh yang terkena kanker. Kebanyakan kemoterapi diberikan secara infus melalui pembuluh darah vena. Namun, teknik kemoterapi di samping membunuh sel-sel kanker juga dapat mengakibatkan rusaknya sel-sel normal yang kebetulan menyerap obat tersebut. Efek samping pengobatan ini cukup berat, misalnya mual, muntah, rambut rontok, dan lain-lain (Anica et al. 2011).
Operasi bedah merupakan pilihan efektif untuk tipe kanker yang tidak terikat erat pada jaringan tubuh lainnya, serta sel-sel kankernya terbungkus dalam satu kesatuan. Namun, teknik pembedahan ini menjadi kurang menguntungkan pada jenis kanker terbuka karena dapat meninggalkan sisa-sisa sel kanker yang dapat tumbuh kembali di kemudian hari. Teknik operasi bedah juga tidak dapat digunakan untuk jenis kanker yang sudah bermetastasis. Saat ini dengan mahalnya obat kemoterapi sintetik dan meningkatnya kasus penyakit kanker maka pengobatan kanker difokuskan pada komponen fitokimia dan bioaktif dari mikroba dan hewan yang berpotensi menekan pertumbuhan sel normal atau reaksi metabolik (Kumaran et al. 2009).
Sampai sekarang belum ditemukan obat yang memenuhi kriteria terapi yang optimal terhadap para penderitanya, sehingga perlu dikembangkan obat baru yang mempunyai efek terapi yang baik (Heti 2009). Xylaria psidii KT30 adalah salah
satu jenis kapang yang dapat menghasilkan protein antikanker. Sitotoksisitas kapang laut X. psidii KT30 belum diketahui sehingga penelitian ini bertujuan untuk menentukan sitotoksisitas protein kapang laut X. psidii KT30 terhadap sel Chang (sel normal) dan sel HeLa.
Bahan dan Metode Tempat penelitian
Penelitian ini dilakukan di Laboratorium Mikrobiologi Hasil Perairan Teknologi Hasil Perairan Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) Institut Pertanian Bogor, Laboratorium Mikrobiologi dan Imunologi Pusat Studi Satwa Primata (PSSP) Institut Pertanian Bogor.
Bahan dan alat
Bahan utama yang digunakan dalam penelitian ini adalah kapang laut Xylaria psidii KT30. Pengujian sitotoksisitas digunakan bahan antara lain sel kanker serviks (HeLa ATCC CCL 2), sel hati normal (Chang ATCC CCL 13), Doxorubicin, Fetal Bovine Serum (FBS), Media Rosewall Park Memorial Institute (RPMI) 1640, 3-(4-,5 dimethylthiazol-2-yl)-2,5-difenil tetrazolium bromida (MTT), larutan SDS 10%, HCl, kristal formazan, dan Phosphate Buffered Saline (PBS). Alat-alat yang digunakan dalam penelitian ini adalah tabung reaksi, micropipet, well plate, inkubator MILLIPORE, microplate reader C-MAG HS Series H24 dan sentrifus HIMAC CR 21 G.
Metode penelitian
Uji sitotoksisitas ekstrak protein kapang laut Xylaria psidii KT30 terhadap sel Chang (Hseu et al. 2006)
Pembuatan media sel kanker (LCAG 2009)
Media DMEM bubuk dimasukkan ke dalam botol steril dan ditambahkan 3,7 gram NaHCO3, antibiotik penisilinstreptomisin 1%, dan 10% FBS, kemudian
dihomogenisasi dan ditambahkan akuabides sampai larutan media menjadi 1000 mL.
Persiapan kultur sel Chang (Li et al. 2011)
Sel Chang ditumbuhkan dalam flask yang berisi media DMEM. Sel yang telah tumbuh (menempel pada dinding flask), kemudian medianya dibuang dan sel HeLa dalam flask dibilas dengan larutan PBS. Enzim tripsin ditambahkan sebanyak 5 mL, lalu dinkubasikan selama 5 menit, kemudian ditambahkan media DMEM. Suspensi tersebut disentrifuse pada kecepatan 700g selama 5 menit. Supernatan yang diperoleh dibuang dan pelet (sel Chang) yang diperoleh
ditambah dengan 5 mL DMEM. Jumlah sel Chang dihitung hingga masing-masing sumur akan terisi 5.000 sel dalam 100 μL kultur sel Chang, dan
dimasukkan ke dalam tiap sumur sebanyak 96 sumur. Kultur sel tersebut diinkubasi selama 24 jam (over night) dalam inkubator CO2.
Sitotoksisitas protein
Kultur sel Chang yang telah diinkubasi selama 24 jam medianya dibuang, kemudian dilanjutkan dengan penambahan sampel protein dari kapang laut X. psidii KT30. Sampel protein yang diuji yaitu protein kasar dan protein fraksi terpilih. Tahap awal perlakuan sampel protein adalah dengan membuat stok larutan sampel dengan konsentrasi masing-masing 10.000 ppm, yang dibuat dengan cara melarutkan 10 mg sampel protein dengan 50 μL DMSO, kemudian ditambah dengan 950 μL DMEM. Masing-masing larutan sampel protein diencerkan dengan menambahkan DMEM untuk mendapatkan konsentrasi akhir pada microplate. Konsentrasi yang digunakan pada semua sampel adalah 7, 16, 32, 75, 150, 250, 500, dan 1.000 ppm. Sumur microplate yang berisi sel Chang dari tahap sebelumnya (kultur sel Chang), ditambahkan 100 μL larutan sampel protein yang uji di atas sebagai perlakuan, dan ditambahkan 100 μL DMEM sebagai kontrol negatif. Campuran dalam microplate tersebut diinkubasi selama 48 jam dalam inkubator CO2.
Uji sitotoksisitas dengan MTT (CCRC 2000)
Sel Chang yang telah diinkubasi 48 jam, dimasukkan garam tetrazolium 5 mg/mL sebanyak 10 μL tiap sumur. Warna campuran menjadi kuning. Inkubasi selama 4 jam pada inkubator CO2. Setelah diinkubasi dan telah terbentuk kristal
formazan, larutan ekstrak dibuang. Kristal formazan yang terbentuk dilarutkan dengan 100 μL etanol 96% pada tiap sumur. Warna larutan menjadi ungu. Nilai absorban dari formazan yang terbentuk diukur dengan microplate reader pada panjang gelombang 595 nm. Semua perlakuan dilakukan triplo.
Uji sitotoksisitas ekstrak protein kapang laut Xylaria psidii KT30 terhadap sel HeLa (Hseu et al. 2006)
Pembuatan media sel kanker (LCAG 2009)
Media DMEM bubuk dimasukkan ke dalam botol steril dan ditambahkan 3,7 gram NaHCO3, antibiotik penisilinstreptomisin 1%, dan 10% FBS, kemudian
dihomogenisasi dan ditambahkan akuabides sampai larutan media menjadi 1.000 mL.
Persiapan kultur sel HeLa (Li et al. 2011)
Sel HeLa ditumbuhkan dalam flask yang berisi media DMEM, setelah sel tumbuh (menempel pada dasar flask), media dibuang dan sel HeLa dalam flask dibilas dengan larutan PBS. Setelah itu, dimasukkan enzim tripsin sebanyak 5 mL, lalu dinkubasikan selama 5 menit, dan kemudian ditambahkan media DMEM. Suspensi tersebut disentrifuse pada kecepatan 700g selama 5 menit. Supernatan yang diperoleh dibuang dan pellet (sel HeLa) yang diperoleh ditambah dengan 5 mL DMEM. Jumlah sel HeLa dihitung hingga masing-masing sumur akan terisi 5.000 unit sel dari 100 μL kultur sel HeLa, dan dimasukkan ke dalam tiap sumur sebanyak 96 sumur. Kultur sel tersebut diinkubasi selama 24 jam (over night) dalam inkubator CO2.
Sitotoksisitas protein
Kultur sel HeLa yang telah diinkubasi selama 24 jam medianya dibuang, kemudian dilanjutkan dengan perlakuan ekstrak. Protein yang diuji meliputi protein kasar dan protein fraksi terpilih. Tahap awal perlakuan sampel adalah dengan membuat stok larutan sampel protein dengan konsentrasi masing-masing 10.000 ppm yang dibuat dengan cara melarutkan 10 mg sampel protein dengan 50 μL DMSO, kemudian ditambah dengan 950 μL DMEM. Masing-masing larutan sampel protein kemudian diencerkan dengan menambahkan DMEM untuk mendapatkan konsentrasi akhir pada microplate. Konsentrasi yang digunakan pada sampel yang diuji meliputi protein kasar, protein fraksi terpilih adalah 30, 60, 90, 180, 270, 360, 720, dan 1080 ppm. Sumur microplate yang berisi sel HeLa dari tahap sebelumnya (kultur sel HeLa), ditambahkan 100 μL larutan sampel protein yang uji di atas sebagai perlakuan dan ditambahkan 100 μL DMEM sebagai kontrol negatif. Campuran dalam microplate tersebut diinkubasi selama 48 jam dalam inkubator CO2.
Uji sitotoksisitas dengan MTT (CCRC 2000)
Sel HeLa yang telah diinkubasi 48 jam, dimasukkan garam tetrazolium 5 mg/mL sebanyak 10 μL tiap sumur. Campuran garam tetrazolium yang berwarna kuning diinkubasi selama 4 jam pada inkubator CO2. Larutan ekstrak
dibuang setelah terbentuk kristal formazan. Kristal formazan yang terbentuk dilarutkan dengan 100 μL etanol 96% pada tiap sumur. Warna larutan menjadi ungu. Nilai absorban dari formazan yang terbentuk diukur dengan microplate reader pada panjang gelombang 595 nm. Semua perlakuan dilakukan triplo.
Analisis Data
Data yang diperoleh dari uji sitotoksisitas dengan MTT berupa nilai absorban tiap sumur, kemudian nilai absorban tersebut dikonversi menjadi % inhibisi dengan menggunakan rumus (Zhang et al. 2005):
% Inhibisi = A kontrol−A sampel x 100%. A kontrol
Analisis statistik untuk membandingkan inhibisi tiap ekstrak dilakukan dengan menggunakan One-Way ANOVA dengan SPSS. Jika terdapat perbedaan yang nyata, maka analisis dilanjutkan dengan uji Duncan menggunakan program SPSS.
Hasil dan Pembahasan
Sitotoksisitas protein kapang laut Xylaria psidii KT30 pada sel Chang
Uji sitotoksisitas dalam penelitian ini dilakukan untuk melihat seberapa besar tingkat sitotoksisitas protein kasar, protein F3.1, F3.2, dan F4 kapang laut Xylaria psidii KT30 terhadap sel normal (Chang) dan sel HeLa. Uji sitotoksisitas awal dilakukan terhadap sel Chang. Sel Chang adalah kultur sel yang diisolasi dari hati manusia.
Uji MTT merupakan uji yang sensitif, kuantitatif, dan terpercaya. Reaksi MTT merupakan reaksi reduksi selular yang didasarkan pada pemecahan garam
tetrazolium MTT berwarna kuning menjadi kristal formazan berwarna biru keungguan (Basmal et al. 2009). Metode perubahan warna tersebut digunakan untuk mendeteksi adanya proliferasi sel. Sel yang mengalami proliferasi, mitokondria akan menyerap MTT sehingga sel-sel tersebut akan berwarna ungu akibat terbentuknya kristal tetrazolium (formazan). Konsentrasi formazan yang berwarna ungu dapat ditentukan secara spektrofotometri visibel dan berbanding lurus dengan jumlah sel hidup. Semakin besar absorbansi menunjukkan semakin banyak jumlah sel yang hidup (Depamede et al. 2009).
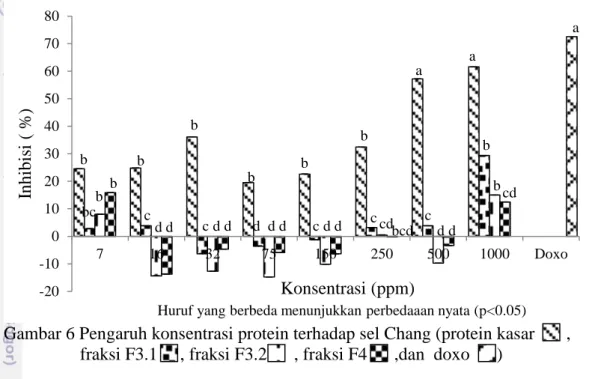
Gambar 6 Pengaruh konsentrasi protein terhadap sel Chang (protein kasar , fraksi F3.1 , fraksi F3.2 , fraksi F4 ,dan doxo )
Gambar 6 menunjukkan hasil fluktuatif antara penambahan konsentrasi sampel protein kasar dan fraksi terpilih terhadap persen inhibisi sel Chang. Protein kasar pada konsentrasi 500 dan 1.000 ppm serta kontrol positif (doxorubicin) menunjukkan hasil yang berbeda nyata, sedangkan sampel protein kasar dan fraksi protein terpilih pada konsentrasi 7, 16, 32, 75, 150 dan 250 ppm tidak berbeda nyata terhadap persen inhibisi sel Chang.
Persen inhibisi tertinggi (61,53%) pada sel Chang terlihat pada protein kasar konsentrasi 1.000 ppm, sedangkan pada fraksi terpilih (F3.1, F3.2 dan F4) pada konsentrasi 1.000 ppm hanya memiliki persen inhibisi berturut-turut 29,39%, 15,01%, dan 15,01%.
Nilai IC50 semua konsentrasi protein kasar dan protein fraksi F3.1, F3.2
dan F4 hasil fraksinasi dari kapang laut Xylaria psidii KT30 pada penelitian ini tidak bisa ditentukan karena pada konsentrasi ekstrak terbesar (1.000 ppm) tidak menghasilkan % inhibisi lebih dari 50% terhadap sel Chang. Nilai IC50 protein
kasar dan protein fraksi terpilih kapang laut terhadap sel Chang disimpulkan lebih dari 1.000 μg/mL.
Doxorubicin digunakan sebagai kontrol positif. Doxorubicin merupakan salah satu agen kemoterapi yang sudah digunakan sebagai obat antikanker (Arafa et al. 2005). Kontrol positif (doxorubicin) dengan konsentrasi 3 ppm menunjukkan persen inhibisi sebesar 72,52% terhadap sel Chang. Jika dibandingkan dengan kontrol positif yang digunakan maka fraksi F4 kapang laut
-20 -10 0 10 20 30 40 50 60 70 80 7 16 32 75 150 250 500 1000 Doxo Inhibi si ( % ) Konsentrasi (ppm) b bc b b b c dd b c d d b d d d b c d d b c cd bcd a c d d a b b cd a
X. psidii KT30 masih memiliki persen inhibisi yang lebih rendah dalam membunuh sel normal sehingga lebih aman untuk digunakan sebagai agen antikanker. Heti (2009) melaporkan bahwa terapi dikatakan berhasil baik bila dosis yang digunakan dapat mematikan sel tumor yang ganas dan tidak mengganggu sel normal yang berproliferasi.
Sitotoksisitas protein kapang laut Xylaria psidii KT30 pada sel HeLa
Sel kanker merupakan sel abnormal yang telah mengalami transformasi dari sel normalnya. Sel kanker dapat digunakan sebagai model biologi untuk menentukan sifat-sifat biologisnya dan analisis obat-obatan sebagai agen antikanker. Penelitian resistensi obat kanker menggunakan sel kanker dapat digunakan untuk mempelajari mekanisme pengaturan resistensi obat-obatan untuk penyakit kanker (Arya et al. 2011).
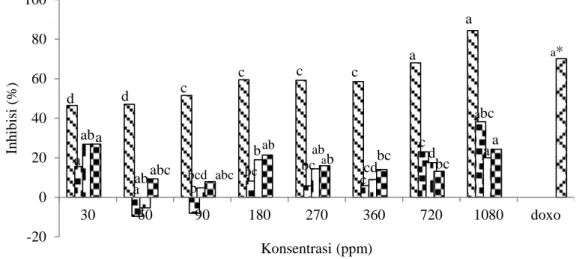
Gambar 7 Pengaruh perlakuan konsentrasi protein terhadap sel HeLa (protein kasar , fraksi F3.1 , fraksi F3.2 , fraksi F4 , dan doxo*(Suci 2013 ) )
Gambar 7 menunjukkan hasil fluktuatif antara penambahan konsentrasi sampel protein kasar dan fraksi terpilih terhadap persen inhibisi sel HeLa. Protein kasar pada konsentrasi 720 dan 1.080 ppm serta kontrol positif (doxorubicin) menunjukkan hasil yang berbeda nyata, sedangkan pada sampel protein kasar dan fraksi terpilih pada konsentrasi 30, 60, 90, 180, 270, dan 360 tidak berbeda nyata terhadap % inhibisi sel HeLa (< 0.05).
Nilai IC50 semua konsentrasi protein fraksi F3.1, F3.2 dan F4 hasil
fraksinasi dari kapang laut Xylaria psidii KT30 pada penelitian ini tidak bisa ditentukan karena pada konsentrasi terbesar (1.080 ppm) tidak menghasilkan persen inhibisi lebih dari 50% terhadap sel HeLa. Pada konsentrasi 30 ppm, fraksi F4 telah membunuh sel HeLa sebesar 26,85%. Suci (2013) melaporkan bahwa doxorubicin dengan konsentrasi 3 ppm menunjukkan persen inhibisi sebesar 70,13% terhadap sel HeLa. Jika dibandingkan dengan persen inhibisi sampel protein kasar dan protein fraksi F3.1 dan F3.2 maka fraksi F4 lebih berpotensi sebagai agen antikanker.
-20 0 20 40 60 80 100 30 60 90 180 270 360 720 1080 doxo In h ib is i (% ) Konsentrasi (ppm) d a ab a d a ab abc c c c c a a b abc bcd bc b ab bc ab ab c cd bc c d bc abc a a a*
Berdasarkan National Cancer Institute (2012), nilai ini menunjukkan aktivitas antikanker protein hasil fraksinasi X. psidii KT30 sangat lemah terhadap sel HeLa, sedangkan protein kasar protein kapang laut memiliki nilai IC50
69,89 μg/mL (Tabel 4). Sitotoksisitas protein fraksi terpilih yang rendah terhadap sel HeLa karena proses fraksinasi yang dilakukan belum optimal sehingga belum menghasilkan senyawa tunggal. Sel HeLa diduga bersifat resisten terhadap
senyawa-senyawa bioaktif yang terdapat dalam protein kapang laut X. psidii KT30. Kumala (2010) melaporkan kapang endofit isolat 1.3.11 yang
diisolasi dari Brucea javanica terbukti bersifat sitotoksik terhadap sel kanker payudara MCF-7 dan T47D dengan IC50 berturut-turut 48 μg/mL dan 68 μg/mL
dan menunjukkan sinergisme dengan doxorubicin dalam pemacuan apoptosis. Tabel 4 Data hasil uji sitotoksisitas ekstrak kasar kapang laut X. psidii KT30
terhadap sel HeLa Konsentrasi (ppm) % Inhibisi Log konsentrasi Probit IC50 30 46,36 1,47 4,90 60 47,01 1,77 4,92 90 51,53 1,95 5,03 180 59,45 2,25 5,23 69,89 μg/mL 270 59,12 2,43 5,23 360 58,48 2,55 5,20 720 68,01 2,85 5,47 1080 84,32 3,03 5,99
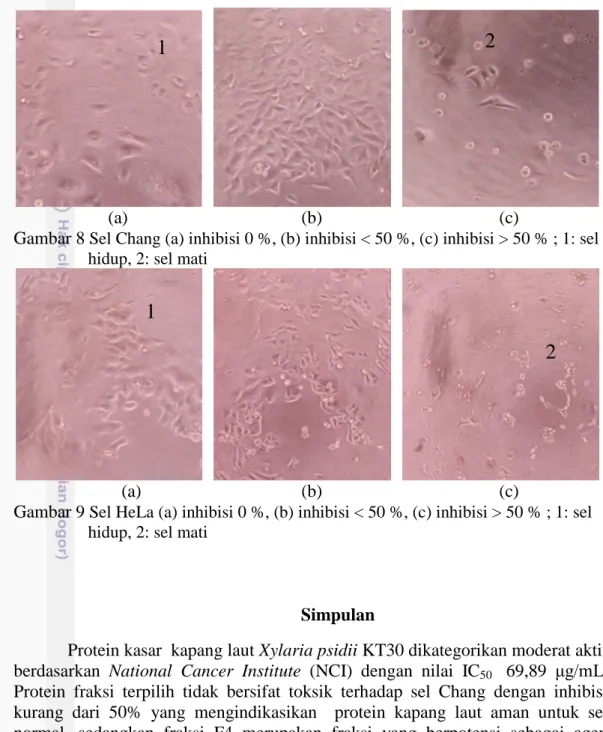
Morfologi sel Chang dan sel HeLa diamati dibawah mikroskop (Gambar 8 dan 9). Bentuk sel Chang dan sel HeLa yang tanpa perlakuan tampak melekat pada bagian permukaan tempat tumbuh sel, selain itu sel juga masih berbentuk epithelial-like (CLS 2013). Sel Chang dan sel HeLa yang telah mendapat perlakuan dan mengalami inhibisi kurang dari 50% masih akan tetap sama dengan benntuk sel hidup, namun pada beberapa sel akan terlihat telah mengalami kerusakan. Pada sel yang mengalami inhibisi lebih dari 50% akan jelas terlihat perubahan morfologinya diantaranya sel sudah tidak lagi terlihat berkonoli dan telah terlepas dari tempat tumbuhnya. Ikatan antar sel yang terlepasnya dapat disebabkan oleh beberapa faktor diantaranya faktor enzimatis seperti enzim tripsin, protease, kolagenase (Freshey 2000).
(a) (b) (c)
Gambar 8 Sel Chang (a) inhibisi 0 %, (b) inhibisi < 50 %, (c) inhibisi > 50 % ; 1: sel hidup, 2: sel mati
(a) (b) (c)
Gambar 9 Sel HeLa (a) inhibisi 0 %, (b) inhibisi < 50 %, (c) inhibisi > 50 % ; 1: sel hidup, 2: sel mati
Simpulan
Protein kasar kapang laut Xylaria psidii KT30 dikategorikan moderat aktif berdasarkan National Cancer Institute (NCI) dengan nilai IC50 69,89 μg/mL.
Protein fraksi terpilih tidak bersifat toksik terhadap sel Chang dengan inhibisi kurang dari 50% yang mengindikasikan protein kapang laut aman untuk sel normal, sedangkan fraksi F4 merupakan fraksi yang berpotensi sebagai agen antikanker.
PEMBAHASAN UMUM
Kanker merupakan penyakit degeneratif yang mematikan. WHO (World Health Organization) (2012) memprediksi kasus kanker dunia yang
menyebabkan kematian akan mengalami 13,1 juta jiwa Tahun 2030. Sebagian besar penyakit kanker disebabkan oleh lingkungan dan gaya hidup. Faktor lingkungan yang menyebabkan kanker antara lain polusi, asap rokok, radiasi, dan infeksi organisme. Faktor gaya hidup yaitu kebiasaan merokok, konsumsi alkohol, makanan yang mengandung bahan tambahan pangan yang karsinogenik, dan makanan berlemak trans serta obesitas (Jemal 2011).
1
2
1
Kanker serviks atau kanker leher rahim merupakan salah satu penyakit yang paling banyak terjadi bagi wanita. Setiap jam, satu wanita meninggal di Indonesia karena kanker serviks atau kanker mulut rahim ini. Fakta menunjukkan bahwa jutaan wanita di dunia terinfeksi Human Papilloma Virus (HPV) (Rasyid 2008). Kanker serviks atau kanker mulut rahim terjadi di bagian organ reproduksi seorang wanita.
Kanker terjadi karena adanya perubahan mendasar dalam fisiologi sel yang akhirnya tumbuh menjadi malignan serta mempunyai ciri -ciri umum sebagai berikut: (1) mandiri dalam signal pertumbuhan, (2) tidak peka terhadap signal anti pertumbuhan, (3) menghindari apoptosis, (4) memiliki potensi replikasi yang tidak terbatas , (5) angiogenesis, (6) invasi dan metastase ke jaringan lain. Oleh karena itu, target pengembangan obat antikanker diarahkan pada induksi/pemacuan apoptosis. Apoptosis merupakan program bunuh diri dari sebuah sel. Program ini memiliki peran yang penting untuk menjaga homeostatis perkembangbiakan sel dan dengan adanya disregulasinya bisa berakibat timbulnya macam-macam penyakit. Salah satu peran pentingnya adalah untuk membatasi proliferasi sel yang tidak diperlukan yang akan dapat menyebabkan kanker. Pada sel kanker program apoptosis ini telah mengalami gangguan sehingga sel akan mengalami metastasis (Manahan dan Wierberg 2002).
Teknologi untuk terapi kanker misalnya pembedahan, radiasi, terapi hormon dan kemoterapi banyak dikembangkan saat ini, tapi pengobatan ini memerlukan biaya yang mahal dan memiliki efek samping yang tidak baik bagi tubuh. Oleh karena itu, perlu dikembangkan suatu pengobatan yang dapat mengobati kanker dengan kemampuan mengobati yang kuat dan tanpa efek samping.
Pengembangan teknologi produksi senyawa aktif dari bahan alami merupakan teknologi yang memiliki prospek yang baik. Salah satu bahan alami yang dapat digunakan untuk menghasilkan senyawa obat dalam skala besar adalah yang diekstrak dari kapang endofit. Penggunaan kapang endofit dapat meningkatkan efisiensi produksi senyawa antikanker, masa berkembang biak kapang endofit yang relatif singkat dengan laju pertumbuhan yang tinggi memungkinkan produksi senyawa antikanker dan penginduksi apoptosis semakin efisien dalam jumlah besar. Kapang laut Xylaria psidii KT30 merupakan salah satu kapang yang dapat menghasilkan protein antikanker (Tarman et al. 2011).
Senyawa bioaktif antikanker yang akan digunakan untuk produk antikanker harus diujikan terlebih dahulu dengan uji sitotoksisitas. Uji sitotoksisitas merupakan salah satu pengembangan metode untuk memprediksi keberadaan senyawa yang bersifat toksik pada sel (Kurnijasanti et al. 2008). Uji toksisitas menggunakan metode BSLT menunjukkan kapang laut X. psidii KT30 bersifat toksik dengan nilai LC50 104,95 ppm.
Pengobatan kanker misalnya kemoterapi dapat mengganggu sel normal yang sedang berploriferasi. Penggunaan doxorubicin dilaporkan dapat menimbulkan risiko efek samping pada jaringan normal terutama jantung serta menekan sistem imun (Wattanapitayakul et al. 2005). Jaringan jantung memiliki kemampuan metabolik yang sangat aktif tetapi memiliki sumber antioksidan yang rendah bila dibandingkan dengan organ lain dalam tubuh. Hal ini menyebabkan jantung rentan terhadap kerusakan akibat radikal bebas yang ditimbulkan oleh doxorubicin (Arafa et al. 2005).