LAPORAN RESMI PRAKTIKUM KIMIA ANORGANIK II
KIMIA MAGNET (MAGNETO CHEMISTRY).
A. Maksud Percobaan
B. Alat dan Bahan 1. Alat
a. Magnetic Suceptibility Balance (MSB-Auto) 1 buah.
b. Spatula 1 buah.
c. Neraca 1 buah.
d. Tabung sampel 1 buah.
e. Mistar 1 buah. f. Kertas secukupnya. 2. Bahan a. CuSO4.5H2O secukupnya. b. NaCl secukupnya. c. MnSO4 secukupnya. d. KMnO4 secukupnya. e. K2Cr2O7 secukupnya. f. ZnSO4 secukupnya. g. K4Fe(CN)6. 3H2O secukupnya. h. CuSO4 secukupnya.
i. Cu(NH3)4.SO4 secukupnya.
C. Dasar Teori
Gejala magnetik di dalam zat kimia dapat timbal balik dari elektron maupun dari neutron akan tetapi efek magnetik yang ditimbulkan elektronkurang dari 103 kali lebih besar dari neutron. Elektron pada hakikatnya dapat dianggap sebagai suatu magnet unsur bila menggambarkan elektron sebagai bola keras bermuatn negatif yang mengisi (spin) pada sumbunya. Gerak pertama menyebabkan momen spin elektron dan kedua menyebabkan momen paramagnetic yang ditemukan pada ion atau logam tertentu (Wilkinson, 1989).
Sifat magnetik suatu zat apakah terdiri atas atom, ion, atau molekul ditentukan oleh struktur elektromagnetiknya. Ada tiga macam interaksi antara zat dan medan magnet, yaitu diamagnetik, paramagnetik, dan ferromagnetik. Banyak unsur transisi dan senyawa bersifat paramagnetik. Hal ini disebabkan adanya elektron yang tidak berpasangan. Perkiraan momen magnetic yang disebabkan oleh spin elektron tidak berpasangan. Perkiraan momen magnetic yang disebabkan oleh spin elektron tidak berpasangan, ditentukan oleh rumus:
√ dan ⁄ maka dapat ditulis :
√ dimana, n = jumlah elektron tidak berpasangan
μ = momen magnet dalam Bohr Magneton
Semakin banyak jumlah elektron yang tidak berpasangan, makin besar sifat paramagnetiknya (Hiskia, 1992).
Zat yang dapat ditarik oleh suatu medan magnet kuat disebut paramagnetiknya. Sedang zat yang ditoleh oleh medan magnet kuat disebut diamagnetik. Sifat-sifat suatu zat paramagnetic sering digankan dengan istilah
momen magnet negatif (momen magnet negatif).
dimana, Xg = sensitivitas massa.
N = bilangan Avogadro. β = Bohr magneton. R = tetapan Boltzman. T = temperatur (K).
√ untuk 1 mol zat (sensitivitas molar) digunakan istilah Xm =
Dalam suatu senyawa juga dapat gugus atau ligan yang bersifat diamagnetic. Ini juga perlu diperhitungkan sebagai faktor koreksi diamagnetic, untuk mendapatkan sensitivitas paramagnetic murni (Xa):
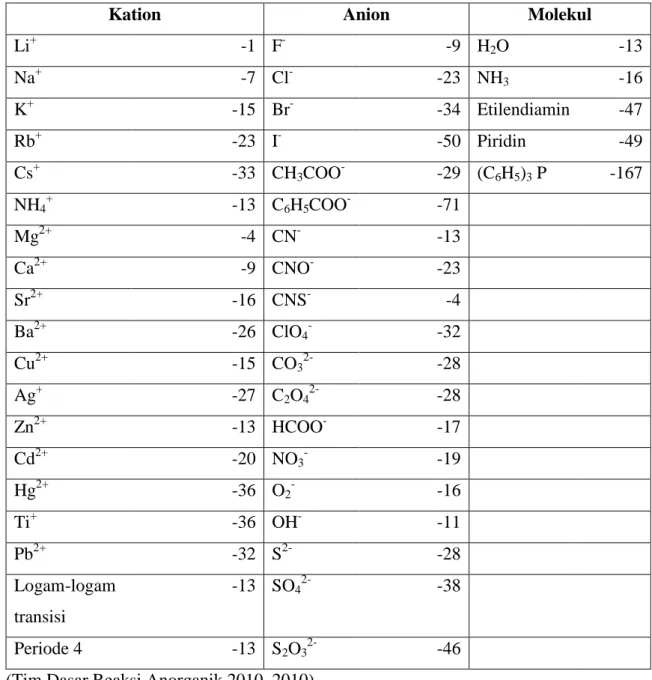
Tabel 1. Faktor Koreksi untuk Beberapa Ion dan Molekul (10-6 cm)
Kation Anion Molekul
Li+ -1 F- -9 H2O -13 Na+ -7 Cl- -23 NH3 -16 K+ -15 Br- -34 Etilendiamin -47 Rb+ -23 I- -50 Piridin -49 Cs+ -33 CH3COO- -29 (C6H5)3 P -167 NH4+ -13 C6H5COO- -71 Mg2+ -4 CN- -13 Ca2+ -9 CNO- -23 Sr2+ -16 CNS- -4 Ba2+ -26 ClO4- -32 Cu2+ -15 CO32- -28 Ag+ -27 C2O42- -28 Zn2+ -13 HCOO- -17 Cd2+ -20 NO3- -19 Hg2+ -36 O2- -16 Ti+ -36 OH- -11 Pb2+ -32 S2- -28 Logam-logam transisi -13 SO42- -38 Periode 4 -13 S2O32- -46
√
Harga momen magnet suatu ion tergantung dari banyaknya elektron yang tidak berpasangan.
√ dimana, s = jumlah elektron tidak berpasangan
= n x ⁄ (Clyde, 1987)
Diamagnetisme adalah suatu sifat yang dimiliki oleh semua atom, tidak peduli apakah masih mempunyai perilaku magnetic jenis lain. Sifat itu timbul karena antar aksi medan magnet terpasang dengan magnet terimbas dalam kelompok elektron tertentu yang penuh. Medan ini dengan sendirinya menantang medan terpasang. Efek antar aksi ini adlah membuat benda diamagnetik itu menyingkir dari medan terpasang agar antar aksi berkurang. Oleh karena itu, maka kerentanan diamagnetic adalah suatu besaran negatif. Suhu tidak mempengaruhi diamagnetisme dan besar medan terpasangpun tidak, tetapi kerentangan akan bernilai negatif bila berhubungan dengan molekul, maka dimisalkan bahwa kerentangan atomis bersifat bertambah aditif (Resnick, 1996).
Magnetisasi, M, (momen magnet per satuan volume) suatu sampel dalam medan magnet, H, berbanding lurus dengan besarnya H, dan tetapan perbandingannya adalah, χ, yang bergantung pada sampel.
M = χ H
χ disebut dengan suseptibilitas volume dan hasil kali χ dan volume molar sampel Vm disebut dengan susceptibilitas molar χm. Dinyatakan dalam persamaan menjadi:
χm = χ.Vm
Semua zat memiliki sifat diamagnetik, dan selain diamagnetisme, zat dengan elektron tidak berpasangan juga menunjukkan sifat paramagnetisme, besar sifat paramagnetisme sekitar 100 kali lebih besar daripada sifat diamagnetisme. (Saito, 1996).
D. Cara Kerja
1. MSB auto dinyalakan dengan menekan tombol on. 2. Ditunggu sampai layar menunjukkan angka nol (0).
3. Kuvet dimasukkan dalam slot pada MSB (jika terlalu dalam menyebabkan momen magnet-nya tidak terdeteksi dan menunjukkan tulisan overflow).
4. Dibuat range:
a. Range I : -0.040 X 10 -5 V. b. Range II : -0.425 X 10-6 V. 5. Ditara sampai menunjukkan -0.001.
6. Kuvet diambil ditimbang sebagai kuvet kosong dengan neraca analit. 7. Sampel dimasukkan dalam kuvet setinggi 1,5 sampai 2,0 cm.
8. Kuvet ditimbang. Massa sampel diperhitungkan dengan mengurangkan kuvet yang berisi bahan dengan kuvet kosong.
9. Kuvet dimasukkan slot pada MSB.
10. Tombol length ditekan, dimasukkan tinggi massa pada kuvet (dalam mm). 11. Tombol weight ditekan, dimasukkan massa sampel dalam kuvet (dalam mg). 12. Tombol mag.sus ditekan, dihasilkan nilai dari momen magnet suatu sampel. E. Hasil Percobaan dan Pembahasan
1. Hasil Percobaan
T = 25oC
massa kuvet kosong = 0, 847 gram.
Kompleks massa (g) tinggi (cm) Xg (cgs) μ (BM) Warna
CuSO4. 5H2O 0.1627 1.8 5.420 X 10-6 1.8713 Biru muda
NiSO4. 6H2O 0.1629 1.8 2.634 X 10-6 1.3980 Hijau K2Cr2O7 0.2127 1.9 0.024 X 10-6 0.4500 Orange K4 [Fe(CN)6]. 3 H2O 0.1205 1.9 0.442 X 10-6 0.9090 Kuning KMnO4 0.1908 1.7 0.148 X 10-6 0.4240 Hitam MnSO4 0.1109 1.8 0.655 X 10-6 0.6440 Putih KCl 0.1062 1.7 0.635 X10-6 0.4500 Putih 2. Pembahasan
Berdasarkan tujuan percobaan, sifat kemagnetan suatu senyawa dapat ditentukan dengan Magnetic Suceptibility Balance (MSB) Auto. Hal ini disebabkan karena MSB mempunyai daya kemagnetan yang dapat mempengaruhi sifat kemagnetan dari senyawa tersebut. Berdasarkan teori, sifat kemagnetan suatu
senyawa dibagi menjadi 3 sesuai dengan kemampuannya ditarik oleh suatu magnet yaitu:
a. Ferromagnetik.
Ferromagnetik adalah senyawa-senyawa yang mampu ditarik sangat kuat oleh suatu magnet.
b. Paramagnetik.
Paramagnetik adalah senyawa-senyawa yang mampu ditarik oleh suatu magnet.
c. Diamagenetik.
Diamagnetik adalah senyawa-senyawa yang ditolak oleh medan magnet. Secara teori, sifat kemagnetan ini dipengaruhi oleh banyaknya elektron dan pengisian elektron pada orbital-orbital yang ada. Cara pengisian elektron dalam orbital-orbital dibagi menjadi dua, yaitu:
a. Spin tinggi.
Misal : 25Mn ___ ___ ___ ___ ___
b. Spin rendah.
Misal : 25Mn ___ ___ ___ ___ ___
Prosedur yang pertama dilakukan dalam percobaan ini adalah mempersiapkan alat yang digunakan yaitu neraca analit dan MSB. Sebelum digunakan kedua alat tersebut harus distabilkan terlebih dahulu. Untuk mengkalibrasi MSB, kuvet kosong dimasukkan ke dalam slot MSB dan ditunggu hingga menunjukkan -0,001E-4 (sama dengan -0,001 x 10-4) V. Jika angka tersebut sudah muncul, prosedur yang selanjutnya dilakukan adalah membuat
range medan magnet yang akan diukur. Range I ditentukan mulai dari -0, 040E-5
sampai range II yaitu, -0,425E-6. Range I menunjukkan batas atas μ terukur sedangkan range II adalah batas bawah. Setelah penentuan range, prosedur yang dilakukan adalah menara kuvet kosong yang digunakan dengan menekan tombol
tare. Proses ini berhenti setelah layar menunjukkan harga -0,001E-4, sama seperti
pada saat pengkalibrasian alat. Proses persiapan MSB selesai, kuvet yang digunakan diambil dan ditimbang untuk mengetahui massa kosong kuvet.
Data yang diperoleh dari pengukuran dengan MSB adalah sensitivitas massa (Xg). sSampel yang pertama diuji adalah CuSO4.5H2O sebagai standar
karena 29Cu memiliki nomer atom yang paling besar sehingga Xg dari semua
logam transisi yang diukur tidak diperbolehkan melebihi Xg dari CuSO4.
a. CuSO4.5H2O.
CuSO4.5H2O Cu2+ + SO42- + 5H2O
Konfigurasi elektron CuSO4: 29Cu = [Ar] 3d10 4s1 ___
Cu2+ = [Ar] 3d9 4s0 ___ ___ ___ ___ ___
pada Cu2+ menunjukkan adanya elektron yang belum berpasangan pada satu orbital. Hal ini dapat menerangkan beberapa hal:
1) Adanya warna biru muda pada CuSO4 merupakan akibat adanya elektron
tunggal (pada 29Cu, berwarna putih).
2) Cu2+ bersifat paramagnetik karena memilik elektron yang belum berpasangan (berdasar pemasangan secara spin
Berdasarkan percobaan dan perhitungan di dapatkan hasil: XL -116 x 10-6cgs.
XM 1,353 x 10-3 cgs.
XA 1,469 x 10-3 cgs.
μe 1,872 BM.
Hal ini sesuai dengan teori yang menyatakan bahwa μe > μ (1,73 BM),
sehingga dapat diketahui bahwa CuSO4.5H2O bersifat paramagnetik.
b. NiSO4.6H2O.
NiSO4.5H2O Ni2+ + SO42- + 5H2O
Konfigurasi elektron CuSO4: 28Ni = [Ar] 3d8 4s2 ___
Ni2+ = [Ar] 3d8 4s0 ___ ___ ___ ___ ___
pada Ni2+ menunjukkan adanya 2 elektron yang belum berpasangan. Hal ini dapat menerangkan beberapa hal:
1) Adanya warna hijau pada NiSO4 merupakan akibat adanya elektron
tunggal.
2) Ni2+ bersifat paramagnetik karena memilik elektron yang belum berpasangan (berdasar pemasangan secara spin
XL -128 x 10-6cgs.
XM 6,923 x 10-4 cgs.
XA 6,9102 x 10-4 cgs.
μe 1,284 BM.
Hal ini tidak sesuai dengan teori yang menyatakan bahwa μe < μ (2,83 BM),
sehingga dapat diketahui bahwa NiSO4.5H2O bersifat paramagnetik.
c. K2Cr2O7.
K2Cr2O7 2K+ + Cr2O7
2-Konfigurasi elektron K2Cr2O7:
28K = [Ar] 4s1 ___
K+ = [Ar] 4s0 ___ ___ ___
pada K+ menunjukkan tidak adanya elektron yang belum berpasangan. Hal ini dapat menerangkan beberapa hal:
1) K+ bersifat diamagnetik karena semua orbital terisi penuh.
2) Adanya warna ditimbulkan bukan oleh ion K+ tetapi oleh ion Cr2O72-.
Berdasarkan percobaan dan perhitungan di dapatkan hasil: XL -78 x 10-6cgs.
XM 7,060 x 10-6 cgs.
XA 8,506 x 10-5 cgs.
μe 0,45 BM.
Hal ini tidak sesuai dengan teori yang menyatakan bahwa μe < μ (BM tidak
terdefinisikan), sehingga dapat diketahui bahwa K2Cr2O7 bersifat diamagnetik.
d. K4[Fe(CN)6].3H2O.
K4[Fe(CN)6] 4K+ + [Fe(CN)6]
4-Konfigurasi elektron K2Cr2O7:
28K = [Ar] 4s1 ___
K+ = [Ar] 4s0 ___ ___ ___
pada K+ menunjukkan tidak adanya elektron yang belum berpasangan. Hal ini dapat menerangkan beberapa hal:
1) K+ bersifat diamagnetik karena semua orbital terisi penuh. 2) Adanya warna disebabkan karena K4[Fe(CN)6] mengikat H2O.
Berdasarkan percobaan dan perhitungan di dapatkan hasil: XL -160 x 10-6cgs.
XM 1,867 x 10-4 cgs.
XA 3,467 x 10-4 cgs.
μe 0,909 BM.
Hal ini tidak sesuai dengan teori yang menyatakan bahwa μe < μ (BM tidak
terdefinisikan), sehingga dapat diketahui bahwa K4[Fe(CN)6].3H2O bersifat
diamagnetik. e. KMnO4
KMnO4 K+ + MnO4
-Konfigurasi elektron KMnO4:
28K = [Ar] 4s1 ___
K+ = [Ar] 4s0 ___ ___ ___
pada K+ menunjukkan tidak adanya elektron yang belum berpasangan. Hal ini dapat menerangkan beberapa hal:
1) K+ bersifat diamagnetik karena semua orbital terisi penuh. 2) Adanya warna disebabkan oleh ion MnO4-.
Berdasarkan percobaan dan perhitungan di dapatkan hasil: XL --52 x 10-6cgs.
XM 2,338, x 10-5 cgs.
XA 7,538 x 10-5 cgs.
μe 0,424 BM.
Hal ini tidak sesuai dengan teori yang menyatakan bahwa μe < μ (BM tidak
terdefinisikan), sehingga dapat diketahui bahwa KMnO4 bersifat diamagnetik.
f. MnSO4.
MnSO4 Mn2+ + SO4
2-Konfigurasi elektron MnSO4: 25Mn = [Ar] 3d5 4s2 ___
Mn2+ = [Ar] 3d5 4s0 ___ ___ ___ ___ ___
pada Mn2+ menunjukkan adanya satu elektron yang belum berpasangan. Hal ini dapat menerangkan beberapa hal:
1) Mn2+ bersifat paramagnetik karena tidak semua orbital terisi penuh.
2) Adanya sifat paramagnetik (berdasar pengisian spin ) menyebabkan MnSO4 berwarna hitam.
Berdasarkan percobaan dan perhitungan di dapatkan hasil: XL --65 x 10-6cgs.
XM 1,107 x 10-4 cgs.
XA 1,757 x 10-4 cgs.
μe 0,644 BM.
Hal ini tidak sesuai dengan teori yang menyatakan bahwa μe < μ (BM 5,92),
sehingga dapat diketahui bahwa MnSO4 bersifat paramagnetik.
g. KCl
KCl K+ + Cl
-Konfigurasi elektron KMnO4:
28K = [Ar] 4s1 ___
K+ = [Ar] 4s0 ___ ___ ___
pada K+ menunjukkan tidak adanya elektron yang belum berpasangan. Hal ini dapat menerangkan beberapa hal:
1) K+ bersifat diamagnetik karena semua orbital terisi penuh. Berdasarkan percobaan dan perhitungan di dapatkan hasil:
XL -38 x 10-6cgs.
XM 4,73 x 10-5 cgs.
XA 8,53 x 10-5 cgs.
μe 0,4497 BM.
Hal ini sesuai dengan teori yang menyatakan bahwa μe < μ (BM tidak
terdefinisikan), sehingga dapat diketahui bahwa KCl bersifat diamagnetik.
F. Kesimpulan Senyawa μe (BM) Μ (BM) CuSO4.5H2O 1,872 1,73 NiSO4.5H2O 1,284 2,83 K2Cr2O7 0,450 - K4[Fe(CN)6].3H2O 0,909 - KMnO4 0,424 - MnSO4 0,644 5,92 KCl 0,450 -
Berdasarkan percobaan diketahui bahwa sifat kemagnetan suatu logam dipengaruhi oleh jumlah elektron yang tidak berpasangan. Selain mempengaruhi sifat kemagnetannya, elektron tidak berpasangan juga mempengaruhi warna dari suatu senyawa.
G. Daftar Pustaka
Clyde, M. d. (1987). Kimia Anorganik Teori. Yogyakarta: UGM Press.
Hiskia, A. (1992). Kimia Unsur dan Radiokimia. Bandung: PT. Citra Aditya Bakti. Resnick, H. (1996). Fisika Jilid 2 Edisi III. Jakarta: Erlangga.
Saito, T. (1996). Buku Teks Kimia Anorganik Online (Terjemahan). Tokyo: Iwanami Shoten Publisher.
Tim Dasar Reaksi Anorganik 2010. (2010). Petunjuk Praktikum Kimia Anorganik Dasar
II. Surakarta: Kimia FMIPA UNS.
Wilkinson, C. (1989). Kimia Anorganik Teori (terj.). Yogyakarta: UGM Press.
H. Lampiran 1. Laporan sementara 2. Perhitungan Surakarta, Mei 2012 Praktikan Amalia R. Gita Mengetahui, Asisten Nur Fitriana