ii
TESIS
KADAR ASAM URAT SERUM TINGGI
MENINGKATKAN RISIKO TERJADINYA
NEUROPATI PERIFER PADA PENDERITA
PENYAKIT GINJAL KRONIK
PRISKA WIDIASTUTI
PROGRAM PASCASARJANA
UNIVERSITAS UDAYANA
iii
TESIS
KADAR ASAM URAT SERUM TINGGI
MENINGKATKAN RISIKO TERJADINYA
NEUROPATI PERIFER PADA PENDERITA
PENYAKIT GINJAL KRONIK
PRISKA WIDIASTUTI
NIM 1114068103
PROGRAM MAGISTER
PROGRAM STUDI ILMU BIOMEDIK
PROGRAM PASCASARJANA
UNIVERSITAS UDAYANA
DENPASAR
iv
KADAR ASAM URAT SERUM TINGGI
MENINGKATKAN RISIKO TERJADINYA
NEUROPATI PERIFER PADA PENDERITA
PENYAKIT GINJAL KRONIK
Tesis untuk Memperoleh Gelar Magister
pada Program Magister, Program Studi Ilmu Biomedik
Program Pascasarjana Universitas Udayana
PRISKA WIDIASTUTI
NIM 1114068103
PROGRAM MAGISTER
PROGRAM STUDI ILMU BIOMEDIK
PROGRAM PASCASARJANA
UNIVERSITAS UDAYANA
DENPASAR
vi
Tesis Ini Telah Diuji pada
Tanggal 1 Juli 2016
Panitia Penguji Tesis Berdasarkan SK Rektor
Universitas Udayana, No : 2992/UN14.4/HK/2016, Tanggal 24 Juni 2016
Ketua
: Dr. dr. Thomas Eko Purwata Sp.S(K), FAAN
Anggota
:
vii
viii
Pertama-tama perkenankanlah penulis memanjatkan puji syukur kehadapan
Tuhan Yang Maha Esa, karena hanya atas berkat dan karunia-Nya penulis dapat
menyelesaikan karya akhir ini sebagai prasyarat mendapatkan tanda keahlian di
bidang Neurologi dan Magister Ilmu Biomedik.
Pada kesempatan ini penulis ingin mengucapkan terima kasih kepada
berbagai pihak yang telah berperan besar sehingga penulis dapat menempuh
Program Pendidikan Dokter Spesialis I Neurologi dan Program Magister Program
Studi Ilmu Biomedik Program Pasca Sarjana Universitas Udayana sampai
tersusunnya karya akhir ini.
Penulis mengucapkan terima kasih kepada Rektor Universitas Udayana Prof.
Dr. dr. Ketut Suastika, Sp.PD-KEMD, Dekan Fakultas Kedokteran Universitas
Udayana Prof.Dr. dr. Putu Astawa, Sp.OT(K), M.Kes, Direktur Program
Pascasarjana Universitas Udayana Prof. Dr. dr. A.A. Raka Sudewi, Sp.S(K) dan
Ketua Program Studi Magister Ilmu Biomedik Program Pascasarjana Universitas
Udayana Dr.dr. Gde Ngurah Indraguna Pinatih, M.Sc,Sp.GK, atas kesempatan
dan fasilitas yang diberikan kepada penulis untuk mengikuti dan menyelesaikan
Pendidikan Dokter Spesialis I Ilmu Penyakit Saraf FK UNUD/RSUP Sanglah.
Terima kasih juga kepada dr. Anak Ayu Sri Saraswati, M.Kes., dan dr. I Wayan
Sutarga, MPHM, selaku Direktur Utama RSUP Sanglah Denpasar saat penulis
menjalani pendidikan sebagai peserta PPDS-1 Neurologi.
ix
Terima kasih yang tak terhingga penulis sampaikan kepada Kepala
Bagian/SMF Neurologi FK UNUD/RSUP Sanglah Denpasar periode 2006-2014
Dr. dr. D.P.G. Purwa Samatra, Sp.S(K) dan periode 2014-2019 dr. A.A.B.N.
Nuartha, Sp.S(K), Ketua TKP PPDS-1 FK UNUD/RSUP Sanglah saat penulis
diterima sebagai peserta PPDS-1 dr. I Wayan Kondra, Sp.S(K) dan Ketua TKP
PPDS-1 FK UNUD/RSUP Sanglah saat ini dr. I Nyoman Semadi, Sp.B,
Sp.BTKV. Penulis juga mengucapkan terima kasih kepada Kepala Divisi Ginjal
Hipertensi Bagian/SMF Ilmu Penyakit Dalam FK UNUD/RSUP Sanglah Prof.
Dr. dr. Ketut Suwitra, SpPD-KGH serta seluruh staf medis Divisi Ginjal Hipetensi
Bagian/SMF Ilmu Penyakit Dalam FK UNUD/RSUP yang tidak dapat penulis
sebutkan satu persatu yang telah memberikan ijin dan kesempatan untuk
dilaksanakannya penelitian ini.
Penulis mengucapkan terima kasih yang tak terhingga kepada pembimbing
karya akhir ini, Dr. dr. Thomas Eko Purwata Sp.S(K), FAAN dan dr. IGN Purna
Putra Sp.S(K) atas segala bimbingan, saran, waktu, kesabaran, nasehat dan
motivasi yang luar biasa selama pendidikan dan penyusunan karya akhir ini serta
kepada para penguji Dr. dr. DPG Purwa Samatra,Sp.S(K), dr.I Made Oka
Adnyana, Sp.S(K), dan Dr. dr. Anna Marita Gelgel, Sp.S(K) yang telah
membantu, memberi dorongan semangat, saran dan koreksi dari tahap
praproposal, ujian proposal, seminar hasil penelitian, ujian hasil penelitian hingga
ujian akhir tesis.
x
Ni Putu Witari, Sp.S, dr. Sri Yenni Trisnawati GS, M. Biomed, Sp.S, dr. I Wayan
Widyantara, M. Biomed, Sp.S, dr. A.A.A. Suryapraba Indradewi, M.Sc, Sp.S,
penulis mengucapkan terima kasih yang tak terhingga atas segala bimbingan dan
saran selama penulis mengikuti pendidikan.
Terima kasih saya ucapkan kepada dr. Lina Kamelia Sp.S, dr. Deddy Andaka,
M.Biomed, Sp.S, dr. Yoanes Gondowardaja, M.Biomed, Sp.S, dr. I Nyoman
Darsana, M.Biomed, Sp.S, dr. Saktivi Harkitasari, M.Biomed, Sp.S, dr. Hadi
Widjaja, M.Biomed, Sp.S, dr. Ni Putu Sukarini, M.Biomed, Sp.S, dr. Made Rudy,
dr. I Ketut Catur Wipradnyana, dr. Gracia Meliana Tanoyo, dr. Octavianus
Darmawan serta seluruh teman sejawat lainnya, peserta PPDS I Neurologi FK
UNUD/RSUP Sanglah yang telah memberikan inspirasi, dorongan, segala
bantuan dan kebersamaan selama penulis menjalani pendidikan dan
menyelesaikan karya akhir ini. Terima kasih juga kepada dr. Cokorda Agung
Wahyu, dr. Tersila, dr. Setiani, dr. Hesti, dr. Angga, dr. IB Dharma, dr. IB Kade
Satyagraha, dr. Dewi Mahayani, dr. Ayu Trisnadewi, dr. Widyawati, para
perawat, paramedis, dan dokter muda atas bantuannya selama penulis mengikuti
pendidikan dan membantu pelaksanaan penelitian ini, serta tenaga administrasi
Bagian/SMF Ilmu Penyakit Saraf FK UNUD/RSUP Sanglah Ni Putu Oka
Swardani, I Wayan Sika Priantha, Kadek Febriyanti, SE, Kadek Arie Ardhiani,
Amd.Akun, dan Ni Wayan Ayu Sukyartini, SE. atas jalinan kerjasama dan
dorongan semangat selama penulis mengikuti pendidikan ini.
Penulis juga ingin menyampaikan ucapan terima kasih kepada seluruh pasien
penyakit ginjal kronis yang telah berkenan menjadi subyek penelitian serta kepada
anggota keluarga pasien atas bantuan dan kerjasamanya selama pelaksanaan
penelitian ini.
xi
Saimo dan ibu Theresia Sukiati, serta saudara saudari penulis Yusak Indradi
Priambodo, Etsmi Monika, Krisdiono Nugrahadi yang telah memberikan kasih
sayang, doa, dukungan dan semangat kepada penulis kesempatan untuk
menyelesaikan pendidikan ini.
Terima kasih dari lubuk hati terdalam juga penulis sampaikan kepada suami
tercinta dan anak terkasih, Andreas Didik Setiyawan, ST dan Nathanael Aditya
Setiawan yang dengan penuh pengertian, kerelaan, pengorbanan, cinta dan kasih
mendukung penulis untuk menyelesaikan tesis ini.
Penulis telah berusaha membuat tesis ini dengan sebaik-baiknya namun tetap
menyadari bahwa tesis ini masih banyak kekurangan baik dari aspek materi dan
penyajiannya. Penulis sangat mengharapkan kritik dan saran yang konstruktif
demi perbaikan tesis ini. Akhirnya penulis tidak lupa mohon maaf
sebesar-besarnya kepada semua pihak, bila dalam proses pendidikan maupun dalam
pergaulan sehari-hari ada tutur kata dan sikap yang kurang berkenan dihati.
Semoga Tuhan Yang Maha Pengasih dan Penyayang selalu melimpahkan berkat
dan karunia-Nya kepada semua pihak yang telah membantu pelaksanaan dan
penyelesaian tesis ini. Amin.
Denpasar, Juni 2016
Penulis
xii
KADAR ASAM URAT SERUM TINGGI MENINGKATKAN RISIKO
TERJADINYA NEUROPATI PERIFER PADA PENDERITA PENYAKIT
GINJAL KRONIK
Penyakit ginjal kronik (PGK) merupakan penyakit yang sering menimbulkan
komplikasi neurologi berupa neuropati perifer. Kadar asam urat serum pada
penderita PGK umumnya meningkat akibat penurunan fungsi ginjal. Penelitian ini
bertujuan untuk mengetahui apakah kadar asam urat serum tinggi meningkatkan
risiko terjadinya neuropati perifer pada penderita PGK.
Penelitian ini dilakukan di RSUP Sanglah periode Maret hingga Mei 2016,
menggunakan rancangan kasus kontrol pada sebanyak 23 subyek penderita PGK
dengan neuropati perifer dan 23 subyek penderita PGK tanpa neuropati perifer.
Penilaian neuropati perifer menggunakan pemeriksaan
nerve conduction study
.
Dari hasil analisis statistik didapatkan bahwa kadar asam urat serum
kelompok kasus dan kelompok kontrol berbeda secara bermakna dengan nilai
p=0,012 (p<0,05) dan didapatkan OR=2,7 (IK 95%=0,236-30,846).
Berdasarkan hasil penelitian ini dapat disimpulkan bahwa kadar asam urat
serum tinggi meningkatkan risiko terjadinya neuropati perifer pada penderita
PGK.
Kata kunci:
penyakit ginjal kronik, neuropati perifer, asam urat,
nerve
conduction study
xiii
HIGH SERUM URIC ACID LEVEL INCREASING RISKS PERIPHERAL
NEUROPATHY IN PATIENTS WITH CHRONIC KIDNEY DISEASE
Chronic kidney disease (CKD) is a disease that often causes neurological
complication such as peripheral neuropathy. Serum uric acid levels in patients
with CKD generally increased due to decreased kidney function. This study aims
to determine whether high serum uric acid levels increase the risk of peripheral
neuropathy in patients with CKD.
This is a case control study design that was enrolled in Sanglah General
Hospital from March until May 2016, included 23 subjects patients with CKD
with peripheral neuropathy and 23 subjects patients with CKD without peripheral
neuropathy. Peripheral neuropathy was evaluated using nerve conduction study.
The results of statistical analysis showed that serum uric acid levels of case
group and control group differ significantly with p=0,012 (p<0,05) and obtained
OR=2,7 (95% CI=0,236-30,846).
Based on these results it can be concluded that high serum uric acid levels
increase the risk of peripheral neuropathy in patients with CKD.
Key words: chronic kidney disease, peripheral neuropathy, uric acid, nerve
conduction study
xiv
Halaman
SAMPUL DALAM.
………..………..
i
PRASYARAT GELAR ………..
ii
LEMBAR PENGESAHAN ………...
iii
PENETAPAN PANITIA PENGUJI………...
iv
SURAT PERNYATAAN BEBAS PLAGIAT ………..
v
UCAPAN TERIMA KASIH ………..
vi
ABSTRAK ……….
x
ABSTRACT………....
xi
DAFTAR ISI ………..
xii
DAFTAR
TABEL ….……….
xiv
DAFTAR GAMBAR ...
………..
xv
DA
FTAR SINGKATAN ………...
xvi
DAFTAR LAMPIRAN ………..
xviii
BAB I
PENDAHULUAN …………..……...………..
1.1 Latar Belakang ………...………
1.2
Rumusan Masalah ………...………...
1.3 Tujua
n Penelitian ………...
1.4 Manfaat
Penelitian ………
.
1
.4.1 Manfaat Ilmiah ………..………
....
1.4.2 Manfaat
Klinik Praktis ……….………
.
1
1
4
4
5
5
5
BAB II
TINJAUAN PUSTAKA ………
.
………..
2.1 Penyakit Ginj
al Kronik ………...………...
2.1.1 Definisi
………...………
2.1.2 Klasifikasi
………...………...
2.1.3 Komplikasi pada Sistem Saraf
………...…
2.2 Neuropati Perifer pada PGK
…………
...
………
2.2.1 Manifestasi Klinis Neuropati Perifer pada PGK
……...
.
2.2.2 Patogenesis Neuropati Perifer pada PGK
………..
2.2.3 Pemeriksaan Penunjang Neuropati Perifer
………
2.3 Asam Urat
………...………
2.3.1 Struktur Asam Urat
………...……….
2.3.2 Sintesis dan Ekskresi Asam Urat
………...
2.3.3 Peran Asam Urat pada Tubuh
………
2.4 Asam Urat dengan Neuropati Perifer
………
...
6
6
6
7
7
9
9
10
15
16
16
17
20
23
BAB III KERANGKA BERPIKIR, KONSEP, DAN HIPOTESIS
PENELITIAN ………
.
……….…
3.1 Kerangka Berpikir ……….
.
3.2 Konsep
Penelitian ………..
3.3 Hipotesi
s Penelitian ………
25
25
28
29
BAB IV
METODE PENELITIAN ………
4.1 Rancangan Penelitian ..
………...
4.2 Lokasi
dan Waktu Penelitian …..………...
xv
4.3 Ruang Lingkup Penelitian ….………...
.
……….
4.4 Penentua
n Sumber Data ……….
4.4.1 Populasi Target ………...………..
4.4.2 Popula
si Terjangkau ………..
4.4.3 Kri
teria Sampel ……….
4.4.3.1 Kriteria Inklusi
Kasus …………
.
...………...…
4.4.3.2 Kriter
ia Inklusi Kontrol ……….
4.4.3.3 K
riteria Eksklusi Kasus dan Kontrol …………
4.4.
4 Besar Sampel ………
4.4.5 Teknik
Pengambilan Sampel ………
4.5 Variabel Penelitian ……...………..
4.5
.1 Identifikasi Variabel …………...………...
4.5.2 Definisi Operasional
Variabel ………...
4.6 Instrumen Penelitian ………...………...
4.7 Prosedur
dan Alur Penelitian ………..…………..…….
4.8 Analisis Data ….
...
……….
31
31
31
31
31
31
32
32
33
33
34
34
34
38
38
40
BAB V
HASIL PENELITIAN ……….
5.1
Karakteristik Dasar Subyek Penelitian………...
5.2 Hubungan antara Kadar Asam Urat Serum dan Variabel
Perancu
Lainnya dengan Kejadian Neuropati Perifer……….
41
41
44
BAB VI PEMBAH
ASAN………...
6.1
Karakteristik Demografi Subyek Penelitian………...
6.2 Hubungan antara Kadar Asam Urat Serum dan Variabel
Perancu
Lainnya dengan Kejadian Neuropati Perifer……….
6.3 Kelemahan dan Kekuatan Penelitian...
47
47
49
52
BAB VII SIMPULAN DAN SARAN………..
7.1 Simpulan……….
7.2 Saran ………...
54
54
54
DAFTAR PUSTAKA……….
55
xvi
DAFTAR TABEL
Halaman
2.1
Kriteria Definisi Penyakit Ginjal Kronik ……….…..
6
2.2
Klasifikasi Stadium PGK………...………
7
2.3
Komplikasi Neur
ologi Pada Pasien Hemodialisis………….…………..
8
2.4
Hasil Pemeriksaan Motorik atau CMAP ………
15
2.5
Hasil Pemeriksaan Sensorik atau SNAP ………
15
5.1
Karakteristik Dasar Subyek Penelitian ………...
42
5.2
Analisis Bivariat Uji T Berpasangan Usia dan Lama Menderita PGK
Antara Kelompok Kasus dan Kontrol ………
43
5.3
Analisis Bivariat Uji McNemar Indeks Massa Tubuh Antara
Kelompok Kasus dan Kontrol ...
43
5.4
Analisis Bivariat Uji McNemar Kadar Asam Urat Serum Antara
Kelompok Kasus dan Kontrol ………..………...
45
5.5
Analisis Bivariat Uji McNemar Laju Filtrasi Glomerulus Antara
Kelompok Kasus dan Kontrol ...………...
45
5.6
Analisis Bivariat Uji McNemar Anemia Antara Kelompok Kasus dan
xvii
DAFTAR GAMBAR
Halaman
2.1
Kerusakan Serabut Saraf pada Neuropati ……….
.. 13
2.2
Stuktur Kimia Asam Urat ………...
... 17
2.3
Pembentuk
an Asam Urat dari Asam Nukleat…….……….
18
2.4
Metabolisme Purin (Adenosin) ………...
18
3.1
Kerangka Berpikir………...
... 27
3.2
Kerangka Konsep ………...
... 28
4.1
Bagan Rancangan Penelitian………...
... 30
xviii
DAFTAR SINGKATAN
AIDS
:
Acquired Immunodeficiency Syndrome
ATP
:
Adenosin Triphosfate
ATPase
:
Adenosine Triphosphate-ase
AUS
:
Asam Urat Serum
Ca
:
Calsium
CDC
:
Centers for Disease Control and Prevention
CMAP
:
Compound Muscle Action Potential
Cu
:
Cuprum
DM
:
Diabetes Melitus
DNA
:
Deoxyribonuclease acid
ENMG
:
Elektroneuromiografi
Fe
:
Ferrum
g/dL
:
Gram per desiliter
Hb
:
Hemoglobin
HD
:
Hemodialisis
HIV
:
Human Immunodeficiency Virus
IK
: Interval kepercayaan
IMT
:
Indeks Massa Tubuh
K
:
Kalium
KHS
:
Kecepatan Hantar Saraf
KTP
:
Kartu Tanda Penduduk
LFG
:
Laju Filtrasi Glomerulus
m/det
:
Mili per detik
mdet
:
Milidetik
mg
:
Milligram
mg/dL
:
miligram/desiliter
ml/menit
:
Milliliter per menit
MRP4
:
Multidrug Resistance-associated Protein 4
mV
:
Milivolt
Na
:
Natrium
NAD
:
nicotinamide adenine dinucleotide
NCS
:
Nerve Conduction Study
NKF- K/DOQI
:
National Kidney Foundation Kidney Disease
Outcomes Quality Initiative
NO
:
Nitric Oxide
OAT
:
Organic anion transporer
OR
:
Odds Ratio
PERKENI
:
Perkumpulan Endokrinologi Indonesia
PERNEFRI
:
Persatuan Nefrologi Indonesia
pH
:
Power of Hydrogen
pKa
:
Power of acidity constant
xix
ROS
:
Reactive Oxigen Species
RSUP
:
Rumah Sakit Umum Pusat
SGOT
:
Serum Glutamic Oxaloacetic Transaminase
SGPT
:
Serum Glutamic Pyruvic Transaminase
SNAP
:
Sensory Nerve Action Potential
SPSS
:
Statistical Product and Service Solutions
TTGO
: Tes Toleransi Glukosa Oral
UNUD
:
Universitas Udayana
URAT1
:
urat transporter 1
WHO
:
World Health Organization
xx
DAFTAR LAMPIRAN
Halaman
Lampiran 1
Keterangan Kelaikan Etik………
61
Lampiran 2
Surat Ijin Penelitian dari RSUP Sanglah……….
62
Lampiran 3 Persetujuan Setelah Penjelasan (
Informed Consent
)
…………..
63
Lampiran 4
Formulir Persetujuan Tertulis ……….
64
Lampiran 5
Lembar Pengumpulan Data ………
65
Lampiran 6 Pemeriksaan Studi Hantaran Saraf/N
erve Conduction Study
…
.. 67
Lampiran 7 Data Subyek Penelitian………
68
1 BAB I
PENDAHULUAN
1.1 Latar Belakang
Penyakit ginjal kronik (PGK) merupakan penyakit yang cukup banyak terjadi di dunia ini. Jumlah penderita PGK juga semakin meningkat seiring dengan gaya hidup saat ini yang kurang memperhatikan keseimbangan pola makan. PGK ini dapat dijumpai mulai dari stadium awal hingga stadium lanjut. Selain mempengaruhi fungsi ginjal, komplikasi PGK juga bermanifestasi pada organ lain, salah satunya adalah sistem saraf.
Penyakit ginjal kronik adalah kerusakan ginjal yang terjadi selama lebih dari tiga bulan, berdasarkan kelainan patologis atau petanda kerusakan ginjal seperti proteinuria. Jika tidak ada tanda kerusakan ginjal maka diagnosis PGK ditegakkan bila nilai laju filtrasi glomerulus kurang dari 60 ml/menit/1,73 m2. Penyakit ginjal kronik ini terdiri dari 5 stadium dan dikatakan stadium akhir atau stadium 5 bila didapatkan fungsi laju filtrasi glomerulus <15 ml/menit/1,73 m2. Pada stadium ini
diperlukan terapi renal replacement baik dengan hemodialisis maupun transplantasi ginjal (Pezarella dan Reilly, 2003; Couser dkk, 2011).
Jumlah penderita PGK semakin meningkat. Di Amerika Serikat, diperkirakan
2
penduduk Amerika Serikat yang menderita PGK stadium akhir sebesar 113.136 orang (CDC, 2014). World Health Organization (WHO) memperkirakan akan terjadi peningkatan penderita PGK stadium akhir di Indonesia tahun 1995-2025 sebesar 41,4%. Data dari Persatuan Nefrologi Indonesia (PERNEFRI) memperkirakan terdapat 70.000 orang menderita gagal ginjal atau PGK stadium akhir di Indonesia. Angka ini akan terus meningkat sekitar 10% setiap tahunnya (Tandi dkk, 2014). Data tahun 2012, jumlah penderita PGK stadium akhir di Bali sebanyak 1433 orang yang memerlukan terapi hemodialisis (PERNEFRI, 2012). Penderita PGK selain mengalami kelainan pada ginjal, biasanya juga sudah mulai mengalami komplikasi ke organ lain, salah satunya adalah sistem saraf. Sekitar 60 persen penderita PGK akan mengalami komplikasi neurologi berupa kelainan pada susunan saraf pusat, saraf perifer, dan saraf otonom. Kelainan pada susunan saraf pusat berupa gangguan kognitif sampai terjadi perubahan status mental karena ensefalopati uremikum. Gangguan neurologi yang mengenai susunan saraf tepi adalah berupa neuropati perifer (Nolan, 2005; Krishnan dan Kiernan, 2009).
Neuropati perifer pada penderita PGK dapat berupa kelainan motorik maupun sensorik. Neuropati perifer merupakan salah satu komplikasi yang ditemukan pada 2/3 atau sekitar 60% hingga 90% dari keseluruhan penderita PGK dan
3
dengan pemeriksaan elektrofisiologi sehingga dapat dikatakan bahwa hampir semua penderita PGK stadium lanjut mengalami neuropati (Levey dan Coresh, 2002; Krishnan dan Kiernan, 2009).
Penderita PGK umumnya memiliki kadar asam urat serum yang meningkat. Beberapa studi menunjukkan bahwa peningkatan kadar asam urat serum secara independen dapat memprediksi berkembangnya penyakit PGK. Namun pada beberapa buku lain disebutkan bahwa penyakit Gout atau hiperurisemia dikeluarkan dari faktor penyebab terjadinya PGK. Hubungan yang terjadi antara hiperurisemia dengan PGK adalah sebagai akibat retensi asam urat di dalam tubuh oleh karena penurunan laju filtrasi glomerulus. Asumsi yang menyebutkan bahwa asam urat dapat menyebabkan PGK adalah melalui mekanisme presipitasi asam urat yang membentuk kristal pada ginjal. Tetapi pada studi uji binatang coba dengan PGK dan hiperurisemia, didapatkan bahwa perkembangan penyakit ginjal yang semakin cepat namun tidak disertai dengan adanya kristal asam urat pada ginjal. Sebagai tambahan, pada beberapa penderita dengan penyakit Gout atau hiperurisemia memiliki kondisi lain yang terjadi bersamaan, seperti hipertensi dan
penyakit vaskular sehingga beberapa para ahli menduga bahwa kelainan ginjal yang terjadi adalah akibat sekunder akibat kondisi-kondisi tersebut (Johnson dkk.,2013).
4
dihubungkan dengan terjadinya neuropati perifer. Neuropati perifer akibat peningkatan asam urat ini terjadi oleh karena kerusakan endotel vaskuler melalui peningkatan reaksi stres oksidasi dan respon inflamasi pada sistem saraf. Pada penderita PGK, fungsi nefron yang terganggu dapat meningkatkan kadar asam urat serum sebagai salah satu toksin uremik dan akumulasi produk racun lain serta defisiensi metabolit esensial, yang diduga sebagai penyebab kematian neuron pada neuropati perifer (Laaksonen dkk., 2002). Beberapa studi telah menunjukkan hubungan antara peningkatan kadar asam urat serum dengan terjadinya neuropati perifer pada penderita diabetes melitus (Papanas, 2011; Darsana 2014), namun hingga saat ini belum ada penelitian yang menghubungkan kadar asam urat serum tinggi dengan terjadinya neuropati perifer pada penderita PGK. Oleh karena itu peneliti ingin mengetahui hubungan kadar asam urat serum dengan terjadinya neuropati perifer pada penderita PGK.
1.2 Rumusan Masalah
Dari uraian di atas, maka didapatkan rumusan masalah yaitu apakah kadar
asam urat serum tinggi meningkatkan risiko terjadinya neuropati perifer pada penderita PGK?
1.3 Tujuan Penelitian
5
1.4 Manfaat Penelitian
1.4.1 Manfaat Ilmiah
Dengan mengetahui kadar asam urat serum tinggi meningkatkan risiko terjadinya neuropati perifer pada penderita PGK maka diharapkan dapat meningkatkan pemahaman mengenai peranan asam urat pada kejadian neuropati perifer dan hasil penelitian ini dapat digunakan untuk mengembangkan penelitian serupa di masa yang akan datang.
1.4.2 Manfaat Klinik Praktis
Dengan mengetahui kadar asam urat serum tinggi dapat meningkatkan risiko terjadinya neuropati perifer pada penderita PGK diharapkan klinisi dapat melakukan deteksi dini terhadap kejadian neuropati perifer dan penatalaksanaan yang lebih adekuat terhadap kadar asam urat serum pada penderita PGK.
6 BAB II
TINJAUAN PUSTAKA
2.1 Penyakit Ginjal Kronik
2.1.1 Definisi
National Kidney Foundation mendefinisikan PGK berdasarkan ada atau
tidaknya kerusakan ginjal dan tingkat fungsi ginjal. Suatu studi patologi
menunjukkan bahwa kerusakan ginjal bisa tidak disertai dengan penurunan laju
filtrasi glomerulus (LFG). Bukti adanya kerusakan ginjal tergantung pada tipe dari
penyakit ginjal itu sendiri dan dapat meliputi abnormalitas pada pemeriksaan
darah, urin seperti adanya proteinuri yang menetap, hematuria serta tes pencitraan
(National Kidney Foundation, 2002).
Tabel 2.1 Kriteria Definisi Penyakit Ginjal Kronik
(National Kidney Foundation, 2002)
1. Kerusakan ginjal selama > 3 bulan, yang disebabkan oleh abnormalitas struktural atau fungsional dari ginjal, dengan atau tanpa penurunan LFG, manifestasi sebagai:
Abnormalitas patologi
Bukti kerusakan ginjal, meliputi abnormalitas
komposisi darah atau urin, abnormalitas pada tes pencitraan
2. Laju filtrasi glomerulus <60 ml/menit/1,73m2 selama > 3
bulan, dengan atau tanpa kerusakan ginjal
Stadium PGK ditegakkan berdasarkan pada tingkat fungsi ginjal. Identifikasi
stadium pada penderita PGK tidak secara akurat mengetahui penyebab penyakit
7
glomerulus yang digunakan adalah 60 ml/menit/1,73m2 karena hal itu merupakan
penurunan 50 persen dari fungsi ginjal yang normal (Couser dkk, 2011).
2.1.2 Klasifikasi
Penyakit ginjal kronik dapat diklasifikasikan menjadi stadium 1 hingga 5,
dimana stadium 1 ditandai dengan kerusakan ginjal dengan LFG normal. Stadium
2 ditandai dengan kerusakan ginjal dengan penurunan laju filtrasi glomerulus
ringan. Stadium menengah yang signifikan secara klinis adalah PGK stadium 3
dan 4 sedangkan PGK stadium 5 sudah dikatakan stadium akhir yaitu dengan nilai
laju filtrasi glomerulus yang rendah <15 ml/menit/1,73m2 (MacGregor, 2006;
Couser dkk, 2011).
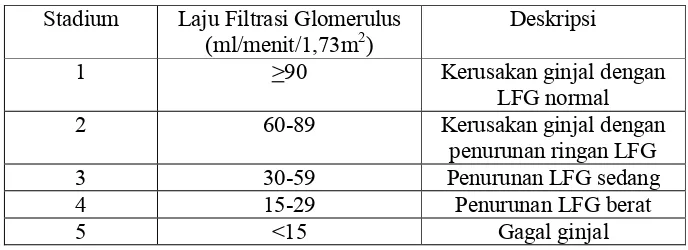
Tabel 2.2 Klasifikasi Stadium PGK (National Kidney Foundation, 2002)
Stadium Laju Filtrasi Glomerulus
(ml/menit/1,73m2) Deskripsi
1 >90 Kerusakan ginjal dengan
LFG normal
2 60-89 Kerusakan ginjal dengan
penurunan ringan LFG
3 30-59 Penurunan LFG sedang
4 15-29 Penurunan LFG berat
5 <15 Gagal ginjal
2.1.3 Komplikasi pada Sistem Saraf
Penyakit ginjal kronik menyebabkan akumulasi produk sisa organik dari
tubuh yang normalnya dibersihkan oleh ginjal. Pada penderita PGK dengan laju
filtrasi glomerulus dibawah 50% sering mengalami komplikasi dibidang neurologi
8
penderita PGK stadium lanjut (Brouns dan De Deyn, 2004) dan mempengaruhi
sistem saraf pada semua level baik sentral maupun perifer (Krishnan dan Kiernan,
2009). Komplikasi pada sistem saraf dapat berhubungan langsung diakibatkan
oleh penyakit ginjal itu sendiri dan dapat berhubungan dengan terapi hemodialisis.
Komplikasi neurologi pada sistem saraf pusat antara lain demensia dialisis,
sindrom disekuilibrium dan ensefalopati uremik sedangkan komplikasi neurologi
pada sistem saraf perifer yang paling sering adalah neuropati perifer (Krishnan
dan Kiernan, 2009; Rizzo dkk, 2012). Komplikasi yang berhubungan dengan
terapi hemodialisis tampak pada Tabel 2.3.
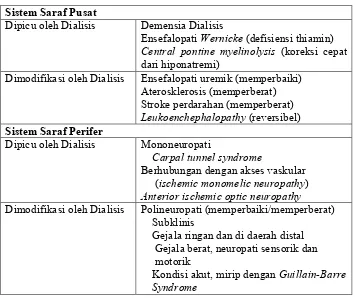
Tabel 2.3 Komplikasi Neurologi Pada Pasien Hemodialisis (Rizzo dkk, 2012)
Sistem Saraf Pusat
Dipicu oleh Dialisis Demensia Dialisis
Ensefalopati Wernicke (defisiensi thiamin)
Central pontine myelinolysis (koreksi cepat
dari hiponatremi)
Dimodifikasi oleh Dialisis Ensefalopati uremik (memperbaiki) Aterosklerosis (memperberat) Stroke perdarahan (memperberat)
Leukoenchephalopathy (reversibel)
Sistem Saraf Perifer
Dipicu oleh Dialisis Mononeuropati
Carpal tunnel syndrome
Berhubungan dengan akses vaskular (ischemic monomelic neuropathy) Anterior ischemic optic neuropathy Dimodifikasi oleh Dialisis Polineuropati (memperbaiki/memperberat)
Subklinis
Gejala ringan dan di daerah distal Gejala berat, neuropati sensorik dan motorik
Kondisi akut, mirip dengan Guillain-Barre
9
2.2 Neuropati Perifer pada PGK
Neuropati perifer diartikan sebagai suatu proses menyeluruh yang
memberikan efek yang bersifat menyebar, simetris bilateral dan bersifat motorik,
sensorik, atau otonom (Herskovitz, 2010). Neuropati uremik terjadi pada dua per
tiga pasien PGK stadium akhir. Proses dialisis biasanya akan memperbaiki kondisi
neuropati ini (Weisberg, 1996). Ada pendapat lain yang menyebutkan bahwa
dengan hemodialisis, gejala neuropati perifer akan semakin bertambah oleh
karena hilangnya tiamin saat proses dialisis. Hal ini belum diketahui secara pasti
(Rizzo dkk, 2012). Neuropati perifer pada penderita PGK memiliki prevalensi
bervariasi sekitar 60%-90% dan dua kali lebih sering terjadi pada laki-laki
(Wijdicks, 2002; Krishnan dan Kiernan, 2009).
2.2.1 Manifestasi Klinis Neuropati Perifer pada PGK
Neuropati perifer pada penderita PGK merupakan suatu neuropati
length-dependent, memiliki karakteristik degenerasi aksonal dengan demielinisasi
sekunder dan kondisi tersebut dapat mempengaruhi saraf motorik, sensorik dan
saraf kranialis. Neuropati yang terjadi ditandai dengan kelainan pada daerah
distal, bersifat simetris dengan predominan neuropati aksonal, campuran neuropati
motorik dan sensorik. Biasanya lebih banyak mengenai tungkai kaki dibandingkan
lengan tangan (Rizzo dkk, 2012).
Neuropati ini biasanya terjadi subklinis dan didiagnosis berdasarkan
pemeriksaan elektrofisiologi. Pada kondisi ringan, gejala yang paling sering
10
dengan hilangnya rasa getar atau vibrasi (Rizzo dkk, 2012). Gejala klinis yang
muncul dapat berupa kram otot yang biasanya dikeluhkan pada malam hari,
biasanya berlokasi pada satu atau lebih otot yang lebih sering mengenai
ekstremitas bawah, selain itu dapat juga terjadi restless leg syndrome, parestesi,
disestesi atau sensasi abnormal yang mengenai jari-jari kaki dan tangan dan
biasanya terjadi pada stadium lanjut PGK, nyeri pada kedua ektremitas bawah
terutama pada daerah yang dipersarafi nervus peroneus dan sensasi terbakar pada
kedua kaki (Mustofa dan El Tayeb, 2004).
Pada pemeriksaan fisik bisa didapatkan hilangya refleks tendon Achiles pada
kasus yang lebih lanjut. Gangguan vibrasi pada ekstremitas bagian distal dialami
selanjutnya. Namun terdapat penelitian lain yang menyebutkan bahwa gangguan
vibrasi lebih terganggu terlebih dahulu dibandingkan modalitas lainnya.
Kelemahan motorik tersering adalah kelemahan dorsofleksi kaki hingga atrofi otot
terutama di bagian distal. Gejala sensoris dominan yang muncul dengan distribusi
seperti kaos kaki. Gangguan motorik dan sensorik lebih ke proksimal dan pada
ekstremitas superior menunjukkan bahwa kerusakan saraf telah lanjut (Latov,
2007; Palmer, 2007; Krishnan dan Kiernan, 2009; Pan, 2009; Herskovitz, 2010).
2.2.2 Patogenesis Neuropati Perifer pada PGK
Patogenesis neuropati perifer pada penderita PGK diawali dengan kondisi
uremia. Pada kondisi uremia banyak bahan toksin uremik yang dapat memicu
munculnya neuropati uremik. Bahan toksin uremik adalah suatu substrat atau
11
negatif pada fungsi biologis tubuh (Duranton, 2012). Meskipun beberapa atau
semua bahan toksin ini berperan dalam terjadinya neuropati uremik, faktanya
bahwa beberapa dari bahan tersebut bersifat neurotoksin masih belum pasti,
contohnya molekul berukuran sedang dengan berat molekul 300 hingga 2500
Dalton dapat bersifat neurotoksin. Suatu bahan disebut toksin uremik biasanya
memiliki syarat-syarat sebagai berikut (Arminoff, 2008; Krishnan dan Kiernan,
2009) :
1. Bahan diidentifikasi secara kimia dan ditemukan dalam cairan biologis
tubuh.
2. Konsentrasi zat tersebut lebih tinggi pada pasien dengan uremia.
3. Konsentrasi dari zat tersebut berkorelasi dengan gejala uremik yang
spesifik.
4. Gejala berkurang bila zat tersebut kadarnya menjadi normal.
5. Efek toksik zat tersebut muncul pada konsentrasi yang sama.
Bahan-bahan toksin uremik ini secara umum dapat dibagi menjadi 3
kelompok besar antara lain bahan molekul ringan yang larut air, molekul
berukuran sedang dan bahan yang terikat dengan protein. Yang termasuk dalam
bahan molekul ringan adalah urea, kreatinin, oksalat dan asam urat. Yang
termasuk dalam molekul berukuran sedang adalah leptin, beta 2 mikroglobulin
dan hormon paratiroid, sedangkan yang termasuk dalam bahan terikat dengan
protein adalah polyamines, indoxyl sulfate, homocystein dan hippuric acid
12
Ada beberapa teori mengenai efek toksik dari bahan-bahan toksin uremik.
Berdasarkan pengamatan pada beberapa pasien didapatkan teori bahwa molekul
berukuran sedang ini memberikan efek toksik, namun terdapat beberapa studi lain
yang tidak mendukung teori ini. Suatu postulat yang dikemukakan oleh Fraser dan
Arieff mengungkapkan bahwa neurotoksin berefek mengurangi suplai energi pada
akson dengan cara menghambat enzim serabut saraf yang diperlukan untuk
produksi energi tersebut. Dengan berkurangnya energi akan mempengaruhi nodus
ranvier dalam menyalurkan impuls konduksi dan akhirnya akan menyebabkan
kerusakan akson (Ramirez dan Gomez, 2012).
Bahan toksin juga menyebabkan disfungsi dari beberapa membran pada
perineurium, dimana berperan sebagai barier difusi antara cairan interstitial dan
saraf; dan pada endoneurium, dimana berperan sebagai barier antara darah dan
saraf. Sebagai konsekuensinya, toksin uremik dapat masuk ke ruang endoneural
dan menyebabkan kerusakan saraf secara langsung, dengan perubahan
hidroelektrolit yang dapat menyebabkan penciutan (shrinkage) (Pan, 2009).
Nielsen pada tahun 1973 mengajukan suatu hipotesis bahwa disfungsi saraf
yang terjadi berhubungan dengan faktor toksik serum uremik yang menghambat
fungsi membran akson dan aktivasi pompa Na/K ATPase. Hal ini dipikirkan
karena terjadi pengurangan kecepatan konduksi saraf akibat dari pompa Na/K
ATPase pada aksolema yang berhubungan dengan toksin uremik, membentuk
akumulasi natrium intrasel dan perubahan potensial membran istirahat. Kondisi
ini memicu degenerasi aksonal dan demielinisasi segmental sekunder (Nielsen,
13
Studi morfologi menunjukkan degenerasi aksonal dengan tipe dying-back dan
demielinisasi yang terjadi merupakan kondisi sekunder dari atropi akson yang
mendahului proses degenerasi aksonal. Gangguan metabolik bertanggung jawab
terhadap terjadinya neuropati tetapi juga berhubungan dengan monoclonal
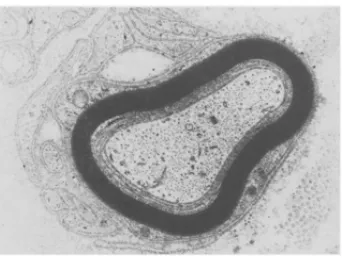
cryoglobulinemia dari diskrasia sel plasma. Pada Gambar 2.1 tampak gambaran
potongan melintang serabut saraf menggunakan mikroskop elektron pada kondisi
neuropati. Beberapa spiral bagian dalam dari sel Schwann tampak tidak padat
untuk membentuk lamellar myelin. Lamellar yang tidak padat ini tampak pada
[image:32.595.234.405.354.483.2]beberapa neuropati (Garcia, 2013).
Gambar 2.1 Kerusakan Serabut Saraf pada Neuropati (Garcia, 2013)
Hemodialisis juga dapat mengakibatkan terakumulasinya molekul berukuran
sedang. Hal ini sesuai dengan hipotesis yang mengatakan bahwa neuropati
disebabkan oleh akumulasi molekul berukuran sedang (300 hingga 12.000
Dalton), dimana dibersihkan lebih lambat daripada urea dan kreatinin (Vanholder
et al, 2008).
Secara patologi, kondisi neuropati perifer dibagi menjadi 3 pola dasar yaitu
14
yang ditandai dengan degenerasi Wallerian, meliputi neuropati akibat trauma,
infark dari saraf perifer (mononeuropati diabetik, vaskulitis) dan infiltrasi
neoplasma. Pada aksonopati distal, didapatkan neuropati akibat gangguan
metabolik, obat-obatan, dan toksin industri seperti pestisida, sedangkan
demielinisasi segmental terjadi pada neuropati demielinisasi akut dan kronik,
neuropati difteritik, metachromatic leukodystrophy dan penyakit
Charcot-Marie-Tooth (Agamanolis, 2015).
Neuropati perifer pada PGK terjadi proses aksonopati distal, diawali dengan
degenerasi akson dan myelin terutama pada bagian distal dari akson. Apabila
kerusakan ini terjadi menetap maka akan terjadi akson “dies back”. Hal ini yang
menyebabkan gejala dengan karakteristik kelemahan dan hilangnya sensoris area
distal “stocking-gloves”. Neurofilamen dan organela berakumulasi pada proses
degenerasi akson, hal ini terjadi kemungkinan oleh karena kondisi stagnan dari
aliran aksoplasmik. Kemudian akson menjadi atropi dan hancur. Aksonopati distal
yang berat hampir menyerupai degenerasi Wallerian. Pada tahap lanjut, akan
terjadi hilangnya mielin pada akson. Aksonopati distal disebabkan oleh patologi
atau kelainan dari badan neuron sebagai akibat dari ketidakmampuan untuk
memenuhi kebutuhan metabolik yang diperlukan akson. Hal ini menjelaskan
mengapa penyakit dimulai dari bagian distal saraf dan akson yang besar yang
memiliki kebutuhan metabolik dan nutrisi terbanyak biasanya sering mengalami
15
2.2.3 Pemeriksaan Penunjang Neuropati Perifer
Pemeriksaan penunjang yang digunakan untuk mendiagnosis suatu neuropati
perifer adalah elektroneuromiografi atau pemeriksaan nerve conduction study
(NCS). Pemeriksaan compound muscle action potential (CMAP) dilakukan pada
nervus medianus, nervus ulnaris, nervus radialis, nervus tibialis, nervus peroneus.
Pemeriksaan sensory nerve action potential (SNAP) pada nervus medianus,
nervus ulnaris, nervus radialis dan nervus suralis. Nilai normal dari pemeriksaan
NCS untuk pemeriksaan motorik dan sensorik nervus medianus, nervus ulnaris,
nervus radialis, nervus tibialis, nervus peroneus, dan nervus suralis tampak pada
[image:34.595.151.488.410.493.2]Tabel 2.4 dan Tabel 2.5 (Preston, 2013).
Tabel 2.4 Hasil Pemeriksaan Motorik atau CMAP (Preston, 2013)
Variabel Latensi (mdet) Amplitudo(mV) KHS(m/det)
N. Medianus <4,4 >4,0 >49
N. Ulnaris <3,3 >6,0 >49
N. Radialis <2,9 >2,0 >49
N. Tibialis <5,8 >4,0 >41
[image:34.595.153.485.539.608.2]N. Peroneus <6,5 >2,0 >44
Tabel 2.5 Hasil Pemeriksaan Sensoris atau SNAP (Preston, 2013)
Variabel Latensi(mdet) Amplitudo(mV) KHS(m/det)
N. Medianus <3,5 >20 >50
N. Ulnaris <3,1 >17 >50
N. Radialis <2,9 >15 >50
N. Suralis <4,4 >6 >40
Nerve Conduction Study merupakan standar baku emas dalam mendiagnosis
neuropati perifer pada penderita PGK (Krishnan dan Kiernan, 2009). Pemeriksaan
16
perifer menyeluruh, tipe aksonal, dengan penurunan amplitudo SNAP dan bila
meluas amplitudo CMAP pun menurun, sedangkan kecepatan hantar saraf (KHS)
relatif masih baik. Latensi F-wave dan H-reflex, amplitudo nervus suralis, dan
deteksi vibrasi pada ekstremitas bawah merupakan parameter elektrofisiologis
yang sensitif. Nervus suralis lebih sering terlibat dibandingkan nervus peroneus
dan tibialis. Amplitudo sensoris nervus suralis menurun pada 50% kasus. Latensi
F-wave pada nervus tibialis dan peroneus memanjang dan H-reflex pun abnormal.
Polineuropati dapat terjadi pada stadium awal PGK dan kemungkinan berjenis
demielinisasi yang ditandai dengan perlambatan pada konduksi saraf dengan
amplitudo sensorik dan motorik yang masih baik. Elektroneuromiografi
khususnya NCS mampu mendeteksi adanya neuropati perifer subklinis 48%-70%
pasien dengan PGK (Oh, 2003; Krishnan dan Kiernan, 2009; Pan, 2009;
Herskovitz, 2010). Suatu penelitian dengan pemeriksaan elektrofisiologis pada
penderita PGK pre-dialisis yang dilakukan pada nervus medianus, nervus ulnaris,
nervus peroneus dan nervus tibialis, didapatkan hasil sebanyak 70% pasien
mengalami neuropati perifer, 6% neuropati asimptomatik, 51% neuropati
simptomatik (Aggarwal, 2013).
2.3 Asam Urat
2.3.1 Struktur Asam Urat
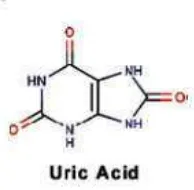
Asam urat adalah produk akhir metabolism purin. Purin (adenin dan guanin)
merupakan konstituen asam nukleat (Warner et al., 2004). Asam urat (
17
didistribusikan dalam cairan ekstraseluler sebagai natrium urat. Asam urat
cenderung berada di cairan plasma ekstraselular sehingga membentuk ion urat
[image:36.595.278.375.185.280.2]pada pH 7.4. Ion urat mudah disaring dari plasma (McCrudden, 2000).
Gambar 2.2 Stuktur Kimia Asam Urat (McCrudden, 2000).
2.3.2 Sintesis dan Ekskresi Asam Urat
Asam urat disintesis terutama dalam hati, dalam suatu reaksi yang dikatalisis
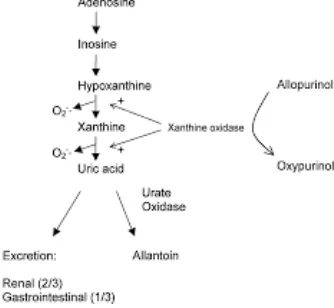
oleh enzim xanthine oxidase (XO). Metabolisme adenosin triphosfate (ATP)
menyebabkan akumulasi hypoxanthine. Hypoxanthine dirubah oleh enzim XO
menjadi xantin. Pada jaringan yang non-iskemik, XO yang berada dalam bentuk
nicotinamide adenine dinucleotide (NAD) menurunkan hydrogenase. Selama
iskemia, Ca2+-stimulated protease yang menyebabkan pemecahan parsial
xanthine dehydrogenase menjadi XO yang irreversible. XO selanjutnya
mengoksidasi xanthine, menghasilkan asam urat, superoksida dan hidrogen
18
Gambar 2.3 Pembentukan Asam Urat dari Asam Nukleat (Sumarni, 2015)
Gambar 2.4 Metabolisme Purin (Adenosin) (Hare dan Johnson, 2003)
Kadar asam urat serum diatur oleh 4 komponen sistem transpor ginjal yang
meliputi proses filtrasi, reabsorbsi, sekresi dan reabsorbsi paska sekresi. Sejumlah
transporter ginjal turut terlibat dalam pengaturan kadar asam urat dalam plasma
seperti urat transporter 1 (URAT1) yang bertanggung jawab terhadap reabsorbsi
urat dan sejumlah sejumlah transporter ion organik (OAT) seperti OAT1 dan
[image:37.595.235.402.344.498.2]19
sekresi urat. Karena keterlibatannya yang begitu penting dalam reabsorbsi urat,
URAT1 dipercaya memainkan peranan yang sangat kritis dalam pengaturan kadar
asam urat serum (Johnson et al., 2003; Hediger et al., 2005).
Sumber asam urat pada manusia didapat melalui dua cara, yaitu secara
endogen dan eksogen. Sumber asam urat secara endogen yaitu melalui sintesis de
novo dan pemecahan asam nukleat kurang lebih sebanyak 600 mg/hari. Sumber
asam urat yang berasal dari eksogen yaitu melalui asupan makanan yang
mengandung purin kurang lebih 100 mg/hari (Pasalic, 2012).
Ekskresi asam urat total pada manusia normal rata-rata adalah 400-600 mg
per hari. Kebanyakan asam urat diekskresikan lewat urin melalui mekanisme yang
kompleks dengan melibatkan filtrasi glomerulus, reabsorbsi tubulus di bagian
awal tubulus konkortus proksimal, sekresi tubulus di bagian akhir reabsorbsi dan
mungkin mengalami reabsorbsi lagi di bagian akhir tubulus proksimal (Capasso et
al., 2005; Hediger et al.,2005).
Kadar darah asam urat normal pada laki-laki yaitu 3.4 - 7 mg/dl sedangkan
pada perempuan yaitu 2.4 - 6 mg/dl (Gray, 2015). Pada keadaan normal,
kebutuhan produksi dan eliminasi asam urat kurang lebih 700 mg. Kurang lebih
sebanyak 30% dari kebutuhan asam urat berkurang di usus karena bakteri
uricolysis pada sistem pencernaan, sedangkan 70% sisanya (atau kurang lebih 500
mg) disekresikan melalui ginjal. Pada manusia, plasma urat secara bebas
mengalami filtrasi di glomerulus, namun komponen yang dieksresikan hanya 10%
20
Beberapa faktor yang telah diteliti berpengaruh terhadap kadar asam urat
serum dalam darah adalah umur dan jenis kelamin. Kadar asam urat juga akan
meningkat dengan adanya gangguan fungsi ginjal (McCrudden, 2000; Liu et
al.,2011). Jumlah asam urat dalam plasma tergantung pada jumlah makanan atau
minuman yang mengandung purin, biosintesis asam urat dan laju ekskresi urat.
Namun di dalam tubuh, perputaran purin terjadi secara terus menerus seiring
dengan sintesis dan penguraian RNA dan DNA, sehingga walaupun tidak ada
asupan purin, tetap terbentuk asam urat dalam jumlah yang subtansial. Kadar
asam urat akan meningkat dengan bertambahnya usia dan gangguan fungsi ginjal
(McCrudden, 2000). Gagal ginjal menyebabkan asam urat, urea, dan kreatinin
terakumulasi. Diuretik tiazid menurunkan ekskresi urat. Alopurinol, probenesid,
kortikosteroid, dan aspirin dosis besar meningkatkan ekskresi urat (Liu et
al.,2011).
2.3.3 Peran Asam Urat pada Tubuh
Asam urat merupakan antioksidan cair terbanyak pada manusia, 2/3 dari total
antioksidan yang memiliki kemampuan menetralisir radikal bebas dalam plasma
terutama hidroksil, superoksida, peroksinitrit dan mungkin memiliki kemampuan
melindungi secara fisiologis dengan mencegah peroksidasi lipid. Namun apabila
jumlahnya berlebihan dalam tubuh juga dapat menimbulkan efek merugikan yaitu
suatu kondisi hiperurisemia dan juga dapat menginduksi stres oksidasi atau
21
Kadar asam urat dapat meningkat pada keadaan tertentu seperti diet tinggi
purin, konsumsi alkohol yang berlebihan, perubahan sel atau kematian sel pada
neoplasma atau obat sitotoksik, kelainan metabolisme purin karena faktor genetik,
kelainan fungsi ginjal yang menyebabkan penurunan klirens (clearance) asam
urat, gangguan ekskresi asam urat yang berhubungan dengan reabsorbsi natrium
yang berlebihan pada beberapa kondisi seperti obesitas, resistensi insulin atau
hiperinsulinemia, hipertensi, diet rendah natrium dan terapi diuretik.
Dalam berbagai organ dan pembuluh darah, konsentrasi lokal asam urat
meningkat selama stres oksidatif akut dan iskemia serta peningkatan
konsentrasinya mungkin merupakan mekanisme kompensasi untuk memberikan
efek perlindungan melawan peningkatan aktivitas radikal bebas. Berkaitan dengan
kondisi iskemik dalam hubungannya dengan kenaikan kadar asam urat perlu
dicatat bahwa xanthin oxidoreductase terdapat dalam dua bentuk yang berbeda
yaitu xanthine dehidrogenase dan xanthine oxidase. Xanthine dehidrogenase
adalah bentuk paling umum yang bekerja di bawah kondisi fisiologis dan
memiliki afinitas yang lebih besar untuk nicotinamide adenin dinukleotide
dioksida (NAD+) dibandingkan dengan oksigen sebagai akseptor elektron. Dalam
kondisi iskemik seiring degradasi ATP menjadi adenin dan xanthine, terjadi
perubahan besar xanthine dehidrogenase menjadi XO. Proses ini menggunakan
molekul oksigen pada tempat NAD+ sebagai akseptor elektron dan mengarah pada
pembentukan anion superoksida dan hidrogen peroksida secara paralel dengan
kadar asam urat serum seperti yang ditunjukkan oleh beberapa studi
22
Selama beberapa tahun, hiperurisemia telah diidentifikasi bersama-sama atau
dianggap sama dengan gout, namun saat ini asam urat telah diidentifikasi sebagai
penanda untuk sejumlah kelainan metabolik dan hemodinamik (Waring et al.,
2000; Qasi and Lohr, 2005). Dalam keadaan normal terdapat keseimbangan antara
pembentukan dan degradasi nukleotida purin serta kemampuan ginjal dalam
mengekskresikan asam urat. Apabila terjadi kelebihan pembentukan asam urat,
hambatan pengeluaran asam urat atau keduanya maka akan terjadi peningkatan
konsentrasi asam urat darah yang disebut dengan hiperurisemia (Edward, 2009).
Asam urat serum merupakan salah satu antioksidan. Namun antioksidan dapat
menjadi prooksidan pada beberapa situasi. Diperkirakan terdapat suatu
mekanisme antioxidant–prooxidant redox shuttle pada pembuluh darah lapisan
intima yang mengalami aterosklerosis. Asam urat pada tahap awal proses
aterosklerosis telah diketahui berperan sebagai antioksidan dan mungkin
merupakan antioksidan terkuat yang terdapat di plasma. Kemudian proses
aterosklerosis dengan kadar asam urat serum meningkat lebih dari nilai normal >
6 mg/dl untuk perempuan dan 6,5-7 mg/dl untuk laki-laki, didapatkan bahwa asam
urat akan berperan sebagai prooksidan. Antioxidant-prooxidant urate redox shuttle
juga bergantung pada kondisi lingkungan sekitar seperti waktu (awal atau akhir
dari proses penyakit), lokasi jaringan dan substrat, tingkat keasaman (pH
asam-basa-netral), oksidan yang ada di lingkungan sekitar, kekurangan antioksidan pada
area tertentu, suplai dan durasi substrat antioksidan. Reaksi yang terjadi meliputi
23
Reaksi Fenton dan reaksi Haber-Weiss dapat meningkatkan oxidative-redox stress
(Hayden, 2004).
Reaksi Fenton:
Fe2+ + H2O2 → Fe3+ + OH• + OH Fe3+ + H2O2 → Fe2+ + OOH• + H+
Reaksi Haber-Weiss:
H2O2 + O2- → O2 + OH- + OH H2O2 + OH- → H2O + O2- + H+
Radikal hidroksil dapat memicu reaksi lanjutan dengan memproduksi ROS
melalui reaksi tambahan, abstraksi hidrogen, transfer elektron dan interaksi
radikal. Sebagai tambahan, ion copper (Cu3+ - Cu2+ - Cu1+) dapat mengalami
reaksi yang serupa dengan pembentukan peroksidase lipid dan ROS. Hal ni akan
menyebabkan kebocoran ion besi dan tembaga dari pecahnya vasa vasorum
(Hayden, 2004).
2.4 Asam Urat dengan Neuropati Perifer
Asam urat merupakan toksin uremik yang jumlahnya semakin meningkat
terutama pada penderita PGK. Pada kondisi jumlah asam urat meningkat, asam
urat sebagai neurotoksin berefek mengurangi suplai energi pada akson dengan
cara menghambat enzim serabut saraf yang diperlukan untuk produksi energi
tersebut. Bahan toksin juga menyebabkan disfungsi dari beberapa membran pada
perineurium, dimana berperan sebagai barier difusi antara cairan interstitial dan
saraf; dan pada endoneurium, dimana berperan sebagai barier antara darah dan
24
sehingga menyebabkan kerusakan saraf secara langsung melalui perubahan
hidroelektrolit yang dapat menyebabkan penciutan (shrinkage) (Pan, 2009).
Asam urat meskipun sebagai antioksidan utama dalam sirkulasi (Ames,1981),
namun juga menginduksi stres oksidasi pada beberapa sel termasuk sel otot polos
(Corry et al.,2008) yang menyebabkan progresivitas penyakit termasuk
kardiovaskular. Mekanisme patogenesisnya diduga melalui penurunan
bioavaibilitas nitric oxide (NO) pada sel otot polos dan sel endotel serta
mengurangi langsung NO (Gersch et al.,2008). Pengamatan klinis dan
laboratorium memperlihatkan peningkatan konsentrasi asam urat dalam darah
lebih dari 5,5 mg/dL, dikaitkan dengan disfungsi endotel (Zharikov et al., 2007).
Peran asam urat pada sel endotel diperkirakan juga melalui aktivasi leukosit dan
terdapat korelasi yang konsisten antara peningkatan konsentrasi asam urat dengan
penanda inflamasi dalam sirkulasi (Culleton et al., 2006). Dengan adanya
kerusakan pada sel otot polos dan sel endotel, akan mempengaruhi vaskularisasi
perifer sehingga dapat mengganggu fungsi saraf perifer sehingga akhirnya
menimbulkan neuropati perifer. Terdapat suatu penelitian yang membuktikan
adanya hubungan antara peningkatan kadar asam urat serum dengan terjadinya