UJI DAYA ANTIOKSIDAN MENGGUNAKAN RADIKAL 1,1-DIFENIL-2-PIKRILHIDRAZIL DAN PENETAPAN KANDUNGAN FENOLIK TOTAL
FRAKSI ETIL ASETAT EKSTRAK ETANOL KULIT JERUK NIPIS (Citrus aurantifolia (Christm.) Swingle)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Farmasi
Oleh :
Febrin Nessy Triana
NIM : 098114130
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
i
UJI DAYA ANTIOKSIDAN MENGGUNAKAN RADIKAL 1,1-DIFENIL-2-PIKRILHIDRAZIL DAN PENETAPAN KANDUNGAN FENOLIK TOTAL
FRAKSI ETIL ASETAT EKSTRAK ETANOL KULIT JERUK NIPIS (Citrus aurantifolia (Christm.) Swingle)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Farmasi
Oleh :
Febrin Nessy Triana
NIM : 098114130
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
vi
HALAMAN PERSEMBAHAN
Skripsiku ini kupersembahkan kepada :
Tuhan Yesus Kristus
Ayah, ibu, kakak dan seluruh keluarga besar Sahabat-sahabat dan
vii PRAKATA
Puji dan syukur kepada Tuhan Yesus Kristus atas segala berkat dan
bimbingan-Nya sehingga penulis dapat menyelesaikan tugas akhir yang berjudul
“Uji Daya Antioksidan Menggunakan Radikal 1,1-Difenil-2-Pikrilhidrazil Dan Penetapan Kandungan Fenolik Total Fraksi Etil Asetat Ekstrak Etanol Kulit Jeruk Nipis (Citrus aurantifolia (Christm.) Swingle)” dengan baik sebagai salah satu syarat guna memperoleh gelar Sarjana Farmasi Universitas
Sanata Dharma Yogyakarta.
Penulis menyadari bahwa penelitian dan penyusunan skripsi ini tidak
lepas dari segala doa, bantuan dan dukungan dari semua pihak baik secara
langsung maupun tidak langsung. Oleh karena itu, melalui kesempatan ini penulis
ingin mengucapkan terima kasih yang sebesar-besarnya kepada :
1. Bapak Ipang Djunarko, M.Sc., Apt., selaku Dekan Fakultas Farmasi
Universitas Sanata Dharma.
2. Bapak Yohanes Dwiatmaka, M.Si selaku Dosen Pembimbing yang telah
banyak memberikan bimbingan, arahan, petunjuk dan motivasi dengan
sabar dalam penelitian dan penyusunan skripsi ini.
3. Bapak Prof. Dr. C.J. Soegihardjo, Apt. Sebagai Dosen Penguji atas
pengarahan dan kesediaannya menguji skripsi ini.
4. Ibu Dra. M.M. Yetty Tjandrawati, M.Si. sebagai Dosen Penguji atas
viii
5. Segenap dosen dan karyawan Fakultas Farmasi Universitas Sanata
Dharma atas segala ilmu dan pengetahuan yang telah dibagikan.
6. Segenap laboran Laboratorium Fakultas Farmasi Universitas Sanata
Dharma, terutama Mas Wagiran selaku laboran Laboratorium
Farmakognosi-Fitokimia dan juga Mas Bimo selaku laboran Laboratorium
Kimia Analisis Instumental atas segala bantuan dan bimbingannya selama
penulis melakukan penelitian.
7. Sahabat seperjuangan Putut Wibisono, Wisnu Brahmana Putra, dan my
special one Augustinus Teti yang telah berjuang bersama dalam
melakukan dan menyelesaikan misi ini.
8. My Besties Anta, Lisu, Selvia, terima kasih atas segala kebersamaan kita
selama empat tahun di Farmasi Sanata Dharma. Sahabat tercinta Victor,
Agnes, Novia, Neti, Jo, Ina, Topan, Leo, Jimmy, Metri, dan Sashya yang
telah menemani dan baerbagi laboratorium dengan penulis.
9. Teman-teman Farmasi angkatan 2009, khususnya kelas C dan FST B
terima kasih atas segala cerita dan kebersaan kita.
10.Keluarga besar Wisma Sri Widodo (the babikers) yang telah setia
menemani dan memberi dukungan setiap saat.
11.Semua pribadi yang telah memberi dukungan dan semangat yang tak dapat
disebutkan satu per satu.
12.Terima kasih terutama kepada kedua orang tua penulis yang selalu percaya
ix
Penulis menyadari bahwa penyusunan skripsi ini masih memilki banyak
kekurangan dan jauh dari sempurna. Oleh karena itu, dengan segala kerendahan
hati penulis menerima kritik dan saran yang membangun dalam penyempurnaan
skripsi ini. Semoga hasil penelitian ini bermanfaat bagi semua pihak yang
membutuhkan dan mampu memberi sumbangan kecil bagi perkembangan ilmu
pengetahuan.
Yogyakarta, Juli 2013
x DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN... iii
PERNYATAAN KEASLIAN KARYA ... iv
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS ... v
HALAMAN PERSEMBAHAN... vi
xi
3. Kandungan kimia ... 7
4. Manfaat tanaman ... 8
B. SENYAWA RADIKAL BEBAS ... 8
C. SENYAWA ANTIOKSIDAN ... 10
D. FENOL DAN FLAVONOID ... 12
E. PENYARIAN ... 12
F. METODE DPPH ... 14
G. SPEKTROFOTOMETER VISIBEL ... 16
H. LANDASAN TEORI ... 17
I. HIPOTESIS ... 18
BAB III METODOLOGI PENELITIAN ... 19
A. Jenis dan rancangan penelitian ... 19
B. Variabel penelitian ... 19
C. Definisi operasional ... 20
D. Bahan dan alat penelitian ... 20
1. Bahan penelitian ... 20
2. Alat penelitian ... 20
E. Tata Cara Penelitian ... 21
1. Determinasi tanaman ... 21
2. Pemilihan dan pengumpulan bahan ... 21
3. Preparasi simplisia ... 21
4. Ekstraksi simplisia ... 21
xii
6. Pembuatan Larutan pembanding, baku dan uji ... 22
7. Uji pendahuluan ... 23
8. Uji aktivitas antioksidan ... 24
9. Penetapan kandungan fenolik total ... 26
BAB IV HASIL DAN PEMBAHASAN ... 28
A. Determinasi tanaman ... 28
B. Pengumpulan bahan ... 28
C. Preparasi sampel ... 28
D. Ekstraksi sampel ... 29
E. Uji pendahuluan ... 32
1. Uji pendahuluan fenolik total ... 32
2. Uji pendahuluan aktiviras antioksidan ... 33
F. Optimasi metode uji aktivitas antioksidan ... 35
1. Penentuan λmaks metode uji aktivitas antioksidan ... 35
2. Penentuan operating time metode uji aktivitas antioksidan ... 37
G. Validasi metode uji aktivitas antioksidan ... 39
1. Linieritas ... 41
2. Presisi ... 42
3. Spesifitas ... 43
H. Penentuan aktivitas antioksidan dengan radikal bebas ... 43
I. Optimasi metode penetapan kandungan fenolik total ... 51
1. Penentuan operating time penetapan kandungan fenolik total ... 51
xiii
J. Validasi metode penetapan kandungan fenolik total ... 54
1. Linieritas ... 55
2. Presisi ... 56
3. Spesifitas ... 56
K. Penetapan kandungan fenolik total ... 57
BAB V KESIMPULAN DAN SARAN ... 61
A. Kesimpulan ... 61
B. Saran ... 61
DAFTAR PUSTAKA ... 62
LAMPIRAN ... 66
xiv
DAFTAR TABEL
Tabel I. Persamaan regresi linier kurva baku rutin ... 41
Tabel II. Persamaan regresi linier kurva fraksi etil asetat kulit jeruk
nipis ... 42
Tabel III. Hasil % CV uji aktivitas antioksidan rutin & fraksi etil asetat
ekstrak etanol kulit jeruk nipis ... 43
Tabel IV. Hasil % IC rutin menggunakan radikal DPPH ... 45
Tabel V. Hasil % IC fraksi etil asetat ekstrak etanol kulit jeruk nipis
menggunakan radikal DPPH ... 46
Tabel VI. Hasil perhitungan IC50 rutin dan fraski etil asetat ekstrak
etanol kulit jeruk nipis ... 47
Tabel VII. Tingkat kekuatan antioksidan senyawa uji dengan metode
DPPH (Ariyanto, 2011) ... 48
Tabel VIII. Hasil % CV uji penetapan kandungan asam galat ... 56
Tabel IX. Hasil pengukuran absorbansi seri baku asam gala ... 58
Tabel X. Hasil penetapan kandungan fenolat total fraksi etil asetat
xv
DAFTAR GAMBAR
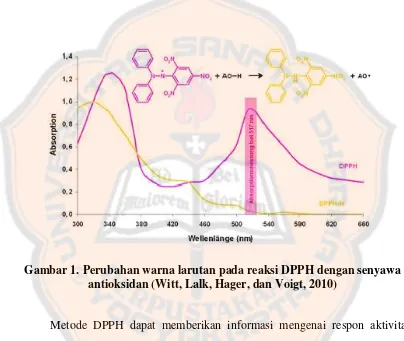
Gambar 1. Perubahan warna larutan pada reaksi DPPH dengan senyawa
antioksidan (Witt, Lalk, Hager, dan Voigt, 2010) ... 15
Gambar 2. Skema alat spektrofotometer UV-Vis ... 17
Gambar 3. Hasil uji pendahuluan fenolik (A = reagen Folin-Ciocalteu +
larutan fraksi etil asetat ekstrak etanol kulit jeruk nipis, B =
kontrol positif [reagen Folin-Ciocalteu + asam galat], C =
blanko [reagen Folin-ciocalteu + natrium karbonat])
... 33
Gambar 4. Hasil uji pendahuluan aktivitas antioksidan (A = larutan
DPPH + larutan fraksi etil asetat ekstrak etanol kulit jeruk
nipis, B = kontrol negatif [larutan DPPH], C = kontrol positif
[larutan DPPH + larutan rutin]) ... 34
Gambar 5. Hasil uji pendahuluan aktivitas antioksidan (A = larutan
fraksi etil asetat ekstrak etanol kulit jeruk nipis + metanol, B
= larutan rutin + metanol) ... 35
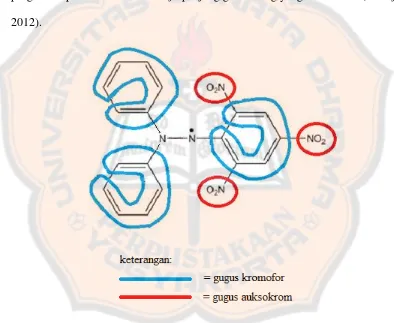
Gambar 6. Gugus kromofor dan auksokrom DPPH ... 36
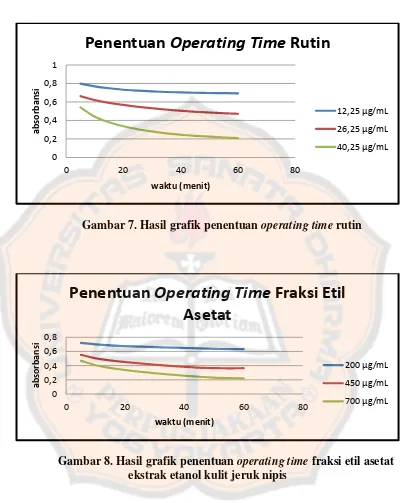
Gambar 7. Hasil grafik penentuan operating time rutin ... 38
Gambar 8. Hasil grafik penentuan operating time fraksi etil asetat
ekstrak etanol kulit jeruk nipis ... 38
xvi
Gambar 10. Kurva persamaan regresi linear aktivitas antioksidan fraksi
etil asetat ekstrak etanol kulit jeruk nipis ... 40
Gambar 11. Struktur DPPH dan DPPH-H (Molyneux, 2004) ... 44
Gambar 12. Struktur rutin (Sidney X. Dos Santos, Luiz H. Mazo, Eder T. G. Cavalheiro, 2008) ... 47
Gambar 13. Hasil uji normalitas rutin ... 48
Gambar 14. Hasil uji normalitas fraksi etil asetat ekstrak etanol kulit jeruk nipis ... 49
Gambar 15. Hasil uji varian rutin dan fraksi etil asetat ekstrak etanol kulit jeruk nipis ... 50
Gambar 16. Hasil T tidak berpasangan varian rutin dan fraksi etil asetat ekstrak etanol kulit jeruk nipis ... 50
Gambar 17. Grafik penentuan operating time asam galat ... 52
Gambar 18. Grafik penentuan operating time fraksi etil asetat ekstrak etanol kulit jeruk nipis ... 53
Gambar 19. Kurva persamaan regresi linear asam galat ... 54
Gambar 20. Reaksi senyawa fenol dengan reagen folin-Ciocalteu ... 58
xvii
DAFTAR LAMPIRAN
Lampiran 1. Gambar tanaman jeruk nipis dari Purwokerto, Jawa
Tengah ... 66
Lampiran 2. Bobot fraksi etil asetat ekstrak etanol kulit jeruk nipis... 66
Lampiran 3. Data penimbangan uji aktivitas antioksidan ... 67
Lampiran 4. Data perhitungan konsentrasi larutan DPPH, larutan
pembanding rutin, dan larutan uji ... 68
Lampiran 5. Optimasi metode uji aktivitas antioksidan ... 69
Lampiran 6. Uji akitivitas antioksidan dengan menggunakan radikal
DPPH ... 72
Lampiran 7. Perhitungan nilai IC50 rutin dan Fraksi etil asetat ekstrak
etanol kulit jeruk nipis ... 73
Lampiran 8. Data penimbangan penetapan kandungan fenolik total ... 75
Lampiran 9. Optimasi penetapan kandungan fenolik total ... 76
Lampiran 10. Penetapan Kandungan fenolik total ... 78
xviii INTISARI
Tanpa kita sadari, di dalam tubuh kita telah terbentuk radikal bebas secara terus-menerus, baik dari proses metabolisme sel normal, peradangan, juga akibat respon terhadap pengaruh dari luar tubuh. Antioksidan adalah senyawa yang mampu menetralisasi radikal bebas tersebut. Antioksidan memiliki berbagai manfaat, seperti terhindar dari penyakit degeneratif, kanker dan juga sebagai anti-aging. Oleh karena itu, peneliti merasa perlu untuk mengeksplor tanaman yang memiliki kemampuan daya antioksidan. Salah satu tanaman yang ingin dieksplor oleh peneliti, yaitu kulit jeruk nipis (Citrus aurantifolia (Christm.) Swingle).
Tujuan dari penelitian ini adalah untuk menguji aktivitas antioksidan menggunakan radikal DPPH (1,1-diphenyl-2-picrylhydrazyl) dan menetapkan kadar fenolat total menggunakan metode Folin-Ciocalteu dari fraksi etil asetat ekstrak etanol kulit jeruk nipis. Hasil uji aktivitas antioksidan dinyatakan dengan nilai IC50 , yaitu nilai konsentrasi fraksi etil asetat ekstrak etanol kulit jeruk nipis
yang menghasilkan penangkapan 50% radikal DPPH. Hasil penelitian menunjukkan bahwa fraksi etil asetat ekstrak etanol kulit jeruk nipis memiliki nilai IC50 sebesar 382,650 ± 6,721 μg/mL yang termasuk golongan aktivitas
antioksidan lemah. Kadar fenolat total sebesar 4,625 ± 0,020 mg ekivalen asam galat per gram fraksi etil asetat ekstrak etanol kulit jeruk nipis.
Kata kunci: fraksi etil asetat ekstrak etanol kulit jeruk nipis, (Citrus aurantifolia
xix ABSTRAK
Without us knowing it, in our body have formed free radicals continuously, both from the normal cell metabolism, inflammation, also due to the response to influences from outside the body. Antioxidants are compounds that can neutralize these free radicals. Antioxidants have a variety of benefits, such as to avoid degenerative diseases, cancer as well as anti-aging. Therefore, researchers feel the need to explore the power plants that have antioxidant capabilities. One of the plants that want to be explored by researchers, the lime peel (Citrus aurantuifolia).
The purpose of this study was to test the antioxidant activity using DPPH radical (1,1-diphenyl-2-picrylhydrazyl) and set the total phenolic content using the Folin-Ciocalteu method of ethyl acetate fraction of ethanol extract of lime peel. The results of this antioxidant activity assay expressed with IC50, that is the
concentration of ethyl acetate fraction of ethanol extract of lime peel to capture 50% DPPH radicals. The results showed that the ethyl acetate fraction of ethanol extract of lime peel have IC50 values of 382.65 ± 6.721 mg / mL has a weak
antioxidant activity. Content of total phenolics was 4.62 ± 0.020 mg gallic acid equivalents per gram of ethyl acetate fraction of ethanol extract of lime peel.
1
BAB I PENGANTAR
A. Latar Belakang
Radikal bebas adalah suatu atom atau molekul yang sangat reaktif
dengan elektron yang tidak memiliki pasangan. Radikal bebas mencari
reaksi-reaksi agar dapat memperoleh kembali elektron pasangannya (Corwin, 2009).
Senyawa radikal sangat aktif menyerang molekul penting yang berada di
sekelilingnya, baik itu senyawa lipid, protein, lipoprotein, maupun karbohidrat.
Meski demikian, keberadaan radikal bebas juga bermanfaat bagi tubuh (Winarsi,
2007). Tanpa kita sadari, di dalam tubuh kita telah terbentuk radikal bebas secara
terus-menerus, baik dari proses metabolisme sel normal, peradangan, juga akibat
respon terhadap pengaruh dari luar tubuh, seperti polusi lingkungan, ultraviolet,
dan lain-lain. Oleh karena itu, yang perlu dilakukan adalah mengontrol dan
mengatur potensi radikal bebas. Pada tubuh manusia memiliki sistem penangkap
radikal bebas yang biasa kita sebut dengan antioksidan. Antioksidan dalam bentuk
enzim tersedia di dalam tubuh dan untuk mempertahankannya diperlukan
antioksidan sekunder yang berasal dari bahan makanan.
Antioksidan adalah zat yang mampu menetralisasi radikal bebas,
sehingga atom dan elektron yang tidak berpasangan mendapat pasangan dan
menjadi stabil. Antioksidan memiliki sangat banyak manfaat bagi tubuh, seperti
penetralisir radikal bebas, dan juga dapat mencegah kanker. Oleh sebab itu, minat
bebas dan memperlambat progres penyakit kronik pun semakin meningkat (Prior,
2003). Selain itu, antioksidan alami ternyata lebih aman jika dibandingkan dengan
antioksidan sintetis yang justru dapat menyebabkan penyakit berbahaya.
Antioksidan juga semakin digemari karena manfaatnya yang beragam, seperti
terhindar dari penyakit degeneratif, kanker dan juga sebagai anti-aging (Tapan,
2005).
Flavonoid merupakan salah satu golongan fenolik yang bersifat sebagai
antioksidan. Flavonoid mencakup banyak pigmen yang paling umum dan terdapat
pada seluruh tumbuhan mulai dari fungus sampai angiospermae. Pada flavonoid
golongan flavon, flavanon, flavonol dan isoflavon banyak tersebar luas pada
pigmen tumbuhan berwarna kuning (Robinson, 1991). Hal ini yang menarik minat
peneliti untuk ikut mengeksplorasi dan meneliti senyawa antioksidan alami dari
kulit jeruk nipis. Berdasarkan penelitian sebelumnya telah diketahui adanya
kandungan flavonoid naringin dan hesperidin pada buah jeruk, kulit, maupun biji
(Tripoli, E., M. Guardia, S. Giammanco, D. Majo, dan M. Giamanco, 2007).
Selain itu pada penelitian, kandungan kimia yang terdapat pada ekstrak kulit jeruk
nipis antara lain karbohidrat, asam amino, flavonoid, seperti rutin, hesperidin,
myrecetin, senyawa kumarin, seperti psoralene, bergapten, isopimpinellin,
imperatorin (Shalaby, Abd-Alla, Ahmeddan Basoudan, 2011). Oleh karena itu,
peneliti ingin meneliti seberapa besar kemampuan senyawa dalam kulit jeruk nipis
meredam aktivitas radikal bebas DPPH.
Dasar pemilihan kulit jeruk nipis dimaksudkan agar didapatkan informasi
jeruk, sehingga pemanfaatan tidak hanya minyak atsirinya sebagai pemberi aroma
tetapi juga memberikan manfaat yang lebih banyak. Selain itu, diharapkan dapat
meningkatkan pemanfaatan limbah menjadi sesuatu yang lebih memiliki nilai.
1. Permasalahan
a. Berapa kadar/kandungan fenolik total fraksi etil asetat ekstrak kulit jeruk
nipis yang dinyatakan dengan massa ekivalen asam galat?
b. Berapa nilai aktivitas antioksidan fraksi etil asetat ekstrak etanol kulit jeruk
nipis dengan menggunakan radikal bebas DPPH yang dinyatakan dengan
IC50?
2. Keaslian penelitian
Uji aktivitas antioksidan kulit jeruk nipis yang dilakukan pada penelitian
ini sudah pernah dilakukan sebelumnya oleh Rafaela Guimaraes, Lillian Barros,
Joao C.M. Barreira, Mª Joao Sousa, Ana Maria Carvalho, Isabel C.F.R. Ferreira
pada tahun 2010 dengan judul penelitian Targeting Excessive Free Radicals with
Peels and Juices of Citrus Fruits: Grapefruit, Lemon, Lime and Orange. Akan
tetapi penelitian yang dilakukan oleh peneliti berbeda dari penelitian yang sudah
ada. Perbedaan ini terletak pada metode pengeringan sampel uji dan pelarut yang
digunakan oleh peneliti, dimana pada penelitian sebelumnya menggunakan
metode liofilisasi dengan pelarut metanol, sedangkan pada penelitian ini
digunakan teknik pengeringan dengan oven dan cairan penyari berupa etanol.
Sehingga melalui penelitian yang dilakukan ini diharapkan mampu memberikan
dilakukan uji antioksidan serta penetapan kandungan fenolik total pada kulit jeruk
nipis ini.
3. Manfaat penelitian
a. Manfaat teoritis. Hasil dari penelitian ini diharapkan dapat memberikan
tambahan pengetahuan mengenai aktivitas antioksidan pada ekstrak kulit
jeruk nipis.
b. Manfaat metodologis. Hasil penelitian ini dapat dijadikan acuan metode
untuk uji aktivitas antioksidan menggunakan radikal bebas DPPH dan
penentuan kandungan fenolik total pada tumbuhan.
c. Manfaat praktis. Hasil penelitian ini diharapkan dapat memberikan informasi
bagi penelitian lebih lanjut maupun masyarakat luas mengenai potensi ekstrak
kulit jeruk nipis sebagai salah satu sumber antioksidan alami.
B. Tujuan Penelitian 1. Khusus
a. Mengetahui kadar kandungan fenolik total fraksi etil asetat ekstrak kulit jeruk
nipis yang dinyatakan dengan massa ekivalen asam galat.
b. Mengetahui nilai aktivitas antioksidan fraksi etil asetat ekstrak etanol kulit
jeruk nipis menggunakan radikal DPPH (1,1-diphenyl-2-picrylhydrazyl) yang
2. Umum
Memberi informasi tambahan baru tentang antioksidan alami pada kulit
jeruk nipis dan ikut berpartisipasi dalam memberi sumbangsih dalam dunia
6
BAB II
PENELAAHAN PUSTAKA
A. Jeruk Nipis
1. Keterangan botani
Jeruk nipis ini memiliki klasifikasi ilmiah sebagai berikut.
Kingdom : Plantae
Subkingdom : Tracheobionta
Superdivision : Spermatophyta
Division : Magnoliophyta
Class : Magnoliopsida
Subclass : Rosidae
Order : Sapindales
Family : Rutaceae
Genus : Citrus
Species : Citrus aurantifolia (Christm.) Swingle
Jeruk nipis memiliki beberapa nama umum, seperti jeruk nipis / jeruk
pecel (Indonesia), dayap (Philipina), manao (Thailand).
(United States Department of Agriculture, 2013)
2. Morfologi tanaman
Jeruk nipis termasuk salah satu jenis Citrus. Jeruk nipis termasuk jenis
tumbuhan perdu yang banyak memiliki dahan dan ranting. Tingginya sekitar
luarnya berwarna tua dan kusam. Daunnya majemuk, berbentuk ellips dengan
pangkal membulat, ujung tumpul, dan tepi beringgit. Panjang daunya mencapai
2,5-9 cm dan lebarnya 2-5 cm, sedangkan tulang daunnya menyirip dengan
tangkai bersayap, hijau dan lebar 5-25 mm. Bunganya berukuran
majemuk/tunggal yang tumbuh di ketiak daun atau di ujung batang dengan
diameter 1,5-2,5 cm. Kelopak bunga berbentuk seperti mangkok berbagi 4-5
dengan diameter 0,4-0,7 cm berwama putih kekuningan dan tangkai putik silindris
putih kekuningan. Daun mahkota berjumlah 4-5, berbentuk bulat telur atau lanset
dengan panjang 0,7-1,25 cm dan lebar 0,25-0,5 cm berwarna putih (Anonima,
2013)
Tanaman jeruk nipis pada umur 2 1/2 tahun sudah mulai berbuah.
Buahnya berbentuk bulat sebesar bola pingpong dengan diameter 3,5-5 cm
berwarna (kulit luar) hijau atau kekuning-kuningan. Tanaman jeruk nipis
mempunyai akar tunggang. Buah jeruk nipis yang sudah tua rasanya asam
(Anonima, 2013).
3. Kandungan kimia
Genus Citrus kaya akan sumber senyawa, seperti minyak atsiri, steroid,
limonoid, flavonoid, kumarin dan pektin (Tripoli, 2007). Berdasarkan penelitian
yang pernah dilakukan, kandungan kimia yang terdapat pada ekstrak kulit jeruk
nipis antara lain karbohidrat, asam amino, flavonoid, seperti rutin, hesperidin,
myrecetin, senyawa kumarin, seperti psoralene, bergapten, isopimpinellin,
bergapten, isopimpinellin, imperatorin, isobergapten, kaempferol, myricetin, rutin,
β-sitosterol (Shalaby, 2011).
4. Manfaat tanaman
Jeruk nipis ini sering digunakan masyarakat, baik untuk kesehatan maupun
kecantikan, antara lain digunakan sebagai obat batuk, mengobati sembelit,
ambeien, suara serak, menambah nafsu makan, mencegah rambut rontok,
ketombe, amandel dan juga mimisan (Nala, 2003).
Selain itu Citrus aurantifolia memiliki manfaat lain, seperti ekstrak kulit
dan daun dari kulit jeruk nipis bermanfaat sebagai antifungal karena adanya
kandungan senyawa alkaloid dan fenolik yang tinggi (Okwu, Awurum, dan
Okoronkwo, 2007).
B. Radikal Bebas
Radikal bebas adalah suatu atom atau molekul yang sangat reaktif dengan
elektron yang tidak memiliki pasangan. Radikal bebas mencari reaksi-reaksi agar
dapat memperoleh kembali elektron pasangannya. Setelah itu radikal bebas dapat
mengalami tubrukan dengan molekul lain dan merusak ikatan di dalam molekul
tersebut. Pada akhirnya radikal dapat merusak membran sel, retikulum
endoplasma, atau DNA sel yang rentan (Corwin, 2009).
Senyawa radikal sangat aktif menyerang molekul penting yang berada di
sekelilingnya, baik itu senyawa lipid, protein, lipoprotein, maupun karbohidrat.
Meskipun demikian, keberadaan radikal bebas juga bermanfaat bagi tubuh,
dinding sel, detoksifikasi bahan kimia xenobiotik, dan sistem pertahanan tubuh
terhadap patogen. Oleh karena itu, perlu dikontrol dan diatur potensi radikal bebas
tersebut (Winarsi, 2007). Radikal dapat terbentuk secara endogen (terbentuk
dalam tubuh melalui proses metabolisme normal) dan juga secara eksogen
(berasal dari bahan pencemar yang masuk ke tubuh) (Subeki, 1998).
Secara umum, tahapan reaksi pembentukan radikal bebas mirip dengan
rancidity oxidative, yaitu melalui 3 tahapan reaksi berikut.
1. Tahap inisiasi, yaitu awal pembentukan radikal bebas, misalnya :
Fe2+ + H2O2 Fe3+ + OH-+ •OH (1)
R1-H + •OH R1• + H2O (2)
2. Tahap propagasi, yaitu pemanjangan rantai radikal
R2-H + R1• R2• + R1-H (3)
R3-H + R2• R3• + R2-H (4)
3. Tahap terminasi, yaitu bereaksinya senyawa radikal dengan radikal lain
atau dengan penangkap radikal, sehingga potensi propagasinya rendah.
R1• + R1• R1-R1 (5)
R2• + R1• R2-R1 (6)
R2• + R2• R2-R2 dst (7)
C. Senyawa Antioksidan
Antioksidan biasa didefinisikan sebagai suatu senyawa yang mampu
memperlambat, menunda bahkan menghambat reaksi oksidasi dan memegang
peranan penting dalam sistem pertahanan tubuh terhadap adanya radikal bebas
yang sangat berbahaya, di mana radikal bebas telah diketahui dapat menginduksi
penyakit kanker, arteriosklerosis dan penuaan disebabkan oleh kerusakan jaringan
(Triana, 2010). Antioksidan merupakan senyawa pemberi elektron (electron
donor) atau reduktan. Senyawa ini memiliki berat molekul kecil, tetapi mampu
menginaktivasi berkembangnya reaksi oksidasi, dengan cara mencegah
terbentuknya radikal. Antioksidan mampu menghambat reaksi oksidasi dengan
mengikat radikal bebas dan molekul yang sangat reaktif sehingga dapat
menghambat kerusakan sel (Winarsi, 2007).
Fungsi antoksidan adalah menetralisasi radikal bebas, sehingga tubuh
terlindungi dari berbagai macam penyakit degeneratif dan kanker. Fungsi lain
antioksidan adalah membantu menekan proses penuaan / antiaging. Para ahli
menemukan bahwa di antara semua makhluk hidup yang ada di dunia, kadar
antioksidan manusia tercatat yang paling tinggi. Antioksidan merupakan zat yang
mampu menetralisasi radikal bebas, sehingga atom danelektron yang tidak
berpasangan mendapat pasangan dan menjadi tidak reaktif lagi atau stabil.
Radikal bebas sendiri merupakan atom atau molekul yang sifatnya sangat tidak
stabil. Ketidakstabilan ini disebabkan atom tersebut memiliki satu atau lebih
Antioksidan dapat dibagi ke dalam dua golongan, yaitu chain breaking
antioxidant dan preventative antioxidant. Mekanisme chain breaking :
L● + AH → LH + A● (8)
LO●+ AH → LOH + A● (9)
LOO●+ AH → LOOH + A● (10)
Dengan demikian, tahap inisiasi dan propagasi pada senyawa radikal dihambat.
Di sisi lain, preventative antioksidan memperlambat laju oksidasi, misalnya
transisi-metal ion pengkhelat mampu menghambat reaksi Fenton yang
menghasilkan radikal hidroksil. Adapun reaksi fenton adalah sebagai berikut.
Fe2+ + H2O2→ Fe3+ + ●OH + OH- (11)
(Resat Apak, Shela Gorinstein, Volker Bohm, Karen M. Schaich, Mustafa
Ozyurek, dan Kubilay Guclu, 2013)
Untuk mendeterminasi akitivitas antioksidan secara in vitro, metode yang paling
umum digunakan antara lain :
1. HAT (Hydrogen Atom Transfer)based assay
HAT-based assay mengukur kapabilitas antioksidan dalam menghambat
radikal dengan adanya donasi atom H. Mekanisme HAT dari aksi
antioksidan ini dengan mentransfer atom hidrogen (H) pada phenol
(Ar-OH) ke radikal ROO●.
2. ET (Electron Transfer) based assay
Pada ET-based assay, antioksidan bereaksi dengan senyawa fluoresens
kapasitas antioksidan dari reduksi senyawa oksidan, yang menyebabkan
perubahan warna. Derajat perubahan warna memiliki korelasi dengan
konsentrasi antioksidan dalam sampel (Resatet al., 2013)
D. Fenolik dan Flavonoid
Fenol merupakan produk alami senyawa aromatik yang paling banyak
terdapat pada tumbuhan. Sangat banyak senyawa yang masuk dalam kategori
fenol, seperti fenol sederhana, fenol eter, phenylpropanoids, flavonoid, tannin
(Kauffman, Cseke, Weber, Duke, dan Brielmann, 1999). Flavonoid merupakan
bahan antioksidan yang mampu menetralisir oksigen reaktif dan berkontribusi
terhadap pencegahan penyakit kronis, seperti kanker. Flavonoid utama dalam
jeruk ialah naringin, narirutin, dan hesperidin (Tripoli et al., 2007), sedangkan
kandungan flavonoid utama pada kulit jeruk nipis adalah rutin, hesperidin, dan
myrecetin (Shalaby et al., 2011)
E. Penyarian
Penyarian adalah kegiatan penarikan zat yang dapat larut dari bahan yang
tidak dapat larut dengan pelarut cair. Sebagai cairan penyari digunakan air, eter,
atau campuran etanol air. Penyarian dengan etanol dan air dilakukan dengan
maserasi atau perkolasi (Anonim, 1986).
1. Infundasi
Infundasi adalah proses penyarian yang umumnya digunakan untuk
menyari zat kandungan aktif yang larut dalam air dari bahan-bahan nabati. Sari
yang dihasilkan tidak stabil dan mudah tercemari oleh kapang dan kuman. Oleh
karena itu, sari yang diperoleh dengan cara ini tidak boleh disimpan lebih dari 24
jam. Infundasi dibuat dengan cara menyari simpilisia pada suhu 90oC selama 15
menit (Anonim, 1986).
2. Maserasi
Maserasi dilakukan dengan cara merendam serbuk simplisia dalam cairan
penyari sehingga cairan penyari akan menembus dinding sel yang mengandung
zat aktif di dalam sel dengan yang di luar sel mengakibatkan pendesakan larutan
terpekat dari dalam sel ke luar sel. Peristiwa tersebut berulang sehingga terjadi
keseimbangan konsentrasi antara di luar sel dan di dalam sel (Anonim, 1986).
3. Perkolasi
Cara penyarian yang dilakukan dengan mengalirkan cairan penyari melalui
serbuk simplisia yang telah terbasahi. Cairan penyari akan mengalir dari atas ke
bawah melalui serbuk simplisia kemudian cairan akan melarutkan zat aktif di
dalam sel yang dilalui sampai mencapai keadaan jenuh. Serbuk simplisia yang
akan diperkolasi dibasahi terlebih dahulu dengan cairan penyari kemudian
4. Penyarian berkesinambungan
Penyarian berkesinambungan merupakan gabungan antara proses untuk
menghasilkan ekstrak cair dan proses penguapan. Alat yang digunakan, misalnya
soxhlet. Pada penyarian ini, cairan dipanaskan hingga mendidih, kemudian uap
penyari akan naik ke atas kemudian akan mengembun karena didinginkan oleh
pendingin balik. Embun akan turun melalui serbuk simplisia sambil melarutkan
zat aktif serbuk simplisia (Anonim, 1986).
F. Metode DPPH
DPPH (1,1-diphenyl-2-picrylhydrazyl) merupakan senyawa radikal
nitrogen yang stabil, berwarna ungu, dan pada awalnya digunakan sebagai reagen
kolorimetri. Karakter dari DPPH diantaranya, DPPH merupakan senyawa
hidrofobik (tidak larut air), namun dapat berubah menjadi hidrofilik dengan
melekatkan gugus CO maupun SO2 pada DPPH. DPPH merupakan senyawa
radikal bebas yang stabil (Ionita, 2003).
Prinsip metode uji antioksidan DPPH didasarkan pada reaksi penangkapan
atom hidrogen oleh DPPH (reduksi DPPH) dari senyawa antioksidan. Reagen
DPPH berperan sebagai radikal bebas yang diredam oleh senyawa antioksidan
yang terkandung dalam sampel. Selanjutnya DPPH akan tereduksi menjadi
senyawa diphenylpicrylhidrazine (DPPH-H). Reduksi DPPH menjadi DPPH-H
menyebabkan perubahan warna pada reagen DPPH, dari ungu menjadi kuning
molekul pendonor atom hidrogen, maka terjadi reaksi penangkapan atom hidrogen
molekul AH olah radikal Z dengan reaksi umumnya sebagai berikut.
Z• + AH = ZH + A●
ZH merupakan bentuk tereduksi dari radikal DPPH dan A• adalah radikal bebas
yang terbentuk dari reaksi pertama tersebut (Molyneux, 2004).
Gambar 1. Perubahan warna larutan pada reaksi DPPH dengan senyawa antioksidan (Witt, Lalk, Hager, dan Voigt, 2010)
Metode DPPH dapat memberikan informasi mengenai respon aktivitas
senyawa yang diuji dengan suatu radikal bebas. Pengukuran serapan DPPH
berkisar pada panjang gelombang 515-520 nm. Metode DPPH dapat digunakan
untuk sampel padatan maupun larutan, dan tidak spesifik untuk komponen
antioksidan partikular, tetapi dapat digunakan untuk pengukuran kapasitas
Persentase DPPH yang tersisa dapat dihitung dengan rumus :
% DPPHsisa = 100 x
Persentase DPPH yang tersisa proporsional dengan konsentrasi antioksidan dan
konsentrasi yang menyebabkan penurunan konsentrasi DPPH awal hingga 50 %.
Keuntungan dari metode ini antara lain mudah, cepat, dan hanya memerlukan alat
UV-vis spektrofotometer untuk melakukan pengukuran (Prior, 2005).
G. Spektrofotometer Visibel
Spektrofotometri UV-VIS adalah salah satu teknik analisis fisika kimia
yang mengamati tentang interaksi atom/molekul dengan radiasi elektromagnetik
pada panjang gelombang 190-380 nm untuk ultraviolet dan 380-780 nm untuk
sinar tampak dengan memakai instrumen spektrofotometer. Prinsip kerja
spektrofotometri adalah berdasarkan atas interaksi antara radiasi elektromagnetik
(salah satu jenis energi yang ditransmisikan dalam ruang dengan kecepatan tinggi)
dengan materi (atom, ion/molekul) (Mulja dan Suharman, 1995).
Kelebihan alat, seperti cepat, simpel, dan sensitive telah membuat
spektrofotometer UV-VIS menjadi suatu metode analisis farmasetika yang sangat
popular untuk pengukuran secara kuantitatif obat dan metabolit dalam sampel
biologi. Identifikasi kualitatif dari obat atau metabolit menggunakan
spektrofotometri UV –VIS berdasarkan pada panjang gelombang maksimum yang
diabsorpsi (max). Pada absorpsi yang maksimum, sensitivitas optimum akan
gelombang, error diminimalkan. Hasilnya akurasi dan presisi yang baik
didapatkan (Mulja dkk, 1995).
Komponen-komponen pokok dari spektrofotometer meliputi : sumber
tenaga radiasi yang stabil, sistem yang terdiri atas lensa-lensa, cermin,
celah-celah, dan lain-lain, monokromator untuk mengubah radiasi, tempat cuplikan yang
transparan, dan detektor radiasi yang dihubungkan dengan sistem meter atau
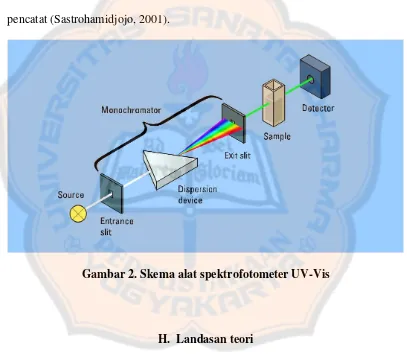
pencatat (Sastrohamidjojo, 2001).
Gambar 2. Skema alat spektrofotometer UV-Vis
H. Landasan teori
Antioksidan didefinisikan sebagai suatu senyawa yang mampu
memperlambat, menunda bahkan menghambat reaksi oksidasi dan memegang
peranan penting dalam sistem pertahanan tubuh terhadap adanya radikal bebas
(Triana, 2010). Flavonoid merupakan bahan antioksidan yang mampu menetralisir
hesperidin yang terdapat dalam kulit buah dan biji. Untuk mengetahui aktivitas
antioksidan pada kulit jeruk nipis, maka digunakan radikal bebas DPPH. Prinsip
metode uji antioksidan DPPH didasarkan pada reaksi penangkapan atom hidrogen
oleh DPPH (reduksi DPPH) dari senyawa antioksidan yang menyebabkan
perubahan warna ungu larutan DPPH menjadi berwarna kuning. Reagen DPPH
berperan sebagai radikal bebas yang dinetralisir oleh senyawa antioksidan yang
terkandung dalam sampel (Molyneux, 2004). Besarnya aktivitas antioksidan
dinyatakan dengan IC50. Adanya aktivitas antioksidan dalam senyawa uji
berhubungan juga dengan kadar fenolik totalnya, maka besarnya fenolik total
ditentukan dengan metode Folin-Ciocalteu. Senyawa fenolik akan bereaksi
dengan pereaksi Folin-Ciocalteu dan membentuk kompleks fosfotungstat
fosfomolibdat berwarna biru, dimana intensitas warna yang dihasilkan sebanding
dengan ion fenolat sampel.
I. Hipotesis
Berdasarkan uraian di atas, dapat diperoleh hipotesis bahwa fraksi etil
asetat ekstrak etanol kulit jeruk nipis memiliki daya antioksidan yang ditetapkan
dengan metode DPPH dan kandungan fenolik total dapat ditentukan dengan
19
BAB III
METODOLOGI PENELITIAN
A. Jenis dan rancangan penelitian
Penelitian ini termasuk penelitian eksperimental dengan tahapan penelitian
sebagai berikut :
a. Pemilihan dan pengumpulan sampel
b. Pembuatan simplisia
c. Ekstraksi dan fraksinasi
d. Penetapan aktivitas antioksidan
e. Penetapan kandungan fenolik total dalam ekstrak kulit jeruk nipis
B. Variabel penelitian
1. Variabel bebas
Variabel bebas pada penelitian ini adalah konsentrasi ekstrak etanol kulit
jeruk nipis (Citrus aurantifolia (Christm.) Swingle).
2. Variabel tergantung
Variabel tergantung pada penelitian ini adalah aktivitas antioksidan (% IC),
kadungan fenolik total fraksi etil asetat ekstrak etanol jeruk nipis.
3. Variabel pengacau terkendali
Variabel pengacau terkendali pada penelitian ini adalah tempat tumbuh
tanaman, umur tanaman saat dipanen, cara pengeringan, dan pembuatan
4. Variabel pengacau tak terkendali
Variabel pengacau tak terkendali pada penelitian ini adalah cuaca atau
musim, curah hujan, hama dan wabah penyakit pada tanaman
C. Definisi Operasional
1. Ekstrak kulit jeruk nipis adalah ekstrak kental yang diperoleh dari hasil
maserasi serbuk simplisia dengan etanol.
2. Fraksi etil asetat, yaitu hasil fraksi ekstrak etanol kulit jeruk nipis
menggunakan etil asetat yang telah difraksinasi dengan wash bensin dan air.
D. Bahan dan Alat Penelitian 1. Bahan penelitian
Bahan yang digunakan dalam penelitian ini adalah serbuk sampel kulit
jeruk nipis, etanol, wash bensin, aquadest, etil asetat, DPPH p.a (Sigma Aldrich),
metanol p.a, rutin, natrium karbonat, asam galat, dan reagen Folin-Ciocalteu.
2. Alat penelitian
Alat yang digunakan dalam penelitian, yaitu spektrofotometer
UV-Visibel Shimadzu UV 1240 mini (Laboratorium Kimia Analisis Instrumental
USD), alat-alat gelas, corong pisah, corong buchner, neraca analitik, vortex,
E. Tata Cara Penelitian 1. Determinasi tanaman
Determinasi tanaman jeruk nipis dilakukan di Laboratorium
Farmakognosi-Fitokimia, Fakultas Farmasi Universitas Sanata Dharma.
2. Pemilihan dan pengumpulan bahan
Pengumpulan sampel jeruk nipis diambil langsung di perkebunan yang
berlokasi di Purwokerto, Jawa Tengah, dengan memilih jeruk dengan usia
tertentu yang merupakan usia konsumsi dari buah jeruk tersebut. Jeruk nipis
dipilih dan dipilah yang memiliki kondisi paling baik kemudian dikupas dan
diambil kulitnya sebagai sampel yang akan dipreparasi dan diuji.
3. Preparasi simplisia
Kulit jeruk nipis dicuci bersih, ditiriskan dan diiris tipis. Kemudian
dikeringkan dalam oven pada suhu 50-55o C selama 24 jam. Simplisia kering
ditandai dengan kulit jeruk yang telah menjadi rapuh. Kemudian kulit jeruk
kering diserbuk kasar dengan menggunakan mesin penyerbuk dan dilewatkan
ayakan dengan nomor mesh 40.
4. Ekstraksi simplisia
Sebanyak 10 g serbuk simplisia kulit jeruk nipis dimasukkan ke dalam
bejana maserasi, ditambah dengan 100 ml etanol 70 % sampai terendam
selama tiga hari. Filtrat diperoleh melalui penyaringan menggunakan kertas
saring kasar dengan bantuan corong Buchner dan pompa vakum. Ampas
penyaringan diremaserasi dengan 100 ml etanol 70 % kembali selama tiga hari.
Kemudian filtrat dicampur dengan filtrat terdahulu. Keseluruhan filtrat diuapkan
pelarutnya dengan vacuum rotary evaporator sehingga diperoleh ekstrak etanol
kental kulit jeruk nipis.
5. Fraksinasi
Ekstrak etanol kental kulit jeruk nipis dilarutkan dalam 100 ml air hangat
dan dilakukan ekstraksi cair-cair menggunakan wash bensin dengan
perbandingan larutan ekstrak : wash bensin (1:1 v/v), sehingga dihasilkan fraksi
air dan wash bensin. Fraksi yang diambil yaitu fraksi air untuk kemudian
diekstraksi kembali menggunakan etil asetat (1:1 v/v), sehingga didapatkan
fraksi air dan fraksi etil asetat. Ambil fraksi etil asetat. Kemudian fraksi etil
asetat diuapkan dengan vacuum rotary evaporator sehingga didapatkan ekstrak
etil asetat kental dan dioven sampai didapatkan bobot tetap. Ekstrak ini yang
digunakan untuk analisis selanjutnya.
6. Pembuatan larutan pembanding, baku, dan uji
a. Pembuatan larutan uji
Sejumlah 25,0 mg fraksi etil asetat ditimbang dan ditambah metanol p.a
sampai 25,0 mL, sehingga didapat larutan sampel dengan konsentrasi 1000
metanol p.a hingga volume 10,0 mL, sehingga di dapat konsentrasi 200; 325;
450; 575; 700 μg/mL.
b. Pembuatan larutan baku asam galat
Sejumlah 10,0 mg asam galat ditimbang dan ditambah pelarut metanol
p.a : air (1:1 v/v) sampai 10,0 mL, sehingga didapat larutan stok asam galat
dengan konsentrasi 1000 µg/ml dalam metanol p.a : air (1:1). Ambil sebanyak
0,5; 0,75; 1,0; 1,25; dan 1,5 ml larutan stok tersebut, kemudian tambahkan
metanol p.a : air (1:1) sampai 10 ml dan diperoleh seri baku asam galat dengan
konsentrasi 50; 75; 100; 125; 150 µg/ml.
c. Pembuatan larutan pembanding rutin
Dibuat larutan stok dengan menimbang sebanyak 2,5 mg rutin dan
dilarutkan dengan metanol p.a sampai 10 mL. Kemudian pipet sebanyak 0,49;
0,77; 1,05; 1,33; 1,61 ml stok, lalu ditambahkan metanol p.a, sehingga diperoleh
larutan rutin dengan konsentrasi 12,25; 19,25; 26,25; 33,25; 40,25 µg/mL.
d. Pembuatan larutan DPPH
Sejumlah 3,9 mg DPPH dilarutkan ke dalam metanol p.a sampai 25 ml,
sehingga diperoleh larutan DPPH dengan konsentrasi 0.4 mM. Larutan ditutup
dengan aluminium foil dan harus selalu dibuat baru.
7. Uji pendahuluan
a. Uji fenolik total
Sebanyak 0,5 ml larutan uji dan larutan pembanding asam galat
dengan 5 ml reagen Folin-Ciocalteu yang telah diencerkan dengan air (1:10 v/v).
Selanjutnya larutan tersebut ditambah dengan 4,0 ml natrium karbonat 1 M.
Vortex selama 15 detik. Amati perubahan warna yang terjadi.
b. Uji aktivitas antioksidan
Sebanyak 1 ml larutan pembanding rutin dan larutan uji masing-masing
ditambahkan 1 ml larutan DPPH dimasukkan ke dalam tabung reaksi. Kemudian
ditambahkan dengan 3 ml metanol p.a dan vortex selama 30 detik. Tunggu
selama 30 menit, amati perubahan warna yang terjadi.
8. Uji aktivitas antioksidan
a. Optimasi metode uji aktivitas antioksidan
1) Penentuan panjang gelombang maksimum
Larutan DPPH dengan volume masing-masing 1,0; 2,0; 3,0 mL
dimasukkan ke dalam 3 buah labu ukur 10 mL dan tambahkan metanol
p.a hingga tanda batas. Larutan tersebut kemudian divortex selama 30
detik. Diamkan selama OT. Lalu dilakukan scanning panjang gelombang
serapan maksimum dengan spektrofotometer visibel pada panjang
gelombang 400-600 nm
2) Penentuan operating time (OT)
Larutan DPPH sebanyak 2 mL dimasukkan ke dalam
masing-masing tiga labu ukur 10 mL dan tambahkan masing-masing-masing-masing dengan 2
mL larutan pembanding rutin 12,5; 26,25 dan 40,25 μg/mL. Selanjutnya
vortex selama 30 detik. Setelah itu baca absorbansinya dengan
spektrofotometer visibel pada panjang gelombang maksimum yang
didapat selama satu jam (cek setiap 5 menit). Demikian juga untuk
larutan uji 200; 450 dan 700 μg/mL diberi perlakuan yang sama..
b. Pengukuran absorbansi larutan DPPH (kontrol)
Sebanyak 2 mL larutan DPPH dimasukkan ke dalam labu ukur 10 mL
dan tambahkan larutan tersebut dengan metanol p.a hingga tanda batas.
Kemudian baca absorbansi larutan pada saat OT danpanjang gelombang
maksimum. Lakukan pengerjaan sebanyak tiga kali replikasi. Larutan ini
digunakan sebagai kontrol untuk menguji larutan pembanding rutin dan sampel.
c. Pengukuran absorbansi larutan pembanding dan uji
Sebanyak 2 mL larutan DPPH dimasukkan ke dalam labu takar 10 ml
kemudian tambahkan dengan 2 mL larutan pembanding dan uji pada berbagai
seri konsentrasi telah dibuat. Kemudian larutan tersebut ditambah dengan
metanol p.a hingga tanda batas. Vortex larutan tersebut selama 90 detik dan
diamkan selama OT. Larutan dibaca absorbansinya dengan spektrofotometer
visibel pada panjang gelombang maksimum hasil optimasi. Pengujian dilakukan
sebanyak tiga kali replikasi.
d. Validasi metode uji aktivitas antioksidan
Validasi dilakukan dengan menghitung nilai presisi (% CV) spesifisitas
dan linearitas (r) dari posedur 8 b dan c.
e. Estimasi aktivitas antioksidan
Hasil dari pengukuran absorbansi pada prosedur 8 a dan b dihitung nilai
% IC dan IC50 untuk rutin dan fraksi etil asetat ekstrak etanol kulit jeruk nipis.
9. Penetapan kandungan fenolik total
a. Optimasi metode penetapan kandungan fenolik total
1) Penentuan operating time (OT)
Sebanyak 0,5 mL larutan asam galat 50; 100 dan 150 μg/mL
ditambahkan dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan
dengan air (1:10 v/v). Selanjutnya ditambahkan dengan 4,0 mL natrium
karbonat 1 M dan diamkan selama satu jam (cek setiap lima menit).
Setelah itu baca absorbansi larutan dengan spektrofotometer visibel pada
panjang gelombang teoritis 750 nm.
2) Penentuan panjang gelombang maksimum
Sebanyak 0,5 mL larutan asam galat 50; 100 dan 150 μg/mL
ditambahkan dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan
dengan air (1:10 v/v). Selanjutnya ditambahkan dengan 4,0 mL natrium
karbonat 1 M, vorteks selama 30 detik dan diamkan selama OT. Setelah
itu baca absorbansi larutan dengan spektrofotometer visibel pada panjang
gelombang 600-800 nm.
b. Pembuatan kurva baku asam galat
Sebanyak 0,5 ml larutan asam galat dengan seri konsentrasi 50; 75; 100;
diencerkan dengan air (1:10 v/v). Larutan selanjutnya ditambah dengan 4,0 ml
natrium karbonat 1 M. Larutan divortex selama 30 detik. Kemudian diamkan
selama OT. Setelah itu baca absorbansi larutan pada panjang gelombang
maksimum yang didapat terhadap blangko yang terdiri dari air : metanol (1:1),
reagen Folin-ciocalteu, dan larutan natrium karbonat 1 M.
c. Validasi metode penetapan kandungan fenolik total
Validasi dilakukan dengan menghitung nilai presisi (% CV) spesifisitas
dan linearitas (r) dari posedur 9 b.
d. Estimasi kandungan fenolik total larutan uji
Sebanyak 0,5 ml larutan uji dengan konsentrasi 575 µg/ml ditambahkan
dengan 5 ml reagen Folin-Ciocalteu yang telah diencerkan dengan air (1:10 v/v).
Larutan selanjutnya ditambahkan dengan 4,0 ml natrium karbonat 1 M. Larutan
divortex selama 30 detik. Kemudian diamkan selama OT. Setelah itu baca
absorbansi larutan pada panjang gelombang maksimum (750 nm). Kandungan
fenolik total dinyatakan sebagai gram ekivalen asam galat (mg ekivalen asam
28
BAB IV
HASIL DAN PEMBAHASAN
A. Determinasi tanaman
Penelitian ini diawali dengan melakukan determinasi pada tanaman uji.
Determinasi tanaman perlu dilakukan dengan tujuan untuk mengetahui dan
memastikan kebenaran identitas tanaman digunakan dalam penelitian ini. Oleh
sebab itu, determinasi merupakan langkah awal terpenting pada penelitian ini.
Hasil determinasi menunjukkan bahwa tanaman ini adalah tanaman jeruk nipis
(Citrus aurantifolia (Christm.) Swingle).
B. Pengumpulan Bahan
Buah jeruk nipis yang digunakan dalam penelitian ini diperoleh dari
perkebunan yang berlokasi di Purwokerto, Jawa Tengah. Buah jeruk diambil dari
perkebunan dengan tujuan agar tempat tumbuh tanaman sama. Dengan tempat
tumbuh yang sama diharapkan kandungan kimia yang terdapat dalam kulit jeruk
nipis tidak jauh berbeda antara buah yang satu dengan yang lainnya. Buah yang
dipilih adalah buah yang siap dipanen.
C. Preparasi Sampel
Buah jeruk nipis yang telah dipanen, dikupas dan diambil kulitnya.
Kemudian dilanjutkan dengan pencucian yang bertujuan untuk menghilangkan
kemudian dioven pada suhu 50oC selama 24 jam sampai cukup kering untuk
diserbuk. Pada penelitian ini, yang diteliti adalah kulit jeruk nipis tanpa minyak
atsiri yang terkandung dalam kulit tersebut, sehingga metode pengeringan dengan
menggunakan panas (oven) yang dapat menghilangkan kandungan minyak atsiri
pada kulit jeruk nipis tidak menjadi masalah. Kulit yang telah kering dan rapuh
dihaluskan dengan mesin penyerbuk. Tujuan dari penyerbukan ini adalah untuk
memperkecil ukuran permukaan sampel uji sehingga luas kontak antara sampel
dan penyari akan semakin besar dan proses penyarian akan lebih optimum.
Kemudian serbuk kulit jeruk dilewatkan ayakan dengan no.mesh 40 agar ukuran
partikel serbuk homogen.
D. Ekstraksi Sampel
Ekstraksi yang dipilih untuk penelitian ini adalah maserasi. Metode
maserasi memiliki beberapa kelebihan di antara metode ekstraksi lainnya. Selain
dapat menjaga stabilitas senyawa fenolik yang terekstraksi dari sampel, metode
ini juga menguntungkan karena sederhana dan mudah dilakukan. Proses maserasi
dilakukan dengan melarutkan sampel ke dalam cairan penyari. Larutan penyari
yang digunakan yaitu etanol 70 %. Cairan penyari etanol 70% ini dipilih karena
senyawa-senyawa flavonoid mudah larut di dalam pelarut metanol maupun etanol
yang mengandung air 20-50 % (Bruneton, 1999) dan proses maserasi ini dibantu
dengan alat shaker. Penggunaan shaker pada proses maserasi bertujuan untuk
membantu agar hasil ekstraksi lebih maksimal dan efektif. Adanya bantuan
berpenetrasi ke dalam sel-sel tanaman. Proses maserasi ini dilakukan selama tiga
hari. Selanjutnya cairan penyari dipisahkan dari ampas serbuk kulit jeruk dengan
disaring. Penyaringan ini menggunakan corong Buchner yang dilapisi kertas
saring dan dibantu dengan pompa vakum. Pompa vakum digunakan untuk
membantu mempercepat proses penyaringan. Ampas hasil penyarian kemudian
diremaserasi lagi dengan menambahkan penyari etanol yang baru dengan volume
yang sama selama tiga hari seperti sebelumnya. Dan hasil remaserasi dipisahkan
dengan penyarinya dengan disaring menggunakan corong Buchner. Tujuan dari
remaserasi ini yaitu untuk menyari senyawa-senyawa yang mungkin belum
sempat terekstraksi karena penyari yang sudah jenuh.
Hasil maserasi dan remaserasi digabung menjadi satu dan diuapkan
pelarutnya menggunakan vacuum rotary evaporator. Prinsip dari alat ini yaitu
penguapan dengan penurunan tekanan. Jika tekanan uap suatu cairan sama dengan
tekanan atmosfer, maka cairan akan mendidih dan menguap pada titik didih
normalnya. Oleh sebab itu, dengan adanya vakum akan menurunkan tekanan pada
alat di bawah tekanan atmosfer sehingga menyebabkan suatu cairan mendidih di
bawah titik didih normalnya. Penguapan pelarut dengan menggunakan rotary
evaporator direkomendasikan untuk residu yang tidak tahan panas karena
temperatur pada penangas air pada rotary evaporator lebih rendah jika dibanding
pada penangas air biasa (Patiram, Brajendra Azad Thakur dan Ramesh, 2007).
Setelah itu, proses penguapan pelarut ini dilanjutkan dengan menggunakan oven
pada suhu 50oC untuk menghilangkan sisa-sisa penyari sampai diperoleh ekstrak
Ekstrak etanol kulit jeruk yang didapat kemudian dilarutkan dalam air
hangat karena ekstrak sulit untuk dilarutkan dalam air dingin. Ekstrak yang telah
larut kemudian diektraksi cair-cair dengan wash bensin dengan perbandingan
wash bensin : air (1:1 v/v) menggunakan corong pisah. Ekstraksi cair-cair
digunakan sebagai cara untuk praperlakuan sampel atau clean-up sampel untuk
memisahkan analit dari komponen-komponen matriks yang mungkin mengganggu
pada saat kuantifikasi atau deteksi analit (Gandjar, 2007). Prinsip dari ekstraksi
cair-cair merupakan pemisahan dua atau lebih senyawa yang saling campur
berdasarkan perbedaan polaritas dengan menggunakan dua pelarut yang memiliki
perbedaan polaritas yang tidak saling campur. Analit-analit yang mudah
terekstraksi ke pelarut organik adalah molekul-molekul netral yang bersifat
non-polar atau agak non-polar. Sementara itu, senyawa non-polar dan juga senyawa-senyawa
yang mudah mengalami ionisasi akan tertahan dalam fase air. Pada partisi ini,
fraksi air akan berada di bagian bawah dan wash bensin di atas. Hal ini
dikarenakan bobot jenis air (0,996 g/ml) lebih besar jika dibandingkan dengan
wash bensin (0,730 g/ml). Bagian yang polar seperti polifenol dan flavonoid akan
terlarut ke dalam air, sedangkan bagian non polar seperti klorofil dan lipid akan
terlarut ke dalam wash bensin. Proses ekstraksi ini dilakukan berulang sampai tiga
kali sampai pelarut wash bensin menjadi bening yang menandakan bahwa tidak
ada lagi senyawa-senyawa yang tidak diinginkan yang terlarut di dalam fraksi air.
Fraksi yang diambil pada partisi ini adalah fraksi air yang mengandung polifenol
senyawa-senyawa yang terlarut bukan merupakan senyawa-senyawa yang ingin diuji dalam
penelitian ini.
Setelah itu, proses partisi dilanjutkan kembali menggunakan pelarut yang
berbeda, yaitu etil asetat yang berbobot jenis 0,898 g/ml dengan perbandingan
volume 1:1 v/v. Pada partisi ini, etil asetat berada di atas karena bobot jenis air
lebih besar (0,996 g/ml) dibandingkan etil asetat. Proses ekstraksi ini juga
dilakukan berulang, yakni tiga kali sampai pelarut etil asetat menjadi bening. Hal
ini menandakan bahwa tidak ada lagi senyawa yang larut dalam pelarut etil asetat.
Pada proses partisi ini, fraksi yang diambil adalah fraksi etil asetat karena
sebagian besar senyawa-senyawa flavonoid larut dalam fraksi etil asetat.
Fraksi etil asetat yang didapat, dievaporasi menggunakan vacuum rotary
evaporator untuk menghilangkan pelarut. Kemudian dioven untuk menguapkan
sisa-sisa etil asetat sampai didapat bobot tetap fraksi etil asetat ekstrak etanolik.
Fraksi etil asetat ini yang akan digunakan untuk uji aktivitas antioksidan dan
ditetapkan kandungan fenolik total yang dinyatakan sebagai ekivalen asam galat.
Berat fraksi etil asetat yang didapat yaitu 245 mg dan disimpan dalam eksikator
untuk menjaga stabilitas senyawa dari pengaruh cahaya maupun kelembaban
lingkungan.
E. Uji Pendahuluan 1. Uji pendahuluan fenolik total
Uji pendahuluan fenolik total ini bertujuan untuk mengetahui adanya
kualitatif. Prinsip dari uji ini adalah reaksi oksidasi-reduksi pada suasana basa.
Penambahan natrium karbonat akan memberikan suasana basa yang akan
mengubah senyawa fenolik menjadi ion fenolat. Ion fenolat yang terbentuk akan
dioksidasi oleh asam fosfomolibdab-fosfotungstat dalam reagen Folin-Ciocalteu
yang menyebabkan larutan berubah menjadi warna biru. Keberadaan senyawa
fenolik dalam sampel positif apabila terjadi perubahan warna pada reagen
Folin-Ciocalteu yang berwarna kuning menjadi biru. Pada uji pendahuluan ini, fraksi
etil asetat ekstrak etanolik kulit jeruk nipis menunjukkan hasil positif dengan
adanya perubahan larutan menjadi berwarna biru, sehingga dapat dikatakan bahwa
mengandung senyawa fenolik.
Gambar 3. Hasil uji pendahuluan fenolik (A = reagen Folin-Ciocalteu + larutan fraksi etil asetat ekstrak etanol kulit jeruk nipis, B = kontrol positif [reagen Ciocalteu + asam galat], C = blanko [reagen
Folin-Ciocalteu + natrium karbonat)
2. Uji pendahuluan aktivitas antioksidan
Uji pendahuluan merupakan langkah awal dalam penentuan aktivitas
antioksidan yang bertujuan untuk mengetahui adanya aktivitas antioksidan dari
fraksi etil asetat ekstrak etanolik kulit jeruk nipis secara kualitatif. Uji ini
dilakukan dengan mereaksikan DPPH 0,4 mM dengan larutan sampel uji yang
dibandingkan dengan kontrol negatif (hanya larutan DPPH) dan kontrol positif
(larutan DPPH yang direaksikan dengan larutan baku pembanding, yaitu rutin).
Apabila senyawa uji memiliki aktivitas antioksidan, ketika direaksikan dengan
DPPH maka radikal DPPH akan menangkap elektron yang menyebabkan
berkurangnya ikatan rangkap konjugasi karena tidak adanya kesempatan elektron
untuk beresonansi. Reaksi ini ditandai dengan adanya perubahan warna larutan
DPPH yang berwarna ungu menjadi kuning. Pada hasil uji pendahuluan (Gambar
4) ini menunjukkan hasil positif untuk larutan rutin yang ditandai dengan
perubahan warna ungu menjadi kuning, sedangkan untuk larutan sampel uji juga
menunjukkan hasil positif dengan ditandai dengan adanya penurunan intensitas
warna ungu. Walaupun tidak terjadi perubahan warna manjadi kuning dan hanya
penurunan intensitas warna, tetap ada kemungkinan aktivitas antioksidan.
Gambar 4. Hasil uji pendahuluan aktivitas antioksidan (A = larutan DPPH + larutan fraksi etil asetat ekstrak etanol kulit jeruk nipis, B =
kontrol negatif [larutan DPPH], C = kontrol positif [larutan DPPH + larutan rutin])
Gambar 5. Hasil uji pendahuluan aktivitas antioksidan (A = larutan fraksi etil asetat ekstrak etanol kulit jeruk nipis + metanol, B = larutan
rutin + metanol)
F. Optimasi Metode Uji Aktivitas Antioksidan 1. Penentuan λmaksmetode uji aktivitas antioksidan
Penentuan panjang gelombang ( λ ) maksimum bertujuan untuk
memperoleh panjang gelombang dimana senyawa uji menghasilkan serapan
maksimum. Beberapa alasan harus menggunakan λ maksimum, yaitu pada λ
maksimum kepekaannya juga maksimum karena pada λ tersebut perubahan
absorbansi untuk setiap satuan konsentrasi adalah paling besar; pada λ maksimal
bentuk kurva absorbansi datar dan pada kondisi tersebut hukum Lambert-Beer
tercapai; dan jika dilakukan pengukuran ulang maka kesalahan yang disebabkan
pemasangan ulang panjang gelombang akan kecil sekali (Gandjar dan Rohman,
2012).
Penentuan λ maksimum ini dilakukan dengan scanning panjang
gelombang serapan maksimum pada 400-600 nm. Dalam penelitian ini yang
diukur adalah absorbansi dari larutan radikal DPPH. DPPH memiliki gugus
kromofor dan auksokrom pada struktur kimianya sehingga mampu memberikan
serapan. Gugus kromofor adalah gugus atau atom dalam senyawa organik yang
mampu menyerap sinar ultraviolet dan juga sinar tampak, sedangkan auksokrom
merupakan gugus fungsional yang mempunyai pasangan elektron bebas. Adanya
gugus auksokrom yang terikat pada gugus kromofor maka akan mengakibatkan
pergeseran pita absorbansi menuju panjang gelombang yang lebih besar (Gandjar,
2012).
Gambar 6. Gugus kromofor dan auksokrom DPPH
Penentuan panjang gelombang serapan maksimum ini dilakukan dengan
scanning pada panjang gelombang 400-600 nm terhadap tiga konsentrasi larutan
absorbansi DPPH saja tanpa gangguan absorbansi senyawa-senyawa lain dari
sampel.
Dari hasil scanning diperoleh panjang gelombang serapan maksimum
DPPH, yaitu 516 nm (lampiran 5). Hasil ini berbeda dengan panjang gelombang
maksimum teoritis DPPH yaitu 517 nm. Namun berdasarkan ketentuan yang
tercantum dalam Farmakope Indonesia edisi IV, batas pergeseran yang
diperbolehkan sebesar 2 nm sehingga panjang gelombang serapan maksimum
yang diperoleh pada penelitian ini masih masuk dalam range dan diperbolehkan
untuk digunakan.
2. Penentuan operating time metode uji aktivitas antioksidan
Penentuan operating time suatu reaksi bertujuan untuk mengetahui dan
menentukan rentang waktu yang tepat dimana reaksi telah berjalan sempurna
sehingga diperoleh nilai absorbansi yang stabil. Ketidaksempurnaan reaksi yang
terjadi dapat mempengaruhi pengukuran absorbansi yang dilakukan baik pada
baku pembanding maupun pada sampel. Penentuan operating time ini dilakukan
dengan mengukur absorbansi DPPH yang direaksikan dengan larutan pembanding
dan larutan fraksi etil asetat ekstrak etanolik kulit jeruk nipis pada tiga konsentrasi
yang berbeda. Pengukuran ini dilakukan setiap lima menit sekali selama 60 menit
pada panjang gelombang maksimum yang didapat pada penentuan λmaks, yaitu 516
nm. Pada awal reaksi, absorbansi DPPH akan mengalami penurunan sampai
waktu tertentu hingga diperoleh absorbansi yang relatif stabil. Semakin lama
waktu pengukuran, maka ada kemungkinan rusak dan terurainya senyawa yang
Gambar 7. Hasil grafik penentuan operating time rutin
Gambar 8. Hasil grafik penentuan operating time fraksi etil asetat ekstrak etanol kulit jeruk nipis
Pada reaksi ini sulit untuk menentukan operating time yang tepat karena
reaksi masih berjalan dan terus mengalami penurunan. Akan tetapi dipilih
operating time menit ke 55 karena pada menit itu penurunan absorbansi tidaklah
besar, sedangkan untuk operating time sampel uji (fraksi etil asetat) adalah 55
menit karena pada menit ke 55 absorbansi sudah stabil untuk konsentrasi rendah
0
Penentuan Operating Time Fraksi Etil
Asetat
200 µg/mL
450 µg/mL
dan sedang, sedangkan untuk konsentrasi tinggi belum stabil tetapi penurunan
tidaklah besar.
G. Validasi Metode Uji Aktivitas Antioksidan
Validasi metode analisis merupakan suatu tahapan penting dalam
penjaminan mutu analisis kuantitatif. Tujuan suatu metode analisis adalah tidak
hanya untuk menentukan estimasi kebenaran (nilai sebenarnya) atau bias dan
presisi, akan tetapi juga untuk mengevaluasi resiko-resiko yang dapat
diekspresikan dengan ketidakpastian pengukuran yang terkait dengan hasil
analisis (Gandjar, 2012). Pada penelitian ini, parameter validasi yang ditentukan
antara lain linieritas, , presisi, dan juga spesifitas.
Linieritas suatu metode merupakan ukuran seberapa baik kurva kalibrasi
yang menghubungkan antara konsentrasi (x) dengan respon (y). Linieritas ini
dapat diukur dengan melakukan pengukuran tunggal pada konsentrasi yang
berbeda. Pada penelitian ini digunakan lima konsentrasi rutin dan juga sampel uji
yang berbeda-beda dan dilakukan tiga kali replikasi. Linieritas dilihat dari nilai
regresi linier antara konsentrasi larutan rutin dan sampel uji terhadap % IC
(Inhibitor Concentration).
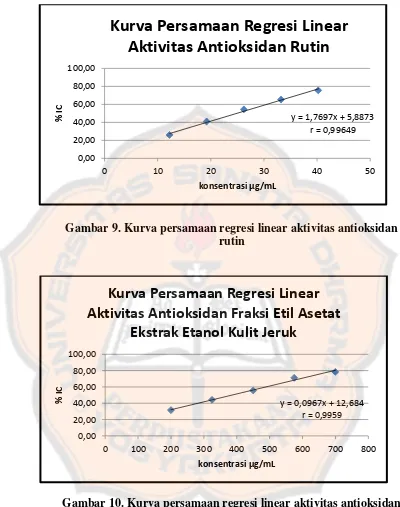
Dari tiga persamaan yang didapat, dipilih persamaan yang memiliki nilai r
paling baik untuk divalidasi. Untuk pembanding rutin diperoleh dari replikasi III
dengan persamaan y = 1,7697x + 5,8873 dan nilai r = 0,99649, sedangkan untuk
sampel uji fraksi etil asetat diperoleh dari replikasi tiga dengan persamaan y =
Gambar 9. Kurva persamaan regresi linear aktivitas antioksidan rutin
Gambar 10. Kurva persamaan regresi linear aktivitas antioksidan fraksi etil asetat ekstrak etanol kulit jeruk nipis
Jika dilihat dari kuva tersebut, terlihat bahwa ada korelasi antara
Aktivitas Antioksidan Fraksi Etil Asetat
tinggi konsentrasi dari rutin dan sampel uji fraksi etil asetat, maka semakin besar
pula % IC yang dihasilkan.
1. Linieritas metode uji aktivitas antioksidan
Linieritas suatu metode merupakan ukuran seberapa baik kurva kalibrasi
yang menghubungkan antara konsentrasi (x) rutin dan juga fraksi etil asetat
dengan respon (y) % IC. Nilai koefisien korelasi (r) adalah indikator kualitas
untuk parameter linieritas metode yang digunakan pada penentuan aktivitas
antioksidan. Dari ketiga replikasirutin diperoleh suatu persamaan dengan nilai r
sebagai berikut.
Tabel I. Persamaan regresi linier kurva baku rutin
Replikasi Persamaan regresi linier (bx+a)
Nilai koefisien korelasi (r)
1 y = 1,5296x + 14,693 0,9957
2 y = 1,7328x + 7,8707 0,9953
3 y = 1,7697x + 5,8873 0,9964
Koefisien korelasi (r) yang paling bagus dari ketiga data tersebut (Tabel
1) adalah replikasi III dengan r = 0,9964, sedangkan untuk fraksi etil asetat
ekstrak etanol kulit jeruk, dari ketiga replikasi diperoleh suatu persamaan dengan


![Gambar 3. Hasil uji pendahuluan fenolik (A = reagen Folin-Ciocalteu + larutan fraksi etil asetat ekstrak etanol kulit jeruk nipis, B = kontrol positif [reagen Folin-Ciocalteu + asam galat], C = blanko [reagen Folin-Ciocalteu + natrium karbonat)](https://thumb-ap.123doks.com/thumbv2/123dok/1762400.2091734/53.595.102.498.342.603/pendahuluan-ciocalteu-ekstrak-kontrol-positif-ciocalteu-ciocalteu-karbonat.webp)