BAB II
TINJAUAN PUSTAKA
A. Hasil Penelitian Terdahulu
Penelitian ini merujuk pada beberapa penelitian-penelitian yang telah
dilakukan sebelumnya. Minyak atsiri aman digunakan pada pangan karena
berstatus GRAS (Generally Recognise as Safe) (Rialita, 2014). De Oliveira et al. (2013), melakukan penelitian mengenai aktivitas penghambatan bakteri
Listeria monocytogenes yang diinokulasikan dalam daging sapi dari minyak atsiri cengkih dan serai. Penelitian tersebut menggunakan minyak atsiri yang
didapatkan dari hasil destilasi air dan dianalisis kandungan senyawanya
dengan menggunakan GC-MS. Senyawa utama yang terdapat dalam minyak
atsiri cengkih yaitu senyawa fenol (eugenol) sebanyak 89.80%, sedangkan
pada minyak atsiri serai kandungan utamanya yaitu senyawa aldehida (neral
dan geranial) sebanyak 73.83%. Senyawa fenol dan aldehida merupakan
golongan senyawa yang bertanggungjawab sebagai antibakteri (Bassolé &
Juliani, 2012). Konsentrasi minyak atsiri yang digunakan yaitu 1.56, 3.125
dan 6.25% (b/v) berdasarkan MIC nya. Konsentrasi 1.56% dapat menghambat
aktivitas pertumbuhan bakteri L. monocyogenes yang diinokulasikan pada daging sapi setelah penyimpanan 3 hari (5±2 0C). Uji sensoris dilakukan untuk
melihat penerimaan terhadap rasa, bau dan warna. Aplikasi minyak atsiri
konsentrasi rendah pada produk makanan dapat digunakan sebagai pengawet
alami makanan.
Hartanti et al. (2015), melakukan penelitian mengenai minyak atsiri cengkih yang dapat menghambat pertumbuhan pada beberapa bakteri.
Aktivitas minyak atsiri cengkih dalam penghambatan pertumbuhan bakteri B. subtilis pada konsentrasi 31.25 µg/ml, menghambat E. coli pada konsentrasi di atas 1000 µg/ml, serta dapat menghambat pertumbuhan S. aureus, S. typhimurium dan V. cholera pada konsentrasi 250 µg/ml. Hamad et al. (2016), melaporkan hal serupa yakni melihat penghambatan pertumbuhan bakteri dari
minyak atsiri serai dan cengkih. Minyak atsiri serai dapat menghambat
pertumbuhan S. typhimurium pada konsentrasi 1000 µg/ml, dan menghambat pertumbuhan bakteri E. coli, S. aureus dan V. cholera pada konsentrasi di atas 1000 µg/ml.
Penelitian Hamad dan Hartanti (2015) melakukan uji potensi minyak
atsiri cengkih sebagai pengawet alami pada tahu. Minyak atsiri yang
digunakan didapatkan dari hasil destilasi air (hydrodistillation) dan kemudian dilakukan identifikasi senyawa dengan GC-MS. Senyawa eugenol dalam
cengkih bertanggungjawab sebagai agen antibakteri, merupakan kandungan
tertinggi yaitu sebanyak 75.19%. Konsentrasi 250 µg/mL dapat digunakan
untuk memperpanjang waktu simpan tahu sampai 2 hari pada suhu ruang.
Menurut Bassolé & Juliani (2012), kombinasi minyak atsiri dapat
meningkatkan efikasi minyak atsiri tersebut dalam pengawetan makanan.
Dalam review tersebut, Bassolé & Juliani menjelaskan berbagai kombinasi minyak atsiri yang dapat menghasilkan efek sinergis, aditif dan antagonis.
Rialita (2014), melakukan penelitian mengenai kombinasi minyak
atsiri lengkuas dan jahe terhadap beberapa bakteri yang diaplikasikan terhadap
daging ayam. Minyak atsiri yang digunakan didapatkan dari hasil destilasi uap
(100 0C ± 6 jam), yang dipisahkan fase air dan minyaknya dengan Na2SO4
anhidrat dan minyak disimpan pada suhu 4 0C di tempat gelap. Menurut
Rialita, kombinasi minyak atsiri dapat menurunkan tingkat konsentrasi dan
mengurangi pengaruh sensoris karena kombinasi berbagai komponen minyak
atsiri bersifat lemah atau sedang dapat menghasilkan efek sinergis atau saling
menguatkan. Kombinasi minyak atsiri konsentrasi 1:1 v/v menunjukkan
efektifitas terbaik terhadap bakteri Gram positif daripada Gram negatif.
Kombinasi pada 2xMIC memiliki efek bakteriostatik. Kombinasi minyak
atsiri terbukti efektif pada media model protein seperti daging ayam.
B. Tinjauan Pustaka
1. Daging ayam
Menurut Direktorat Kesehatan Masyarakat Veteriner dan
Pascapanen (2010), daging ayam adalah bagian-bagian dari karsas ayam
protein, lemak, mineral sehingga bernilai gizi tinggi. Harga yang relatif
murah dan rasa yang enak membuat daging ayam banyak dikonsumsi oleh
masyarakat (Kusumaningrum et al., 2013). Menurut Purba et al. (2005), mutu daging pada umumnya ditentukan oleh beberapa faktor, yaitu:
a. Kelezatan bahan (palatability) yang terdiri dari keempukan (tenderness), berair (juiceness), warna, aroma, dan flavor.
b. Sifat fisis bahan yang terdiri dari kekenyalan (resilience), kekukuhan (firmness), pengikatan (binding), dan kekerasan (grainness).
c. Kandungan nutrisinya, air, protein, lemak, dan mineral serta
vitamin.
d. Kandungan mikroba.
Pertumbuhan mikroba di dalam daging segar dapat dipengaruhi
oleh beberapa faktor antara lain suhu, waktu, tersedianya oksigen, dan
kadar air daging (Kusumaningrum et al., 2013). Menurut Oliveira et al. (2013), daging mudah rusak (perishable) dan terkontaminasi oleh mikroorganisme karena adanya kandungan air yang tinggi dan pH yang
cocok untuk pertumbuhan bakteri patogen maupun bakteri pembusuk. Jika
daging ayam yang sudah ditumbuhi bakteri, maka dapat menyebabkan
foodborne disease. Terdapat dua syarat mutu daging ayam, yaitu syarat mutu mikrobiologi dan fisik (Tabel 2.1). Syarat mutu mikrobiologi daging
ayam yaitu tidak boleh sedikitpun mengandung bakteri Salmonella sp dan
Campylobacter sp per 25 gram, tidak boleh mengandung total plate count
Tabel 2.1. Persyaratan tingkatan mutu fisik daging ayam (SNI, 2009)
3. Perlemakan Banyak Banyak Sedikit
4. Keutuhan Utuh Tulang utuh, kulit sobek
2. Foodborne disease dan food spoilage
Foodborne disease merupakan suatu penyakit yang bersifat infeksius atau toksik yang disebabkan karena makanan terkontaminasi
bakteri patogen. Beberapa contoh bakteri patogen dan bakteri pembusuk
yaitu Pseudomonas, Acinetobacter, Flavobacterium, Corynebacterium,
Enterobacteriaceae, B. cereus, S. aureus, E. coli, Salmonella sp, dan C. jejuni (Rialita, 2014). Gejala yang dapat timbul akibat terkontaminasinya makanan oleh bakteri patogen yaitu sakit perut, mual, muntah, diare, tidak
nafsu makan, perut kejang, demam, dan dehidrasi (Kusumaningsih, 2010).
Menurut WHO (2015), terdapat 600 juta kasus foodborne disease di seluruh dunia pada tahun 2010, dan 230.000 di antaranya menyebabkan
kematian. Perlu penanganan yang baik untuk memperkecil angka kejadian
foodborne disease.
Selain foodborne disease, suatu makanan yang terkontaminasi bakteri dapat menyebabkan food spoilage atau pembusukan makanan.
Perubahan visual yang terjadi yaitu dari aspek tekstur, warna, bau, dan
rasa yang menjadi tidak enak. Pembusukan makanan ini dapat terjadi
karena terjadi aktivitas enzim dari bakteri pembusuk dalam makanan
tersebut. Sehingga menimbulkan perubahan visual.
3. Pengawet makanan
Penambahan bahan tambahan/zat aditif ke dalam makanan
merupakan hal yang dipandang perlu untuk meningkatkan mutu suatu
produk sehingga mampu bersaing di pasaran. Bahan tambahan tersebut
diantaranya: pewarna, penyedap rasa dan aroma, antioksidan, pengawet,
pemanis, dan pengental (Winarno, 1992). Bahan pengawet dalam makanan
digunakan untuk membuat makanan tampak lebih berkualitas, tahan lama,
menarik, serta rasa dan teksturnya lebih sempurna. Penggunaan bahan
pengawet dapat menjadikan bahan makanan bebas dari kehidupan mikroba
baik yang bersifat patogen maupun non patogen yang dapat menyebabkan
kerusakan bahan makanan seperti pembusukan (Tranggono et al., 1990). Bahan pengawet dapat menghambat atau memperlambat proses
fermentasi, pengasaman, atau penguraian yang disebabkan oleh mikroba.
Bahan pengawet ada dua macam, yaitu bahan pengawet organik
dan anorganik. Bahan pengawet organik lebih banyak dipakai dari pada
bahan pengawet anorganik, karena lebih mudah dalam proses
pembuatannya. Bahan organik digunakan baik dalam bentuk asam maupun
garamnya. Zat kimia yang sering dipakai sebagai pengawet organik adalah
asam sorbat, asam propionat, asam benzoat. Sedangkan zat pengawet
anorganik yang sering digunakan adalah sulfit, nitrat dan nitrit (Winarno,
1992). Asam benzoat merupakan zat pengawet yang paling luas
penggunaannya dan sering digunakan pada bahan makanan yang asam.
Bahan pengawet yang diizinkan pada Permenkes
No.722/Menkes/Per/IX/88 yaitu: asam benzoat, asam propionat, asam
sorbat, sulfur dioksida, etil p-hidroksi benzoat, kalium benzoat, kalium
bisulfit, kalium meta bisulfit, kalium nitrat, kalium nitrit, kalium
propionat, kalsium sorbat, natrium benzoat, metil p-hidroksi benzoit,
natrium bisulfit, natrium metabisulfit, natrium nitrat, natrium nitrit,
natrium propionat, natrium sulfit, nisin dan propil p-hidroksi benzoit.
Sedangkan pengawet yang diperbolehkan dan dinyatakan aman
dikonsumsi oleh FDA yaitu vitamin C, asam sitrat, natrium dan asam
benzoat, sorbat, kitosan, asap cair, kunyit, air KI, sulfur dioksida, kalium
nitrit, kalium dan natrium propionat, natrium metasulfat dan asam sorbat.
4. Serai (Cymbopogon citratus)
Tanaman serai atau Lemongrass (Inggris) sering digunakan sebagai bumbu masakan di daerah Asia Tenggara dan tempat lainnya. Selain itu,
oleh masyarakat, serai digunakan sebagai obat kumur, penghangat badan,
mengobati sakit gigi, radang lambung dan usus (Zeruya, 2007). Nama
serai di luar negeri bermacam-macam, diantaranya yaitu citronella (USA),
sera (Hindi), lemon grass (Egypt), ta-khrai (Thailand), sakumau
(Malaysia) (Shah et al., 2011). Sedangkan nama daerah serai di Indonesia yaitu serai (Sunda), sere (Jawa tengah), sarae (Lampung), lauwariso
(Seram), sangae-sangae (Batak). Tanaman serai umumnya tumbuh sebagai
tanaman liar di tepi jalan atau perkebunan, namun ada juga yang dengan
sengaja ditanam. Kondisi pertumbuhan serai yaitu di daerah tropis lembab,
cukup sinar matahari dan dengan curah hujan relatif tinggi. Menurut Shah
et al. (2016), tanaman serai dapat diklasifikasikan sebagai berikut: Kingdom : Plantae
Divisi : Tracheophyta
Kelas : Magnoliopsida
Ordo : Poales
Famili : Poaceae
Genus : Cymbopogon
Spesies : Cymbopogon citratus
Serai dapat tumbuh 1-1,5 m dengan panjang daunnya yang
kasar dan beraroma kuat (Fitriani et al., 2013). Serai berupa tumbuhan yang termasuk dalam keluarga Poaceae, menahun dan mempunyai
perakaran yang dalam dan kuat. Memiliki jenis daun tunggal, lengkap,
ujungnya berlidah (ligula), helaian dan lebih dari separuhnya
menggantung.
Kandungan senyawa kimia dalam serai yaitu minyak atsiri,
saponin, tannin, alkaloid, flavonoid, keton (Sousa et al., 2010). Minyak atsiri serai memiliki aktivitas antimikroba terhadap S. aureus, B. subtilis,
E. coli, S. typhimurium (Hamad et al., 2016; Naik et al., 2010; Nuritasari
et al., 2016; Singh et al., 2011). Senyawa yang bertanggungjawab dalam aktivitas antimikroba tersebut karena minyak atsiri cengkih mengandung aldehida (α citral dan β citral) paling dominan (Hamad et al., 2016; Noermentari et al., 2016). Menurut Bassole dan Juliani (2012), senyawa aldehid merupakan senyawa yang bertugas menghambat pertumbuhan
bakteri, selain fenol, keton, alkohol.
5. Cengkih (Syzygium aromaticum)
Cengkih memiliki nama daerah yang berbeda-beda, yaitu: clove
(Inggris), cengkih (Jawa, Sunda), wunga lawing (Bali), bunga lawing
(Gayo), sake (Nias), cangkih (Lampung), hungolawa (Gorontalo)
(Thomas, 2007). Menurut Interagency Taxonomic Information System atau ITIS (2016), tanaman cengkih dapat diklasifikasikan sebagai berikut:
Kingdom : Plantae
Divisi : Tracheophyta
Kelas : Magnoliopsida
Ordo : Myrtales
Famili : Myrtaceae
Genus : Syzygium
Spesies : Syzygium aromaticum
Cengkih banyak digunakan sebagai bumbu masakan pedas di
negara-negara Eropa, dan sebagai bahan utama rokok kretek khas Indonesia.
Pohon cengkih merupakan tanaman tahunan yang dapat tumbuh dengan
tinggi 10-20 m, mempunyai daun berbentuk lonjong yang berbunga pada
pucuk-pucuknya. Tangkai buah pada awalnya berwarna hijau, dan
berwarna merah jika bunga sudah mekar. Cengkih akan dipanen jika sudah
mencapai panjang 1,5-2 cm. Bunga cengkih mengandung minyak atsiri,
dan juga senyawa kimia yang disebut eugenol, asam oleanolat, asam
galotanat, fenilin, karyofilin, resin dan gom. Minyak esensial dari cengkih
mempunyai fungsi anestetik dan antimikrobial. Minyak cengkih sering
digunakan untuk menghilangkan bau nafas dan untuk menghilangkan sakit
gigi. Zat yang terkandung dalam cengkih yang bernama eugenol,
digunakan dokter gigi untuk menenangkan saraf gigi (Laitupa dan Susane,
2010).
Minyak atsiri daun cengkih memiliki aktivitas antibakteri dengan
menghambat pertumbuhan bakteri gram negatif maupun bakteri gram
positif (Rahayu, 2000). Senyawa yang mengambil peran penting dalam
aktivitas antibakteri tersebut yaitu eugenol yang bersifat asam lemah.
Senyawa asam lemah, senyawa-senyawa fenolik dapat terionisasi melepas
ion H+ dan meninggalkan gugus sisanya yang bermuatan negatif. Kondisi
yang bermuatan negatif ini akan ditolak oleh dinding sel bakteri gram
positif dan negatif (Rahayu, 2000).
6. Minyak atsiri (Essential oil)
Minyak atsiri atau minyak eteris atau minyak terbang merupakan
minyak yang mudah menguap pada suhu kamar (Lutony dan Rahmayati,
2002) tanpa mengalami perubahan komposisi, larut dalam pelarut organik,
komposisi berbeda sesuai dengan sumber penghasilnya. Minyak atsiri
biasanya tidak berwarna atau berwarna kekuning-kuningan, tetapi ada juga
beberapa minyak yang berwarna kemerah-merahan, hijau, coklat dan biru.
Minyak atsiri jika dibiarkan di udara terbuka dan terkena sinar matahari
menjadi resin (Masriah, 2007). Sifat minyak atsiri yang umum yaitu
mudah menguap pada suhu kamar, mempunyai rasa getir, berbau wangi
sesuai aroma tanaman yang menghasilkannya dan umumnya larut dalam
pelarut organik (Lutony dan Rahmayati, 2002).
Minyak atsiri memiliki komposisi yang berbeda-beda, disebabkan
adanya perbedaan jenis tanaman penghasil, kondisi iklim, tanah tempat
tumbuh, umur panenan, metode ekstraksi yang digunakan dan cara
penyimpanan minyak. Minyak atsiri biasanya terdiri dari berbagai
campuran persenyawaan kimia yang terbentuk dari unsur karbon (C),
hidrogen (H), dan oksigen (O).
Terdapat 3 metode untuk memperoleh minyak atsiri, yaitu:
destilasi (penyulingan), ekstraksi dan pengepresan (penekanan) (Voight,
1984). Destilasi merupakan proses pemisahan komponen cairan atau
padatan dari dua atau lebih campuran berdasarkan perbedaan titik
didihnya. Titik didih komponen minyak mudah menguap anatara 150-300 0
C pada tekanan 760 mmHg. Komponen dengan titik didih rendah akan
terdestilasi dahulu baru kemudian yang bertitik didih tinggi.
Metode destilasi dibagi menjadi 3 metode, yaitu:
a. Destilasi air
Bahan yang akan didestilasi harus kontak langsung dengan air
sampai terendam seluruhnya atau mengapung tergantung dari berat
jenis dan jumlah bahan yang akan didestilasi (Sastrohamidjojo,
2004). Air dipanaskan dengan metode pemanasan yang biasa
dilakukan, yaitu dengan panas langsung, mantel uap, pipa uap
melingkar tertutup, atau dengan memakai pipa uap berlingkar
terbuka atau berlubang. Penyulingan dengan cara langsung ini
dapat menyebabkan banyaknya rendemen minyak yang hilang
(tidak tersuling) dan terjadi pula penurunan mutu minyak yang
diperoleh.
b. Destilasi air dan uap air
Bahan yang akan didestilasi diletakkan di atas rak atau saringan
dipanaskan menyebabkan uap air yang basah, jenuh dan tidak
terlalu panas. Bahan tersebut hanya mengalami kontak dengan uap
dari pemanasan air atau tidak kontak langsung.
c. Destilasi dengan uap langsung
Air penyulingan tidak diisi langsung di dalam alat destilasi. Uap
jenuh atau uap kelewat panas (di atas 1 atm) dialirkan pada pipa
uap berpori pada bagian bawah bahan dan kemudian bergerak ke
atas melewati saringan dan kontak dengan bahan (Indriyanti,
2013).
7. GC-MS (Gas chromatography-mass spectrometry)
GC-MS merupakan metode pemisahan senyawa organik yang
menggunakan dua metode analisis senyawa yaitu kromatografi gas (GC)
untuk menganalisis jumlah senyawa secara kuantitatif dan sebagai alat
pemisah berbagai campuran komponen dalam sampel sedangkan
spektrometri massa (MS) untuk menganalisis struktur molekul senyawa
analit. Gas kromatografi merupakan salah satu teknik spektroskopi yang
menggunakan prinsip pemisahan campuran berdasarkan perbedaan
kecepatan migrasi komponen-komponen penyusunnya. Spektroskopi
massa adalah suatu metode untuk mendapatkan berat molekul dengan cara
mencari perbandingan massa terhadap muatan dari ion yang muatannya
diketahui dengan mengukur jari-jari orbit melingkarnya dalam medan
magnetik seragam. Dalam kromatografi gas, fase yang bergerak (atau
mobile phase) adalah sebuah operator gas, yang biasanya gas murni seperti helium atau yang tidak reaktif seperti gas nitrogen. Stationary phase atau fase diam merupakan tahap mikroskopis lapisan cair atau polimer yang
mendukung gas murni, di dalam bagian dari sistem pipa-pipa kaca atau
logam yang disebut kolom. Untuk spektra GC, informasi terpenting yang
didapat adalah waktu retensi untuk tiap-tiap senyawa dalam sampel.
molekul relatif dari senyawa sampel tersbut. Tahap-tahap suatu rancangan
penelitian GC-MS adalah (1) preparasi sampel, (2) derivatisasi, (3) injeksi,
(4) pemisahan, (5) deteksi oleh MS, (6) pembacaan hasil.
Bagian utama dari kromatografi gas (GC) adalah gas pembawa,
sistem injeksi, kolom, fase diam, suhu dan detektor. Gas pembawa harus
memenuhi persyaratan antara lain harus inert, murni, dan mudah
diperoleh. Gas pembawa yang sering dipakai adalah helium (He), argon
(Ar), nitrogen (N2), hidrogen (H2), dan karbon dioksida (CO2). Cuplikan
dimasukkan kedalam ruang suntik melalui gerbang suntik, biasanya
berupa lubang yang ditutupi dengan septum atau pemisah karet. Ada dua
macam kolom, yaitu kolom kemas dan kolom kapiler. Fase diam
dibedakan berdasarkan kepolarannya, yaitu non polar, sedikit polar, polar,
semi polar dan sangat polar. Berdasarkan sifat minyak atsiri yang nonpolar
sampai sedikit polar maka untuk keperluan analisis sebaiknya digunakan
kolom dengan fase diam yang bersifat sedikit polar.
Spektrometer massa (MS) sebagai detektor terdiri dari sistem
pemasukan cuplikan, ruang pengion dan percepatan, tabung analisis,
pengumpul ion dan penguat, dan pencatat. Keuntungan utama spektrometri
massa sebagai metode analisis yaitu metode ini lebih sensitif dan spesifik
untuk identifikasi senyawa yang tidak diketahui atau untuk menetapkan
keberadaan senyawa tertentu. Hal ini disebabkan adanya pola fragmentasi
yang khas sehingga dapat memberikan informasi mengenai bobot molekul
dan rumus molekul. Puncak ion molekul penting dikenali karena
memberikan bobot molekul senyawa yang diperiksa. Puncak paling kuat
pada spektrum, disebut puncak dasar (base peak), dinyatakan dengan nilai 100% dan kekuatan puncak lain, termasuk puncak ion molekulnya
dinyatakan sebagai persentase puncak dasar tersebut.
8. Metode pengukuran pertumbuhan bakteri
Metode untuk mengukur pertumbuhan mikroorganisme pada suatu
media ada dua macam, yaitu pengukuran secara langsung dan pengukuran
a. Metode Langsung
1) Pengukuran menggunakan bilik hitung (counting chamber) Metode pengukuran bakteri ini menggunakan bilik hitung
Petroff Hausser. Keuntungan menggunakan metode ini adalah mudah, murah, dan cepat, serta bisa diperoleh informasi
tentang ukuran dan morfologi mikroorganisme. Kerugiannya
yaitu populasi mikroorganisme yang digunakan harus banyak
(minimum 106 CFU/ml), karena pengukuran dengan volume
dalam jumlah sedikit tidak dapat membedakan antara sel hidup
dan sel mati.
2) Pengukuran menggunakan electronic counter
Pengukuran dilakukan dengan mengalirkan suspensi mikro
organisme melalui lubang kecil (orifice) dengan bantuan aliran listrik. Elektroda pada dua sisi orifice mengukur tahanan listrik (ditandai dengan naiknya tahanan) pada saat bakteri melalui
orifice. Pada saat inilah sel terhitung. Keuntungan metode ini adalah hasil bisa diperoleh dengan lebih cepat dan lebih akurat,
serta dapat menghitung sel dengan ukuran besar.
3) Pengukuran dengan plating technique
Pengukuran ini adalah perhitungan jumlah sel tampak (visible) dan didasarkan pada asumsi bahwa bakteri hidup akan tumbuh,
membelah, dan memproduksi satu koloni tunggal. Satuan
perhitungan yang dipakai adalah CFU (Colony Forming Unit) dengan cara membuat seri pengenceran sampel dan
menumbuhkan sampel pada media padat. Pengukuran
dilakukan pada plate dengan jumlah koloni berkisar 25-250
atau 30-300. Keuntungan metode ini adalah sederhana, mudah,
dan sensitive karena menggunakan colony counter sebagai alat hitung dan dapat digunakan untuk menghitung mikroorganisme
pada sampel makanan, air, ataupun tanah. Kerugiannya adalah
kurang akurat karena satu koloni tidak selalu berasal dari satu
individu sel.
4) Pengukuran dengan teknik filtrasi membran
Sampel dialirkan pada suatu sistem filter membran dengan
bantuan vacum. Bakteri yang terperangkat selanjutnya ditumbuhkan pada media yang sesuai dan jumlah koloni
dihitung. Keuntungan metode ini adalah dapat menghitung sel
hidup dan sistem perhitungannya langsung, sedangkan
kerugiannya adalah tidak ekonomis karena membutuhkan alat
khusus yang mahal.
b. Metode Tidak Langsung
1) Pengukuran turbudity (kekeruhan)
Pengukuran ini dilakukan atas dasar terjadinya bakteri yang
bermultiplikasi pada media cair, sehingga akan menyebabkan
kekeruhan media. Alat yang digunakan untuk pengukuran
adalah spektrofotometer atau kolorimeter dengan cara
membandingkan densitas optik (optical density, OD) antara media tanpa pertumbuhan bakteri dan media dengan
pertumbuhan bakteri.
2) Pengukuran aktivitas metabolik
Pengukuran didasarkan pada asumsi bahwa jumlah produk
metabolik tertentu, misalnya asam atau CO2, menunjukkan
jumlah mikroorganisme yang terdapat di dalam media.
Misalnya pengukuran produksi asam untuk menentukan jumlah
vitamin yang dihasilkan mikroorganisme.
3) Pengukuran berat sel kering (BSK)
Metode ini umum digunakan untuk mengukur pertumbuhan
fungi berfilamen. Miselium fungi dipisahkan dari media dan
dihitung sebagai berat kotor. Miselium selanjutnya dicuci dan
dikeringkan dengan alat pengering (deksikator) dan ditimbang beberapa kali hingga mencapai berat konstan yang dihitung
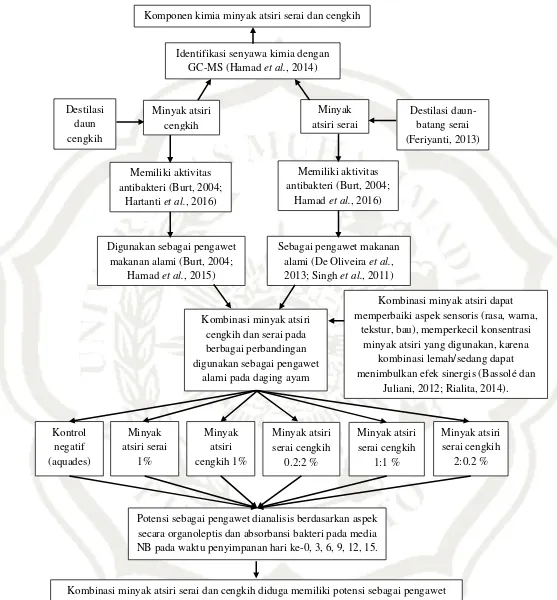
C. Kerangka Konsep
Kerangka konsep penelitian mengenai identifikasi senyawa kimia dan
Potensi sebagai pengawet dianalisis berdasarkan aspek secara organoleptis dan absorbansi bakteri pada media NB pada waktu penyimpanan hari ke-0, 3, 6, 9, 12, 15.
Kombinasi minyak atsiri
Komponen kimia minyak atsiri serai dan cengkih
Kombinasi minyak atsiri dapat
Kombinasi minyak atsiri serai dan cengkih diduga memiliki potensi sebagai pengawet alami pada daging ayam yang lebih baik dibandingkan pada penggunaan secara tunggal.
Minyak atsiri
D. Hipotesis
Kombinasi minyak atsiri serai dan cengkih diduga memiliki potensi
sebagai pengawet alami pada daging ayam yang lebih baik dibandingkan pada
penggunaan secara tunggal berdasarkan aktivitasnya dalam menghambat
BAB III
METODOLOGI PENELITIAN
A. Jenis Rancangan Penelitian
Metode yang digunakan dalam penelitian ini adalah gabungan antara
metode non eksperimental dan metode eksperimental. Metode non
eksperimental yaitu melakukan determinasi tanaman serai dan cengkih,
destilasi daun cengkih dan serai, identifikasi kandungan senyawa kimia dalam
minyak atsiri serai dan cengkih dengan menggunakan GC-MS. Metode
eksperimental yaitu melakukan uji potensi minyak atsiri serai dan cengkih
sebagai pengawet daging ayam berdasarkan aktivitasnya sebagai
menghambat pertumbuhan bakteri dengan menggunakan perbandingan
konsentrasi minyak atsiri serai dan cengkih.
B. Variabel Penelitian
1. Variabel bebas
Variabel bebas dari penelitian ini adalah perbandingan konsentrasi minyak
atsiri serai dan cengkih dan waktu penyimpanan daging ayam.
2. Variabel tergantung
Variabel tergantung dari penelitian ini adalah absorbansi sampel yang
dikultur pada media NB dengan spektrofotometer UV-Vis pada panjang
gelombang 600 nm, dan pengamatan organoleptis sampel daging ayam.
3. Variabel terkendali
Variabel terkendali dari penelitian ini adalah proses pengerjaan aseptis,
sterilisasi, media kultur, suhu penyimpanan, waktu destilasi, preparasi
sampel.
C. Waktu dan Tempat Penelitian
Penelitian ini dilakukan selama 5 bulan. Proses pengerjaan determinasi
tanaman cengkih dan serai dilakukan di Laboratorium Taksonomi Tumbuhan
Fakultas Biologi Universitas Jendral Soedirman Purwokerto, destilasi minyak
Treatment Fakultas Teknik Kimia Universitas Muhammadiyah Purwokerto (UMP), identifikasi kandungan senyawa minyak atsiri serai dan cengkih
dilakukan di Laboratorium Microinstrument Terpadu UMP, dan uji potensi minyak atsiri serai dan cengkih sebagai pengawet makanan dilakukan di
Laboratorium Bioprocess Fakultas Teknik Kimia UMP.
D. Alat dan Bahan
1. Alat
Alat yang digunakan pada penelitian ini yaitu timbangan analitik
(Shimadzu), dandang uap destilasi, mikropipet (Socorex), GCMS-QP2010
SE dengan SH-Rxi-5Sil MS (Shimadzu), LAF/Laminar Air Flow
(Mascotte model LH-S), Spektrofotometer UV-Vis (Shimadzu UV-1240),
pH meter, autoklaf, oven (Memmert)dan alat-alat gelas (Pyrex).
2. Bahan
Bahan yang digunakan pada penelitian ini yaitu simplisia batang
dan daun serai, simplisia daun cengkih, akuades, natrium sulfat anhidrat,
n-heksan, daging ayam segar, formalin, dimetil solfoksida (DMSO),
natrium benzoat, media Nutrient Broth (NB) dan alkohol.
E. Cara Penelitian
1. Pengumpulan Tanaman
Daun cengkih yang dipakai diambil dari daerah Pemalang, Jawa
Tengah. Serai (aerial parts) yang digunakan diambil dari daerah Sokaraja, Banyumas, Jawa Tengah.
2. Determinasi Tanaman
Determinasi tanaman dilakukan di Laboratorium Taksonomi
Tumbuhan Fakultas Biologi Universitas Jenderal Soedirman Purwokerto mengunakan buku acuan “Flora of Java” Volume III (Backer dan Bakhuizen Van Den Brink, 1968).
3. Penyiapan Simplisia
Sampel yang telah dikumpulkan, dilakukan pengeringan di bawah
4. Pengambilan Minyak Atsiri (Destilasi)
Pengambilan minyak atsiri serai dan cengkih dilakukan dengan
metode destilasi uap dan air. Simplisia serai dan cengkih masing-masing
dimasukkan ke dalam dandang uap berbeda yang telah diisi dengan
akuades. Proses destilasi berlangsung selama 5-6 jam. Minyak yang
didapat yang masih tercampur dengan air dipisahkan dengan Na2SO4
anhidrat sebanyak 10% dari cairan. Minyak yang telah dipisahkan,
disaring dan disimpan dalam botol vial dalam lemari pendingin suhu
rendah 5±2oC dalam botol kaca dibungkus aluminium foil (Oliveira et al., 2013).
5. Identifikasi Kandungan Kimia Minyak Atsiri (GC-MS)
Minyak atsiri dianalisis dengan menggunakan GCMS-QP2010 SE
dengan SH-Rxi-5Sil MS, dilengkapi dengan kolom HP-5 5%
fenilmetilsiloksan ukuran 30 m x 0,25 mmID x 0,25 µm df. Suhu oven
diprogram dari suhu 50oC selama 2 menit, lalu dinaikkan sampai 100oC
dengan laju 2oC/menit, dan langsung dinaikkan lagi sampai 2800C dengan
laju 5oC/menit dan ditahan sampai 10 menit. Gas pembawa berupa gas
helium dengan laju alir sebesar 1ml/menit. Rasio injeksinya yaitu 1:50 dan
voltasi ionisasi yaitu 70 eV. Suhu injektor dan deterktor masing-masing
280oC dan 230oC. Volume minyak atsiri atau sampel yang diinjeksi
sebanyak 1µL 10000 ppm dengan n-heksan sebagai pelarutnya. Waktu
tunggu pembacaan pelarut selama 2 menit dan analisis satu sampel
berlangsung selama 73 menit. Identifikasi konstituen dari spektrum massa
dibandingkan dengan library Wiley 9.0 (Adam, 2001).
6. Uji Potensi minyak atsiri serai dan cengkih sebagai bahan pengawet
daging ayam
a. Pembuatan media NB
Melarutkan 4 g NB dalam 500 mL akuades, diaduk dan
dipanaskan di atas hot plate sampai homogen, lalu tutup rapat dengan aluminium foil. Kemudian dilakukan sterilisasi basah (Pratiwi, 2008).
Alat yang digunakan disterilkan dengan metode sterilisasi
kering menggunakan oven bersuhu 170oC selama 1 jam (Pratiwi,
2008). Alat yang digunakan dicuci dan dibungkus rapat baru
dimasukkan ke dalam oven.
c. Sterilisasi bahan
Bahan yang digunakan disterilkan dengan metode sterilisasi
basah menggunakan autoklaf 121 0C 1 atm selama 20 menit (Pratiwi,
2008). Bahan diletakkan dalam wadah yang sesuai dan ditutup rapat
dengan aluminium foil, lalu di masukkan ke dalam autoklaf.
d. Persiapan daging ayam
Daging ayam segar diperoleh dari pasar
Tambaksogra-Purwokerto, Jawa Tengah. Daging ayam segar dipotong dadu kecil
(1cm x 1cm x 1cm), kemudian dicuci dengan akuades steril.
e. Persiapan kelompok perlakuan
Penelitian ini menggunakan 9 kelompok perlakuan.
Masing-masing kelompok perlakuan disiapkan dalam volume 500 mL.
Terdapat 3 kelompok yang menggunakan kombinasi minyak atsiri
dengan perbandingan minyak atsiri serai dengan cengkih sebesar
0.2:2, 1:1, dan 2:0.2 %. Dan terdapat 2 kelompok perlakuan dengan
minyak atsiri tunggal konsentrasi 1%. Sebagai kontrol positif
digunakan formalin 10% dan Na benzoat 0.12%. Sebagai kontrol
negatif yaitu DMSO dan air steril.
Sejumlah volume minyak atsiri tertentu dipipet, ditambah
DMSO dengan volume yang sama dan ditambahkan akuades steril
sampai 500 mL. Formalin diambil 50 mL dan ditambahkan akuades
steril sampai 500 mL. Na benzoat ditimbang 0.6 g dan dilarutkan
dengan akuades steril sampai 500 mL. Diambil DMSO 5 mL dan
ditambahkan dengan akuades steril sampai 500 mL. Air steril
disiapkan dalam wadah sebanyak 500 mL (tabel 3.1). Perlakuan
Tabel 3.1. Jumlah pemipetan cairan kelompok perlakuan
Pengawetan daging ayam dengan cara memasukkan potongan
daging ayam yang telah dicuci bersih ke dalam 9 kelompok perlakuan
selama 1 menit dan dibantu dengan pengadukan. Setiap 6 potong
daging ayam dipindahkan ke dalam gelas steril untuk dilakukan
penyimpanan pada hari ke-0, 3, 6, 9, 12 dan 15. Semua disimpan di
dalam lemari pendingin (2-70C), kecuali untuk penyimpanan hari
ke-0.
f. Pengamatan potensi minyak atsiri serai dan cengkih sebagai pengawet
alami pada daging ayam
Setiap waktu penyimpanan dilakukan pengamatan. Pengamatan
tersebut ada 2 aspek, yaitu pengamatan secara organoleptis dan
absorbansi bakteri pada media NB.
1) Organoleptis
Pengamatan uji organoleptis pada sampel daging ayam
yang telah diawetkan dengan kelompok perlakuan. Uji dilakukan
dengan diambil sampel potongan daging ayam kemudian diamati
Perhitungan absorbansi bakteri diambil dari sampel daging
ayam yang telah diawetkan dengan kelompok perlakuan. Diambil
1 potong daging ayam dan dimasukkan dalam erlenmeyer yang
berisi 25 mL media NB steril. Homogenkan campuran tersebut
selama 1 menit. Diambil 1 mL cairan yang telah homogen dan
tuangkan pada tabung reaksi yang berisi 9 mL media NB steril.
Tabung reaksi diinkubasi pada suhu 37 0C. Ukur absorbansi media
setelah 24 jam dengan spektrofotometer UV-Vis pada panjang
gelombang 600 nm. Sebagai blanko digunakan media NB steril.
Perlakuan dilakukan replikasi sebanyak 3x dan semua dalam
keadaan aseptis (De Oliveira et al., 2013; Rialita, 2014).
F. Analisis Data
Analisis deskriptif dilakukan untuk deskripsi data hasil organoleptis
sampel daging ayam hasil penyimpanan. Sedangkan data hasil absorbansi
diolah secara statistik. Sebelum dianalisis harus dilakukan uji homogenitas
dan normalitas. Data yang tidak homogen dan tidak normal, kemudian
dianalisis secara non-parametrik menggunakan metode Kruskal-Wallis. Jika terdapat perbedaan yang signifikan maka dilanjutkan analisis Post Hoc
menggunakan tes Mann-Whitney untuk mengetahui perbedaan antar kelompok perlakuan, bermakna (p <0.05) atau tidak bermakna (p>0.05)