BAB II
TINJAUAN PUSTAKA
2.1 Uraian Bahan 2.1.1 Parasetamol
Menurut Ditjen BKAK (2014), uraian mengenai parasetamol adalah sebagai berikut:
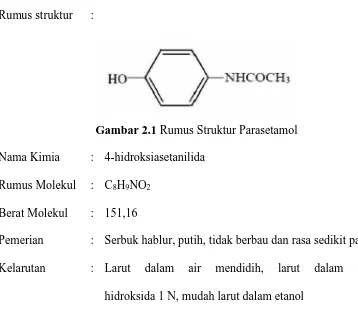
Rumus struktur :
Gambar 2.1 Rumus Struktur Parasetamol
Nama Kimia : 4-hidroksiasetanilida Rumus Molekul : C8H9NO2
Berat Molekul : 151,16
Pemerian : Serbuk hablur, putih, tidak berbau dan rasa sedikit pahit
Kelarutan : Larut dalam air mendidih, larut dalam natrium hidroksida 1 N, mudah larut dalam etanol
Parasetamol merupakan metabolit dari fenasetin, memiliki khasiat analgetik antipiretik tanpa aktivitas antiradang, memiliki waktu paruh (t1/2) 1-4 jam. Dewasa ini pada umumnya dianggap sebagai zat antinyeri yang paling aman, juga untuk pengobatan swamedikasi (pengobatan mandiri). Efek analgetiknya dapat diperkuat oleh kafein hingga 50%. Pada dosis tinggi mengakibatkan nekrosis hati yang tidak reversibel. Dosis yang berlebihan (overdose) dapat menimbulkan mual dan
muntah (Tan dan Rahardja, 2007).
Menurut Moffat, dkk. (2011), pada pelarut asam, parasetamol memiliki panjang gelombang maksimum sebesar 245 nm (A11 = 668a). Pada pelarut basa,
parasetamol memiliki panjang gelombang maksimum sebesar 257 nm (A11 = 715a). Spektrum parasetamol dapat dilihat pada Gambar 2.2.
Gambar 2.2 Spektrum Parasetamol (Moffat, dkk., 2011) 2.1.2 Kafein
Menurut Ditjen BKAK (2014), uraian mengenai kafein adalah sebagai berikut:
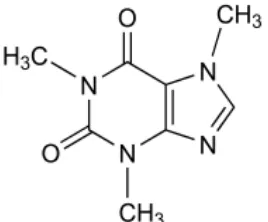
Rumus Struktur :
Gambar 2.3 Rumus Struktur Kafein Nama Kimia : 1,3,7–trimetilxantine
Pemerian : Serbuk putih, bentuk jarum mengkilat, biasanya menggumpal, tidak berbau, rasa pahit, larutan bersifat netral terhadap kertas lakmus, bentuk hidratnya mengembang di udara
Kelarutan : Agak sukar larut dalam air dan dalam etanol, mudah larut dalam kloroform, sukar larut dalam eter
Secara alami, kafein banyak terdapat dalam kopi, kakao dan daun teh. Kafein memiliki efek menghilangkan rasa letih, lapar dan mengantuk, serta meningkatkan daya konsentrasi. Kafein memiliki waktu paruh (t1/2) 3-5 jam. Kafein sering dikombinasi dengan parasetamol guna memperkuat efek analgetiknya. Penggunaan kafein secara berlebihan dapat menyebabkan ketergantungan (Tan dan Rahardja, 2007)
Menurut Moffat, dkk. (2011), pada pelarut asam, kafein memiliki panjang gelombang maksimum sebesar 273 nm (A11 = 504a). Pada pelarut basa, kafein tidak memberikan serapan. Spektrum kafein dapat dilihat pada Gambar 2.4.
2.2 Spektrofotometri Ultraviolet-Visibel (UV-Vis) 2.2.1 Pengertian spektrofotometri ultraviolet-visibel
Spekrofotometri ultraviolet-visibel merupakan salah satu teknik analisis spektrofotometri yang menggunakan sumber radiasi elektromagnetik sinar ultraviolet dan sinar tampak (visibel) dengan memakai instrumen spektrofotometer (Gandjar dan Rohman, 2012). Spektrofotometer digunakan untuk mengukur energi secara relatif jika energi tersebut ditransmisikan, direfleksikan, atau diemisikan sebagai fungsi dari panjang gelombang (Khopkar, 1985). Sinar ultraviolet memiliki panjang gelombang antara 200-400 nm, sedangkan sinar tampak memiliki panjang gelombang antara 400-800 nm (Moffat, dkk., 2011).
2.2.2 Instrumensasi spektrofotometer ultraviolet-visibel
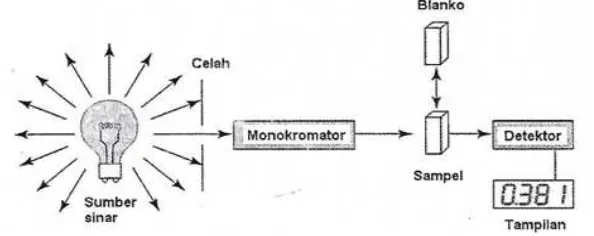
Spektrofotometer adalah alat yang terdiri dari spektrometer dan fotometer. Spektrometer menghasilkan sinar dari spektrum dengan panjang gelombang tertentu dan fotometer adalah alat pengukur intensitas cahaya yang ditransmisikan atau yang diabsorpsi (Khopkar, 1985). Biasanya spektrofotometer telah mempunyai software untuk mengolah data yang dapat dioperasikan melalui komputer yang telah terhubung dengan spektrofotometer (Moffat, dkk., 2011). Diagram spektrofotometer ultraviolet-visibel dapat dilihat pada Gambar 2.5.
Menurut Rohman (2007) dan Satiadarma, dkk. (2004), komponen spektrofotometer ultraviolet-visibel adalah sebagai berikut:
a. Sumber sinar atau lampu: lampu deuterium digunakan untuk daerah ultraviolet pada panjang gelombang dari 200-400 nm, sementara lampu halogen kuarsa atau lampu tungsten digunakan untuk daerah visibel pada panjang gelombang antara 400-800 nm.
b. Monokromotor: digunakan untuk memperoleh sumber sinar yang monokromatis.
c. Optik-optik: dapat didesain untuk memecah sumber sinar melewati dua kompartemen.
d. Detektor: digunakan sebagai alat yang menerima sinyal dalam bentuk radiasi elektromagnetik, mengubah, dan meneruskannya dalam bentuk sinyal listrik ke rangkaian sistem penguat elektronika.
2.2.3 Proses penyerapan radiasi pada spektrofotometer ultraviolet-visibel Radiasi di daerah ultraviolet-visibel diserap melalui eksitasi elektron yang terlibat dalan ikatan antara atom-atom pembentuk molekul (Gandjar dan Rohman, 2012; Watson, 2005). Jika suatu berkas radiasi dikenakan pada larutan sampel maka intensitas sinar radiasi yang diteruskan dapat diukur besarnya. Radiasi yang diserap oleh cuplikan ditentukan dengan membandingkan intensitas sinar yang diteruskan dengan intensitas sinar yang diserap jika tidak ada zat penyerap lainnya. Serapan dapat terjadi jika radiasi yang mengenai larutan sampel memiliki energi yang sama dengan energi yang dibutuhkan untuk menyebabkan perubahan energi. Kekuatan radiasi juga mengalami penurunan dengan adanya penghamburan dan pemantulan cahaya, akan tetapi penurunan hal ini sangat kecil
Sinar ultraviolet dan sinar tampak memberikan energi yang cukup untuk terjadinya transisi elektron (Rohman, 2007). Elektron yang energinya tertinggi dalam molekul, berada dalam tingkat energi elektron dasar, terdapat dalam orbital
δ, π, atau n, masing-masing mempunyai keadaan tereksitasi sesuai dengan energi elektron terendah (Satiadarma, dkk., 2004).
Penyerapan sinar ultraviolet dan sinar tampak dibatasi oleh sejumlah gugus fungsional (yang disebut dengan kromofor) yang mengandung elektron valensi dengan tingkat energi eksitasi yang relatif rendah. Elektron yang terlibat pada penyerapan sinar ultraviolet dan sinar tampak ini ada tiga, yaitu elektron sigma, elektron phi, dan elektron bukan ikatan (non bonding electron) (Rohman, 2007). Diagram tingkat energi elektronik dapat dilihat pada Gambar 2.6.
Gambar 2.6 Diagram Tingkat Energi Elektronik (Rohman, 2007)
Menurut Rohman (2007), transisi-transisi elektronik yang terjadi di antara tingkat-tingkat energi di dalam suatu molekul ada empat yaitu:
1. Transisi δ→δ*
Energi yang diperlukan untuk transisi ini besarnya sesuai dengan energi sinar yang frekuensinya terletak di antara ultraviolet vakum (kurang dari 180 nm). Jenis transisi ini terjadi pada daerah ultraviolet vakum sehingga kurang begitu bermanfaat untuk analisis dengan cara spektrofotometri ultraviolet-visibel.
δ* anti ikatan sigma
π* anti ikatan phi n elektron non ikatan
π ikatan phi
2. Transisi n→δ*
Jenis transisi ini terjadi pada senyawa organik jenuh yang mengandung atom-atom yang memiliki elektron bukan ikatan (elektron n). Energi yang diperlukan untuk transisi jenis ini lebih kecil dibandingkan
transisi δ→δ* sehingga sinar yang diserap pun mempunyai panjang
gelombang lebih panjang, yakni sekitar 150-250 nm. Kebanyakan transisi ini terjadi pada panjang gelombang kurang dari 200 nm.
3. Transisi n→π* dan transisi π→π*
Untuk memungkinkan terjadinya transisi ini, maka molekul organik harus mempunyai gugus fungsional yang tidak jenuh sehingga ikatan rangkap dalam gugus tersebut memberikan orbital phi yang diperlukan. Jenis transisi ini merupakan transisi yang paling cocok untuk analisis dengan panjang gelombang 200-700 nm, dan panjang gelombang ini secara teknis dapat diaplikasikan pada spektrofotometer ultraviolet-visibel.
2.2.4 Hukum Lambert-Beer
Hukum Lambert-Beer menyatakan bahwa intensitas yang diteruskan oleh
larutan zat penyerap berbanding lurus dengan tebal dan konsentrasi larutan (Rohman, 2007). Hukum Lambert-Beer umumnya dikenal dengan persamaan sebagai berikut:
A = a.b.c (g/liter) atau A = ε.b.c (mol/liter) atau A = A11.b.c (g/100 ml) Keterangan: A = absorbansi c = konsentrasi
2.2.5 Kegunaan spektrofotometri ultraviolet-visibel
Metode spektrofotometri memiliki beberapa keuntungan antara lain kepekaan yang tinggi, ketelitian yang baik, mudah dilakukan, cepat pengerjaannya, dan dapat digunakan untuk menentukan senyawa campuran (Munson, 1984). Data spektrum ultraviolet-visibel secara tersendiri dapat digunakan untuk identifikasi kualitatif obat, tetapi sangat terbatas karena rentang daerah radiasi yang relatif sempit hanya dapat menghasilkan sedikit sekali puncak absorpsi. Penggunaan utama spektrofotometri ultraviolet-visibel adalah dalam analisis kuantitatif. Apabila dalam alur radiasi spektrofotometer terdapat senyawa yang mengabsorpsi radiasi, akan terjadi pengurangan kekuatan radiasi yang mencapai detektor (Satiadarma, dkk., 2004; Rohman, 2007).
2.3 Analisis Multikomponen dengan Spektrofotometri Ultraviolet-Visibel
Analisis kuantitatif campuran dua komponen merupakan teknik pengembangan analisis kuantitatif komponen tunggal. Prinsip pelaksanaannya adalah mencari absorban atau beda absorban tiap-tiap komponen yang memberikan korelasi yang linier terhadap konsentrasi, sehingga akan dapat dihitung masing-masing kadar campuran zat tersebut secara serentak atau salah satu komponen komponen dalam campurannya dengan komponen lainnya (Mulja dan Suharman, 1995).
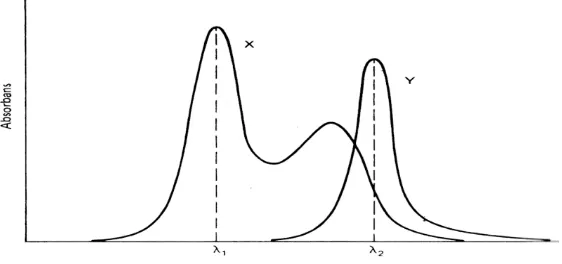
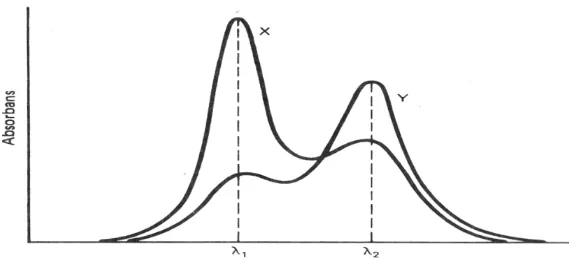
Menurut Day dan Underwood (1986), terdapat beberapa kemungkinan yang terjadi pada spektrum absorban dua komponen.
Kemungkinan I
λ1 dan λ2. Gambar spektrum absorban senyawa X dan Y dapat dilihat pada Gambar 2.7.
Gambar 2.7 Spektrum Absorban Senyawa X dan Y Kemungkinan II
Terjadi tumpang tindih satu cara dimana Y tidak mengganggu pengukuran X pada λ1, tetapi X mengganggu pengukuran Y karena X memang menyerap cukup banyak bersama-sama Y pada λ2. Spektrum absorban senyawa X dan Y, spektrum X bertumpang tindih pada spektrum Y dapat dilihat pada Gambar 2.8.
Gambar 2.8 Spektrum Absorban Senyawa X dan Y, Spektrum X Bertumpang Tindih pada Spektrum Y
Kemungkinan III
Gambar 2.9 Spektrum Absorban Senyawa X dan Y Saling Tumpang Tindih
Menurut Andrianto (2009), pada penetapan kadar campuran multikomponen sulit dilakukan, sehingga untuk mengatasi hal tersebut diperkenalkan analisis multikomponen menggunakan prinsip persamaan regresi berganda melalui perhitungan matriks dengan metode pengamatan beberapa panjang gelombang berganda (multiple wavelength).
2.4 Validasi Metode
Validasi metode adalah suatu proses yang menunjukkan bahwa prosedur analitik telah sesuai dengan penggunaan yang dikehendaki. Proses validasi metode untuk prosedur analitik dimulai dengan pengumpulan data validasi oleh pelaksana guna mendukung prosedur analitiknya (Bliesner, 2006).
Hasil validasi metode dapat digunakan untuk memutuskan kualitas, reabilitas, dan konsistensi dari hasil analisis (Huber, 2007). Adapun karakteristik dalam validasi metode menurut USP 30 NF 25 (2007) yaitu akurasi, presisi, spesifisitas, batas deteksi, batas kuantitasi, linieritas, rentang, dan kekasaran/ketahanan.
2.4.1 Akurasi
perolehan kembali (% recovery). Akurasi merupakan ukuran ketepatan prosedur analisis (Satiadarma, dkk., 2004).
2.4.2 Presisi
Presisi adalah ukuran keterulangan metode analisis, termasuk di antaranya kemampuan instrumen dalam melakukan hasil analisis yang reprodusibel. Presisi dinyatakan sebagai standar deviasi relatif atau koefisien variasi. Keterulangan dilakukan dengan cara menganalisis sampel yang sama oleh analis yang sama menggunakan instrumen yang sama dalam periode waktu yang singkat. Syarat koefisien variasi bernilai kurang dari 2% (Satiadarma, dkk., 2004).
2.4.3 Spesifisitas
Spesifisitas adalah suatu ukuran seberapa mampu metode tersebut mengukur analit saja dengan adanya senyawa-senyawa lain yang terkandung di dalam sampel (Watson, 2005). Secara umum, spesifisitas dapat ditunjukkan oleh minimalnya gangguan oleh senyawa lain terhadap hasil analisis. Pendekatan tidak langsung adalah lewat pengamatan karakteristik akurasi dari metode tersebut. Bila akurasi metode telah dapat diterima maka metode tersebut otomatis telah masuk kriteria sebagai metode yang spesifik (Ermer dan McB. Miller, 2005).
2.4.4 Batas deteksi dan batas kuantifikasi
Batas deteksi didefinisikan sebagai konsentrasi analit terendah dalam sampel yang masih dapat dideteksi, meskipun tidak dapat dikuantifikasi. Batas deteksi merupakan batas uji yang spesifik menyatakan apakah analit di atas atau di bawah nilai tertentu (Rohman, 2007). Menurut Harmita (2004), batas deteksi dapat dihitung dengan rumus sebagai berikut:
Batas kuantifikasi didefinisikan sebagai konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan presisi dan akurasi yang dapat diterima pada kondisi operasional metode yang digunakan (Rohman, 2007). Menurut Harmita (2004), batas kuantifikasi dapat dihitung dengan rumus sebagai berikut:
Batas kuantifikasi =
2.4.5 Linieritas
Linieritas menunjukkan kemampuan suatu metode analisis untuk memperoleh hasil pengujian yang sesuai dengan kisaran konsentrasi analit tertentu. Hal ini dapat dilakukan dengan cara membuat kurva kalibrasi dari beberapa set larutan baku yang telah diketahui konsentrasinya. Persamaan garis yang digunakan pada kurva kalibrasi diperoleh dari persamaan y = ax + b. Persaman ini akan menghasilkan koefisien korelasi (r). Koefisien korelasi inilah yang digunakan untuk mengetahui linieritas suatu metode analisis (Satiadarma, dkk., 2004).
2.4.6 Rentang
Rentang adalah interval antara batas konsentrasi tertinggi dan terendah analit yang terbukti dapat ditentukan menggunakan prosedur analisis, dengan presisi, akurasi, dan linieritas yang baik. Rentang biasanya dinyatakan dalam satuan yang sama dengan hasil uji (Satiadarma, dkk., 2004).
2.4.7 Kekasaran dan ketahanan