sma11kim Kimia AriHarnanto
Teks penuh
Gambar


Dokumen terkait
Grafik titrasi asam dan basa Siswa dapat menganalisis grafik hasil titrasi asam kuat dan basa kuat, asam kuat dan basa lermah, asam lemah dan basa kuat untuk menjelaskan larutan
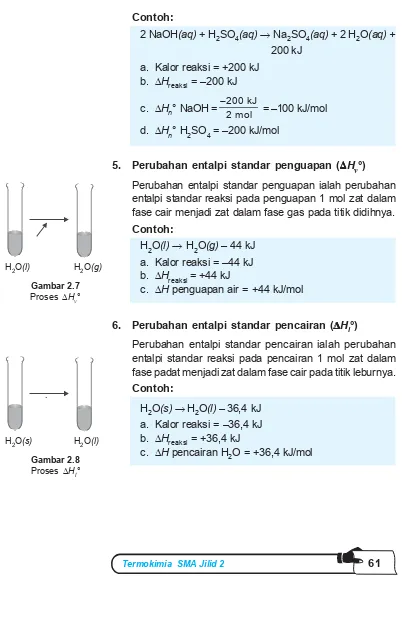
Pada titik ekivalen, semua asam telah berubah menjadi garam pH hidrolisis garam dari asam lemah dan basa kuat.. Setelah titik ekivalen, pH ditentukan oleh konsentrasi OH
Pada praktikum standardisasi HCl dengan Na 2 CO 3 , titrasi tersebut adalah titrasi antara basa kuat dan asam kuat.. Titik akhir titrasi ditentukan berdasarkan pada perubahan pH pada
Sebagai contoh, titrasi asam kuat dengan basa kuat yang sering digunakan adalah indikator fenolftalein karena pada keadaan basa akan memberikan warna merah jambu dan pada
Dalam titrasi ada pula yang tidak memerlukan indikator sebagai penunjuk titik akhir titrasi, hal ini memungkinkan karena zat asalnya yang berwarna dan memiliki perbedaan warna pada
Reaksi antara asam lemah dengan basa kuat menghasilkan molekul air (H2O) dan garam (yang bersifat basa); Titrasi berakhir dengan tercapainya titik ekivalen pada pH lebih dari
Perbedaan dari jenis titrasi di atas terletak pada titik akhir titrasi, dimana Jika titrasi dilakukan dengan asam maupun basa kuat yang juga merupakan elektrolit kuat maka
Titik ekivalen yaitu pH pada saat asam dan basa (titrant dan titer) tepat ekivalen atau secara stoikiometri tepat habis bereaksi. Titik ekuivalen titrasi ini dapat