SKRIPSI
PEMILIHAN BAHAN PENGAWET YANG SESUAI PADA PRODUK TAHU PUTIH
SIGIT JAYA SAPUTRA F24101071
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
PEMILIHAN BAHAN PENGAWET YANG SESUAI PADA PRODUK TAHU PUTIH
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh :
SIGIT JAYA SAPUTRA F24101071
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
PEMILIHAN BAHAN PENGAWET YANG SESUAI PADA PRODUK TAHU PUTIH
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
SIGIT JAYA SAPUTRA F24101071
Dilahirkan pada tanggal 08 Oktober 1983 Di Bekasi
Tanggal lulus : Menyetujui, Bogor, Februari 2006
Dr. Ir. Slamet Budijanto, M.Agr Dosen Pembimbing
Dr. Ir. Dahrul Syah, M.Sc Ketua Departemen ITP
Sigit Jaya Saputra. F24101071. Pemilihan Bahan Pengawet yang Sesuai pada Produk Tahu Putih. Di bawah bimbingan. Slamet Budijanto. 2006
RINGKASAN
Tahu merupakan salah satu bahan makanan yang mempunyai nilai gizi tinggi, terutama karena mutu protein dan daya cernanya yang tinggi. Akan tetapi tahu termasuk bahan pangan yang mudah rusak sehingga digolongkan dalam High Perisable Food. Berbagai upaya telah dilakukan untuk memperpanjang umur simpan tahu. Salah satu cara yang diterapkan adalah dengan merebus atau merendam tahu dalam air, dan mengusahakan tahu tetap dalam keadaan basah atau berair selama operasi penjualan. Upaya lain yang lebih banyak diterapkan oleh produsen maupun pengecer tahu ialah penggunaan bahan tambahan yang ilegal, seperti formalin.
Penelitian ini bertujuan untuk mencari pengawet yang tepat bagi produk tahu dalam rangka menggantikan formalin sebagai bahan pengawet pangan. Selain itu pula ditentukan konsentrasi yang tepat sehingga dapat memperpanjang umur simpan tahu dengan target 3 hari (72 jam).
Pada awal penelitian dilakukan seleksi terhadap pengawet yang akan digunakan dalam proses pengawetan tahu. Dari tahap seleksi awal pengawet didapat hasil bahwa hanya pengawet metil paraben, asam benzoat dan kalium sorbat yang mampu mempertahankan tahu dari kerusakan hingga mendekati 72 jam. Ketiga pengawet ini kemudian digunakan untuk mengawetkan tahu dengan konsentrasi 600 ppm, 800 ppm dan 1000 ppm. Pengawetan tahu dilakukan dengan cara tahu putih yang berukuran 4 x 4 x 2 cm3 dengan bobot ± 35 gram direndam dalam 150 ml larutan pengawet yang telah ditempatkan dalam gelas plastik. Analisis dilakukan selama dan setelah pengawetan yang meliputi analisis mikrobiologi (TPC), kimia (pH), dan organoleptik (hedonik dan different from control). Analisis mikrobiologi dan analisis pH dilakukan pada jam ke-0, 24, 48 dan 72 dengan dua kali ulangan. Sedangkan analisis organoleptik dilakukan setelah pengawetan selesai (72 jam) dengan menggunakan sampel tahu terbaik hasil analisis mikrobiologi dan analisis pH.
Berdasarkan analisis mikrobiologi dengan disertai pengujian statistika, didapat bahwa pengawet asam benzoat 1000 ppm dan metil paraben 1000 ppm dapat mereduksi pertumbuhan mikroba hingga jam ke-72. Namun dengan pertimbangan ekonomis penggunaan asam benzoat 1000 ppm lebih direkomendasikan. Nilai TPC untuk tahu putih dengan asam benzoat 1000 ppm pada jam ke-72 adalah 4.1 x 105 cfu/g. Berdasarkan analisis pH dengan disertai pengujian statistika, didapat bahwa pengawet asam benzoat 1000 ppm dan metil paraben 1000 ppm dapat menghambat peningkatan pH tahu putih hingga 72 jam. Namun dengan pertimbangan ekonomis penggunaan asam benzoat 1000 ppm lebih direkomendasikan. Nilai pH untuk tahu putih dengan asam benzoat 1000 ppm pada jam ke-72 adalah 4.35
Berdasarkan analisis organoleptik didapat bahwa tahu putih dengan pengawet asam benzoat 1000 ppm lebih disukai panelis. Hal ini terlihat dari hasil uji hedonik untuk parameter aroma dan tekstur, dimana panelis lebih menyukai tahu putih dengan pengawet asam benzoat 1000 ppm. Sedangkan untuk parameter
warna dan uji different from control panelis secara umum menyukai tahu putih yang telah mengalami proses pengawetan.
Dari hasil penelitian ini dapat disimpulkan bahwa pengawet asam benzoat dengan konsentrasi 1000 ppm memberikan hasil terbaik dalam mempertahankan umur simpan tahu putih selama 3 hari (72 jam). Hasil yang didapat ini diharapkan dapat mengurangi dan menggantikan penggunaan pengawet yang dilarang pada produk tahu putih. Untuk memperoleh tahu putih yang mempunyai umur simpan yang lama, selain penggunaan bahan pengawet pangan yang tepat perlu diperhatikan juga aspek sanitasi dalam proses pembuatan tahu putih. Selain itu, perlu dilakukan penelitian lebih lanjut untuk memperpanjang umur simpan tahu putih menggunakan bahan pengawet pangan dengan metode yang lain.
KATA PENGANTAR
Alhamdulillahirabbil’alamin. Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala Karunia, Hidayah dan Rahmat-Nya, sehingga penulis dapat menyelesaikan penelitiannya yang berjudul “Pemilihan Bahan Pengawet yang Sesuai pada Produk Tahu Putih”. Dalam penelitian dan penyusunan skripsi ini, penulis tidak terlepas dari bantuan dan doa dari berbagai pihak. Semoga Allah SWT membalas budi baik pihak-pihak yang senantiasa membimbing, membantu dan mendoakan penulis dalam menyelesaikan penelitian dan penyusunan skripsinya. Amin yaa rabbal alamin. Perkenankanlah penulis untuk mengucapkan ucapan terima kasih kepada :
1. Bapak dan Mamah, atas kasih sayang, doa, dorongan dan kesabaran yang tanpa batas kepada penulis selama menempuh pendidikan.
2. Dr. Ir. Slamet Budijanto, M.Agr., selaku dosen pembimbing yang telah memberikan arahan dan bimbingan kepada penulis selama perkuliahan, penelitian, dan penyusunan skripsi ini.
3. Dian Herawati, STP dan Antung Sima F., STP yang telah bersedia menjadi dosen penguji.
4. Keluarga tercinta; Mbak Endah, Mas Budi dan Safa atas doa, dorongan yang diberikan.
5. Dedeh Komariah, atas segala bantuan, dukunganmu dan kebersamaan yang indah selama ini.
6. Almira Rahmah Anggraini, Prista Vitali dan Fitria Kurniasih untuk kenangan yang pernah ada.
7. Ir. Soesarsono Wijandi, Msc. (alm) dan keluaraga atas segala bantuan dan dukungan selama ini.
8. Keluarga besar Soka 12, Kang Budi, Chamdani, Lilik, Wahono, Anto, dan Ono.
9. Kelompok C2, Maya, Nandang, Via dan Imam senang bekerja bersama kalian. 10. Sidiq, Yulin, Manong dan keluarga yang banyak membantu dalam penulisan
11. Teman-teman sebimbingan, Otem, Erik, Unyil, Pungki, Abah, Idhuy, Niko, Mbak Ambar, Maul, Abud, Malvin, Indri, Rahmat, Boss, Didin, Fahrul, Yoga, Christina, Dini, Rucitra, Irma dan Andal.
12. Rekan-rekan TPG 38 (Engkus, Bangun, Ibot, Acang, Ade, Fajri, Jalu, Anwar, ST, Daniel, Pitoy, Vica, Hans, Armi, Hesty, Bobby), TPG 37 (Acuy, Zuki, Tado, Ami dkk), TPG 36 (Gemi, Kheri, Fera), TPG 39 (Ajeng, Ulik, Deddy, Dadik, Tante, Ibu, Tissa dkk).
13. Teman-teman di lab, Derry, Intan, Sofyan, Bule, Umi, Vivin, Itin, Sanjung, Tantri, Mimi, Putri, Novi, Manda, Inggrid, Astri, Hendry, Phay, Fanny, Irus, Okta, Wanda, Wulan, Meli, Nia, Anita, Hadi, Lukman, Udin, Jamil.
14. Seluruh Staf, Laboran dan Teknisi TPG, Pak Koko, Pak Sidik, Pak Sobirin, Pak Wahid, Pak Gatot, Pak Solihin, Pak Yahya, Bu Rubiyah, Pak Rojak, Mas Edi, Teh Ida.
15. Semua pihak yang tidak dapat disebutkan satu persatu yang telah membantu penulis dalam menyelesaikan skripsi ini.
Semoga skripsi ini bermanfaat bagi pengembangan ilmu dan teknologi, khususnya di bidang teknologi pangan.
Bogor, Januari 2006
RIWAYAT HIDUP
Penulis dilahirkan di Bekasi, Jawa Barat pada tanggal 08 Oktober 1983 anak kedua dari dua bersaudara dari pasangan Bapak Supratiknyo dan Ibu Sri Paryanti. Penulis memiliki seorang kakak perempuan, Endah Wijayanti.
Penulis memulai pendidikan pada tahun 1988-1989 di TK PERKASA Jakarta Timur. Pada tahun 1989-1995, di Sekolah Dasar Negeri Jatinegara 02, Jakarta Timur. Pada tahun 1995 melanjutkan ke Sekolah Lanjutan Tingkat Pertama 90 Jakarta dan lulus pada tahun 1998. Pada tahun yang sama penulis melanjutkan ke Sekolah Menengah Umum Negeri 36 Jakarta dan lulus pada tahun 2001.
Pada tahun 2001 penulis diterima di Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB. Selain mengikuti kegiatan perkuliahan penulis juga aktif di berbagai organisasi seperti BEM FATETA dan HIMITEPA. Penulis juga aktif diberbagai kepanitiaan seperti panitia PERDANA PPAMB-IPB 2002, SMILE-F 2002, SPIRIT-F 2003, BAUR 2003, Olimpiade Mahasiswa IPB 2003, LCTIP XI, GELORA-F 2004 dan sebagainya.
Penulis juga pernah menjadi asisten praktikum Teknologi Penyimpanan Pangan, Teknologi Pengemasan Pangan, Analisis Pangan dan Evaluasi Nilai Biologis Pangan. Terakhir penulis melaksanakan kegiatan Tugas Akhir sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian, dengan judul “Pemilihan Bahan Pengawet yang Sesuai pada Produk Tahu Putih”, dibawah bimbingan Slamet Budijanto.
DAFTAR ISI
Halaman
KATAPENGANTAR ... iii
DAFTAR ISI ... v
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix I PENDAHULUAN ... A. LATAR BELAKANG ... B. TUJUAN PENELITIAN ... 1 1 3 II TINJAUAN PUSTAKA ...
A. TAHU DAN PROSES PENGOLAHANNYA ... Tahu ...
Proses Pengolahan Tahu ... Pencucian dan Perendaman ... Penggilingan ... Pemasakan ... Penyaringan dan Ekstraksi Susu Kedelai ... Penggumpalan ... Pemisahan ”whey” ... Pencetakan dan Pengepresan ...
B. BAHAN PENGAWET ... Parabens ... Asam Benzoat ... Kalium Sorbat ... C. KERUSAKAN TAHU ... 4 4 4 6 6 6 6 7 7 8 8 10 12 13 15 18 III BAHAN DAN METODE ...
A. BAHAN DAN ALAT ... B. METODE PENELITIAN ... 1. Pemilihan Pengawet Proses Pengawetan ...
19 19 19 19
2. Analisis ... a. Analisis Mikrobiologi ... b. Analisis pH ... c. Analisis Organoleptik ... 3. Rancangan Percobaan dan Analisis Data ... a. Rancangan Percobaan ... b. Analisis Data ... 20 21 21 22 22 22 23 IV HASIL DAN PEMBAHASAN ...
A. PEMILIHAN PENGAWET ... B. PROSES PENGAWETAN TAHU PUTIH ...
1. Analisis Mikrobiologi ... 2. Analisis pH ... 3. Analisis Organoleptik ... a. Warna ... b. Aroma ... c. Tekstur ... d. Uji Different from Control ...
24 24 25 26 31 36 37 38 39 40 V KESIMPULAN DAN SARAN ...
A. KESIMPULAN ... B. SARAN ... 42 42 42 DAFTAR PUSTAKA ... 43 LAMPIRAN ... 46
DAFTAR TABEL Halaman Tabel 1 Tabel 2 Tabel 3 Tabel 4 Tabel 5 Tabel 6 Tabel 7 Tabel 8 Tabel 9
Komposisi kimia dalam 100 gram tahu... Syarat mutu tahu ... Pengaruh pH pada penguraian asam benzoat ... Pengaruh pH pada penguraian asam sorbat ... Pengawet yang digunakan pada tahu putih dan alasan penggunaan ... Respon panelis terhadap warna tahu putih yang telah diawetkan ... Respon panelis terhadap aroma tahu putih yang telah diawetkan ... Respon panelis terhadap tekstur tahu putih yang telah diawetkan ... Respon panelis terhadap perbedaan tahu putih yang telah diawetkan dengan kontrol yang tidak diawetkan ...
5 5 14 17 24 37 38 39 41
DAFTAR GAMBAR Halaman Gambar 1 Gambar 2 Gambar 3 Gambar 4 Gambar 5 Gambar 6 Gambar 7 Gambar 8 Gambar 9 Gambar 10 Gambar 11 Gambar 12 Gambar 13 Gambar 14 Gambar 15 Gambar 16 Gambar 17 Gambar 18
Skema pembuatan tahu secara umum ... Rumus struktur metil paraben dan propil paraben ... Rumus struktur asam benzoat ... Rumus struktur kalium sorbat ... Tahu putih yang direndam pengawet ... Tahu putih yang telah diawetkan ... Grafik Total Plate Count (TPC) tahu putih dengan pengawet metil paraben ... Grafik Total Plate Count (TPC) tahu putih dengan pengawet asam benzoat ... Grafik Total Plate Count (TPC) tahu putih dengan pengawet kalium sorbat ... Plot pengaruh lama penyimpanan, jenis pengawet dan konsentrasi pengawet terhadap jumlah mikroba (ln cfu/g) ... Histogram pH larutan pengawet metil paraben ... Histogram pH tahu putih dengan pengawet metil paraben .... Histogram pH larutan pengawet asam benzoat ... Histogram pH tahu putih dengan pengawet asam benzoat .... Histogram pH larutan pengawet kalium sorbat ... Histogram pH tahu putih dengan pengawet kalium sorbat .... Plot pengaruh jenis pengawet, lama penyimpanan dan konsentrasi pengawet terhadap nilai pH larutan pengawet ... Plot pengaruh jenis pengawet, lama penyimpanan dan konsentrasi pengawet terhadap nilai pH tahu putih yang direndam larutan pengawet ...
9 12 14 16 25 25 26 27 28 29 31 31 32 32 33 33 34 35
DAFTAR LAMPIRAN Halaman Lampiran 1 Lampiran 2 Lampiran 3 Lampiran 4 Lampiran 5 Lampiran 6 Lampiran 7 Lampiran 8 Lampiran 9 Lampiran 10 Lampiran 11 Lampiran 12 Lampiran 13 Lampiran 14 Lampiran 15
Hasil analisis TPC tahu putih dengan pengawet metil paraben 600 ppm ... Hasil analisis TPC tahu putih dengan pengawet metil paraben 800 ppm ... Hasil analisis TPC tahu putih dengan pengawet metil paraben 1000 ppm ... Hasil analisis TPC tahu putih dengan pengawet asam benzoat 600 ppm ... Hasil analisis TPC tahu putih dengan pengawet asam benzoat 800 ppm ... Hasil analisis TPC tahu putih dengan pengawet asam benzoat 1000 ppm ... Hasil analisis TPC tahu putih dengan pengawet kalium sorbat 600 ppm ... Hasil analisis TPC tahu putih dengan pengawet kalium sorbat 800 ppm ... Hasil analisis TPC tahu putih dengan pengawet kalium sorbat 1000 ppm ... Uji lanjut lama penyimpanan terhadap jumlah mikroba ... Uji lanjut jenis pengawet terhadap jumlah mikroba ... Uji lanjut konsentrasi pengawet terhadap jumlah mikroba Hasil pengukuran pH tahu putih dan larutan dengan pengawet metil paraben ... Hasil pengukuran pH tahu putih dan larutan dengan pengawet asam benzoat ... Hasil pengukuran pH tahu putih dan larutan dengan pengawet kalium sorbat ...
46 46 47 47 48 48 49 50 51 52 52 53 54 55 56
Lampiran 16 Lampiran 17 Lampiran 18 Lampiran 19 Lampiran 20 Lampiran 21 Lampiran 22 Lampiran 23 Lampiran 24 Lampiran 25 Lampiran 26 Lampiran 27 Lampiran 28 Lampiran 29 Lampiran 30 Lampiran 31
Uji lanjut jenis pengawet terhadap nilai pH larutan pengawet ... Uji lanjut jenis pengawet terhadap nilai pH tahu putih yang direndam pengawet ... Uji lanjut lama penyimpanan terhadap nilai pH larutan pengawet ... Uji lanjut lama penyimpanan terhadap nilai pH tahu putih yang direndam pengawet ... Uji lanjut konsentrasi pengawet terhadap nilai pH larutan pengawet ... Uji lanjut konsentrasi pengawet terhadap nilai pH tahu putih yang direndam pengawet ... Form kuisioner uji hedonik ... Form kuisioner uji different from control ... Hasil uji hedonik warna tahu putih ... Analisis sidik ragam parameter warna tahu putih ... Hasil uji hedonik aroma tahu putih ... Analisis sidik ragam parameter aroma tahu putih ... Hasil uji hedonik tekstur tahu putih ... Analisis sidik ragam parameter tekstur tahu putih ... Hasil uji different from control tahu putih ... Analisis sidik ragam different from control test ...
57 57 58 59 60 60 61 62 63 63 64 65 66 67 68 69
I. PENDAHULUAN
A. LATAR BELAKANG
Pangan merupakan salah satu kebutuhan dasar hidup manusia. Selain lezat dan bergizi tinggi, pangan yang dikonsumsi harus aman. Karena itu, untuk menghindarkan masyarakat dari jenis pangan yang tidak aman dikonsumsi atau berbahaya bagi kesehatan perlu diadakan usaha untuk menjamin keamanan pangan.
Di negara-negara sedang berkembang termasuk Indonesia, masih dijumpai permasalahan produk pangan yang tidak mematuhi syarat keamanan pangan. Rendahnya kesadaran masyarakat akan keamanan pangan tercermin dari masih banyaknya proses pengolahan dan upaya memperpanjang umur simpannya yang tidak sesuai. Salah satu contohnya adalah proses memperpanjang umur simpan pada produk tahu putih.
Tahu merupakan salah satu bahan makanan yang mempunyai nilai gizi tinggi, terutama karena mutu protein dan daya cernanya yang tinggi. Akan tetapi tahu termasuk bahan pangan yang mudah rusak sehingga digolongkan dalam High Perisable Food. Penyebab utama kerusakan tahu adalah sebagai akibat dari aktivitas mikroorganisme, terutama golongan bakteri yang mengkontaminasi selama proses pembuatan, penyimpanan dan distribusi pemasarannya. Jenis tahu yang paling mudah mengalami kerusakan ialah tahu putih. Hal ini disebabkan karena selama dan setelah pengolahan tidak ada proses termal tambahan seperti yang dilakukan pada jenis tahu lainnya. Proses termal tambahan ini dapat berupa perebusan tahu dengan kunyit dan garam (tahu kuning), perebusan kedelai sebelum digiling (tahu cina) dan sterilisasi (tahu sutra).
Berbagai upaya telah dilakukan untuk memperpanjang umur simpan tahu. Salah satu cara yang diterapkan secara luas untuk mempertahankan kesegaran tahu oleh pengusaha dan pengecer tahu di Indonesia adalah dengan merebus atau merendam tahu dalam air, dan mengusahakan tahu tetap dalam keadaan basah atau berair selama operasi penjualan. Meskipun cara ini sudah
operasi penjualannya, aspek mikrobiologis yang berkaitan dengan keamanan konsumen masih perlu dipertimbangkan, apalagi cara-cara ini sangat tergantung pada mutu mikrobiologi air yang digunakan.
Upaya lain yang lebih banyak diterapkan oleh produsen maupun pengecer tahu ialah penggunaan bahan tambahan yang ilegal, seperti formalin. Penggunaan formalin sebagai bahan pengawet untuk bahan pangan adalah satu hal yang sangat membahayakan. Hal ini dikarenakan formalin bukan merupakan bahan tambahan pangan sehingga akan memberikan dampak yang merugikan apabila dikonsumsi oleh tubuh.
Penggunaan formalin pada produk tahu sudah berlangsung lama, hal ini dapat dilihat dari hasil penelitian Mena (1994) yang menunjukkan bahwa tahu yang beredar di pasar tradisional Jakarta, 70% mengandung formalin dengan kadar berkisar antara 4.08-85.96 ppm. Untajana et al. (1996) memberitahukan bahwa hampir semua jenis tahu yang meliputi tahu cina, tahu biasa dan tahu kuning yang dijual di pasar tradisional dan swalayan di kotamadya Bogor juga menggunakan pengawet formalin dengan kandungan tertinggi pada tahu cina yaitu 805 ppb dan terendah 1 ppb terdapat pada tahu kuning. Selain itu di kota Tangerang, dari 20 industri yang diteliti, yang terdiri dari 11 industri tahu kuning dan 9 industri tahu putih diketahui bahwa seluruh tahu mengandung formalin dengan kandungan formalin tertinggi ditemukan pada tahu putih yaitu 42.44 ppm dan terendah pada tahu kuning dengan hasil 3.79 ppm (Tresniani, 2003). Badan Pengawas Obat dan Makanan mengungkapkan formalin banyak digunakan pada mie basah, tahu, dan ikan. Penelitian Badan POM terhadap 700 sampel produk yang diambil dari Jawa, Sulawesi, dan Lampung pada bulan Desember 2005 menunjukkan bahwa 56% produk itu mengandung formalin (Tempo, 23/12/05).
Berdasarkan data diatas, perlu dilakukan usaha mengganti formalin dengan bahan pengawet yang diijinkan. Pengawet tersebut haruslah sesuai dengan karakteristik tahu sebagai bahan pangan yang akan diawetkan. Dengan demikian diharapkan penggunaan formalin sebagai pengawet tahu dapat dihindari dan digantikan dengan pengawet lain yang diijinkan.
B. TUJUAN PENELITIAN
Penelitian ini bertujuan untuk mencari pengawet yang tepat bagi produk tahu khususnya tahu putih dalam rangka menggantikan formalin sebagai bahan pengawet pangan. Selain itu pula ditentukan konsentrasi yang tepat sehingga dapat memperpanjang umur simpan tahu putih dengan target 3 hari (72 jam).
II. TINJAUAN PUSTAKA
A. TAHU DAN PROSES PENGOLAHANNYA
1. Tahu
Tahu merupakan produk kedelai nonfermentasi yang disukai dan digemari di Indonesia seperti halnya tempe, kecap dan tauco. Tahu adalah salah satu produk olahan kedelai yang berasal dari daratan Cina. Pembuatan tahu dan susu kedelai ditemukan oleh Liu An pada zaman pemerintahan Dinasti Han, kira-kira 164 tahun sebelum Masehi (Shurtleff dan Aoyagi, 1975).
Kata tahu berasal dari bahasa Cina yaitu tao-hu, teu-hu/tokwa. Kata tao/teu berarti kacang untuk membuat tahu, orang menggunakan kacang kedelai kuning (putih) yang disebut wong-teu (wong = kuning). Hu/kwa itu artinya rusak, lumat, hancur menjadi bubur. Kedua istilah itu digabungkan menjadi tahu. Pengertian tahu adalah makanan yang terbuat dari kedelai yang dilumatkan atau dihancurkan menjadi bubur (Kastyanto, 1999).
Tahu adalah suatu produk makanan berupa padatan lunak yang dibuat melalui proses pengolahan kedelai (Glycine species) dengan cara pengendapan proteinnya, dengan atau tidak ditambah bahan lain yang diizinkan (SNI, 1998). Sedangkan menurut Shurtleff dan Aoyagi (1975), tahu adalah gumpalan protein dari susu kedelai yang telah dipisahkan dari bagian yang tidak menggumpal (whey) dengan cara pengepresan.
Tahu terdiri dari berbagai jenis, yaitu tahu putih, tahu kuning, tahu sutra, tahu cina, tahu keras, dan tahu kori (Sarwono dan Saragih, 2004). Perbedaan dari berbagai jenis tahu tersebut ialah pada proses pengolahannya dan jenis penggumpal yang digunakan.
Komposisi zat gizi dalam tahu cukup baik. Tahu mempunyai kadar protein sebesar 8-12%, sedangkan mutu proteinnya yang dinyatakan sebagai NPU sebesar 65% (Shurtleff dan Aoyagi, 1975). Tahu juga mempunyai daya cerna yang sangat tinggi karena serat dan karbohidrat yang bersifat
larut dalam air sebagian besar terbuang pada proses pembuatannya. Dengan daya cerna sekitar 95%, tahu dapat dikonsumsi dengan aman oleh semua golongan umur dari bayi hingga orang dewasa, termasuk orang yang mengalami gangguan pencernaan (Shurtleff dan Aoyagi, 1975). Komposisi kimia pada tahu dapat dilihat pada Tabel 1., sedangkan syarat mutu tahu berdasarkan Standar Industri Indonesia SII No. 0270-1990 dapat dilihat pada Tabel 2.
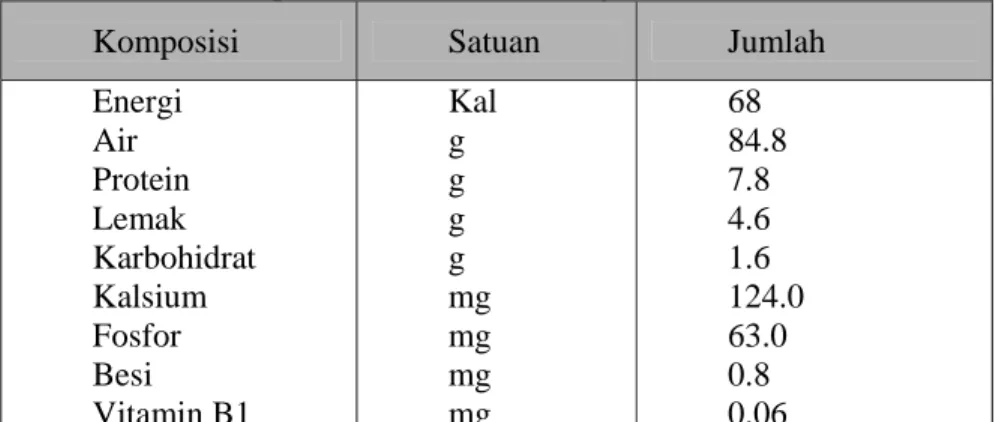
Tabel 1. Komposisi kimia dalam 100 gram tahu *
Komposisi Satuan Jumlah
Energi Air Protein Lemak Karbohidrat Kalsium Fosfor Besi Vitamin B1 Kal g g g g mg mg mg mg 68 84.8 7.8 4.6 1.6 124.0 63.0 0.8 0.06 * Direktorat Gizi, Depkes RI (1981)
Tabel 2. Syarat mutu tahu*
No. Jenis uji Persyaratan 1. 1.1 1.2 1.3 1.4 2. 3. 4. 5. 6. 7. 7.1 7.2 7.3 Keadaan : Bau Rasa Warna Penampakan Abu Protein (N x 6.25) Lemak Serat kasar
Bahan tambahan makanan
Cemaran mikroba : Angka lempeng Total E. coli
Salmonella
Normal Normal
Putih normal atau kuning normal Normal tidak berlendir dan tidak berjamur
Maks. 1.0 % (b/b) Min 9.0 % (b/b) Min 0.5 % (b/b) Maks 0.1 % (b/b)
Sesuai SNI 01-0222-1995 dan Peraturan Menteri Kesehatan No. 722/MenKes/Per/IX/1988 Maks. 1.0 x 106 (koloni/g) Negatif /25 g (APM/g) Negatif (/25g)
2. Proses Pengolahan Tahu
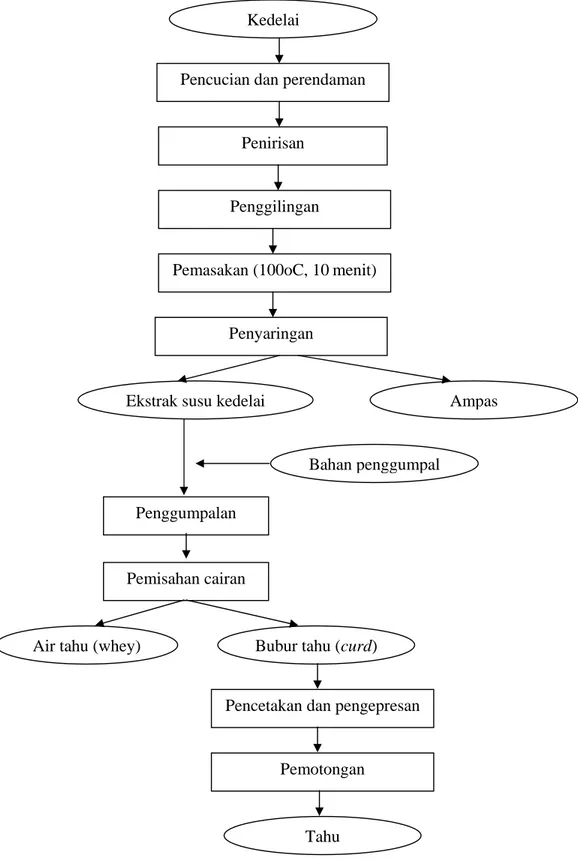
Pembuatan tahu dibagi menjadi dua bagian utama, yaitu (1) pembuatan susu kedelai dan (2) koagulasi atau penggumpalan protein susu kedelai sehingga dihasilkan curd yang kemudian dipres dan dicetak menjadi tahu (Shurtleff dan Aoyagi, 1979). Diagram pembuatan tahu dapat dilihat pada Gambar 1. Berikut ini dijelaskan tahapan proses pembuatan tahu.
a. Pencucian dan Perendaman
Kedelai dicuci berulang kali dengan menggunakan air bersih untuk menghilangkan debu dan kotoran dari kacang kedelai. Proses selanjutnya dilakukan perendaman yang bertujuan untuk melunakkan struktur selulernya sehingga mempermudah dan mempercepat penggilingan. Biasanya kedelai direndam dalam air sebanyak 3 kali beratnya sampai bobotnya menjadi sekitar 2.2 kali bobot kedelai kering. Lama perendaman kedelai antara 8-12 jam (Shurtleff dan Aoyagi, 1979).
b. Penggilingan
Kedelai yang telah bersih dan ditiriskan lalu digiling dengan disertai penambahan air kira-kira 1-1,5 kali berat kedelai basah (berat setelah direndam). Tujuan penggilingan adalah untuk memperkecil ukuran partikel sehingga dapat mengurangi waktu pemasakan dan memberikan fasilitas untuk melakukan ekstraksi susu kedelai (Shurtleff dan Aoyagi, 1979).
c. Pemasakan
Kedelai yang telah digiling kemudian dimasak. Menurut Shurtleff dan Aoyagi (1979), pemasakan ini dimaksudkan untuk menginaktifasi trypsin inhibitor, meningkatkan nilai gizi dan kualitas kedelai, mengurangi rasa mentah dan beany pada susu kedelai, menambah keawetan produk akhir, dan merubah sifat protein kacang
kedelai sehingga mudah dikoagulasikan. Pemasakan dilakukan pada suhu 100oC selama 10-15 menit (Sarwono dan Saragih, 2004). Pada saat pemasakan bubur kedelai ditambahkan air untuk memperoleh rendemen yang baik. Penggunaan jumlah air dalam pemasakan perlu diperhatikan, dimana air yang terlalu sedikit akan menyebabkan sari kedelai yang terekstrak juga sedikit, sedangkan air yang terlalu banyak akan membuat energi dan waktu untuk ekstraksi sari kedelai semakin besar. Perbandingan berat kedelai kering dan air yang baik adalah sebesar 1:10 (Shurtleff dan Aoyagi, 1979). Selama proses pemasakan dilakukan pengadukan secara kontinyu untuk mencegah terjadinya kegosongan.
d. Penyaringan dan Ekstraksi Susu Kedelai
Bubur kedelai disaring dengan penyaring yang umum digunakan oleh pengusaha tahu, yaitu penyaring kain blacu berwarna putih. Hasil penyaringan ini adalah ekstrak susu kedelai, sedangkan ampas akan tertinggal dalam kain penyaring. Untuk mendapatkan sari kedelai yang lebih banyak, ampas dapat dicuci kemudian disaring kembali.
e. Penggumpalan
Setelah penyaringan adalah pengendapan susu kedelai dengan menambahkan penggumpal. Proses penggumpalan protein susu kedelai ini merupakan tahapan yang paling menentukan sifat fisik dan organoleptik tahu yakni jenis dan jumlah bahan penggumpal serta suhu susu kedelai pada saat penggumpalan (Shurtleff dan Aoyagi, 1975). Penggumpalan dilakukan pada saat suhu susu kedelai berkisar 70-90oC. (Sarwono dan Saragih, 2004).
Ada berbagai jenis penggumpal yang biasa digunakan dalam pembuatan tahu. Perbedaan penggumpal akan menghasilkan tahu dengan jenis dan karakteristik yang berbeda. Sebagai contoh, dalam pembuatan tahu putih di Indonesia, pengerajin tahu lebih banyak
menggunakan air tahu (whey) yang telah didiamkan semalam sebagai penggumpal. Sedangkan untuk pembuatan tahu sutra, biasa digunakan GDL (Glucone Delta Lactone) sebagai penggumpal (Sarwono dan Saragih, 2004). Selama proses penggumpalan perlu pengadukan secara perlahan-lahan dengan arah yang tetap Pengadukan dihentikan jika sudah terbentuk gumpalan.
f. Pemisahan whey
Setelah gumpalan (curd) terbentuk dilakukan pengendapan hingga gumpalan turun ke bawah. Pengendapan ini bertujuan untuk mempermudah pemisahan cairan dengan curd. Cairan (whey) kemudian dipisahkan dari endapan agar proses pencetakan dapat dilakukan dengan mudah dan tahu yang dihasilkan mempunyai konsistensi yang lebih baik (Sarwono dan Saragih, 2004).
g. Pencetakan dan Pengepresan
Gumpalan yang terbentuk selanjutnya dicetak dengan memasukkannya ke dalam cetakan yang telah dialasi kain blacu berwarna putih, lalu bagian atas juga ditutup dengan kain serupa , dan papan. Diatas papan selanjutnya diletakkan pemberat hingga air tahu menetes habis dan terbentuklah tahu cetak.
Kedelai
Pencucian dan perendaman
Penirisan
Penggilingan
Pemasakan (100oC, 10menit)
Penyaringan
Ekstrak susu kedelai Ampas
Bahan penggumpal Penggumpalan
Pemisahan cairan
Pencetakan dan pengepresan Air tahu (whey) Bubur tahu (curd)
Pemotongan
Tahu
B. BAHAN PENGAWET
Zat Aditif bahan pangan menurut Komite Gabungan Ahli FAO (Food and Agriculture Organization) dan WHO (World Health Organization) merupakan suatu substansi bukan gizi yang ditambahkan ke dalam bahan pangan dengan sengaja, yang pada umumnya dalam jumlah kecil, untuk memperbaiki penampakan, cita rasa, tekstur atau sifat-sifat penyimpanannya (Desrosier, 1988). Zat aditif yang banyak digunakan dalam kehidupan sehari-hari ialah bahan pengawet kimia.
Menurut Buckle et al. (1987), bahan-bahan pengawet kimia adalah salah satu kelompok dari sejumlah besar bahan-bahan kimia yang baik ditambahkan dengan sengaja kedalam bahan pangan atau ada dalam bahan pangan sebagai akibat dari perlakuan prapengolahan, pengolahan atau penyimpanan. Pengawet kimia didefenisikan oleh FDA (Food and Drug Administration) sebagai semua bahan kimia yang bila ditambahkan pada pangan cenderung untuk mencegah atau menghambat kerusakan
(deteriorasi), tetapi tidak termasuk garam dapur, gula, rempah atau minyak yang diekstrak dari rempah, bahan yang ditambahan pada makanan dengan pemaparan secara langsung terhadap asap kayu atau bahan-bahan kimia yang diaplikasikan untuk kemampuan inseksidal atau herbisidalnya (Desrosier, 1988).
Pengawet adalah bahan tambahan pangan yang dapat mencegah atau menghambat fermentasi, pengasam, dan peruraian lain terhadap pangan yang disebabkan oleh mikroorganisme (Winarno dan Rahayu, 1994). Bahan tambahan pangan ini biasanya ditambahkan ke dalam pangan yang mudah rusak, atau pangan yang disukai sebagai medium tumbuhnya bakteri atau kapang. Pertumbuhan bakteri dicegah atau dihambat tergantung dari jumlah pengawet yang ditambahkan dan juga pH atau keasaman dari pangan.
Pengawet digunakan untuk mencegah atau menghambat kerusakan kimia maupun biologis makanan. Bahan aditif yang digunakan untuk mencegah kerusakan biologis disebut antimikroba (Davidson dan Branen, 1993). Zat anti mikroba adalah senyawa biologis atau kimia yang dapat menghambat pertumbuhan dan aktivitas mikroba (Pelczar dan Reid, 1972).
Zat anti mikroba dapat bersifat bakterisidal (membunuh bakteri), bakteriostatik (menghambat pertumbuhan bakteri), fungisidal (membunuh kapang), fungistatik (menghambat pertumbuhan kapang), germisidal
(menghambat germinasi spora bakteri), dan lain sebagainya (Fardiaz, 1992). Umumnya bahan pengawet yang dipakai dalam bahan makanan hanya bersifat bakteriostatik. Menurut Pelczar dan Reid (1972), mekanisme penghambatan pertumbuhan mikroba oleh senyawa anti mikroba adalah sebagai berikut : (1) merusak dinding sel sehingga menyebabkan lisis dan menghambat sintesis
komponen selnya
(2) mengganggu permeabilitas membran sitoplasma sehingga terjadi kebocoran zat nutrisi dalam sel
(3) denaturasi protein
(4) merusak sistem metabolisme dalam sel dengan cara menghambat kerja enzim intraseluler
Menurut Frazier dan Westhoff (1988), ada beberapa faktor yang mempengaruhi efektivitas mekanisme senyawa anti mikroba yaitu: (1) jenis, jumlah, umur, dan keadaan mikroba
(2) konsentrasi zat anti mikroba (3) suhu dan waktu kontak
(4) sifat fisiko kimia substrat seperti pH, kadar air, tegangan permukaan, jenis dan jumlah komponen yang ada dan sebagainya
Seleksi penggunaan antimikroba yang tepat tergantung pada beberapa faktor, termasuk zat antimikroba dan zat kimia yang terkandung, komposisi produk pangan, sistem pengawetan selain bahan kimia yang digunakan pada produk, tipe, karateristik dan jumlah mikroorganisme, keamanan antimikroba dan efektivitas biaya penggunaan antimikroba. Bahan pengawet kimia yang digunakan pada penelitian ini adalah parabens, asam benzoat dan kalium sorbat. Berikut akan dijelaskan mengenai sifat dan karakteritik dari ketiga jenis pengawet tersebut.
1. Parabens
Alkil (metil, etil, propil, butil, dan heptil) ester dari asam p-hidroksi benzoat dikenal sebagai paraben. Dibanyak negara, tiga komponen fenolik, metil, propil, dan heptil ester dari asam p-hidroksibenzoat (paraben) diizinkan untuk ditambahkan langsung pada makanan sebagai antimikroba (Davidson, 1993). Paraben bersifat tidak berwarna, tidak berbau (kecuali metil paraben), tidak berasa, relatif tidak higroskopik, dan bukan merupakan komponen volatil (Davidson dan Juneja, 1990). Paraben biasa dipasarkan dalam bentuk bubuk putih (Davidson, 1993). Salah satu bentuk paraben yang banyak dijual di pasaran adalah metil paraben atau lebih dikenal dengan nama dagang nipagin. Nipagin biasa dijual dengan harga cukup mahal yaitu sekitar Rp 100.000/kg. Rumus struktur paraben dapat dilihat pada Gambar 2.
Gambar 2. Rumus struktur metil paraben (A) dan propil paraben (B)
Ester dari asam p-hidroksibenzoat memiliki spektrum aktivitas anti mikroba yang luas. Paraben memiliki nilai pKa yang tinggi yaitu sebesar 8.5 (Booth dan Kroll, 1989). Paraben efektif pada kondisi pH asam maupun basa (Davidson dan Juneja, 1990). Menurut Davidson (1993), paraben efektif pada pH 3-8. Dibandingkan dengan kelemahan asam sebagai pengawet, paraben efektif secara signifikan pada konsentrasi yang lebih rendah (Eklund, 1985).
Alkil ester dari paraben sebagian besar tidak terdisosiasi sempurna pada kondisi netral (Booth dan Kroll, 1989). Aktivitas penghambatan paraben tidak tergantung pada pH, walaupun beberapa paraben aktivitas penghambat pertumbuhannya meningkat pada pH yang lebih rendah
(Eklund, 1985). Aktivitasnya semakin tinggi dengan meningkatnya panjang rantai alkil esternya tetapi kelarutannya menurun (Booth dan Kroll, 1989).
Menurut Davidson dan Juneja (1990), mekanisme penghambatan mikroba oleh paraben ialah pengaruh yang diberikan pada membran sitoplasma dari mikroba. Paraben mampu menghambat trasport membran dan sistem transport elektron. Paraben juga berpengaruh langsung pada sintesis RNA, DNA dan protein (Eklund, 1985).
Penggunaan paraben sebagai tambahan makanan diperbolehkan dengan batas maksimal penambahan 0.1 % (Davidson dan Juneja, 1990). Menurut Departemen Kesehatan RI (1988), kadar penggunaan metil paraben yang diijinkan adalah 0.1 g/kg untuk kecap, minuman ringan, acar ketimun dalam botol, margarin, padatan sari nanas, dan saus tomat. Paraben memiliki bahaya keracunan yang rendah. Paraben dengan cepat dapat dihidrolisis di hati dan ginjal menjadi asam p-hidoksihipurat kemudian diekskresikan melalui urin (Davidson dan Juneja, 1990). Konsumsi paraben berlebih akan menyebabkan penumpukan asam p-hidoksihipurat di hati dan ginjal sehingga kondisinya menjadi asam (Davidson, 1993).
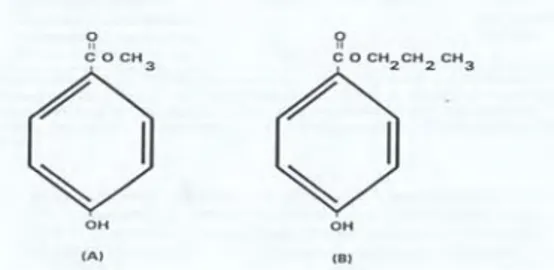
2. Asam Benzoat
Asam benzoat dengan rumus empiris C7H6O2 merupakan padatan berupa kristal putih yang umum digunakan sebagai antimikroba. Asam benzoat terbentuk secara alami pada kranberri (Desrosier, 1988), cengkeh dan kayu manis (Winarno, 1997). Asam benzoat dan garam-garamnya dan derivat-derivatnya adalah suatu kelompok zat pengawet kimia yang sudah digunakan secara luas dan sering digunakan pada makanan yang asam (Winarno, 1997). Asam benzoat biasa dijual dengan harga yang cukup murah yaitu sekitar Rp 17.000/kg. Rumus struktur asam benzoat dapat dilihat pada Gambar 3.
Gambar 3. Rumus struktur asam benzoat
Asam benzoat lebih efektif terhadap kamir dan bakteri daripada kapang dan pada konsentrasi diatas 25 mg/l asam yang tidak terurai akan menghambat pertumbuhan kapang (Buckle et al., 1987). Benzoat efektif pada pH 2.5-4.0 (Winarno, 1997). Menurut Desrosier (1988), benzoat kurang efektif dalam suatu bahan pangan yang mempunyai pH 7.0 dibandingkan dengan bahan pangan asam yang mempunyai pH mendekati 3.0.
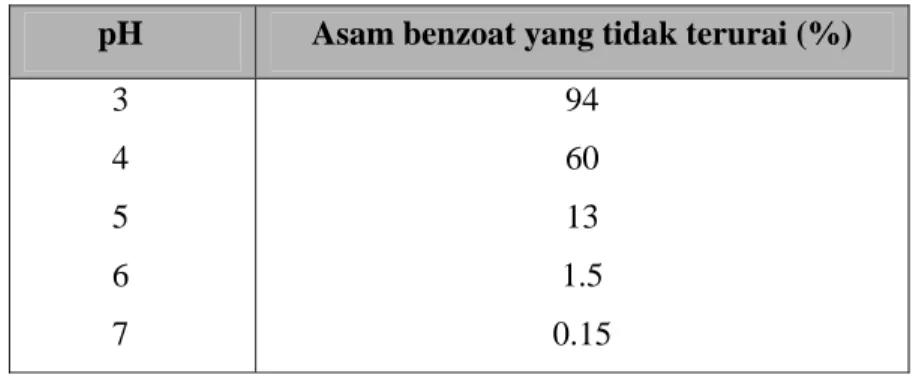
Asam benzoat banyak beredar dalam bentuk garam-garamnya seperti natrium benzoat, kalium benzoat dan amonium benzoat. Garam natrium dan amonium benzoat dapat digunakan, akan tetapi molekul-molekul asam benzoat itu sendiri yang mempunyai sifat yang mematikan Molekul-molekul yang tidak mengalami disosiasi diduga merupakan komponen yang aktif (Desrosier, 1988). Jumlah komponen asam benzoat yang tidak berdisosiasi ini tergantung pada tingkat pH bahan pangan yang bersangkutan. Pengaruh pH pada penguraian asam benzoat dapat dilihat pada Tabel 3.
Tabel 3. Pengaruh pH pada penguraian asam benzoat*
pH Asam benzoat yang tidak terurai (%) 3 4 5 6 7 94 60 13 1.5 0.15 * (Buckle et al., 1987)
Pada umumnya aktivitas germisidal dari asam benzoat meningkat menjadi 10 kali dalam substrat yang mempunyai pH rendah daripada substrat yang mempunyai pH tinggi. Bahkan dalam suatu bahan pangan yang sangat asam daya mematikannya berada pada tingkatan 100 kali lebih efektif daripada dalam bahan pangan yang sedikit alkalis (Desrosier, 1988).
Sebagai pengawet pada makanan, ada beberapa keuntungan penggunaan asam benzoat yaitu tidak berwarna dan mudah larut dalam produk. Asam benzoat harus digunakan dengan konsentrasi serendah mungkin untuk menghindari kemungkinan terjadi penyimpangan flavor (off-flavor) pada produk. Kadar penggunaan asam benzoat yang diijinkan adalah 0.1 g/kg untuk makanan lain selain kecap, minuman ringan, acar ketimun dalam botol, margarin, padatan sari nanas, dan saus tomat (Departemen Kesehatan RI, 1988). Sedangkan menurut SNI (1995), untuk makanan yang disebutkan diatas dan makanan lain batas penggunaan maksimum adalah 1 g/kg.
Asam benzoat memiliki bahaya keracunan yang rendah karena dalam tubuh manusia sudah ada mekanisme detoksifikasi benzoat. Asam benzoat akan berkonjugasi dengan glisin didalam ginjal membentuk asam hipurat yang kemudian diekskresikan melalui urin (Davidson dan Juneja, 1990). Konsumsi asam benzoat berlebih akan menyebabkan ginjal menjadi asam karena adanya penumpukan asam hipurat (Chipley, 1993)
3. Kalium Sorbat
Asam sorbat (trans, trans-2,4-hexadienoic acid) yang memiliki rumus empiris C6H8O2 merupakan padatan putih, berbentuk kristal dan berbau agak asam. Menurut Desrosier (1988), asam sorbat termasuk golongan asam lemak rantai panjang yang tidak jenuh yang efektif sebagai agensia fungistatis (menghambat pertumbuhan jamur). Secara komersil asam sorbat tersedia dalam bentuk garamnya termasuk kalsium, natrium dan kalium sorbat.
Kalium sorbat dengan rumus empiris C6H7O2K merupakan garam kalium dari asam sorbat. Kalium sorbat lebih umum digunakan daripada asam sorbat karena kelarutannya yang lebih tinggi dalam air daripada asam sorbat (Merck Indeks, 1989). Kalium sorbat akan menjadi asam sorbat begitu terlarut dalam air. Kalium sorbat memiliki 74% aktivitas antimikroba asam sorbat sehingga membutuhkan konsentrasi lebih tinggi untuk mencapai hasil yang sama dengan asam sorbat murni. (Sofos dan Busta, 1993). Kalium sorbat biasa dijual dengan harga cukup mahal yaitu sekitar Rp 90.000/kg. Rumus struktur kalium sorbat dapat dilihat pada Gambar 4.
Gambar 4. Rumus struktur kalium sorbat
Secara umum sorbat dapat menghambat mikroba gram positif, gram negatif, katalase positif, katalase negatif, aerobik dan anaerobik, mesofilik dan psikrofilik serta bakteri patogen (Sofos dan Busta, 1993). Pada produk dengan pertumbuhan kapang yang rendah, asam sorbat dapat digunakan sebagai penghambat pertumbuhan kapang (fungistatis), bahkan membunuh kapang (fungisida), tetapi dengan adanya jumlah pertumbuhan kapang yang tinggi, asam sorbat dimetabolisasikan dan tidak memperlihatkan daya hambat (Desrosier, 1988).
Mekanisme penghambatan mikroba oleh asam sorbat adalah mencegah kerja enzim dehidrogenase terhadap asam lemak. Struktur α-diena pada asam sorbat dapat mencegah oksidasi asam lemak oleh enzim tersebut (Winarno, 1997). Menurut Sofos dan Busta (1993), penghambatan bakteri oleh sorbat yaitu dengan memperpanjang fase adaptasi (lag phase) pertumbuhan mikroba, dengan pengaruh yang lebih kecil pada laju
pertumbuhan. Sorbat pada bakteri pembentuk spora mempengaruhi germinasi spora, pertumbuhan dan atau pemisahan sel vegetatif.
Jumlah kebutuhan asam sorbat untuk pengawetan suatu produk tergantung dari beberapa faktor termasuk komposisi produk (pH, Aw), jumlah kontaminasi awal, pengemas atau suhu penyimpanan. Sebagai pengawet berbasis asam, asam sorbat dan kalium sorbat lebih baik digunakan dibawah pH 5-6. Kalium sorbat efektif hingga pH 6.5 tetapi efektifitasnya meningkat dengan menurunnya pH (Sofos dan Busta, 1993). Pengaruh pH pada penguraian asam sorbat dapat dilihat pada Tabel 4.
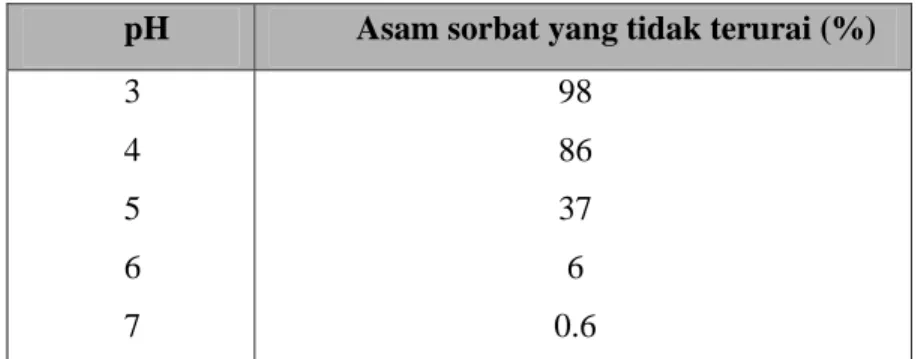
Tabel 4. Pengaruh pH pada penguraian asam sorbat*
pH Asam sorbat yang tidak terurai (%) 3 4 5 6 7 98 86 37 6 0.6 * (Buckle et al., 1987)
Berdasarkan Peraturan Menteri Kesehatan RI No. 722/ Menkes/ Per/ IX/ 1988, kalium sorbat digunakan pada sediaan keju olahan dengan batas maksimum 3 g/kg. Sedangkan pada produk keju, margarin, acar ketimun dalam botol, jem dan jeli serta pekatan sari nenas batas maksimum penggunaannya sebesar 1g/kg.
Sorbat dapat menyebabkan iritasi kulit pada beberapa orang yang sensitif dengan konsentrasi sekitar 1% dan beberapa yang sangat sensitif mengalami iritasi pada konsentrasi lebih rendah (Sofos dan Busta, 1993). Mengingat rata-rata penggunaan sorbat pada proses pangan adalah 0,1-0,3%, potensi iritasi karena adanya sorbat pada produk komersil sangat kecil (Davidson dan Branen, 1993).
C. KERUSAKAN TAHU
Tahu termasuk bahan pangan yang sangat mudah rusak sehingga dapat digolongkan ke dalam High Perisable Food (Shurtleff dan Aoyagi, 1979). Penyimpanan pada suhu rendah (15oC) hanya dapat mempertahankan kesegaran tahu 1-2 hari (Dotson et al.,1977). Hasil penelitian Prastawa et al. (1980), menunjukkan bahwa tahu yang dibiarkan pada udara terbuka tanpa perendaman di dalam air hanya bertahan sekitar 10 jam. Secara organoleptik, tanda-tanda yang dapat digunakan untuk mengetahui telah terjadinya kerusakan tahu antara lain adalah permukaan tahu berlendir, tekstur menjadi lunak, kekompakan berkurang, warna dan penampakan tidak cerah, dan kadang-kadang berjamur pada permukaannya (Prastawa et al., 1980).
Kerusakan tahu mempunyai kaitan erat dengan aktivitas mikroorganisme. Menurut Frazier dan Westhoff (1978), mikroorganisme penyebab kerusakan pada bahan pangan yang berkadar air tinggi dengan pH sekitar netral terutama adalah golongan bakteri. Shurtleff dan Aoyagi (1979), menyatakan bahwa penyebab utama kerusakan tahu adalah bakteri. Terdapatnya mikroba pada tahu yang baru saja keluar dari proses produksi tidak dapat dihindari, meskipun proses pembuatannya telah dilakukan dengan sanitasi yang baik. Jumlah koloni bakteri sering mencapai 100 000 per gram (Shurtleff dan Aoyagi,1979).
Sehubungan dengan aktivitas bakteri, kerusakan tahu dapat tergantung dari beberapa faktor antara lain : 1) adanya bakteri yang tahan panas seperti golongan termodurik, 2) adanya kontaminan yang mengkontaminasi tahu selama proses pembuatan sampai tahu siap dikonsumsi, 3) suhu penyimpanan, dan 4) adanya enzim tahan panas yang dihasilkan oleh golongan bakteri tertentu (Shurtleff dan Aoyagi, 1979).
III. BAHAN DAN METODE
A. BAHAN DAN ALAT
Bahan yang digunakan dalam penelitian ini adalah bahan untuk pengawetan tahu putih dan bahan untuk analisis mikrobiologi, analisis pH dan analisis organoleptik. Bahan yang digunakan dalam pengawetan tahu putih adalah tahu putih yang diperoleh dari pabrik tahu di Cibanteng, metil paraben, kalium sorbat, asam benzoat, natrium benzoat, kalsium propionat, dan air. Bahan yang digunakan untuk analisis adalah media Plate Count Agar (PCA), NaCl, aquades, alkohol 70%, spiritus, dan plastik High Density Polyethylene (HDPE).
Alat-alat yang digunakan dibagi menjadi dua bagian yaitu alat untuk pengawetan tahu putih dan alat untuk analisis, baik mikrobiologi, pH dan organoleptik. Alat-alat yang digunakan untuk pengawetan tahu putih adalah gelas plastik, sudip, gelas ukur, dan gelas pengaduk. Sedangkan alat-alat yang digunakan untuk dan analisis adalah timbangan, pisau, sudip, botol semprot, piring kertas, gelas ukur, gelas piala, erlenmeyer, cawan petri, tabung reaksi, pipet mohr, mikro pipet, tips, stomacher, inkubator, otoklaf, oven, bunsen, dan pH-meter.
B. METODE PENELITIAN
1. Pemilihan Pengawet dan Proses Pengawetan
Pada tahap ini dilakukan eksplorasi berbagai macam pengawet yang diijinkan untuk pangan. Pertimbangan yang dilakukan pada pemilihan pengawet ini antara lain legalitas, spektrum pengawet, faktor ekonomis, dan ketersediaan. Pengawet yang digunakan adalah metil paraben, kalium sorbat, asam benzoat, natrium benzoat dan kalsium propionat. Pada seleksi awal berbagai pengawet tersebut digunakan untuk mengawetkan tahu putih .
Pengawetan tahu putih dilakukan dengan cara tahu putih yang berukuran 4 x 4 x 2 cm3 dengan bobot ± 35 gram direndam dalam 150 ml larutan pengawet yang telah ditempatkan dalam gelas plastik. Penggunaan pengawet dilakukan secara tunggal dengan konsentrasi maksimal yang diijinkan yaitu 1000 ppm untuk metil paraben, asam benzoat, natrium benzoat, kalium sorbat dan 3000 ppm untuk kalsium propionat. Pengamatan yang dilakukan adalah pengamatan visual yang meliputi warna larutan, aroma, tekstur tahu putih dan penampakan yang dilakukan secara subjektif. Target umur simpan yang diinginkan ialah 3 hari (72 jam).
Berdasarkan pengamatan yang telah dilakukan didapat hasil bahwa hanya pengawet metil paraben, asam benzoat dan kalium sorbat yang mampu mempertahankan tahu putih dari kerusakan hingga mendekati 72 jam. Sedangkan natrium benzoat dan kalsium propionat hanya mampu mempertahankan tahu putih kurang dari 48 jam. Sehingga hanya metil paraben, asam benzoat dan kalium sorbat yang kemudian digunakan lebih lanjut dalam proses pengawetan tahu putih.
Pada proses berikutnya ketiga pengawet diatas digunakan untuk analisis. Ketika dilakukan analisis, konsentrasi pengawet yang digunakan adalah 600 ppm, 800 ppm dan 1000 ppm. Penurunan konsentrasi ini dimaksudkan untuk melihat seberapa besar kemampuan pengawet dengan konsentrasi yang lebih rendah dalam mempertahankan tahu putih dari kerusakan.
2. Analisis
Analisis yang dilakukan pada tahap ini meliputi analisis mikrobiologi (TPC), kimia (pH), dan organoleptik (hedonik dan different from control). Sampel yang digunakan untuk analisis mikrobiologi dan analisis pH adalah tahu putih yang diawetkan menggunakan metil paraben, asam benzoat dan kalium sorbat dengan konsentrasi 600 ppm, 800 ppm dan 1000 ppm. Kedua analisis ini dilakukan pada jam ke-0, 24, 48 dan 72 dengan dua kali ulangan. Dengan demikian sampel untuk analisis
mikrobiologi dan analisis pH berjumlah 72. Analisis organoleptik dilakukan setelah pengawetan selesai (72 jam) dengan menggunakan sampel tahu putih terbaik hasil analisis mikrobiologi dan analisis pH.
a. Analisis Mikrobiologi (Fardiaz, 1993)
Analisis mikrobiologi yang dilakukan yaitu analisis total mikroba. Analisis total mikroba dilakukan dengan metode Total Plate Count (TPC). Sebanyak 10 gram sampel dimasukkan ke dalam plastik tahan panas steril yang berisi 90 ml larutan pengencer steril. Sampel tersebut kemudian dihancurkan dengan menggunakan alat stomacher selama 60 detik sehingga dihasilkan sampel tahu putih dengan pengenceran 1:10. Campuran dikocok, diambil 1 ml kemudian dimasukkan dalam tabung reaksi berisi 9 ml larutan pengencer steril sehingga diperoleh pengenceran 10-2. Dengan cara yang sama dilakukan pengenceran 10-3, 10-4 dan seterusnya.
Dari masing-masing pengenceran diambil 1 ml suspensi sampel secara aseptis dan dimasukkan ke dalam cawan petri steril. Selanjutnya ditambahkan media Plate Count Agar (PCA) steril (duplo). Setelah media membeku, cawan petri diinkubasi dengan posisi terbalik pada inkubator dengan suhu 37oC selama 2 hari. Penghitungan total mikroba dilakukan menggunakan metode Standart Plate Count (SPC).
b. Analisis pH (AOAC, 1984)
Sebelum digunakan, pH meter dikalibrasi terlebih dahulu dengan menggunakan larutan buffer pH 4.0 dan pH 7.0. Sebanyak 10 gram contoh dihaluskan, ditambahkan sedikit aquades dan diaduk sampai merata. Kemudian elektroda ditempatkan dalam sampel sehingga dapat terbaca nilai pH yang diukur. Elektroda diangkat dan dibilas dengan aquades.
c. Analisis Organoleptik (Soekarto, 1985)
Uji organoleptik ini menggunakan 30 orang panelis semi terlatih (mahasiswa Departemen Ilmu dan Teknologi Pangan, Fateta, IPB). Uji organoleptik yang digunakan pada penelitian ini ialah uji hedonik dengan parameter warna, aroma dan tekstur, dan uji different from control.
Skala yang digunakan pada uji hedonik yaitu : (1) sangat tidak suka, (2) tidak suka, (3) agak tidak suka, (4) netral, (5) agak suka, (6) suka, dan (7) sangat suka. Untuk uji different from control digunakan 4 sampel yang telah diberi kode. Salah satu sampel yang digunakan merupakan blind control. Keempat sampel ini kemudian dibandingkan dengan kontrol yang telah disediakan. Skala nilai yang digunakan pada uji ini yaitu : (0) sama dengan kontrol, (1) hampir tidak beda, (2) agak tidak beda, (3) agak beda, (4) beda, dan (5) sangat beda.
3. Rancangan Percobaan dan Analisis Data
a. Rancangan Percobaan (Mattjik dan Sumertajaya, 2002)
Rancangan percobaan adalah suatu uji atau sederetan uji, baik itu menggunakan statistika deskripsi maupun statistika inferensia, yang bertujuan untuk mengubah peubah input menjadi suatu output yang merupakan respon dari percoban tersebut (Mattjik dan Sumertajaya, 2002). Rancangan percobaan yang digunakan untuk analisis mikrobiologi dan analisis pH adalah rancangan acak lengkap (RAL) faktorial dengan dua kali ulangan. Model faktorial RAL yang digunakan adalah sebagai berikut :
( ) ( ) ( )
ij ik jk(
)
ijk ijkl k j i ijkl Y =μ+α +β +γ + αβ + αγ + βγ + αβγ +ε dengan :Yijkl = respon lama penyimpanan ke-i dan jenis pengawet ke-j serta konsentrasi ke-k pada ulangan ke-l
μ = rataan umum
αi = pengaruh lama penyimpanan ke-i βj = pengaruh jenis pengawet ke-j γk = pengaruh konsentrasi ke-k
(αβ)ij = pengaruh interaksi lama penyimpanan ke-i dan jenis pengawet ke-j
(αγ)ik = pengaruh interaksi lama penyimpanan ke-i dan konsentrasi ke-k
(βγ)jk = pengaruh interaksi jenis pengawet ke-j dan konsentrasi ke-k (αβγ)ijk = pengaruh interaksi lama penyimpanan ke-i dan jenis
pengawet ke-j serta konsentrasi ke-k
εijkl = galat percobaan untuk lama penyimpanan ke-i dan jenis pengawet ke-j serta konsentrasi ke-k pada ulangan ke-l
b. Analisis Data
Analisis data digunakan untuk mengubah data awal menjadi suatu informasi yang mempunyai makna dan dapat dimengerti dengan jelas. Analisis data pada penelitian ini menggunakan program statistika Minitab 14.0 dan SPSS 12.0. Data dari analisis mikrobiologi dan analisis pH diolah menggunakan Minitab 14.0 dengan uji lanjut Duncan untuk analisis mikrobiologi dan uji lanjut Tukey HSD untuk analisis pH. Sedangkan data dari analisis organoleptik diolah menggunakan SPSS 12.0 secara ANOVA dengan uji lanjut Duncan untuk uji hedonik dan uji lanjut Dunnett untuk uji different from control.
IV. HASIL DAN PEMBAHASAN
A. PEMILIHAN PENGAWET
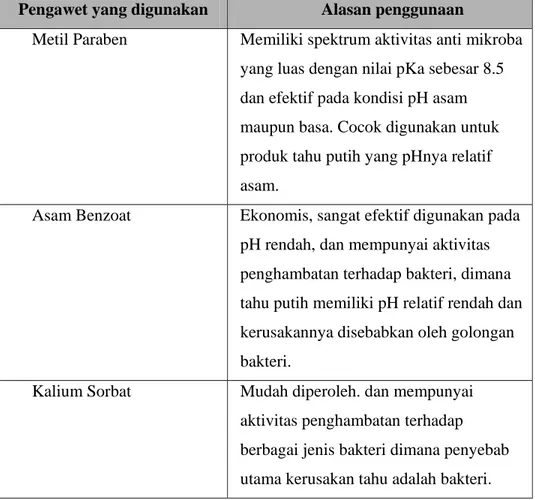
Salah satu upaya dalam memperpanjang umur simpan dari produk pangan adalah dengan memepergunakan bahan pengawet. Ada beberapa pertimbangan yang harus diperhatikan dalam pemilihan pengawet ini. Menurut Alcamo (1983), syarat-syarat yang harus dipenuhi oleh bahan pengawet kimia antara lain ekonomis, aman, mempunyai spektrum pH yang luas, dan tidak menurunkan kualitas makanan. Berdasarkan kriteria diatas, dipilih metil paraben, asam benzoat dan kalium sorbat sebagai pengawet yang digunakan untuk memperpanjang umur simpan tahu putih . Secara spesifik, alasan penggunaan pengawet diatas dapat dilihat pada Tabel 5.
Tabel 5. Pengawet yang digunakan pada tahu putih dan alasan penggunaan Pengawet yang digunakan Alasan penggunaan
Metil Paraben Memiliki spektrum aktivitas anti mikroba yang luas dengan nilai pKa sebesar 8.5 dan efektif pada kondisi pH asam maupun basa. Cocok digunakan untuk produk tahu putih yang pHnya relatif asam.
Asam Benzoat Ekonomis, sangat efektif digunakan pada pH rendah, dan mempunyai aktivitas penghambatan terhadap bakteri, dimana tahu putih memiliki pH relatif rendah dan kerusakannya disebabkan oleh golongan bakteri.
Kalium Sorbat Mudah diperoleh. dan mempunyai aktivitas penghambatan terhadap berbagai jenis bakteri dimana penyebab utama kerusakan tahu adalah bakteri.
Pengawet yang telah dipilih selanjutnya diaplikasikan dalam proses pengawetan tahu putih secara tunggal dengan konsentrasi yang berbeda. Konsentrasi yang digunakan yaitu 600 ppm, 800 ppm dan 1000 ppm. Cara pengawetan tahu putih yang dilakukan pada penelitian ini adalah dengan merendam tahu putih dengan bobot ± 35 gram ke dalam 150 ml larutan berbagai pengawet sebagaimana disebutkan di atas (Gambar 5). Tahu putih yang direndam dalam larutan pengawet tersebut kemudian disimpan pada suhu ruang selama 72 jam. Tahu putih yang telah diawetkan seperti terlihat pada Gambar 6.
Gambar 5. Tahu putih yang direndam pengawet
Gambar 6. Tahu putih yang telah diawetkan
Selama dan setelah pengawetan dilakukan pengamatan dan pengujian untuk melihat perbedaan yang terjadi pada sampel tahu putih. Pengamatan dan pengujian yang dilakukan terdiri dari analisis mikrobiologi, analisis pH dan analisis organoleptik. Analisis mikrobiologi dan analisis pH dilakukan pada jam ke-0, 24, 48 dan 72, sedangkan
analisis organoleptik dilakukan setelah pengawetan tahu putih selesai (72 jam).
1. Analisis Mikrobiologi
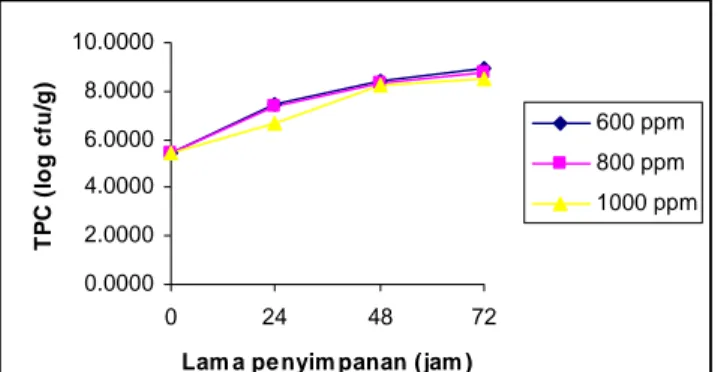
Analisis mikrobiologi yang dilakukan adalah analisis Total Plate Count (TPC). Analisis TPC dilakukan untuk setiap jenis pengawet yang dipakai. Hasil analisis TPC tahu putih dengan pengawet metil paraben dapat dilihat pada Gambar 7. Hasil analisis TPC tahu putih dengan pengawet asam benzoat dapat dilihat pada Gambar 8. Sedangkan hasil analisis TPC tahu putih dengan pengawet metil paraben dapat dilihat pada Gambar 9. 0.0000 1.0000 2.0000 3.0000 4.0000 5.0000 6.0000 7.0000 0 24 48 72
Lam a pe nyim panan (jam )
TP C ( log c fu /g) 600 ppm 800 ppm 1000 ppm
Gambar 7. Grafik Total Plate Count (TPC) tahu putih dengan pengawet metil paraben
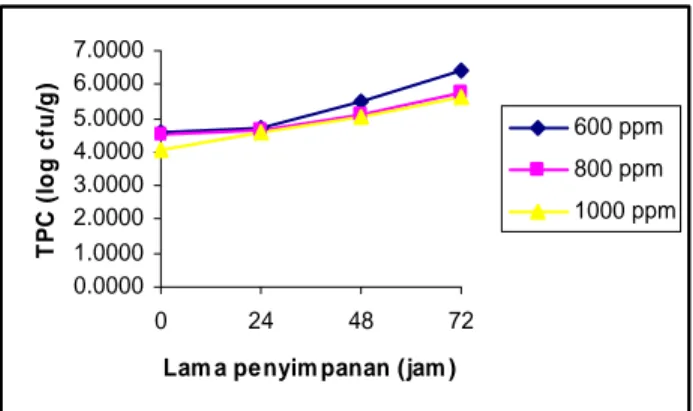
Dari grafik pada Gambar 7. dapat dilihat bahwa nilai TPC pada jam ke-24 dari ketiga sampel tahu putih dengan konsentrasi pengawet metil paraben yang berbeda hampir mendekati nilai yang sama. Nilai TPC untuk sampel dengan konsentrasi metil paraben 800 ppm dan 1000 ppm dari jam ke-0 hingga jam ke-72 tidak terlalu besar perbedaannya. Sedangkan sampel dengan konsentrasi metil paraben 600 ppm memiliki nilai TPC yang cukup jauh berbeda dengan kedua sampel yang lain. Perbedaan nilai TPC pada jam ke-0 dari masing-masing konsentrasi metil paraben disebabkan karena pengawet telah mulai aktif dalam menghambat
pertumbuhan mikroba awal dari tahu putih. Semakin tinggi konsentrasi pengawet maka jumlah mikroba awal akan semakin kecil.
Nilai TPC untuk sampel dengan konsentrasi metil paraben 600 ppm, 800 ppm dan 1000 ppm pada jam ke-72 berturut-turut adalah 2.9 x 106 cfu/g, 6.5 x 105 cfu/g dan 3.8 x 105. Hal ini berarti sampel dengan konsentrasi metil paraben 800 ppm daan 1000 ppm pada jam ke-72 masih memenuhi syarat SII (1.0 x 106 cfu/g). Hasil analisis TPC dengan pengawet metil paraben secara lengkap dapat dilihat pada Lampiran 1-Lampiran 3. 0.0000 1.0000 2.0000 3.0000 4.0000 5.0000 6.0000 7.0000 0 24 48 72
Lam a pe nyim panan (jam )
TP C ( log c fu/ g) 600 ppm 800 ppm 1000 ppm
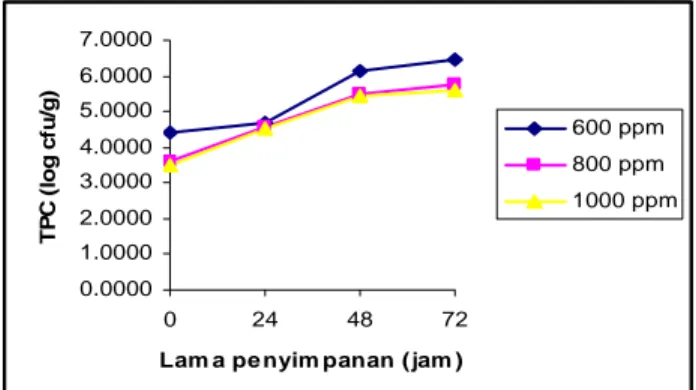
Gambar 8. Grafik Total Plate Count (TPC) tahu putih dengan pengawet asam benzoat
Dari grafik pada Gambar 8. dapat dilihat bahwa nilai TPC pada jam ke-24 dari ketiga sampel tahu putih dengan konsentrasi pengawet asam benzoat yang berbeda hampir mendekati nilai yang sama. Pada jam ke-0 nilai TPC sampel dengan konsentrasi asam benzoat 800 ppm mendekati 600 ppm. Namun pada jam ke-48 dan jam-72 nilainya mendekati sampel dengan konsentrasi asam benzoat 100 ppm. Perbedaan nilai TPC pada jam ke-0 dari masing-masing konsentrasi asam benzoat disebabkan karena pengawet telah mulai aktif dalam menghambat pertumbuhan mikroba awal pada tahu putih. Semakin tinggi konsentrasi pengawet maka jumlah mikroba awal akan semakin kecil.
Nilai TPC untuk sampel dengan konsentrasi asam benzoat 600 ppm, 800 ppm dan 1000 ppm pada jam ke-72 berturut-turut adalah 2.7 x
106 cfu/g, 6.5 x 105 cfu/g dan 4.1 x 105 cfu/g. Hal ini berarti sampel dengan konsentrasi asam benzoat 800 ppm dan 1000 ppm pada jam ke-72 masih memenuhi syarat SII (1.0 x 106 cfu/g). Hasil analisis TPC dengan pengawet asam benzoat secara lengkap dapat dilihat pada Lampiran 4-Lampiran 6. 0.0000 2.0000 4.0000 6.0000 8.0000 10.0000 0 24 48 72
Lam a pe nyim panan (jam )
TP C (l og c fu /g) 600 ppm 800 ppm 1000 ppm
Gambar 9. Grafik Total Plate Count (TPC) tahu putih dengan pengawet kalium sorbat
Dari grafik pada Gambar 9. dapat dilihat bahwa nilai TPC pada jam ke-0 dan jam ke-48 dari ketiga sampel tahu putih dengan konsentrasi pengawet kalium sorbat yang berbeda hampir mendekati nilai yang sama. Pada jam ke-0 hingga jam ke-72 nilai TPC sampel dengan konsentrasi kalium sorbat 600 ppm mendekati 800 ppm. Nilai TPC sampel dengan konsentrasi kalium sorbat 1000 ppm pada jam ke-24 memiliki perbedaan yamg cukup besar dibandingkan dengan 600 ppm dan 800 ppm. Namun pada jam ke-72 perbedaannya tidak sebesar pada jam ke-24.
Sampel tahu putih dengan konsentrasi kalium sorbat 600 ppm, 800 ppm dan 1000 ppm memiliki perbedaan nilai TPC yang besar dibandingkan dengan sampel tahu putih yang menggunakan metil paraben dan asam benzoat., nilai TPC sampel tahu putih yang menggunakan kalium sorbat 600 ppm, 800 ppm dan 1000 ppm pada jam ke-24 berturut-turut adalah 2.7 x 107 cfu/g, 2.5 x 107 cfu/g dan 4.7 x 106 cfu/g. Hal ini berarti sampel tahu putih pada jam ke-24 sudah tidak memenuhi syarat SII
(1.0 x 106 cfu/g). Hasil analisis TPC dengan pengawet kalium sorbat secara lengkap dapat dilihat pada Lampiran 7-Lampiran 9.
Nilai TPC yang tinggi menunjukkan adanya kerusakan tahu putih oleh mikroba dalam jumlah besar. Mikroba penyebab utama kerusakan tahu adalah bakteri (Shurtleff dan Aoyagi, 1979). Dotson et al. (1977), menemukan adanya golongan bakteri asam laktat, yaitu bakteri yang bersifat gram positif, tidak membentuk spora, berbentuk bulat dan batang, berpasangan dan atau berantai, pada tahu yang disimpan pada suhu 15o, 10o dan 5o C. Kerusakan tahu oleh bakteri asam laktat ini secara dapat dilihat dari permukaan tahu berlendir, tekstur menjadi lunak, kekompakan berkurang, warna dan penampakan tidak cerah (Prastawa et al., 1980).
Hasil analisis mikrobiologi kemudian diolah secara statistika dengan menggunakan Minitab 14.0. Data jumlah mikroba (cfu/g) ternyata tidak memenuhi semua asumsi (menyebar normal, saling bebas dan homogen) yang mendasari pengujian statistika. Oleh karena itu data harus ditransformasi agar semua asumsi dapat terpenuhi. Transformasi data perlu dilakukan agar asumsi-asumsi yang mendasari analisis dapat terpenuhi sehingga pengujian menjadi sahih (Mattjik dan Sumertajaya, 2002). Transformasi yang dilakukan pada data jumlah mikroba (cfu/g) ialah dengan mengubahnya kedalam bentuk ln sehingga semua asumsi dapat terpenuhi. Hasil dari pengujian statistika ditampilkan berbentuk plot pengaruh faktor lama penyimpanan, jenis pengawet dan konsentrasi pengawet terhadap jumlah mikroba seperti terlihat pada Gambar 10.
M e an o f l n C FU 72 48 24 0 18 16 14 12 10 sorbat paraben benzoat 1000 800 600 18 16 14 12 10
lama penyimpanan jenis pengawet
konsentrasi
Plot pengaruh utama masing-masing faktor
Gambar 10. Plot pengaruh lama penyimpanan, jenis pengawet dan konsentrasi pengawet terhadap jumlah mikroba (ln cfu/g) Dari Gambar 10. dapat dilihat bahwa lama penyimpanan (1), jenis pengawet (2) dan konsentrasi pengawet (3) memberikan pengaruh yang cukup besar terhadap jumlah mikroba. Jumlah mikroba akan semakin meningkat seiring semakin lamanya waktu penyimpanan. Pada jam ke-48 hingga jam ke-72, peningkatan jumlah mikroba sudah tidak sebanyak jam ke-0 hingga jam ke-48. Hal ini dapat terjadi karena adanya penurunan pertumbuhan mikroba. Penurunan pertumbuhan mikroba dapat disebabkan karena mikroba telah memasuki stationary phase dan death phase. Berdasarkan uji lanjut Duncan, lama penyimpanan jam ke-0, 24, 48, dan 72 berbeda nyata satu sama lain pada selang kepercayaan 95% (Lampiran 10).
Pengawet asam benzoat dan metil paraben memberikan pengaruh yang sama terhadap jumlah mikroba. Sedangkan kalium sorbat memberikan pengaruh yang sangat berbeda jika dibandingkan dengan asam benzoat dan metil paraben, dimana peningkatan jumlah mikrobanya sangat besar. Ini berarti asam benzoat dan metil paraben lebih efektif mereduksi jumlah mikroba dibandingkan dengan kalium sorbat. Berdasarkan uji lanjut Duncan, jenis pengawet asam benzoat dan metil paraben berbeda nyata dengan kalium sorbat. Sedangkan asam benzoat dengan metil paraben tidak berbeda nyata pada selang kepercayaan 95% (Lampiran 11).
2
3 1
Semakin tinggi konsentrasi pengawet, jumlah mikroba akan semakin rendah. Hal ini disebabkan konsentrasi yang lebih tinggi memiliki komponen anti mikroba yang lebih banyak sehingga penghambatan pertumbuhan mikroba akan semakin baik. Berdasarkan uji lanjut Duncan, konsentrasi pengawet 600 ppm, 800 ppm dan 1000 ppm, berbeda nyata satu sama lain pada selang kepercayaan 95% (Lampiran 12).
Berdasarkan analisis mikrobiologi dan pengujian statistika didapat bahwa pengawet asam benzoat 1000 ppm dan metil paraben 1000 ppm dapat mereduksi pertumbuhan mikroba hingga jam ke-72. Namun dengan harga metil paraben (Rp 100/g) yang jauh lebih mahal dari asam benzoat (Rp 17/g), penggunaan asam benzoat 1000 ppm lebih direkomendasikan.
2. Analisis pH
Pengukuran derajat keasaman (pH) dilakukan untuk mengetahui kecenderungan perubahan nilai pH selama penyimpanan tahu putih. Tahu putih merupakan bahan pangan yang mempunyai pH dibawah netral, yaitu berkisar antara 3-6 tergantung penggumpal yang digunakan. Pengukuran pH dilakukan pada jam ke-0, 24, 48, dan 72 pada larutan pengawet yang digunakan untuk merendam tahu putih serta tahu putih yang diawetkan. Hasil pengukuran pH larutan dan tahu putih yang menggunakan 3 jenis pengawet disajikan pada Gambar 11-Gambar 16.
0 1 2 3 4 5 6 0 24 48 72
Lam a pe nyim panan (jam )
pH
600 ppm 800 ppm 1000 ppm
0 1 2 3 4 5 6 0 24 48 72
Lam a pe nyim panan (jam )
pH
600 ppm 800 ppm 1000 ppm
Gambar 12. Histogram pH tahu putih dengan pengawet metil paraben
Berdasarkan Gambar 11. dan Gambar 12. terlihat bahwa selama penyimpanan telah terjadi perubahan pH pada larutan pengawet metil paraben dan tahu putih yang direndam pengawet. Larutan pengawet dan tahu putih dengan konsentrasi metil paraben lebih rendah memiliki pH yang lebih tinggi. Pada jam ke-0, nilai pH larutan pengawet dan tahu putih berada pada kisaran pH 4-5. Pada jam ke-24, terjadi penurunan pH untuk semua konsetrasi pengawet dan tidak ada perbedaan nilai pH yang besar diantara masing-masing konsentrasi. Setelah jam ke-24, pH terus meningkat seiring bertambah lamanya waktu penyimpanan. Hasil pengukuran pH larutan pengawet dan tahu putih yang menggunakan metil paraben secara lengkap dapat dilihat pada Lampiran 13.
0 1 2 3 4 5 6 0 24 48 72
Lam a pe nyim panan (jam )
pH
600 ppm 800 ppm 1000 ppm
0 1 2 3 4 5 6 0 24 48 72
Lam a pe nyim panan (jam )
pH
600 ppm 800 ppm 1000 ppm
Gambar 14. Histogram pH tahu putih dengan pengawet asam benzoat
Berdasarkan Gambar 13. dan Gambar 14. terlihat bahwa selama penyimpanan telah terjadi perubahan pH pada larutan pengawet asam benzoat dan tahu putih yang direndam. Larutan pengawet dan tahu putih dengan konsentrasi asam benzoat lebih rendah memiliki pH yang lebih tinggi. Pada jam ke-0, nilai pH untuk larutan pengawet berada pada kisaran pH 3-4, sedangkan tahu putih yang direndam pengawet berada pada kisaran pH 5-6.
Pada jam ke-24, terjadi peningkatan pH larutan pengawet tetapi hal yang sebaliknya terjadi pada tahu putih yang direndam larutan pengawet. Ini disebabkan sedang terjadi proses kesetimbangan antara larutan pengawet dengan tahu putih yang direndam. Nilai pH larutan pengawet dan tahu putih pada jam ke-48 mengalami penurunan dalam level yang tidak terlalu besar. Pada jam ke-72, terjadi peningkatan pH untuk larutan pengawet dan tahu putih yang direndam. Hasil pengukuran pH larutan pengawet dan tahu putih yang menggunakan asam benzoat secara lengkap dapat dilihat pada Lampiran 14.
0 1 2 3 4 5 6 0 24 48 72
Lam a pe nyim panan (jam )
pH
600 ppm 800 ppm 1000 ppm
Gambar 15. Histogram pH Larutan pengawet kalium sorbat
0 1 2 3 4 5 6 0 24 48 72
Lam a pe nyim panan (jam )
pH
600 ppm 800 ppm 1000 ppm
Gambar 16. Histogram pH tahu putih dengan pengawet kalium sorbat
Berdasarkan Gambar 15. dan Gambar 16. terlihat bahwa selama penyimpanan telah terjadi perubahan pH pada larutan pengawet kalium sorbat dan tahu putih yang direndam. Larutan pengawet dan tahu putih dengan konsentrasi kalium sorbat lebih rendah memiliki pH yang lebih rendah juga. Pada jam ke-0, nilai pH untuk larutan pengawet berada pada kisaran pH 5-6, sedangkan tahu putih yang direndam pengawet berada pada kisaran pH 4-5.
Pada jam ke-24, terjadi penurunan pH larutan pengawet dan tahu putih yang direndam. Setelah jam ke-24, pH larutan pengawet dan tahu putih terus meningkat seiring bertambah lamanya waktu penyimpanan. Hasil pengukuran pH larutan pengawet dan tahu putih yang menggunakan kalium sorbat secara lengkap dapat dilihat pada Lampiran 15.
Berdasarkan analisis pH didapat bahwa, seiring bertambahnya waktu penyimpanan semua sampel tahu putih mengalami peningkatan
terbentuknya senyawa-senyawa hasil penguraian protein oleh mikroba yang bersifat basa seperti amoniak atau NH3. Peningkatan pH ini menunjukkan bahwa telah terjadi penurunan kualitas tahu putih, dimana semakin tinggi pH maka kesempatan mikroba untuk merusak tahu putih akan semakin besar.
Hasil analisis pH kemudian diolah secara statistika dengan menggunakan Minitab 14.0. Data nilai pH larutan pengawet dan tahu putih setelah diuji ternyata telah memenuhi semua asumsi (menyebar normal, saling bebas dan homogen) yang mendasari analisis statistika sehingga tidak perlu dilakukan transformasi. Hasil dari pengujian statistika ditampilkan berbentuk plot pengaruh faktor jenis pengawet, lama penyimpanan dan konsentrasi pengawet terhadap nilai pH larutan pengawet (Gambar 17) dan pH tahu putih yang direndam larutan pengawet (Gambar 18). M e an o f p H (l a ru tan ) sorbat paraben benzoat 5,00 4,75 4,50 4,25 4,00 72 48 24 0 800 600 1000 5,00 4,75 4,50 4,25 4,00
jenis pengawet lama penyimpanan
konsentrasi
Plot pengaruh utama masing-masing faktor
Gambar 17. Plot pengaruh jenis pengawet, lama penyimpanan dan konsentrasi pengawet terhadap nilai pH larutan pengawet 1
3
M e an o f p H ( tah u ) sorbat paraben benzoat 4,8 4,7 4,6 4,5 72 48 24 0 800 600 1000 4,8 4,7 4,6 4,5
jenis pengawet lama penyimpanan
konsentrasi
Plot pengaruh utama masing-masing faktor
Gambar 18. Plot pengaruh jenis pengawet, lama penyimpanan dan konsentrasi pengawet terhadap nilai pH tahu putih yang direndam larutan pengawet
Dari Gambar 17 dan Gambar 18. dapat dilihat bahwa jenis pengawet (1), lama penyimpanan (2) dan konsentrasi pengawet (3) memberikan pengaruh yang cukup besar terhadap nilai pH larutan pengawet dan tahu putih. Perbedaan jenis pengawet memberikan pengaruh yang besar terhadap nilai pH larutan pengawet, dimana larutan asam benzoat memiliki nilai pH paling rendah dibandingkan larutan metil paraben dan kalium sorbat. Sedangkan tahu putih dengan pengawet metil paraben memiliki pH yang lebih rendah dibandingkan tahu putih dengan pengawet asam benzoat dan kalium sorbat. Berdasarkan uji lanjut Tukey HSD, nilai pH larutan pengawet dan tahu putih yang direndam pengawet untuk setiap jenis pengawet berbeda nyata satu sama lain pada selang kepercayaan 95% (Lampiran 16 dan Lampiran 17).
Nilai pH larutan pengawet tidak berbeda jauh pada jam ke-0, 24 dan 48, namun pada jam ke-72 terjadi perbedaan dimana nilai pHnya mengalami peningkatan. Berdasarkan uji lanjut Tukey HSD, nilai pH larutan pengawet pada jam ke-0, 24 dan 48 berbeda nyata dengan jam ke 72 (Lampiran 18). Tahu putih yang direndam pengawet pada jam ke-0 berbeda dengan jam ke-24 dimana terjadi penurunan nilai pH. Pada jam 48 dan 72, tahu putih yang direndam pengawet berbeda dengan jam ke-24 dimana terjadi peningkatan pH. Berdasarkan uji lanjut Tukey HSD 1
3
pada selang kepercayaan 95%, nilai pH tahu putih yang direndam pengawet pada jam ke-24 dan 48 berbeda nyata dengan jam ke 72, namun jam ke-0 tidak berbeda nyata dengan jam ke-72 (Lampiran 19).
Semakin tinggi konsentrasi pengawet, nilai pH larutan pengawet dan tahu putih yang direndam pengawet akan semakin rendah. Berdasarkan uji lanjut Tukey HSD pada selang kepercayaan 95%, nilai pH larutan pengawet dan tahu putih yang direndam pengawet pada kontrasi pengawet 600 ppm berbeda nyata dengan 1000 ppm tetapi tidak berbeda nyata dengan 800 ppm (Lampiran 20).
Berdasarkan analisis pH yang diperkuat dengan uji secara statistika didapat bahwa pengawet asam benzoat 1000 ppm dan metil paraben 1000 ppm menghambat peningkatan pH tahu putih hingga 72 jam. Namun dengan harga metil paraben (Rp 100/g) yang jauh lebih mahal dari asam benzoat (Rp 17/g), maka penggunaan asam benzoat 1000 ppm lebih direkomendasikan.
3. Analisis Organoleptik
Uji organoleptik adalah cara menilai mutu suatu produk dengan menggunakan kepekaan alat indera manusia, yaitu pengelihatan dengan mata, penciuman dengan hidung, pencicipan dalam rongga mulut, perabaan dengan ujung jari dan pendengaran dengan telinga. Pada penelitian ini dilakukan uji hedonik dengan parameter warna, aroma, dan tekstur dan uji different from control dengan menggunakan 30 panelis semi terlatih.
Untuk uji organoleptik ini digunakan 3 sampel tahu putih terbaik hasil dari analisis mikrobiologi dan analisis pH. Ketiga sampel tahu putih tersebut adalah tahu putih dengan pengawet asam benzoat 800 ppm; asam benzoat 1000 ppm; dan metil paraben 1000 ppm. Ketiga sampel tersebut diberi kode secara acak untuk kemudian diuji oleh panelis. Panelis akan memberikan penilaian untuk setiap sampel tersebut. Hasil penilaian panelis dituliskan pada form yang telah disediakan. Form kuisioner untuk uji hedonik tahu putih dapat dilihat pada Lampiran 22., sedangkan form