EVALUASI KETAHANAN PLANLET MUTAN JERUK
TERHADAP PENYAKIT BUSUK PANGKAL BATANG JERUK
WINDI DHITA
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
2011
ABSTRAK
WINDI DHITA. Evaluasi Ketahanan Planlet Mutan Jeruk terhadap Penyakit Busuk Pangkal Batang Jeruk. Dibimbing oleh MEITY SURADJI SINAGA.
Penyakit busuk pangkal batang (BPB) yang merupakan salah satu penyakit yang sangat merugikan pada pertanaman jeruk, disebabkan oleh Phytophthora citrophthora dan Botryodiplodia theobromae. Penelitian ini bertujuan untuk mengevaluasi ketahanan in vitro mutan jeruk terhadap P. citropthora dan B. theobromae penyebab busuk pangkal batang jeruk. Pengujian dilakukan menggunakan jeruk Japansche citroen, merupakan jeruk batang bawah. Planlet jeruk hasil iradiasi dengan dosis 1000, 2000, dan 3000 rad diuji ketahannya dengan menggunakan teknik penempelan inokulum secara langsung pada pangkal batang planlet jeruk. Pengamatan periode inkubasi dan keparahan penyakit dilakukan selama empat belas hari. Periode inkubasi semua planlet adalah 3 hari setelah inokulasi (HSI) dengan gejala berupa nekrosis. Tingkat keparahan penyakit lebih lanjut ditandai dengan timbulnya gejala gumosis yang merupakan gejala khas pada penyakit BPB. Gejala gumosis dengan inokulasi B. theobromae muncul pada 4 HSI sedangkan pada perlakuan P. citrophthora 6 HSI. B. theobromae menyebabkan tingkat keparahan lebih tinggi dibandingkan dengan P. citrophthora. Pengujian ketahanan dengan teknik in vitro menunjukan perlakuan iradiasi terhadap persen keparahan planlet tidak berbeda nyata.
Kata kunci: busuk pangkal batang jeruk, uji ketahanan in vitro, Phytophthora citrophthora, Botryodiplodia theobromae
EVALUASI KETAHANAN PLANLET MUTAN JERUK
TERHADAP PENYAKIT BUSUK PANGKAL BATANG JERUK
WINDI DHITA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
2010
Judul : Evaluasi Ketahanan Planlet Mutan Jeruk terhadap Penyakit Busuk Pangkal Batang Jeruk
Nama Mahasiswa : Windi Dhita
NIM : A34060761
Disetujui Dosen Pembimbing
Prof. Dr. Ir. Meity Suradji Sinaga, M.Sc. NIP. 19501125 197603 2 002
Diketahui
Ketua Departemen Proteksi Tanaman
Dr. Ir. Dadang, M.Sc. NIP: 19640204 199002 1 002
RIWAYAT HIDUP
Penulis dilahirkan di Semarang, Jawa Tengah pada tanggal 19 Januari 1988. Penulis adalah putri kedua dari empat bersaudara dari pasangan Bapak Endjang Sudradjat dan Ibu Ida Ningsih.
Penulis menamatkan pendidikan menengah atas di SMA Negeri 1 Bogor, Jawa Barat pada tahun 2006. Pada tahun yang sama penulis diterima sebagai mahasiswa di Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis selanjutnya memilih program Studi Hama dan Penyakit Tanaman, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Selain menjadi mahasiswa, penulis aktif mengikuti kegiatan yang diadakan di IPB terutama kegiatan dalam Himpunan Mahasiswa Proteksi Tanaman (HIMASITA) periode 2008-2009. Pada tahun 2008 penulis mengikuti program magang di Laboratorium Mikologi, Departemen Proteksi Tanaman, Institut Pertanian.
PRAKATA
Puji syukur penulis panjatkan atas kehadirat Allah SWT yang telah memberikan rahmat serta hidayah-Nya. Shalawat beserta salam semoga tetap tercurah bagi Nabi Muhammad SAW karena jasanya membawa umat islam mempelajari segala ilmu. Alhamdulillah penulis dapat menyelesaikan skripsi penelitian yang berjudul evaluasi ketahanan planlet mutan jeruk terhadap penyakit busuk pangkal batang.
Pada kesempatan ini penulis mengucapkan terimakasih kepada Prof. Dr. Ir. Meity Suradji Sinaga, M.Sc sebagai dosen pembimbing penelitian yang telah memberikan bimbingan, saran, dan pengarahan dalam merencanakan dan melaksanakan penelitian serta menyusun laporan akhir ini. Kepada Dr. Ir. Abdjad Asih M.Si selaku dosen pembimbing akademik yang senantiasa memberikan perhatian dan semangat selama ini. Kepada Dr. Ir. Sugeng Santoso M.Sc selaku dosen penguji tamu yang telah memberikan masukan dan menambah wawasan kepada penulis. Kepada Mia Kosmiatin SSi. M.Si selaku dosen pembimbing di BB Biogen yang memberikan masukan dan perhatiannya kepada penulis selama menjalankan penelitian. Kepada bapak Joko Tamami sebagai kepala ruang media Laboratorium Kultur Jaringan BB Biogen yang selalu memberi semangat dan masukan saat melakukan penelitian. Kepada bapak Dadang Surachma selaku laboran di laboratorium mikologi Departemen Proteksi Tanaman IPB yang memberi masukan dan semangat. Terimakasih juga disampaikan kepada seluruh staf pengajar di Departemen Proteksi Tanaman atas bimbingan yang diberikan selama melaksanakan pendidikan.
Penulis juga mengucapkan terimakasih yang sebesar-besarnya kepada Ayah dan bunda yang telah memberikan semangat, cinta, doa dan kasih sayangnya. Ucapan terimakasih juga penulis sampaikan kepada kakak dan adik tersayang (Indi Dhita, Andika Wiradiputra, dan Satria Anugrah Wiradinata) yang tak lelah memberikan dorongan dan semangat selama ini. Terimakasih kepada seluruh sahabat seperjuangan mahasiswa Proteksi Tanaman 43 khususnya kepada Lara Hikmahayati, Haryanto, Eka Retnosari, Algienka Defaosandi, Nuri Risa, Anief Nugroho, Vani Nur Oktaviany, dan Fitra Murgianto yang membantu memberikan dorongan semangat dan kebersamaannya. Terimakasih kepada anggota Laboratorium Mikologi Mbak Linda, Pak Tri, Mbak Nilda, Pak Fajar, Pak Jack, serta rekan-rekan yang namanya tidak dapat disebutkan satu persatu.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan, sehingga kritik dan saran sangat diharapkan penulis untuk perbaikan laporan tugas akhir ini. Semoga penelitian ini dapat memberi manfaat bagi yang memerlukan.
Bogor, November 2010
DAFTAR ISI
Halaman DAFTAR TABEL ... ix DAFTAR GAMBAR ... x PENDAHULUAN ... 1 Latar Belakang ... 1 Tujuan Penelitian ... 3 Manfaat Penelitian ... 3 TINJAUAN PUSTAKA ... 4 Tanaman Jeruk ... 4Jeruk Japansche citroen ... 4
Kultur Jaringan Tanaman Jeruk ... 5
Induksi Mutasi dengan Iradiasi Sinar Gamma ... 6
Penyakit Busuk Pangkal Batang ... 6
Gejala yang ditimbulkan oleh Phytophthora ... 7
Gejala yang ditimbulkan oleh Botryodiplodia ... 7
Phytophthora citrophthora ... 8 Karakteristik P. citrophthora... 8 Siklus P. citrophthora ... 8 Botryodiplodia theobromae ... 9 Karakteristik B. theobromae ... 9 Siklus B. theobromae... 9
BAHAN DAN METODE ... 10
Tempat dan Waktu Penelitian... 10
Bahan dan Alat ... 10
Persiapan Inokulum P. citrophthora ... 11
Persiapan Inokulum B. theobromae... 11
Perbanyakan Planlet Japansche Citroen ... 11
Perbanyakan Mutan Japansche Citroen ... 12
Uji Media Tanam Jeruk, P. citrophthora dan B. theobromae ... 12
Uji Ketahanan In Vitro Planlet ... 12
Rancangan Percobaan dan Analisis Data ... 13
HASIL DAN PEMBAHASAN ... 15
Tingkat Keparahan Penyakit ... 15
Gejala Penyakit Busuk Pangkal Batang ... 18
KESIMPULAN DAN SARAN ... 24
DAFTAR PUSTAKA ... 25
DAFTAR TABEL
Halaman
1. Pengaruh iradiasi terhadap persen keparahan penyakit pada hari ke enam setelah inokulasi P. citrophthora dan B. theobromae ... 15
DAFTAR GAMBAR
Halaman
1. Persen keparahan penyakit dengan inokulum P. citrophthora ... 17
2. Persen keparahan penyakit dengan inokulum B. theobromae ... 18
3. Gejala awal klorosis ... 19
4. Gejala lanjut nekrosis ... 20
5. Gejala nekrosis pada batang jeruk 2 bulan setelah inokulasi ... 20
6. Gejala gumosis pada planlet dan di lapangan ... 21
7. Gejala gumosis pada pembibitan JC ... 21
8. Sindro gejala dengan inokulasi P. citrophthora ... 22
9. Sindrom gejala dengan inokulasi B. theobromae ... 22
PENDAHULUAN
Latar Belakang
Jeruk merupakan salah satu komoditas hortikultura yang memiliki nilai ekonomi tinggi. Buah jeruk memiliki peluang pasar yang cukup besar karena selain dapat dimakan dalam keadaan segar juga dapat dibuat sebagai minuman kaleng. Selain itu jeruk juga memiliki berbagai manfaat lain diantaranya adalah kulit jeruknya yang dapat diolah menjadi minyak kulit jeruk dipakai untuk membuat minyak wangi, sabun, esens minuman dan untuk campuran kue. Buah jeruk juga dapat dimanfaatkan sebagai obat tradisional penurun panas, pereda nyeri saluran napas bagian atas dan penyembuh radang mata. Jeruk merupakan sumber vitamin C yang baik, mengandung 50 mg/100 ml sari buah, serta vitamin A dan protein (Lelly 2004)
Permintaan jeruk di Indonesia dari tahun ke tahun mengalami peningkatan, diperkirakan kebutuhan buah jeruk nasional pada tahun 2010 mencapai 3.483.095 ton atau sekitar 1.5 kali dari produksi nasional tahun 2005 (Badan Litbang Departemen Pertanian 2005), namun saat ini produktivitas jeruk nasional Indonesia cenderung mengalami penurunan. Salah satu penyebabnya adalah Organisme Pengganggu Tanaman (OPT).
Penyakit busuk pangkal batang merupakan salah satu penyakit yang sangat merugikan (Dirjen Hortikultura 2007). Menurut Timmer et al (2000) penyakit BPB yang paling berbahaya disebabkan oleh jamur Phytophthora sp. Dari laporan Direktorat Perlindungan Tanaman, tahun 2006 tercatat 67.429 pohon jeruk di Indonesia terserang Phytophthora sp. yang menyebabkan busuk pangkal batang dan mematikan tanaman, serta merupakan penyakit utama ke tiga yang mematikan setelah CVPD (471.267 pohon) dan Diplodia (203.047 pohon). Di Indonesia penyakit ini telah menyerang pertanaman jeruk di Jawa, Sumatera, Kalimantan, dan Nusa Tenggara Timur (Semangun 2004).
Perbanyakan jeruk dapat dilakukan dengan biji, pencangkokan dan penyambungan. Perbanyakan tanaman dengan biji jarang dilakukan karena sifat tanaman yang dihasilkan banyak yang menyimpang dari sifat induknya dan memiliki masa juvenile yang lebih lama. Dengan pencangkokan, tanaman yang
2
dihasilkan memiliki perakaran yang pendek serta tidak dapat dilakukan secara besar-besaran karena membutuhkan cabang (bahan tanaman) yang lebih banyak. Oleh sebab itu perbanyakan tanaman lebih banyak dilakukan dengan penyambungan (Putri 2004). Penyambungan merupakan proses penggabungan dua jenis tanaman antara batang bawah dan batang atas yang berbeda dengan tujuan untuk menggabungkan sifat unggul yang terdapat pada batang atas dan batang bawah sehingga diperoleh tanaman yang bersifat lebih unggul dibandingkan tanaman asalnya.
Budidaya tanaman jeruk secara komersil umumnya menggunakan bibit yang berasal dari penempelan atau okulasi penyambungan antara batang bawah dan batang atas (Samson 1980). Menurut Supriyanto (1990) teknik penempelan merupakan salah satu metode baku perbanyakan tanaman jeruk secara komersial yang umum digunakan di Indonesia. Dalam teknik tersebut dibutuhkan batang atas yang berasal dari kultivar yang bertanggung jawab terhadap produksi dan mutu buah yang dihasilkan, dan batang bawah yang berasal dari kultivar lain yang bertanggung jawab terhadap kemampuan sistem perakarannya dalam mengeksploitasi kondisi lahan dan lingkungan. Batang bawah jeruk yang digunakan sangat menentukan pertumbuhan jeruk, karena bagian tersebut mempunyai kemampuan dalam mengeksploitasi kondisi lingkungan yang tidak menguntungkan, seperti kekeringan, kelebihan air, dan ketahanan terhadapa hama penyakit (Kosmiatin 2007).
Saat ini lebih dari 95% pertanaman jeruk yang ada di Indonesia menggunakan batang bawah Citrus limonia Osbeck atau sering disebut Japansche citroen (JC) (Balitjestro 2006). Kelebihan dari JC adalah batang bawah yang digunakan sesuai dengan semua batang atas jeruk yang ada, dan cenderung tahan terhadap patogen. Namun seiring berjalannya waktu menurut Triatminingsih dan Karsinah (2004) JC kurang toleran terhadap penyakit BPB, hal ini diakibatkan strain dari patogen yang meningkat virulensinya. Oleh karena itu untuk memperoleh batang bawah jeruk yang tahan terhadap serangan patogen, maka digunakan mutan-mutan somaklonal yang berasal dari induksi mutasi. Biakan mutan yang digunakan adalah jeruk batang bawah JC yang diperoleh dari hasil induksi mutasi dengan sinar iradiasi sinar gamma pada dosis 1000, 2000, 3000 rad
3
dan telah diseleksi dengan simulasi ketahanan terhadap cekaman abiotik lahan masam kahat Al dan kekeringan (Kosmiatin 2008).
Penelitian mengenai uji ketahanan terhadap penyakit BPB terutama secara in vitro masih jarang dilakukan sehingga informasi mengenai teknik in vitro dalam pengendalian BPB masih kurang. Menurut Slavov (2005) dalam penelitiannya mengenai uji ketahanan dengan menggunakan filtrat dari Phythophthora citrophthora tidak dapat digunakan sebagai seleksi in vitro terhadap ketahanan varietas jeruk. Oleh karena itu mutan-mutan yang diperoleh dari hasil iradiasi dilakukan uji ketahanan terhadap penyakit BPB jeruk dengan pengembangan teknik uji ketahanan in vitro penempelan inokulum Phytophthora citrophthora dan Botryodiplodia theobromae secara langsung pada planlet. Uji ketahanan in vitro dilakukan dengan tujuan untuk mempersingkat waktu, untuk mengatasi permasalahan lahan, dan mengetahui adanya atau tidaknya ketahanan tanaman pada tahap ini.
Tujuan
Penelitian ini bertujuan untuk mengevaluasi ketahanan planlet mutan jeruk terhadap P. citropthora dan B. theobromae penyebab busuk pangkal batang jeruk.
Manfaat
Penelitian ini diharapkan dapat memberi informasi dasar dalam evaluasi ketahanan tehadap P. citrophthora dan B. theobromae penyebab busuk pangkal batang jeruk.
TINJAUAN PUSTAKA
Tanaman Jeruk (Citrus sp.)
Tanaman jeruk adalah tanaman buah tahunan yang berasal dari Asia. Jeruk pertama kali tumbuh di Negara Cina kemudian menyebar ke negara-negara lain. Sejak ratusan tahun yang lalu, jeruk sudah tumbuh di Indonesia baik secara alami atau dibudayakan. Tanaman jeruk yang ada di Indonesia adalah peninggalan orang Belanda yang mendatangkan jeruk manis dan keprok dari Amerika dan Itali.
Jeruk memiliki banyak spesies dari enam genus, yakni Citrus, Microcitrus, Fortunella, Poncirus, Cymedia, dan Eremocirus. Genus yang terkenal adalah Citrus, Fortunella, dan Poncitrus. Namun yang memiliki nilai ekonomi tinggi hanyala Citrus. Spesies jeruk yang terkenal yaitu C.reticulata (jeruk Keprok), C. sinensis (jeruk manis), C. grandis atau C.Maxima (jeruk besar atau jeruk gulung), C. aurantifolai (jeruk nipis), C. hystrix (jeruk purut), C. trifoliate (Jeruk ponsil). Selain itu spesies jeruk yang penting, walaupun nilai ekonominya rendah adalah jeruk Rough Lemon (RL), dan jeruk Japansche Citroen (JC). Hal ini dikarenakan jeruk tersebut dapat digunakan sebagai batang bawah (rootstock) dalam perbanyakan jeruk.
Jeruk Japanshe Citroen (Citrus limonia Osbeck)
Jeruk Japanshe Citroen (Citrus limonia Osbeck) atau sering disebut JC merupakan varietas hibrida yang dihasilkkan dari persilangan antara Citroes nobilis (keprok) X Citroes medica (lemon). JC bersifat tahan terhadap kekeringan, dapat merangsang pembentukan buah lebih awal dari biasanya dan menghasilkan produksi tinggi dengan kualitas yang baik. Jenis ini menurut Triatminingsih dan Karsinah (2004), kurang toleran terhadap penyakit Busuk Pangkal Batang.
Menurut Masyarakat Jeruk Indonesia (2004), jeruk JC mempunyai ciri-ciri sebagai berikut:
1. Pohon tegar dan produktif, ukuran sedang, cabang menyebar dan merunduk, duri kecil dan sedikit
2. Daun berwarna hijau gelap, aromadaun menyengat, pupus warna ungu 3. Bunga berukuran kecil hingga sedang, putik dan kelopak bunga berwarna
5
4. Buah kecil hingga sedang, warna kulit buah bila masak kekuningan sampai jingga kemerahan
5. Biji jumlahnya banyak, berukuran kecil dan wanra keeping biji hijau muda, setiap buah berisi 8-10 biji
6. Tanah kekeringan
7. Daya dukung terhadap batang atas baik dan cepat mengahasilkan buah yang berkhualitas sedang hingga baik
8. Peka terhadap Phytophthora, Exocortis,dan Xyloporosis 9. Tahan terhadap Psorosis dan agak tahan terhadap Triteza.
JC memiliki kevigoran yang tinggi, ukuran biji sedang (diameter 0.5), mudah beradaptasi tetapi buahnya sangat masam dan kurang layak untuk dikonsumsi, oleh karena itu direkomendasikan sebagai batang bawah (Purbiati et al 2002). Batang bawah JC memiliki kompatibilitas yang baik. Menurut hasil penelitian Susanto (2003), penggunaan batang bawah JC bersifat lebih mendorong pertumbuhan vegetatife batang atas dibandingkan dengan Rough Lemon.
Kultur Jaringan Tanaman Jeruk
Pengembangan tanaman jeruk menuntut adanya penyediaan bibit tanaman jeruk yang bebas penyakit, baik batang atas maupun batang bawah (Triatminingsih dan Karsinah 2004). Pada umumnya batang bawah jeruk diperbanyak dengan biji. Sebaiknya biji yang digunakan mempunyai derajat embrio nuselar yang tinggi, sehingga keseragaman batang bawah lebih terjamin (Starrantino dan Caruso 1983). Bila materi yang tersedia terbatas, maka perbanyakan dapat dilakukan dengan cara kultur in vitro. Teknik ini berguna untuk industri pembibitan jeruk dalam skala besar terutama untuk varietas-varietas tertentu yang ketersediaan bijinya sangat terbatas atau tergantung musim.
Pada prinsipnya metode kultur jaringan merupakan cara untuk memperbanyak protoplas atau sel atau organ dalam media tumbuh aseptik (yang mengandung formulasi hara buatan) dengan lingkungan yang terkendali. Arah pertumbuhan dan perkembangan suatu sel sangat dipengaruhi oleh media tumbuhnya. Ketepatan pemilihan dan penggunaan media kultur sangat menentukan keberhasilan penggunaan teknik kultur jaringan.
6
Media kultur jaringan yang paling banyak digunakan untuk berbagai tujuan kultur jaringan adalah media dasar Murashige dan Skoog (1962). Media MS mengandung unsur makro dengan konsentrasi relatife tinggi terutama unsur N yang diberikan dalam bentuk NO3- dan NH4+ (nitrat dan amonium). George dan
Sherington (1984), mengungkapkan kandungan media kultur jaringan yaitu unsur hara makro (N, P, K, Ca, Mg, dan S), unsur hara mikro (Fe, Mn, Zn, Co, Mo, B, dan Cu), ditambah dengan sukrosa sebagai sumber karbon bagi tanaman.
Induksi Mutasi dengan Iradiasi Sinar Gamma
Mutasi adalah perubahan genetik baik gen tunggal maupun sejumlah gen atau susunan kromosom. Mutasi lebih banyak terjadi pada bagian jaringan yang masih aktif mengadakan pembelahan sel seperti tunas, biji, dan sebagainya. Menurut Syarifah (2006) mutasi sebenarnya dapat terjadi secara alamiah di alam, tetapi peluang kejadiannya sangat kecil yaitu 10-7 – 10-6. Untuk meningkatkan mutasi alami, dilakukan mutasi buatan dengan menggunakan mutagen. Mutagen dapat dikelompokkan kedalam 3 golongan yaitu: (1) mutagen kimia, seperti EMS (Ethyl Methane Sulfonate), DES (Diethyl Sulfate) dan NMU (Nitrosomethyl Urea), (2) mutagen fisik iradiasi, seperti sinar x, sinar β, dan sinar γ, (3) mutagen fisik non-radiasi, seperti sinar UV (Poespodarsono 1988).
Induksi yang banyak digunakan saat ini yaitu induksi mutasi fisik radiasi. Prinsip dari induksi radiasi yaitu sel yang diradiasi dibebani oleh tenaga kinetik yang tinggi sehingga dapat mempengaruhi atau mengubah reaksi kimia yang ada dalam jaringan tanaman, yang pada akhirnya menyebabkan perubahan susunan kromosom (Poespodarsono 1988). Sumber iradiasi yang sering digunakan yaitu sinar gamma dari Cobalt 60. Kelebihan sinar gamma yaitu karena energi dan daya tembusnya yang relatif tinggi, serta secara global telah terbukti paling efektif dan efisien dalam menghasilkan varietas unggul bermacam jenis tanaman (Maluszynski, et al 2000).
Penyakit Busuk Pangkal Batang (Gummosis)
Gummosis pada jeruk pertama kali didiskripsikan di Azores pada tahun 1934 (Fawcett 1925). Gejala penyakit yang disebabkan P. citrophthora bervariasi
7
antar kultivar. Faktor-faktor lingkungan memiliki peran penting dalam pembentukan gejala. Gejala penyakit ini umumnya menyerang bagian pangkal batang dekat permukaan tanah atau pada bagian antara batang atas dan bawah bibit jeruk okulasi.
Gejala yang ditimbulkan oleh Phytophthora
Penyakit ini umumnya menyerang pada bagian pangkal batang dekat permuakaan tanah atau pada bagian sambungan atara batang atas dan batang bawah bibit jeruk. Gejala awal tampak berupa bercak basah yang berwarna gelap/hitam kebasah-basahan pada permukaan kulit pangkal batang (Erwin dan Ribeiro 1996). Jaringan kulit kayu yang terserang mengalami perubahan warna bahkan permukaan kulit, kambium, kayu, terutama pada serangan lanjut. Kulit batang yang terserang, permukaannya cekung dan mengeluarkan blendok, dan pada tanamaan terserang sering terbentuk kalus. Kematian tanaman akibat serangan penyakit ini terjadi apabila bercak pada kulit melingkari batang. Perkembangan bercak ke bagian atas, umumnya terbatas hingga 60 cm di atas permukaan tanah, sedangkan perkembangan ke bagian bawah dapat meluas ke bagian akar tanaman.
Gejala yang ditimbulkan oleh Botrydiplodia
Penyakit ini dikenal dua macam yaitu Diplodia basah dan Diplodia kering. Penyakit ini menyerang akar, batang dan ranting dan dapat mengakibatkan busuk akar, busuk leher dan mati ranting. Serangan Diplodia basah ditandai dengan keluarnya blendok yang berwarna kuning emas dari batang atau cabang-cabang tanaman. Kulit tanaman yang terserang tidak dapat sembuh kembali, kulit yang terserang kering dan mengelupas. Serangan Diplodia kering gejala awalnya sukar diketahui. Kulit batang atau cabang tanaman yang mengering terdapat celah-celah kecil pada permukaan kulit. Pada bagian celah-celah kulit terdapat spora cendawan yang berwarna putih atau hitam. Perluasan kulit yang mongering sangat cepat dan bila sampai menggelang tanaman dapat menyebabkan kematian tanaman.
8
Phytophthora citrophthora
Phytophthora citrophthora pertama kali diisolasi oleh Smith dari buah lemon yang busuk, semenjak itu P. citrophthora dikenal sebagai patogen utama dari buah jeruk yang mengakibatkan mahkota busuk, gumosis, busuk akar, serta busuk kecoklatan pada buah (Erwin dan Ribeiro 1996).
Karakteristik
Dimana ciri dari koloni Phytophthora sp. yaitu miselium berwarna putih, berbentuk rosaceus, dan secara mikroskopis hifanya tidak bersekat, bercabang, hialin (Henuk 2010). Miselium berkembang dengan baik interselular. Zoospora berbentuk oval atau lemon, terbentuk pada tangkai sporangia atau sporangiosfor. Reproduksi seksual dilakukan melalui fusi karakteristik oogonia dan antheridia yang kemudian menghasilkan oospora. Oospora berkecambah membentuk miselium yang kemudian dapat membentuk sporangia dan zoospora. Klamidospor terbentuk pada tanah pada saat kondisi lingkungan tidak memungkinkan atau kurangnya kelembaban (Erwin dan Ribeiro 1996).
Siklus Patogen
P. citrophthora merupakan patogen saprofit fakultatif. Jika tanahnya dalam keadaan lembab maka memungkinkan patogen untuk melakukan infeksi.
9
Botryodiplodia theobromae
Karakteristik B. theobromae
Ciri dari Bortyodiplodia yaitu miselium aerial, awalnya berwarna putih setelah 4-5 hari menjadi hitam kehijauan sampai keabu-abuan, setelah 10 hari miselium menjadi hitam. Secara mikroskopis hifa bersekat awalnya hialin kemudian menjadi coklat dan bersekat (Henuk 2010). Memiliki stadia seksual (teleomorfik) dan stadia aseksual (anamorfik). Spora seksual yang diproduksi disebut askuspora. Spora aseksual (konidia) diproduksi pada hifa dalam struktur tubuh buah aseksual (piknidia).
Siklus Patogen
Spora (konidia) berkecambah membentuk miselium berkembang menjadi piknidia atau badan buah aseksual, dalam piknidia dihasilkan konidia, kumpulan dari piknidia ini disebut stroma.
BAHAN DAN METODE
Waktu dan Tempat
Perbanyakan P. citrophthora dan B. theobromae dilaksanakan di Laboratorium Mikologi Tumbuhan Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, sedangkan perbanyakan planlet mutan dilakukan di Laboratorium Biologi Sel dan Jaringan, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian. Penelitian dilaksanakan dari bulan Februari sampai Agustus 2010.
Bahan dan Alat
Bahan tanaman yang dipakai yaitu biji buah JC, planlet mutan jeruk batang bawah JC hasil peningkatan keragaman genetik dengan induksi mutasi fisik dengan dosis radiasi sinar gamma 1000, 2000, 3000 rad. Isolat P.citrophthora dan B. theobromae. Media yang dipakai media dasar MS (Murashige-Skoog), KVMV (Kontrol Vitamin Morel Wetmore), PDA (Potato Dextros Agar), dan V8. Bahan Sterilisasi yang digunakan Alkohol 70%, alkohol 96%, dan aquades steril. Bahan lain yang digunakan yaitu HCL 1.0 N dan 0.1 N, NaOH 1.0 N dan 0.1 N, alumunium foil, plastik wrap, spirtus, tisu, agar.
Peralatan untuk pembuatan media yaitu gelas ukur, labu takar, Erlenmeyer, gelas piala, pipet volumetrik, magnetic stirrer, spatula, hot plate, botol kultur, corong, timbangan analitik, pH meter, autoclave, dan oven. Peralatan untuk menanam antara lain Laminar Air Flow Cabinet, petridhis, lampu bunsen, pinset, hand sprayer, pisau, dan gunting. Peralatan lain yang digunakan yaitu ruang gelap, ruang kultur, rak kultur, penggaris, kamera digital.
11
Metode Penelitian
Persiapan Inokulum P. citrophthora
Isolat P. citrophthora merupakan hasil isolasi dari batang kayu jeruk yang berasal dari Desa Oehala, Kabupaten Soe, Nusa Tenggara Timur. Batang kayu yang menunjukan gejala terlebih dahulu dicuci menggunakan air mengalir, kemudian bagian yang sakit dipotong dengan ukuran 1x1cm, dan didesinfeksi dengan larutan klorok 0.5% selama 30 detik. Selanjutnya dibilas dengan air steril, dikeringkan dengan kertas tisu dan ditanam pada media Potato Dextrose Agar (PDA). Setelah 3 sampai 4 hari masa inkubasi cendawan yang menunjukan ciri koloni Phytophthora sp. dibiakan pada media V8 untuk merangsang sporulasi.
Persiapan Inokulum B. theobromae
Isolat B. theobromae hasil dari isolasi tanah yang berasal dari Lampung. Isolasi dilakukan dengan metode trapping. Tanah diinokulasikan pada buah apel. Setelah tiga hari masa inkubasi pada baki steril, bagian buah apel yang berwarna coklat diambil secara aseptik dan diletakkan di atas media PDA. Setelah 3 hari masa inkubasi cendawan yang menunjukan ciri koloni Botryodiplodia dibiakan pada media PDA untuk mendapatkan biakan murni dan diidentifikasi.
Perbanyakan Planlet Japansche Citroen
Planlet berasal dari biji jeruk yang masih muda, berukuran ± 1 mm. Biji jeruk yang digunakan berasal dari buah muda JC dengan diameter antara 1-2 cm. Buah disterilkan terlebih dahulu dengan cara dicuci bersih kemudian direndam dengan menggunakan alkohol 96% selama 5 menit, kemudian buah dibakar dalam laminarflow untuk mengurangi kontaminasi saat pemisahan biji dan buah. Setelah itu buah dikupas menggunakan pisau steril dan dikeluarkan bijinya. Selanjutnya biji jeruk ditanam pada media kontrol vitamin morel wetmore (KVMW). Biji diinkubasi di ruang gelap dengan suhu ± 21oC. Setelah ± 1-2 bulan tumbuh tunas, tunas dipisahkan dari kulit biji dan ditanam pada media Murashige and Skoog (MS). Biakan kemudian disimpan di ruang kultur dengan suhu ± 21oC, dengan penyinaran lampu TL.
12
Perbanyakan Mutan Japansche Citrus
Perbanyakan mutan dilakukan dengan cara mengisolasi 1-2 buku tunas terminal dari planlet penelitian sebelumnya, uji ketahanan mutan jeruk dengan dosis radiasi 1000, 2000, 3000 rad dan tanpa perlakuan iradiasi terhadap cekaman kekeringan. Eksplan dikulturkan pada media KVMW dengan penambahan ekstrak malt 500 mg/l. Sumber karbon yang digunakan adalah sukrosa 30 g/l dan dipadatkan dengan phytagel 2,5 g/l. Kemasaman media diatur 5,8 dengan menambahkan KOH atau HCl 1N. Planlet diinkubasi di ruang kultur dengan temperatur ± 21oC, dengan penyinaran lampu TL.
Uji Media Tanam Jeruk, P. citrophthora dan B. theobromae
Pembuatan media menggunakan media yang biasa digunakan untuk media tumbuh jeruk, P. citrophthora, B.theobromae, antara lain Murashige and Skoog (MS) merupakan media yang biasa digunakan untuk planlet, Potato Dextrose Agar (PDA) merupakan media yang biasa digunakan untuk B. theobromae dan P. citrophthora, V-8 merupakan media selektif yang baik untuk tumbuh P. citrophthora, MSPDA merupakan media campuran MS dan PDA, MSV8 merupakan media campuran MS dan V8. Peubah yang diamati adalah pertumbuhan patogen dan planlet pada masing-masing media. Pertumbuhan patogen diamati dengan mengukur diameter dalam waktu seminggu. Sedangkan pada planlet yang diamati adalah tinggi planlet, jumlah buku, jumlah daun, serta visual planlet dalam waktu satu bulan.
Uji Ketahanan In vitro Planlet
Planlet jeruk yang berumur ± 4-5 bulan dengan jumlah buku tiga dalam keadaan sehat disubkultur ke dalam tabung kultur berisi media MSPDA bersamaan dengan inokulasi patogen. Biakan patogen dilubangi dengan menggunakan cork borer dengan diameter 2 mm diletakkan di bagian pangkal batang. Tabung kultur diletakan pada ruang kultur dengan suhu ± 21oC, dan penyinaran lampu TL. Pengamatan terhadap keparahan penyakit dilakukan setiap hari selama 2 minggu.
13
Rancangan Percobaan dan Analisis Data
Percobaan dilakukan menggunakan Rancangan Acak Lengkap (RAL), dengan dua faktor perlakuan dan empat ulangan. Faktor pertama adalah dosis radiasi yaitu tanpa iradiasi (JC), dosis iradiasi 1000 rad (J1000), 2000 rad (J2000), dan 3000 rad (J3000), sedangkan faktor kedua adalah patogen yaitu P.citrophthora dan B. theobromae.
Pengamatan Tingkat Keparahan Penyakit dan Laju Infeksi
Persentase kerusakan nekrosis dan gumosis pada planlet digunakan untuk menentukan tingkat keparahan penyakit dengan menggunakan metode pemberian skor skala 0 sampai 4 yang dilakukan secara kualitatif (Tabel 1).
Tabel 1 Nilai skoring penyakit pada planlet yang terinfeksi penyebab penyakit BPB (Sinaga, komunikasi pribadi)
Nilai skor % nekrosis dan gumosis Keterangan
0 0 ≤ x < 5 Tidak ada infeksi
1 5 ≤ x < 20 Serangan ringan
2 20 ≤ x < 40 Serangan sedang
3 40 ≤ x < 60 Serangan cukup berat
4 60 ≤ x < 100 Serangan sangat berat
Keparahan penyakit dihitung menggunakan rumus Townsend & Heuberger dalam Aripin et al. (2003):
KP =
x 100%
KP = keparahan penyakit ni = jumlah planletvi = nilai skor dari masing masing kategori
N = jumlah planlet yang diamati Z = nilai skor tertinggi
14
Laju infeksi penyakit dapat diukur dengan menggunakan rumus:
r = 1/ t2 –t1 (ln x 2 / 1- x 2 – ln x 1/1- x 1)
r = laju infeksit = waktu pengamatan
x = proporsi bagian tanaman atau bagian dari populasi tanaman yang terkena infeksi atau sakit
HASIL DAN PEMBAHASAN
Tingkat Keparahan Penyakit
Hasil analisis sidik ragam untuk mengevaluasi ketahanan pada berbagai perlakuan dosis radiasi mutan dan jenis patogen menunjukan bahwa perlakuan patogen berpengaruh nyata terhadap tingkat keparahan penyakit. Setelah dilakuakan uji lanjut Duncan hasilnya seperti pada tabel 1.
Tabel 1 Pengaruh iradiasi terhadap persen keparahan penyakit pada hari ke enam setelah inokulasi P. citrophthora dan B. theobromae
Perlakuan Iradiasi Persen keparahan1)
P. citrophthora B. theobromae JC 68.75a 81.25a J1000 75.00 a 93.75a J2000 50.00 b 93.75a J3000 62.50 ab 87.50a 1)
Angka yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf α 0.05
Persen keparahan penyakit merupakan proporsi ekspresi area tanaman yang mengalami infeksi penyakit karena serangan patogen dalam satu tanaman. Persen keparahan penyakit menentukan tingkat serangan pertanaman dalam populasi (Sinaga 2010). Pada tabel 1 terlihat bahwa dosis iradiasi sebesar 2000 rad terhadap P. citrophthora memiliki nilai persen keparahan yang nyata lebih rendah jika dibandingkan dengan planlet jeruk tanpa radiasi yaitu masing-masing sebesar 50% dan 68.75%. Sedangkan persen keparahan planlet dengan iradiasi 1000 dan 3000 rad masing- masing sebesar 75% dan 62.50%. Tampak bahwa dengan dosis iradiasi 1000 rad planlet mutan memiliki tingkat keparahan tertinggi hal ini tidak sesuai dengan evaluasi pada penelitian sebelumnya terhadap cekaman kekeringan. Diduga hal ini disebabkan karena terjadinya recovery (mutasi dapat kembali normal) dari sel-sel yang dapat mengalami mutasi (Nur 2010).
Pengaruh dosis radiasi terhadap tingkat keparahan penyakit dengan inokulasi B. theobromae menunjukan nilai yang lebih tinggi dibandingkan dengan inokulasi P. citrophthora. Berdasarkan hasil analisis yang diperoleh B. theobromae menyebabkan persen keparahan hampir mencapai 100%. Dengan teknik uji ketahanan yang dilakukan menunjukan dosis iradiasi tidak berpengaruh
16
nyata terhadap persen ketahanan penyakit. Tingkat keparahan yang tinggi dipengaruhi oleh sifat patogen yang virulen serta jumlah populasi dari patogen yang banyak, hal ini dapat dilihat bahwa dalam kurun waktu tiga hari B. theobromae sudah dapat menutupi seluruh permukaan media uji, dan dengan jumlah yang banyak dapat menimbulkan keparahan yang lebih tinggi.
Planlet mutan hasil inokulasi jeruk JC dengan patogen P. citrophthora dan B. theobromae diketahui tidak ada planlet mutan yang tahan. Hasil parameter pengamatan persen keparahan penyakit menunjukan bahwa dengan teknik pengujian ketahanan penempelan inokulum pada pangkal batang tidak ada planlet yang tahan terhadap patogen. Hal ini tidak sesuai yang diharapkan bahwa akibat penggunaan radiasi sinar gama dapat terjadi perubahan pada planlet jeruk yang dapat meningkatkan keragaman genetik yang tahan terhadap faktor abiotik maupun biotik, salah satunya tahan terhadap penyakit. Kondisi ini dimungkinkan karena adanya kerusakan pada sel meristem yang sangat sensitive terhadap peningkatan dosis iradiasi yang cenderung menghambat pertumbuhan sel-sel tunas bahkan dapat mematikan. Menurut Duncan (1997) iradiasi sinar gamma dapat menyebabkan ketidak seimbangan fisiologis tanaman. Semakin tinggi dosis iradiasi sinar gamma, semakin meningkatkan efek kerusakan pada DNA, dosis tertentu dapat mengakibatkan perubahan struktur kromosom (Harten 1998). Lemahnya kondisi planlet dapat meningkatkan keparahan planlet semakin meningkat.
Metode evaluasi in vitro telah dimanfaatkan pada berbagai tanaman untuk menghasilkan varietas baru dengan sifat yang baru dan diwariskan pada turunanya (Husni dan Kosmiatin 2005). Hal ini untuk menyeimbangi perubahan-perubahan yang mungkin terjadi pada patogen yang dapat meningkatkan sifat patogenisitasnya atau terbentuknya suatu ras baru yang lebih virulen. Salah satunya dengan induksi iradiasi dapat menyebabkan mutasi pada planlet karena sel yang diiradiasi dibebani oleh tenaga kinetik yang tinggi sehingga dapat mempengaruhi atau mengubah reaksi kimia yang ada dalam jaringan tanaman, yang pada akhirnya menyebabkan perubahan susunan kromosom (Poespodarsono 1998). Menurut Das et al (2000) mutasi yang dihasilkan melalui mutagen fisik telah intensif digunakan untuk memperbaiki sifat tanaman.
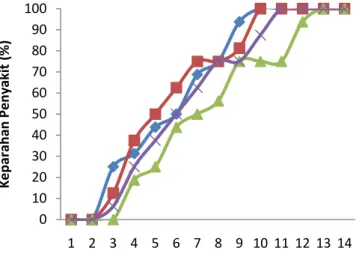
17
Perlakuan iradiasi dengan dosis 2000 rad dapat menunda terjadinya kematian pada planlet. Perlakuan dosis iradiasi 2000 rad (J2000) memiliki laju infeksi paling rendah yaitu sebesar 0.091. Sedangkan laju infeksi JC sebesar 0.116 berbeda nyata dengan J1000 dengan laju infeksinya sebesar 0.115, hal ini menunjukan bahwa planlet J1000 tidak berpengaruh dalam ketahanan jika dibandingkan dengan JC. Sedangkan laju infeksi perlakuan dengan dosis iradiasi 3000 rad tidak berbeda nyata bila dibandingkan dengan JC dan J1000, yaitu sebesar 0.107. Tingkat laju infeksi menunjukan semakin besar nilai laju infeksi maka infeksi yang terjadi semakin cepat, semakin cepatnya infeksi maka patogen lebih mudah untuk menimbulkan penyakit. Perlakuan iradiasi 2000 rad pada kalus memiliki tingkat laju infeksi paling rendah, hal ini menunjukan planlet jeruk 200 rad relative lebih tahan terhadap P. citrophthora.
Gambar 8 Persen keparahan penyakit pada mutan JC yang mendapat iradiasi sinar gama (0, 1000, 2000, 3000 rad) dengan inokulasi P. citrophthora 0 10 20 30 40 50 60 70 80 90 100 1 2 3 4 5 6 7 8 9 10 11 12 13 14 K e p ar ah an Pen yaki t (% )
18
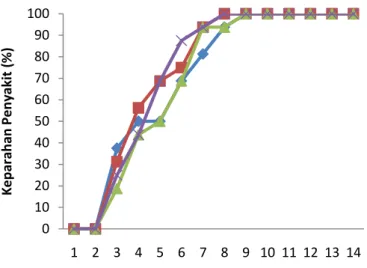
Gambar 9 Persen keparahan penyakit pada mutan JC yang mendapat iradiasi sinar gama (0, 1000, 2000, 3000 rad) dengan inokulasi B. theobromae
Laju infeksi dengan perlakuan iradiasi 2000 rad pada patogen B. theobromae sebesar 0,142. Sedangkan laju infeksi perlakuan iradiasi 1000 dan 3000 rad serta tanpa iradiasi pada planlet jeruk, berturut-turut sebesar 0,156; 0,164 dan 0,131. Dilihat dari selisih nilai laju infeksi setiap perlakuan tidak berbeda. Hal ini menunjukan bahwa iradiasi planlet mutan jeruk tidak menunjukan ketahanan planlet terhadap B. theobromae.
Gejala Penyakit Busuk Pangkal Batang
Gejala penyakit busuk pangkal batang tampak pada planlet jeruk yang diberi perlakuan dosis iradiasi 0, 1000, 2000, dan 3000 rad dan diinokulasi P. citrophthora dan B. theobromae. Pada hari pertama dan kedua setelah inokulasi (HSI) P.citrophthora dan B. theobromae gejala pada planlet jeruk belum muncul, namun inokulum patogen sudah mulai berkembang. Periode inkubasi pada semua planlet jeruk yaitu tiga HSI, dengan munculnya gejala awal berupa klorosis. Menurut Agrios (1996) klorosis merupakan gejala awal yang ditunjukan dengan gejala berupa menguningnya jaringan tanaman akibat nekrotik jaringan kloroplas. Kloropas pada daun muncul dari ujung daun planlet bagian atas, ujung daun tersebut berwarna hijau kekuningan (Gambar 1). Klorosis yang terjadi pada
0 10 20 30 40 50 60 70 80 90 100 1 2 3 4 5 6 7 8 9 10 11 12 13 14 K e p ar ah an Pen yaki t (% )
Waktu pengamatan (hari)
JC J1000 J2000 J3000
19
planlet selain disebabkan karena perkembangan patogen juga dapat terjadi karena adanya persaingan dalam memperoleh unsur hara pada media.
Gambar 1 Gejala awal klorosis dengan (A) inokulum P. citrophthora (B) inokulum B. theobromae
Nekrosis merupakan gejala penyakit yang ditandai dengan degenerasi protoplas lalu diikuti dengan matinya sel-sel jaringan, organ, dan seluruh tumbuhan (Sinaga 2000). Menurut Umezurike (1979) nekrosis terjadi karena adanya aktifitas patogen yang menghasilkan enzim selulitik untuk mendegradasi selulosa dan hemiselulosa pada jaringan kayu bibit jeruk sehingga menjadi senyawa dengan rantai yang lebih pendek dan dapat diabsorb oleh patogen, namun dapat berakibat matinya jaringan tanaman. Agrios (1996) menyatakan bahwa penyakit BPB dapat terjadi oleh gangguan inokulum patogen terhadap translokasi air pada tanaman pembuluh xylem dan floem. Nekrosis yang lebih lanjut dapat menyebabkan daun berwarna coklat dan mati (Gambar 2). Pada inokulum P. citrophthora daun berubah warna menjadi coklat dan pada daun dengan inokulum B. theobromae daun berubah warna menjadi hitam. Peneliti lain Maryono (2010) melaporkan gejala penyakit BPB dengan inokulasi buatan isolat B. theobromae yang sama pada bibit JC menyebabkan gejala nekrosis pada kambium dan pembuluh, namun perkembangannya sangat lambat (Gambar 3).
B A
20
Gambar 2 Gejala lanjut Nekrosis dengan (A) Inokulum P.citrophthora (B) Inokulum B. theobromae
Gambar 3 Gejala nekrosis pada batang jeruk 2 bulan setelah inokulasi (foto: oleh Tri Maryono)
Nekrosis yang terus berkembang diikuti gejala gumosis, menurut Agrios (1996) gumosis atau sering disebut blendok merupakan gejala yang khas dalam penyakit BPB. Gumosis ini merupakan cairan yang dihasilkan tumbuhan sebagai respon inang terhadap serangan patogen atau adanya benda asing dalam jaringan tanaman. Planlet jeruk yang diinokulasi P. citrophthora menimbulkan gejala gumosis rata-rata 6 HSI, sedangkan pada B. theobromae perkembangan gejala gumosis lebih cepat yaitu rata-rata 4 HSI. Gambar 4 menunjukan perbandingan gejala gumosis penyakit BPB di lapangan dan in vitro. Pada inokulasi P. citrophthora gumosis berwarna kuning bening dan lebih cair atau encer seperti tampak pada gambar 4A. Hal ini sesuai dengan laporan Balitjestro (2006) bahwa kulit kayu yang terserang patogen Phytophthora spp. permukaannya cekung dan
21
tidak merata dan mengeluarkan gumosis encer. Pada gambar 4B gejala di lapangan, gumosis lebih encer dan mudah meluas. Sedangkan planlet yang diinokulasi B. theobromae gumosis berwarna kuning kecoklatan dan lebih kental (Gambar 4C) begitu juga gejala yang ditemukan di lapangan yang mana gumosis berwarna lebih gelap (Gambar 4D). Pada gambar 5 menunjukan gejala gumosis pada bibit JC yang terserang penyakit BPB, tampak gumosis keluar dari pangkal batang dekat titik penyambungan okulasi. Balai Penelitian Jeruk dan Buah Subtropika, Malang, Jawa Timur melaporkan bahwa pada pembibitan jeruk JC disana tidak sedikit bibit yang terserang penyakit BPB.
Gambar 4 Gejala Gumosis atau Blendok: (A) pada Planlet jeruk dengan inokulasi P. citrophthora, (B) pada batang jeruk di lapangan yang disebabkan oleh Phytophthora spp., (C) pada planlet jeruk dengan inokulasi B. theobromae, (D) pada batang jeruk di lapangan yang disebabkan oleh Bortydiplodia
Gambar 5 Gejala gumosis pada pembibitan JC (foto: Julinda Henuk) D
C B
22
Gambar 6 Sindrom gejala dengan inokulasi P. citrophthora (A) 3-4 HSI, (B) 5-6 HSI, (C) 7-9 HSI, (D) 10-11 HSI, (E) 11-12 HSI, (F) 13-14 HSI
Gambar 7 Sindrom gejala dengan inokulasi B. theobromae (A) 3-4 HSI, (B) 5-6 HSI, (C) 7-9 HSI, (D) 10-11 HSI, (E) 11-12 HSI, (F) 13-14 HIS
A
B
C
F
E
D
A
B
C
D
E
F
23
Gambar 6 dan 7 menunjukkan perkembangan pertumbuhan gejala dengan infeksi P. citrophthora lebih lambat dibandingkan dengan B. theobromae. Pada 13 HSI koloni P. citrophthora lebih sedikit dibandingkan dengan B. theobromae yang telah menutupi permukaan media dan planlet jeruk. Perlakuan inokulasi permukaan planlet dengan P. citrophthora telah terselimuti koloni patogen rata-rata 12 HSI, sedangkan pada inokulasi B. theobromae koloni miselium menutupi seluruh permuakaan planlet pada 7 HSI. B. theobromae mulai membentuk stroma berwarna hitam yang merupakan matriks hifa vegetatif dan bentuknya seperti sklerotium pada 13 HSI. Stroma terbentuk membentuk piknidia yang di dalamnya terdapat konidia. Pada suhu kamar, Phytophthora sp. yang dibiakkan pada media PDA dapat tumbuh memenuhi cawan petri dengan diameter 9 cm pada 21 HSI, sedangkan Botryodiplodia sp. mempunyai kemampuan tumbuh lebih cepat yaitu, 3 sampai 7 HSI (Henuk 2010).
Perkembangan kedua patogen ini dipengaruhi oleh karakter masing-masing patogen. P. citrophthora merupakan organisme hemibiotrop, dapat menyerang dan mendapatkan makanan dari jaringan hidup, tetapi masih mampu berkembang dan bersporulasi setelah jaringan inangnya mati (Sinaga 2000). Meskipun patogen ini lambat, namun patogen pasti akan mematikan, sedangkan B. theobromae memiliki siklus hidup yang lebih cepat dan juga dapat mematikan inangnya. Lain halnya di lapangan inokulasi patogen yang sama, B. theobromae pada bibit jeruk JC baru menunjukan gejala nekrosis ± 2 bulan setelah inokulasi buatan (Maryono 2010). Dibandingkan dengan inokulasi in vitro, waktu yang dibutuhkan untuk mengetahui terjadinya proses infeksi yang ditunjukan oleh penyakit BPB jauh lebih lama. Hal ini menunjukan bahwa perkembangan gejala berkorelasi positif dengan proses infeksi patogen. Berdasarkan perkembangan gejala penyakit yang terjadi dengan metode inokulasi patogen pada planlet jeruk dapat digunakan sebagai teknik uji ketahanan in vitro BPB jeruk. Keuntungan lain dari teknik ini ialah penghematan waktu evaluasi ketahanan BPB jeruk.
KESIMPULAN DAN SARAN
Kesimpulan
Hasil evaluasi in vitro ketahanan jeruk mutan dengan radiasi 1000, 2000, dan 3000 rad terhadap BPB yang disebabkan oleh P. citrophthora dan B. theobromae diketahui ada planlet jeruk yang tahan terhadap kedua patogen. Teknik evaluasi ketahanan dengan cara penempelan inokulum pada planlet dapat digunakan untuk memberi informasi awal mengenai ketahanan.
Saran
Perlu dilakukan penelitian lanjutan untuk memvalidasi teknik uji ketahanan planlet dengan cara penempelan inokulum dengan uji ketahanan tanaman jeruk setelah aklimatisasi.
DAFTAR PUSTAKA
Agrios G. 1996. Plant Pathology. Ed ke-3. New York: Academic Press.
Aripin K, Lubis L, Zulnayati. 2003. Pengaruh jenis tanah terhadap serangan jamur akar putih (Rigidoporus mikroporus Swarrzi. FR ) van ov pada tanaman karet. [laporan penelitian]. http://www.library.usu.ac.id. [5 juli 2010] Badan Litbang Departemen Pertanian. 2005. Prospek dan Arah Pengembangan
Agribisnis Jeruk. hal 39.
Balitjestro. 2006. Penyediaan Batang Bawah dalam Pengelolaan Blok Penangkar Benih. http://www.citrusindo.org [3 Juli 2010]
Balitjestro. 2004. Masyarakat Jeruk Indonesia. Website:http:www.citrus-indonesia.com.[3 Mei 2009]
Drenth A, David IQ. 2004. Principles of P. citrophthora Disease Management. ACIAR Monograph 114:154.
Direktorat Perlindungan Tanaman Hortikultura. 2006. Peta penyebaran serangan OPT pada tanaman hortikultura. hal 14.
Duncan RR. 1997. Tissue Culture Induced Variation and Crop Improvement. Adv Agron. 58:201-204.
Erwin, DC and Olaf K. Ribeiro. 1996. Phytophthora Diseases Worldwide. Minnesota : The American Phytopathological Society.
George EF and Sherington PD. 1984. Plant Propagation by Tissue Culture. Exegenetics 1-72p.
Graham, JH and L.W. Timmer. 2008. Phytophthora diseases of citrus. Citrus Research and Education Centre, Lake Alfred, Institute of Food and agricultural Sciences, University of Florida.13p.
Harten VA. 1998. Mutation Breeding. Theory and Practical Aplication New York. Cambrige University Press. Hal 111-162.
Henuk JBD. 2010. Identifikasi dan Uji Patogenisitas Penyebab Busuk Pangkal Batang pada Jeruk (Citrus spp.) dari Beberapa Sentra Produksi Jeruk di Indonesia [Tesis]. Bogor : Institut Petanian Bogor, Fakultas Pertanian. Husni A, Kosmiatin M. 2005. Penerapan Teknologi Fusiprotoplas dalam
Perakitan Jeruk Lokal Tipe Baru. Laporan Hasil Penelitian Program Insentif Terapan Tahun 2005. Hal 42 (tidak dipublikasiakan
26
Maluszynki M, Nicterlein K, Van Zanten L and Ahloowalia BS. 2000. Officially released mutans varieties. Mutation Breeding 12:1-83.
Martias. 2004. Respon pertumbuhan bibit jeruk JC terhadap pemberian CaCO3
dan pupuk P pada tanah Ultisol. J. Hort.14 (1): 33-40
Maryono T. 2010. Peran FMA dan PGPR dalam Menginduksi Ketahanan Tanaman Jeruk terhadap Penyakit Busuk Pangkal Batang [Tesis]. Bogor : Institut Pertanian Bogor, Fakultas Pertanian.
Masyarakat Jeruk Indonesia. 2004. Varietas Batang Bawah Jeruk dan Sifatnya. http://www.citrus-Indonesia.com. [ 3 Juli 2010]
Miller PM. 1995. V8-Juice agar as general purpose medium for fungi and bacteria. Phytopathology 45: 461-462.
Mitra, S.K. 1997. Postharvest Physiology and Storage of tropical and Subtropical Fruits. UK : CAB Internasional.
Murashige T. and Skoog F. 1962. A Revised Medium for Rapid Growth and Bioassay with Tobacco Tissue Culture Physid Plant 15:473-497.
Nur Fitria. 2010. Seleksi Ketahanan Batang Bawah Jeruk (JC) terhadap Cekaman Kekeringan [Tesis]. Bogor : Institut Pertanian Bogor, Fakultas Pertanian. Poespodarsono S. 1988. Dasar-Dasar Ilmu Pemuliaan Tanaman. PAU- IPB
Bogor. hal 169.
Purbiati T, Supriyanto A dan Yati. 2002. Kompatibilitas Batang Atas dan Batang Bawah pada Penyambungan Tunas Pucuk (PTP) Jeruk (Citrus sp.) secara In Vitro. Balai Penelitian Jeruk dan Buah Subtropika. Tlekung.
Samson J.A. 1980. Tropical Fruit. Longman, London and New York. 250p. Sinaga MS. 2000. Dasar-dasar Ilmu Penyakit Tumbuhan. Bogor: Jurusan Hama
dan Penyakit Tumbuhan, Fakultas Pertanian IPB; Bogor.
Semangun H. 2004. Penyakit-penyakit Tanaman Holtikultura di Indonesia. Gadjah Mada University Press.
Slavov S. 2005. Phytotoxins and In vitro Screening for Improved Diseases Resistant Plants. Bulgaria. AgroBio Institute, Sofia.
Soedjono S. 2003. Aplikasi Mutasi Induksi dan Variasi Somaklonal dalam Pemuliaan Tanaman. Jurnal Litbang Pertanian 2:22.
Starrantino A and Caruso A. 1983. The development of tolerance cells to mineral stress. Hortikultura 19:377-382.
Steel RGD dan Torrie J. 1960. Principles and Procedurs of STATISTICS with Special Reference to the Biological Sciences. McGraw-Hill Bokk Company, Inc. New York.
27
Supriyanto A. 1990. Pengolahan pembibitan jeruk bebas penyakit dalam kantong plastic. Sub Balai Penelitian Holtikultura Tlekung. Hal 15.
Susanto S. 2003. Pertumbuhan dan Pembuahan Jeruk Besar Cikoneng pada Beberapa Jenis Batang Bawah. Jurnal Ilmu Pertanian. 1:57-63.
Syarifah IS. 2006. Seleksi In Vitro untuk Ketegangan terhadap Aluminium pada 4 genotipe Jagung. Jurnal Akta Agrosia 2:61-66.
Timmer LW, SM Garnsey, J.H Graham. 2000. Compendium of Citrus Diseases 2nd id. The American Phytophathological society. 92P.
Triatminingsih R, Karsinah. 2004. Perbanyakan Bibit Jeruk Citromelo dan JC secara In vitro. Jurn. Hort. 14(4):238245
Triwiratno A. 1998. Pengendalian Penyakit Blendok pada Tanaman Jeruk Besar. Balai pengkajian teknologi pertanian karang ploso.
Umezurike GM. 1979. The cellulolytic enzymes of Botryodiplodia theobromae Pat.: Separation and characterization of cellulases and β-glucosidases. Biochem. 177:9-19.
29
Tabel Lampiran 1 Komposisi media MS (Murashige and Skoog)
Larutan Bahan Kimia Konsentrasi Senyawa
dalam Media (g/l) KNO3 38 NH4NO3 33 Makro CaCl2.2H2O 8.8 MgSO4.7H2O 7.4 KH2PO4 3.4 MnSO4.H2O 1.69 ZnSO4.7H2O 0.86 H3BO3 0.62 KI 0.083 Mikro Na2MoO4.2H2O 0.025 CuSO4.5H2O 0.0025 CoCl2.6H2O 0.0025 FeSO4.7H2O 2.78 Na2.EDTA.2H2O 37.3 Phytagel 2.59 Gula 30
Tabel Lampiran 2 Komposisi Media KVMW (Kontrol Vitamin Morell Wetmore) Larutan Konsentrasi senyawa dalam media
(ml/liter) Makro 50 Mikro 10 FeEDTA 10 Inositol 10 Vitamin Morell 1
Biotin Morell dan Wetmore 1