Bab 7. Stoikiometri Larutan dan Titrasi Asam Basa. A. Reaksi dalam Larutan B. Titrasi Asam Basa
Teks penuh
Gambar

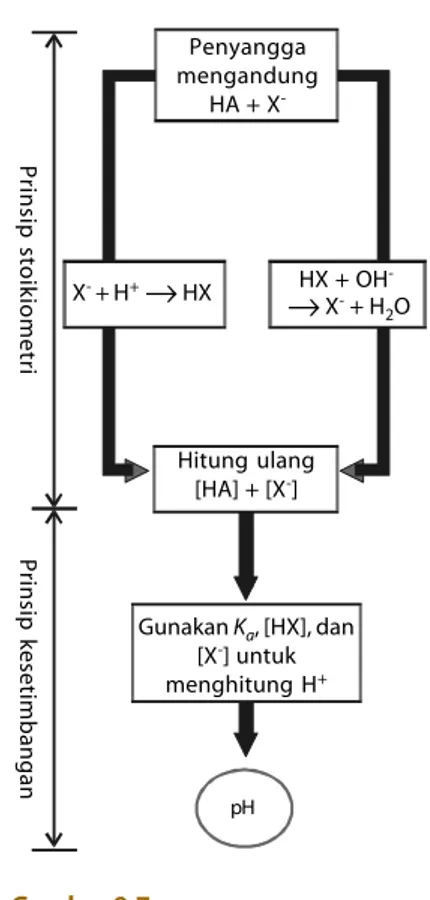
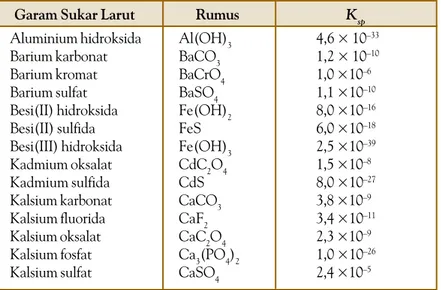
Garis besar
Dokumen terkait
❖ Zat pentiter adalah asam kuat. ❖ Daerah perubahan pH drastis 4-7. ❖ Indikator yang dapat digunakan adalah metil merah. Titrasi basa kuat dengan asam lemah. ❖ Zat
Garam yang kationnya adalah donor proton (garam yang kationnya dari basa lemah dan anionnya dari asam kuat). Garam yang kation-kationnya adalah asam dan anion- anionnya adalah
Skripsi yang berjudul “Pengembangan Modul Bergambar mengenai Larutan Asam Basa Stoikiometri dan Titrasi Asam Basa untuk Kelas XI SMA RSBI” yang disusun oleh Nendrowati,
hidrolisis.Berlangsungnya hidrolisis disebabkan adanya kecenderungan ion-ion tersebut untuk membentuk asam atau basa asalnya.Hidrolisis hanya dapat terjadi pada pelarutan
Larutan yang diuji pH Perubahan warna Kesimpulan (asam/ Basa/Netral) Lakmus merah Lakmus biru.. Larutan cuka dapur Larutan HCl 1M Larutan
Indikator asam basa adalah senyawa khusus yang ditambahkan pada larutan dengan tujuan mengetahui kisaran pH dari larutan tersebut. Indikator asam basa akan memberikan
4.1 Menjelaskan teori asan basa Arhenius, mengklasifikasi berbagai larutan asifikasi berbagai larutan ke dalam larutan asam, netral dan basa serta menghitung ke dalam larutan
Siswa menentukan konsentrasi ion dalam larutan Reaksi asam dan basa menghasilkan garam dan air Contoh : HCl terionisasi menjadi H+ dan Cl-, NaOH terionisasi menjadi Na+ dan OH-