PERCOBAAN VIII
SINTESIS DIAZOAMINOBENZEN
I. Tujuan Percobaan
Mempelajari reaksi garam diazonium dengan amina dalam sintesis diazoaminobenzen.
II. Tinjauan Pustaka
Garam diazonium adalah senyawa antara sistesis yang bermanfaat. Salah satunya dalam reaksi kupling diazonium. Nitrogen ujung pada kation diozonium digunakan sebagai suatu elektrofil dalam suatu reaksi substitusi elektrofilik pada aromatic. Sebagian besar produk tipe reaksi kupling diazonium berwarna cerah, dikenal dengan “azo-dyes”. Sintesis kombinatorial dibutuhkan untuk menyediakan beragam jenis senyawa dengan beragam fungsi dalam serangkaian reaksi yang dilakukan bersamaan. Dua pendekatan yang dapat dilakukan yaitu sintesisi parallel dan sintesis split. Dalam sistem parallel, tiap senyawa dibuat secara individu dan beragam uji dilakukan secara terpisah untuk tiap senyawa. Sedangkan sintesis split hasil ujinya memerlukan proses deconvolution (pemisahan campuran). Zat warna azo merupakan kelas zat warna yang terbesar dan terpenting, jumlahnya mencapai ribuan. Dalam pewarnaan-azo, mula-mula tekstil itu dibasahi dengan senyawa aromatik yang teraktifkan terhadap substitusi elektrofilik, kemudian diolah dengan suatu garam diazonium untuk menghasilkan zat warna (Fessenden dan Fessenden, 1986).
Amina adalah turunan organik dari ammonia dimana satu atau lebih atom hidrogen pada nitrogen telah tergantikan oleh gugus alkil atau aril. Karena itu amina memiliki sifat mirip dengan ammonia seperti alkohol dan eter terhadap air. Seperti alkohol, amina bisa diklasifikasikan sebagai primer, sekunder dan tersier. Meski demikian dasar dari pengkategoriannya berbeda dari alkohol. Alkohol diklasifikasikan dengan jumlah gugus non hidrogen yang terikat pada kaebon yang mengandung hidroksil. Namun amina diklasifikasikan dengan jumlah gugus
nonhidrogen yang terikat langsung pada atom nitrogen (Stroker dan Walker, 1991).
Amina dengan jumlah atom karbon dibawah enam biasanya larut dalam air akibat adanya interaksi ikatan hidrogen. Meskipun nitrogen tidak seelektronegatif oksigen namun mampu mempolarisasi ikatan N-H sehingga terbentuk gaya dipol-dipol yang kuat antara molekulnya. Amine tersier tidak memiliki atom hidrogen karena itu tidak terjadi ikatan hidrogen antara air dengannya atau dengan amin tersier lainnya.konsekuensinya titik didihnya lebih rendah dibanding amina primer atau sekunder. Salah satu sifat yang paling dikenal dari amina berbobot molekul rendah adalah aromanya yang tidak menyenangkan. Amine volatile ini menguap secara cepat dan terciup seperti campuran ammonia dan ikan busuk. Kebanyakan bahan yang membusuk terutama organ yang mengandung protein tinggi menghasilkan amina. Bagian dari aroma tumbuhan yang mati, rumah penyimpanan daging, dan bagian pengolahan limbah semuanya adalah amina (Stroker dan Walker, 1991).
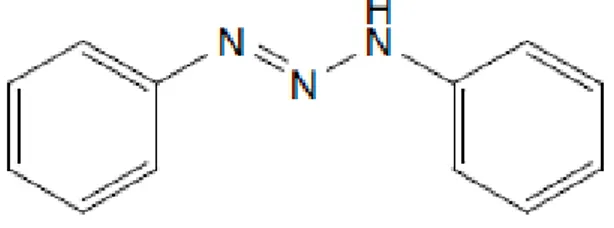
Gambar 1. Struktur Diazoaminobenzen
Diazoaminobenzene cukup diantisipasi menjadi karsinogen manusia berdasarkan bukti dari penelitian pada hewan percobaan dan pada jaringan manusia menunjukkan diazoaminobenzen yang dimetabolisme oleh benzene, yang dikenal bersifat karsinogenik pada manusia, dan bukti bahwa diazoaminobenzen. menyebabkan kerusakan genetik. Studi pada tikus dan tikus telah menunjukkan bahwa metabolisme diazoaminobenzene benzena adalah kuantitatif. Benzene tercantum dalam Laporan Tahunan Pertama di Karsinogen pada tahun 1980 berdasarkan studi epidemiologi manusia menunjukkan bahwa paparan benzena
menyebabkan leukemia. Benzene juga menyebabkan kanker pada berbagai situs jaringan pada hewan pengerat (Akron, 2009).
Diazoaminobenzen digunakan sebagai perantara, agen kompleks kimia, dan aditif polimer oleh Mathews dan De Costa pada tahun 1999. Diazoaminobenzen memiliki kegunaan yang berhubungan dengan sintesis organik dan pewarna serta pembuatan insektisida oleh Lewis pada tahun 1997 dan efektif untuk laser Abla-tion (mikro-mesin) dari polymethylmethacrylate oleh Bolle pada tahun 1990. Diazo aminobenzena telah diidentifikasi sebagai kontaminan tingkat rendah dalam pewarna A & P red no. 33, FD & C no kuning 5 (tartrazine), dan FD & C no kuning 6. Ketiganya diizinkan untuk digunakan dalam obat-obatan dan kosmetik, dan dua terakhir diizinkan dalam makanan (FDA, 2010).
Menurut Tim Dosen Kimia Organik Sintesis (2016), senyawa diazoamino disintesis dari senyawa garam diazonium dengan amina. Pada proses diazonisasinya asam klorida yang berlebih. Diazoaminobenzen dapat disintesis dari dua ekivalen anilin dengan tiga ekivalen asam klorida dan ditambahkan natrium nitrit yang diikuti dengan dua ekivalen natrium asetat.
Reaksi sintesis diazoaminobenzen:
Gambar 2. Reaksi sintesis diazoaminobenzen
Gugus diazonium mudah digeser selaku N2 oleh ion halida (F-, Cl-, Br-, atau I-)
atau ion sianida (-CN). Reaksi-reaksi ini memberikan rute aril fluorida, iodida, dan
nitril (ArCN), yang tak satu pun dapat diperoleh langsung dengan substitusi elektrofilik. Meskipun aril bromida dan aril klorida dapat disintesis dengan reaksi substitusi elektrofilik, produk-produknya sering tercemar dengan produk sampingan terdisubstitusikan. Penggantian diazonium menghasilkan senyawa monokloro atau monobromo murni, tak terkontaminasikan oleh produk disubstitusi (Fessenden dan Fessenden, 1986).
III. Metodologi
3.1. Waktu dan Tempat
Praktikum ini dilaksanakan pada hari Rabu, 2 Maret 2016, Pukul 08.00 WITA sampai selesai di Laboratorium Kimia Organik, Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Tadulako, Palu.
3.2. Alat dan Bahan 3.2.1. Alat
Adapun alat-alat yang digunakan pada percobaan ini yaitu neraca analitik, neraca ohaus, erlenmeyer 250 mL, gelas kimia 250 mL, gelas ukur 10 mL dan 50 mL, magnetic stirer, penyaring Buchner, batang pengaduk, termometer, botol semprot, melting point, pipa kapiler, bunsen, korek api, cawan petri, stopwatch, sendok zat, lemari asam, wadah es dan pipet tetes.
3.2.2. Bahan
Adapun bahan-bahan yang digunakan pada percobaan ini yaitu HCl pekat, anilin, natrium nitrit, natrium asetat, petroleum benzen, es batu, kertas saring, aluminium foil dan aquadest.
3.3. Prosedur Kerja
Memasukkan 37,5 mL aquadest, 10 mL HCl pekat, dan 6,85 mL anilin ke dalam erlenmeyer 250 mL. Kemudian mengocok dengan stirer dan selanjutnya menambahkan 25 gram serpihan es. Memasukkan 2,6 gram natrium nitrit dalam 6 mL aquadest, kemudian mengaduk sampai natrium nitrit larut. Melanjutkan pengocokan dengan stirer dan menambahkan larutan 10,5 gram kristal natrium asetat dalam 20 mL aquadest lalu mengocoknya. Endapan kuning diazoaminobenzen mulai terbentuk dengan seketika. Selanjutnya, melanjutkan pengocokan hingga 45 menit dan jangan membiarkan temperatur diatas 20 oC
(menambahkan es bila perlu). Menyaring endapan kuning diazoaminobenzen dengan penyaring Buchner dan mencuci dnegan 125 mL aquadest dingin, mengeringkan dengan sempurna. Rendemen crude diazoaminobenzen adalah sekitar 7,5 gram (titik leleh 91 oC). Merekristalisasi sebagian kecil crude
diazoaminobenzen dengan 100 mL benzene. Senyawa murni diazoaminobenzen diperoleh titik leleh 97 oC.
IV. Hasil dan Pembahasan 4.1. Hasil Pengamatan
No. Perlakuan Hasil
1. 2. 3. 4. 5. 6. 7. 8. 9. 32,5 mL air + 10 mL HCl pekat + 6,85 mL anilin + 25 gr serpihan es (kocok)
+ 2,6 gr NaNO2 dalam 6 mL air (aduk
5-10 menit)
+ 10,5 gr CH3COONa dalam 20 mL air
(5 menit)
Kocok larutan 45 menit (20oC)
Saring endapan dan cuci dengan 250 mL air dingin Keringkan Berat kristal Titik lebur Rekristalisasi Berat kristal Titik lebur Larutan bening
Larutan berwarna coklat Warna tetap
Larutan berwarna orange Larutan berwarna kuning kecoklatan
Terbentuk endapan berwarna kuning
Endapan berwarna coklat
50,603 gr 90oC
43,444 gr 95oC
Keterangan : Berat kaca arloji = 38,9 gr Berat kertas saring 1 = 0,485 gr Berat kertas saring 2 = 0,208 gr
4.2. Analisa Data
Diketahui : Berat HCl Pekat = 10 mL × 1,19 gr/mL = 11,9 gr Berat Anilin = 6,85 mL × 1,02 gr/mL = 6,987 gr Berat NaNO2 = 2,6 gr
Berat sebelum rekristalisasi = 11,218 gr Berat setelah rekristalisasi = 4,336 gr Ditanyakan : Rendemen sebelum rekristalisasi =...?
Rendemen setelah rekristalisasi =...? Penyelesaian :
Rendemen sebelum rekristalisasi= Berat sebelum rekristalisasiBerat jumlahbahan × 100
= (11,9+6,987+2,6+10,5) gr11,218 gr × 100
= 38,987 gr11,218 gr× 100
= 35,07%
Rendemen setelah rekristalisasi = Berat setelah rekristalisasiBerat jumlahbahan ×100
= (11,9 +6,987+2,6+10,54,336 gr )gr× 100
= 38,987 gr4,336 gr × 100 = 13,55%
4.6. Pembahasan
Senyawa diazoamino disintesis dari senyawa garam diazonium dengan amina. Pada proses diazonisasi digunakan asam klorida berlebih. Diazoaminobenzen dapat disintesis dari dua ekivalen aniline dengan tiga ekivalen asam klorida dan ditambahkan natrium nitrit yang diikuti dengan dua ekivalen natrium asetat. Pada praktikum ini memiliki tujuan yakni untuk mempelajari reaksi garam diazonium dengan amina dalam sintesis diazoaminobenzen. Pada sintesis
diazoaminobenzen dibuat dengan mereaksikan senyawa anilin dengan senyawa HCl pekat, NaNO2, dan CH3COONa.
Pertama-tama, mencampurkan HCl pekat dengan senyawa anilin dalam aquadest lalu mengocok larutan sampel dan menambahkan serpihan es yang berfungsi untuk membentuk garam diazonium. Pada pencampuran senyawa ini, aquadest dimasukkan lebih dahulu. Hal ini dikarenakan HCl pekat merupakan senyawa asam monoprotik yakni senyawa yang dapat terionisasi secara cepat melepaskan ion H+ dan ion Cl- dan larutan HCl bersifat eksoterm. Sehingga ion ion Cl- akan
berikatan dengan anilin membentuk garam. Fungsi dari anilin dalam percobaan ini yakni untuk membentuk garam diazonium dalam hal ini anilin bersifat basa lemah yang larut dalam mineral asam. Garam diazonium adalah senyawa organik yang diperoleh dari reaksi suatu amina aromatik primer yang dilarutkan atau disuspensikan dalam suatu larutan asam mineral dalam air. Atom N ujung pada kation diazonium digunakan sebagai suatu elektrofil dalam suatu reaksi substitusi elektrofilik pada aromatik. Sebagian besar produk tipe reaksi kupling diazonium berwarna cerah, dikenal dengan “azo-dyes”. Pembuatan garam diazonium disebut dengan reaksi diazotisasi/diazotasi yang berfungsi untuk pembuatan garam diazonium yang diperlukan tiga macam pereaksi, yaitu suatu amina aromatik primer, suatu asam mineral, dan garam natrium nitrit. Reaksi pembuatan garam diazonium dilakukan dalam keadaan dingin dengan cara mempertahankan suhu reaksi dibawah 5oC. Menurut McMurry (2000), agar garam diazo yang terbentuk
lebih stabil, sehingga meminimalisis bahkan menghentikan terjadinya pelepasan nitrogen selama proses reaksi berlangsung. Suhu ideal untuk menghentikan pelepasan nitrogen adalah pada suhu 0 – 5oC. Penguapan nitrogen harus
diminmalisir agar pembentukan garam diazonium dapat terbentuk.
Selanjutnya, mencampurkan NaNO2 yang berfungsi untuk membentuk asam nitrit
dan memberikan kontribusi gugus N-nya pada 3-nitroanilin untuk membentuk suatu garam diazonium. Gugus N pada ujung kation diazonium inilah yang akan berperan sebagai elektrofil yang akan menyerang reagen pengupling. Dalam pembentukan garam diazonium, digunakan Natrium Nitrit (NaNO2) dan HCl
pekat. HCl pekat akan menghidrolisis natrium nitrit sehingga terbentuk asam yang akan dihidrolisis oleh larutan HCl pekat menjadi asam nitrit. Asam nitrit yang terbentuk, dapat bereaksi dengan HCl untuk melepaskan molekul air serta menghasilkan ion NO+. Ion NO+ akan diserang oleh pasangan elektron bebas dari
anilin yang nantinya akan diikuti oleh reaksi dehidrasi (pelepasan molekul air). Pada reaksi ini, terjadinya donor proton dari suatu basa konjugasi yang mudah lepas yaitu HCl.
Mekanisme reaksi yang terjadi yaitu saat larutan asam klorida diencerkan direaksikan dengan anilin maka reaksi ini berlangsung dalam suasana asam, sehingga terbentuk amina terprotonkan (Aril-NH3+). Kemudian saat natrium nitrit
bereaksi dengan asam klorida membentuk asam nitrit dan garam natrium klorida. Selanjutnya terjadi proses protonasi antara asam nitrat dan kation asam klorida membentuk kation asam nitrat (H+HNO
2) yang kemudian melepaskan molekul
airnya dan ion nitrosonium (NO+) yang merupakan spesies reaktif dalam reaksi
asam nitrit. Proses selanjutnya adalah proses diazotisasi. Dimana terjadi serangan nukleofilik dari amina primer pada ion nitrosonium, diikuti lepasnya proton dan nitrosamine primer. Setelah protonasi oksigen pada nitrosamine yang diperoleh, diikuti oleh eliminasi air, kemudian dihasilkan kation diazonium aromatik (kation arildiazonium).
Selanjutnya campuran ditambahkan natrium asetat yang berfungsi untuk memutuskan suatu ion klorida yang masih terdapat dalam campuran. Karena ion klorida (Cl-) merupakan gugus pergi yang baik, reaksi kesetimbangan dapat
berjalan ke arah produk. Pada reaksi ini, campuran dibiarkan dalam wadah yang berisi air dingin untuk mencegah terdekomposisinya aminobenzena menjadi fenol. Lalu campuran larutan dikristalisasi untuk mendapatkan senyawa azo dyes yang murni. Bila ion klorida tidak dieliminasi, maka akan memungkinkan terjadi mekanisme reaksi SN1 yang mana ion klorida akan menyerang ion diazo yang
terikat langsung pada cincin benzen sehingga molekul air yang ada akan menggantikan posisi diazo sehingga hasil yang terbentuk berupa senyawa fenol.
Selanjutnya menambahkan natrium asetat sehingga terbentuk endapan kuning diazoaminobenzen. Pada tahap ini kation diazonium aromatik yang mengandung gugus diazonio (-N2+) akan digantikan oleh nukleofilik ion asetat (CH3COO-),
sehingga menghasilkan arilasetat dan gas N2 namun karena reaksi dalam keadaan
suhu dingin maka gas N2 tidak sampai hilang sehingga menyebabkan ion asetat
(CH3COO-) dalam aromatik (arilasetat) akan terlepas kembali dan gas N2 yang
tidak menguap akan terikat kembali dalam cincin aromatik membentuk kation diazonium aromatik. Ion diazonium aromatik ini kemudian bereaksi lebih lanjut dengan anion anilin. Kemudian bereaksi dengan kation diazonium aromatik membentuk diazoamino aromatik (diazoaminobenzena) dan asam klorida.
Selanjutnya, melakukan pengocokan hingga 45 menit dan menahan temperatur di bawah 20°C yang berfungsi untuk menghentikan pelepasan nitrogen, menjaga temperature 20oC juga untuk membantu proses pengendapan (pembentukan
endapan). Kemudian, endapan yang terbentuk disaring menggunakan corong kaca sambil memberikan pencucian kristal menggunakan air dingin dan diperoleh berat kristal sebelum rekristalisasi sebesar 11,218 gram dan rendemen yang dihasilkan sebesar 35,07%. Fungsi pencucian dengan air dingin yakni untuk tetap menjaga nitrogen tetap terikat dan pembentukan kristal dapat berlangsung sempurna juga sebagai rekristalisasi awal untuk membersihkan pengotor-pengotornya. Prinsip kerja corong Buchner yakni meminimalisir suatu tekanan di dalam sistem sehingga tekanan di luar sistem menjadi lebih besar, hal ini yang membuat proses penyaringan manjadi lebih cepat. Titik leleh diazoaminobenzen yang diperoleh adalah 90oC. Menurut Gnanou dan Fontanille (2008), titik leleh dari garam
diazoaminobenzen yang belum direkristalisasi mencapai 92,5oC. Jika melihat hasil
yang diperoleh, titik leleh yang dihasilkan sesuai dengan literatur.
Selanjutnya, merekristalisasi kristal diazoaminobenzen menggunakan petroleum benzene. Menurut Anonim (2016), rekristalisasi adalah proses pengulangan kristal agar diperoleh zat murni atau kristal yang lebih murni. Rekristalisasi didasarkan pada perbedaan kelarutan senyawa dalam suatu pelarut tunggal atau campuran. Pada dasarnya proses rekristalisasi adalah melarutkan senyawa yang dimurnikan
ke dalam pelarut yang sesuai pada atau dekat titik didihnya. Penggunaan petroleum benzene karena sifatnya yang sama-sama tidak polar. Maka kristal diazoaminobenzen dapat sedikit larut. Hasil rekristalisasi disaring pada penyaring buchner kemudian ditimbang dan diperoleh berat kristal diazoaminobenzen murni adalah 4,336 gram dan titik leleh sebesar 97oC. Rendemen kristal
diazoaminobenzen setelah rekristalisasi yakni sebesar 13,55%. Menurut Carey (2001), titik leleh kristal diazoaminbenzen murni adalah 98oC. Jadi, hasil yang
diperoleh telah sesuai dengan literatur.
V. Kesimpulan
Berdasarkan hasil pengamatan yang diperoleh dapat disimpulkan bahwa :
1. Diazoaminobenzen merupakan senyawa turunan benzen yang memiliki bentuk padatan kristal berwarna orange.
2. Diazoaminobenzen dapat disintesis dari dua ekivalen aniline dengan tiga ekivalen asam klorida dan ditambahkan natrium nitrit yang diikuti dengan ekivalen natrium nitrit.
3. Hasil yang diperoleh endapan diazoaminobenzen sebelum rekristralisasi yakni berat endapan kristal sebesar 11,218 gram, titik leleh pada suhu 90oC
dan rendemen kristal sebesar 35,07 %.
4. Hasil yang diperoleh endapan diazoaminobenzen setelah rekristralisasi yakni berat endapan kristal sebesar 4,336 gram, titik leleh pada suhu 97oC dan
rendemen kristal sebesar 13,55 %.
DAFTAR PUSTAKA
Akron. 2009. The Chemical Database. The Department of Chemistry at the University of Akron. http://ull. chemistry.uakron.edu/erd and search on CAS number. Diakses pada tanggal 04 maret 2016. Palu
Anonim. 2016. Rekristalisasi. http://tihamahsiti.blogspot.co.id/2012/11/laporan-rekristalisasi.html. Diakses pada tanggal 08 Maret 2016. Palu
Carey, Francis A. 2001. Organic Chemistry Fourth Edition. McGraw Hill. New York
FDA. 2010. Color Certification Reports. U.S. Food and Drug Administration. http://www.fda.gov/ForIndustry/ColorAdditives/ColorAdditiveInventories/ ucm115641.htm. Diakses pada tanggal 04 maret 2016. Palu
Fessenden, R.J., dan Fessenden, J.S., 1986. Kimia Organik Jilid 2. Erlangga. Jakarta
Gnanau, Y. dan Fontanille, M. 2008. Organic and Physical Chemistry of Polymer. John Willey & Sons, Inc. USA
McMurry. 2000. Organic Chemistry Fifth Edition. Brooks/Cole. Ohio
Stoker, SH dan Walker, EB . 1991. Fundamentals Of Chemistry General, Organic and Biological. Allyn and Bacon. USA
Tim Dosen Kimia Organik Sintesis. 2016. Penuntun Kimia Organik Sintesis. Jurusan Kimia FMIPA UNTAD. Palu
LEMBAR ASISTENSI
No. STB : G 301 13 010 Kelompok : III
Asisten : Pratiwi Dwiasmukti
No. Hari/ Tanggal Koreksi Paraf
LAPORAN LENGKAP
PRAKTIKUM KIMIA ORGANIK SINTESIS “SINTESIS DIAZOAMINOBENZEN”
Disusun Oleh: Nama : Novaldi No. STB : G 301 13 010 Kelompok : III
Asisten : Pratiwi Dwiasmukti
LABORATORIUM KIMIA ORGANIK DAN BIOKIMIA JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS TADULAKO
PALU 2016
TUGAS PENDAHULUAN
PRAKTIKUM KIMIA ORGANIK SINTESIS “SINTESIS DIBENZALASETON”
Disusun Oleh: Nama : Novaldi No. STB : G 301 13 010 Kelompok : III
Asisten : Annisa Setyaningrum
LABORATORIUM KIMIA ORGANIK DAN BIOKIMIA JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS TADULAKO
PALU 2016