Laporan Hasil Praktikum
HIDROKARBON
ANDI BESSE KHAERUNNISA H031 17 1001
LABORATORIUM KIMIA DASAR
UNIT PELAKSANA TEKNIS MATA KULIAH UMUM UNIVERSITAS HASANUDDIN
LEMBAR PENGESAHAN
HIDROKARBON
Disusun dan diajukan oleh:
ANDI BESSE KHAERUNNISA H031 17 1001
Diperiksa dan disetujui oleh:
Makassar, 01 Maret 2018 ASISTEN
BAB I PENDAHULUAN
1.1 Latar Belakang
Pada permulaan abad ke-19 ilmu kimia terbagi atas kimia anorganik dan kimia organik. Pembagian tersebut didasarkan asalnya. Kimia organik hanya mempelajari
zat-zat yang berasal dari jasad-jasad hidup seperti tumbuhan dan binatang. Kimia anorganik mempelajari zat-zat yang ada di alam sebagai benda mati, seperti
batu-batuan.
Pada tahun 1827 Friedrich Wohler berhasil membuat ureu(senyawa organik) dan ammonium sianat (senyawa anorganik). Urea yang dihasilkan dari pemanasan ammonium sianat sama dengan urea pada air kencing pada binatang. Sehingga hilanglah perbedaan yang spesifik antara senyawa organik dan senyawa anorgnik. Sekarang sudah banyak senyaa organik yang tidak berasal dari makhluk hidup, seperti plastik, obat-obatan, serat sintetik dan lain-lain.
Dari beberapa analisis diketahui bahwa seluruh senyawa organik mengandung unsur karbon (C), sehingga istilah kimia organik identik dengan kimia karbon. Senyawa karbon umumnya tersusun dari karbon, hidrogen, oksigen dan nitrogen. Senyawa yang paling sederhana adalah hidrokarbon, yaitu senyawa karbon yang hanya tersusun dari hidrogen dan karbon (Sukarmin dan Sugiarto, 2004).
1.2 Maksud dan Tujuan Percobaan 1.2.1 Maksud Percobaan
Maksud dari percobaan ini adalah mengetahui kelarutan hidrokarbon dan reaksi yang terjadi pada hidrokarbon.
1.2.2 Tujuan Percobaan
Tujuan dari percobaan ini adalah membedakan antara hidrokarbon jenuh, tidak jenuh dan senyawa aromatik.
1.3 Prinsip Percobaan
1.3.1 Kelarutan Hidrokarbon
Prinsip dari percobaan ini adalah menentukan kepolaran suatu senyawa berdasarkan kelarutannya pada air dan dietil eter.
1.3.2 Reaksi Hidrokarbon
BAB II
TINJAUAN PUSTAKA
Kimia organik berkembang seiring dengan perkembangan teori struktur molekul (senyawa) organik. Teori struktur adalah penjelasan bagaimana unsur-unsur penyusun senyawa organik bergabung melalui suatu ikatan. Rumus molekul sudah dapat ditentukan jauh sebelum teori struktur molekul ditemukan oleh para ahli. Untuk persenyawaan organik bila rumus molekulnya diketahui tidak serta merta strukturnya diketahui atau tidak seperti persenyawaan anorganik yang mengenal kaedah identitas yaitu satu rumus molekul untuk satu struktur karena adanya isomer
pada molekul organik. Pengetahuan tentang teori struktur akan dapat menjelaskan berbagai fenomena isomeri tersebut (Sitorus, 2010).
Secara umum hidrokarbon dinotasikan sebagai R – H, maka derivatnya adalah bila H diganti fungsional seperti R – OH untuk alkohol R – O – R untuk eter dan seterusnya. Golongan senyawa amina dipandang sebagai turunan amoniak (NH3)
dengan pergantian 1 – 3 H dengan gugus samping R. pengertian (– R) secara umum adalah suatu spesi senyawa organik yang kehilangan satu atom hidrogen, seperti alkil, bezenil, benzil, vinil, alil dan lain-lain (Sitorus, 2010).
Berdasarkan jumlah atom penyusunnya yang tidak terlalu banyak, maka senyawa organik dapat dikatakan adalah suatu molekul sederhana. Namun kenyataanya mempelajari senyawa organik tidaklah sesederhana itu karena pada senyawa organik ditemukan fenomena isomer yaitu berumus molekul sama tetapi
mempunyai struktur yang berbeda. Di samping itu isomer juga masih beragam yaitu
(Sitorus, 2010) : Isomer struktur Isomer fungsional Isomer geometri Isomer optik
Atom karbon mempunyai keistimewaan dapat membentuk persenyawaan yang stabil yang begitu besar jumlahnya, sebab atom karbon mempunyai beberapa kekhasan, yaitu(Sukarmin dan Sugiarto, 2004) :
1. Atom karbon dapat membentuk empat ikatan kovalen
Atom karbon mempunyai nomor atom 6. Di dalam sistem periodik atom karbon terletak pada golongan IVA periode 2. Konfigurasi atom karbon adalah sebagai berikut :
Berdasarkan konfigurasi tersebut, atom karbon mempunyai 4 elektron terluar (elektron valensi). Agar susunan elektronnya stabil sesuai dengan kaidah oktet
(mempunyai 8 elektron terluar), atom karbon memerlukan 4 elektron. Sehingga atom dapat membentuk empat buah ikatan kovalen.
2. Atom karbon dapat membentuk senyawa yang stabil
Dalam persenyawaannya, atom karbon membentuk empat pasang elektron ikatan dengan atom-atom lain, sehingga lengkaplah pembentukan oktetnya tanpa adanya pasangan elektron bebas. Akibatnya persenyawaan atom karbon sangat stabil.
3. Atom karbon dapat membentuk ikatan tunggal dan rangkap
Keempat elektron valensi yang dimiliki atom karbon dapat membentuk ikatan tunggal, ikatan rangkap dua dan ikatan rangkap tiga.
4. Atom karbon dapat membentuk rantai lurus dan bercabang
Kekhasan atom karbon yang tidak dimiliki atom lain adalah kemampuan membentuk rantai yang sangat panjang antar sesama atom karbon. Rantai karbon
tersebut dapat lurus dan bercabang.
Dalam ikatan antar karbon, setiap atom karbon dapat mengikat 1,2,3 atau 4 atom karbon yang lain. Berdasarkan jumlah atom karbon yang diikat, posisi atom karbon
dapat dibedakan menjadi empat macam, yaitu (Sukarmin dan Sugiarto, 2004): Atom C primer : atom C yang berikatan dengan 1 atom C lainnya
Atom C sekunder : atom C yang berikatan dengan 2 atom C lainnya Atom C tersier : atom C yang berikatan dengan 3 atom C lainnya
Senyawa hidrokarbon merupakan senyawa karbon yang paling sederhana. Dari namanya, senyawa hidrokarbon adalah senyawa karbon yang hanya tersusun dari atom hidrogen dan atom karbon. Dalam kehidupan sehari-hari banyak kita temui senyawa hidrokarbon, misalnya minyak tanah, bensin, gas alam, plastik dan lain-lain. Sampai saat ini telah dikenal lebih dari 2 juta senyawa hidrokarbon. Untuk mempermudah mempelajari senyawa hidrokarbon yang begitu banyak, para ahli menggolongkn hidrokarbon berdasarkan susunan atom-atom karbon dalam molekulnya (Sukarmin dan Sugiarto, 2004).
Berdasarkan susunan atom karbon dalam molekulnya, senyawa karbon terbagi dalam 2 golongan besar, yaitu senyawa alifatik dan senyawa siklik (Sukarmin dan Sugiarto, 2004).
Senyawa hidrokarbon alifatik adalah senyawa karbon yang rantai C nya terbuka dan rantai C itu memungkinkan bercabang. Berdasarkan jumlah ikatannya, senyawa hidrokarbon alifatik terbagi menjadi senyawa alifatik jenuh dan tidak jenuh, yaitu (Sukarmin dan Sugiarto, 2004) :
Senyawa alifatik jenuh adalah senyawa alifatik yang rantai C nya hanya berisi ikatan-ikatan tunggal saja. Golongan ini dinamakan alkana.
Senyawa alifatik tidak jenuh adalah senyawa alifatik yang rantai C nya terdapat ikatan rangkap dua atau rangkap tiga. Jika memiliki rangkap dua dinamakan alkena dan memiliki rangkap tiga dinamakan alkuna.
Senyawa alisiklik yaitu senyawa karbon alifatik yang membentuk rantai tertutup
Senyawa aromatik yaitu senyawa karbon yang terdiri dari 6 atom C yang membentuk rantai benzene
Alkana dan sikloalkana, kedua golongan senyawa ini adalah golongan senyawa hidrokarbon jenuh di mana semua ikatannya tunggal. Alkana disebut juga senyawa alifatik atau alisiklik yang artinya adalah senyawa rantai terbuka. Istilah lain untuk sikloalkan adalah paraffin yang artinya sukar beraksi. Golongan alkana adalah salah satu komponen utama dalam minyak bumi (crude oil = petroleum), yang melalui proses fraksinasi (penyulingan) akan menghasilkan premium dengan titik didih antara 30-200ᵒC (Sitorus, 2010).
Alkana dikenal juga sebagai parafin artinya sukar bereaksi sedangkan fraksi minyak tanah dikenal dengan nama kerosin. Dengan demikian reaksi terhadap alkane dan juga sikloalkana tidak terlalu banyak dilakukan oleh para ahli. Beberapa jenis reaksi yang dapat dilakukan terhadap alkane adalah sebagai berikut (Sitorus, 2010): a. Reaksi pembakaran, alkana akan terbakar dalam keadaan oksigen berlebihan dan
membentuk karbon dioksida dan air. Pada hakekatnya reaksi ini adalah reaksi oksidasi dan akan melepaskan kalor yang sangat tinggi
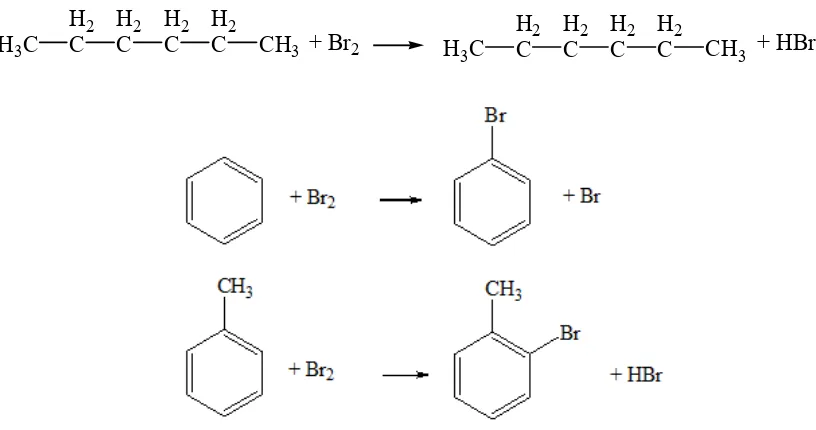
b. Halogenasi alkana, reaksi ini adalah reaksi radikal bebas (reaksi rantai) atau
reaksi kompleks, sehingga untuk mendapatkan hasil tertentu harus dilakukan perlakuan tertentu (tahap penghentian).
Alkena dan alkuna adalah golongan hidrokarbon tidak jenuh dengan alkena mempunyai ikatan rangkap (C=C) dengan rumus umum CnH2n dan ikatan tripel
(C≡C) dengan rumus umum CnH2n-2. Golongan alkena dan alkuna dapat mempunyai
BAB III
METODE PERCOBAAN
3.1 Alat Perobaan
Alat yang digunakan pada percobaan hidrokarbon ini adalah tabung reaksi, rak tabung, pipet tetes, gelas piala, kaki tiga, kasa dan spiritus.
3.2. Bahan Percobaan
Bahan yang digunakan pada percobaan ini adalah n-heksana, sikloheksana, etil asetoasetat, KMnO4 0,1 M, dietil eter, parafin, toluen, benzena, Br2/CCl4 5%,
tissue roll dan kertas label.
3.3 Prosedur Percobaan
3.3.1 Kelarutan Senyawa Hidrokarbon
1. Siapkan 2 buah tabung reaksi yang bersih dan kering.
2. Tabung reaksi (1) diisi 0,5 mL air, dan tabung reaksi (2) diisi 0,5 mL dietil eter. 3. Pada tabung reaksi (1) dan (2), tambahkan setetes demi setetes larutan n-heksana
(±10 tetes), kocok dan perhatikan kelarutannya (catat).
4. Ulangi langkah 1 sampai langkah 3 dengan menggunakan sikloheksana, benzena, toluen dan parafin.
3.3.2 Reaksi Senyawa Hidrokarbon
1. Siapkan 5 buah tabung reaksi yang bersih dan kering.
2. Masing-masing tabung reaksi diisi sebanyak 1,0 mL n-heksana, sikloheksana, benzena, toluen, parafin dan etilasetoasetat.
3. Tambahkan 1 tetes larutan KMnO4 0,1 M, kocok dan bila perlu panaskan.
BAB IV
HASIL DAN PEMBAHASAN 4.1 Kelarutan Senyawa Hidrokarbon
Tabel 1 Hasil Pengamatan Kalarutan Senyawa Hidrokarbon
Hirokarbon Kelarutan dalam air Kelarutan dalam dietil eter
n-heksana 2 fasa 1 fasa
Sikloheksana 2 fasa 1 fasa
Benzena 2 fasa 1 fasa
Toluena 2 fasa 1 fasa
Parafin 2 fasa 1 fasa
4.2 Reaksi Senyawa Hidrokarbon
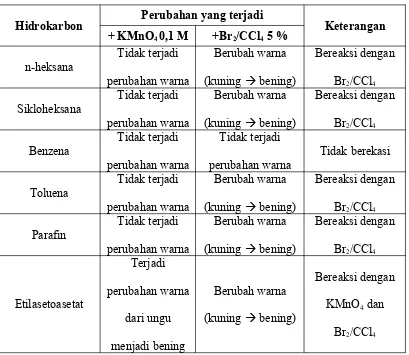
Tabel 2 Hasil Pengamatan Reaksi Senyawa Hidrokarbon
4.3 Hasil dan Reaksi
CH3
H3C C HC2 O
C O
OC2H5 H3C HC2 CH2 HC2 HC2 CH3
+ KMnO4
+ KMnO4
+ KMnO4
+ KMnO4 H3C C HC2 O
C O
OH + MnO2 + C2H5OH + K -+ KMnO4
Gambar 1. Kelarutan Senyawa Hidrokarbon
+ Br2
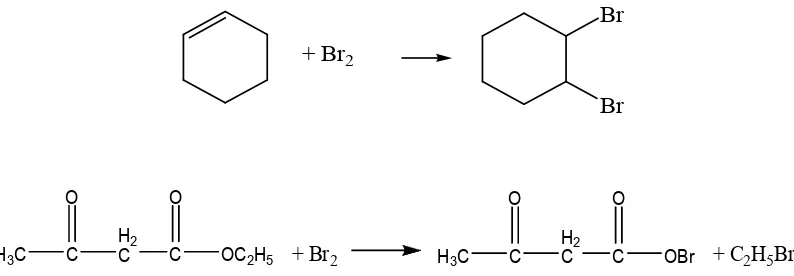
Gambar 2. Reaksi Senyawa Hidrokarbon dengan Br2/CCl4
4.3 Pembahasan
4.3.1 Kelarutan Hidrokarbon
Berdasarkan data dan pengamatan yang telah dilakukan yang ditunjukkan pada tabel 1, dapat diketahui bahwa n-heksana tidak dapat larut dalam air dan juga dietil eter, sikloheksana tidak dapat larut dalam air dan dietil eter, benzena tidak dapat larut dalam air dan dalam dietil eter, begitu pula dengan toluena dan parafin yang tidak dapat larut dalam kedua pelarut itu. Senyawa hidrokarbon yang diujikan bersifat non polar karena pada saat direaksikan dengan air yang bersifat polar, terbentuk 2 fase. Sedangkan pada saat direaksikan dengan dietil eter yang bersifat non polar, terbentuk 1 fase. Senyawa non polar akan membentuk 1 fase jika direaksikan dengan senyawa non polar, dalam percobaan ini dietil eter dan membentuk 2 fase jika direaksikan dengan senyawa polar, dalam percobaan ini air.
4.3.2 Reaksi Hidrokarbon
Berdasarkan data dan pengamatan yang telah dilakukan yang ditunjukkan pada tabel 2, reaksi yang ditunjukkan diamati melalui perubahan warna larutan. Senyawa hidrokarbon akan direaksikan dengan KMnO4 dan Br2 5%. Fungsi KMnO4
tidak terjadi perubahan warna (endapan ungu). Hal ini menandakan tidak terjadi reaksi antara senyawa hidrokarbon tersebut dengan pereaksi KMnO4 karena
senyawa-senyawa tersebut tergolong ke dalam kelompok senyawa alkana dan aromatik yang jika ditinjau dari ikatan antarelektronnya sangat sulit untuk diputus. Namun berbeda dengan hasil yang diperoleh ketika larutan etil asetoasetat bening ditambahkan ditambahkan KMnO4 yang berwarna ungu, terjadi perubahan warna
yaitu berubah warna menjadi bening. Hal ini menandakan bahwa terjadi reaksi, karena KMnO4 merupakan oksidator kuat yang dapat mengoksidasi etilasetoasetat
sehingga terjadi reaksi oksidasi. Fungsi Br2 5 % untuk mengetahui adanya reaksi
halogenasi yang terjadi pada senyawa hidrokarbon. Hasil yang diperoleh saat n-heksana dan toluena dimana larutannya bening ditambahkan Br2 5 % yang
warnanya berubah dari jingga menjadi bening setelah dilakukan pemanasan. Fungsi pemanasan untuk mempercepat reaksi dengan memutus ikatan dalam senyawanya. Berdasarkan teori kedua hidrokarbon ini adalah hidrokarbon tidak jenuh akan sulit untuk mengalami reaksi adisi karena senyawa hirokarbon tersebut tidak reaktif dan tidak jenuh serta ikatan-ikatan yang berada pada senyawa hidrokarbon tersebut sangat sulit terputus. Namun dalam praktikum ini, bisa saja terjadi hal yang tidak sesuai dengan teori dikarenakan alat yang kurang bersih, pereaksi yang mungkin sudah rusak, sampel yang telah terkontamidasi ataupun jumlah larutan yang dimasukkan terlalu sedikit atau berlebih.
Hasil yang diperoleh ketika larutan etilasetoasetat bening ditambahkan ditambahkan Br2 5 % yang berwarna jingga adalah terjadi perubahan warna yaitu
berubah warna menjadi bening. Hal ini menandakan bahwa terjadi reaksi karena etilasetoastetat dapat diadisi oleh Br2 5 %. Namun lain halnya dengan benzena yang
pemanasan. Hal ini disebabkan karena elektron pada cincin karbon benzena terus mengalami delokasi elektron yang menyebabkan ikatan rangkapnya sehingga ikatan rangkapnya berpindah-pindah, sehingga sulit diputuskan dan sulit diadisi.
Parafin ketika direaksikan dengan Br2, tidak terjadi reaksi. Hal ini
disebabkan karena parafin merupakan suatu senyawa yang afinitasnya kecil sehingga sukar sekali bereaksi dan merupakan senyawa yang stabil. Sikloheksana sendiri adalah hidrokarbon non reaktif, non-polar, hidrofobik sehingga sesuai dengan hasi praktikum dimana sikloheksana tidak bereaksi.
BAB V
KESIMPULAN DAN SARAN 5.1 Kesimpulan
Setelah melakukan percobaan hidrokarbon dapat disimpulkan bahwa:
1. Senyawa hidrokarbon yang bersifat non polar seperti: dietil eter, sikloheksana, benzena, toluen, parafin, dan etil asetoasetat tidak larut dalam pelarut polar seperti air dan larut dalam pelarut non polar seperti n-heksana.
5.2 Saran
Saran saya untuk laboratorium agar alat dan praktikum dapat diperbarui sehingga dapat menunjang jalannya praktikum.
Lampiran 1 Bagan Kerja A. KelarutanHidrokarbon
Disiapkan tabung reaksi Diisi dengan air dan dietil eter Dipipet masing-masing 0,5 mL.
Dimasukkan ke dalam 2 tabung reaksi yang berbeda. Ditambahkan 10 tetes n-heksana
Dikocok, perhatikan kelarutannya Dicatat perubahan yang terjadi.
Diulangi percobaan diatas dengan menggunakan senyawa hidrokarbon lain (sikloheksana, benzena, toluena, parafin).
Air Dietil Eter
B. Reaksi Hidrokarbon
Ditambahkan satu tetes larutan KMnO4 0,1 M
Dikocok bila perlu dipanaskan lalu amati perubahan yang terjadi
Diulangi percobaan dengan mengganti KMnO4 0,1 M
dengan 1-2 tetes larutan Br2/CCl4.
Dicatat hasil pengamatan.
Lampiran 2 Gambar Percobaan
1.Reaksi kelarutan senyawa hidrokarbon
Gambar 2.1 Kelarutan parafin Gambar 2.3 Kelarutan toluena dalam air dan dietil eter dalam air dan dietil eter
1,0 mL (n-heksana, benzena, toluen, parafin, dan etilasetoasetat)
Gambar 2.3 Kelarutan sikloheksana Gambar 2.4 Kelarutan benzena dalam air dan dietil eter dalam air dan dietil eter
Gambar 2.5 Kelarutan n-heksana dalam air dan dietil eter
2. Reaksi oksidasi antara hidrokarbon dengan Br2/CCl4 5% dan KMnO4
DAFTAR PUSTAKA
Drs. Sukarmin, M.pd dan Drs. Bambang S, M.Pd , 2004 , Hidrokarbon dan Minyak Bumi , Jakarta.