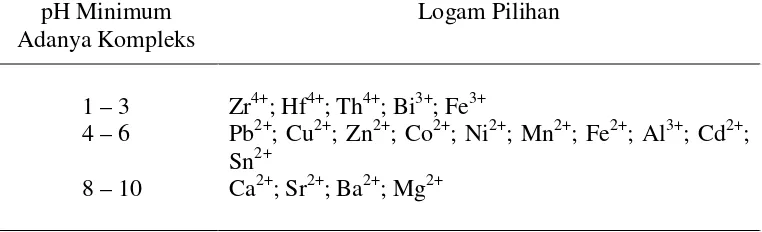4 BAB II
TINJAUAN PUSTAKA
2.1 Tablet
Tablet adalah sediaan padat mengandung bahan obat dengan atau tanpa bahan pengisi. Berdasarkan metode pembuatan, dapat digolongkan sebagai tablet cetak dan tablet kempa. Selain bahan pengisi digunakan juga zat tambahan lain yang berfungsi sebagai bahan tambahan, pengikat, pelicin, pembasah atau zat lain yang cocok (Ditjen POM, 1995).
Tablet kunyah dimaksudkan untuk dikunyah memberikan rasa yang enak dalam rongga mulut, mudah ditelan dan tidak meninggalkan rasa pahit atau tidak enak. Jenis tablet ini digunakan dalam formulasi tablet untuk anak, terutama formulasi multivitamin, antasida dan antibiotik tertentu. Tablet kunyah dibuat dengan cara dikempa, umumnya menggunakan manithol, sorbitol atau sukrosa sebagai bahan pengikat dan bahan pengisi, mengandung bahan pewarna dan bahan pengaroma untuk meningkatkan penampilan dan rasa (Ditjen POM, 1995).
2.2 Antasida
5
menghambat pepsin secara langsung. Kapasitas menetralkan asam dari berbagai antasida pada dosis terapi bervariasi, tetapi umumnya pH lambung tidak sampai diatas 4 (Estuningtyas dan Arif, 2007).
2.2.1 Penggolongan antasida
Antasida dibagi dalam 2 golongan yaitu antasida sistemik dan antasida nonsistemik. Antasida sistemik, misalnya natrium bikarbonat, diabsorpsi dalam usus halus sehingga menyebabkan urin bersifat alkalis. Pada pasien dengan kelainan ginjal dapat terjadi alkalosis metabolik (Estuningtyas dan Arif, 2007).
Antasida nonsistemik hampir tidak diabsorpsi dalam usus sehingga tidak menimbulkan alkalosis metabolik. Contoh antasida nonsistemik adalah sediaan magnesium, aluminium, dan kalsium (Estuningtyas dan Arif, 2007).
2.2.2 Sediaan antasida
Antasida tersedia dalam sediaan sirup maupun tablet, antasida juga tersedia sebagai obat generik maupun obat paten (Anief, 1991).
Kandungan dari sediaan antasida yaitu: kandungan aluminium dan magnesium, kandungan natrium bikarbonat, serta kandungan kalsium karbonat. Simeticone diberikan sendiri atau ditambahkan pada antasida sebagai anti buih untuk meringankan kembung (flatulen) (Sukandar, dkk., 2008).
2.3 Pemeriksaa Mutu Tablet
Pemeriksaan mutu tablet dilakukan dengan uji kekerasan tablet,
6 2.3.1 Uji kekerasan tablet
Masing-masing sediaan diletakkan pada tempat yang tersedia pada alat
Hardness tester (Coplay) dengan posisi tidur, alat diatur, kemudian ditekan
tombol start, pada saat sediaan pecah dicatat angka yang tertera pada layar
digital.
Syarat : Kekerasan tablet secara umum 4 s/d 8 dan 7 s/d 12 untuk tablet kunyah
(Soekemi, 1987).
2.3.2 Uji kerapuhan tablet
Alat : Friabilator (Roche)
Cara : ditimbang 20 tablet yang dibersihkan dari debu, dicatat beratnya (a
gram), dimasukkan ke dalam alat, lalu alat dijalankan selama 4 menit (100
kaliputaran), setelah batas waktu yang ditentukan, tablet dikeluarkan dan
dibersihkan dari debu, lalu ditimbang lagi (b gram), maka friabilitas (F)= (a-b)/
a x 100%
Syarat : Kehilangan berat ≤ 0,8% (Voigt, 1994).
2.3.3 Waktu hancur
Alat : Disintegration Tester ( Erweka).
Cara : Dilakukan pada 6 tablet. Dimasukkan 1 tablet pada masing-masing
tabung darikeranjang, dimasukkan 1 cakram pada tiap tabung. Digunakan air
bersuhu ± 370 sebagai media kemudian alat dijalankan. Waktu hancur tablet
dicatat yaitu sejak tablet dinaik turunkan sampai tablet hancur. Tablet
7
Persyaratan : Menurut Farmakope Indonesia edisi III tahun 1979 tablet
memenuhi syarat jika waktu hancur tablet tidak lebih dari 15 menit. Bila 1
tablet atau 2 tablet tidak hancur sempurna ulangi pengujian dengan 12 tablet
lainnya : tidak kurang 16 tablet dari 18 tablet yang di uji harus hancur semua
(Ditjen POM, 1995).
2.3.4 Uji kergaman bobot
Menurut Farmakope Indonesia edisi IV bahwa kadar zat aktif 50 mg
atau lebih besar dari 50 mg yang merupakan 50% atau lebih dari bobot satuan
sediaan, maka uji keseragaman sediaan dilakukan dengan cara keragaman
bobot.
Cara : Pilih tidak kurang dari 30 tablet dan timbang seksama 10 tablet, satu
persatu dan dihitung bobot rata-rata kemudian ditentukan kadarnya. Dari hasil
penetapan kadar dihitung jumlah zat aktif dari masing-masing 10 tablet dengan
anggapan zat aktif terdistribusi homogen (Ditjen POM, 1995).
2.3.5 Uji kadar magnesium hidroksida
Menurut USP Vol III tahun 2009, timbang seksama 20 tablet sampel,
gerus, timbang serbuk setara dengan 75 mg magnesium hidroksida,
dimasukkan kedalam erlenmeyer, ditambahkan 2 ml asam klorida 2 N,
ditambahkan 100 ml air, ditambahkan natrium hidroksida 1 N , cek pH hingga
mencapai 10 dengan menggunakan indikator universal, ditambahkan 5 ml
ammonium klorida dan 50 mg indikator eriochrom black dan titrasi dengan
dinatrium EDTA 0,05 M hingga terjadi warna biru.
8 2.4 Magnesium Hidroksida
Rumus Molekul : Mg(OH)2
Berat Molekul : 78,00
Magnesium hidroksida yang telah dikeringkan pada suhu 1050 selama 2 jam
mengandung tidak kurang dari 95,0% dan tidak lebih dari 100,5% Mg(OH)2
(Ditjen POM, 1995).
2.4.1. Teori kompleksometri
Reaksi pembentukan kompleks dianggap sebagai reaksi asam-basa Lewis dengan ligan bekerja sebagai basa dengan memberikan sepasang elektron kepada kation yang merupakan suatu asam (Day dan Underwood, 1981).
Ligan dari kata Latin ligare, yang berarti “mengikat”. Atom pada ligan yang memberikan pasangan elektron pada ion logam dinamakan atom donor sedangkan ion logamnya disebut akseptor. Ligan dalam kompleks dapat berupa anion atau molekul netral yang mengandung sebuah atom atau lebih dengan paling sedikit mempunyai sepasang elektron yang dapat diberikan pada ion logam (Brady, 1999).
9
Schwarzenbach menyatakan bahwa ion asetat mampu membentuk kompleks-kompleks asetat yang rendah kestabilannya dengan hampir semua kation polivalen dan sifat ini diperkuat dengan efek sepit, maka kompleks-kompleks yang jauh lebih kuat akan terbentuk oleh kation ion logam. Ia menemukan asam-asam aminopolikarboksilat merupakan zat-zat pengkompleks yang baik (Basset, dkk., 1991).
Berbagai nama trivial (nama khusus) digunakan untuk asam etilenadiaminatetraasetat dan garam natriumnya meliputi: Trilon B, Komplekson III, Sekuestrena, Versena, dan Khelaton 3 (Basset, dkk., 1991).
EDTA mendapat aplikasi umum yang paling luas dalam analisis karena aksi mengkompleksnya yang sangat kuat dan tersedia secara komersial (Basset, dkk., 1991). Dalam perdagangan yang sering digunakan bentuk garamnya yaitu
dinatrium edetat dengan struktur kimia dibawah ini.
10
yang dibawa. Satu struktur kompleks dengan suatu ion divalen dapat dilihat pada gambar berikut ini.
CO CH2
O CH2
CO
(Basset, dkk., 1991).
Untuk menyerdehanakan pembahasan berikut, EDTA diberi rumus H4Y; maka garam dinatriumnya adalah Na2H2Y, dan memberi ion pembentuk kompleks H4Y2- dalam larutan air; ia bereaksi dengan semua logam dalam rasio 1:1. Reaksi dengan kation dapat ditulis sebagai:
M2+ + H2Y2-↔ MY2- + 2H+ (1) M3+ + H2Y2-↔ MY- + 2H+ (2)
M4+ + H2Y2-↔ MY + 2H+ (3)
11
mana suatu titrasi EDTA dari ion logam bersangkutan dapat dilaksanakan (Basset, dkk., 1991).
Tabel di bawah ini menunjukkan nilai pH minimum untuk eksistensi kompleks EDTA dari beberapa logam pilihan.
pH Minimum
Jadi terlihat bahwa pada umumnya kompleks EDTA dengan ion logam divalen stabil dalam larutan basa atau sedikit asam, sementara kompleks dengan ion logam tri dan tetravalen terjadi dalam larutan-larutan dengan keasaman yang jauh lebih tinggi (Basset, dkk., 1991).
2.4.2 Metode kompleksometri 1. Titrasi langsung
12 2. Titrasi balik (Tidak Langsung)
Karena berbagai alasan, banyak logam tak dapat dititrasi langsung; mungkin mengendap dari dalam larutan dalam jangkau pH yang perlu untuk dititrasi, atau mungkin membentuk kompleks-kompleks yang inert, atau indikator logam yang sesuai tidak tersedia. Dalam hal ini ditambahkan larutan baku EDTA berlebih, kemudian larutan di buffer pada pH yang diinginkan, dan kelebihan pereaksi dititrasi kembali dengan larutan baku ion logam; yaitu larutan ZnCl2 / ZnSO4 atau MgCl2 / MgSO4. Titik akhir titrasi dideteksi dengan bantuan indikator logam yang memberi respon terhadap ion logam yang terdapat dalam titrasi kembali (Basset, dkk., 1991).
3. Titrasi penggantian (Substitusi)
Titrasi substitusi dapat digunakan untuk ion logam yang tidak bereaksi (bereaksi dengan tak memuaskan) dengan indikator logam, atau untuk ion logam yang membentuk kompleks EDTA yang lebih stabil dari pada kompleks EDTA dari logam-logam lainya seperti magnesium dan kalsium. Kation logam Mn+ yang akan ditetapkan dapat diolah dengan kompleks magnesium EDTA, pada mana reaksi berikut terjadi:
Mn+ + MgY2-↔ (MY)(n-4)+ + Mg2+
13 4. Titrasi alkalimetri
Bila suatu larutan dinatrium etilenadiaminatetraasetat (Na2H2Y), ditambahkan pada larutan yang mengandung ion-ion logam, terbentuklah kompleks-kompleks dengan disertai pembebasan dua ekuivalen ion hidrogen:
Mn+ + H2Y2-↔ (MY)(n-4)+ + 2H+
Ion hidrogen yang dibebaskan dapat dititrasi dengan larutan baku natrium hidroksida dengan menggunakan indikator asam-basa. Pilihan lain, suatu campuran iodat-iodida ditambahkan disamping larutan EDTA, dan iod yang dibebaskan dititrasi dengan larutan baku tiosulfat. Larutan logam yang akan ditetapkan harus dinetralkan dengan tepat sebelum dititrasi; ini hal yang sukar yang disebabkan oleh hidrolisis banyak garam, dan merupakan segi lemah dari titrasi alkalimetri (Basset, dkk., 1991).
2.4.3 Indikator ion logam
Keberhasilan suatu titrasi EDTA bergantung pada penetapan titik akhir secara cermat. Persyaratan bagi sebuah indikator ion logam untuk digunakan pada pendeteksian visual dari titik-titik akhir meliputi:
1. Reaksi warna harus sedemikian sehingga sebelum titik akhir, bila hampir semua ion logam telah berkompleks dengan EDTA, larutan akan berwarna jelas.
2. Reaksi warna itu haruslah spesifik (khusus), atau sedikitnya selektif.
14
untuk menjamin pada titik-akhir, EDTA melepaskan ion-ion logam dari kompleks indikator-logam. Perubahan dalam kesetimbangan dari kompleks indikator-logam ke kompleks logam-EDTA harus tajam dan cepat.
4. Warna yang kontras antara indikator bebas dan kompleks indikator-logam harus sedemikian sehingga mudah diamati.
5. Indikator harus sangat peka terhadap ion logam sehingga perubahan warna terjadi sedekat mungkin dengan titik ekuivalen.