BAB II
TINJAUAN PUSTAKA
2.1. Air
Semua makhluk hidup ini memerlukan air, karena air merupakan kebutuhan dasar bagi
kehidupan. Khususnya manusia, air diperlukan untuk berbagai keperluan, antara lain
rumah tangga, industri, pertanian, dan sebagainya. Dalam memenuhi kebutuhan air,
manusia selalu memperhatikan kualitas dan kuantitas air. Kualitas yang cukup
diperoleh dengan mudah karena adanya siklus hidrologi, yakni siklus ilmiah yang
mengatur dan memungkinkan tersedianya air permukaan dan air tanah. Namun
demikian, pertambahan penduduk dan kegiatan manusia menyebabkan pencemaran
sehingga kualitas air yang baik dan memenuhi persyaratan tertentu sulit diperoleh.
Dalam hal ini masalah pencemaran air dapat diidentifikasikan melalui beberapa
cara, antara lain dengan pengamatan tidak langsung dan langsung. Adapun yang
dimaksudkan dengan pengamatan tidak langsung melalui keluhan penduduk pemakai
air leding berbau bahan kimia. Sebagian lainnya menyaksikan kematian ikan di perairan
yang mereka gunakan untuk keperluan rumah tangga. Sedangkan pengamatan langsung
melalui indera untuk mengidentifikasi bau busuk, rasa tidak enak, kekeruhan,
pertumbuhan algae dan rumput, dan kematian ikan. Selain itu identifikasi masalah
diperoleh dengan mempelajari laporan hasil penelitian dan monitoring yang dilakukan
diidentifikasi masalah secara kasar yang menjadi titik tolaknya melakukan penelitian
(Sutrisno, 2006).
Peraturan Pemerintah Republik Indonesia No. 82 tahun 2001 tentang
Pengelolaan kualitas dan Pengendalian Pencemaran Air, maka klasifikasi mutu air
ditetapkan menjadi 4 (empat) kelas sebagai berikut :
a. Kelas satu, air yang diperuntukannya dapat digunakan untuk air bakti air
minum, dan atau peruntukan lain yang mempersyaratkan mutu air yang sama
dengan kegunaan tersebut.
b. Kelas dua, air yang diperuntukannya dapat digunakan untuk prasarana / sarana
rekreasi air, pembudidayaan ikan air tawar, peternakan, air untuk mengairi
pertanaman, dan atau peruntukann lain yang mempersyratkan mutu air yang
sama dengan kegunaan tersebut.
c. Kelas tiga, air yang diperuntukannya dapat digunakan pembudidayaan ikan air
tawar, peternakan, air untuk mengairi pertanaman, dan atau peruntukann lain
yang mempersyratkan mutu air yang sama dengan kegunaan tersebut.
d. Kelas empat, air yang diperuntukannya dapat digunakan untuk mengairi
peternakan, pertanaman, dan atau peruntukann lain yang mempersyratkan mutu
air yang sama dengan kegunaan tersebut.
(http://www.jakartawater.org/images/stories/undang/PP1182.pdf)
Pada prinsipnya, jumlah air di alam ini tetap dan mengikuti suatu aliran yang
dinamakan cyclus Hydrologie. Dengan adanya penyinaran matahari, maka air yang ada
di permukaan bumi akan menguap dan membentuk uap air. Karena adanya angin, maka
uap air ini akan bersatu dan berada di tempat yang tinggi yang sering dikenal dengan
nama awan. Oleh angin, awan ini akan terbawa makin lama makin tinggi di mana
sebagai hujan. Air hujan ini sebagian mengalir ke dalam tanah, jika menjumpai lapisan
rapat air akan berkurang, dan sebagian air akan mengalir di atas lapisan rapat ini. Jika
air ini ke luar pada permukaan bumi, maka air ini disebut mata air. Air permukaan yang
mengalir di permukaan bumi, umumnya bebentuk sungai – sungai dan jika melalui
suatu tempat rendah (cekung) maka air akan berkumpul, membentuk suatu danau atau
telaga. Tetapi banyak di antaranya yang mengalir ke laut kembali dan kemudian akan
mengikuti siklus hidrologi ini (Sutrisno, 2006).
A. Air Permukaan (Surface Water)
Air tawar berasal dari dua sumber, yaitu air permukaan (surface water) dan air tanah
(ground water). Air permukaan adalah air yang berada di sungai, danau, waduk, rawa,
dan badan air lain, yang tidak mengalami infiltrasi ke bawah tanah. Areal tanah yang
mengalir ke suatu badan air disebut water heads atau drainage basins. Air yang
mengalir dari daratan menuju suatu badan air disebut limpasan permukaan (surface run
off); dan air yang mengalir di sungai menuju laut disebut aliran air sungai (river run
off). Sekitar 69% air yang masuk ke sungai berasal dari hujan, pencairan es / salju
(terutama untuk wilayah ugahari), dan sisanya berasal dari air tanah.
Peraiarn permukaan diklasifikasikan menjadi dua kelompok utama, yaitu badan
air tergenang (standing waters atau lentik) dan badan air mengalir (flowing waters atau
lotik).
1. Perairan Tergenang (Lentik)
Perairan tergenang meliputi danau, kolam, waduk (reservoir), rawa (wetland), dan
stratifikasi secara vertikal akibat perbedaan intensitas cahaya dan perbedaan suhu pada
kolom air yang terjadi secara vertikal.
Danau dicirikan dengan arus yang sangat lambat ( 0,001 – 0,01 m/detik ) atau
tidak ada arus sama sekali. Oleh karena itu , waktu tinggal air dapat berlangsung lama.
Arus air danau dapat bergerak ke berbagai arah. Perairan danau biasanya memiliki
stratifikasi kualitas air secara vertikal. Stratifikasi ini tergantung pada kedalaman dan
musim.
2. Perairan Mengalir (Lotik)
Salah satu contoh perairan mengalir adalah sungai. Sungai dicirikan oleh arus yang
searah dan relatif kencang, dengan kecepatan berkisar antara 0,1 – 1,0 m/detik, serta
sangat dipengaruhi oleh waktu, iklim dan pola drainase. Pada perairan sungai, biasanya
terjadi pencampuran massa air secara menyeluruh dan tidak terbentuk stratifikasi
vertikal kolom air seperti pada peraiaran lentik. Kecepatan arus, erosi, dan sedimentasi
merupakan fenomena yang biasa terjadi di sungai sehingga kehidupan flora dan fauna
sangat dipengaruhi oleh ketiga variabel tersebut.
Klasifikasi perairan lentik sangat dipengaruhi oleh intetensitas cahaya dan
perbedaan suhu air; sedangkan klasifikasi perairan lotik justru dipengaruhi oleh
kecepatan arus atau pergerakan air, jenis sedimen dasar, erosi, dan sedimentasi.
Kecepatan arus dan pergerakan air sangat dipengaruhi oleh jenis bentang alam, jenis
batuan dasar dan curah hujan. Semakin rumit bentang alam, semakin besar ukuran
batuan dasar, dan semakin banyak curah hujan, pergerakan air semakin kuat dan
kecepatan arus semakin cepat (Effendi, 2003).
Air mempunyai sifat melarutkan bahan kimia. Abel Wolman menyatakan bahwa
buangan manusia selama beberapa tahun. Dengan bertambahnya aktivitas manusia,
maka faktor X tersebut dalam air akan bertambah dan merupkan masalah.
Faktor X merupakan zat – zat kimia yang mudah larut dalam air dan dapat
menimbulkan masalah sebagai berikut :
a. Toksisitas
b. Reaksi – reaksi kimia yang menyebabkan :
1. Pengendapan yang berlebihan.
2. Timbulnya busa yang menetap, yang sulit untuk dihilangkan.
3. Timbulnya respon fisiologis yang tidak diharapkan terhadap rasa
4. Perubahan perwujudan fisik air.
Air dapat juga menimbulkan berbagai akibat gangguan kesehatan terhadap
si-pemakai. Ini disebabkan karena :
a. Adanya kemampuan dari air untuk melarutkan bahan – bahan padat,
mengabsorpsikan gas – gas dan bahan cair lainnya, sehingga semua air alam
mengandung mineral dan zat – zat lain dalam larutan yang diperolehnya dari
udara, tanah dan bukit – bukit yang dilaluinya. Kandungan bahan atau zat – zat
ini dalam air dalam konsentrasi tertentu dapat menimbulkan efek gangguan
kesehatan pada si pemkai.
b. Air sebagai faktor yang utama dalam penularan berbagai penyakit infeksi
bakteri – bakteri usus tertentu seperti typus, paratypus, dysentri, baccilair, dam
kolera. Dalam hubungannnya dengan kebutuhan manusia akan air minum, dan
dengan memperhatikan adanya efek gangguan kesehatan yang dapat
ditimbulkan karena pemakaian air tersebut, maka ditetapkanlah kualitas air
minum.
2.2. Ion Renik (Trace) Di Perairan
Ion renik (trace) adalah ion yang terdapat di perairan dalam jumlah yang sangat sedikit,
biasanya dinyatakan dalam satuan nanogram/liter – mikrogram/liter. Beberapa unsur
meskipun dapat bersifat racun, masih dapat ditolerir kehaadirannya dalam air asalkan
bahan tersebut tidak melebihi konsentrasi yang ditetapkan. Unsur tersebut antara lain
kadmium, tembaga dan seng.
Adapun tinjauan secara terperinci terhadap setiap unsur yang tercantum dalam
standar persyaratan kualitas kimia air, di bawah ini akan memberikan gambaran yang
sedikit lebih jelas tentang sifat pengaruh unsur – unsur tersebut dalam air, sumber dari
unsur – unsur dan akibat yang dapat ditimbulkan apabila konsentrasi adanya unsur –
unsur tersebut dalam air melebihi standar yang telah ditetapkan.
2.2.1. Kadmium (Cd)
Kadmium adalah logam putih keperakan, yang dapat ditempa dan liat. Melebur pada
suhu 3210C. Larut dengan lambat dalam asam encer dengan melepaskan hidrogen
(diebabkan potensial elektrodanya yang negatif) :
Cd + 2H+ Cd2+ ` + H2
Beberapa reaksi ion kadmium (II) : reaksi ini dapat dipelajari paling mudah
dengan larutan kadmium sulfat 0,25 M.
1. Hidrogen sulfida (gas atau larutan air jenuh) : endapan kuning kadmium sulfida
:
Cd2+ + H2S CdS + 2H+
2. Larutan amonia bila ditambahkan tetes demi tetes : endapan putih kadmium (II)
hidroksida :
Cd2+ + 2NH3 + 2H2O Cd(OH)2 + 2NH4+
Regensia yang berlebihan melarutkan endapan, membentuk kompleks yang tak
berwarna
Cd(OH)2 + 4NH3 [Cd(NH3)4]2+ + 2OH-
(Vogel, 1985)
Kadmium (Cd) merupakan logam yang hingga kini belum diketahui dengan
jelas peranannya bagi tumbuhan dan makhluk hidup lain. Di dalam air, kadmium (Cd)
terdapat dalam jumlah yang sangat sedikit (renik) dan bersifat tidak larut dalam air.
Kadar kadmium pada kerak bumi sekitar 0,2 mg/kg. Sumber alami kadmium adalah
greenocsite (CdS), hawleyite, sphalerite, dan otavite.
Kadmiun banyak digunakan dalam industri metalurgi, pelapisan logam, pigmen,
baterai, peralatan elektronik, pelumas, peralatan fotografi, gelas, keramik, tekstil dan
plastik.
Kadmium karbonat dan kadmium hidroksida memiliki sifat kelarutan yang
terbatas. Garam – garam kadmium (klorida, nitrat, dan sulfat) dapat berupa senyawa
kompleks organik dan anorganik, atau terserap ke dalam bahan tersuspensi dan sedimen
Kadar kadmium pada perairan tawar alami sekitar 0,0001 – 0,01 mg/L,
sedangkan pada perairan laut sekitar 0,0001 mg/L. Menurut WHO, kadar kadmium
maksimal pada air yang diperuntukkan bagi kepentingan pertanian dan peternakan,
kadar kadmium sebaiknya tidak melebihi 0,05 mg/L. Untuk melindungi kehidupan pada
ekosistem akuatik, perairan sebaiknya memiliki kadar kadmium sekitar 0,0002 mg/L.
Kadmium bersifat kumulatif dan sangat toksik bagi manusia karena dapat
mengakibatkan gangguan fungsi ginjal dan paru – paru, menigkatkan tekanan darah,
dan mengakibatkan kemandulan pada pria dewasa. Kasus keracunan kadmium yang
terkenal adalah timbulnya penyakit Itai – itai di Jepang, ditandai dengan rasa sakit pada
tulang dan terjadi pengeroposan tulang. Kadmium juga bersifat sangat toksik dan
bioakumulasi terhadap organisme (Effendi, 2003).
Kadmium dapat menyebabkan keracunan yang akut pada manusia yang
mendapat unsur tersebut dari makanan. Konsentrasi ini dalam ginjal dan hati tikus akan
meningkatkan pada keadaan di mana kepada tikus tersebut, diberikan air dengan
konsentrasi Cd 0,1 – 10 mg/L. Secara individual, pemberian air dengan konsentrasi Cd
rata – rata 0,047 mg/L tidak memberikan gejala. Unsur ini tidak penting dan tidak
menguntungkan.
Konsentrasi air minum dengan konsentrasi Cd yang melebihi standar yang
ditetapkan, akan menyebabkan unsur tersebut berakumulasi dalam jaringan tubuh
sehingga dapat menimbulkan batu ginjal, gangguan lambung, kerapuhan tulang,
2.2.2. Tembaga (Cu)
Tembaga adalah logam merah muda,yang lunak, dapat ditempa, dan liat. Ia melebur
pada suhu 10380C. Karena elektroda potensial standarnya positif, (+0,34 V untuk
pasangan Cu/Cu2+), tak larut dalam asam klorida dan asam sulfat encer, meskipun
dengan adanya oksigen ia bisa larut sedikit. Asam nitrat yang sedang pekatnya (8M)
dengan mudah melarutkan tembaga.
Ada dua deret senyawa tembaga. Senyawa – senyawa tembaga (I) diturunkan
dari tembaga (I) oksida Cu2O yang merah, dan mengandung ion tembaga (I) Cu+.
Senyawa – senyawa ini tidak berwarna, kebanyakan garam tembaga (I) tak larut dalam
air, perilakunya mirip senyawa perak (I). Mereka mudah dioksidasi menjadi senyawa
tembaga (II), yang dapat diturunkan dari tembaga (II) oksida, CuO, hitam. Garam –
garam tembaga (II) umumnya berwarna biru, baik dalam bentuk hidrat, padat, maupun
dalam larutan air; warna ini benar – benar khas hanya untuk ion tetraakuokuprat (II)
[Cu(H2O)4]2+ saja. Batas terlihatnya warna ion kompleks tersebut adalah 500 µg dalam
batas konsentrasi 1 dalam 104. Garam – garam tembaga (II) anhidrat, seperti tembaga
(II) sulfat anhidrat CuSO4, berwarna putih (atau sedikit kuning). Dalam larutan air
selalu terdapat ion kompleks tetraakuo; demi kesederhanaan biasa disebut sebagai ion
tembaga (II) Cu2+ saja (Vogel, 1985).
Tembaga atau Copper (Cu) merupakan logam berat yang dijumpai pada perairan
alami dan merupakan unsur yang esensial bagi tumbuhan dan hewan. Pada tumbuhan,
termasuk algae, tembaga berperan sebagai penyusun plastocyanin yang berfungsi dalam
transpor elektron dalam proses fotosintesis. Garam – garam tembaga divalen, misalnya
tembaga klorida, tembaga sulfat, dan tembaga nitrat bersifat sangat mudah larut dalam
tidak mudah larut dalam air. Apabila masuk ke dalam perairan alami yang alkalis, ion
tembaga akan mengalami presipitasi dan mengendap sebagai tembaga hidroksida dan
tembaga karbonat.
Kadar tembaga pada kerak bumi sekitar 50 mg/kg. Sumber alami tembaga
adalah chalcopyrite (CuFeS2), copper sulfida (CuS), malachite [Cu2(CO3)(OH)2], dan
azurite [Cu3(CO3)2(OH)2]. Tembaga banyak digunakan dalam industri metalurgi, tektil,
elektronika, dan sebagai cat anti karat (anti fouling). Tembaga (CuSO4.5H2O) juga
digunakan sebagai algasida untuk membasmi algae yang tumbuh secara berlebihan di
perairan. Sebagai algasida, tembaga menghambat penyerapan silika oleh diatom
sehingga menggangu proses pembentukan frustule. Tembaga karbonat digunakan
sebagai molusida yang berfungsi untuk membunuh Moluska.
Pada perairan alami, kadar tembaga biasanya < 0,02 mg/L. Air tanah dapat
mengandung tembaga sekitar 12 mg/L. Pada perairan laut , kadar tembaga berkisar
antara 0,001 –m0,025 mg/L. Kadar tembaga maksimum pada air minum adalah 0,1
mg/L. Defisiensi tembaga dapat mengakibatkan anemia; namun, kadar tembaga yang
berlebihan dapat mengakibatkan air menjadi berasa jika diminum dapat mengakibatkan
kerusakan pada hati. Kadar tembaga yang tinggi juga dapat mengakibatkan korosi pada
besi dan aluminium (Effendi, 2003).
Tembaga merupakan satu unsur yang paling penting dan berguna untuk
metabolisme. Konsentrasi batas dari unsur ini dapat menimbulkan rasa pada air
bervariasi 1 – 5 mg/L. Konsentrasi 1 mg/L merupakan batas konsentrasi tertinggi untuk
mencegah timbulnya rasa yang tidak menyenangkan.
Dalam jumlah kecil Cu diperlukan untuk pembentukan sel – sel darah merah,
namun dalam jumlah besar dapat menyebabkan rasa yang tidak enak di lidah, selain
Konsentrasi standar maksimum yang ditetapkan oleh Dep. Kes R.I. untuk Cu ini
adalah sebesar 0,05 mg/L sebagai batas maksimal yang diperbolehkan. (Sutrisno, 2006).
2.2.3. Seng (Zn)
Seng adalah logam yang putih kebiruan; logam ini cukup mudah ditempa dan liat pada
suhu 110 - 1500C. Seng melebur pada 4100C dan mendidih pada 9060C.
Logamnya yang murni, melarut lambat sekali dalam asam dan alkali; adanya zat
– zat penceemar atau kontak dengan platinum atau tembaga, yang dihasilkan oleh
penambahan beberapa tetes larutan garam dari logam – logam ini, mempercepat reaksi.
Ini menjelaskan larutnya seng – seng komersial. Yang terakhir ini dengan mudah larut
dalam asam klorida encer dan asam sulfat encer dengan mengeluarkan hidrogen :
Zn + 2H+ Zn2+ + H2
Pelarutan akan terjadi dalam asam nitrat yang encer sekali, pada mana tak ada
gas yang dilepaskan :
4Zn + 10H+ + NO3- 4Zn2+ + NH4+ + 3 H2O
Dengan bertambah pekatnya konsentrasi asam nitrat, akan terbentuk dinitrogen
oksida (N2O), nitrogen oksida (NO).
Asam nitrat pekat mempunyai pengaruh yang kecil terhadapa seng, karena
rendahnya kelarutannya seng nitrat dalam suasana demikian. Dengan asam sulfat pekat,
panas, dilepaskan belerang dioksida :
Zn + 2H2SO4 Zn2+ + SO2 + SO42- + 2H2O
Seng juga larut dalam hidroksida alkali, pada mana tertrahidroksozinkat (II) :
Seng membentuk hanya satu seri garam; garam – garam ini mengandung kation
seng (II), yang diturunkan dari seng oksida, ZnO (Vogel, 1985)
Seng (zinc) termasuk unsur yang terdapat dalam jumlah yang berlimpah di alam.
Kadar seng pada kerak bumi sekitar 70 mg/kg. Kelarutan unsur seng dan oksida seng
dalam air relatif rendah. Seng yang berikatan dengan klorida dan sulfat mudah terlarut,
sehingga kadar seng dalam air sangat dipengaruhi oleh bentuk senyawanya. Ion seng
mudah terserap dalam sedimen dan tanah. Silika terlarut dapat meningkatkan kadar
seng, karena silika mengikat seng. Jika perairan bersifat asam, kelarutan seng
meningkat. Kadar seng pada perairan alami < 0,05 mg/L; pada perairan asam mencapai
50 mg/L; dan pada perairan laut 0,01 mg/L.
Sumber alami utama seng adalah calamine (ZnCO3), sphalerite (ZnS),
smithsonite (ZnCO3), dan wilewmite (Zn2SiO4). Seng digunakan dalam industri besi
baja, cat, karet, tekstil, kertas, dan bubur kertas.
Seng termasuk unsur yang esensial bagi makhluk hidup, yakni berfungsi untuk
menbantu kerja enzim. Seng juga diperlukan dalam proses fotosintesis sebagai agen
bagi transfer hidrogen dan berperan dalam pembentukan protein. Davis dan Cornwell
(1991) mengemukakan bahwa seng tidak bersifat toksik bagi manusia, akan tetapi pada
kadar yang tinggi dapat menimbulkan rasa pada air (Effendi, 2003)
Unsur ini penting dan berguna dalam metabolisme, dengan kebutuhan per hari
10 – 15 mg. Pada konsentrasi 675 – 2280 mg/L dapat menyebabkan muntah. Dengan
garam – garam seng, akan menjadi seperti susu pada konsentrasi 30 mg/L dan menjadi
beras logam pada konsentrasi 40 mg/L. Batas konsentrasi tertinggi sebagai standar yang
Dalam jumlah kecil merupakan unsur yang penting untuk metabolisme, karena
kekurangan Zn dapat menyebabkan hambatan pada pertumbuhan anak. Dalam jumlah
besar unsur ini dapat menimbulkan rasa pahit dan sepat pada air minum.
Konsentrasi standar maksimum yang ditetapkan oleh Dep. Kes. R.I untuk Zn ini
adalah 0,1 mg/L untuk batas maksimum yang dianjurkan, dan sebesar 0,5 mg/L sebagai
batas maksimal yang diperbolehkan (Sutrisno, 2006)
2.3. Spektrofotometri Serapan Atom
Peristiwa serapan atom pertama kali diamati oleh Fraunhofer, ketika menelaah garis –
garis hitam pada spektrum matahari. Sedangkan yang memanfaatkan prinsip serapan
atom pada bidang analisis adalah seorang Australia bernama Alan Walsh di tahun 1955.
Sebelumnya ahli kimia banyak bergantung pada cara – cara spektrofotometrik atau
metode analisis spektrografik. Beberapa cara ini yang sulit dan memakan waktu,
kemudian segera digantikan dengan spektroskopi serapan atom atau atomic absorption
spectroscopy (AAS). Metode ini sangat tepat untuk analisis zat pada konsentrasi
rendah. Teknik ini mempunyai beberapa kelebihan dibandingkan metode spektroskopi
emisi konvensional. Pada metode konvensional, emisi tergantung pada sumber eksitasi.
Bila eksitasi dilakukan secara termal, maka ia bergantung pada temperatur sumber.
Selain itu eksitasi termal tidak selalu spesifik, dan eksitasi secara serentak pada
berbagai spesies dalam suatu campuran dalam suatu campuran dapat saja terjadi.
Sedangkan dengan nyala, eksitasi unsur – unsur dengan tingkat tingkat energi eksitasi
yang rendah dapat dimungkinkan. Tentu saja perbandingan benyaknya atom yang
metode serapan atom hanya tergantung pada perbandingan ini dan tidak bergantung
pada temperatur. Metode serapan sangatlah spesifik. Logam – logam yang membentuk
campuran kompleks dapat dianalisis dan selain itu tidak selalu diperlukan sumber
energi yang besar (Khopkar, 2008)
2.3.1 Teori Spektrofotometri Serapan Atom
Metode AAS berprinsip pada absorbsi cahaya oleh atom. Atom – atom menyerap
cahaya tersebut pada panjang gelombang tertentu, tergantung pada sifat unsurnya.
Misalkan natrium menyerap pada 589 nm, uranium pada 358,5 nm, sedangkan kalium
766,5 nm. Cahaya pada panjang gelombang ini cukup energi untuk mengubah tingkat
elektronik suatu atom. Transisi elektronik suatu unsur bersifat spesifik. Dengan absorpsi
energi, berarti memperoleh lebih banyak energi, suatu atom pada keadaan dasar
dinaikan tingkat energinya ke tingkat eksitasi. Tingkat – tingkat eksitasinya pun
bermacam-macam. Misalkan unsur Na dengan nomor atom 11 mempunyai konfigurasi
1s22s2sp63s1, tingkat dasar untuk elektron valensi 3s, artinya tidak memiliki kelebihan
energi. Elektron ini dapat tereksitasi ke tingkat 3p dengan energi 2,2 eV ataupun ke
tingkat 4p dengan energi 3,6 eV, masing – masing sesuai dengan panjang gelombang
sebesar 589 dan 330 nm. Kita dapat memilih di antara panjang gelombang ini yang
menghasilkan garis spektrum yang tajam dan dengan intensitas maksimum. Inilah yang
dikenal dengan garis – garis resonansi. Garis – garis lain yang bukan garis resonansi
dapat berupa spektrum yang berasosiasi dengan tingkat energi molekul, biasanya
berupa pita – pita lebar ataupun garis tidak berasal dari eksitasi tingkat dasar yang
2.3.2 Instrumentasi Spektrofotometer Serapan Atom
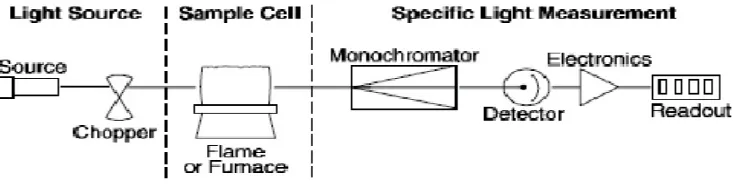
Skema komponen – komponen pada sebuah spektrofotometri serapan atom secara
umum dapat dilihat pada gambar di bawah ini :
Gambar 2.1 : Skema komponen – komponen Spektrofotometri Serapan Atom
A. Lampu katoda berongga
Seperangkat sumber yang dapat memberikan garis emisi yang tajam dari suatu unsur
spesifik tertentu dikenal dengan sebagai lampu pijar hollow katoda. Lampu ini memiliki
dua elektroda, satu diantaranya berbentuk silinder dan terbuat dari unsur dan terbuat
dari unsur yang sama dengan unsur yang dianalisis. Lampu ini diisi dengan gas mulia
bertekanan rendah. Dengan pemberian tegangan pada arus tertentu, logam mulai
memijar, dan atom – atom logam katodanya akan teruapkan dengan pemercikan. Atom
akan tereksitasi kemudian mengemisikan radiasi pada panjang gelombang – panjang
gelombang tertentu. (Khopkar, 2008).
B. Nyala
Nyala yang digunakan pada SSA harus mampu memberikan suhu ≥ 2000 K. Untuk
pengoksida (oksidan) seperi misalnya udara dan nitrogen oksida (N2O). Suhu
maksimum yang dihasilkan pada pembakaran berbagai campuran gas pembakar dengan
gas pengoksida adalah sebagai berikut :
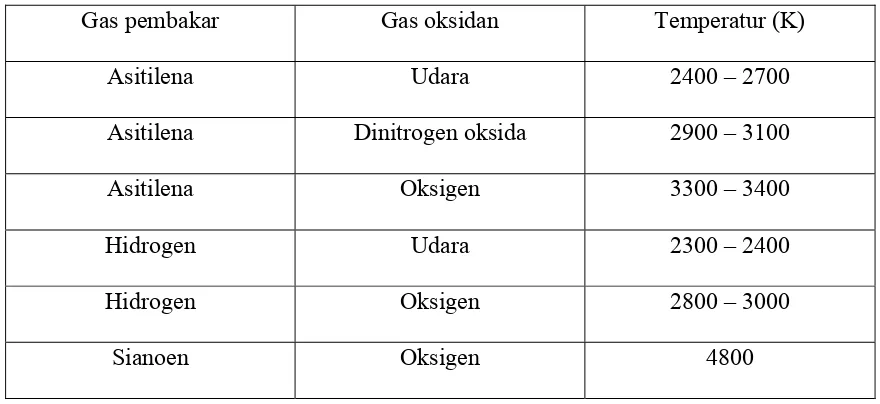
Tabel 2.1 : Jenis – jenis gas pembakar pada SSA
Gas pembakar Gas oksidan Temperatur (K)
Asitilena Udara 2400 – 2700
Asitilena Dinitrogen oksida 2900 – 3100
Asitilena Oksigen 3300 – 3400
Hidrogen Udara 2300 – 2400
Hidrogen Oksigen 2800 – 3000
Sianoen Oksigen 4800
C. Monokromator
Dalam spektroskopi serapan atom fungsi monokromator adalah untuk memencilkan
garis resonansi dari semua garis tak diserap yang dipancarkan oleh sumber radiasi.
Dalam kebanyakan instrumen komersial digunakan kisi difraksi karena sebaran yang
dilakukan oleh kisi lebih seragam dari pada yang dilakukan prisma, dan akibatnya
instrumen kisi difraksi dapat memelihara daya pisah yang lebih tinggi sepanjang jangka
panjang gelombang yang lebih lebar.
D. Detektor
Dalam spektrofotometer serapan atom, mengingat kepekaan spektral yang lebih baik
yang diperlakukan, digunakan penggandaan foton. Keluaran dari detektor diumpankan
ke suatu sistem peragaan yang sesuai, dan dalam hubungan ini hendaknya diingat
telah diseleksi tetapi dapat juga timbul dari emisi dalam nyala. Emisi ini dapat
disebabkan oleh emisi atom yang timbul dari atom – atom yang sedang diselidiki, dan
dapat juga dari emisi pita molekul.
E. Amplifier
Amplifier berfungsi untuk memperkuat sinyal yang diterima dari detektor sebelum
sampai ke rekorder.
F. Rekorder
Rekorder pada instrumen SSA berfungsi untuk mengubah sinyal yang diterima menjadi
bentuk digital, yaitu dengan satuan absorbansi. Isyarat dari detektor dalam bentuk
tenaga listrik akan diubah oleh rekorder dalam bentuk nilai bacaan serapan atom.
(Maria, 2009)
2.3.2 Pengukuran Kuantitatif
Pengukuran secara kuantitatif dapat dibuat dengan menggunakan kurva kalibrasi
sebelumnya atau dengan metode dari penambahan standar. Dalam kasus yang berbeda,
kondisi pengeoperasian harus dioptimalkan terlebih dahulu dengan menganggap
rentang konsentrasi sampel yang diduga dan kelinieran tanggapan. Ini termasuk
pemilihan garis resonansi yang semestinya (biasanya dibuat tabel referensi), pengaturan
lampu yang sesuai, temperatur nyala dan laju penguapan sampel, penempatan pembakar
dan lebar celah monokromator. Larutan standar yang terbaik disiapkan dengan
sedekat mungkin dengan komposisi kasar untuk sampel – sampel ini. Presisi yang
relatif dari sebuah pengukuran serapan atom adalah baik, dalam banyak kasus 0,5 -2 %
dapat dicapai tanpa kesulitan dimana digunakan nyala atomisasi. Presisi untuk metode
tanpa nyala walau bagaimana pun sering jauh lebih buruk sebagai hasil beberapa
gangguan yang akan dibahas di bawah. Kurva kalibrasi selalu menunjukkan lengkungan
menuju sumbu konsentrasi ketika melewati sumbu satu. Ini tidak linier disebabkan tidak
terserapnya radiasi yang mencapai detektor atau ketika setengah lebar dari garis emisi
dari lampu yang semestinya atau melampaui garis absorbansi. Radiasi yang tidak
terserap dapat dijangkau detektor banyaknya sumber, termasuk garis emisi dari unsur
katoda mendekati garis resonansi yang terpilih atau gas pengisi, sebaran radiasi dalam
monokromator dan radiasi yang melewati nyala atau penguapan sampel. (Fifield, 1987)
2.3.1 Interferensi
Yang dimaksud dengan gangguan – gangguan (interference) pada SSA adalah peristiwa
– peristiwa yang menyebabkan pembacaan absorbansi unsur yang dianalisis menjadi
lebih kecil atai lebih besar dari nilai yang sesuai dengan konsentrasinya dalam sampel.
Gangguan – gangguan yang dapat terjadi dalam SSA adalah sebagai berikut :
1. Gangguan yang berasal dari matriks sampel yang mana dapat mempengaruhi
banyaknya sampel yang mencapai nyala. Sifat – sifat tertentu matriks sampel
dapat berpengaruh terhadap laju aliran bahan bakar / gas pengoksidasi. Sifat –
tersebut adalah : viskositas, tegangan permukaan, berat jenis, dan tekanan uap.
jumlah atom yang mencapai nyala menjadi lebih sedikit dari konsentrasi yang
seharusnya terdapat dalam sampel.
2. Gangguan kimia yang dapat mempengaruhi jumlah / banyaknya atom yang
terjadi di dalam nyala. Terbentuknya atom – atom netral yang masih dalam
keadaan azas di dalam nyala sering terganggu oleh dua peristiwa kimia yaitu :
a. Disosiasi senyawa – senyawa yang tidak sempurna
b. Ionisasi atom – atom di dalam nyala
3. Gangguan oleh absorbansi yang disebabkan bukan oleh absorbansi atom yang
dianalisis; yakni absorbansi oleh molekul – molekul yang tidak terdisosiasi di
dalam nyala. Gangguan ini dapat diatasi dengan cara sebagai berikut :
a. Penggunaan nyala / suhu atomisasi yang lebih tinggi
b. Penambahan senyawa penyangga
c. Pengekstrasian unsur yang akan dianalisis
d. Pengekstrasian ion atau gugus pengganggu
4. Gangguan oleh penyerapan non-atomik (non atomic absorption). Gangguan ini
berarti terjadinya penyerapan cahaya dari sumber sinar yang bukan berasal dari
atom – atom yang akan dianalisis. Penyerapan non-atomik dapat disebabkan
adanya penyerapan cahaya oleh partikel – partikel padat yang berada di dalam
nyala. Cara mengatasinya adalah dengan bekerja pada panjang gelombang yang
lebih besar atau pada suhu yang lebih tinggi.