7 BAB II
TINJAUAN PUSTAKA
2. 1 SEPSIS
2. 1.1 Definisi
Definisi Sepsis pertama sekali diperkenalkan oleh American college
OfChest Physicians (ACCP) dan The Society Of Critical Care Medicine (SCCM)
Consensus Conference pada tahun 1991, dimana sepsis diartikan sebagai suatu
respons inflamasi sisemik (systemic inflammatory response) terhadap infeksi30. Meskipun SIRS, sepsis dan syok septik biasanya berhubungan dengan infeksi
bakteri, namun tidak harus terdapat bakterimia. Hal ini terjadi karena di dalam
darah kemungkinan terdapat endo maupun eksotoksemia sedangkan bakterinya
berada dalam jaringan. Bakterimia adalah keberadaan bakteri hidup dalam
komponen cairan tubuh, biasanya dijumpai setelah jejas pada permukaan mukosa,
primer (jika fokus infeksi tidak teridentifikasi) ataupun sekunder terhadap fokus
infeksi intravaskuler atau ekstravaskuler, sehingga biakan darah tidak harus
positif.1-3
Sepsis berat adalah sepsis yang berhubungan dengan adanya
disfungsiorgan (satu atau lebih) hipoperfusi jaringan atau hipotensi. Hipoperfusi
termasuk asidosis laktat, oligouria dan perubahan status mental2,3,30-32. Sedangkan
syok sepsis adalah sepsis yang disertai hipotensi (TDS< 90mmHg atau penurunan
≥ 40 mmHg dari tekanan darah sebelumnya) tanpa ada penyebab hipotensi
lainnya, yang menetap walaupun telah dilakukan resusitasi cairan yang adekuat.1-3
2. 1.2 Epidemiologi
yang dirawat di Intensive Care Unit (ICU)4,33,34.Namun di Indonesia belum ada data mengenai prevalensi terjadi sepsis pada pasien dewasa baik di ruang rawatan
ICU maupun non-ICU.
2. 1.3 Etiologi
Infeksi pada sepsis dapat disebabkan oleh bakteri Gram-negatif atau
Gram-positif, namun penyebab sepsis terbesar adalah bakteri gram negatif dengan
persentase 60-70% yang menghasilkan berbagai produk yang menstimulasi sistem
imun. Produk yang berperan penting terhadap sepsis adalah lipopolosakarida
(LPS). LPS atau endotoksin glikoprotein kompleks merupakan komponen utama
terluar dari bakteri gram negatif. Selama periode 1979 – 2000 di Amerika Serikat
angka sepsis terus meningkat sampai 13,7% per tahun. Dari hasil biakan kuman
yang tumbuh, 52,1% diantaranya adalah gram positif, 37,5% gram negatif, 4,7%
polimikrobial, 4,6% jamur, dan 1% bakteri anaerob. Infeksi bakteri gram positif
terus meningkat disebabkan oleh peningkatan infeksi nosokomial dari berbagai
sumber seperti kateterisasi atau terapi imunosupresif. Hal ini ditunjukkan dari
meningkatnya kasus MRSA (Methicillin-Resistant Staphylococcus Aureus) dari 29% menjadi 45%. Infeksi terutama terjadi pada saluran nafas (40-44%), diikuti
oleh infeksi saluran genitourinarius 18%) dan infeksi intra abdominal
(9-14%).3,4
2. 1.4 Patogenesis Dan Patofisiologi
Sepsis merupakan puncak dari interaksi yang kompleks antara organisme
penyebab infeksi dan host imun. Kedua hal yakni respon host dan karakteristik
dari organisme penyebab infeksi mempengaruhi outcome sepsis. Pada sepsis
diawali dengan aktifasi sistem imun bawaan, sebagai respons terhadap infeksi,
melalui pengenalan terhadap benda asing yakni lipopolisakarida bakteri
(endotoksin atau LPS). Mekanisme ini antara lain pelepasan sitokin, aktifasi
neutrofil, monosit, makrofag dan sel endotel serta aktifasi komplemen, koagulasi,
fibrinolitik, dan sistem kontak.35-37
Toll-like receptors (TLR) mengatur mekanisme pertahanan tubuh dan
permukaan sel yang mengenali komponen molekuler dari mikroorganisme. Pada
fase awal dari infeksi, TLR mengaktifasi sistem imun bawaan dan menghancurkan
patogen dari makrofag, natural killer cells dan sistem komplemen. Pada fase kedua, TLR mengaktifasi sistem imun didapat dengan mengaktifasi limfosit T dan
B. Disini produksi sitokin berperan penting, makrofag dan monosit yang
teraktifasi adalah sel yang utama yang menghasilkan sitokin, tapi fibroblast,
neutrofil dan sel endotel juga dapat menghasilkan sitokin.32,35,37
TLR-4 mengenali LPS bakteri gram negatif, TLR-2 mengenali
peptidoglikan bakteri gram positif. Ikatan TLR dengan epitop pada
mikroorganisme akan mengaktifkan intracellular signal transduction pathway yang mengaktifkan cytosolic nuclear factor kB (NF-kB). NF-kB meningkatkan transkripsi sitokin. Sitokin akan mengaktifkan sel endotel dengan meningkatkan
ekspresi molekul permukaan dan memperkuat adhesi neutrofil dan endotel di
tempat infeksi. Sitokin juga menyebabkan injuri sel endotel melalui induksi
neutrofil, monosit, makrofag dan trombosit yang melekat pada sel endotel.35-39
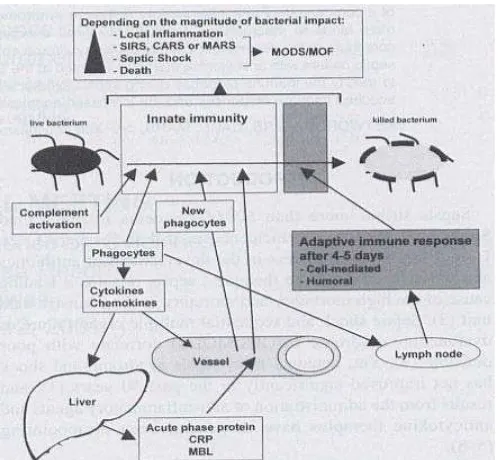
Gambar 2.1 Respon Imun terhadap Infeksi Organisme
(Dikutip dari : Oberholzer A,Shock. 2001;16:83-96)
Sitokin melepaskan mediator seperti protease, oksidan, prostaglandin, dan
endotel, menimbulkan peningkatan pemeabilitas, vasodilatasi dan perubahan
keseimbangan prokoagulan dan koagulan. Sitokin juga mengaktifasi kaskade
koagulasi. Selain itu endotel yang teraktifasi akan melepaskan nitric oxide (NO),
suatu bahan vasodilator poten yang berperan pada syok sepsis. Sitokin dibedakan
menjadi proinflamsi dan anti inflamasi, tergantung fungsinya. TNF-α, IL-1ß, IL-6, Il-8, Il-12 adalah sitokin proinflamasi utama yang berperan dalam aktifasi awal
dari respons inflamasi sistemik pada sepsis. TNF-α terutama diproduksi oleh monosit dan makrofag, dan bekerja merangsang produksi molekul adhesi pada sel
endotel serta sistem koagulasi dan komplemen. IL-1 terutama dihasilkan oleh
monosit dan makrofag. IL-1ß dan TNF-α mempunyai efek sinergik. IL-1ß merangsang produksi IL-6, IL-8 dan TNF-α dan dapat menyebabkan perubahan hemodinamik sama seperti shock sepsis. Pada banyak penelitian didapat bahwa
kadar IL-1ß tidak berhubungan dengan beratnya penyakit, sedangkan TNF-α berhubungan dengan beratnya penyakit pada beberapa studi.2,3,35-37
Sepsis juga mengaktifkan produksi dan pelepasan sitokin anti inflamasi.
IL-1 receptor antagonist (IL-1ra) menghambat IL-1, yang berikatan secara
kompetitif dengan reseptor IL-1 dan menghambat kerja IL-1. IL-1ra dihasilkan
terutama oleh makrofag, beberapa studi gagal membuktikan bahwa pemberian
IL-1ra pada sepsis dapat memperbaiki mortalitas pada sepsis.37,38
IL-10 adalah sitokin anti inflamasi utama. Sitokin ini menghambat
produksi TNF-α, IL-1ß, IL-6, IL-8. Sitokin ini juga menekan pelepasan radikal bebas dan aktifitas NO serta produksi prostaglandin. Beberapa sel yang dapat
memproduksi IL-10 adalah CD-4, CD-8, makrofag, monosit, limfosit B, sel
dendrite dan sel epitel. Pada syok sepsis, monosit merupakan sumber utama dari
sitokin ini. IL-10 tidak hanya membatasi beratnya respons imflamasi, tapi juga
mengatur proliferasi sel T, sel B, natural killer cells, antigen precenting cells, cel
mast dan granulosit. Sitokin ini berperan dalam imun supresi, sebagai stimulator
imunitas bawaan dan imunitas TH-2. Beberapa studi mendapatkan bahwa pada
keadaan sepsis kadar sitokin IL-10 meningkat dan lebih meningkat lagi pada syok
sepsis.39-41
IL-6 merupakan sitokin yang paling banyak diteliti pada sepsis dan paling
TNF-α dan iIL-1ß. Sitokin ini terutama diproduksi oleh monosit dan makrofag dan sel indotel dan berhubungan dengan derajat beratnya sepsis sehingga peningkatan
yang persisten berhubungan dengan perkembangan Multiple Organ Failure (MOF) dan prognosis buruk.Sitokin ini mengatur diferensiasi dari sel limfosit B
dan T. Sitokin ini adalah pirogen endogen dan demam pada pasien sepsis
disebabkan oleh sitokin ini. Sitokin ini juga bersifat anti inflamasi yang
menghambat produksi sitokin pro-inflamasi lainnya dan respons yang adekuat
dapat mengaktivasi HPA pada penyakit kritis.1-3
IL-8 berfungsi mengaktifasi dan sebagai kemotaksis netrofil ke tempat
inflamasi. Konsentrasi tinggi dari sitokin ini dapat merangsang infiltrasi netrofil,
merusak endotel, kebocoran plasma dan injuri jaringan lokal. Sebaliknya sitokin
ini juga menghambat migrasi netrofil apabila berada dalam sirkulasi, sehingga
sitokin ini bersifat pro dan anti inflamasi.2
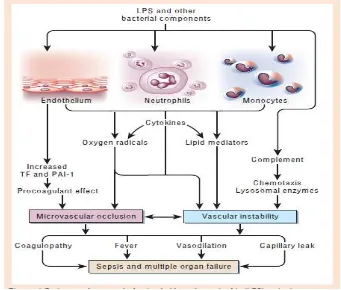
Gambar 2. 2 Patogenesis Terjadinya Multiple Organ Failure dan Syok pada Sepsis
(Dikutip dari: Cohen J, Nature. 2002;420:19-26)
Gejala klinis sepsis biasanya tidak spesifik seperti demam, menggigil dan
gejala konstitusional seperti lelah, malaise, gelisah, kebingungan sampai
penurunan kesadaran. Manifestasi klinis sepsis akan lebih berat bila terjadi pada
penderita usia lanjut, diabetes mellitus, keganasan, HIV atau komorbid dengan
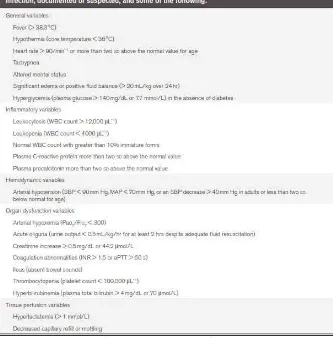
penyakit immunokompromise lainnya. Manifestasi SIRS dapat berupa dua atau
lebih dari gejala berikut: 1) Suhu > 38⁰C atau < 36⁰C; 2) Takikardia (HR > 90
kali/menit; 3) Takipneu (RR > 20 kali/menit) atau PaCO2 < 32 mmHg; 4) Lekosit
darah > 12.000/µL, <4.000/µL atau neutrofil batang > 10%.2,3
Dikutip dari: Dellinger PR, Crit Care Med. (2013); 41:580–637. Tabel 2. 2 Kriteria Sepsis Berat
2. 2 Trombosit
2. 2.1 Produksi Trombosit
Trombosit dihasilkan dalam sumsum tulang melaui fragmentasi sitoplasma
megakariosit. Prekursor megakariosit, megakarioblast muncul melalui proses
diferensiasi dari sel induk hemopoetik. Megakariosit mengalami pematangan
dengan replikasi inti endomitotik yang sinkron, memperbesar volume sitoplasma
sejalan dengan penambahan lobus inti menjadi kelipatan duanya. Pada berbagai
stadium perkembangannya (paling banyak pada stadium inti delapan), sitoplasma
menjadi granular dan trombosit dilepaskan. Produksi trombosit mengikuti
pembentukam mikrovesikel dalam sitoplasma sel yang menyatu dan membentuk
membrane pembatas trombosit. Tiap sel megakariosit bertanggung jawab untuk
menghasilkan sekitar 4000 trombosit. Interval waktu semenjak diferensiasi sel
induk manusia sampai produksi trombosit sekitar 10 hari. Trombopoetin adalah
mempunyai reseptor untuk trombopoetin (C-MPL) dan mengeluarkannya dari
sirkulasi.42
2. 2.2 Struktur Trombosit
Glikoprotein permukaan sangat penting dalam reaksi adhesi dan agregasi
trombosit. Adhesi pada kolagen difasilitasi oleh glikoprotein Ia (GPIa).
Glikoprotein Ib dan IIb/IIIa penting dalam perlekatan trombosit pada faktor von
Willebrand (vWF) dan subendotel vaskuler. Reseptor IIb/IIIa juga merupakan
reseptor untuk fibrinogen yang penting dalam agregasi trombosit. Membran
plasma berinvaginasi ke bagian dalam trombosit untuk membentuk suatu sistem
kanalikular terbuka yang menyediakan permukaan reaktif yang luas tempat
protein koagulasi plasma diabsorpsi secara selektif. Fosfolipid membrane (faktor
3 trombosit) sangat penting dalam konversi faktor koagulasi X menjadi Xa dan
protrombin (faktor II) menjadi thrombin (faktor IIa).42,43
2. 2.3 Fungsi trombosit
Fungsi utama trombosit adalah pembentukan sumbat mekanik selama
respons hemostasis normal terhadap cedera vaskular. Tanpa trombosit, maka
dapat terjadi kebocoran darah spontan. Reaksi trombosit dapat berupa adhesi,
sekresi, agregasi dan fusi serta aktivitas prokoagulannya sangat penting untuk
fungsinya.42-44
2. 3 Trombosis
Pembuluh darah yang normal dilapisi oleh sel endotel. Dalam keadaan
yang utuh sel endotel bersifat antikoagulan dengan menghasilkan inhibitor
trombosit (nitrogen oksida, prostasiklin, ADPase), inhibitor bekuan darah/lisis
(heparin, tissue plasminogen activator, urokinase plasminogen aktivator,
trombomodulin, inhibitor jalur faktor jaringan). Sel endotel ini dapat terkelupas
oleh berbagai rangsangan seperti asidosis, hipoksia, endotoksin, oksidan, sitokin
dan stress oksidatif. Endotel pembuluh darah yang tidak utuh akan menyebabkan
vasokonstriksi lokal, menghasilkan faktor koagulasi (tromboplastin, faktor von
1), terbukanya jaringan ikat subendotel (serat kolagen, serat elastin dan membran
basalis) yang menyebabkan aktivasi dan adhesi trombosit serta mengaktifkan
faktor XI dan XII.43
Trombosis adalah pembentukan suatu massa abnormal di dalam sistem
peredaran darah yang berasal dari komponen-komponen darah. Trombosis terjadi
karena adanya ketidak seimbangan antara faktor trombogenik dengan mekanisme
proteksi sebagai akibat dari meningkatnya stimulus trombogenik atau penurunan
mekanisme proteksi, misalnya cedera jaringan pada sepsis yang melepaskan
berbagai mediator inflamasi, sitokin dan terjadinya disfungsi endotel. Pada tahun
1845 Virchow pertama kali mengemukakan adanya 3 faktor utama yang berperan
dalam patofisiologi thrombosis (Triad of Virchow’s) yaitu kelainan endotel pembuluh darah, perubahan aliran darah yang melambat/stasis dan perubahan
daya beku darah/hiperkoagulasi.43,4
2. 4 Hubungan Kelainan Trombosis dan Sepsis
Komplikasi perdarahan yang sering terjadi pada sepsis dapat disebabkan
oleh gangguan vaskuler, koagulasi dan gangguan fibrinolitik. Trombosis
intravaskuler merupakan petanda respons inflamasi lokal untuk membatasi ruang
gerak invasi mikroorganisme. Terjadinya deposit fibrin intravaskuler, trombosis
dan koagulasi intravaskuler diseminata (KID) merupakan manifestasi respons
sistemik terhadap infeksi dan sepsis.2,3,47,48
Pada sepsis berat terjadi berbagai peristiwa seperti leukosit yang
mengalami hiperresponsif persisten, jejas endotel vaskuler yang luas, KID,
disfungsi multi organ dan trombosis yang menunjukkan prognosis yang jelek.
Pada sepsis terjadi gangguan hemostasis, gangguan keseimbangan faktor
prokoagulan dan antikoagulan dan juga terjadi peningkatan aktivitas hemostatik
yang berlebihan untuk mengatasi jejas vaskuler yang luas. Pelepasan sitokin
pro-inflamasi pada sepsis seperti TNF-α, IL-1, IL-2, IL-6 dan IL-8 akan menginduksi monosit dan sel endotel vaskuler serta mengaktivasi jalur intrinsik dan ekstrinsik,
gangguan fungsi protein-C, menghambat jalur protein-S dan menurunkan
antitrombin. Fibrinolisis dapat dihambat melalui peningkatan activator inhibitor-1
trombosis, perdarahan dan KID yang menyebabkan disfungsi multiorgan maupun
syok. Hal inilah yang apada akhirnya menimbulkan kondisi status hiperkoagulasi,
hipokoagulasi dan trombositopeni yang pada akhirnya menyebabkan KID dimana
bisa terjadi trombosis dan perdarahan. Jika proses ini terus berlanjur akan terjadi
kegagalan fungsi organ dan menyebabkan kematian.49-54
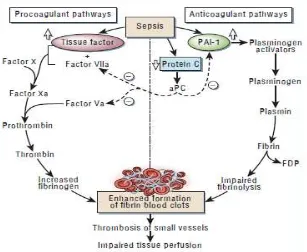
Gambar 2. 3 Patogenesis Trombosis pada Sepsis
2. 5 Mean Platelet Volume (MPV)
Mean Platelet Volume (MPV) adalah marker dari rata-rata ukuran dan volume trombosit yang beredar pada sirkulasi dan dapat digunakan untuk melihat
aktivitas dan fungsi trombosit. Nilai Normal MPV adalah 7,0-10,2 fL,
pengukuran MPV telah dilakukan sejak tahun 1970-an dan sekarang telah
menjadi pemeriksaan rutin, namun masih jarang dipelajari dalam hubungannya
dengan sepsis. Pada populasi sehat, MPV mempunyai hubungan terbalik dengan
jumlah trombosit, namun efek biologis, arti klinis dan hubungannya dengan
perubahan jumlah trombosit dengan sepsis masih belum dipahami dengan jelas.
Peningkatan MPV disertai peningkatan produksi trombosist dapat terjadi pada
immune trombositopenia, KID, myeloproliferatif disorders dan pre-eklampsia. Peningkatan MPV disertai adanya trombositopenia dapat terjadi pada sepsis,
immune trombositopenia dan kelainan herediter trombosit seperti Bernard Soulier
Syndrome. Semantara penurunan nilai MPV disertai trombositopenia
menunjukkan adanya hipersplenisme atau rendahnya produksi trombosit oleh
karena aplasia sumsum tulang, terapi dengan obat-obatan sitotoksik dan kelainan
herediter seperti Wiskott Aldrich Syndrome.7-9
Dari beberapa studi dilaporkan peningkatan MPV pada keadaan sepsis
yang mungkin terjadi sebagai kompensasi terhadap percepatan destruksi platelet
oleh karena sepsis. Becci C dkk melaporkan bahwa MPV lebih tinggi pada
kondisi sepsis berat dari pada sepsis saja. Mereka juga melaporkan bahwa nilai
MPV pada saat diagnosis sepsis >9.7 fL (nilai normal 7.0 – 8,0) berhubungan
dengan tiga kali lipat peningkatan mortalitas (OR=3,04;p<0,05).
Sampai saat ini, hanya trombositopenia saat masuk rumah sakit pada
pasien sakit kritis telah dikenali sebagai petanda prognostik buruk dan
berhubungan dengan risikorelatif mortalitas sebesar 1,66 pada pasien sepsis.9-14 Menurut Thompson, perubahan trombosit pada sepsis terjadi karena pelepasan
faktor pertumbuhan pada sumsum tulang yang memacu produksi trombosit dalam
ukuran besar sebagai mekanisme kompensasi.15 Dastugue dkk dan Van der Lelie dkk menyatakanbahwa terdapat peningkatan MPV pada pasien dengan sepsis dan
syok septik. Peningkatan MPV menunjukkan terjadinya infeksi invasif atau
infeksi yang tidak responsif dengan pemberian antibiotik, sehingga
menimbulkanmortalitas yang tinggi pada sepsis.16,17 Alshorman A dkk yang melakukan penelitian pada sepsis neonatorum melaporkan terjadinya peningkatan
MPV seiring dengan terjadinya trombositopenia terutama infeksi yang disebabkan
oleh kuman gram negatif.12 Studi-studi sebelumnya juga melaporkan hal yang sama seperti studi yang dilakukan Connor dkk menemukan bahwa MPV dapat
digunakan sebagai pemeriksaan tambahan untuk mendiagnosis sepsis neonatorum
dengan bakteri Stafilokokus koagulase negatif.18
Bessman dkk menyatakan bahwa MPV dapat digunakan sebagai prediktor
pemulihan trombositopenia yang disebabkan supresi sumsum tulang pada sepsis,
dapat mendeteksi gangguan trombosit lebih awal walaupun jumlah trombosit
Cho SY dkk (Korea, 2013) melaporkan bahwa MPV meningkat seiring
dengan peningkatan prokalsitonin >1,0 ng/mL walaupun secara statistik tidak
signifikan dan menyimpulkan bahwa peningkatan MPV menunjukkan adanya
pro-inflamasi dan kondisi trombosis yang melibatkan sejumlah mediator pro-inflamasi,
sitokin dan disfungsi endotel.20 Eberhardt A dkk melaporkan penelitian yang melibatkan 183 pasien sepsis bahwa MPV mempunyai korelasi positif yang
signifikan dengan terjadinya bakterimia dan kematian sehingga MPV dapat
digunakan sebagai biomarker untuk menilai beratnya derajat sepsis dimana
semakin tinggi nilai MPV maka prognosisnya semakin buruk (9.6 vs 9.19fL
;P=0.031).21 Kukukardali Y dkk juga menemukan korelasi positif yang signifikan antara MPV dan skor APACHE dalam menilai beratnya sepsis (r=0,34), namun
tidak didapati korelasi yang signifikan antara MPV dengan kematian pada
pasien sepsis yang dirawat di ICU.22 Sebaliknya, studi yang dilakukan Sadaka F (2014) dan Wilar R dkk tidak menemukan hubungan yang signifikan antara MPV
dengan mortalitas.23,24
Guclu E dkk melaporkan bahwa nilai MPV >8 fL (rujukan normal 7,0-8,0
fL) memiliki sensitivitas 53,47%, spesifisitas 87,41% dan positive predictive value (PPV) 81,1% dalam menegakkan diagnosa sepsis.25 Beberapa studi juga melaporkan bahwa peningkatan MPV, trombositopenia dan peningkatan PDW
(Platelet Width Distribution) dapat digunakan sebagai indikator langsung
terjadinya disfungsi organ pada sepsis.26-28 Sementara Patrick CH dkk yang
melakukan studi pada sepsis neonatorum melaporkan bahwa spesifisitas MPV
danPDW dalam mendeteksi adanya bakterimia masing-masing adalah 95% dan