INSTRUMENTASI ANALITIK
Laporan
Konduktometri
Oleh:
Eri Ismail
NIM 141411038
Kelas 1B
Kelompok 2
Dosen Pembimbing : Dra. Bevi Lidya, MS, Apt
Tanggal Praktikum : 9 April 2015
Tanggal Laporan : 9 April 2015
PROGRAM STUDI D3-TEKNIK KIMIA
JURUSAN TEKNIK KIMIA
PENDAHULUAN
Tujuan
a. Melakukan titrasi konduktometri
b. Menentukan titik ekuivalen dan menentukan konsentrasi larutan Dasar Teori
Konduktometri merupakan salah satu metoda analisa yang didasarkan pada hantaran atau daya hantar. Daya hantar ini bergantung pada jenis dan konsentrasi lain yang ada di dalam larutan.
Menurut hukum Ohm, arus (I) berbanding lurus dengan gaya listrik (E), yang digunakan tetapi berbanding terbalik dengan tahanan listrik (R).
I=E
R
G=1
R
Daya hantar (G) merupakan kebalikan dari tahanan sehingga mempunyai satuan Ohm (ohm-1) atau Siemens (S)
Bila arus listrik dialirkan ke suatu larutan melalui dua elektroda, maka daya hantar listrik berbanding lurus dengan luas bidang elektroda (A) dan berbanding terbalik dengan jarak kedua elektroda (I)
G=1
K merupakan daya hantar jenis (komduktivitas) dengan satuan ohm.cm-1
atau S.cm-1. Daya hantar suatu zat terlarut disebut daya hantar molar (λ) yang
bergantung pada konsentrasi larutan.
λ=1000.K
S . cm−1
. mol−1
¿ )
Titrasi Konduktometri
Biasanya konduktometri merupakan prosedur titrasi, sedangkan konduktometri bukanlah prosedur titrasi. Metode konduktansi dapat digunakan untuk mengikuti reaksi titrasi jika perbedaan antara konduktansi cukup besar sebelum dan sesudah penambahan reagen. Tetapan sel harus diketahui. Berarti selama pengukuran berturut-turutjarak elektroda harus tetap. Hantaran sebanding dengan konsentrasi larutan pada temperatur tetap, tetapi pengenceran akan menyebabkan hantarannya tidak berfungsi secara linear lagi dengan konsentrasi.
Pada reaksi netralisasi seperti titrasi NaOH terhadap HCl. Akan terlihat bahwa hantaran ion H+ berkurang sampai titik ekuivalen tercapai, kemudian dengan penambahan titran terlihat bahwa hantaran total sesudah titik ekuivalen akn naik kembali. Ion Cl- tidaklah memberikan sumbangan terhadap hantaran, tetapi ion H+ sendiri memberikan sumbangan 82% sedang Cl- memberikan
sumbangan 18% dari hantaran.
Titrasi konduktometri sangat berguna bila hantaran sebelum dan sesudah reaksi cukup banyak berbeda. Metode ini kurang bermanfaat untuk larutan dengna konsentrasi ionic terlalu tinggi, misalkan titrasi Fe3+ dengan KMnO
4
METODE PENELITIAN
Tabel 1. Alat dan Bahan
ALAT BAHAN
1. Botol semprot 2. Dosimal 665
3. Elektroda Immersion Cell 4. Gelas kimia 100 ml 5. Konduktometer 660
6.
Pengaduk magnet1. Larutan KCl 0,1 M 2. Larutan NaOH 0,1 N 3. Larutan HCl 0,1 N 4. Larutan CH3COOH 0,1
5. Larutan H2C2O4
Diagram Alir Kerja
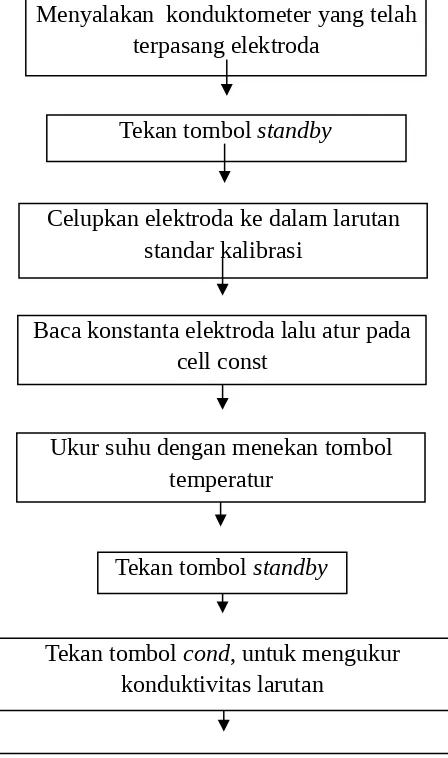
Kalibrasi elektroda dan konduktometer
Menyalakan konduktometer yang telah terpasang elektroda
Tekan tombol standby
Celupkan elektroda ke dalam larutan standar kalibrasi
Baca konstanta elektroda lalu atur pada cell const
Ukur suhu dengan menekan tombol temperatur
Tekan tombol standby
Tekan tombol cond, untuk mengukur konduktivitas larutan
Titrasi Konduktometer
Atur angka pada cell const hingga diperoleh angka konduktivitas sesuai dengan perhitungan
Angka yang tertera pada cell const di kalikan dengan skala pengukuran
Siapkan buret dan konduktometer
Isi buret dengan larutan NaOH
Ulangi pekerjaan seperti di atas untuk larutan CH3COOH dan HCl
Lakukan sampai volume 10 ml Catat daya hantar setiap penambahan NaOH
0,5 ml
Lakukan titrasi antara H2C2O4 dan NaOH
Catat daya hantar & suhu awal dari larutan H2C2O4
Aduk larutan dengan batang pengaduk pada kecepatan sedang
Masukkan 5 ml larutan H2C2O4 ± 0,1 N ke
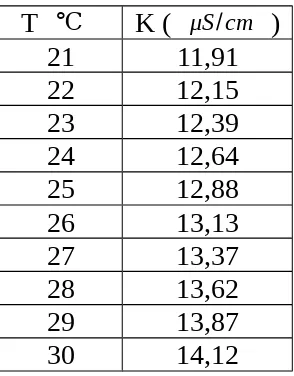
Tabel 3. Hubungan Temperatur dengan Daya Hantar Jenis
T
℃K (
μS/cm)
21
11,91
22
12,15
23
12,39
24
12,64
25
12,88
26
13,13
27
13,37
28
13,62
29
13,87
DATA PENGAMATAN DAN PERHITUNGAN
a. Kalibrasi elektrodadan perhitungan tetapan sel
Suhu = 27 ℃
Konstanta Sel (K) = 0,79 cm-1
Konduktivitas pada 27 ℃ = 13,37 mS/cm Tetapan Sel (K) pada suhu 27 ℃ = 1,14 cm-1
Konduktansi (G) = Konduktivitas(k)
Konstanta sel(K)
= 13,37mS/cm 1,14cm−1
= 11,73 mS
b. Data pengamatan
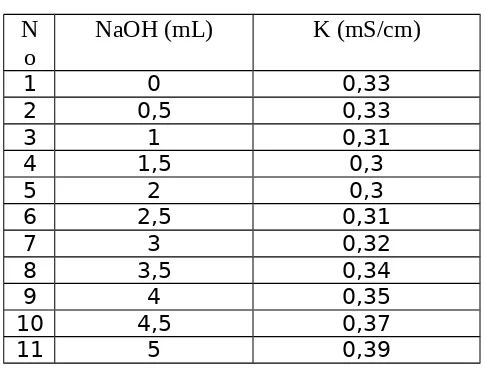
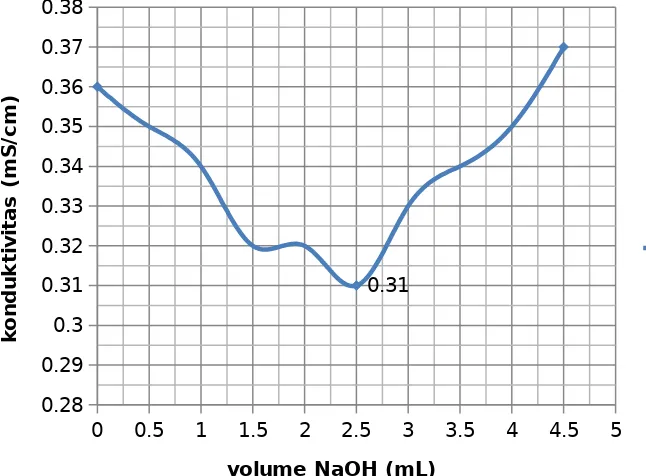
1. Penentuan konsentrasi NaOH Volume Asam Oksalat 0,1 N = 5 mL
0 1 2 3 4 5 6 7 8
volume NaOH (mL)
k
Menentukan konsentrasi NaOH
V NaOH × N NaOH=V AsamOksalat × N Asam Oksala t
N NaOH=V AsamOksalat × N AsamOksalat
V NaOH
N NaOH=5mL×0,1N
3mL
¿0,167N
Menentukan daya hantar NaOHλ=1000 k
N o
1 0 1,86
0 2 4 6 8 10 12 14 16
volume NaOH (mL)
k
Perhitungan :
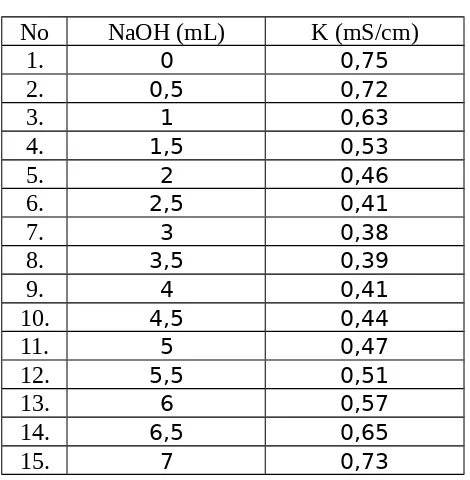
Menentukan konsentrasi HCl
V NaOH × N NaOH=V HCl × N HCl
Menentukan daya hantar HCl
λ=1000 k
Volume CH3COOH = 5 mL
Grafik titrasi CH3COOH 0,1 N VS NaOH
0 1 2 3 4 5 6
volume NaOH (mL)
Perhitungan :
Menentukan konsentrasi CH3COOH 0,1 N
V NaOH × N NaOH=V CH3COOH × N CH3COOH
Menentukan daya hantar CH3COOH λ=1000 k
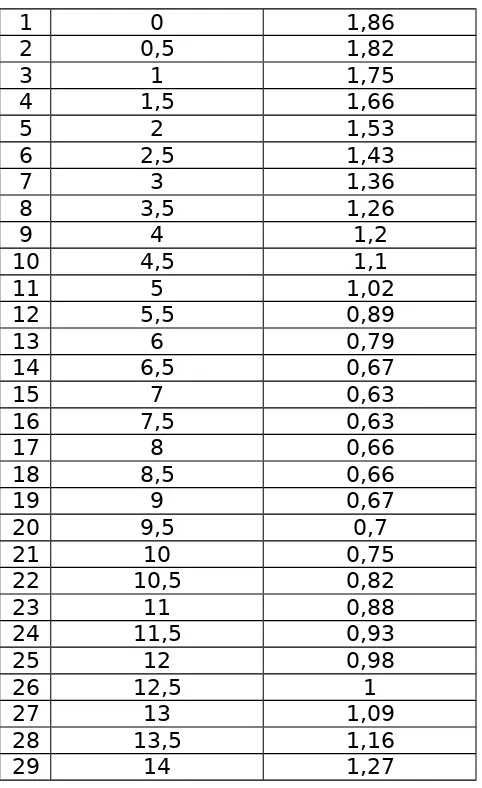
4. Penentuan konsentrasi CH3COOH 1 N
Grafik titrasi CH3COOH 1 N VS NaOH
volume NaOH (mL)
k
Menentukan konsentrasi CH3COOH 1 N
V NaOH × N NaOH=V CH3COOH × N CH3COOH
Menentukan daya hantar CH3COOH 1 N λ=1000 k
C
λ=10000,3 1×10
−3 S/cm
0,0 835N =3,713S/cmN
Pembahasan
Pada praktikum ini dilakukan analisis konduktometri. Praktikum ini bertujuan untuk menentukan titik ekuivalen, konsentrasi larutan dan daya hantar listrik. Larutan yang digunakan adalah larutan elektrolit yang terdiri dari larutan asam dan larutan basa.
Konduktivitas suatu larutan elektrolit bergantung pada ion-ion yang ada dalam konsentrasinya. Larutan elektrolit yang digunakan adalah HCl 0,1 N, CH3COOH 0,1
N, NaOH 0,1 N dan CH3COOH 1 N.
Dalam praktikum ini, dilakukan kalibrasi sel konduktansi dengan larutan KCl, kemudian sel konduktansi dibilas dengan aquades agar alat yang digunakan bebas dari ion-ion yang mengganggu serta untuk menetralkan alat sehingga tidak dipengaruhi oleh pengukuran sebelumnya.
Dilakukan penentuan titik ekuivalen antara larutan HCl dan larutan NaOH dimana kedua larutan ini, merupakan penghantar listrik yang baik.
Setiap proses titrasi, (penambahan NaOH 0,5 mL) dilakukan proses pengadukan dengan magnetik stirer. Hal ini dilakukan agar dapat mengoptimalkan kemampuan daya hantar listrik sehingga ionnya dapat menyebar merata.
Pada proses titrasi HCl 5 ml di lakukan penambahan larutan NaOH, setiap penambahan 0,5 ml di catat konduktivitas larutan dalam keadaan elektroda tercelup. Hal ini dimaksud untuk menentukan konsentrasi HCl dan membuatan grafik titrasi. Setelah elektroda selesai di gunakan, bersihkan elektroda tersebut dengan aquades dan keringkan. Dari grafik yang didapat, bisa di lihat bahwa nilai konduktivitas larutan awalnya turun kemudian naik, hal tersebut di karenakan pada volume tersebut terjadi reaksi antara H+ dengan OH- membentuk H
2O, sehingga jumlah H+ didalam
larutan berkurang sedangkan jumlah NaOH bertambah. Pada titik akhir titrasi H+
dalam larutan telah bereaksi seluruhnya dengan OH-. Untuk penentuan nilai ekuivalen
Pada penentuan konsentrasi CH3COOH pun, prinsip nya sama dengan penentuan konsentrasi HCl, dilakukan titrasi dengan NaOH setiap penambahan 0,5 ml di catat nilai konduktivitas larutan, dari data yang didapat di buat kan grafik dan di tentukan nilai ekuivalen nya dengan membuat dua garis yang saling berpotongan. Setelah itu di lakukan perhitungan dan didapatkan nilai konsentrsai CH3COOH 0,1 N sebesar 0,068 N dan pada konsentrasi CH3COOH 1 N sebesar 0,085 N. Hal ini di sebabkan oleh beberapa faktor diantaranya kemungkinan ada zat lain yang terlarut dalam larutan tersebut, kesalahan dalam pembacaan data dan kemungkinan NaOH berlebih pada saat titrasi.
Simpulan
Konstanta Sel (K) = 1,07 cm-1
Konduktivitas pada suhu 27 ℃ = 13,37 mS/cm
Konduktansi (G) = 11,73 mS
Tetapan Sel = 1,14 cm-1
[NaOH] = 0,167 N [HCl] = 0,225 N [CH3COOH] 0,1 N = 0,068 N
[CH3COOH] 1 N = 0,085 N