GENOTIPING GEN ACACA DAN HUBUNGANNYA DENGAN ASAM
LEMAK SUSU SAPI FRIESIAN HOLSTEIN MENGGUNAKAN
TEKNOLOGI
TAQMAN REAL-TIME
PCR
ROSIDI AZIS
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Genotiping Gen ACACA dan Hubungannya dengan Asam Lemak Susu Sapi FH Menggunakan TaqMan real-time PCR adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2015
Rosidi Azis
RINGKASAN
ROSIDI AZIS. Genotiping gen ACACA dan Hubungannya dengan Asam Lemak Susu Sapi Perah Friesian Holstein Menggunakan TaqMan Real-time PCR. Dibimbing oleh JAKARIA, ASEP GUNAWAN dan ANNEKE ANGGRAENI.
Kandungan asam lemak susu sangat besar dipengaruhi oleh faktor genetik. Gen ACACA merupakan gen penting dalam regulasi dan metabolisme asam lemak susu pada sapi Friesian Holstein (FH). Pengaruh keragaman gen ACACA terhadap asam lemak susu pada sapi FH dalam negeri belum banyak dilakukan. Penelitian bertujuan untuk mengidentifikasi keragaman gen ACACA pada sapi FH dan analisis hubungan kergaman gen ACACA terhadap kandungan asam lemak susu.
Sampel DNA sapi FH yang digunakan berasal dari lima lokasi sebanyak 277 sampel yang terdiri atas sapi betina laktasi sebanyak 113 ekor dari Balai Penelitian Ternak (Balitnak) Ciawi, 42 ekor berasal dari BPPT-SP Cikole, 76 ekor berasal dari BBPTU Baturraden, serta sapi pejantan sebanyak 17 ekor dari BIB Lembang dan 29 ekor dari BBIB Singosari. Sampel susu sebanyak 42 dikoleksi dari BPTU Baturaden berdasarkan uji satu hari dengan menjumlahkan produksi pagi dan sore dari bulan laktasi 1-4. Sampel susu dianalisis menggunakan Gas Chromatography Mass Spectromtery (GCMS).
Ampilfikasi gen ACACA menggunakan TaqMan real-time PCR (polymerase chain reaction) dengan kondisi suhu thermal cycler yaitu suhu denaturasi, annealing dan ekstensi masing-masing 95 oC selama 20 detik, 60 oC selama 1 menit dan 95 oC selama 3 detik yang diulang sebanyak 40 siklus. Penentuan genotipe gen ACACA pada setap individu dan kelompok sampel ditunjukkan dalam bentuk kurva dan klaster fluoresensi genotipe. Genotipe GG ditunjukkan dengan kurva fluoresensi FAM berwarna biru, genotipe GT ditunjukkan oleh kurva fluoresensi berwarna FAM-VIC kombinasi warna biru dan merah jambu (pink) atau hijau, sedangkan genotipe TT ditunjukkan oleh kurva fluoresensi VIC.
Data genotipe dianalisis menggunakan frekuensi genotipe, frekuensi alel, derajat heterozigositas, indeks deferensiasi genetik (FST) dan tingkat keragaman alel dihitung menggunakan nilai PIC (polymorphic informative content). Analisis hubungan keragaman genotipe ACACA dengan kandungan asam lemak susu menggunakan GLM (general linier model) SAS versi 9.2.
genotipe GT memiliki kandungan asam lemak dodecanoat lebih tinggi (0.29±0.06) dibanding genotipe GG (0.14±0.06).
Disimpulkan bahwa gen ACACA pada sapi FH yang diamati bersifat polimorfik. Keragaman gen ACACA berpengaruh nyata terhadap asam lemak laurat (C12:0) dan dodecanoat (C12:1). Keragaman gen ACACA berpotensi menjadi marka genetik yaitu genotipe GG untuk meningkatkan asam lemak laurat dan genotipe GT untuk meningkatkan asam lemak dodecanoat.
SUMMARY
ROSIDI AZIS. Genotyping ACACA Gene and its Assosiasion with Milk Fatty Acid in Holstein Friesian using TaqMan Real-time PCR. Supervised by JAKARIA, ASEP GUNAWAN and ANNEKE ANGGRAENI.
Milk fatty acids are largely effected by genetic factor. ACACA gene is one of importen genes in regulation and metabolism function on milk fatty acids in dairy cattle. Study on effect of the ACACA gene on milk fatty acid components in domestic Holstein Friesian (HF) cows should be done. The aims of the research were to identify the ACACA gene polymorphism and to associate varian genotypes of this gene with each milk fatty acid components in daity cattle.
DNA samples of dairy cattle were extracted from five locations consisting of HF lactating cows from Balitnak (113 hds.), BBPTU Baturraden (76 hds.), BPPT-SP Cikole (42 hds.); as well as HF bulls from BIB Lembang (17 hds.) and BBIB Singosari (29 hds.). A number of 42 milk samples were collected from BBPTU Baturraden based on a single test day as the summation of morning and noon milk yields of cows for lactation periods among 1-4 and lactation months among 1-4. Milk samples were analyzed by Gas Chromatography Mass Spectromtery(GCMS).
Amplification of ACACA gene used TaqMan real-time PCR (polymerase chain reaction) with thermo cycler condition of denaturation, annealing and extention for 95 oC for 20s, 60 oC for 1 min and 95 oC for 3s, respectively in 40 cycles. To determine genotype variant of the ACACA gene of individual animal was done through fluorescence curve and cluster genotype. GG genotype was shown by FAM fluoresence with blue dye, GT genotype was shown by FAM and VIC fluorescence with combination of blue and pink (green) dye, while TT genotype was shown by VIC fluorescence with pink dye.
Data of genotyping were analyzed for genotype frequency, allele frequency, heterozigosity and level of polymorphic allele using PIC (polymorphic informative content) value. Association of genotype variants of the ACACA gene with each of milk fatty acids was analyzed by GLM (general linier model) procedure by SAS ver. 9.2.
Genotyping the ACACA gene resulted two genoypes, namely GG and GT.The GG genotype was shown by FAM fluorescence with blue dye, while the GT genotype was shown by FAM dan VIC fluorescences with blue and pink (green) dye. Frequency of the GG genotype totally were higher (0.885) than the GT genotype (0.115). Thus frequency of G allele totally was higher than that of T allele, namely 0.942 and 0.058. The values of heterozigosity observation was lower than the expectation one (Ho=0.027-0.176 and He=0.026-0.161). The average of FSTwas 0.100 and PIC value was at a low category (<0.25). Associations of genotype polymorphism of the ACACA gene with individual milk fatty acids were generally not significant instead of laurat (C12:0) and dodecanoat (C12:1) fatty acids. The GG cows produced higher laurat than the GT ones, namely 5.99±0.09 % vs. 5.55±0.18 %, whilst the GT cows produced higher dodecanoat than the GG ones, namely 0.29±0.06 % vs. 0.14±0.06 %.
dodecenoat (C12:1). Those the ACACA gene may be possible to be used as gene assisted selection to increase laurat and dodecanoat fatty acids in domestic HF cows.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Produksi dan Teknologi Peternakan
GENOTIPING GEN ACACA DAN HUBUNGANNYA DENGAN ASAM
LEMAK SUSU SAPI FRIESIAN HOLSTEIN MENGGUNAKAN
TEKNOLOGI
TAQMAN REAL-TIME
PCR
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Genotiping Gen ACACA dan Hubungannya dengan Asam Lemak Susu Sapi Friesian Holstein Menggunakan Teknologi
TaqMan Real-time PCR Nama : Rosidi Azis
NIM : D15130251
Disetujui oleh Komisi Pembimbing
Dr Jakaria, SPt MSi Ketua
Dr agr Asep Gunawan, SPt MSc Anggota
Ir Anneke Anggraeni, MSi PhD Anggota
Diketahui oleh
Ketua Program Studi Ilmu Produksi dan Teknologi Peternakan
Dr Ir Salundik, MSi
Dekan Sekolah Pascasarjana IPB
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian ini yaitu genotiping gen ACACA dan hubungannya dengan asam lemak susu sapi Friesian Holstein Menggunakan TaqMan real-time
PCR.
Terima kasih penulis ucapkan kepada Dr Jakaria SPt MSi, Dr agr Asep Gunawan, SPt MSc dan Ir Anneke Anggraeni, MSi PhD selaku pembimbing yang telah banyak memberi saran masukan dan motivasi mulai dari awal hingga akhir penulisan tesis ini. Terima kasih penulis ucapkan kepada Dr Ir Dedy Duryadi Solihin, DEA selaku penguji luar komisi pada ujian tesis yang telah memberikan masukan yang konstruktif untuk kesempurnaan tesis ini. Penghargaan penulis sampaikan kepada Prof Cece Sumantri, MAgrSc, Eryk Andreas, SPt MSi serta Selvy SSi dan teman-teman di Laboratorium Genetika Molekuler Ternak (LGMT) yang telah memberikan masukan yang sangat berharga untuk kesempurnaan penelitian ini.
Penulis mengucapkan terimakasih kepada Dr Ir Salundik, MSi selaku Ketua Program Studi Ilmu Produksi dan Teknologi Peternakan (IPTP) serta jajarannya (ibu Ade dan ibu Okta) di sekretariat Pasca IPTP. Teman-teman seperjuangan di Pascasarjana IPTP 2013 terima kasih atas canda dan tawa serta mohon maaf bila ada hal yang kurang berkenan.
Terima kasih kepada Direktorat Jenderal Pendidikan Tinggi atas Beasiswa Unggulan Dalam Negeri (BU-DN) yang diberikan kepada Penulis selama menempuh pendidikan Pascasarjana IPB dan kepada program Hibah KKP3N yang telah membiayai penelitian ini. Penulis sampaikan terima kasih kepada Kepala dan Staf Balai Penelitian Ternak (Balitnak), BBPTU Baturraden, BPTP SP Cikole, BBIB Singosari dan BIB Lembang atas materi penelitian yang diberikan.
Ungkapan terima kasih penulis sampaikan kepada ayahanda, ibunda, keluarga di Madura dan di Kudus tanpa menyebutkan satu persatu dan istri tercinta serta anak saya yang sholeh atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
2 TINJAUAN PUSTAKA 3
Susu dan asam lemak 3
Keragaman gen ACACA 5
Real-time PCR 6
3 MATERI DAN METODE 8
Lokasi Penelitian 8
Materi Penelitian 8
Metode Penelitian 8
Analisis Data 10
4 HASIL DAN PEMBAHASAN 11
Amplifikasi Gen ACACA 11
Frekuensi Gen ACACA 13
Heterozigositas, FST dan PIC 14
Asosiasi Gen ACACA dengan Asam Lemak Susu 15
5 SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
DAFTAR PUSTAKA 18
LAMPIRAN 22
DAFTAR TABEL
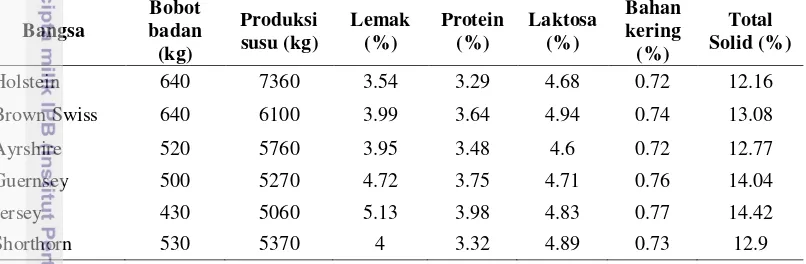
1 Kandungan komponen susu pada beberapa bangsa sapi perah perah 4
2 Karakteristik sampel penelitian sapi FH 8
3 Hasil desain primer dan probe gen ACACA 9
4 Frekuensi genotipe dan alel gen ACACA pada sapi FH 14 5 Analisis derajar heterozigositas, FST dan PIC 15 6 Pengaruh keragaman gen ACACA terhadap asam lemak susu sapi FH 16
DAFTAR GAMBAR
1 Ruang lingkup penelitian gen ACACA dan analisis asam lemak susu 3 2 Struktur Gen ACACA pada sapi rumpun Bos taurus 5 3 Sintesis asam lemak dalam sistem seluler
4 Amplifikasi dan genotiping dalam real-time PCR 7 5 Primer dan probe (forward-reverse) gen ACACA 9
6 Kurva amplifikasi dan genotiping gen ACACA 12
7 Kelompok genotipe gen ACACA 13
DAFTAR LAMPIRAN
1
PENDAHULUAN
Latar Belakang
Susu merupakan salah satu sumber gizi hewani yang bermanfaat bagi manusia. Air susu menyediakan komponen penting berupa protein, lemak, laktosa, kalsium dan komponen lainnya yang bermanfaat bagi kesehatan, pertumbuhan, kecerdasan dan sistem kekebalan tubuh (Feskanich et al. 1997). Lemak susu merupakan salah satu komponen yang memiliki nilai ekonomis tinggi yang dibutuhkan untuk produk keju dan produk pangan fungsional lainnya. Kandungan asam lemak jenuh (saturated fatty acid/SFA) dalam susu termasuk tinggi yaitu sekitar 67.25 %, sedangkan kandungan asam lemak tak jenuh baik tunggal (monounsaturated fatty acid/MUFA) ataupun asam lemak tak jenuh ganda (polyunsaturated fatty acid/PUFA) rendah yaitu masing-masing sekitar 27.63 % dan 3.33 % (Ellis et al. 2006). Penelitian sebelumnya telah melaporkan bahwa mengkonsumsi makanan yang mengandung berlebihan SFA dan lemak trans
dapat menyebabkan penyakit kardiovaskular, jantung koroner dan stroke (Ulbricht and Southgate 1991; Kelly et al. 1998). Sebaliknya, mengkonsumsi asam lemak tak jenuh (omega-3, omega-6 dan omega-9) berkorelasi positif terhadap kesehatan tubuh manusia, salah satunya yaitu mengurangi dan mencegah terjadinya penyakit kanker dan tumor (Kennelly 1996; Connor 2000; Huth dan Park 2012).
Asam lemak susu merupakan sifat kuantitatif yang dikodekan oleh banyak gen dalam sejumlah alur biologis yang membawa sintesis asam lemak (Mao et al.
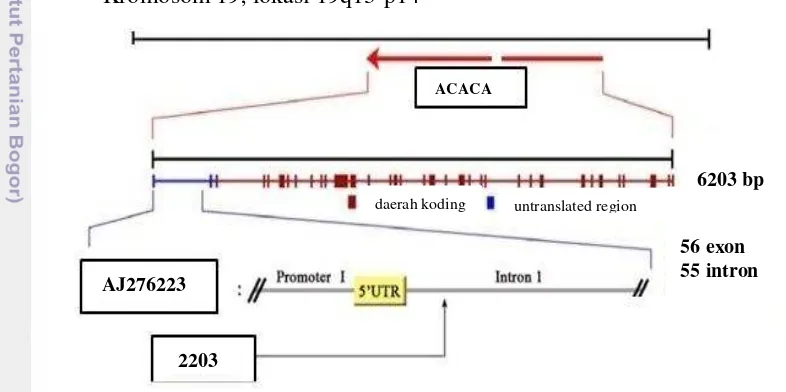
2001; Bionaz dan Loor 2008; Marchitelli et al. 2013). Salah satu gen yang berpengaruh untuk hal tersebut adalah gen acetyl-CoA carboxylase α (ACACA). Gen ACACA terletak pada kromosom 19q13-p14 yang memiliki panjang 6203 pb (panjang basa) yang terdiri dari 56 exon dan 55 intron (Shin et al. 2011). Gen tersebut memiliki peranan kunci di dalam alur metabolisme lemak susu yang mengontrol enzim acetyl-CoA carboxylase dalam regulasi sintesis asam lemak (Abu-Elheiga et al. 1995; Barber et al. 2003). Aktivitas Acetyl-CoA carboxylase
di dalam sistem seluler meningkat, sehingga mengakibatkan peningkatan produksi
malonyl-CoA yang digunakan sebagai substrat untuk sintesis asam palmitat dan asam lemak rantai panjang (asil-CoA>C22: 0). Malonil-CoA berfungsi sebagai inhibitor penting dalam sintesis asam lemak di dalam mitokondria untuk β -oksidasi (Awan dan Saggerson 1993; Barber et al. 2003). ACACA diekspresikan dalam metabolisme asam lemak di seluruh jaringan lipogenik ternak seperti jaringan adipose, liver dan kelenjar susu selama laktasi (Barber et al. 2003; Thering et al. 2009). Penelitian sebelumnya melaporkan bahwa sebanyak delapan SNP (g.2064T>A, g.2155C>T, g.2203G>T, g.2268T>C, g.2274G>A, g.2340A>G, g.2350T>C dan g.2370A>G) di daerah promotor I 5’UTR (untranlated region) berpengaruh signifikan (P<0.05) terhadap komposisi asam lemak pada daging sapi (Zhang et al. 2009). Berdasarkan informasi tersebut bahwa SNP (single nucleotide polymorphism) gen ACACA perlu diverikasi pengaruhnya terhadap komponen asam lemak sebagai salah satu upaya untuk meningkatkan kualitas asam lemak susu pada sapi FH.
2
seleksi di masa yang akan datang dapat diarahkan untuk mendorong produksi bibit sapi FH berkualitas yaitu sebagai penghasil susu dengan kandungan asam lemak yang baik. Pemanfaatan teknologi dalam bidang molekuler saat ini sudah berkembang dengan menggunakan PCR (Polymerase Chain Reaction).
Real-time PCR merupakan salah satu teknologi baru dalam bidang molekuler untuk identifikasi SNP dengan cepat dalam menghasilkan data genotipe (Ranade et al. 2001). Real-time PCR menggunakan TaqMan MGB probe atau dikenal dengan nama lain yaitu TaqMan SNP genotyping assay atau 5’nuclease allelic discrimination assay yang dapat memancarkan fluoresensi spesifik pada situs target. TaqMan real-time PCR telah digunakan secara luas dalam bidang biologi molekuler termasuk pada hewan ternak (Poon et al. 2009; Navarro et al.
2015). Keunggulan real-time PCR dalam genotiping gen hanya membutuhkan sampel sedikit, melihat produk PCR secara real-time tanpa membutuhkan elektroforesis, memiliki sensitifitas yang tinggi dan hasilnya sangat akurat (Ranade et al. 2001; Mackay et al. 2002; Shen et al. 2009). Dengan demikian, seleksi melalui penerapan teknologi TaqMan real-time PCR dalam bidang molekuler dapat dimanfaatkan untuk identifikasi SNP gen ACACA dalam upaya meningkatkan kualitas asam lemak susu pada sapi FH di dalam negeri.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk melakukan:
1. Analisis keragaman gen ACACA menggunakan teknologi TaqMan real-time
PCR.
2. Analisis hubungan keragaman genotipe gen ACACA terhadap komponen asam lemak susu pada sapi FH domestik.
Manfaat Penelitian
Informasi yang diperoleh dari penelitian ini diharapkan dapat diaplikasikan sebagai dasar seleksi berbasis SNP untuk mendapatkan sapi-sapi FH yang memiliki kandungan asam lemak susu yang baik.
Ruang Lingkup Penelitian
3
Gambar 1 Ruang lingkup penelitian gen ACACA dan analisis asam lemak susu
2
TINJAUAN PUSTAKA
Susu dan Asam Lemak Susu
Susu merupakan sumber gizi hewani yang bermanfaat bagi manusia. Susu dihasilkan oleh kelenjar mamae sapi perah selama laktasi. Susu mengandung protein, lemak, laktosa, kalsium dan komponen lainnya yang sangat besar manfaatnya bai kesehatan, kecerdasan dan sistem imun (Feskanich et al. 1997).
Kandungan komponen susu pada beberapa rumpun sapi perah Bos taurus
4
Lemak susu dibutuhkan oleh masyarakat terutama untuk pembuatan keju dan produk olahan pangan (Henning et al. 2006). Lemak susu merupakan salah satu komponen terbesar ke-empat setelah air, protein dan laktosa yang terdapat dalam susu. Lemak susu berbentuk bola-bola kecil yang jumlahnya sangat banyak berukuran antara 1-20 mikron dengan garis tengah 3 mikron (Bukcle et al. 2009). Kandungan lemak susu ditentukan oleh komponen asam lemak. Sebagian besar (98%) asam lemak susu tersebut berupa trigliserida yang berasal dari aktivitas mikrobiologi dalam rumen (Jensen et al. 1991). Secara umum, trigliserida disusun oleh asam lemak rantai pendek, rantai panjang dan rantai sangat panjang yang disintesis oleh kelenjar susu (Gresti et al. 1993).
Pengelompokan berdasarkan isomer geometrinya bahwa asam lemak menjadi asam lemak tak jenuh "cis" dan asam lemak jenuh "trans". Berdasarkan panjang rantai karbonnya asam lemak digolongkan menjadi rantai pendek (C2-C6), rantai sedang (C8-C12) dan rantai panjang (C14-C24) (Jensen et al. 1991). Asam lemak jenuh (Saturated Fatty Acid/SFA) yang paling dominan dalam susu adalah miristat (C14), Palmitat (C16) dan stearat (C18). Asam lemak tak jenuh baik
Monounsaturated Fatty Acid (MUFA) dan polyunsaturated Fatty Acid (PUFA) yang utama meliputi oleat (C18:1) linoleat (C18:2) dan linolenat (C18:3). Asam butirat (C4) dan kaproat (C6) berada dalam jumlah kecil sebagai trigliserida (Bukcle at al. 2009). Trigliserida disusun oleh komponen asam lemak lebih dari 400-500 jenis asam lemak yang berbeda. Trigliserida utama berupa butyroyl-palmitoylacy-lglycerols dimana proporsinya butyroy-lpalmitoy-loleoyl-glycerol, butyroyl-dipalmitoyl-glycerol, butyroyl-myristoyl-palmitoylglycerol dengan keadaan masing-masing sekitar 4.2%, 3.2% dan 3.1%. Asam lemak susu lebih komplek jika dibanding asam lemak alami lainnya, disebabkan setidaknya lebih dari 1% terdapat dua dari empat asam lemak rantai panjang utama (C14:0, C16:0, C18:0 dan C18:1) di dalam dua puluh dua trigliserida (Gresti et al. 1993). SFA adalah asam lemak yang tidak memiliki ikatan rangkap pada atom karbonnya. Dengan demikian, asam lemak tersebut tidak peka terhadap oksidasi dan pembentukan radikal bebas yang memiliki dampak terhadap peningkatan kadar kolestrol darah. Sebaliknya, MUFA dan PUFA merupakan jenis asam lemak yang mempunyai satu atau lebih ikatan rangkap pada rantai atom karbon. Oleh karena itu, asam lemak tak jenuh baik MUFA dan PUFA memiliki pengaruh positif dalam menurunkan kadar kolesterol darah (Sartika 2008).
Tabel 1 Kandungan komponen susu pada beberapa rumpun sapi perah Bos taurus
5 Keragaman Gen ACACA
Enzim Acetyl-CoA Carboxylase Alpha (ACACA) yang dikode oleh gen ACACA mengkatalisis pembentukan malonyl-Coa dari acetyl-Coa di dalam sitoplasma (Badaoui et al. 2007; Bionaz dan Loor, 2008). Struktur gen ACACA terletak pada kromosom 19 terdiri atas 56 exon dan 55 intron. Total pasang basa (pb) pada gen ACACA pada rumpun Bos taurus adalah 6203 pb (Gambar 2 dan Lampiran 1). Gen ACACA dapat dijadikan marka SNP untuk komposisi asam lemak daging pada sapi, babi dan susu kambing (Gallardo et al. 2009; Zhang et al.
2010). Hasil studi intensif oleh Bouwman et al. (2011) terhadap runutan nukleotida dari gen-gen major pengatur alur biosintesis lemak susu selama masa laktasi, diketahui total varian genotipe aditif sifat kadar dan komposisi asam lemak susu bernilai sedang sampai tinggi (h2 = 0,25-0,45). Asam lemak rantai pendek sampai sedang (C4:0 - C16:0), dan asam lemak rantai panjang (≥ C16:0), disintesis secara de novo dalam kelenjar ambing. Enzim ACACA ditemukan secara merata dalam banyak jaringan, tetapi tingkat yang paling tinggi ditemukan dalam jaringan lipogenik kelenjar susu selama laktasi (Mao et al. 2001).
Gambar 2 Struktur gen ACACA pada rumpun sapi Bos taurus (Shin et al. 2011) Sintesis asam lemak dalam sistem seluler disajikan pada gambar 3. Sintesis asam lemak susu dikendalikan oleh multi enzim, dimana aktivasi enzim tersebut berawal dari Acetyl-CoA (Park et al. 2002). Enzim acetyl-CoA merupakan enzim penentu kecepatan sintesis asam lemak. Karboksilasi acetyl-CoA menjadi
6
dengan mengeluarkan H2O. Enzim yang bekerja pada reaksi ini yaitu 3-hidroksi asil ACP dehidratase. Reaksi terakhir dari putaran pertama sintesis asam lemak yaitu pembentukan butiril ACP dari krotonil ACP dengan katalis enoil ACP reduktase. Jadi putaran pertama elongasi atau perpanjangan atom C ini telah mengubah acetyl-CoA menjadi butiril ACP. Urutan reaksi ini berulang-ulang sampai panjang atom C mencapai 16 atom C. Pada tahap ini terjadi hidrolisis dan palmitat dibebaskan. Pemanjangan asam lemak palmitat dan mengalami desaturasi untuk menghasilkan bermacam-macam asam lemak (Kim 1997; Sul et al. 2000).
Real-time PCR
Polymerase chain reaction (PCR) merupakan suatu teknik untuk menggandakan jumlah molekul DNA dan monomer-monomer nukleotida pada ruas-ruas tertentu yang dilakukan secara in vitro dengan bantuan primer dan enzim polymerase (Arya et al. 2005). Primer merupakan oligonukleotida spesifik pada DNA template. Hasil dari proses PCR dapat divisualisasikan dengan elektroforesis dalam PCR komvensional. Secara umum, reaksi yang terjadi dalam mesin PCR dapat dibagi menjadi tiga tahap, yaitu tahap denaturasi (pemisahan untai ganda DNA), tahap annealing (penempelan primer), dan tahap pemanjangan primer atau dikenal fase ekstensi (Muladno 2002).
Real-time PCR pada prinsipnya sama dengan prinsip PCR konvensional hanya saja real-time PCR dapat mendeteksi produk amplifikasi pada tiap siklus selama proses PCR (Bustin 2004). Aplikasi real-time PCR memanfaatkan TaqMan probe berfluoresensi, dimana TaqMan Probe didesain untuk menempel pada akumulasi produk yang mengikat sekuen target (Arya et al. 2005). Pemanfaatan TaqMan probe dalam real-time PCR sebagai sistem deteksi telah luas digunakan dalam genotiping dan kuantifikasi gen (Morita et al. 2007).
7 Molekul probe memiliki dua bagian dalam mendeteksi gen yaitu reporter dye pada ujung 5’ dan quencher pada ujung 3’ (Arya et al. 2005). Reporter dye probe berfungsi sebagai pendonor fluoropohor pada ujung 5’, sedangkan quencher dye probe berfungsi sebagai penerima fluorophorpada ujung 3’. Setelah
terjadinya proses denaturasi, probe menempel (annealing) pada sekuen target yang mengakibatkan terjadinya hibridisasi. Arya et al. (2005) menyatakan bahwa ke-dua probe berhibridisasi hanya dengan sekuen target selama tahapan atau fase
annealing. Hibridisasi probe wild-type hanya berhibridisasi dengan target wild-type bukan dengan mutan, sehingga dapat menghasilkan sinyal fluoresensi. Bila
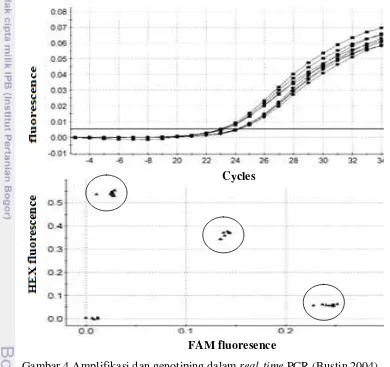
molekul probe tidak berhibridisasi dengan sekuen target, maka tidak akan menghasilkan sinyal fluoresensi. Cheng et al. (2004) menyatakan bahwa hibridisasi probe sesuai dengan situs mutasi yang menjadi target dan akan menghasilkan sinyal fluoresen. Oleh karena itu, sinyal fluoresen dihasilkan akibat donor molekul fluoresen padam dan molekul akseptor berpendar (Didenko 2001). Kurva fluoresensi hasil hibridisasi probe dapat dimonitor secara real-time dan data genotipe terbaca setelah proses PCR selesai. Data genotipe gen ACACA berbentuk kuva dan berbentuk cluster genotipe berdasarkan fluoresensinya, sebagaimana yang ditunjukkan pada Gambar 4 (Bustin 2004).
Gambar 4 Amplifikasi dan genotiping dalam real-time PCR (Bustin 2004) FAM fluoresence
8
3
MATERI DAN METODE
Lokasi dan Waktu
Penelitian ini dilaksanakan di Laboratorium Genetika Molekuler Ternak, divisi Pemuliaan dan Genetika, Fakultas Peternakan, Institut Pertanian Bogor dan Balai Penelitian Ternak (Balitnak) Ciawi Bogor dari bulan April 2014 sampai Januari 2015.
Materi Penelitian
Sampel Penelitian
Sampel penelitian berupa darah dan susu sapi FH. Sampel darah yang digunakan adalah 277 ekor yang berasal dari lima lokasi yang terdiri atas 113 ekor dari Balai Penelitian Ternak (Balitnak), BPPT-SP Cikole 42 ekor, BBPTU Baturraden 76 ekor dan 29 ekor, serta untuk pejantan aktif Inseminasi Buatan (IB) dari Balai Inseminasi Nasional yaitu BBIB Singosari 29 ekor dan BIB Lembang 17 ekor (Tabel 2). Sampel susu sapi perah yang digunakan berasal dari BBPTU Baturraden (42 sampel) untuk mengetahui profil asam lemak susu sapi FH. Sampel susu yang dikoleksi berdasarkan uji satu hari dengan menjumlahkan produksi pagi dan sore dari sapi laktasi 1-4 dan periode 1-4. Sampel susu menggunakan jasa analisis asam lemak di Laboratorium Terpadu di Universitas Diponegoro Semarang Jawa Tengah.
Metode Penelitian
Prosedur Ekstraksi DNA
Ekstraksi DNA menggunakan GeneJET Whole Blood Genomic DNA
Purification Mini Kit (Thermo Scientific) dengan prosedur ekstraksi sebagai berikut:
Presipitasi sampel. Sampel darah yang disimpan dalam tabung vaccutaier
diambil sebanyak 200 µ l dan dimasukkan ke dalam tabung 1,5 ml.
Degradasai protein dan bahan organik. Sampel yang sudah dimasukkan tabung
eppendorf 1,5 ml, ditambahkan proteinase K, dikocok kuat menggunakan vortex, ditambahkan Lysis Solution sebanyak 400 µl dan di-vortex kembali. Campuran
Tabel 2 Sampel penelitian sapi FH
9 reaksi digoyang pelan menggunakan nutating mixer di dalam inkubator pada suhu 56 oC selama 10 menit. Setelah proses inkubasi selesai, ditambahkan etanol
absolute sebanyak 200 µl di-vortex dengan menggunakan pipet. Selanjutnya, dipindahkan ke dalam spin column (kolom saring) dan disentrifugasi selama 1 menit dengan kecepatan 8.000 rpm. Cairan yang berhasil tersaring dibuang, substrat ditambahkan 500 µ l WB (wash buffer) I dan sentrifugasi kembali selama 1 menit pada kecepatan 10.000 rpm. Supernatan yang diperoleh dibuang sehingga yang tersisa adalah DNA.
Purifikasi DNA. Sebanya 500 µ l WB (wash buffer) II ditambahkan untuk mencuci DNA, larutan kemudian disentrifugasi selama 3 menit dengan kecepatan 14.000 rpm. Selanjutnya ditambahkan 200 µl Elution Buffer dan inkubasi selama 2 menit pada suhu ruang dan sentrifugasi pada kecepatan 10.000 rpm selama 1 menit. Proses selesai dan sampel DNA disimpan pada suhu -20 ˚C, kemudian siap untuk digunakan.
Desain Primer dan Probe Gen ACACA
Primer dan probe gen ACACA dirancang menggunakan software primer express versi 3.0.1 (perkin-Elmer, Applied Biosystems) berdasarkan sekuen gen ACACA (No. Akses Genebank : AJ276223). Hasil desain primer dan probe gen ACACA ditampilkan pada Tabel 3. Sekuen primer-forward yaitu 5'-GCC TCC CTG CCT TCA GAT AAA -3'; primer riverse yaitu 5'-GGG AAG TCC CCA GTA TCA TTT TT-3'. Sekuen probe 1 yaitu 5'-(FAM) TGA AGT GTA TAG GAC TTA GAA-3' dan probe 2 yaitu 5'-(VIC) TAT AGG ACT TAT AAA GGG C-3’. TaqMan Probe 1 disintesis dengan fluoresensi FAM™ dye TaqMan®MGB probe untuk mengenali spesifik untuk alel G (wild type) di 5’ akhir reporter
berwarna biru, sedangkan probe 2 disintesis dengan fluoresensi VIC™ dye TaqMan®MGB probe untuk mengenali spesifik untuk alel T (mutan) di 3’ akhir
quencher berwarna pink (merah jambu), sebagaimana tertera pada Gambar 5. Tabel 3 Hasil desain primer dan probe gen ACACA
10
Amplifikasi Gen ACACA
Amplifikasi gen ACACA dijalankan pada kondisi Thermal cycler real time-PCR yaitu pada suhu denaturasi 95 oC selama 20 detik, suhu annealing 60 oC selama 1 menit dan suhu ekstensi 95 oC selama 3 detik yang dijalankan selama 40 siklus. Campuran reaksi terdiri atas sample DNA sebanyak 1 µl di distribusikan ke dalam MicroAmp Optical 96-Well reaction plates. Komposisi pereaksi mix terdiri atas : 5 µl TaqMan® GTXpressTM Master Mix yang mengandung buffer, Uracil-N-glicosylase, deoxyribonucleotides, uridine, passive reference dye (ROX) dan Taq Gold DNA polymerse (Applied Biosystems, Foster City, CA USA), 0.5 ul primer
dan Taqman-MGB probe (forward dan reverse) dan sisanya RT-PCR grade water
3.5 µl. Substrat DNA kemudian didistribusikan sebanyak 9 µ l ke dalam Micro Amp Optical 96-Well reaction plates dengan perbandingan antara DNA dan campuran reaksi 1:9 (vol/vol), non-template DNA digunakan sebagai control dan ditutup dengan sealing foil 96-well. Larutan disentrifugasi terlebih dahulu dengan kecepan 2500 rpm selama 3 menit agar campuran reaksi berada di dasar well dan dimasukkan dalam mesin real-time PCR.
Genotiping Gen ACACA
Genotiping atau penentuan genotipe dari gen ACACA setiap sampel didasarkan pada tipe kurva dan clustering fluoresensi yang diterima oleh sensor pada mesin real-time PCR. Genotipe GG ditunjukkan fluoresensi FAM berwarna biru, genotipe GT ditandai dengan kombinasi fluoresen VIC dan FAM dengan fluoresensi merah jambu (pink) dan biru atau hijau dan genotipe TT dengan fluoresen VIC dengan warna pink. Hasil data diterima oleh 7500 software v2.0.6 (Applied Biosystems, Foster City, CA, USA) dalam bentuk Microsoft excel.
Analisis Data
Frekuensi Gen, Heterozigositas dan PIC
Frekuensi genotipe, frekuensi alel, derajat heterozigositas dan indeks deferensiasi genetik (FST) gen ACACA dihitung menggunakan software popgen32 versi 1.31. Polymorphic Informative Content (PIC) gen ACACA dihitung menurut Hartl & Clark (1997), dengan rumus sebagai berikut :
11 Asosiasi Varian Genotipe dari Gen ACACA dengan Asam Lemak Susu
Asosiasi keragaman dari dari gen ACACA dengan setiap komponen asam lemak susu dihitung menggungakan prosedur GLM (general linier model) dalam SAS ver. 9.2 dengan model sebagai berikut:
�
=
�
+
�
+
�
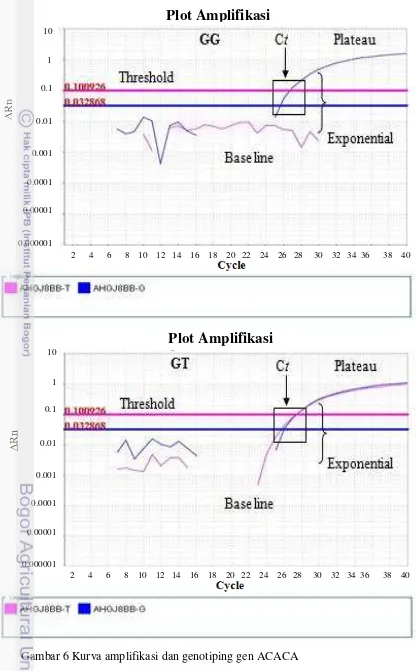
Hasil amplifikasi gen ACACA dengan suhu annealing 60oC selama 1 menit pada sapi FH memperoleh dua genotipe yaitu GG dan GT (Gambar 6 dan 7). Genotipe gen ACACA pada individu sapi FH ditunjukkan dengan dua tipe kurva amplifikasi. Genotipe GG ditunjukkan dengan kurva amplifikasi berfluoresensi FAM berwarna biru dan genotipe GT ditunjukkan dengan kurva amplifikasi berfluoresensi FAM dan VIC berwarna biru dan merah jambu (pink). Gen ACACA mulai teramplifikasi pada siklus ke 22 dan 26 dan kurva fluoresensi berhasil melewati garis siklus threshold (Ct) dari base line (awal amplifikasi) menuju fase eksponesial sampai fase plateau (perpanjangan). Nilai siklus
threshold kedua kurva fluoresesi VIC dan FAM masing sebesar 0.100926 dan 0.032868. Tinggi rendahnya nilai Ct berhubungan dengan kualitas DNA sampel yang digunakan. Semakin rendah nilai Ct maka kualitas DNA yang teramplifikasi semakin baik (Fraga et al. 2008). Nilai Ct ditentukan secara otomatis pada saat kurva berada pada fase eksponensial (Mackay et al. 2002). Keberhasilan kurva fluoresensi yang melewati nilai Ct dijadikan sebagai indikator keberhasilan amplifikasi gen target dan dijadikan sebagai landasan untuk menentukan genotipe individu sampel yang akurat (Wilhelm et al. 2000; Ranade et al. 2001; Mackay et al. 2002).
12
1
Gambar 6 Kurva amplifikasi dan genotiping gen ACACA
Plot Amplifikasi
10
1
0.1
0.01
0.001
0.0001
0.00001
0.000001
2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40
10
1
0.1
0.01
0.001
0.0001
0.00001
0.000001
2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40
13
Frekuensi Gen ACACA
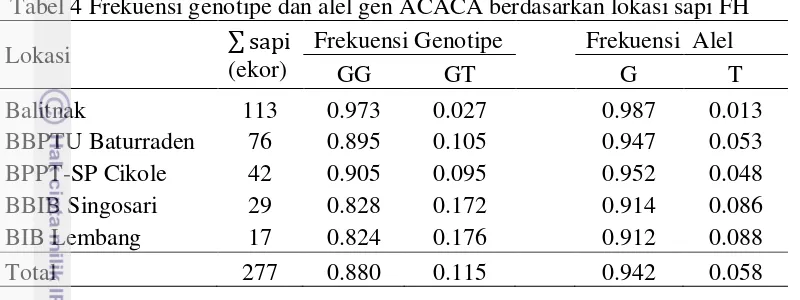
Frekuensi genotipe gen ACACA pada Tabel 4, menunjukkan bahwa secara umum frekensi genotipe GG lebih tinggi (0.880) dibandingkan genotipe GT (0.115) pada populasi sapi FH pengamatan. Frekuensi genotipe GG yang paling tinggi pada sapi FH Balitnak (0.973), sebaliknya yang terendah pada sapi FH pejantan di BIB Lembang (0.824). Frekuensi genotipe GT yang paling tinggi pada sapi FH pejantan di BIB Lembang (0.176), sebaliknya yang terendah pada sapi FH betina di Balitnak (0.027).
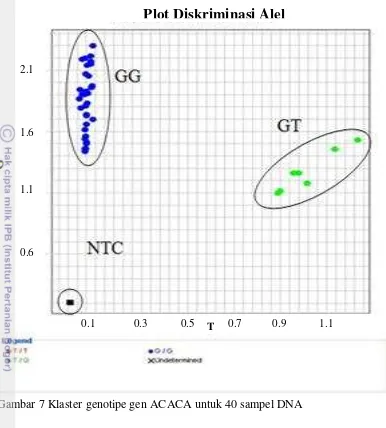
Frekuensi alel G gen ACACA sapi FH secara umum menunjukkan lebih dominan terhadap alel T, dengan nilai frekuensi yaitu 0.942 dan 0.058. Nilai frekuensi alel G berkisar antara 0.912-0.987, sedangan frekuensi alel T berkisar antara 0.013-0.088. Tingginya frekuensi alel G mengindikasikan bahwa sebagian besar individu sapi FH tidak mengalami mutasi pada posisi sekuen ke 2203 bp. Hal tersebut dibuktikan dengan tingginya alel G sebagai tipe alel liar (wild type) dan rendahnya alel T sebagai tipe alel mutan. Nei M. (1987) menyatakan bahwa penyebab mutasi gen dapat terjadi akibat adanya perubahan basa pada tingkat DNA (A=adenine, T=timin, G=guanine dan C=sitosin) baik dalam bentuk Gambar 7 Klaster genotipe gen ACACA untuk 40 sampel DNA
Plot Diskriminasi Alel
2.1
1.6
1.1
0.6
14
subtitusi, delesi, insersi dan inversi pada saat replikasi dan adanya zat-zat yang bersifat mutagen. Penyebab lainnya dapat dipengaruhi oleh sumber pejantan Inseminasi Buatan (IB) yang digunakan. Sumber pejantan yang digunakan untuk IB, pada umumnya berasal dari BBIB Singosari dan BIB Lembang. Ke-dua
sumber IB tersebut tidak mewariskan genotipe TT. Hal tersebut kemungkinannya sapi pejantan untuk IB yang digunakan bergenotipe GG dikawinkan dengan sapi betina bergenotipe GT atau sebaliknya, pejantan bergenotipe GT dikawinkan dengan betina bergenotipe GG sehingga genotipe TT tidak ditemukan (Tabel 4). Meskipun demikian gen ACACA pada sapi FH bersifat beragam (polimorfik) kecuali pada sapi FH Balitnak yang memiliki frekuensi alel G dan T yaitu 0.987 dan 0.013. Hartl DL. (1987) menyatakan bahwa suatu alel bersifat polimorfik apabila salah satu frekuensi alelnya kurang dari 0.99 (>0.01). Keragaman gen ACACA telah dilaporkan pada beberapa spesies hewan yaitu pada sapi (Shin et al.
2011), kambing (Badaoui et al. 2007), tikus (Mao et al. 2001), babi (Gallardo et al.
2009) dan manusia (Abu-Elheiga et al. 1995).
Heterozigositas FST dan PIC Gen ACACA
Nilai heterozigositas gen ACACA sapi FH disajikan pada Tabel 5. Nilai heterozigositas pengamatan (Ho) gen ACACA pada sapi FH pengamatan memeiliki nilai antara 0.027-0.186, sedangkan nilai heterozigositas harapan (He) berada dalam kisaran antara 0.027-0.161. Secara umum nilai Ho lebih besar dari pada He di lima lokasi sapi FH. Hal tersebut mengindikasikan bahwa nilai heterozigositas gen ACACA pada sapi FH rendah. Nilai heterozigositas di bawah 0.5 (<50%) menunjukkan variasi suatu gen dalam suatu populasi bersifat renda (Hartl dan Clark 1997). Rendahnya nilai heterozigositas dapat diakibatkan karena adanya seleksi dan terjadinya perkawinan silang dalam (inbreeding) pada sapi FH. Pendugaan nilai inbreeding dapat diduga berdasarkan nilai FST (indeks derensiasi genetik). Nilai FST gen ACACA pada Tabel 5 termasuk dalam kelompok yang rendah (<0.5) dengan rataan yaitu 0.100. Wright (1987) menyatakan bahwa nilai FST kurang dari 0.5 termasuk kelompok rendah. Nilai FST yang rendah menunjukkan rendahnya tingkat inbreeding pada sapi FH di Balitnak dan BPPT-SP Cikole, sedangkan pada sapi FH BBPTU Baturraden, BBIB Singosari dan BIB Lembang memiliki nilai FST sedang (>5%). Inbreeding pada
Tabel 4 Frekuensi genotipe dan alel gen ACACA berdasarkan lokasi sapi FH
Lokasi sapi
(ekor)
Frekuensi Genotipe Frekuensi Alel
15 suatu populasi bertujuan untuk meningkatkan derajat homozigositas dan menurunkan derajat heterozigositas (Noor RR 2010).
Bostein et al. (1980) menyatakan bahwa nilai PIC merupakan salah satu parameter yang menunjukkan tingkat informasi suatu penciri genetik pada ternak. Hasil nilai PIC gen ACACA yang diperoleh berada dalam kisaran antara 0.026-0.148 (Tabel 5). Nilai PIC termasuk tinggi apabila nilainya PIC > 0.5, sedang bila nilai PIC > 0.25 dan rendah bila PIC < 0.25 (Xin-Sheng et al. 2008). Gen ACACA pada penelitian ini memiliki tingkat ke-informatifan sebesar 0.026-0.148 dalam mendeteksi keragaman populasi sapi FH. Berdasarkan parameter tersebut bahwa nilai PIC gen ACACA pada penelitian ini termasuk dalam kelompok yang rendah (PIC < 0.25). Hal ini mengindikasikan bahwa keragaman gen ACACA pada sapi FH kurang ideal untuk dijadikan sebagai marka pembantu dalam seleksi. Marka genetik yang diharapkan yaitu memilki nilai PIC yang tinggi (PIC > 0.5) untuk memberikan informasi suatu penciri genetik terhadap sifat-sifat ekonomis (Hildebrand et al. 1992).
Asosiasi Gen ACACA dengan Asam Lemak Susu
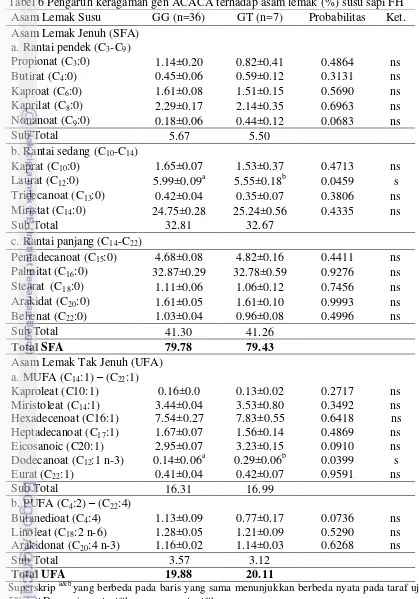
Hasil analisis setiap komponen asam lemak susu tertera pada Tabel 6. Asam lemak yang berhasil diidentifikasi sebanyak 24 jenis asam lemak susu yang terbagi dalam kelompok asam lemak jenuh (SFA) dan tak jenuh (unsaturated fatty acid/UFA = MUFA dan PUFA). Jenis SFA ditemukan 5 jenis rantai pendek yaitu propionat, butirat, kaproat, kaprilat dan nonanoat; 4 rantai sedang yaitu kaprat, laurat, tridekanoat dan miristat; dan 5 rantai panjang yaitu pentadecanoat, palmitat, stearat, arakidat dan behenat; untuk MUFA ditemukan 6 jenis asam lemak yaitu kaproleat, miristoleat, dodecanoat, hexadecenoat, Heptadecanoat, eicosanoat dan eurat; sedangkan untuk PUFA ditemukan 3 jenis asam lemak yaitu butanedioat, linoleat dan arakidonat. Kandungan total SFA, MUFA dan PUFA masing-masing berkisar antara 79.43-79.78%, 16.31-16.99% dan 3.12-3.57%.
Pengaruh varian genotipe dari gen ACACA secara umum tidak berbeda nyata (P<0.05) terhadap komponen asam lemak susu baik SFA rantai pendek, rantai sedang dan rantai panjang maupun pada MUFA dan PUFA, kecuali pada asam lemak laurat (C12:0) dan dodecanoat (C12:1 n-3) atau lauroleat. Asam laurat termasuk jenis SFA, sedangkan dodecanoat termasuk dalam kelompok MUFA. Keragaman genotipe gen ACACA yang memiliki potensi berpengaruh terhadap Tabel 5 Analisis derajat heterozigositas, FST dan nilai PIC gen ACACA
16
asam lemak susu yaitu pada nonanoat (C9:0) dari kelompok SFA; eicosanoat (C20:0) dari kelompok MUFA; dan butanedioat (C4:4) dari kelompok PUFA. Genotipe GG memiliki kandungan asam laurat lebih tinggi dibandingkan dengan
Tabel 6 Pengaruh keragaman gen ACACA terhadap asam lemak (%) susu sapi FH Asam Lemak Susu GG (n=36) GT (n=7) Probabilitas Ket. Hexadecenoat (C16:1) 7.54±0.27 7.83±0.55 0.6418 ns Heptadecanoat (C17:1) 1.67±0.07 1.56±0.14 0.4869 ns Eicosanoic (C20:1) 2.95±0.07 3.23±0.15 0.0910 ns Dodecanoat (C12:1 n-3) 0.14±0.06a 0.29±0.06b 0.0399 s
17 genotipe GT masing-masing 5.99±0.09 % dan 5.55±0.18 %. Demikian pula pada kelompok SFA lainnya yang secara umum genotipe GG memiliki pengaruh lebih tinggi. Hal ini berbeda dengan kelompok MUFA khususnya dodecanoat (C12:1 n-3) bahwa genotipe GT memiliki kandungan lebih tinggi dibanding genotipe GG, yaitu 0.29±0.06 % dan 0.14±0.06 %. Hal yang sama terjadi pada kandungan MUFA lainnya, dimana genotipe GT cendrung memiliki pengaruh lebih baik dibandingkan genotipe GG. Asam lemak kelompok PUFA bahwa genotipe GT juga memiliki kecendrungan lebih baik dibandingkan dengan genotipe GG. Hal tersebut terjadi hanya pada asam lemak butanedioat (C4:4), sebaliknya pada asam lemak PUFA lainnya. Hasil analisis asam lemak pada penelitian ini telah sesuai dengan Zhang et al. (2009) bahwa genotipe GG memiliki pengaruh lebih kuat dibandingkan dengan genotipe GT terhadap total SFA, dan kondisi sebaliknya pada MUFA dan PUFA.
Kandungan asam lemak tentunya sangat besar dipengaruhi oleh faktor lingkungan baik nutrisi dan sistem pemeliharaan ternak sapi (Butler et al. 2008). Pakan yang dikonsumsi oleh ternak disintesis menjadi asam lemak SFA, MUFA dan PUFA. Kandungan asam lemak yang dihasilkan dipengaruhi oleh aktivitas gen yang mengontrol dalam pembentukan asam lemak susu (Sutton 1989; Salman dan Djaja 2012). Ternak khususnya sapi, tidak dapat mensintesis asam lemak linoleat (C18:2) dan linolenat (C18:3 n3), dan jenis asam lemak PUFA lainnya. Asam lemak PUFA dihasilkan oleh pakan yang dikonsumsinya. Malonyl-CoA
merupakan produk dari ACACA yang menjadi substrat intermediasi untuk sintesis asam lemak (FASN). Tinggi rendahnya malonyl-CoA sangat ditentukan oleh ACACA. Tingginya produk malonyl-CoA dari ACACA akan mempengaruhi tingginya produk asam lemak (SFA, MUFA dan PUFA) yang dihasilkan. (Zhang
et al. 2009). Sintesis SFA oleh FASN kemudian mengalami perpanjangan atau desaturasi di dalam mikrosom jaringan adipose untuk memproduksi beberapa MUFA seperti C14:1, C16:1 dan C18:1 (St John et at. 1991 dalam Zhang et al. sedangkan asam lemak tak jenuh yang utama adalah oleat (C18:1), linoleat (C18:2) dan linolenat (C18:3). Total asam lemak susu (3.5-5%) disusun oleh partikel-partikel kecil seperti fosfolipid sekitar 0,5-1% dan sterol hanya 0.2-0.5%, dimana keberadaan mereka berada dalam bentuk triasilgliserida (Jensen et al. 1991).
18
5
SIMPULAN DAN SARAN
Simpulan
Gen ACACA pada sapi FH pengamatan bersifat polimorfik yaitu ditemukan dua genotipe GG dan GT. Varian genotipe gen ACACA berpengaruh nyata terhadap asam lemak laurat dan dodecanoat. Dengan demikian, varian genotipe gen ACACA berpeluang untuk menjadi marka genetik untuk asam lemak susu. sapi perah untuk asam lemak susu.
DAFTAR PUSTAKA
Abu-Elheiga L, Jayakumar A, Baldini A, Chirala SS, Wakil SJ. 1995. Human acetyl-CoA carboxylase: characterization, molecular cloning, and evidence for two isoforms. Proceed of the National Academy of Sci. 92:4011-5. Arya M, Shergill IS, Williamson M, Gommersall L, Arya N, Patel HR. 2005.
Basic principles of real-time quantitative PCR. Expert Rev Mol Diagn.5(2) 1473-7159.
Awan MM, Saggerson ED. 1993. Malonyl-CoA metabolism in cardiac myocytes and its relevance to the control of fatty acid oxidation. J Biochem. 295:61-6.
Badaoui B, Serradilla J, Tomas A, Urrutia B, Ares J, Carrizosa J, Sanchez A, Jordana J, Amills M. 2007. Goat acetyl-coenzyme A carboxylase α: molecular characterization, polymorphism, and association with milk traits.
J Dairy Sci.90:1039-43.
Barber M, Vallance A, Kennedy H, Travers M. 2003. Induction of transcripts derived from promoter III of the acetyl-CoA carboxylase-α gene in mammary gland is associated with recruitment of SREBP-1 to a region of the proximal promoter defined by a DNase I hypersensitive site. J Biochem.
375:489-501.
Bionaz M, Loor JJ. 2008. Gene networks driving bovine milk fat synthesis during the lactation cycle. BMC Genomics.9:366.
Botstein D, White RL, Skolnick M, Davis RW. 1980. Construction of a genetic linkage map in man using restriction fragment length polymorphisms. Am J Hum Genet.32, 314-31.
19 Bukcle K, Edwards R, Fleet G, Woothon M. 2009. Ilmu Pangan. Terjemahan Hari
Purnomo dan Agiono. Jakarta (ID). UI Press.
Bustin SA. 2004. AZ of quantitative PCR. International University Line La Jolla, CA, (US) USA. IUL Press.
Butler G, Nielsen JH, Slots T, Seal C, Eyre M D, Sanderson R, Leifert a.C. 2008. Fatty acid and fat-soluble antioxidant concentrations in milk from high and low-input conventional and organic systems: seasonal variation. J of the Sci of Food and Agr. 1431–41.
Cheng J, Zhang Y, Li Q. 2004. Real-time PCR genotyping using displacing probes. Nucleic acids research. 32, 61.
Cole J, Null D, VanRaden P. 2009. Best prediction of yields for long lactations. J Dairy Sci. 92, 1796-810.
Connor WE. 2000. Importance of n− 3 fatty acids in health and disease. The American J of clin nutr. 71:171S-5S.
Didenko VV. 2001. DNA probes using fluorescence resonance energy transfer (FRET): Designs and applications. Biotec. 31:1106-21.
Ellis KA, Innocent G, Grove-White D, Cripps P, McLean WG, Howard CV, Mihm M. 2006. Comparing the Fatty Acid Composition of Organic and Conventional Milk. J Dairy Sci. 89:1938-50.
Feskanich D, Willett WC, Stampfer MJ, Colditz G.A. 1997. Milk, dietary calcium, and bone fractures in women: a 12-year prospective study. American J of Public Health. 87, 992-7.
Fraga D, Meulia T, Fenster S. 2008. Real‐Time PCR. Current Protocols Essential Laboratory Techniques. 10.3. 1-3. 40.
Gallardo D, Quintanilla R, Varona L, Díaz I. Ramirez O, Pena R, Amills M. 2009. Polymorphism of the pig acetyl‐coenzyme A carboxylase α gene is associated with fatty acid composition in a Duroc commercial line. Anim Genet. 40:410-7.
Gresti J, Bugaut M, Maniongui C, Bezard J. 1993. Composition of Molecular Species of Triacylglycerols in Bovine Milk Fat. J Dairy Sci.76:1850-69. Hartl DL. 1987. A primer of population genetics. Sinauer Associates, Inc.
Hartl DL, Clark AG. 199. Principles of population genetics. Sinauer associates Sunderland.
Henning DR, Baer RJ, Hassan AN, Dave R. 2006. Major advances in concentrated and dry milk products, cheese, and milk fat-based spreads. J Dairy Sci.89:1179-88.
Hildebrand C, Torney D, Wagner R. 1992. Informativeness of polymorphic DNA markers. Los Alamos Sci.20, 100-2.
Huth PJ, Park KM. 2012. Influence of dairy product and milk fat consumption on cardiovascular disease risk: a review of the evidence. Advances in Nutrition: An Intern Rev J. 3:266-85.
Jensen RG,Ferris AM, Lammi-Keefe CJ. 1991. The Composition of milk fat. J Dairy Sci.74:3228-43.
Kelly ML, Kolver ES, Bauman DE, Van Amburgh ME, Muller LD. 1998. Effect of intake of pasture on concentrations of conjugated linoleic acid in milk of lactating cows. J Dairy Sci.81:1630-6.
20 repressive element different from that in rat. J Biochem. 358:127-35. Marchitelli C, Contarini G, De Matteis G, Crisà A, Pariset L, Scatà MC, Catillo G,
Napolitano F, Moioli B. 2013. Milk fatty acid variability: effect of some candidate genes involved in lipid synthesis. J of Dairy Research. 80:165-73.
Morita A, Nakayama T, Doba N, Hinohara S, Mizutani T, Soma M. 2007. Genotyping of triallelic SNPs using TaqMan® PCR. Molecular and Cellular Probes. 21:171-6.
Muladno. 2002. Teknologi Rekayasa Genetika. Bogor (ID): IPB Press
Navarro E, Serrano-Heras G, Castaño M, Solera J. 2015. Real-time PCR detection chemistry. Clinica Chimica Acta. 439:231-50.
Nei M. 1987. Molecular Evolutionary Genetics. (CU) Columbia university press. Noor RR. 2010. Genetika ternak. Cet. VI. Jakarta(ID). Penebar Swadaya.
Park H, Kaushik VK, Constant S, Prentki M, Przybytkowski E, Ruderman NB, Saha AK. 2002. Coordinate regulation of malonyl-CoA decarboxylase, sn-glycerol-3-phosphate acyltransferase, and acetyl-CoA carboxylase by AMP-activated protein kinase in rat tissues in response to exercise. J of Bio Chem.277, 32571-7.
Poon LL, Chan K, Smith G, Leung C, Guan Y, Yuen K, Peiris J. 2009. Molecular detection of a novel human influenza (H1N1) of pandemic potential by conventional and real-time quantitative RT-PCR assays. Clinical Chem.55:1555-8.
Ranade K, Chang MS, Ting CT, Pei D, Hsiao CF, Olivier M, Pesich R, Hebert J, Chen YDI, Dzau VJ. 2001. High-throughput genotyping with single nucleotide polymorphisms. Genome Research.11:1262-8.
Salman LB, Djaja W. 2012. Analysis on holstein cow milk production maintainned by large scale dairy farm on middle plain in west java. Lucr̆ri ̧tiiņifice-Universitatea de Ştiinţe Agricole şi Medicină Veterinară, Seria Zootehnie.58:73-7.
Sartika RAD. 2008. Pengaruh asam lemak jenuh, tidak jenuh dan asam lemak trans terhadap kesehatan. Kesmas J Kes Masy Nasional.2.
Shen GQ, Abdullah KG, Wang QK. 2009. The TaqMan method for SNP genotyping. In: Single Nucleotide Polymorphisms. Springer. 293-306. Shin SC, Heo Jp, Chung ER. 2011. Effect of single nucleotide polymorphisms of
acetyl-coa carboxylase α (ACACA) gene on carcass traits in Hanwoo (Korean Cattle). Asian-Australasian J of Anim Sci. 24:744-51.
Sul HS, Latasa MJ, Moon Y, Kim KH. 2000. Regulation of the fatty acid synthase promoter by insulin. The J of nutrition. 130: 315S-20S.
21 Thering B, Graugnard D, Piantoni P, Loor J. 2009. Adipose tissue lipogenic gene networks due to lipid feeding and milk fat depression in lactating cows. J Dairy Sci.92:4290-300.
Ulbricht TLV, Southgate DAT. 1991. Coronary heart disease: seven dietary factors. The Lancet. 338, 985-92.
Veerkamp R. 1998. Selection for economic efficiency of dairy cattle using information on live weight and feed intake: a review. J Dairy Sci. 81: 1109-19.
Webb BH, Johnson AH. 1965. Fundamentals of dairy chemistry. Avi Publishing Co Inc.
Wilhelm J, Hahn M, Pingoud A. 2000. Influence of DNA target melting behavior on real-time PCR quantification. Clinical Chem.46:1738-43.
Wright S. 1978. Variability Within and Among Natural Population. Chicago (US): Uni of Chicago Press.
Xin-Sheng W, Tian-Wen W, Hui-Ling Z, Guang-Long CXQ, Jin-Hua C, Xiu-Bai Z, Guo-Hong C. 2008. Correlation analysis of wool yield in wan line angora rabbits using microsatellite DNA markers. J of Biological Sci. 8: 679-82.
22
Lampiran 1 Sekuen Gen ACACA No. Akeses Gene Bank AJ276223 LOCUS AJ276223 6203 bp DNA linear MAM 13-JUN-2002
DEFINITION Bos taurus gene for acetyl-CoA-carboxylase alpha, 5' region.
ACCESSION AJ276223
VERSION AJ276223.1 GI:11064514
KEYWORDS acetyl-CoA-carboxylase alpha; promoter. SOURCE Bos taurus (cattle)
AUTHORS Mao,J., Marcos,S., Davis,S.K., Burzlaff,J. and Seyfert,H.M.
TITLE Genomic distribution of three promoters of the bovine gene encoding
acetyl-CoA carboxylase alpha and evidence that the nutritionally
regulated promoter I contains a repressive element different from
23
24
25 Riwayat Hidup
Penulis dilahirkan di Dusun Perrengan, Desa Lantek Timur Galis, Kabupaten Bangkalan Madura pada tanggal 5 September 1987, sebagai anak ke-dua dari empat bersaudara (Ahmad Syafi’i, Siti Maisarotus Syafila dan Sumiati Alya Jazila) dari pasangan ayahanda Nahrawi dan ibunda Sudiah. Penulis menikah dengan seorang wanita sholihah bernama Uswatun Chasanah dan dianugerahi anak Muhammad Hafidz Aufaa Rosyidi.
Gelar (sarjana) pertama penulis didapatkan dari Fakultas Peternakan Universitas Brawijaya Malang, Jurusan Ilmu dan Teknologi produksi Ternak pada Tahun 2012. Pada tahun yang sama penulis diterima menjadi Supervisor di PT Charoen Pokphan Indonesia dan mengundurkan diri pada Tahun 2013.