2.5. Materi Kalor.
Kalor didefinisikan sebagai energi yang berpindah dari benda yang suhunya lebih tinggi ke benda yang suhunya lebih rendah ketika kedua benda
bersentuhan (Kanginan, 2007). Benda yang menerima kalor, suhunya akan naik atau wujudnya berubah. Benda yang melepas kalor suhunya akan turun atau wujudnya berubah. Pengertian kalor berbeda dengan suhu, jika suhu adalah
ukuran derajat panas dan dinginnya suatu benda, sedangkan kalor adalah ukuran banyaknya panas. Besarnya kalor yang diserap atau dilepas oleh suatu benda
berbanding lurus dengan: massa benda, kalor jenis benda dan perubahan suhu (Zaelani dkk, 2006: 221). Persamaan kalor secara matematis dapat dirumuskan sebagai:
Q = m c ∆T...(2.1) Keterangan : Q = Banyaknya kalor yang diperlukan (J)
m = Massa zat (kg)
c = Kalor jenis zat (kal/g°C)
∆T = T2 – T1 = perubahan suhu (°C, K)
Kalor merupakan bentuk energi, oleh karena itu satuan kalor dalam sistem internasional (SI) sama dengan satuan energi, yaitu Joule (J). Satuan selain joule
yang sering digunakan adalah kalori (kal). Satu kalori didefinisikan sebagai banyaknya kalor yang diperlukan oleh satu gram air untuk menaikkan suhunya sebesar 10C (Foster, 2004: 21). Berdasarkan percobaan yang dilakukan oleh
1 Kalori = 4,2 Joule atau 1 Joule = 0,24 Kalori
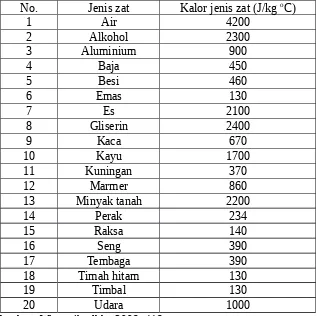
Kalor jenis (c) didefinisikan banyaknya kalor yang diperlukan untuk menaikkan suhu 1 kg zat sebesar 1 K atau 1°C (Zaelani dkk, 2006: 221). Kalor
jenis adalah sifat khas suatu zat yang menunjukkan kemampuannya untuk menyerap kalor. Zat yang kalor jenisnya tinggi mampu menyerap lebih banyak kalor untuk kenaikkan suhu yang rendah (Kanginan, 2007 : 235). Kalor jenis
berbagai zat ditunjukkan pada tabel dibawah ini:
Tabel 4. Kalor Jenis Berbagai Zat
c =
m∆ TQ ...(2.2)Kapasitas kalor (C) didefinisikan sebagai banyaknya kalor yang diperlukan untuk menaikkan suhu suatu benda sebesar 1°C (Kanginan, 2007).
Dari persamaan (2.2), dapat ditulis dalam bentuk persamaan berikut:
mc =
∆ TQ ...(2.3)Kapasitas kalor diberi lambang C (huruf besar), maka:
C =
∆ TQ...(2.4)
Keterangan :
Q = Banyaknya kalor yang diperlukan (J)
C = Kapasitas kalor (J/°C) m = Massa zat (kg)
c = Kalor jenis zat (kal/g°C)
∆T = T2 – T1 = perubahan suhu (°C, K) (Kanginan, 2007: 236)
2.5.1. Asas Black
Gambar 1 menunjukkan bagaimana cara mendinginkan air panas, yaitu dengan mencampurkannya dengan air dingin. setelah keseimbangan termal
tercapai, kita memperoleh air hangat, yang suhunya di antara suhu air panas dan air dingin. Dalam pencampuran ini tentunya air panas melepaskan energi,
Gambar 1. Contoh Peristiwa Asas Black
Seorang ilmuan Inggris yaitu Joseph Black mengadakan pengamatan
mengenai kalor. Black menyatakan bahwa jika dua zat yang suhunya berbeda dicampur, zat yang suhunya lebih tinggi akan melepaskan sejumlah kalor yang
akan diserap oleh zat yang suhunya lebih rendah (Purwoko dan Fendi, 2009: 192). Black menyimpulkan bahwa “ banyaknya kalor yang dilepas zat yang suhunya lebih tinggi sama dengan banyaknya kalor yang diserap oleh zat yang suhunya
lebih rendah”. Kesimpulan ini disebut asas Black secara matematis ditulis:
Q lepas = Q terima...(2.5)
Pengukuran kalor sering dilakukan untuk menentukan kalor jenis suatu zat, sebab jika kalor jenis suatu zat diketahui, maka kalor yang diserap akan dilepaskan dapat ditentukan dengan mengukur perubahan suhu zat tersebut. Kalor
dapat dihitung dengan menggunakan rumus Q = m c ∆T. pada waktu menggunakan rumus ini harus diingat bahwa suhu naik berarti zat menerima kalor
dan suhu turun berarti zat melepas kalor (Supiyanto, 2007). Air panas
2.5.2. Perubahan Wujud Zat
Kalor dapat mengubah wujud zat. Misalnya, es (zat padat) yang dipanaskan (diberi kalor) akan berubah wujudnya menjadi cair (zat cair).
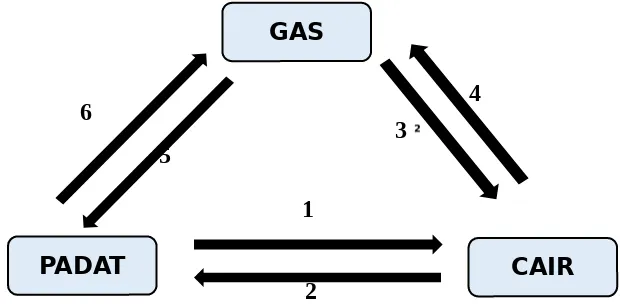
Sebaliknya, air (zat cair) yang didinginkan (diambil kalornya) dalam batas waktu tertentu akan berubah menjadi wujud es (zat padat) (Purwoko dan Fendi, 2009). Diagram perubahan wujud zat dapat dilihat pada gambar 2 berikut:
Gambar 2. Diagram Perubahan Wujud Zat
Keterangan: 1 = Melebur 2 = Membeku 3 = Mengembun 4 = Menguap 5 = Mengkristal 6 = Menyublim
Tiga jenis wujud zat, yaitu zat padat, zat cair dan gas. Sebuah benda dapat
berubah wujud ketika suhunya dinaikkan atau diturunkan (Foster, 2004: 23). Melebur adalah perubahan wujud zat dari padat menjadi cair (Kanginan,
2007: 240). Pada saat melebur, zat memerlukan kalor meskipun tidak mengalami GAS
PADAT CAIR
6
5
4 3
kenaikan suhu. Titik lebur adalah suhu pada zat melebur. Membeku adalah
perubahan wujud zat dari cair menjadi padat (Foster, 2004: 23). Titik beku adalah suhu pada waktu zat membeku. Pada saat membeku zat melepaskan kalor.
Menguap adalah perubahan wujud zat dari cair menjadi gas (Supiyanto, 2007: 158). Peristiwa penguapan membutuhkan kalor. Proses penguapan membutuhkan kalor ini dapat dilihat dari peristiwa mendidih. Menguap hanya terjadi pada
permukaan zat cair an dapat terjadi pada sembarang suhu, sedangkan mendidih terjadi pada seluruh bagian zat cair dan hanya dapat terjadi pada titik didih.
Suhu zat pada waktu mendidih adalah tetap sekalipun pemanasan terus dilakukan. Semua kalor yang diberikan kepada zat digunakan untuk mengubah wujud dari cair menjadi uap. Suhu tetap ini disebut titik didih yang besarnya
sangat bergantung pada tekanan dipermukaan zat itu. Titik didih zat pada tekanan 1 atm disebut titik didih normal (Kanginan, 2007: 241). Proses kebalikan dari
menguap adalah mengembun, yaitu perubahan wujud dari uap (gas) menjadi cair. Suhu zat tetap ketika sedang berubah wujud, baik melebur, menguap, membeku dan mengembun, walaupun ada pelepasan atau penyerapan kalor. Ada
sejumlah kalor yang dilepaskan atau diserap pada saat perubahan wujud zat, tetapi tidak digunakan untuk menaikkan atau menurunkan suhu. Kalor yang digunakan
untuk perubahan wujud suatu zat tanpa adanya perubahan suhu disebut kalor laten dan disimbolkan dengan simbol huruf L. Besarnya kalor ini bergantung pada jumlah zat yang mengalami perubahan wujud. Jadi, kalor laten adalah kalor yang
Besarnya kalor yang diperlukan atau dilepaskan selama proses perubahan
wujud zat (Zaelani, 2006: 222) dirumuskan sebagai berikut:
Q = m . L...(2.6)
Dengan : Q = Banyaknya kalor yang diperlukan atau dilepaskan (J, kal) m = Massa zat (g/kg)
L = Kalor laten (J/kg, kal/gr)
Kalor yang diserap oleh suatu zat pada saat melebur atau menguap tidak menaikkan suhu. Teori kinetik menjelaskan pada saat melebur atau menguap,
kecepatan getaran molekul bernilai maksimum. Kalor yang diserap tidak menambah kecepatannya, tetapi digunakan untuk melawan gaya ikat antar molekul zat tersebut. Molekul-molekul ini akhirnya dapat melepaskan diri dari
ikatannya sehingga zat padat melebur atau menguap, barulah suhu zat bertambah lagi. Peristiwa sebaliknya terjadi pada saat zat cair membeku atau mengembun
(Supiyanto, 2007: 160).
Kalor yang diperlukan untuk mengubah wujud 1 kg zat padat menjadi zat cair dinamakan kalor laten lebur atau kalor lebur. Kalor yang dilepaskan pada
waktu zat membeku dinamakam kalor laten beku atau kalor beku. Hasil percobaan menunjukkan bahwa untuk zat yang sama, kalor lebur = kalor beku.
Kedua jenis kalor ini selanjutnya disebut kalor lebur dan diberi symbol Lf. Jika
banyak kalor yang diperlukan oleh zat yang massanya m kg untuk melebur adalah Q joule, maka sesuai dengan definisi di atas dapat ditulis (Kanginan, 2007 : 240) :
Lf
=
Q
m ...(2.7)
Q = Banyaknya kalor yang diterima /dilepas (J/kal)
m = Massa zat (kg)
Kalor laten uap atau kalor uap adalah kalor yang diperlukan untuk
mengubah wujud 1 kg zat cair menjadi uap pada titik didih normal. Kalor uap disebut juga kalor didih. Kalor yang dilepaskan untuk mengubah wujud 1 kg uap menjadi cair dan titik didih normalnya disebut kalor laten embun atau kalor
embun. Hasil percobaan menunjukkan bahwa untuk zat yang sama, kalor didih = kalor embun. Istilah kalor didih paling umum digunakan dan diberi lambang Lv.
Jika banyaknya kalor yang diperlukan untuk mendidihkan zat yang massanya m kg adalah Q joule (Kanginan, 2007: 241) dapat ditulis:
Lv
=
Q
m ...(2.8)
Dengan : Lv = Kalor didih (J/kg)
Q = Banyaknya kalor yang diterima atau dilepas (J,kal)
m = Massa zat (kg)
Kalor merupakan faktor yang mempengaruhi perubahan wujud suatu zat.
Suatu zat dapat berubah wujud dari padat ke cair, cair ke gas, padat ke gas dan sebaliknya akibat penyerapan dan pelepasan kalor. Faktor-faktor lain yang dapat mempengaruhi perubahan wujud suatu zat, yaitu tekanan dan ketidakmurnian.
Tekanan dan ketidakmurnian berpengaruh pada kenaikkan titik didih dan penurunan titik beku. Semakin tinggi tekanan dan konsentrasi ketidakmurnian
semakin tinggi. Oleh karena itu, titik didih di daerah pegunungan akan semakin
besar dibandingkan didaerah rendah (Supiyanto, 2007: 161). 2.5.3 Perpindahan Kalor
Kalor merupakan energi yang dapat berpindah dari benda yang bersuhu tinggi ke benda yang bersuhu rendah. Ada tiga cara kalor berpindah dari satu benda ke benda yang lain, yaitu konduksi, kenveksi, dan radiasi
(Nurachmandani,b2009:v165) 1. Konduksi
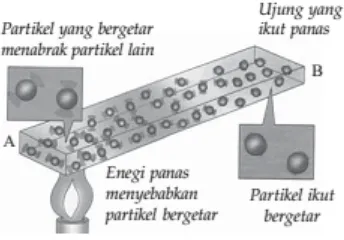
Jika sepotong sendok makan yang Anda bakar pada api lilin, lama kelamaan tangan Anda merasakan hangat dan akhirnya panas. Peristiwa perpindahan kalor melalui suatu zat tanpa disertai dengan perpindahan
partikel-partikelnya disebut konduksi (Nurachmandani, 2009)
Gambar 3. Skema perpindahan kalor secara konduksi
Perpindahan kalor dengan cara konduksi disebabkan karena
partikelpartikel penyusun ujung zat yang bersentuhan dengan sumber kalor bergetar. Makin besar getarannya, maka energi kinetiknya juga makin besar. Energi kinetik yang besar menyebabkan partikel tersebut menyentuh partikel di
aliran kalor secara matematis dapat dinyatakan sebagai berikut: (Nurachmandani,
Q : banyak kalor yang mengalir (J)
A : luas permukaan (m2)
∆ T : perbedaan suhu dua permukaan (K)
d : tebal lapisan (m)
k : konduktivitas termal daya hantar panas (J/ms K)
t : lamanya kalor mengalir (s)
H : kelajuan hantaran kalor (J/s)
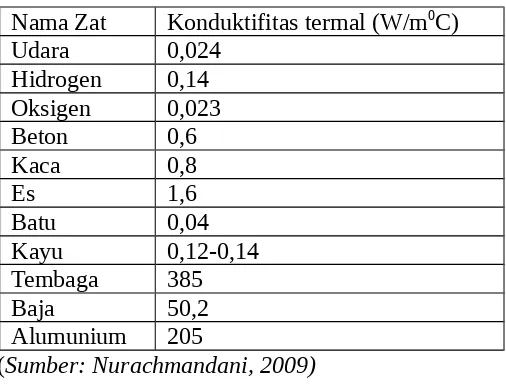
Setiap zat memiliki konduktivitas termal yang berbeda-beda.
Konduktivitas termal beberapa zat ditunjukkan pada tabel berikut. Tabel 5. Tabel Konduktivitas Termal Beberapa Zat
Nama Zat Konduktifitas termal (W/m0C)
Udara 0,024
Ditinjau dari konduktivitas termal (daya hantar kalor), benda dibedakan
menjadi dua macam, yaitu konduktor kalor dan isolator kalor. Konduktor kalor adalah benda yang mudah menghantarkan kalor. Hampir semua logam termasuk
adalah zat yang sulit menghantarkan kalor. Bahanbahan bukan logam biasanya
termasuk isolator kalor, seperti kayu, karet, plastik, kaca, mika, dan kertas. Berikut contoh alat-alat yang menggunakan bahan isolator dan konduktor kalor
(Nurachmandani, 2009).
a) Alat-alat yang menggunakan bahan isolator kalor, antara lain i. pegangan panci presto,
ii. Pegangan setrika, dan iii. pegangan solder.
b) Alat-alat yang menggunakan bahan konduktor kalor, antara lain: i. Kawat kasa, partikel-partikel zat (Nurachmandani, 2009:). Perpindahan kalor secara konveksi
dapat terjadi pada zat cair dan gas. Perpindahan kalor secara konveksi terjadi karena adanya perbedaan massa jenis zat. Konveksi air banyak dimanfaatkan dalam pembuatan sistem aliran air panas di hotel, apartemen, atau
perusahaan-perusahaan besar.
Contoh konveksi udara dalam kehidupan sehari-hari, antara lain,
sebagai berikut.
1) Sistem ventilasi rumah. Udara panas di dalam rumah akan bergerak naik dan keluar melalui ventilasi. Tempat yang ditinggalkan akan diisi oleh udara dingin
melalui ventilasi yang lain sehingga udara di dalam rumah lebih segar.
2) Cerobong asap pabrik. Pada pabrik-pabrik, udara di sekitar tungku pemanas
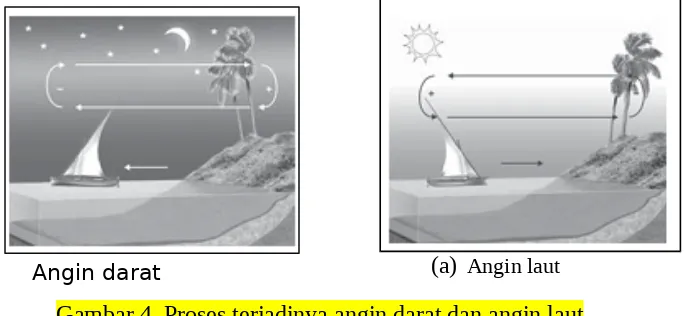
3) Angin laut dan angin darat. Pada siang hari daratan lebih cepat panas daripada
lautan. Udara di daratan memuai sehingga massa jenisnya mengecil dan bergerak naik ke atas. Tempat yang ditinggalkan akan diisi oleh udara dingin
dari laut, maka terjadilah angin laut. Sebaliknya, pada malam hari daratan lebih cepat dingin daripada lautan. Udara di atas laut memuai, massa jenisnya mengecil dan bergerak ke atas. Tempat yang ditinggalkannya akan diisi oleh
udara dingin dari darat, maka terjadilah angin darat
Gambar 4. Proses terjadinya angin darat dan angin laut
Adapun secara empiris laju perpindahan kalor secara konveksi dapat dirumuskan sebagi berikut.
H = h · A. ∆ t4 ....(2.10)
Keterangan
H : laju perpindahan kalor (W)
A : luas permukaan benda (m² )
∆ T : T2-- T1 perbedaan suhu (K atau ° C)
h : koefisien konveksi (Wm-2K-4 atau Wm-2(°C)4)
3. Radiasi
Diantara matahari dan bumi juga terdapat ruang hampa yang tidak
memungkinkan terjadinya perpindahan kalor. Dengan demikian, perpindahan kalor dari matahari sampai ke bumi tidak memerlukan perantara. Perpindahan
kalor yang tidak memerlukan zat perantara (medium) disebut radiasi
(Nurachmandani, 2009). Setiap benda mengeluarkan energi dalam bentuk radiasi elektromagnetik.
Laju radiasi dari permukaan suatu benda berbanding lurus dengan luas penampang, berbanding lurus dengan pangkat empat suhu mutlaknya, dan
tergantung sifat permukaan benda tersebut. Secara matematis dapat di tulis sebagai berikut (Nurachmandani, 2009):
H=A . e . σ T4 ...(2.11) Keterangan:
H : laju radiasi (W)
A : luas penampang benda (m2)
T : suhu mutlak (K)
e : emisitas bahan