Lampiran 1. Perhitungan Pembuatan Pereaksi
1. 500 ml NaOH 0,03 M dalam etanol 70 % NaOH 0,03 M = V x N X BE
= 500 ml x 0,03 x 40 = 600 mg
(dilebihkan 10 %) = 600 + (10 % x 600 mg)
= 660 mg NaOH ditambah etanol 70 % sampai 500 ml 2. 500 ml NaOH 0,2 M
NaOH 0,2 M = V x N X BE = 500 ml x 0,2 x 40
= 4000 mg
(dilebihkan 10 %) = 4000 + (10 % x 4000 mg)
= 4400 mg NaOH ditambah aquadest sampai 500 ml 3. 50 ml Asam Klorida 2 N
Diencerkan dari Asam Klorida 37% ~ 12 N
V1.NI = V2.N2 V1.12 N = 50.2 N
V1 = 8,33 ml 4. 500 ml Natrium Fosfat 28 mM M =
V(ml) 1000 x Mr gram
0,028 =
500 1000 x 164 gram
5. 500 ml Ammonium Molibdat 4 mM M =
V(ml) 1000 x Mr gram
0,004 =
500 1000 x 1235,86
gram
Jumlah ammonium molibdat unuk 4 mM adalah sebanyak 2,472 gram 6. 500 ml Asam Sulfat 0,6 M
N = M x valensi N = 0,6 M X 2 N = 1,2 N
Diencerkan dari Asam Sulfat 98% ~ 36,8 N V1.NI = V2.N2
Lampiran 2. Perhitungan Penetapan Kadar Abu Total
% Kadar Abu Total =
Sampel Berat
Abu Berat
x 100 %
Berat Sampel ( g) Berat Abu (g)
2,0016 0,0859
2,0012 0,0883
2,0015 0,0906
1. % Kadar =
0016
,
2
0859
,
0
X 100% = 4,29%
2. % Kadar =
0012
,
2
0883
,
0
X 100% = 4,41%
3. % Kadar =
0015
,
2
0906
,
0
X 100% = 4,53%
% Kadar Abu Total Rata- rata =
3
4,53%
4,41%
4,29% + +
Lampiran 3. Perhitungan Penetapan Kadar Abu yang Tidak Larut Asam
% Kadar Abu yang Tidak Larut dalam Asam =
Sampel Berat
Abu Berat
x 100 %
Berat Sampel ( g) Berat Abu (g)
2,0016 0,0181
2,0012 0,0146
2,0015 0,0175
1. % Kadar =
0016
,
2
0181
,
0
X 100% = 0,91%
2. % Kadar =
0012
,
2
0146
,
0
X 100% = 0,73%
3. % Kadar =
0015
,
2
0175
,
0
X 100% = 0,87%
% Kadar Abu yang Tidak Larut Asam Rata-rata =
3
4,53%
4,41%
4,29% + +
Lampiran 4. Perhitungan Susut Pengeringan
% Susut Pengeringan =
Sampel Berat
Kering Berat
x 100 %
Berat Sampel ( g) Berat Kering (g)
2,0013 0,1669
2,0018 0,1552
2,0015 0,1663
1. % Susut Pengeringan =
0013
,
2
1669
,
0
X 100% = 8,34%
2. % Susut Pengeringan =
0018
,
2
1552
,
0
X 100% = 7,75%
3. % Susut Pengeringan =
0015
,
2
1663
,
0
X 100% = 8,31%
% Susut pengeringan Rata- rata =
3
8,31%
7,75%
8,34% + +
Lampiran 5. Perhitungan Persen (%) Rendemen Hemiselulosa Sekam Padi (HSP)
Berat sampel = 50 gram
Berat rendemen = 1,5210 gram % Rendemen =
Sampel Berat
Rendemen Berat
X 100%
= 50 5210 , 1
X 100%
Lampiran 6. Hasil Pengujian Karakeristik dengan Spektofotometri Inframerah
Lampiran 8. Data Hasil Penentuan Panjang Gelombang Maksimum
Lampiran 9. Data Hasil Penentuan Waktu Kerja
Menit Abs
16 0,449
17 0,448
18 0,447
19 0,449
20 0,449
21 0,450
22 0,448
23 0,449
24 0,448
25 0,448
26 0,447
27 0,447
28 0,447
29 0,447
30 0,447
31 0,447
32 0,447
33 0,447
34 0,447
35 0,447
36 0,447
37 0,448
38 0,448
39 0,448
40 0,446
41 0,445
42 0,445
43 0,446
44 0,446
45 0,447
Lampiran 10. Perhitungan kurva kalibrasi Vitamin C
LIB I =
ml 50
mg 50
=
ml 50
µg 50000
= 1000 µg/ml.
Untuk kurva kalibrasi Dari LIB I dipipet
0,8 ml ==>V1.NI = V2.N2 0,8.1000 = 10.N2 N2 = 80 µg/ml
Dari 80 µg/ ml dipipet 0,5 ml dan ditambah 5 ml larutan pereaksi V1.NI = V2.N2
0,5.80 = 5,5.N2 N2 = 7,2727 µg/ml 1,0 ml ==>V1.NI = V2.N2
1.1000 = 10.N2 N2 = 100 µg/ml
Dari 100 µg/ ml dipipet 0,5 ml dan ditambah 5 ml larutan pereaksi V1.NI = V2.N2
0,5.100 = 5,5.N2
N2 = 9,0909 µg/ml 1,2 ml ==>V1.NI = V2.N2
1,2.1000 = 10.N2 N2 = 100 µg/ml
V1.NI = V2.N2 0,5.120 = 5,5.N2
N2 = 10,909 µg/ml
1,4 ml ==>V1.NI = V2.N2 1,4.1000 = 10.N2 N2 = 140 µg/ml
Dari 140 µg/ ml dipipet 0,5 ml dan ditambah 5 ml larutan pereaksi V1.NI = V2.N2
0,5.140 = 5,5.N2
N2 = 12,7272 µg/ml 1,6 ml ==>V1.NI = V2.N2
1,6.1000 = 10.N2 N2 = 160 µg/ml
Dari 160 µg/ ml dipipet 0,5 ml dan ditambah 5 ml larutan pereaksi V1.NI = V2.N2
0,5.160 = 5,5.N2
Lampiran 11. Data kurva kalibrasi Vitamin C pada panjang gelombang 710 nm
Lampiran 12. Perhitungan Persamaan Regresi No . Konsentrasi (X) Absorbansi
(Y) XY X
2
Y2
1. 0,0000 0 0 0 0
2. 7,2727 0,312 2,2690824 52,89216529 0,09734 3. 9,0909 0,384 3,4909056 82,64446281 0,147456
4. 10,909 0,469 5,116321 119,006281 0,219961
5. 12,7272 0,523 6,6563256 161,9816198 0,273529 6. 15,5454 0,609 8,8581486 211,5686612 0,370881
∑X=54,5452 X=9,0909 ∑Y=2,297 Y=0,3828 ∑XY=26,39 08 ∑X2 =628,093
2 ∑Y
2 =1,1092
∑
∑
∑
∑ ∑
− − = n x X n Y X XY a / ) ( / ) . ( 2 2=
628
,
0932
(
54
,
5452
)
2
/
6
6
/
)
297
,
2
.
5452
,
54
(
3908
,
26
−
−
= 0,0423 b = Y- aX= 0,3828 - (0,0423.9,0909) = -0.0017 ) / ) ( )( / ) ( ( / ) . ( 2 2 2 2 n Y Y n X X n Y X XY r
∑
−∑
∑
∑ ∑
∑
−∑
− = ) 6 / ) 297 , 2 ( 1092 , 1 )( 6 / ) 5452 , 54 ( 0932 , 628 ( 6 / ) 297 , 2 . 5452 , 54 ( 3908 , 26 2 2 − − − = r = 0,9994Lampiran 13. Hasil dan Data Pengukuran Kapasitas Antioksidan dari Hemiselulosa Sekam Padi (HSP)
NO.
Berat sampel (gram)
Absorbansi Konsentrasi (µg/ml)
Kapasitas antioksidan ( mg vit C/g sampel )
1 0,0750 0,558 13,23 9,70
2 0,0751 0,561 13,37 9,74
3 0,0752 0,559 13,26 9,70
4 0,0751 0,559 13,26 9,71
5 0,0752 0,564 13,37 9,78
Lampiran 14. Contoh Perhitungan Kapasitas Antioksidan dalam Sampel
Berat sampel yang ditimbang = 0,0750 gram Absobansi (Y) = 0,558
Persamaan regresi : y = 0,0423x - 0,0017 y = 0,0423x - 0,0017
Konsentrasi (x) =
a b) i (absorbans − = 0,0423 0,0017) y ( + = 0,0423 0,0017) 0,558 ( +
= 13,23 µg/ml
Kapasitas Antioksidan (mg vit c/g sampel) = x Fp (µg/ml) sampel
x
X Fp
Kapasitas Antioksidan (mg vit c/g sampel) = kesetaraan jumlah kapasitas antioksidan sampel dalam berat vitamin c
Kadar Antioksidan = x Fp (µg/ml) sampel
x
X Fp
= 13,39 µg/ml X
µg 1000 mg 1 gram 0,075 ml 5 ml 0,5 ml 5 , 5 X X
= 9,70 mg/gram
Lampiran 15. Data perhitungan Analisis Data Statistik
1. Uji Q Q = |
terendah Nilai tertinggi Nilai terdekat yang Nilai -dicurigai yang Nilai |
Q = |
9,61 -9,78 9,70 -9,61 |
Q = 0,5294
Qkritis pada taraf kepercayaan 95% untuk 6 data adalah 0,621
makaQ<Qkritis, sehingga data diterima.
2. Uji t
SD = 1 ) ( 2 − −
∑
n X Xi = 5 0160 , 0 = 0,0566Pada tingkat kepercayaan 95% dengan nilai α = 0,05 dan dk = 5,
diperoleh ttabel = 2,0150. Data diterima jika thitung <
ttabel
t hitumg =
n
SD
X
Xi
|
−
|thitung data 1 = 0,0721
thitung data 2 = 0,2165
X Xi – X Ʃ( Xi - X)2
9,70 0,01 0,0001
9,74 0,03 0,0009
9,70 0,01 0,0001
9,71 0 0
9,78 0,007 0,0049
9,61 0,1 0,0100
thitung data 3 = 0,0721
thitung data 4 = 0
thitung data 5 = 0,0505
thitung data 3 = 0,7215
Semua data diterima,maka
Kadar sebenarnya: μ = X ± (t(α/2, dk) x α SD n) = 9,71 ± 2,5706.0,1386
= 9,71 ± 2,7092 *
Lampiran 16. Perhitungan Hasil Penentuan Batas Deteksi dan Batas Kuantitasi
Simpangan Baku =
1 n Yi) Y ( 2 − −
∑
= 4 000367 , 0= 0,0086
LOD =
slope
3xSB
=0423
,
0
0086
,
0
x
3
= 0,6099 µg/ml
LOQ =
slope
10xSB
=0423
,
0
0086
,
0
x
10
= 2,033 µg/ml
X Y Yi y – yi (y - yi)2
0 0 0 0 0
7,2727 0,314 0,306 0,008 0,000064
9,0909 0,384 0,383 0,001 0,000001
10,909 0,469 0,460 0,009 0,000081
12,7272 0,523 0,537 0,014 0,000196
14,5454 0,609 0,614 0,005 0,000025
Lampiran 17. Perhitungan Hasil Nilai Standar Deviasi (SD) dan Relative Standar Deviasi (RSD)
X Xi – X Ʃ( Xi - X)2
9,70 0,01 0,0001
9,74 0,03 0,0009
9,70 0,01 0,0001
9,71 0 0
9,78 0,007 0,0049
9,61 0,1 0,0100
X = 9,71 Ʃ( Xi - X)2 = 0,0160
SD =
( )
1 -n
X -Xi 2
∑
SD =
5 0160 , 0
SD = 0,0566
RSD = x100% X
SD
RSD =
x
100
%
71
,
9
0566
,
0
Lampiran 18. Data dan Contoh Perhitungan Uji Akurasi dengan Persen Perolehan Kembali (% Recovery)
Contoh Perhitungan
Konsentrasi sampel yang diperoleh setelah penambahan larutan baku (CF)
Absobansi (Y) = 0,591
Persamaan regresi : y = 0,0423x - 0,0017 y = 0,0423x - 0,0017
Konsentrasi CF =
a b) i (absorbans − = 0,0423 0,0017) y ( + = 0,0423 0,0017) 0,591 ( +
= 14,01 µg/ml
Komsentrasi konsentrasi sampel awal (CA)
Absobansi (Y) = 0,558
Persamaan regresi : y = 0,0423x - 0,0017 y = 0,0423x - 0,0017
No. Abs CF CF
(µg/ml) Abs CA
CA (µg/ml) C*A (µg/ml) % recovery (%)
1 0,591 14,01 0,558 13,23 0,909 85,81
2 0,595 14,12 0,561 13,30 0,909 90,21
3 0,595 14,12 0,559 13,26 0,909 94,61
4 0,594 14,08 0,559 13,26 0,909 90,21
5 0,596 14,13 0,564 13,37 0,909 83,61
6 0,586 13,89 0,552 13,09 0,909 88,01
Konsentrasi CA = a b) i (absorbans − = 0,0423 0,0017) y ( + = 0,0423 0,0017) 0,558 ( +
= 13,23 µg/ml
Konsentrasi larutan baku yang ditambahkan (C*A)
LIB I =
ml 50 mg 50 = ml 50 µg 50000
= 1000 µg/ml.
Dari LIB I dipipet
1,0 ml ==>V1.NI = V2.N2 1,0.1000 = 10.N2 N2 = 100 µg/ml
Dari 100 µg/ml dipipet 0,5 ml dan dimasukkan ke labu tentukur 5 ml yang telah diisi sampel
V1.NI = V2.N2 0,5.100 = 5.N2
N2 = 10 µg/ml
Dari labu tentukur 5 ml yang berisi larutan baku 10 µg/ml dipipet 0,5 ml dan ditambah 5 ml larutan pereaksi
V1.NI = V2.N2 0,5.10 = 5,5.N2
Keterangan : * maka konsentrasi larutan baku yang ditambahkan adalah sebesar 0,909 µg/m
% Recovery = A
A F
* C
C C −
x 100%
% Recovery =
909 , 0
13,23 -01 , 14
x 100%
= 85,81%
Perhitungan peroleham kembali (%) kapasitas antioksidan pada sampel lain dapat dihitung dengan cara yang sama seperti contoh diatas.
DAFTAR PUSTAKA
Antolovich, M., Prenzler, P.D., Patsalides, E., McDonald, S., dan Robards, K. (2002). Methods for Testing Antioxidant Activity. Analyst. 127: 183-198.
Anonim. (2010). Sekam Padi Sebagai Sumber Energi Alternatif dalam Rumah Tangga Petani. Diunduh dari
Apak, R., Guclu, K., Demirata, B., Ozyurek,M., Celik, S.E., Bektasoglu, B., Berker, I.K., dan Ozyurt, D. (2007). Comparative Evaluation of Various Total Antioxidant Capacity Assays Applied to Phenolic Compounds with the CUPRAC Assay. Molecules 12: 1496-1547.
Boer, Y. (2000). Uji Aktivitas Antioksidan Ekstrak Kulit Buah Kandis (Garcinia parvifolia Miq). Jurnal Matematika dan IPA 1(3): 26-33. Carvalheiro, F., Duarte, L.C., dan Girio, F.M. (2008). Hemicellulose
biorefineries: a review on biomass pretreatments. Journal of Scientific & Industrial Research 67: 849-864.
Caprita,R., Caprita, A., dan Julean, C. (2010). Biochemical Aspects of Non-Starch Polysaccharides. Journal Animals Sciences and Biotechnologies 43(1).
Christian, G.D. (2004). Analytical Chemistry. Edisi VI. New Jersey: John Wiley & Sons, Inc. Hal. 128-132.
Ermer, J. dan Miller, J.H.M. (2005). Method Validation in Pharmaceutical Analysis. Weinheim: Wiley-Vch Verlag Gmbh & Co. KGaA. Hal. 171.
Dachriyanus. (2004). Analisis Struktur Senyawa Organik Secara Spektroskopi. Cetakan Pertama. Padang: Andalas University Press. Hal 21-23.
Depkes, RI. (1995). Materia Medika Indonesia. Jilid V. Jakarta: Departemen Kesehatan RI. Hal. 324-325.
Ditjen POM. (1979). Farmakope Indonesia. Edisi ketiga. Jakarta: Departemen Kesehatan R.I. Hal. 4, 6, 66, 262, 296, 579, 639, 744, 748, 793.
Dumitriu, S. (2005). Polysacharides: Structural Diversity and Functional Versatility. New York: Marcel Dekker. Hal. 24.
Gandjar, I.G. dan Rohman, A. (2007). Kimia Farmasi Analisis. Cetakan III. Yogyakarta: Pustaka Pelajar. Hal. 223, 252-256.
Harmita (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya. Majalah Ilmu Kefarmasian 1(3): 117-135.
Karaaslan, A.M., Tshabalala, M.A., dan Buschle, D.G. (2010). Wood Hemicellulose/ Chitosan Basedsemi-Interpenetrating Networks Hydrogels: Mechanical, Swelling and Control Drug Release Properties. Journal BioResources 5(2): 1036-1054.
Khopkar, S.M. (1998). Basic Concepts of Analytical Chemistry. Second Edition. New Delhi: New Age International. Hal 189, 194-196.
Kosasih, E.N., Tony, S., dan Hendro, H. (2004). Peran Antioksidan pada Lanjut Usia. Jakarta: Pusat Kajian Nasional Masalah Lanjut Usia. 56-57.
Kukic, J., Silvana, P., dan Marjan, N. (2006). Antioxidant Activity of Four Endemic Stachys Taxa. Biol Pharm Bull 29(4): 725-729.
Kumalaningsih, S. (2006). Antioksidan Alami. Surabaya: Trubus Agrisarana. Hal. 8, 16-18.
Lingga, L. (2012). The Healing Power of Anti-oxidant. Jakarta: Penerbit PT Elex Media Komputindo. Halaman 1-2, 26-27, 69, 161-162.
Meydani, S.N., Meydani, M., dan Blumberg, J.B. (1995). Antioxidants and Immune Response in Aged Persons : Overview of Present Evidence. American Journal of Clinical Nutrition 62 : 1462 -1476.
Muchlisyam, Harahap, U., dan Silalahi, J. (2011). Isolasi dan Karakteristik Hemiselulosa Tongkol Jagung. Media Farmasi 17(1): 35-43.
Melo, S.R.F., Fidelis, G.P., Costa, M.S.S.P., Telles, C.B.S., Dantas-Santos, N., Elias. S.O., Ribeiro, V.B., Barth, A.L., Macedo, A.J., Leite, E.L., dan Rocha, H.A.O. (2012). In Vitro Antioxidant, Anticoagulant and Antimicrobial Activity and in Inhibition of Cancer Cell Proliferation by Xylan Extracted from Corn Cobs. International Journal of Molecular Sciences. 13: 409-426.
Saha, C.B. (2003). Hemicellulose bioconversion. Journal Microbiologie Biotechnologie 30(16): 279-291.
Sudjana. (2005). Metode Statistika. Edisi Keenam. Bandung: Penerbit Tarsito. Hal. 168, 371.
BAB III
METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian dilakasanakan pada bulan Oktober 2012 sampai Maret 2013, penelitian dilakasanakan di laboratorium penelitian dan laboratorium kimia analisis II (kuantitatif) Fakultas Farmasi USU.
3.2 Alat
Alat-alat yang digunakan dalam penelitian adalah spektrofotometer sinar ultra violet (Shimadzu), FTIR (Shimadzu), KCKT lengkap (Shimadzu Prominience series) dengan pompa (LC 20 AD), degasser (DGU 20 A5),
injektor (Rheodyne 7225i), kolom Shim-Pack VP-ODS (4,6 x 250 mm), detektor UV/VIS (SPD 20 A), neraca analitis (Sartorius, Metler Toledo), sentrifuge (Hitachi), oven (Memmert), Hot plate, tanur (Stuart), desikator, blender (Kris), kertas saring Whatman No. 1 dan No.42, krus porselen, spatula, termometer dan alat-alat gelas lainnya (Pyrex dan Oberol).
3.3 Sampel dan Bahan- bahan 3.3.1 Sampel
Metode pengambilan sampel yang digunakan adalah metode purposif
representatif. Sampel merupakan sekam padi yang diambil di daerah Pangkalan Susu, kabupaten Langkat, Sumatera Utara.
3.3.2 Bahan- bahan
Bahan- bahan yang digunakan dalam penelitian ini berkualitas pro analisis yaitu asam asetat glasial 96% (E. Merck), asam klorida 37% (E. Merck),asam sulfat96% (E. Merck), ammonium molibdat (E. Merck), etanol 95% (E. Merck), hidrogen peroksida30% (E. Merck), metanol grade for HPLC (E. Merck), natrium hidroksida (E. Merck), natrium fosfat (E. Merck), kecuali aquabidest (Laboratorium Penelitian Fakultas Farmasi USU), aquadest (CV. Rudang Jaya) dan vitamin C baku pabrik (CSPS Weisheng Pharmaceutical).
3.4 Pembuatan Pereaksi
3.4.1 Pembuatan etanol 70% v/v
Diencerkan 368,5 ml etanol 95% v/v dengan air secukupnya hingga 500 ml (Ditjen POM, 1979).
3.4.2 Pembuatan Aquadest Bebas CO2
Dididihkan Aquadest kuat-kuat dalam beaker glass selama 5 menit atau lebih dan diamkan sampai dingin dan tidak boleh menyerap karbondioksida dari udara (Ditjen POM, 1979).
3.4.3 Pembuatan Larutan NaOH 0,03 M dalam etanol 70%
3.4.4 Pembuatan Larutan NaOH 0,2 M
Dilarutkan 4,4 gram NaOH dalam aquades bebas CO2 secukupnya
hingga 500 ml (Ditjen POM, 1979). Data dapat dilihat pada Lampiran 1. 3.4.5 Pembuatan Larutan Hidrogen Peroksida 3% v/v
Diencerkan 15 ml H2O2 30% dalam 150 ml air, kemudian
dihomogenkan (Ditjen POM, 1979). 3.4.6 Pembuatan Asam Asetat 10% v/v
Diencerkan 10 ml asam asetat glasial dengan air secukupnya hingga 50 ml (Ditjen POM, 1979).
3.4.7 Pembuatan Asam Klorida 2 N
Diencerkan 8,33 ml HCl 37% dengan air secukupnya hingga 50 ml
(Ditjen POM, 1979). Data dapat dilihat pada Lampiran 1. 3.4.8 Pembuatan Asam Klorida 1% v/v
Diencerkan 0,37 ml HCl 37% dengan air secukupnya hingga 10 ml
(Ditjen POM, 1979).
3.4.9 Pembuatan Larutan NaOH 1% b/v
Dilarutkan 0,1 gram NaOH dalam aquades bebas CO2 secukupnya
hingga 10 ml (Ditjen POM, 1979). 3.4.10 Pembuatan Larutan Pereaksi
secukupnya hingga 500 ml (Melo, et al., 2012). Data dapat dilihat pada Lampiran 1.
3.5 Prosedur Penelitian 3.5.1 Preparasi Sekam Padi
Preparasi diawali dengan mengeringkan sekam padi dan dihaluskan
dengan cara diblender. Serbuk kemudiaan diayak dengan mesh 40, serbuk halus ini digunakan untuk karakteristik sekam padi.
3.5.2Karakteristik Sekam Padi (Oryza sativa) 3.5.2.1Pemeriksaan Organoleptis
Pemeriksaan organoleptis meliputi bau, warna serta rasa. 3.5.2.2 Penetapan Kadar Abu Total
Ditimbang seksama sebanyak 2 gram serbuk sekam padi , kemudian dimasukkan ke dalam krus porselin yang telah dipijar dan ditara, lalu diratakan. Krus dipijarkan pada suhu 600°C sampai arang habis, kemudian didinginkan dan ditimbang sampai diperoleh berat konstan. Kadar abu dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.5.2.3Penetapan Kadar Abu yang Tidak Larut dalam Asam
konstan, kemudian didinginkan dan ditimbang. Kadar abu tidak larut dalam asam dihitung terhadap bahan yang dikeringkan (Depkes RI, 1995).
3.5.2.4Susut Pengeringan
Ditimbang sebanyak 1 gram serbuk sekam padi dan dimasukkan ke dalam krus porselein yang telah ditimbang konstan, lalu dipanaskan pada suhu 105°C selama 1 jam, kemudian ditimbang hingga berat konstan (Ditjen POM, 1979).
3.5.3 Isolasi Hemiselulosa Sekam Padi (HSP)
Metode yang digunakan untuk isolasi Hemiselulosa dari sekam padi adalah sebagi berikut: ditimbang sebanyak 50 gram serbuk sekam padi, kemudian dimasukkan ke dalam beaker glass lalu ditambahkan 500 ml NaOH 0,03 M dalam etanol 70% dan dipanaskan pada suhu 60°C dan diaduk selama 2 jam untuk melarutkan lignin. Suspensi tersebut dibiarkan mendingin ke suhu kamar dan disaring dengan kertas saring whatman No.1. Residu ditambahkan 500 ml NaOH 0,2 M, dan diaduk selama 8 jam pada suhu kamar untuk melarutkan hemiselulosa lalu disaring. Filtrat dipanaskan pada suhu 65°C, dan ditambahkan 137 ml H2O2 3% secara bertahap. Setiap penambahan H2O2 3% 1
3.5.4Karakteristik Hemiselulosa Sekam padi (HSP)
3.5.4.1Pemeriksaan Organoleptis
Pemeriksaan organoleptis meliputi bau, warna serta rasa. 3.5.4.2 Kelarutan
Ditimbang sebanyak 50 mg HSP, kemudian dilarutkan dalam 1 ml aquades, aquades 80°C, HCl 1%, dan NaOH 1% dan dibandingkan kelarutannya (Ditjen POM, 1979).
3.5.4.3Pengujian karakeristik dengan Spektofotometri Inframerah
Ditimbang sebanyak 1 mg HSP dan 100 mg kalium bromida. Kemudian dimasukkan ke dalam lumpang,digerus hingga homogen yang selanjutnya dianalisis pada rentang bilangan gelombang 4000–500 cm-1 dan direkam spektrum Inframerahnya (Muchlisyam, dkk., 2011).
3.5.4.4Pengujian karakeristik dengan Kromatografi Cair Kinerja Tinggi (KCKT)
3.5.5 Pengujian Kapasitas Antioksidan Hemiselulosa Sekam Padi (HSP)
3.5.5.1 Pembuatan Larutan Induk Baku Vitamin C
Ditimbang setara 50 mg Vitamin C, kemudian dimasukkan ke dalam labu tentukur 50 ml, dan dilarutkan dengan aquadest sampai garis tanda. Diperoleh konsentrasi Vitamin C pada Larutan Induk Baku (LIB) I adalah 1000 µg/ml.
3.5.5.2 Penentuan Panjang Gelombang Maksimum
Dari LIB I dipipet 1,2 ml dimasukkan ke dalam labu tentukur 10 ml, dicukupkan volumenya dengan aquadest hingga garis tanda untuk mendapatkan konsentrasi 120 µg/ml. Dipipet 0,5 ml dan dicampur dengan 5 ml larutan pereaksi sehingga diperoleh konsentrasi 10,909 µg/ml. Kemudian diinkubasi selama 90 menit pada suhu 95°C-100°C dan didinginkan pada suhu kamar kemudian diukur absorbansi dari kompleks fosfomolibdenum pada panjang gelombang 400-800 nm.
3.5.5.3 Penentuan Waktu Kerja (Operating time)
3.5.5.4 Pengukuran Kurva Kalibrasi Vitamin C
Dari LIB I dipipet 0,8 ml, 1 ml, 1,2 ml, 1,4 ml dan 1,6 ml ke labu tentukur 10 ml, dicukupkan volumenya dengan aquadest hingga garis tanda untuk mendapatkan konsentrasi 80 µg/ml, 100 µg/ml, 120 µg/ml, 140 µg/ml dan 160 µg/ml. Dipipet 0,5 ml dan dicampur dengan 5 ml larutan pereaksi kemudian diinkubasi selama 90 menit pada suhu 95°C-100°C dan didinginkan pada suhu kamar kemudian diukur absorbansi dari kompleks fosfomolibdenum pada panjang gelombang maksimum yang didapat. Data perhitungan dapat dilihat pada Lampiran 10.
3.5.5.5Penetapan Kapasitas Antioksidan dari Hemiselulosa Sekam Padi (HSP)
Ditimbang sebanyak 75 mg HSP, kemudian dimasukkan ke dalam labu tentukur 5 ml, dan dilarutkan dengan aquadest sampai garis tanda. Dipipet 0,5 ml dan dicampur dengan 5 ml larutan pereaksi kemudian dicukupkan volumenya dengan aquadest dan diinkubasi selama 90 menit pada suhu 95°C-100°C dan didinginkan pada suhu kamar kemudian diukur absorbansi dari kompleks fosfomolibdenum pada panjang gelombang maksimum yang didapat. Data pengamatan dapat dilihat pada Lampiran 13.
3.6 Uji Validasi Metode
3.6.1 Penentuan Batas Deteksi dan Batas Kuantitasi
merupakan kuantitas terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama.
Menurut Harmita (2004), batas deteksi dan batas kuantitasi dapat dihitung dengan rumus sebagai berikut:
Simpangan Baku =
2 n Yi) Y ( 2 − −
∑
LOD = slope SB x 3 LOQ = slope SB x 10 3.6.2 Uji PresisiUji presisi (keseksamaan) ditentukan dengan parameter relatif standar deviasi (RSD). Menurut Harmita (2004), rumus perhitungan standar deviasi (SD):
SD =
( )
1 -n X -Xi 2
∑
RSD = x100% X
SD
Keterangan :
RSD = Relatif standar deviasi (%) SD = Standar deviasi
3.6.3 Uji Akurasi dengan Persen Perolehan Kembali (% Recovery)
Uji perolehan kembali atau recovery dilakukan dengan menambahkan larutan baku Vitamin C 1000 µg/ml yang jumlahnya telah diketahui kedalam sampel kemudian dianalisis dengan perlakuan yang sama seperti pada sampel.
Menurut Harmita (2004), perolehan kembali atau recovery dapat dihitung dengan rumus sebagai berikut:
% Recovery = A A F * C C C − x 100%
Keterangan : CF = konsentrasi sampel yang diperoleh setelah penambahan baku
CA = konsentrasi sampel awal
C*A = konsentrasi larutan baku yang ditambahkan
3.7 Analisis Data Secara Statistik
Kadar antioksidan yang diperoleh dari hasil pengukuran masing-masing 6 larutan sampel, diuji secara statistik dengan uji Q. Menurut Gandjar dan Rohman (2007), nilai Q merupakan sebagai berikut:
| % x100 terendah nilai tertinggi Nilai terdekat yang Nilai -dicurigai yang Nilai | Q=
[image:37.595.116.516.638.730.2]Hasil pengujian atau nilai Q yang diperoleh ditinjau terhadap daftar harga Qkritis pada Tabel 3.1, apabila Q>Qkritis maka data tersebut ditolak.
Tabel 3.1. Nilai Qkritis pada Taraf Kepercayaan 95%
Banyak data Nilai Qkritis
4 0,831
5 0,717
6 0,621
7 0,570
Menurut Sudjana (2005), kadar dapat dihitung dengan persamaan garis regresidan untuk menentukan data diterima atau ditolak digunakan rumus:
t hitumg = |
n SD
X Xi−
|
Menurut Sudjana (2005), dengan dasar penolakan apibila thitung > ttabel.
Untuk menentukan kadar antioksidan di dalam sampel dengan interval
kepercayaan 95%, α = 0,05, dk = n-1, dapat digunakan rumus:
μ = X ± (t(α/2, dk) x α SD n)
Keterangan : µ = interval kepercayaan X = kadar rata-rata sampel
t = harga t tabel sesuai dengan dk = n-1
α = tingkat kepercayaan SD = standar deviasi
BAB IV
HASIL DAN PEMBAHASAN
4.1 Karakteristik Serbuk Sekam Padi (Oryza sativa)
Dilakukan karakteristik serbuk sekam padi meliputi organoleptis, penetapan kadar abu, kadar abu total serta susut pengeringan.
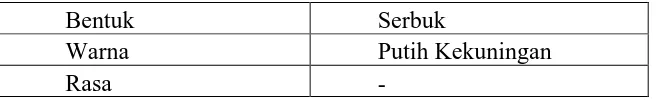
4.1.1 Organoleptis Meliputi Bentuk, Warna dan Rasa
[image:39.595.143.472.376.426.2]Dilakukan karakteristik serbuk sekam padi secara organoleptis yang meliputi bentuk, warna dan rasa. Hasil dapat dilihat pada Tabel 4.1
Tabel 4.1 Hasil Organoleptis Serbuk Sekam Padi (Oryza sativa)
Dari Tabel 4.1 dapat dilihat bahwa organoleptis serbuk sekam padi mempunyai warna putih kekuningan.
4.1.2 Karakteristik Mutu Serbuk Sekam Padi (Oryza sativa)
Hasil analisis meliputi penetapan kadar abu total, kadar abu yang tidak larut dalam asam dan susut pengeringan dapat dilihat pada Tabel 4.2
Tabel 4.2 Karakteristik Serbuk Sekam Padi (Oryza sativa)
Karakteristik Rata-rata (%)
Kadar Abu Total 4,41
Kadar Abu yang Tidak Larut dalam Asam 0,81
Susut Pengeringan 8,13
Dari Tabel 4.2 dapat dilihat bahwa karakteristik serbuk sekam padi mempunyai susut pengeringan sebesar 8,13%, kadar abu total 4,41%, dan
Bentuk Serbuk
Warna Putih Kekuningan
kadar abu yang tidak larut dalam asam 0,81%. Kadar abu menunjukkan terdapat mineral - mineral yang tidak larut dalam asam seperti silika dan pasir pada sampel. Data perhitungan dapat dilihat pada Lampiran 2,3 dan 4.
4.2. Isolasi Hemiselulosa Sekam Padi (HSP)
Metode isolasi hemiselulosa sekam padi yang dilakukan adalah metode modifikasi yang dikembangkan oleh Muchlisyam, dkk., 2011. Metode isolasi terlebih dahulu menggunakan pelarut NaOH di dalam etanol 70%, H2O2 umtuk
proses delignifikasi. Kemudian digunakan pelarut NaOH dan didiamkan selama 8 jam untuk melarutkan hemiselulosa kemudian disaring untuk memisahkan ampas yang mengandung selulosa karena selulosa mengendap pada suasana basa pada pH 11 - 12 (Dumitriu, 2005). Penambahan asam dan etanol digunakan untuk mengendapkan hemiselulosa, kemudian ditambahkan etanol yang akan menyebabkan hemiselulosa mengendap atau menggumpal sehingga mudah dipisahkan.
Berdasarkan percobaan yang dilakukan didapatkan persen (%) rendemen hemiselulosa hasil isolasi sekam padi sebesar 3,04%. Data dapat dilihat pada Lampiran 5.
4.3 Karakteristik Hemiselulosa Sekam Padi (HSP)
4.3.1 Organoleptis meliputi bentuk, warna dan rasa
Dilakukan karakteristik serbuk sekam padi secara organoleptis yang meliputi bentuk, warna dan rasa. Hasil dapat dilihat pada Tabel 4.3
Tabel 4.3 Hasil Organoleptis Hemiselulosa Sekam Padi (HSP)
Bentuk Serbuk
Warna Putih Kekuningan
Rasa -
Dari Tabel 4.3 dapat dilihat bahwa warna hemselulosa sekam padi berwarna putih kekuningan, hal ini berbeda dengan literatur yang menyebutkan hemiselulosa berwarna putih. Hal ini mungkin disebabkan masih terdapat lignin yang mengganggu keputihan hemiselulosa. Dimana proses delignifikasi lignin tidak sempurna, karena pada proses ini tidak dilakukan terlebih dahulu bilangan kappa (Muchlisyam, dkk., 2011).
4.3.2Kelarutan
[image:41.595.152.485.559.620.2]Kelarutan dari HSP yang didapatkan dapat dilihat pada Tabel 4.4 Tabel 4.4 Uji Kelarutan Hemiselulosa Sekam Padi (HSP)
Aquades Sukar larut
Aquades 80°C Larut
HCl 1 % Tidak Larut
NaOH 1% Larut
membentuk larutan yang transparan serta tidak larut dalam asam dan sangat mudah larut dalam NaOH 1% (Carvalheiro, et al., 2008).
4.3.3Karakteristik HSP dengan Spektrum Inframerah
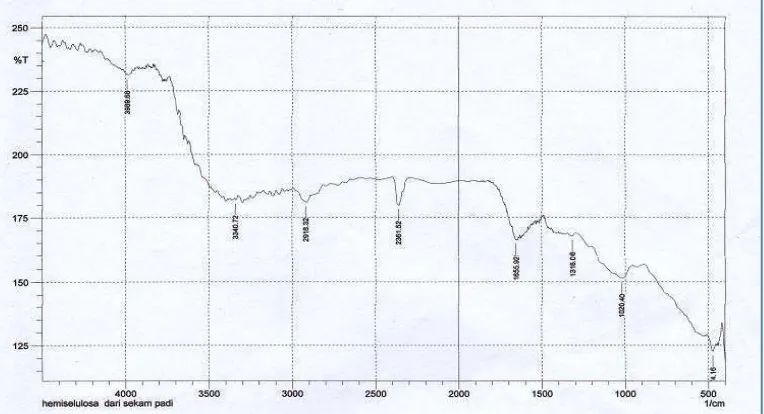
[image:42.595.116.498.377.584.2]Hasil uji karakeristik dengan Spektrofotometri Inframerah dianalisis pada rentang bilangan gelombang 4000–500 cm-1 dan direkam spektrum Inframerahnya. KBr digunakan untuk membantu dalam proses pemadatan senyawa sampel yang akan dianalisis. KBr merupaka senyawa yang tidak terbaca pada IR sehingga hasil yang terbaca pada IR adalah hanya senyawa sampel saja. Hasil pengujian karakteristik HSP dengan spektrofotometri inframerah dapat dilihat pada Gambar 4.1
Gambar 4.1 Karakteristik HSP dengan IR
menunjukkan adanya gugus CH2 dan CH3, vibrasi pada bilangan gelombang
1655,92 cm-1 menunjukkan adanya gugus karboksil, dan bilangan gelombang 1020,4 cm-1 dengan intensitas lemah menunjukkan adanya gugus C-OH dan gugus C-O-C (Melo, et al., 2012). Data pengamatan dapat dilihat pada Lampiran 6. Dari penelitian yang dilakukan sebelumnya, dapat disimpulkan bahwa senyawa yang dianlisis merupakan hemiselulosa oleh karena mengandung gugus OH pada bilangan gelombang 3400 - 2400 cm-1 dan gugus karboksil pada bilangan gelombang 1820 – 1600 cm-1 (Muchlisyam, dkk., 2011).
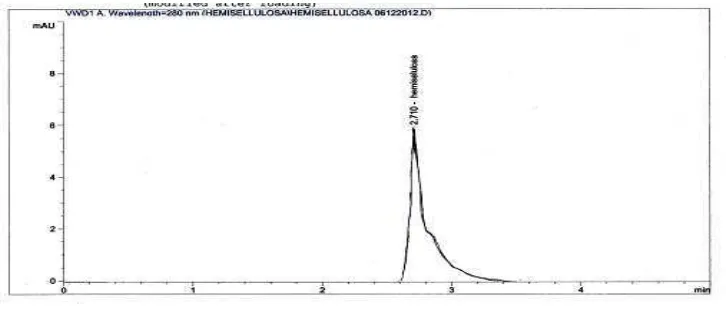
4.3.4 Karakteristik HSP dengan Kromatografi Cair Kinerja Tinggi (KCKT)
Karakteristik kromatogram hemiselulosa sekam padi (HSP) dengan KCKT dilakukan dengan menggunakan kolom C18 dengan pelarut aquades laju
alir 0,8 ml/menit serta detektor sinar ultra violet pada panjang gelombang 280 nm.
Gambar 4.2 Karakteristik HSP dengan KCKT
Dari Gambar 4.2 dapat dilihat hasil KCKT memberikan waktu retensi 2,710 menit, tinggi puncak 6,0841, luas area 0,0912 dan harga simetris sebesar 0,24. Data pengamatan dapat dilihat pada Lampiran 7. Apabila dibandingkan dengan Hemiselulosa tongkol jagung yang dilakukan peneliti sebelumnya, waktu retensi yang didapatkan sebesar 1,8 menit oleh karena digunakan panjang kolom yang berbeda dimana hemiselulosa tongkol jagung menggunakan panjang kolom 15 cm sedangkan hemiselulosa sekam padi menggunakan panjang kolom 25 cm (Muchlisyam, dkk., 2011). Dari hasil KCKT dapat disimpulkan bahwa senyawa yang diisolasi merupakan hemiselulosa.
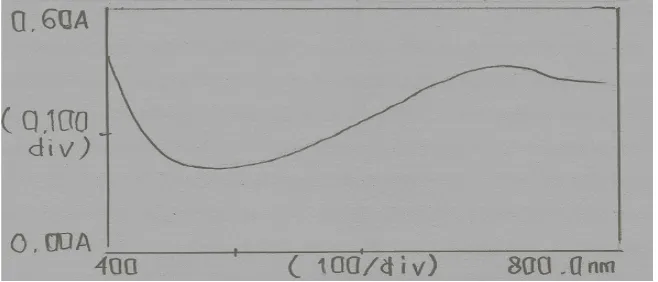
4.4 Kapasitas Antioksidan Hemiselulosa Sekam Padi (HSP) 4.4.1 Panjang Gelombang Maksimum
diinkubasi selama 90 menit pada suhu 95°C-100°C diukur pada rentang panjang gelombang 400 - 800 nm. Hal ini dilakukan karena pada panjang gelombang maksimum kepekaanya juga maksimum dan disekitar panjang gelombang maksimun kurva absorbansi datar dan pada kondisi tersebut hukum Lambert-Beer akan terpenuhi (Gandjar dan Rohman, 2007). Kurva serapan pengukuran Mo (V) dengan larutan pereaksi dapat dilihat pada Gambar 4.3.
Gambar 4.3 Kurva Serapan Maksimum Pengukuran Mo (V) dengan Larutan Pereaksi
Dari Gambar 4.3 dapat dilihat bahwa penetapan pengukuran kompleks fosfomolibdenum dengan larutan pereaksi dilakukan pada panjang gelombang 710 nm. Hal ini sesuai dengan literatur dimana warna hijau kebiruan diserap pada panjang gelombang 610-750 nm (Gandjar dan Rohman, 2007). Data pengamatan dapat dilihat pada Lampiran 8.
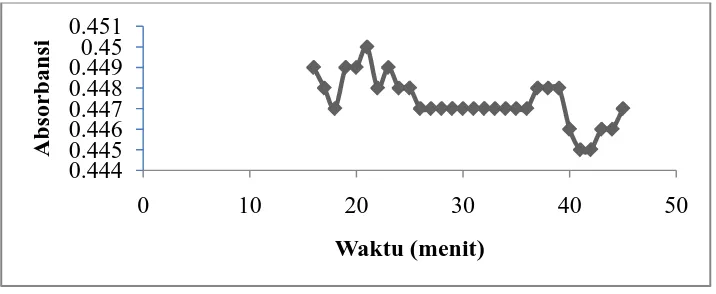
4.4.2 Waktu Kerja (Operating Time)
Kurva penentuan waktu kerja dapat dilihat pada Gambar 4.4. Data
[image:45.595.142.471.265.406.2]Gambar 4.4 Kurva Waktu Kerja
Dari Gambar 4.4 menunjukkan penentuan waktu kerja pengukuran kompleks fosfomolibdenum secara spektrofotometri sinar tampak dilakukan selang waktu satu menit selama 30 menit. Dari kurva di atas terlihat waktu pengukuran terbaik ialah pada menit ke-26 hingga menit ke-36. Sehingga, dapat disimpulkan bahwa pengukuran kompleks Mo (V) dengan larutan peraksi stabil selama 11 menit.
4.4.3 Kurva Kalibrasi Vitamin C
Pembuatan kurva kalibrasi Vitamin C dilakukan dengan membuat seri larutan kerja Vitamin C 1000 µg/ml dengan berbagai konsentrasi yaitu 7,2727; 9,0909; 10,909; 12,7272; 14,5454 µg/ml, kemudian diukur serapannya pada panjang gelombang maksimum yang didapat yaitu 710 nm. Linearitas kurva kalibrasi Vitamin C dapat dilihat pada Gambar 4.5. Data pengamatan dapat dilihat pada Lampiran 11.
0.444 0.445 0.446 0.447 0.448 0.4490.45 0.451
0 10 20 30 40 50
A
bs
or
ban
si
Gambar 4.5 Kurva Kalibrasi Vitamin C pada Panjang Gelombang 710 nm Dari Gambar 4.5 menunjukkan dari kurva kalibrasi di atas diperoleh hubungan yang linear antara konsentrasi dengan absorbansi.Persamaan garis yang diperoleh adalah Y = 0,0423x - 0,0017, dengan koefisien kolerasi (r) sebesar 0,9994. Dari hasil tersebut, dapat dikatakan terdapat korelasi yang positif antara kadar dengan serapan, artinya dengan meningkatnya konsentrasi maka absorbansi juga akan meningkat. Besar hubungannya ditentukan oleh koefisien kolerasi (r) yakni 0,9994 (99,94%). Hal ini berarti terdapat 99,94% data yang memiliki hubungan linear (Sudjana, 2005). Data pengukuran dapat dilihat pada Lampiran 12.
4.4.4 Penetapan Kapasitas Antioksidan dari Hemiselulosa Sekam Padi (HSP)
Hasil pengukuran kapasitas antioksidan dari hemiselulosa hasil isolasi sekam padi didasarkan atas pembentukan kompleks fosfomolibdat. Metode ini didasarkan terjadi reduksi dari Mo (VI) menjadi Mo (V) oleh senyawa antioksidan (Melo, et al., 2012). Pemeriksaan secara kulitatif menunjukkan adanya aktivitas antioksidan pada HSP yang ditunjukkan dengan terbentuknya
y = 0.0423x - 0.0017 R² = 0.999 0.000
0.200 0.400 0.600 0.800
0.0000 5.0000 10.0000 15.0000 20.0000
A
bs
or
ban
si
warna hijau oleh kompleks fosfomolibdat pada suasana asam. Secara kuantitatif, kapasitas antioksidan dari HSP didapatkan sebesar (9,71 ± 2,7092) mg vitamin C/gram sampel. Artinya kapasitas antioksidan 1 gram sampel HSP setara dengan (9,71 ± 2,7092) mg vitamin C. Data dapat dilihat pada Lampiran 15. Hemiselulosa merupakan salah satu karbohidrat yang dilaporkan memiliki aktivitas antioksidan. Hemiselulosa mengandung gula pereduksi pada rantai cabang seperti D-mannosa, D-galaktosa, D-fruktosa, dan pentosa-pentosa seperti D-xilosa dan L-arabinosa sehingga mempunyai aktivitas antioksidan (Melo, et al., 2012).
4.5 Validasi Metode
Validasi metode yang dilakukan yaitu uji akurasi dengan parameter persen perolehan kembali (% recovery) dan uji presisi dengan parameter standar deviasi (SD), relative standar deviasi (RSD), batas deteksi dan batas kuantitasi.
Syarat dari RSD tidak boleh lebih dari 16% untuk ppm (part per million) dan 32% untuk ppb (part per billion) (Harmita, 2004). Batas deteksi
dan kuantitasi yang diperoleh pada penelitian ini yaitu 0,6099 µg/ml dan 2,033 µg/ml. Data perhitungan dapat dilihat pada Lampiran 16.
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
a. Isolasi hemiselulosa dari sekam padi dengan menggunakan metode yang dipakai dapat dilakukan dan didapatkan persen (%) rendemen sebesar 3,04%.
b. Pemeriksaan kualitatif antioksidan dari hemiselulosa sekam padi dengan pereaksi fosfomolibdat memberikan warna hijau di mana reduksi dari Mo (VI) menjadi Mo (V) oleh antioksidan membentuk kompleks fosfat dengan Mo (V) yang berwarna hijau pada suasana asam.
c. Kapasitas antioksidan dari HSP berbeda dengan kapasitas antioksidan vitamin C dimana didapatkan kapasitas antioksidan 1 gram sampel setara dengan (9,71 ± 2,7092) mg vitamin C.
5.2 Saran
a. Disarankan kepada peneliti selanjutnya untuk melakukan isolasi hemiselulosa dari sampel yang berbeda.
BAB II
TINJAUAN PUSTAKA
2.1 Sekam Padi
Sekam Padi merupakan lapisan keras yang meliputi kariopsis yang terdiri dari dua belahan yang disebut lemma dan palea yang saling bertautan. Pada proses penggilingan beras sekam padi akan terpisah dari butir beras dan menjadi bahan sisa atau limbah penggilingan. Sekam padi dikategorikan sebagai biomassa yang dapat digunakan untuk berbagai kebutuhan seperti bahan baku industri, pakan ternak dan energi atau bahan bakar. Dari proses penggilingan padi biasanya diperoleh sekam padi sekitar 20-30%, dedak antara 8-12% dan beras gilingan antara 50-63,5% dari bobot awal gabah. Sekam padi dengan persentase yang tinggi tersebut dapat menimbulkan masalah lingkungan (Anonim, 2010).
2.2 Hemiselulosa
Indonesia merupakan negara pertanian sebagai penghasil beras, jagung, tebu dan kakao. Dalam proses pengolahan hasil pertanian, selain dihasilkan bagian yang bermanfaat, tetapi juga menghasilkan produk ikutan (by product) yang merupakan Non-Starch Polysaccarides (NSP), yang jumlahnya 30-50% dari keseluruhan proses pengolahan hasil pertanian (Caprita, et al., 2010).
polisakarida merupakan sumber daya terbarukan (renewable sources) yang senantiasa dihasilkan dengan formasi tahunan, dari berbagai jenis tanaman, disintesis oleh energi matahari dan sepenuhnya terurai di keadaan asli (Caprita, et al., 2010).
Komponen yang terbesar dari NSP adalah serat, terdiri dari komponen hetero polisakarida dan non polisakarida antara lain selulosa (20-35%), hemiselulosa (20-35%), pektin, alginate dan lignin (10-25%). Dengan melakukan proses ekstraksi dan fraksinasi yang cermat terhadap biomassa produk ikatan ini dapat menghasilkan berbagai bahan, yang dapat dikonversi menjadi produk bernilai tinggi (Karaaslan, dkk., 2010).
Beberapa hemiselulosa dari tanaman dan tumbuhan yang lebih tinggi merupakan polisakarida sumber potensial untuk perkembangan farmakologi (Saha, 2003).
Hemiselulosa merupakan polisakarida dimana monomer penyusun hemiselulosa biasanya adalah rantai D-glukosa, ditambah dengan berbagai bentuk monosakarida yang terikat pada rantai, baik sebagai cabang atau mata rantai, seperti D-mannosa, D-galaktosa, D-fruktosa, dan pentosa-pentosa seperti D-xilosa dan L-arabinosa yang merupakan gula pereduksi (Melo, et al., 2012)
dapat mereduksi senyawa-senyawa pengoksidasi seperti ferisianida, hydrogen peroksida dan ion kupro (Lingga, 2012).
2.3 Antioksidan
Antioksidan adalah senyawa yang mempunyai struktur molekul yang dapat memberikan elektronnya kepada molekul radikal bebas tanpa terganggu sama sekali dan dapat memutus reaksi berantai dari radikal bebas Radikal bebas adalah atom atau senyawa yang kehilangan pasangan elektronnya (Kumalaningsih, 2006).
Antioksidan dapat berupa enzim (misalnya superoksida dismutase, katalase dan glutation peroksidase), vitamin-vitamin (seperti vitamin E, vitamin C, vitamin A dan beta karoten), ataupun senyawa lain (misalnya flavonoid, albumin, bilirubin, seruloplasmin dan lain-lain). Antioksidan enzimatis merupakan pertahanan utama (primer) terhadap kondisi stress oksidatif (Winarsi, 2007).
Menurut Kosasih, dkk. (2004), berdasarkan mekanisme kerjanya, antioksidan dapat dibagi dalam tiga kelompok, yaitu antioksidan primer, antioksidan sekunder dan antioksidan tersier.
2. Antioksidan sekunder berfungsi menangkap senyawa serta mencegah terjadinya reaksi berantai. Contoh antioksidan sekunder : vitamin E, vitamin C, betakaroten, asam urat, bilirubin dan albumin.
3. Antioksidan tersier bekerja dengan cara memperbaiki kerusakan sel-sel dan jaringan yang disebabkan radikal bebas. Contoh enzim yang memperbaiki DNA pada inti sel adalah metionin sulfooksidan reduktase. Adanya enzim-enzim perbaikan DNA ini berguna untuk mencegah penyakit misalnya kanker.
2.4 Mekanisme Kerja Antioksidan
Mekanisme kerja antioksidan secara umum adalah menghambat oksidasi lemak. Menurut Antolovich, et al. (2002), oksidasi lemak terdiri dari beberapa tahap, yaitu inisiasi, propagasi, branching dan terminasi.
1. Inisiasi: LH + R* L* + RH
Dimana LH merupakan molekul substrat, contohnya lipid, dan R* merupakan radikal pengoksidasi. Oksidasi lipid menghasilkan radikal asam lemak yang sangat reaktif (L*) yang dapat dengan cepat bereaksi dengan oksigen membentuk radikal peroksil lipid (LOO*).
2. Propagasi: L* + O2 LOO*
LOO* + LH L* + LOOH
3. Branching: LOOH LO* + HO*
2LOOH LOO* + LO* + H2O
Pemecahan dari hidroperoksid lipid melibatkan katalis ion logam transisi. Tahap ini akan menghasilkan peroksil lipid dan alkoksi lipid radikal. 4. Terminasi: LO* + LO* produk non radikal
LOO* + LOO* produk non radikal LO* + LOO* produk non radikal
Reaksi terminasi mencakup penggabungan radikal-radikal membentuk produk non radikal.
2.5 Metode Fosfomolibdenum
Metode ini didasarkan pada proses reduksi dari Mo (VI) menjadi Mo (V) oleh antioksidan sehingga dapat membentuk kompleks fosfat/Mo(V) yang berwarna hijau. Untuk sampel yang tidak diketahui komposisinya, kapasitas
antioksidan dapat dinyatakan sebagai ekivalensi α-tokoferol atau asam askorbat (Melo, et al., 2012)
2.6 Spektrofotometer Infra Merah
gelombang 2,5- 50 µm atau bilangan gelombang 4000- 200 cm-1. Energi yang dihasilkan oleh radiasi ini akan menyebabkan vibrasi atau getaran pada molekul. Pita absorbansi inframerah sangat khas dan spesifik untuk setiap tipe ikatan kimia atau gugus fungsi. Metode ini sangat berguna mengindentifikasi senyawa organik. Sebagai sumber cahaya yang umum digunakan adalah lampu tungsten, Nerst glowers (Dachriyanus, 2004)
2.7 Kromatografi Cair Kinerja Tinggi
Kromatografi cair kinerja tinggi (KCKT) merupakan sistem pemisahan dengan kecepatan dan efisiensi yang tinggi karena didukung oleh kemajuan dalam teknologi kolom, sistem pompa tekanan tinggi, dan detector yang sangat sensitif dan beragam sehingga mampe menganalisa berbagai cuplikan secara kualitatif maupun kuantitatif, baik dalam komponen tunggal maupun campuran (Ditjen POM, 1995).
2.8 Spektrofotometri Sinar Tampak
seluruh radiasi yang mengenai zat tersebut akan diserap, sebagian diteruskan atau ditransmisikan. Spektrum absorpsi merupakan gambaran hubungan antara panjang gelombang sinar yang mengenai suatu zat dengan besarnya serapan sinar pada panjang gelombang tersebut oleh zat yang bersangkutan. Pengukuran absorpsi radiasi UV-Vis oleh spesi larutan dapat digunakan sebagai metode analisis kuantitatif (Khopkar, 1998).
Menurut Gandjar dan Rohman (2007), ada beberapa hal yang harus diperhatikan dalam analisis dengan spektrofotometri UV-Vis terutama untuk senyawa yang semula tidak berwarna yang akan dianalisis dengan spektrofotometri visibel karena senyawa tersebut harus diubah terlebih dahulu menjadi senyawa yang berwarna.Berikut adalah tahapan-tahapan yang perlu diperhatikan:
a. Pembentukan molekul yang dapat menyerap sinar UV-Vis
Hal ini perlu dilakukan jika senyawa yang dianalisis tidak menyerap pada daerah tersebut. Cara yang digunakan adalah dengan merubahnya menjadi senyawa lain atau direaksikan dengan pereaksi tertentu. Pereaksi yang digunakan harus memenuhi beberapa persyaratan yaitu:
- Reaksinya selektif dan sensitif
- Reaksinya cepat, kuantitatif dan reprodusibel - Hasil reaksi stabil dalam jangka waktu yang lama b. Pemilihan Panjang Gelombang
panjang gelombang maksimal, dilakukan dengan membuat kurva hubungan antara absorbansi dengan panjang gelombang dari suatu larutan baku pada konsentrasi tertentu.
Ada beberapa alasan mengapa pengukuran harus menggunakan panjang gelombang maksimal, yaitu:
- Pada panjang gelombang maksimal, kepekaannya juga maksimal karena pada panjang gelombang maksimal tersebut, perubahan absorbansi untuk setiap satuan konsentrasi adalah yang paling besar
- Di sekitar panjang gelombang maksimal, bentuk kutva absorbansi datar dan pada kondisi tersebut hukum Lambert-Beer akan terpenuhi
- Jika dilakukan pengukuran ulang maka kesalahan yang disebabkan oleh pemasangan ulang panjang gelombang akan kecil sekali, ketika digunakan panjang gelombang maksimal
c. Waktu Operasional (Operating time)
Cara ini biasa digunakan untuk pengukuran hasil reaksi atau pembentukan warna. Tujuannya adalah untuk mengetahui waktu pengukuran yang stabil. Waktu operasional ditentukan dengan mengukur hubungan antara waktu pengukuran dengan absorbansi larutan.
d. Pembuatan kurva baku
e. Pembacaan absorbansi sampel atau cuplikan
Absorban yang terbaca pada spektrofotometer hendaknya antara 0,2 sampai 0,8 atau 15% sampai 70% jika dibaca sebagai transmitans. Anjuran ini berdasarkan anggapan bahwa kesalahan dalam pembacaan T adalah 0,005 atau 0,5% (kesalahan fotometrik).
2.9 Validasi Metode Analisis
Validasi metode analisis adalah suatu tindakan penilaian terhadap parameter tertentu berdasarkan percobaan laboratorium untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita, 2004).
Beberapa parameter analisis yang harus dipertimbangkan dalam validasi metode analisis adalah sebagai berikut:
a. Kecermatan
Kecermatan adalah ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya. Kecermatan dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan (Harmita, 2004).
Menurut Ermer (2005), rentang persen perolehan kembali memenuhi syarat jika nilai persen perolehan kembali berada pada rentang 80% -120%. b. Keseksamaan (presisi)
menunjukkan derajat kesesuaian antara hasil uji individual ketika suatu metode dilakukan secara berulang untuk sampel yang homogen. Nilai simpangan baku relatif yang memenuhi persyaratan menunjukan adanya keseksamaan metode yang dilakukan (Harmita, 2004).
c. Sensitivitas
Sensitivitas merupakan kemampuan untuk membedakan dua konsentrasi yang berbeda dan ditentukan dengan kemiringan dari kurva kalibrasi (Christian, 2004).
d. Linearitas dan rentang
Linearitas adalah kemampuan metode analisis yang memberikan respon baik secara langsung maupun dengan bantuan transformasi matematika, menghasilkan suatu hubungan yang proporsional terhadap konsentrasi analit dalam sampel. Rentang merupakan batas terendah dan batas tertinggi analit yang dapat ditetapkan secara cermat, seksama dan dalam linearitas yang dapat diterima (Harmita, 2004).
e. Batas deteksi
Batas deteksi merupakan tingkat konsentrasi terendah yang dapat dikatakan secara statistic berbeda dari blanko (Christian, 2004).
f. Batas Kuantitasi
BAB I
PENDAHULUAN
1.1 Latar belakang
Antioksidan adalah senyawa yang mampu menangkal atau meredam dampak negatif oksidan dalam tubuh. Antioksidan bekerja dengan cara mendonorkan satu atau lebih elektronnya kepada senyawa yang bersifat oksidan sehingga aktivitas senyawa oksidan tersebut bisa dihambat. Keseimbangan oksidan dan antioksidan sangat penting karena berkaitan dengan berfungsinya sistem imunitas tubuh (Meydani, et al., 1995). Penggunaan senyawa antioksidan semakin berkembang, baik untuk makanan maupun untuk pengobatan seiring dengan bertambahnya pengetahuan tentang aktivitas radikal bebas (Boer, 2000).
Antioksidan dalam tubuh bermanfaat untuk mencegah reaksi oksidasi yang ditimbulkan oleh radikal bebas baik hasil metabolisme tubuh maupun faktor eksternal lainnya. Berdasarkan sumbernya, antioksidan terdiri dari dalam tubuh (endogen) dan luar tubuh (eksogen). Adakalanya sistem antioksidan endogen tidak cukup untuk memecah spesies oksigen reaktif (ROS), keadaan ini disebut stress oksidatif. Oleh karena itu, diperlukan antioksidan dari luar (eksogen) untuk mengatasinya (Kukic, et al., 2006).
tumbuhannya. Dalam beberapa tahun terakhir, hemiselulosa sebagi polimer telah dikembangkan melalui berbagai reaksi kimia, bioteknologi dan aplikasi farmasi. Beberapa penelitian tentang pemanfaatan hemiselulosa antara lain sebagai salah satu sumber bioetanol, dan media pada mikrobiologi (Richana, dkk., 2007).
Beberapa penelitian terbaru melaporkan bahwa hemiselulosa dapat bersifat sebagai antioksidan. Hemiselulosa memiliki aktivitas antioksidan oleh karena pada rantai cabangnya merupakan monosakarida, antara lain: D-mannosa, D-galaktosa, D-fruktosa, serta pentosa seperti D-xilosa dan L-arabinosa yang merupakan gula pereduksi (Melo, et al., 2012).
Indonesia sebagai negara pertanian menghasilkan sekam padi sekitar 0,85 ton/jam atau sekitar 8,5 ton/hari. Volume yang besar ini akan menjadi masalah serius dalam jangka panjang apabila tidak ditangani dengan baik. Sekam padi mengandung hemiselulosa sekitar 6% dan belum banyak dimanfaatkan. Oleh karena itu, penulis mencoba melakukan isolasi hemiselulosa berdasarkan metode yang pernah dilakukan peneliti terdahulu (Muchlisyam, dkk., 2011).
senyawa antioksidan yang terlarut dalam pelarut organik, khususnya alkohol. Selain itu, reagen DPPH tidak stabil, sangat rentan terhadap cahaya, udara, tipe pelarut, dan pH. Oleh karena itu, diperlukan teknik penyiapan khusus agar terlindung dan reagen yang baru saat melakukan analisis (Apak, et al., 2007).
Selain itu, penetapan kapasitas antioksidan juga dapat ditentukan dengan metode Ferric Reducing Antioxidant Power (FRAP), namun metode FRAP memiliki keterbatasan dimana tidak semua antioksidan dapat mereduksi Fe (III) dalam kurun waktu pengukuran dari FRAP. Beberapa senyawa antioksidan membutuhkan waktu reaksi yang lebih lama sehingga tidak dapat diukur dengan metode FRAP. Metode penghilangan warna (decolorization) seperti 2,2’-azinobis-(3-ethylbenzothiazoline-6-sulfonic acid (ABTS) dan DPPH juga memiliki keterbatasan dimana semakin pekat warna awal sampel, semakin kecil penurunan pada absorbansi dan semakin sedikit aktivitas antioksidan yang dapat diukur, bahkan walaupun apabila dibuat dalam volume sampel yang minimal (Apak, et al., 2007).
Berdasarkan uraian di atas, maka penulis memilih menggunakan metode fosfomolibdenum untuk pengujian kualitatif dan kuantitatif kapasitas antioksidan dari Hemiselulosa Sekam Padi (HSP).
Pada penelitian ini, penulis memilih vitamin C sebagai antioksidan pembanding. Vitamin merupakan salah satu zat gizi yang berperan sebagai antioksidan efektif atau mengatasi radikal bebas yang dapat merusak sel atau jaringan, termasuk melindungi sel dari kerusakan oksidatif yang ditimbulkan oleh radiasi. Vitamin C banyak terdapat pada sayur-sayuran dan buah-buahan dan merupakan antioksidan yang paling sering digunakan (Lingga, 2012). 1.2 Perumusan Masalah
Berdasarkan uraian di atas, maka perumusan masalah pada penelitian ini adalah:
a. Apakah metode isolasi yang dipakai dapat digunakan untuk mengisolasi hemiselulosa dari sekam padi?
b. Apakah akitivitas antioksidan dari HSP dapat diperiksa secara kualitatif dengan pereaksi fosfomolibdat?
c. Apakah kapasitas antioksidan HSP berbeda dengan kapasitas antioksidan Vitamin C?
1.3 Hipotesis
Berdasarkan perumusan masalah di atas, maka hipotesis pada penelitian ini adalah:
b. Pemeriksaan kualitatif aktivitas antioksidan HSP dapat ditentukan dengan pereaksi fosfomolibdat.
c. Terdapat perbedaan kapasitas antioksidan HSP dengan kapasitas antioksidan Vitamin C.
1.4 Tujuan Penelitian
Tujuan dilakukannya penelitian ini adalah:
a. Untuk mengetahui apakah metode isolasi yang dipakai dapat digunakan dan berapa % rendemen hemiselulosa yang diperoleh dari sekam padi. b. Untuk mengetahui apakah pemeriksaan kualitatif aktivitas antioksidan
HSP dengan pereaksi fosfomolibdat dapat dilakukan.
c. Untuk mengetahui perbedaan kapasitas antioksidan HSP apabila dibandingkan dengan kapasitas antioksidan Vitamin C.
1.5 Manfaat Penelitian
ISOLASI DAN PENETAPAN KAPASITAS ANTIOKSIDAN HEMISELULOSA SEKAM PADI (Oryza sativa)
SECARA IN VITRO
ABSTRAK
Hemiselulosa merupakan salah satu sumber daya alam terbarukan yang paling berlimpah sebagai biopolimer kedua. Dalam beberapa tahun terakhir, hemiselulosa sebagi polimer telah dikembangkan melalui berbagai reaksi kimia, bioteknologi dan aplikasi farmasi. Sekam padi merupakan limbah pertanian yang mengandung polisakarida antara lain hemiselulosa. Tujuan penelitian ini adalah melakukan isolasi dan karakteristik hemiselulosa sekam padi serta penetapan kapasitas antioksidan dari Hemiselulosa Sekam Padi (HSP) baik secara kualitatif maupun kuantitatif.
Isolasi hemiselulosa dari sekam padi dilakukan dengan metode dengan menggunakan pelarut NaOH 0,2 M dan diendapkan dengan asam asetat 10% di dalam etanol 95%. Kemudian dilakukan uji karekteristik dengan organoleptis, kelarutan, spektofotometri infra merah (IR) dan Kromatografi Cair Kinerja Tinggi (KCKT). Pengujian kapasitas antioksidan baik kualitatif maupun kuantitatif dilakukan dengan metode fosfomolibdenum secara spektofotometri sinar tampak berdasarkan terjadinya reduksi Mo (VI) menjadi Mo (V) oleh karena adanya antioksidan.
Isolasi HSP dihasilkan hemiselulosa sebesar 3,04%. Dari uji karakteristik dengan spektofotometri IR memberikan serapan pada bilangan gelombang 3340,72 cm-1 menunjukkan adanya gugus OH dan pada bilangan gelombang 1655,92 cm-1 menunjukkan adanya gugus karboksil. Dengan KCKT didapatkan waktu retensi sebesar 2,710 menit, tinggi puncak 6,0841, luas area 0,0912 dan harga simetris sebesar 0,24. Kapasitas antioksidan dari HSP secara kulitatif dibuktikan dengan terbentuknya kompleks fosfat dan Mo (V) yang berwarna hijau. Secara kuantitatif diperoleh 1 gram sampel setara dengan (9,71 ± 2,7092) mg vitamin C.
Dari penelitian yang dilakukan dapat disimpulkan bahwa isolasi hemiselulosa dapat dilakukan dan hemiselulosa memiliki aktivitas antioksidan sehingga dapat dikembangkan sebagai salah satu antioksidan alami.
Kata kunci : sekam padi, hemiselulosa, antioksidan, metode fosfomolibdenum
ISOLATION AND DETERMINATION OF IN VITRO ANTIOXIDANT CAPACITY OF HEMICELLULOSE FROM RICE HUSK (Oryza sativa)
ABSTRACT
Hemicellulose is one of the most abundant second biopolymer as the renewable natural resources. In recent years, hemicellulose as polymer have been developed through various chemical, biotechnology and pharmaceutical applications. Rice husk is an agricultural waste containing polysaccharides such as hemicellulose. The purpose of this study is to isolate, characterize and determine the antioxidant capacity from rice husks hemicelluloses for either qualitatively or quantitatively.
Isolation of hemicellulose from rice husk is based on method that used NaOH 0.2 M as solvent and precipitated using acetid acid 10% in etanol 95%. Then for the characterization tests included the organoleptic characteristics, solubility, Infrared Spektrophotometry (IR) and High Performance Liquid Chromatography (HPLC). The determination of total antioxidant capacity for
either qualitatively or quantitatively is performed with visible
spektophotometry using phosphomolibdenum method based on reduction from Mo (VI) to Mo (V) by antioxidants.
From the isolation results, 3.04% rendement is obtained. From the characteristization test with IR show that vibration of OH at 3340.72 cm-1 and carboxyl at 1655.92 cm-1 . From HPLC, it achieved retention time at 2.710, 6.0841 height, 0.0912 width and 0.24 symetry. Determination of antioxidant capacity qualitatively proved by formed of green complex fosfomolybdat. As quantitatively, the antioxidant capacity achieved from hemicellulose is (9.71 ± 2.7092) mg vitamin C/g sample.
From the conducted research, it can be concluded that the isolation method of hemicelluloses can be used and hemicelluloses has antioxidant activity so it can be developed as natural antioxidants.
ISOLASI DAN PENETAPAN KAPASITAS ANTIOKSIDAN
HEMISELULOSA SEKAM PADI (Oryza sativa)
SECARA IN VITRO
SKRIPSI
Diajukan untuk melengkap
i salah satu syarat untuk mem
peroleh
gelar Sarjana Farmasi pada Fakultas Farmasi
OLEH:CLARESTA FREDICIA ANGELINA NIM 091501125
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
ISOLASI DAN PENETAPAN KAPASITAS ANTIOKSIDAN
HEMISELULOSA SEKAM PADI (Oryza sativa)
SECARA IN VITRO
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
CLARESTA FREDICIA ANGELINA NIM 091501125
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
ISOLASI DAN PENETAPAN KAPASITAS ANTIOKSIDAN
HEMISELULOSA SEKAM PADI (Oryza sativa)
SECARA IN VITRO
OLEH:
CLARESTA FREDICIA ANGELINA NIM 091501125
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal : 15 Juni 2013
Disetujui Oleh:
Pembimbing I, Panitia Penguji,
Drs. Maralaut Batubara, M.Phill., Apt. Drs. Chairul Azhar Dalimunthe, M.Sc., Apt.
NIP 195101311976031003 NIP 194907061980021001
Drs. Maralaut Batubara, M.Phill., Apt.
Pembimbing II, NIP 195101311976031003
Dr. Muchlisyam, M.Si., Apt. Dra. Tuty Roida Pardede, M.Si., Apt.
NIP 195006221980021001 NIP 195401101980032001
Drs. Syahrial Yoenoes, S.U., Apt. NIP 195112061983031001
Medan, Juli 2013
Fakultas Farmasi
Universitas Sumatera Utara Dekan,
Prof. Dr. Sumadio Hadisahputra, Apt.
KATA PENGANTAR
Puji syukur penulis ucapkan kepada Tuhan atas segala limpahan rahmat dan karunianya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini. Skripsi ini disusun untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara, dengan judul Isolasi dan Penetapan Kapasitas Antioksidan Hemiselulosa Sekam Padi (Oryza sativa) Secara In Vitro.
Penulis juga mengucapkan terima kasih dan penghargaan yang tiada terhingga kepada Ayahanda Tio Kok Sin dan Ibunda Tan Bie Jan yang telah memberikan cinta dan kasih sayang yang tidak ternilai dengan apapun, pengorbanan baik materi maupun motivasi beserta doa yang tulus yang tidak pernah berhenti. Abang Thomas dan adik Jesslyn, serta seluruh keluarga yang selalu mendoakan dan memberikan semangat.
Penulis menyadari sepenuhnya bahwa dalam penulisan skripsi ini masih jauh dari kesempurnaan, oleh karena itu dengan segala kerendahan hati, penulis menerima kritik dan saran demi kesempurnaan skripsi ini. Akhirnya, penulis berharap semoga skripsi ini dapat memberi manfaat bagi kita semua.
Medan, Juni 2013 Penulis,
Claresta Fredicia Angelina NIM 091501125
ISOLASI DAN PENETAPAN KAPASITAS ANTIOKSIDAN HEMISELULOSA SEKAM PADI (Oryza sativa)
SECARA IN VITRO
ABSTRAK
Hemiselulosa merupakan salah satu sumber daya alam terbarukan yang paling berlimpah sebagai biopolimer kedua. Dalam beberapa tahun terakhir, hemiselulosa sebagi polimer telah dikembangkan melalui berbagai reaksi kimia, bioteknologi dan aplikasi farmasi. Sekam padi merupakan limbah pertanian yang mengandung polisakarida antara lain hemiselulosa. Tujuan penelitian ini adalah melakukan isolasi dan karakteristik hemiselulosa sekam padi serta penetapan kapasitas antioksidan dari Hemiselulosa Sekam Padi (HSP) baik secara kualitatif maupun kuantitatif.
Isolasi hemiselulosa dari sekam padi dilakukan dengan metode dengan menggunakan pelarut NaOH 0,2 M dan diendapkan dengan asam asetat 10% di dalam etanol 95%. Kemudian dilakukan uji karekteristik dengan organoleptis, kelarutan, spektofotometri infra merah (IR) dan Kromatografi Cair Kinerja Tinggi (KCKT). Pengujian kapasitas antioksidan baik kualitatif maupun kuantitatif dilakukan dengan metode fosfomolibdenum secara spektofotometri sinar tampak berdasarkan terjadinya reduksi Mo (VI) menjadi Mo (V) oleh karena adanya antioksidan.
Isolasi HSP dihasilkan hemiselulosa sebesar 3,04%. Dari uji karakteristik dengan spektofotometri IR memberikan serapan pada bilangan gelombang 3340,72 cm-1 menunjukkan adanya gugus OH dan pada bilangan gelombang 1655,92 cm-1 menunjukkan adanya gugus karboksil. Dengan KCKT didapatkan waktu retensi sebesar 2,710 menit, tinggi puncak 6,0841, luas area 0,0912 dan harga simetris sebesar 0,24. Kapasitas antioksidan dari HSP secara kulitatif dibuktikan dengan terbentuknya kompleks fosfat dan Mo (V) yang berwarna hijau. Secara kuantitatif diperoleh 1 gram sampel setara dengan (9,71 ± 2,7092) mg vitamin C.
Dari penelitian yang dilakukan dapat disimpulkan bahwa isolasi hemiselulosa dapat dilakukan dan hemiselulosa memiliki aktivitas antioksidan sehingga dapat dikembangkan sebagai salah satu antioksidan alami.
Kata kunci : sekam padi, hemiselulosa, antioksidan, metode fosfomolibdenum
ISOLATION AND DETERMINATION OF IN VITRO ANTIOXIDANT CAPACITY OF HEMICELLULOSE FROM RICE HUSK (Oryza sativa)
ABSTRACT
Hemicellulose is one of the most abundant second biopolymer as the renewable natural resources. In recent years, hemicellulose as polymer have been developed through various chemical, biotechnology and pharmaceutical applications. Rice husk is an agricultural waste containing polysaccharides such as hemicellulose. The purpose of this study is to isolate, characterize and determine the antioxidant capacity from rice husks hemicelluloses for either qualitatively or quantitatively.
Isolation of hemicellulose from rice husk is based on method that used NaOH 0.2 M as solvent and precipitated using acetid acid 10% in etanol 95%. Then for the characterization tests included the organoleptic characteristics, solubility, Infrared Spektrophotometry (IR) and High Performance Liquid Chromatography (HPLC). The determination of total antioxidant capacity for
either qualitatively or quantitatively is performed with visible
spektophotometry using phosphomolibdenum method based on reduction from Mo (VI) to Mo (V) by antioxidants.
From the isolation results, 3.04% rendement is obtained. From the characteristization test with IR show that vibration of OH at 3340.72 cm-1 and carboxyl at 1655.92 cm-1 . From HPLC, it achieved retention time at 2.710, 6.0841 height, 0.0912 width and 0.24 symetry. Determination of antioxidant capacity qualitatively proved by formed of green complex fosfomolybdat. As quantitatively, the antioxidant capacity achieved from hemicellulose is (9.71 ± 2.7092) mg vitamin C/g sample.
From the conducted research, it can be concluded that the isolation method of hemicelluloses can be used and hemicelluloses has antioxidant activity so it can be developed as natural antioxidants.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 4
1.3 Hipotesis ... 4
1.4 Tujuan Penelitian ... 5
1.5 Manfaat Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Sekam Padi ... 6
2.2 Hemiselulosa ... 6
2.3 Antioksidan ... 8
2.4 Mekanisme Kerja Antioksidan ... 9
2.6 Spektrofotometer Infra Merah ... 10
2.7 Kromatografi Cair Kinerja Tinggi ... 11
2.8 Spektrofotometri Sinar Tampak ... 11
2.9 Validasi Metode Analisis ... 14
BAB III METODE PENELITIAN ... 16
3.1 Waktu dan Tempat Penelitian ... 16
3.2 Alat ... 16
3.3 Sampel dan Bahan- bahan ... 16
3.3.1 Sampel ... 16
3.3.2 Bahan- bahan ... 17
3.4 Pembuatan Pereaksi ... 17
3.4.1 Pembuatan etanol 70% v/v ... 17
3.4.2 Pembuatan Aquadest Bebas CO2 ... 17
3.4.3 Pembuatan NaOH 0,03 M dalam etanol 70% ... 17
3.4.4 Pembuatan NaOH 0,2 M ... 18
3.4.5 Pembuatan Hidrogen Peroksida 3% v/v ... 18
3.4.6 Pembuatan Asam Asetat 10% v/v . ... 18
3.4.7 Pembuatan Asam Klorida 2 N ... 18
3.4.8 Pembuatan Asam Klorida 1% v/v ... 18
3.4.9 Pembuatan NaOH 1% b/v... 18
3.4.10 Pembuatan Larutan Pereaksi ... 18
3.5 Prosedur Penelitian ... 19
3.5.2 Pengujian Karakteristik Sekam Padi (Oryza sativa) ... 19
3.5.2.1 Pemeriksaan Organoleptis. ... 19
3.5.2.2 Penetapan Kadar Abu Total ... 19
3.5.2.3 Penetapan Kadar Abu yang Tidak Larut dalam Asam ... 19
3.5.2.4 Susut Pengeringan ... 20
3.5.3 Isolasi Hemiselulosa Sekam Padi (Oryza sativa) ... 20
3.5.4 Karakteristik Hemiselulosa Sekam padi ... 21
3.5.4.1 Organoleptis meliputi bentuk, warna dan rasa .. 21
3.5.4.2 Kelarutan ... 21
3.5.4.3 Pengujian Karakeristik dengan Spektofotometri Inframerah ... 21
3.5.4.4 Pengujian Karakeristik dengan Kromatografi Cair Kinerja Tinggi (KCKT) ... 21
3.5.5 Pengujian Kapasitas Antioksidan Hemiselulosa Sekam Padi (HSP) ... 22
3.5