UJI EFEK ANTIPROLIFERATIF CAMPURAN SENYAWA EUGENOL
DAN ISOLAT KATEKIN GAMBIR (Uncaria gambier, Roxb) DARI FASE ETIL ASETAT TERHADAP KULTUR SEL KANKER SERVIKS (HeLa
CELL LINE)
SKRIPSI
Diajukan Sebagai Tugas Akhir Untuk Memperoleh Gelar Sarjana Farmasi (S.Far).
OLEH KIKI ZAKIAH NIM : 107102001475
PROGRAM STUDI FARMASI
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
ii
LEMBAR PERSETUJUAN SKRIPSI
NAMA : KIKI ZAKIAH
NIM : 107102001475
JUDUL : UJI EFEK ANTIPROLIFERATIF CAMPURAN SENYAWA
EUGENOL DAN ISOLAT KATEKIN GAMBIR (Uncaria
gambier, Roxb) DARI FASE ETIL ASETAT TERHADAP
KULTUR SEL KANKER SERVIKS (HeLa CELL LINE)
Disetujui oleh :
Pembimbing I Pembimbing II
Nurmeilis, M.Si, apt drg. Laifa Annisa H., Ph.D. NIP:197404302005012003 NIP : 197804022009012003
Mengetahui,
Ketua Program Studi Farmasi UIN Syarif Hidayatullah Jakarta
iii
LEMBAR PENGESAHAN SKRIPSI
Skripsi dengan Judul
UJI EFEK ANTIPROLIFERATIF CAMPURAN SENYAWA EUGENOL
DAN ISOLAT KATEKIN GAMBIR (Uncaria gambier, Roxb) DARI FASE ETIL ASETAT TERHADAP KULTUR SEL KANKER SERVIKS (HeLa
CELL LINE)
Telah disetujui, diperiksa dan dipertahankan dihadapan tim penguji oleh
Kiki Zakiah NIM: 107102001475
Menyetujui,
Pembimbing:
1. Pembimbing I Nurmeilis, M.Si, Apt. ...
2. Pembimbing II drg. Laifa Annisa H., PhD ...
Penguji:
1. Ketua Penguji Dr. M. Yanis Musdja, M.Sc, Apt. ...
2. Anggota Penguji I Dr. M. Yanis Musdja, M.Sc, Apt. ...
3. Anggota Penguji II Ofa Suzanti Bheta, M.Si, Apt. ... 4. Anggota Penguji III Drs. Ahmad Musir, M.Sc, Apt. ...
Mengetahui,
Dekan Fakultas Kedokteran Dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta
Prof. Dr (hc). dr. M.K. Tadjudin, Sp. And
iv
LEMBAR PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi yang berjudul:
UJI EFEK ANTIPROLIFERATIF CAMPURAN SENYAWA EUGENOL DAN ISOLAT KATEKIN GAMBIR (Uncaria gambier, Roxb) DARI FASE ETIL ASETAT TERHADAP KULTUR SEL KANKER SERVIKS (HeLa
CELL LINE)
Adalah karya saya sendiri dan belum pernah diajukan dalam bentuk apapun kepada perguruan tiggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkandari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka.
Penulis
v
KATA PENGANTAR
Alhamdulillahirrabil ‘alamin, puji dan syukur kehadirat Allah SWT yang selalu melimpahkan rahmat, karunia, cinta dan kasihNya yang tidak terbatas kepada penulis sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi berjudul “Uji Efek Antiproliferatif Campuran Senyawa Eugenol dan Isolat Katekin Gambir (Uncaria gambir Roxb) dari Fase Etil Asetat Terhadap Kultur Sel Kanker Serviks (HeLa cell line).
Skripsi ini disusun untuk memenuhi tugas akhir sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Kedokteran dan Ilmu Kesehatan Program Studi Farmasi UIN Syarif Hidayatullah Jakarta.
Pada kesempatan ini perkenankanlah penulis menyampaikan ucapan terima kasih yang sebesar-besarnya kepada:
1. Bunda Nia Nurhamidah Romli, Ayah Muzimi Effendi, Sis Fetty Fatihatun N, Syarief Muiz Abdillah dan Putri Khatami yang selalu memberikan kasih sayang, doa, semangat dan dukungan baik moril maupun materil sehingga penulis dapat menyelesaikan skripsi ini.
2. Bapak Prof. Dr. (hc) dr. M.K Tadjudin Sp.And, selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
3. Bapak. Dr. M. Yanis Musdja M.Sc, Apt, selaku Ketua Jurusan Farmasi Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta. 4. Ibu Nurmeilis, M.si, Apt, selaku pembimbing I yang tak bosan mengajarkan
dan membimbing penulis di segala kesempatan.
5. Ibu drg. Laifa Annisa H., Ph.D selaku pembimbing II yang juga telah membimbing dan berbagi ilmu kepada penulis.
6. Bapak dan Ibu dosen yang tak hanya memberikan ilmu, hingga penulis dapat menyelesaikan skripsi ini, namun juga semangat dan teladan mulia. Semoga Allah membalas kebaikanmu dengan pahala yang berlipat.
7. Bapak Kusmardi, MSc. yang telah berbaik hati memfasilitasi penulis dalam pengerjaan penelitian di Laboratorium Patology FKUI-Salemba.
vi
9. Kepada sahabat seperjuangan penelitianku (RESONANSI) , Silfia Windy Kusumadewi dan Dahlia Sari, Kepada sahabat Farmasi angkatan 2007 khususnya kelas A.
10.Kepada para senior, Ahmed Rizky F, Dea Arditia R, Ahmad Hariri, Raisani Rusli, Dalilah Qisthina, Purnama Dwi T, dan semua yang tidak bisa disebutkan satu persatu, terimakasih untuk setiap semangat dan masukan yang berharga
11.Serta semua pihak yang tidak dapat disebutkan satu persatu yang turut membantu menyelesaikan skripsi ini.
Penulis menyadari bahwa penyusunan skripsi ini sangat jauh dari sempurna. Oleh karena itu kritik dan saran yang bersifat membangun sangat penulis harapkan guna tercapainya kesempurnaan skripsi ini.
Akhirnya, dengan segala kerendahan hati, penulis berharap semoga hasil penelitian ini dapat bermanfaat baik bagi kalangan akademis, khususnya bagi mahasiswa farmasi, masyarakat pada umumnya dan bagi dunia ilmu pengetahuan.
vii
1.4. Tujuan Penelitian 4
1.5. Manfaat Penelitian 4
BAB II TINJAUAN PUSTAKA
2.1. Eugenol 5
2.1.1. Sifat Fisika dan kimia 5
2.1.2. Sumber Eugenol 6
2.1.3. Pemanfaatan Eugenol 6
2.2. Tanaman Gambir (Uncaria gambir Roxb.) 7 2.2.1.Klasifikasi Gambir (Uncaria gambir Roxb.) 7
2.2.2.Nama daerah 7
2.2.3.Uraiantanaman 8
2.2.4.Kandungan Kimia 8
2.2.5.ManfaatTumbuhan 8
2.4.2. Cara Pembuatan Ekstrak 15
2.4.3. Metode Ekstraksi 16
2.4.4. Parameter Ekstrak 18
2.5. Kanker 19
2.5.1. PengertianKanker 19
2.5.2. KankerServiks 21
2.6. HeLaCell Line 24
viii
2.10. UjiAntiproliferatif 35
2.10.1.MetodePengujianAntiproliferatif 35 2.11. Enzyme Linked Immunosorbent Assay (ELISA) 36
2.12. PotensiPenelitian 37
2.13. KerangkaKonsepPenelitian 40
BAB III METODOLOGI PENELITIAN
3.1. Tempat dan Waktu Penelitian 41
3.2. Alat dan Bahan Penelitian 41
3.2.1.AlatPenelitian 41
3.2.2.BahanPenelitian 42
3.3. Prosedur Penelitian 43
3.3.1.PenyiapanSimplisiaUji 43
3.3.2.IdentifikasiGambir 43
3.3.3.IdentifikasiCemaran Urea 43
3.3.4.Isolasi KatekinGambir 44
3.3.5.PenapisanFitokimia 44
3.3.6.PemeriksaanKatekin 48
3.3.7.SterilisasiAlat 50
3.3.8.PembuatanReagen 51
3.3.9.Persiapan LarutanUji 52 3.3.10.PersiapanKulturHeLaCell Line 53 3.3.11.PemeliharaanKulturHeLaCell Line 55
3.3.12.UjiAntiproliferatif 56
3.3.13.PerhitunganPersentaseKematianSel 57
3.4. Analisa Data 57
3.5. AlurPenelitian 58
BAB IV HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian 59
4.1.1. DeterminasidanSertifikasi 59 4.1.2.KarakteristikSimplisia&Senyawaujicampuran 59
4.1.3.JumlahKepadatanSel 60
4.1.4.UjiEfekAntiproliferatif 60
4.2. Pembahasan 66
BAB V KESIMPULAN DAN SARAN
5.1. Kesimpulan 72
6.1. Saran 72
DAFTAR PUSTAKA 73
ix
DAFTAR TABEL
Halaman
Tabel 1. Konfigurasi Komponen Katekin ... 10
Tabel 2. Karakteristik Simplisia dan Senyawa Uji Campuran ... 59
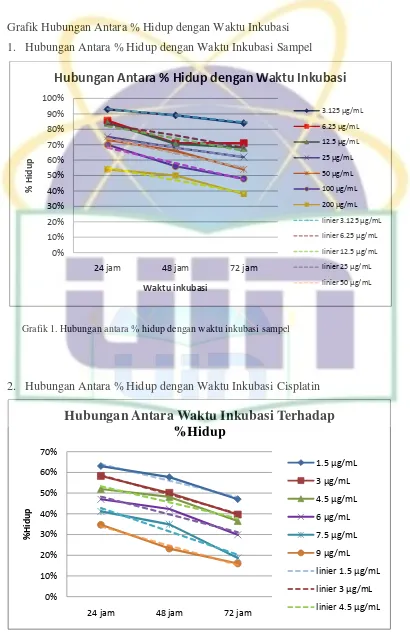
Tabel 3. Hasil Pengujian Efek Antiproliferatif Sampel 24 jam ... 60
Tabel 4. Hasil Pengujian Efek Antiproliferatif Sampel 48 jam ... 61
Tabel 5. Hasil Pengujian Efek Antiproliferatif Sampel 72 jam ... 61
Tabel 6. Hasil Pengujian Efek Antiproliferatif Cisplatin 24 jam ... 61
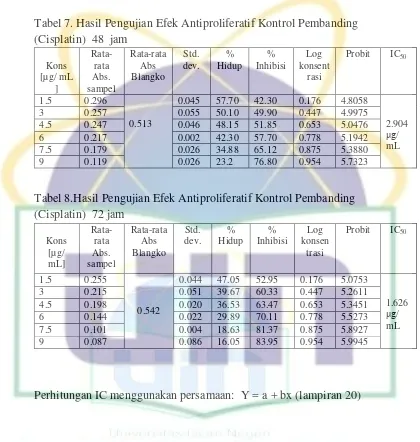
Tabel 7. Hasil Pengujian Efek Antiproliferatif Cisplatin 48 jam ... 62
Tabel 8. Hasil Pengujian Efek Antiproliferatif Cisplatin 72 jam ... 62
Tabel 9. Hasil Pengamatan Penapisan Fitokimia ... 86
Tabel 10. Perhitungan Persentase Kadar Katekin Sampel ... 90
Tabel 11. Hasil Perhitungan Konsentrasi Sampel ... 97
Tabel 12. Hasil Perhitungan Konsentrasi Cisplatin ... 98
Tabel 13. Pengujian Efek Antiproliferatif Sampel Tiap Interval Waktu .... 102
Tabel 14. PengujianEfekAntiproliferatifCisplatin per Interval Waktu ... 105
x
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur Kimia Eugenol ... 5
Gambar 2. Struktur Dasar Katekin dan Galloyl Group... ... 10
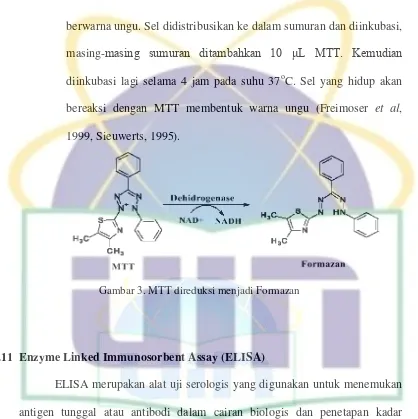
Gambar 3. MTT direduksimenjadiFormazan ... 36
Gambar 4. Eugenol ... 85
Gambar 5. BongkahGambir... 85
Gambar 6. SerbukGambir ... 85
Gambar 7. HasilIdentifikasi... 85
Gambar 8. HasilUjiCemaran Urea ... 85
Gambar 9. SerbukKatekinSampel ... 85
Gambar 10. SerbukKatekinStandar ... 85
Gambar 11. Alat Haemocytometer ... 107
Gambar 12. Pemetaan Haemocytometer ... 107
Gambar 13 Biology Safety Cabinet ... 108
Gambar 14. Incubator ... 108
Gambar 15. Autoklaf ... 108
Gambar 16. Microscope inverted ... 108
Gambar 17. Mikropipet... 108
Gambar 18. Sentrifuge... 108
Gambar 19. ELISA reader ... 108
Gambar 20. T-Flask ... 108
Gambar 21. Spektrometer ... 108
Gambar 22. Micro well Plate... 108
Gambar 23. Medium DMEM ... 109
Gambar 24. DMSO ... 109
Gambar 25. Fetal Bovine Serum ... 109
Gambar 26. MTT ... 109
Gambar 27. Tripan Blue ... 109
Gambar 28. Trypsin EDTA ... 109
Gambar 29. Phospate Buffer ... 109
xi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil Determinasi Gambir ... 82
Lampiran 2. Sertifikasi Eugenol ... 83
Lampiran 3. Sertifikat Kemurnian Katekin Standar ... 84
Lampiran 4. Eugenol, Gambir dan Katekin ... 85
Lampiran 5. Hasil Pengamatan Fitokimia ... 86
Lampiran 6. Hasil Pengujian Karakteristik Katekin ... 87
Lampiran 7. Lanjutan (lampiran 6) ... 88
Lampiran 8. Hasil Penetapan Kadar Katekin ... 89
Lampiran 9. Skema Proses Pembuatan Katekin Gambir ... 91
Lampiran 10. Skema Kerja Kultivasi sel HeLa ... 92
Lampiran11.Skema Kerja Subkultivasi Sel HeLa ... 93
Lampiran12.Uji MTT ... 94
Lampiran13.PerhitunganKonsentrasiSampel ... 95
Lampiran14.Lanjutan (lampiran 13)... ... 96
Lampiran15.Lanjutan (lampiran 13)... ... 97
Lampiran16.Perhitungan Konsentrasi Cisplatin ... 98
Lampiran17.Perhitungan Kepadatan Sel ... 99
Lampiran 18. Skema Pemetaan Sumuran 96... 100
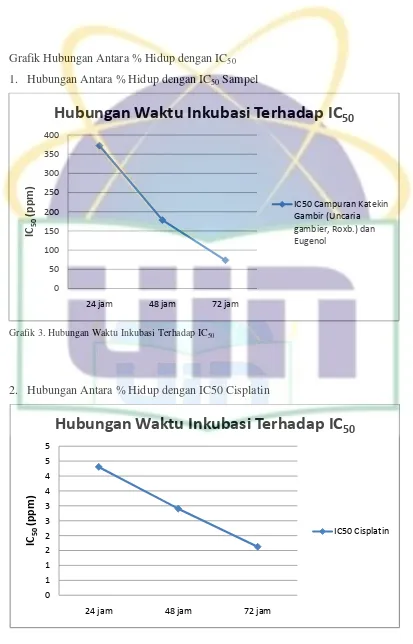
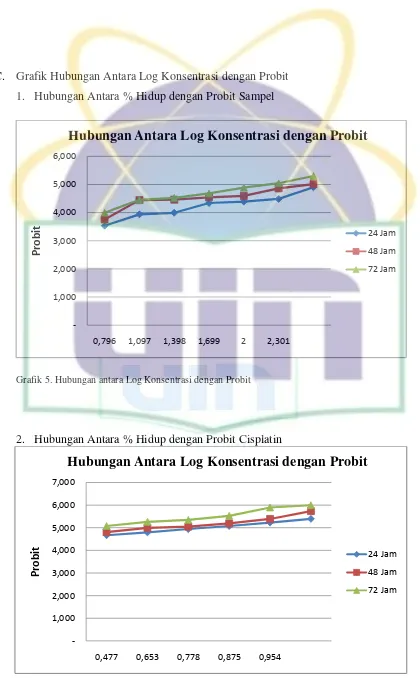
Lampiran 19. Perhitungan IC50 Sampel... 102
Lampiran 20. Perhitungan IC50Cisplatin... ... 105
Lampiran 21. Pemetaan Haemocytometer... ... 107
Lampiran22. Alat dan Bahan yang digunakan dalam penelitian ... 108
Lampiran 23. Deskripsi Medium DMEM... ... 110
xii ABSTRAK
Judul : Uji Efek Antiproliferatif Campuran Senyawa Eugenol dan Isolat Katekin Gambir (Uncaria gambier Roxb) dari Fase Etil Asetat Terhadap Kultur Sel Kanker Serviks (HeLa Cell Line)
Penelitian dilakukan untuk mengetahui efek antiproliferatif campuran katekin gambir (Unicaria gambier, Roxb) dan eugenol terhadap sel kanker HeLa secara in vitro. Katekin dari gambir (Unicaria gambier, Roxb) dicampur dengan Eugenol menggunakan DMSO. Uji antiproliferatif dilakukan melalui metode MTT assay, doubling time. Pada MTT assay dan doubling time sel kanker HeLa dibedakan menjadi lima kelompok perlakuan yakni sampel (sel+medium kultur+sampel), kontrol sel (sel+medium kultur), kontrol positif (sel+medium kultur+cisplatin), kontrol medium (kultur medium) dan kontrol pelarut (sel+medium kultur+DMSO) masing-masing seri konsentrasi tiga kali ulangan. Hasil penelitian efek antiproliferatif ini menunjukkan nilai IC50 masing-masing interval waktu (24, 48 dan 72 jam) sebesar 372.4 µg/mL, 178.24 µg/mL, dan 73.45 µg/mL. Nilai IC50 pada 72 jam menunjukkan adanya potensi sampel sebagai agen kemoprevensi.
xiii
ABSTRACT
Tittle : Antiproliferative Effect Test of Mixed Eugenol and Catechin Isolate
of Uncaria gambier Roxb from Ethyl Acetat Phase on Cervix Cancer Culture Cell (HeLa Cell Line)
The aim of this research is to know in vitro antiproliferative effect of mixed catechin of Uncaria gambier Roxb and Eugenol on HeLa cancer cells. The catechin of Uncaria gambier Roxb and Eugenol was mixed by DMSO. Antiproliferative effect test was performed by MTT assay, doubling time methods. Cell was determined by five treatment groups on the MTT assay and doubling time methods. They were the extract group (cells + culture medium + test material), cell control group (cells + culture medium), positive control group (cells + culture medium + cisplatin), medium control group (cells + culture medium), and solvent control group (cells + culture medium + DMSO), which was every series has three times repetition. The result showed that IC50 value of antiproliferative effect test on each time interval (24, 48 and &2 hour) are 372.4 µg/mL, 178.24 µg/mL, and 73.45 µg/mL. IC50 value on 72 hour showed kemopreventive agent potency.
BAB I
PENDAHULUAN
1.1Latar Belakang
Hingga saat ini, kanker serviks merupakan penyebab kematian terbanyak akibat penyakit kanker di Negara berkembang. Inisiden dan mortalitas kanker serviks di dunia menempati urutan kedua setelah kanker payudara. Semetara itu, di Negara berkembang masih menempati urutan pertama sebagai penyebab kematian akibat kanker pada wanita usia reproduktif. Diperkirakan setiap tahun dijumpai sekitar 500.000 penderita baru di seluruh dunia dan umumnya terjadi di negara berkembang (Desen, 2008). Pada tahun 2008, International Agency for Research on Cancer (IARC) melaporkan inisiden kanker serviks terjadi sebanyak
530.232 jiwa di dunia dengan angka mortalitas 275.008 jiwa. Di tahun yang sama, inisiden kanker serviks di Indonesia terjadi sebanyak 16.413 jiwa dengan mortalitas 7.493 jiwa (Globocan,2008).
Pemberian terapi baik operasi, radioterapi atau kemoterapi akan menurunkan imunitas penderita. (Sukardja, 2000)
Dewasa ini, ekstrak tumbuhan telah lama digunakan dalam pengobatan penyakit kanker. Uji antiproliferatif menyediakan data permulaan yang penting untuk membantu dalam pemilihan ekstrak-ekstrak tumbuhan yang berpotensi sebagai agen antineoplasmik (Cardellina et al. 1999). Proliferasi adalah pertumbuhan sel kanker yang tak terkendali sehingga berhasil membentuk kelompok.
Gambir (Uncaria gambier Roxb) adalah tumbuhan yang secara empiris telah dimanfaatkan tidak hanya sebagai komponen menyirih, namun juga sebagai obat-obatan. Komponen bioaktif utama pada tanaman gambir adalah flavonoid (terutama gambiriin), katekin (sekitar 51%), zat penyamak (22-50%), serta sejumlah alkaloid (seperti gambir, tannin dan turunan dihidro- dan okso-nya) (Hermawan 2009). Katekin merupakan golongan flavanoid dengan aktivitas antioksidan yang lebih tinggi daripada antioksidan sintetik (Das, 1994) . Tingginya antioksidan katekin menunjukkan potensi senyawa antiproliferatif yang bersifat toksik terhadap sel kanker (Wagner,1985).
persentase 85% untuk (–)-gallo-catechin dan 93% untuk (–)-gallocatechin gallate. Sementara persentase penghambatan pada sel kanker paru-paru adalah 87% untuk (–)-gallo-catechin dan 67% untuk (–)-gallocatechin gallate.
Pada percobaan lain, senyawa epigallocatechin gallate (EGCG) dan epicatechin gallate (ECG) menunjukkan efek antiproliferasi pada konsentrasi
100µM. Dibandingkan variabel kontrol, besar hambatan terhadap kultur sel tumor yang ditunjukkan oleh senyawa EGCG pada 24 jam dan 48 jam berturut-turut adalah 70.2 ± 1.8% dan 85.6 ± 1.0%. sedangkan nilai hambatan yang ditunjukkan oleh senyawa ECG pada 24 dan 48 jam berturut-turut adalah 34.8 ± 2.2% dan 69.2 ± 1.1%. (Tsuchiya et. al. 2008)
Selain katekin, senyawa yang terbukti dapat mempengaruhi pertumbuhan sel kanker adalah eugenol. Eugenol dapat menghambat pertumbuhan tumor sebesar 24.35% dengan dosis 100 mg/kg; i/p. (Jaganathan, 2010). Eugenol juga terbukti mempengaruhi pertumbuhan sel kanker hati secara sinifikan. Sel HCT 15 dan HT 29 ditekan oleh eugenol dengan nilai IC50 berturut-turut 300 µM untuk HTC 15 dan 500 µM untuk HT 29 (Jaganathan, 2010).
Beberapa peresepan pengobatan tradisional yang terdiri dari campuran beberapa bahan mempunyai khasiat saling menguatkan, meskipun ketika bahan tersebut berdiri sendiri sudah terbukti memiliki khasiat masing-masing. Ternyata, perpaduan dua ekstrak herbal atau lebih itu memiliki fungsi, antara lain supaya komponen-komponennya saling mendukung atau saling mengurangi efek samping (Sukardiman, 1999).
eugenol. Campuran senyawa katekin dari gambir dan eugenol murni diharapkan dapat memberikan efek atau aktivitas yang lebih baik dalam merusak atau menghambat proliferasi sel-sel kanker, khususnya sel kanker HeLa.
1.2Perumusan Masalah
Apakah campuran katekin Gambir (Uncaria gambier Roxb) dan Eugenol memiliki efek antiproliferatif terhadap kultur sel kanker serviks (HeLa cell line) ?
1.3Hipotesis
Campuran katekin Gambir (Uncaria gambier Roxb) dan Eugenol memiliki efek antiproliferatif terhadap kultur sel kanker serviks (HeLa cell line)
1.4Tujuan penelitian
Penelitian ini bertujuan untuk menguji efek antiproliferatif campuran katekin Gambir (Uncaria gambir Roxb) dan Eugenol terhadap kultur sel kanker serviks (HeLa cell line)
1.5Manfaat penelitian
1. Memberikan pengetahuan dan informasi mengenai komponen bahan alam yang berkhasiat bagi kesehatan khususnya bagi pengobatan kanker.
2. Memberikan informasi dan pengetahuan mengenai antikanker dari katekin Gambir (Uncaria gambir Roxb) dan Eugenol sehingga penelitian tekait dapat dilanjutkan.
BAB II
TINJAUAN PUSTAKA
2.1.Eugenol (Eugenolum)
2.1.1.Sifat Fisika dan Kimia (Depkes, 1995)
Rumus Kimia :
Nama IUPAC : 4-Alil-2-metoksifenol [97-53-0] Rumus Struktur : C10H12O2
Berat Molekul : 164,20
Pemerian : Cairan tidak berwarna atau kuning pucat; bau cenkeh kuat dan menusuk; rasa pedas; tidak memutar bidang polarisasi. Bila terpapar udara warna menjadi lebih tua dan mengental.
Kelarutan : Sukar larut dalam air; bercampur dengan etanol, dengan kloroform, dengan eter dan dengan minyak lemak. Kelarutan dalam etanol 70% Satu bagian volume larut dalam 2 bagian volume etanol.
Bobot Jenis : Antara 1,064 dan 1,070
Indeks Bias : Antara 1,540 dan 1,542 pada suhu 200.
2.1.2.Sumber Eugenol
Eugenol merupakan komponen terbesar yang terkandung dalam minyak daun cengkeh (49-87%) yang didistilasi uap dari daun pohon cengkeh (Eugenia caryophyllata Thunberg, famili Myrtaceae) (Anonim, 2008). Di Indonesia, daerah produksi cengkeh terdapat di sekitar Padang, Bengkulu dan Lampung (di Pulau Sumatera), dekat Minahasa (di Pulau Sulawesi) dan Ternate, Tidore, Makian, Ambon, Nusa Laut, Saparua, Amadina, Seram dan Banda (di Kepulauan Maluku). Sebagai penghasil cengkeh utama di Indonesia adalah Maluku (Guenther, 1990). Selain terdapat pada cengkeh, eugenol terdapat pula pada pala, kulit manis, salam dan daun sirih (Manopo, 2008).
2.1.3.Pemanfaatan Eugenol
Eugenol memiliki aroma yang menyegarkan dan pedas seperti bunga cengkeh kering, sehingga sering menjadi komponen untuk menyegarkan mulut. Eugenol dimanfaatkan sebagai pengaroma parfum, makanan dan pengobatan (antiseptik dan anestetik) (Manopo, 2008).
2.2TANAMAN GAMBIR (Uncaria gambier Roxb.) 2.2.1 Klasifikasi Tanaman (Haryanto, 2009)
Kingdom : Plantae
Divisi : Spermatophyta Sub Divisi : Angiospermae Kelas : Dicotyledone Ordo : Rubiales Famili : Rubiaceae Genus : Uncaria
Spesies : Uncaria gambir Roxb. Sinonim : Ourouparia gambir Roxb.
Nauclea gambir
2.2.2 Nama Daerah
Sumatera : Gambe, gani (Aceh), kacu (Gayo), sontang (Batak), gambe (Nias), gambie (Minangkabau), pengilom, sepelet (Lampung).
Jawa : Gambir (Jawa), ghambhir (Madura). Kalimantan : Kelare (Dayak), abi (Kayan).
Sulawesi : Gambere (Sangir), gambele (Gorontalo), gambere (Makassar), gaber (Majene).
2.2.3 Uraian Tanaman
Gambir berasal dari tumbuhan perdu yang membelit dan berbatang keras.Tinggi 1-3 cm. Batang tegak, bulat, percabangan simpodial warna cokelat pucat.Daun tunggal, berhadapan, bentuk elips, tepi bergerigi, pangkal bulat, ujung meruncing, panjang 8-13 cm. lebar 4-7 cm, warna hijau. Bunga majemuk, bentuk lonceng, di ketiak daun, panjang lebih kurang 5 cm, mahkota 5 helai berbentuk lonceng, tongkol-bulat, terdiri dari bunga kecil-kecil yang berwarna putih. Buah berbentuk bulat telur, panjang lebih kurang 1,5 cm, warna hitam (Haryanto, 2009 & Mardisiswojo, 1968).
2.2.4 Kandungan Kimia
Senyawa flavonoid katekin (7-33%), asam katekutanat (20-50%) (Thorpe dan Whiteley, 1921) ; gambir Sumatera Barat memiliki kandungan katekin terbanyak (40-80%) (Amos,2010)
2.2.5 Manfaat Tumbuhan
2.2.6 Efek Farmakologis
Ekstrak gambir memiliki daya hambat terhadap bakteri Streptococcus mutans yang menyebabkan plak pada gigi (Kozai et al,
1995). Khasiat lainnya sebagai obat diare dan disentri serta obat kumur-kumur pada sakit kerongkongan. Pada industri farmasi gambir digunakan sebagai bahan baku obat penyakit hati dengan paten catergen (Suherdi et al,1991; Nazir, 2000). Bahan infuse dari gambir digunakan untuk penyembuhan gangguan darah (Sukati dan Kusharyono, 2004), perangsang system saraf autonom (Kusharyono, 2004), sebagai antimikroba (Rahayuningsih et al, 2004) dan bahan toksisitas terhadap organ ginjal, hati, dan jantung (Armenia et al,2004)
2.2.7 Katekin
Komponen Katekin Konfigurasi R1 R2 (-)-epicatechin (EC) 2S, 3R OH H (-)-epicatechin gallate (ECG) 2R, 3R GA H (-)-epigallocatechin (EGC) 2R, 3R OH OH
(+)-catechin 2R, 3S OH H
(-)-epigallocatechin gallate (EGCG) 2R, 3R GA OH Tabel 1. Konfigurasi Komponen Katekin
Katekin digunakan sebagai obat tukak lambung (Tika et al, 2004) dan dapat menghambat pertumbuhan tumor mamma pada mencit dengan rasio penghambatan sebesar 57,14% pada pemberian dosis 800 mg/kgBB/hari (Gunawijaya et al, 1999). Katekin juga memiliki aktifitas sebagai antimikroba, antioksidan, antiradiasi, memperkuat pembuluh darah dan melancarkan sekresi air seni.(Alamsyah, 2006).
2.3 Simplisia
Simplisia adalah bentuk jamak dari kata simpleks yang berasal dari kata simple, berarti satu atau sederhana. Istilah simplisia dipakai untuk menyebut
bahan-bahan obat alam yang masih berada dalam wujud aslinya atau belum mengalami perubahan bentuk. Departemen kesehatan RI membuat batasan tentang simplisia bahwa simplisia adalah bahan alami yang digunakan untuk obat dan belum mengalami perubahan proses apapun, dan kecuali dinyatakan lain umumnya berupa bahan yang telah dikeringkan. Berdasarkan hal itu maka simplisia dibagi menjadi tiga golongan, yaitu simplisia nabati, simplisia hewani, dan simplisia pelikan/mineral (Depkes RI, 1979 & Gunawan, 2004).
2.3.1 Pengelolaan Simplisia
a. Sortasi Basah
Sortasi basah dilakukan untuk memisahkan kotoran-kotoran atau bahan-bahan asing lainnya dari bahan simplisia. Misalnya simplisia yang dibuat dari akar suatu tanaman obat, bahan-bahan asing seperti tanah, kerikil, rumput, batang, daun, akar yang telah rusak, serta pengotoran lainnya harus dibuang. Tanah mengandung bermacam-macam mikroba dalam jumlah yang tinggi, oleh karena itu pembersihan simplisia dari tanah yang terikut dapat mengurangi jumlah mikroba awal (Gunawan, 2004).
b. Pencucian
atau air PAM. Bahan simplisia yang mengandung zat yang mudah larut di dalam air yang mengalir, pencucian hendaknya dilakukan dalam waktu yang sesingkat mungkin (Gunawan, 2004).
c. Perajangan
Beberapa jenis bahan simplisia perlu mengalami proses perajangan. Perajangan bahan simplisia dilakukan untuk mempermudah proses pengeringan, pengepakan dan penggilingan. Semakin tipis bahan yang akan dikeringkan, semakin cepat penguapan air, sehingga mempercepat waktu pengeringan (Gunawan, 2004).
d. Pengeringan
Tujuan pengeringan ialah untuk mendapatkan simplisia yang tidak mudah rusak, sehingga dapat disimpan dalam waktu yang lebih lama. Dengan mengurangi kadar air dan menghentikan reaksi enzimatik akan dicegah penurunan mutu atau perusakan simplisia.
e. Sortasi Kering
Sortasi setelah pengeringan merupakan tahap akhir pembuatan simplisia. Tujuan sortasi memisahkan benda-benda asing seperti bagian-bagian tanaman yang tidak diinginkan dan pengotoran-pengotoran lain yang masih ada dan tertinggal pada simplisia kering. Proses ini dilakukan sebelum simplisia dibungkus untuk kemudian disimpan. Pada simplisia bentuk rimpang, sering jumlah akar yang melekat pada rimpang terlampau besar dan harus dibuang. Demikian pula adanya partikel-partikel pasir, besi dan benda-benda tanah lain yang tertinggal harus dibuang sebelum simplisia dibungkus (Depkes RI, 1999).
f. Penyimpanan
Setelah tahap pengeringan dan sortasi kering selesai maka simplisia perlu ditempatkan dalam suatu wadah tersendiri agar tidak saling bercampur antara simplsia satu dengan lainnya. Selanjutnya, wadah-wadah yang berisi simpilisia disimpan dalam rak pada gudang penyimpanan. Adapun faktor-faktor yang mempengaruhi pengepakan dan penyimpanan simplisia adalah cahaya, oksigen atau sirkulasi udara, reaksi kimia yang terjadi antara kandungan aktif tanarnan dengan wadah, penyerapan air, kemungkinan terjadinya proses dehidrasi, pengotoran atau pencemaran, baik yang diakibatkan oleh serangga, kapang atau lainnya (Gunawan, 2004). Untuk persyaratan wadah yang akan digunakan sebagai
bereaksi dengan bahan lain, tidak beracun, mampu melindungi bahan simplisia dari cemaran mikroba, kotoran, serangga, penguapan kandungan aktif serta dari pengaruh cahaya, oksigen dan uap air (Gunawan, 2004).
2.4 Ekstrak dan Ekstraksi
2.4.1 Pengertian Ekstrak dan Ekstraksi
Ekstrak adalah sediaan cair yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukakn sedemikian sehingga memenuhi baku yang telah ditetapkan (Depkes RI, 1995).
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Simplisia yang akan diekstrak mengandung senyawa aktif yang dapat larut dan senyawa yang tidak dapat larut dan mempunyai struktur kimia yang berbeda-beda yang dapat mempengaruhi kelarutan dan stabilitas senyawa-senyawa tersebut terhadap suhu, udara, cahaya, dan logam berat (Depkes RI, 2000).
2.4.2 Cara Pembuatan Ekstrak
Proses ekstraksi (pembuatan ekstrak) terdiri atas beberapa tahap, yaitu:
1. Pembuatan serbuk
Proses awal pembuatan ekstrak adalah tahapan pembuatan serbuk simplisia yang kering (penyerbukan). Dari simplisia dibuat serbuk simplisia dengan peralatan tertentu sampai derajat kehalusan tertentu.
2. Cairan pelarut
Faktor utama untuk pertimbangan pada pemilihan cairan penyari adalah sebagai berikut : selektivitas, kemudahan bekerja dan proses dengan cairan tersebut, ekonomis, ramah lingkungan, keamanan.
3. Separasi dan pemurnian
Proses-proses pada tahapan ini adalah pengendapan, pemisahan dua cairan tak campur, sentrifugasi, dekantasi, dan filtrasi.
4. Pemekatan / penguapan (vaporasi dan evaporasi)
Pemekatan berarti peningkatan jumlah partikel solute (senyawa terlarut) secara penguapan pelarut tanpa sampai menjadi kondisi kering, ekstrak hanya menjadi kental/pekat.
5. Pengeringan ekstrak
6. Rendemen
Rendemen adalah perbandingan antara ekstrak yang diperoleh dengan simplisia awal (Depkes RI, 2000).
2.4.3 Metode Ekstraksi
Ada dua cara ekstraksi, yaitu :
a. Cara dingin 1) Cara maserasi
Maserasi adalah proses pengekstrakan simplisia dengan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruang (kamar). Remaserasi berarti dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama, dan seterusnya.
Cairan penyari yang digunakan dapat berupa air, etanol, air-etanol atau pelarut lain. Keuntungan cara penyarian dengan maserasi adalah cara pengerjaan dan peralatan yang digunakan sederhana dan mudah diusahakan. Sedangkan kerugian dari maserasi adalah pengerjaannya lama dan penyariannya kurang sempurna.
2) Perkolasi
b. Cara panas 1) Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik. Biasanya dilakukan pengulangan proses pada residu pertama sampai 3-5 kali sehingga terbentuk proses ekstraksi sempurna.
2) Soklet
Soklet adalah ekstraksi menggunakan pelarut yang baru, secara umum dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinyu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
3) Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinyu) pada temperatur yang lebih tinggi dari temperatur ruangan yaitu secara umum pada temperature 40-50°C.
4) Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur penangas air mendidih (96-98°C) selama waktu tertentu (15-20 menit).
5) Dekok
2.4.4 Parameter Ekstrak
Parameter non spesifik ekstrak terdiri dari: a. Susut pengeringan
Susut pengeringan adalah pengukuran sisa zat setelah pengeringan pada temperatur 105oC selama 30 menit atau sampai berat konstan, yang dinyatakan sebagai nilai persen (%). Tujuannya untuk memberikan batasan maksimal (rentang) tentang besarnya senyawa yang hilang pada proses pengeringan. Nilai untuk susut pengeringan jika tidak dinyatakan lain adalah kurang dari 10 %.
b. Kadar air
Kadar air adalah pengukuran kandungan air yang berada di dalam bahan. Tujuannya untuk memberikan batasan maksimal (rentang) tentang besarnya kandungan air di dalam bahan. Nilai untuk kadar air sesuai dengan yang tertera dalam monografi.
c. Kadar abu
2.5 Kanker
2.5.1 Pengertian Kanker
Kanker atau neoplasma merupakan massa jaringan abnormal dengan pertumbuhan berlebihan, tidak berkoordinasi dengan pertumbuhan jaringan normal, dan tetap tumbuh secara berlebihan setelah stimulus yang menimbulkan perubahan tersebut berhenti (Robbins dan Kumar, 1995). Sel kanker akan menyusup ke jaringan sekitarnya (invasif), lalu bermetastasis ke tempat yang lebih jauh melalui pembuluh darah dan getah bening (Dalimartha, 2001). Sifat umum dari kanker adalah sebagai berikut :
1. Pertumbuhan berlebihan umumnya membentuk tumor.
2. Gangguan diferensasi dari sel dan jaringan mirip jaringan mudigah. 3. Bersifat invasif, mampu tumbuh di jaringan di dekatnya (perbedaan
pokok dengan jaringan normal)
4. Bersifat metastatik, menyebar ke tempat lain dan menyebabkan pertumbuhan baru;
5. Memiliki acquired heredity, yaitu keturunan sel kanker juga dapat menimbulkan kanker.
6. Pergeseran metabolisme ke arah pembentukan makromolekul dari nukleosida dan asam amino dan peningkatan katabolisme karbohidrat untuk energi sel. (Farmakologi dan terapi ed. 2 FKUI 1980)
Kanker dibedakan menurut jaringan tempatnya berasal yaitu adenoma (benjolan maligne pada kelenjar), limfoma (kanker pada
atau tulang), leukimia (kanker yang berhubungan dengan produksi leukosit abnormal), myeloma (kanker pada sumsum tulang), carcinoma (kanker pada kelenjar) dan melanoma (kanker pada kulit) (Tjay, 2002).
Penyebab yang dapat merangsang pembentukan kanker, diantaranya (Dalimartha, 2001):
a. Senyawa kimia (karsinogen), seperti zat pewarna, pengawet, merkuri, dll.
b. Faktor fisika, misalnya radioterapi agresif (radiasi sinar pengion). c. Virus, contoh: virus hepatitis B dan C penyebab hepatis kronis,
Humam Papilloma Virus (HPV) penyebab kanker serviks, dll.
d. Hormon, pemberian hormon tertentu secara berlebihan dapat menimbulkan kanker seperti payudara, rahim, indung telur dan prostat.
e. Faktor genetis, dapat terjadi apabila individu memiliki gen rusak yang diwariskan secara genetis dari orang tuanya.
Kanker dapat terjadi melalui beberapa tahapan, yaitu (Miller, 2008):
Fase inisiasi, terjadi kerusakan secara langsung dalam bentuk
terjadinya mutasi pada DNA dalam sel. Kerusakan akan terbawa pada sel anak yang dihasilkan dari pembelahan oleh sel-sel.
Fase promosi, terjadi perkembangbiakan pada sel yang rusak, hal ini
Fase progresi, gen-gen pertumbuhan yang diaktivasi oleh kerusakan
DNA mengakibatkan mitose dipercepat dan pertumbuhan liar dari sel-sel ganas. Tumor menjadi manifes.
Pengobatan kanker dapat dilakukan dengan beberapa cara yaitu pembedahan, radioterapi, kemoterapi, imunoterapi, pengobatan dengan hormon serta tumbuhan obat, simplisia dari binatang dan mineral lainnya (Dalimartha, 2001).
2.5.2 Kanker Serviks
Penyakit ini berawal dari infeksi virus yang merangsang perubahan perilaku sel epitel serviks.Sel kanker serviks pada awalnya berasal dari epitel serviks yang mengalami mutasi genetik sehingga mengubah perilakunya.Sel yang bermutasi ini melakukan pembelahan sel yang tidak terkendali, immortal dan menginvasi jaringan stroma di bawahnya. Keadaan yang menyebabkan mutasi genetik yang tidak dapat diperbaiki akan menyebabkan terjadinya pertumbuhan kanker ini. (Desen, 2008)
Faktor risiko yang merupakan pencetus kanker serviks, antara lain (Rasjidi, 2007):
penyebab kanker adalah tipe 16, 18 dan 52. Tipe ini menimbulkan lesi rata dan tidak terlihat sedangkan tipe risiko rendah menimbulkan pertumbuhan seperti jengger ayam pada tipe HPV 6 dan 11 (Aziz, 2006).
e. Berganti-ganti mitra seks dan usia saat melakukan hubungan seks yang pertama dibawah umur 15 tahun.
f. Merokok, asap rokok bersifat karsinogen dan mutagen.
g. Defisiensi terhadap asam folat, vitamin C, E, beta karoten dihubungkan dengan risiko kanker serviks.
1. Gejala dan Tanda Kanker Serviks (Buku Acuan Nasional
Onkologi Ginekologi, 2006)
Tanda dini kanker serviks tidak spesifik seperti adanya sekret vagina yang agak banyak dan kadang-kadang dengan bercak pendarahan.Umumnya tanda yang sangat minimal ini sering diabaikan oleh penderita.
mendapat aliran darah yang cukup.Nekrosis ini menimbulkan bau yang tidak sedap dan reaksi peradangan non spesifik.
Pada stadium lanjut ketika tumor telah menyebar ke luar dari serviks dan melibatkan jaringan di rongga pelvis dapat dijumpai tanda lain seperti nyeri yang menjalar ke pinggul atau kaki. Hal ini menandakan keterlibatan ureter, dinding panggul, atau nervus skiatik.Beberapa penderita mengeluhkan nyeri berkemih, hematuria, perdarahan rektum sampai sulit berkemih dan buang air besar.Penyebaran ke kelenjar getah bening tungkai bawah dapat menimbulkan oedema tungkai bawah, atau terjadi uremia bila telah terjadi penyumbatan kedua ureter.
2.Terapi
Secara umum jenis terapi yang dapat diberikan bergantung pada usia dan keadaan umum penderita, luasnya penyebaran, dan komplikasi lain yang menyertai. Untuk ini, diperlukan pemeriksaan fisik yang seksama.Juga diperlukan kerjasama yang baik antara ginekologi onkologi dengan radioterapi dan patologi anatomi.
Terapi tunggal baik radiasi atau operasi merupakan pilihan bila kanker serviks dapat didiagnosis dalam stadium dini.
2.6 HeLaCell Line
Sel HeLa ini berasal dari tumor ganas serviks milik Henrietta Lacks. Sel ini telah digunakan di laboratorium di seluruh dunia tak terhitung jumlahnya. Sel tersebut telah membantu penemuan beberapa penelitian. Kutipan ilmiah di US National Library of Medicine menunjukkan bahwa ada sekitar 61.911 studi yang telah menggunakan sel ini. sel HeLa telah menjadi komponen berharga dalam memahami penyakit pada tingkat molekul khususnya model pemahaman kanker invitro. Selain itu, sel ini telah berperan dalam penyaringan obat anti-kanker. Sebagai contoh, sel ini digunakan untuk menyebarkan virus polio yang akhirnya mengarah pada penemuan dan pengembangan vaksin polio. Saat ini strategi tersebut digunakan dalam berbagai laboratorium di seluruh dunia untuk pengembangan vaksin.
Sel HeLa merupakan kategori cell line atau sel lestari, yaitu kultur sel yang berasal dari organ atau jaringan yang telah diuraikan secara mekanis dan atau enzimatis menjadi suspensi sel. Suspensi tersebut kemudian dibiakkan menjadi satu lapisan jaringan (monolayer) diatas permukaan yang keras (botol, tabung, cawan) atau menjadi suspensi sel dalam media penumbuh. Monolayer tersebut kemudian dapat diperbanyak lagi sesudah melalui proses pemisahan sel secara enzimatis dan diencerkan dengan media penumbuh. Apabila di subkultur terus menerus maka dihasilkan sel lestari (Malole, 1990).
2.7 Antikanker
2.7.1 Obat Antikanker
Obat antikanker merupakan senyawa kemoterapetik untuk pengobatan tumor yang membahayakan dan diharapkan memiliki toksisitas selektif dalam menghancurkan sel kanker tanpa merusak sel jaringan normal. Terapi dikatakan berhasil apabila mematikan sel tumor yang ganas dan tidak mengganggu sel normal yang berproliferasi (Departemen Farmakologi dan Terapeutik, 2007; Siswandono, 2000)
2.7.2 Mekanisme Kerja Obat Antikanker (Siswandono, 2000; Departemen Farnakologi dan Terapeutik, 2007)
1. Fase mitosis (M), terjadi pembelahan sel aktif. Replikasi kromosom terpisah menjadi dua inti anak sel yang berlangsung selama 1 jam. Pada fase ini terjadi dua alternatif yaitu:
a. Menuju fase G1 dan memulai proses proliferasi.
b. Masuk ke fase istirahat (Go), kemampuan sel untuk berproliferasi hilang dan sel meninggalkan siklus secara tidak terpulihkan. 2. Fase post mitotik (G1), terjadi sintesis RNA dan protein. Pada fase
akhir terjadi sintesis RNA yang optimum. Fase ini umumnya terjadi kurang lebih 5 jam.
3. Fase sintetik (S), terjadi replikasi DNA dengan bantuan DNA-polimerase yang menghasilkan DNA baru, sehingga rantai tunggal DNA menjadi rantai ganda. Fase ini terjadi selama 7 jam.
4. Fase post sintetik (G2), terjadi bila sel telah menjadi tetraploid dan mengandung dua DNA, kemudian sintesis RNA dan protein dilanjutkan. Fase ini terjadi selama 3 jam. Selanjutnya sel kembali ke fase mitotik.
2.7.3 Golongan Obat Antikanker
a. Senyawa Pengalkilasi
pengobatan limfosarkoma, penyakit Hodgkin, leukimia limfositik dan mieloma. Contoh senyawa pengalkilasi: mekloretamin, klorambusil, siklosfosfamid, bisulfan, dan karmustin (Tjay, 2002; Siswandono, 2000).
b. Antimetabolit
Antimetabolit menghambat asam folat, purin, pirimidin dan asam amino, serta jalur nukleosida pirimidin pada sintesis DNA sel kanker. Replikasi DNA dapat dihambat secara langsung maupun tidak langsung yang menyebabkan sel tidak berkembang biak dan mengalami kematian (Siswandono, 2000; Tjay, 2002).
Berdasarkan sifat antagonismenya, golongan ini terdiri dari empat kelompok yaitu (Siswandono, 2000; Tjay, 2002):
1) Antagonis Pirmidin
Obat golongan ini mengalami anabolisme menjadi senyawa aktif secara in vivo, sehingga dapat mempengaruhi sintesis DNA pada fase awal yang menyebabkan kekosongan asam timidilat akibatnya sel mengalami kematian. Contoh: 5-fluorourasil, sitarabin, tegafur dan floksuridin.
2) Antagonis Purin
3) Antagonis Asam Folat
Pada golongan ini obat bekerja tidak khas dengan menghambat secara bersaing dihidrofolat reduktase (enzim yang mengkatalisis reduksi asam dihidrofolat menjadi asam tetrahidrofolat). Antagonis asam folat mengikat enzim tersebut sehingga terjadi hambatan tak terpulihkan. Penghambatan enzim dihidrofolat reduktase menyebabkan hambatan sintesis DNA, RNA dan protein. Antagonis asam folat menghambat timidilat sintetase sehingga menyebabkan kematian sel karena kekurangan timin. Contoh: aminopterin, metotreksat dan ketotreksat.
4) Antagonis Asam Amino
Antagonis asam amino menghambat beberapa proses metabolik yang memerlukan glutamin sebagai kofaktor. Aktivitas antikanker disebabkan oleh kemampuan menghambat fosforibosil formilglisinamida ribonukleotida menjadi fosmilglisinamidin ribonukleotida. Contoh: azaserin dan 6-diazo-5-okso-L-norleusin (DON).
c. Antikanker Produk Alam
Senyawa antikanker ini dihasilkan dari alam dan memiliki khasiat sebagai antikanker. Obat antikanker golongan ini terbagi menjadi (Siswandono, 2000; Tjay, 2002):
1) Antibiotika Antikanker
dan dikembangkan menjadi obat antikanker. Antibiotika antikanker sukar diabsorpsi pada saluran cerna sehingga diberikan melalui parenteral. Contoh: mitomisin, daktinomisin, doksurubisin, dan bleomisin.
2) Antikanker Produk Tanaman
Obat-obat antikanker golongan ini bekerja dengan mengikat tubuli dan menghambat pertumbuhan komponen mikrotubuli pada kumparan mitosis sehiggga metafase berhenti. Alkaloid vinca bekerja pada fase M, vinkristin memiliki kemampuan penetrasi ke dalam sel kanker yang lebih baik dibanding vinblastin. Contoh: vinblastin, vinkristin, dan podophyllotoksin (seperti etoposida).
3) Antikanker Produk Rekayasa Genetika
Obat yang termasuk dalam golongan ini yaitu interferon α -2a (Roferon-A) dan interferon α-2b (Intron-A) yang mengandung 165 asam amino, dihasilkan melalui teknologi rekombinan DNA menggunakan rekayasa genetik pada strain E.coli. contoh lainnya: antineoplaston dan avaron.
d. Hormon
e. Golongan Lain-lain
Sitostatika lainnya yang digunakan berupa enzim asparaginase, senyawa-senyawa platina berupa sisplatin dan
karboplatin, hidroksiurea, procarbazin dan topotecan yang menghambat enzim topoisimerase-1, yang terlibat pada replikasi DNA. Kompleksnya dengan DNA distabilkan, menimbulkan cacat dan matinya sel (Siswandono, 2000; Tjay, 2002).
2.8 Cisplatin (Farmakologi dan terapi 2008)
Cisplatin merupakan obat kanker golongan platinum.Cisplatin juga merupakan metal inorganik.Karena toksisitas cisplastin yang mempunyai sitotoksisitas sinergik dengan radiasi dan obat kemoterapi lain (Mary dan Pamela, 2001; Departemen Farmakologi dan terapi, 2008).
Karena toksisitas cisplastin yang mempunyai sitotoksisitas sinergik dengan radiasi dan obat kemoterapi lain (Mary dan Pamela, 2001).
1). Mekanisme kerja:
Mekanisme kerja sama dengan alkilator. Golongan obat ini membunuh sel pada semua siklus pertumbuhannya, menghambat biosintesis DNA dan berikatan dengan DNA membentuk ikatan silang (cross linking). Sitotoksisitas dapat terjadi pada setiap tahap pengembangan siklus sel, tetapi sel yang paling peka adalah fase G1 dan S. Tempat ikatan utama adalah N7 pada guanin, namun juga terbentuk ikatan kovalen dengan adenin dan sitosin.
Pada lingkungan plasma yang tinggi klorida, cisplastin menetapkan sebagai jenis netral, yang masuk sel dan terikat pada N’ guanine DNA, membentuk crosslink inter- dan intra- strand. Lesi sitotoksik yang menghambat sintesis DNA dan RNA (Mary dan Pamela, 2001).
2). Farmakokinetik
3). Penggunaan dalam terapi
Cispaltin banyak digunakan untuk pengobatan tumor padat seperti metastasis karsinoma testis dikombinasikan dengan vinblastin dan bleomisin, karinoma ovarium kombinasi dengan siklofosfamid, atau tunggal untuk karsinoma kanndung kemih (Mary dan Pamela, 2001).
4). Efek samping
Muntah yang hebat dan persisten terjadi 1 jam setelah pemberian cisplatin dan dapat berlangsung sampai 5 hari. Premedikasi dengan antiemetik biasanya dapat menolong.Toksisitas terbatas yang paling sering adalah nefrotoksisitas yang tergantung dosis, menyangkut tubulus renalis kontortus distal dan tubulus renalis rektus.Kedaan ini diperburuk oleh hidrasi hebat dan diuresis (Mary dan Pamela, 2001).
Efek samping utama cisplat in adalah nefrotoksisitas.Hidrasi yang cukup dengan garam fisiologis atau manitol penting untuk mengurangi nefrotoksisitas.Selain itu, cisplatin juga menyebabkan neurotoksisitas perifer yang irreversibel (Departemen Farmakologi dan terapi, 2008).
2.9 Kultur Sel (Malole, 1990; Freshney,1992)
diperbanyak dan diencerkan pada media penumbuh disebut teknik subkultur (pasase). Subkultur yang dilakukan terus-menerus akan dihasilkan sel lestari dengan sifat meningkatnya jumlah sel, memiliki daya tumbuh tinggi, sel-sel tersebut seragam dan mengalami perubahan fenotip atau transformasi.
Kultur sel memerlukan adanya pergantian medium secara berkala yang diikuti subkultur jika sel-sel berproliferasi, intervalnya berbeda-beda sesuai jenis sel yang tergantung pada kecepatan pertumbuhan dan metabolisme sel. Sel disimpan dalam inkubator pada lingkungan ber CO2 dengan suhu 37oC.
Persediaan sel manusia dan hewan yang akan dibiakan dalam kultur, disimpan beku dalam nitrogen cair. Selama proses penyimpanan ini digunakan larutan dimetil sulfoksida (DMSO) sebagai agen krioprotektan bersama medium untuk mengawetkan sel pada suhu dibawah -70°C. DMSO juga memiliki kemampuan untuk berpenetrasi kedalam sel dan membekukan cairan sel tanpa menyebabkan terbentuknya kristal es.
Subkultur bertujuan untuk memperbanyak kultur sel, selain itu juga untuk mempertahankan kelangsungan hidup sel karena labu kultur yang telah penuh dengan sel akan menghambat pertumbuhan sel itu sendiri.Pengaruh lingkungan kultur meliputi:
1. Kondisi alami substrat yang terdiri dari:
a. Substrat
terbuat dari plastik polistiren yang telah diolah dengan radiasi sinar gamma, dengan zat kimia atau dengan pengisian muatan listrik untuk menghasilkan permukaan yang bermuatan sehingga mudah terbasahi.
b. pH
kebanyakan sel turunan akan tumbuh baik pada pH 7,4 walaupun pH optimum untuk pertumbuhan sel bervariasi antara beberapa jenis sel.
c. Dapar (buffer)
Dapar ditambahkan kedalam medium untuk mempertahankan pH. Dapar natrium bikarbonat paling sering digunakan karena toksisitasnya rendah, murah dan memberikan nutrisi bagi kultur sel.
2. Komposisi medium
Komposisi medium sangat beragam, mulai dari asam amino esensial, vitamin dan garam sampai dengan senyawa yang kompleks
3. Penyusunan fase lag gas (dalam inkubator)
Meliputi oksigen dan karbondioksida.
4. Suhu inkubasi
2.10 UJI ANTIPROLIFERATIF
Proliferasi adalah pertumbuhan sel kanker yang tak terkendali sehingga berhasil membentuk kelompok. Aktivitas antiproliferasi terhadap suatu sel dan harga IC50 ditetapkan melalui uji sitotoksik dan pengamatan kinetika proliferasi dengan metode MTT (Utami, Dwi. 2007)
Adanya kemampuan bertahan hidup diartikan sebagai tidak hilangnya kemampuan metabolik atau proliferasi dan dapat diukur dari pertambahan jumlah sel, peningkatan jumlah protein atau DNA yang disintesis. Uji antiproliferatif merupakan salah satu metode untuk mengetahui pertumbuhan sel diukur dari persamaan regresi linear yang dibuat dari slope sehingga menggambarkan kinetika proliferasi sel. Uji ini didasarkan pada uji sitotoksisitas. Jumlah sel yang bertahan hidup pada uji sitotoksisitas ditetapkan dengan beberapa cara yang didasarkan pada parameter kerusakan membran meliputi perhitungan sel yang mengambil (uptake) atau tidak mengambil bahan pewarna seperti biru tripan (Freshney, 1987; Malole, 1990).
2.10.1 Metode Pengujian Antiproliferatif
Metode pengujian antiproliferatif dilakukan dengan mengghunakan metode reduksi pewarna tetrazolium, menggunakan garam tetrazolium (MTT) yang merupakan singkatan dari (3–[4,5– dimethylthiazol–2Yi]–2,5–diphenyl tetrazolium bromide) yaitu metode penghitungan sel hidup dengan pewarnaan (kolorimetri) untuk menghitung jumlah sel hidup berdasarkan reduksi oleh enzim suksinat dehidrogenase mitokondria pada sel dari garam tetrazolium
berwarna ungu. Sel didistribusikan ke dalam sumuran dan diinkubasi, masing-masing sumuran ditambahkan 10 μL MTT. Kemudian diinkubasi lagi selama 4 jam pada suhu 37oC. Sel yang hidup akan bereaksi dengan MTT membentuk warna ungu (Freimoser et al, 1999, Sieuwerts, 1995).
2.11 Enzyme Linked Immunosorbent Assay (ELISA)
ELISA merupakan alat uji serologis yang digunakan untuk menemukan antigen tunggal atau antibodi dalam cairan biologis dan penetapan kadar imunosorben taut-enzim. Uji ini dibagi menjadi dua jenis yaitu competitive assay yang menggunakan konjugat antigen-enzim atau konjugat antibodi-enzim
dan non-competitive assay yang menggunakan dua antibodi, antibodi kedua akan dikonjugasikan dengan enzim sebagai indikator (Baratawidjaya, 2004).
2.12 Potensi Penelitian
Penelitian-penelitian terdahulu membuktikan adanya potensi yang baik dari senyawa katekin maupun eugenol.Baik secara umum, maupun secara khusus, yang dalam hal ini adalah penghambatan sel-sel kanker.
katekin telah teruji memiliki efek antiinflamasi dengan dosis pemberian 100 dan 200 mg/KgBB pada marmut (Arundina et al, 2003). Rasio penghambatan pertumbuhan tumor mamma dicapai katekin hingga 57.14% dengan dosis 800 mg/kgBB/hari (Gunawijaya e.t al., 1999). Aktivitas katekin sebagai antioksidan yang diujikan pada suhu 400, 500 dan 600C masing-masing menunjukkan rasio penghambatan sebesar 37,55%, 36,51% dan 29,67% (Hukmah, 2007).
MCF-7 (kanker payudara) yang dikultur selama 48 jam pada konsentrasi 300 µg/ml sebesar 52,95% (Alshatwi, 2010).
Eugenol dilaporkan dapat menginduksi apoptosis pada sel melanoma manusia (G361) hingga 50% dalam masa inkubasi selama 24 jam dan 100% dalam masa inkubasi 72 jam (Kim, 2006). Uji antiproliferatif eugenol terhadap sel melanoma malignant manusia (WM1205Lu) mengindikasikan bahwa eugenol dapat menginduksi apoptosis sel WM1205Lu, (Ghosh, 2005).
Penelitian aktivitas sitotoksik dari pencampuran beberapa komponen minyak essensial dengan perbandingan 1:1 dan konsentrasi masing-masing
komponen 50 μg/mLyang diujikan pada sel MCF-7 (sel kanker payudara) menunjukkan persen kematian sel eugenol ataupun campuran eugenol:berberapa komponen minyak esensial sebesar < 50%, kecuali pada campuran eugenol:citral yang menunjukkan persen kematian sebesar 90% (Wright, 2007)
Efek antioksidant dari eugenol telah dibandingkan dengan beberapa senyawa fenol lainnya, yaitu 4-allyl-2,6-dimethoxyphenol; p,p’-biphenol; 2-allyl-6-methylphenol; honokiol; magnolol; caffeic acid; p-ethylphenol dan guaiacol. Berdasarkan hubungan struktur-aktivitas, aktivitas antioksidant
senyawa fenol yang dihasilkan 4-allyl-2,6-dimethoxyphenol p,p’-biphenol > eugenol > 2-allyl-6-methylphenol > honokiol > magnolol > caffeic acid >
sehingga dapat berperan dalam menghentikan reaksi ikatan radikal bebas (Ogata, 1997). Kemampuan antiradikal dari minyak esensial Cinnamomum zelanycum, dengan komponen eugenol 89.1% memiliki aktivitas antiradikal
efek dari minyak esensial lebih tinggi dari butylated hydroxyl toluene (BHT) (SC50= 7 mg/L) (Dongmo, 2007).
2.13 KERANGKA KONSEP PENELITIAN Carcinoma) dengan IC50 32.1 ppm (Sadava
et al., 2007), katekin hidrat (300 µg/mL) menghambat proliferasi sel MCF-7 (kanker
payudara) sebesar 52.95% (Alshatwi, 2010). EGCG memiliki nilai IC50 sebesar
12.51 ppm dan 21.96 ppm untuk menghambat proliferasi sel kanker serviks
yaitu sel CaSki dan sel HeLa (Qiao et al., - menekan pertumbuhan sel
BAB III
METODOLOGI PENELITIAN
3.1Waktu dan Tempat Penelitian
3.1.1Waktu Penelitian
Penelitian ini berlangsung mulai daribulan Mei hingga Oktober 2011.
3.1.2 Tempat Penelitian
Pembuatan sampel uji dan uji antiproliferatif dilakukan di Laboratorium FKIK UIN dan Laboratorium Departemen Patologi dan Anatomi FKUI Salemba.
3.2Alat dan Bahan
3.2.1 Alat Penelitian
3.2.2 Bahan yang Digunakan
a. Sampel Uji
Sampel uji yang digunakan dalam uji antiproliferasi ini adalah Eugenol dan Katekin gambir (Uncaria gambier, Roxb) dalam fase etil asetat yang telah diidentifikasi di Herbarium Bogoriense Litbang LIPI Bogor, Cibinong.
b. Sel Uji
Pada uji antiproliferatif ini, sel uji yang digunakan adalah sel HeLa yang diperoleh dari stok Fakultas Kedokteran Hewan Institut Pertanian Bogor – Bogor yang merupakan Pasase 3.
c. Bahan Kimia yang Digunakan
Aquadest, kloroform, etil asetat, etanol 70%, HCl, dragendorf, meyer, serbuk Mg, amil alkohol, FeCl3, pereaksi Stiasny (Formaldehid 30% : HCl pekat = 2 : 1), Na asetat, NaOH, pereaksi Liebermann-Buchard (2 tetes asam asetat anhidrat dan 1 tetes H2SO4 pekat), eter, ammonia (NH4OH) 10%, media sel DMEM (Dulbecco's Modified Eagle's Medium) (Sigma), Phosphate Buffered Salina (PBS), Penicillin-streptomisin (Pen-Strep), Fetal Bovine Serum (FBS) (Sigma), Trypsin EDTA 5% (Sigma), MTT [3-(4,5 dimetiltiazol-2-yI)-2,5 difenil tetrazolium bromide] (Sigma), Trypan Blue (Sigma),
3.3 Prosedur Penelitian
3.3.1 Penyiapan Simplisia Uji
Penyiapan gambir yaitu dengan cara membersihkannya dari pengotor, gambir yang digunakan yaitu berupa bongkahan yang diperoleh dari Payakumbuh Padang Sumatera Barat. Bongkahan gambir kemudian dihaluskan sampai menjadi serbuk. Serbuk gambir tersebut diidentifikasi dan dilakukan pemeriksaan kadar urea untuk mengetahui kadar urea yang terkandung didalamnya.
3.3.2 Identifikasi Gambir
1. 2 mg serbuk gambir ditambahkan 5 tetes asam sulfat P warna coklat merah
2. 2 mg serbuk gambir ditambahkan asam sulfat 10 N warna coklat muda
3. 2 mg serbuk gambir ditambahkan 5 tetes Na hidroksida 5% dalam etanol warna coklat merah
4. 2 mg serbuk gambir ditambahkan 5 tetes ammonia 25% warna coklat merah
5. 2 mg serbuk gambir ditambahkan 5 tetes larutan FeCl3 5% coklat kehitaman (Depkes RI, 1989).
3.3.3 Identifikasi Cemaran Urea
3.3.4 Isolasi Katekin Gambir
Sebanyak 500 gram serbuk gambir diekstraksi dengan pelarut air pada temperatur mendidih 90-960C selama 15-20 menit sambil diaduk. Selanjutnya, infusa disaring dalam keadaan panas menggunakan corong yang dilapisi dengan kertas saring (DepKes, 1986). Residu dibilas kembali dengan air panas (900C) dan disaring hingga jernih. Filtrat dipartisi dengan etil asetat dengan perbandingan filtrat:etil asetat yaitu 1:½ kemudian ditambahkan dengan NaCl hingga jenuh. Fase air dipartisi kembali dengan etil asetat. Proses ini dilakukan hingga lima kali, kemudian fase air dibuang dan fase etil asetat yang diperoleh dikumpulkan untuk dievaporasi hingga kental, kemudian diberi air dingin, diambil endapannya dan dikeringkan menggunakan oven pada suhu 70oC, lalu dilakukan penetapan kadar katekin yang dibandingkan dengan katekin standar, penetapan kadar air dan kadar abu, uji jarak lebur dan penghitungan rendemen katekin total serta uji penapisan fitokimia.
3.3.5 Penapisan Fitokimia
Pemeriksaan kandungan golongan senyawa kimia dari serbuk ekstrak air gambir (Unicaria gambir) yang dilakukan antara lain ialah ujialkaloid, flavonoid, saponin, tanin, steroid, glikosida, steroid, triterpenoid,dan kumarin.
1) Alkaloid
ditambahkan 20 mlkloroform dean digerus kembali dengan kuat. Campuran tersebut disaringdengan menggunakan kertas saring. Filtrat berupa larutan organik diambil(larutan A). Sebanyak 10 ml larutan A diambil kemudian diekstraksi dengan10 ml larutan HCl 1 : 10 dengan pengocokan dalam tabung reaksi, ambillarutan bagian atasnya (larutan B). Larutan A diteteskan beberapa tetes padakertas saring dan disemprot atau ditetesi dengan pereaksi Dragendorf,terbentuk warna merah/jingga pada kertas saring menunjukkan adanyasenyawa alkaloid. Larutan B dibagi dalam dua tabung reaksi, kemudianditambahkan masing–masing pereaksi Dragendorf dan Mayer, terbentukendapan merah bata dengan pereaksi Dragendorf dan endapan putih denganpereksi Mayer menunjukkan adanya senyawa golongan alkaloid(Fransworth, 1969). 2) Glikosida
menjadibiru/lembayung menunjukkan adanya glikosida (Guevara et al, 1985).
3) Saponin
Ditimbang 0,5 gram serbuk simplisia, dimasukkan ke dalam tabungreaksi, kemudian ditambahkan 10 mL air panas, didinginkan dan kemudiankocok kuat-kuat selama 10 detik. (jika zat yang diperiksa berupa sediaancair, encerkan 1 mL sediaan yang diperiksa dengan 10 mL air dan kocok kuat-kuat selama 10 menit); sehingga terbentuk buih yang mantap selama tidakkurang dari 10 menit, setinggi 1 cm sampai 10 cm. Pada penambahan 1 tetesasam klorida 2 N, buih tidak hilang (Fransworth, 1969).
4) Flavonoid
2 gram serbuk simplisia ditambahkan 100 mL air panas, didihkanselama 5 menit. Setelah 5 menit, saring dengan kertas saring, diperolehfiltrat yang akan digunakan sebagai larutan percobaan. Kedalam 5 mL larutanpercobaan (dalam tabung reaksi), ditambahkan serbuk atau lempengmagnesium secukupnya dan 1 mL HCl pekat, tambahkan 5 mL amilalkohol,dikocok dengan kuat, biarkan hingga memisah, terbentuk warna dalamlarutan amilalkohol menunjukkan adanya senyawa flavonoid (Fransworth,1969).
5) Tanin
(III) klorida 1%,terbentuk warna biru tua atau hijau kehitaman menunjukkan adanya senyawa golongan tanin. Kedalam filtrat yang kedua ditambahkan 15 mlpereaksi Stiasny (Formaldehid 30% : HCl pekat = 2:1), dipanaskan di ataspenangas air, terbentuk endapan warna merah muda menunjukkan adanyatanin katekuat. Selanjutnya endapan disaring, filtrat dijanuhkan dengannatrium asetat, ditambahkan beberapa tetes larutan Ferri (III) klorida 1%,terbentuk warna biru tinta menunjukkan adanya tanin galat (Fransworth,1969). 6) Kuinon
2 gram serbuk simplisia ditambahkan 100 ml air panas, didihkanselama 5 menit. Setelah 5 menit, saring dengan kertas saring, diperolehfiltrat yang akan digunakan sebagai larutan percobaan. Di dalam tabungreaksi, filtrat ditambahkan dengan beberapa tetes larutan NaOH 1 N,terbentuk warna merah menunjukkan adanya senyawa golongan kuinon (Fransworth, 1969). 7) Steroid dan Triterpenoid
8) Kumarin
2 gram simplisia dimasukkan dalam tabung reaksi (volume 20 mL) ditambahkan 10 mL pelarut kloroform dan pasang corong (yang diberilapisan kapas yang telah dibasahi air) pada mulut tabung. Selanjutnyapanaskan selama 20 menit di antas penangas air dan dinginkan, kemudiansaring dengan kertas saring. Filtrat di dalam cawan penguap diuapkansampai kering, sisa ditambahkan air panas sebanyak 10 mL, dinginkan,larutan dimasukkan ke dalam tabung reaksi, kemudian ditambahkan 1,5 mllarutan amonia (NH4OH) 10%, amati di bawah sinar ultraviolet padapanjang gelombang 365 nm, maka terjadi fluoresensi warna biru atau hijau,menunjukkan adanya golongan kumarin (Fransworth, 1969).
3.3.6 Pemeriksaan Katekin
a. Penetapan Kadar Katekin
Sebanyak 50 mg katekin standar ditimbang dan dilarutkan dalam etil asetat hingga 50 ml (konsentrasi 1 mg/ml). Dari larutan induk diencerkan hingga menjadi 0,04 mg/ml. Diukur panjang gelombang 279 nm dengan spektrofotometer UV.
Penetapan kadar katekin sampel dengan cara sebanyak 50 mg katekinditimbang dan dilarutkan dalam etil asetat hingga 50 ml, lalu dibuat larutan katekinmenggunakan etil asetat dengan berbagai konsentrasi, yaitu 0,02 mg/mL, 0,03 mg/mL, 0,04 mg/mL, 0,05 mg/mL, dan 0,06 mg/mL. Kemudian diukur serapannya dengan spektrofotometri UV pada panjang gelombang 279 nm. Kadar katekin dalam larutan dihitung dengan menggunakan kurva kalibrasi (Lucida et al, 2007).
b. Kadar Abu
Sebanyak 1 gram katekinditimbang dan dimasukkan ke dalam cawan porselen. Katekin dipijar dengan pembakar bunsen selama kira-kira 1 jam dan disempurnakan pemijarannya dengan menempatkan bahan dalam tanur suhu tinggi pada 900o ± 20oC sampai diperoleh abu berwarna abu-abu. Didinginkan dalam desikator, ditimbang serta dicatat pengurangan beratnya. Dihitung kadar abu dari pengurangan berat yang didapat (DepKes, 2000).
c. Kadar air
pengurangan berat antara dua penimbangan berturut-turut lebih kecil dari 0,001 g. Kadar air dihitung dari pengurangan yang didapat (Depkes, 2000).
d. Uji Jarak Lebur
Menempatkan sejumlah katekin ke dalam tabung kapiler lalu dipanaskan dalam tangas udara atau tangas cair kemudian suhu dicatat pada saat zat melebur dan pada saat semua dimana semua zat melebur. Dengan demikian jarak lebur dicatat sebagai jarak antara suhu permulaan dan suhu akhir peleburan yang sempurna. Laju pemanasan alat diatur sekitar 10oC per menit, ketika mencapai suhu 165-170oC diatur kembali hingga kenaikannya sekitar 1oC per menit (DepKes, 1979). Jarak lebur katekin pada literatur ialah 175-177oC (WHO, 1998).
e. Rendemen Katekin
Rendemen katekin dihitung dengan membandingkan berat awal serbuk dengan berat akhir katekin yang dihasilkan.
Rendemen = % kemurnian x Bobot serbuk katekin Bobot serbuk gambir di ekstraksi
3.3.7. Sterilisasi Alat
seperti debu yangakan merusak validitas hasil penelitian. Filter yang umumnya digunakanadalah filter MF-Milipore tipe GS dengan ukuran pori 0,2 µm.
Alat–alat gelas yang akan digunakan dicuci bersih kemudiandikeringkan, selanjutnya dibungkus dengan kertas dan disterilkan dalamautoklaf pada suhu 121oC, tekanan 15 lb, selama 15 menit.
3.3.8 Pembuatan Reagen
a. Pembuatan Medium DMEM berserum
Sebanyak 500 ml medium DMEM berserum ditambahkan 50ml FBS 10% dan penstrep (Penisilin-Streptomisin) sebanyak 5 ml, kemudian dihomogenkan. Selanjutnya larutan medium DMEM berserum disaring dengan syringe filter 0.2 µm membrane non pyrogenic dan disimpan pada suhu -4oC
b. Pembuatan Larutan PBS (Phosfhat Buffer Saline)
c. Pembuatan Larutan SDS (Sodium Dedocyl Sulfat) 10 % b/v
Menimbang SDS sebanyak 10 gram kemudian dilarutkan dalam 90 mlaquadest steril dan 10 ml HCl 0.01 N, kemudian diaduk sampai larut.
d. Pembuatan Larutan MTT (3 – [4,5 – dimethylthiazol – 2Yi] – 2,5 – diphenyl tetrazolium bromide)
Untuk pengamatan proliferatif sel secara kolorimetri, 5 mg MTT dilarutkan dalam 1 ml PBS dan difilter agar steril. Kemudian MTT diberikan sebanyak 10 µL per 100 µL medium pada tiap-tiap sumuran (Mosmann, 1983).
Pada penelitian ini, Larutan MTT dibuat dengan cara melarutkan serbuk MTT sebanyak 1 gram dalam 40 ml PBS steril. Tiap sumuran diberi larutan MTT tersebut sebanyak 10 µl.
3.3.9 Persiapan Larutan Uji
a. Suspensi Campuran Katekin Gambir (Uncara gambier Roxb.) dan Eugenol.
Sebanyak masing-masing 125 mgkatekin dan eugenol ditimbang dan dimasukkan ke dalam mikro tube dan dilarutkan dalam 5000µl DMSO 99 %, sentrifuge sampai homogen. Larutan ini dijadikan larutaninduk dengan konsentrasi 50000 µg/mL (larutan
induk 1), diambil 50 μl laluditambahkan media DMEM sebanyak
17.5; 25; 50; 100; dan 200 µg/mL dibuat dengan mengencerkan
beberapa μl dari larutan induk 2.
b. Kontrol Cisplatin
Sediaan cisplatin 10 mg/20 ml (500 µg/mL) sebagai larutan indukdimasukkan dalam mikrotube, kemudian dibuat pengenceran
denganmemipet beberapa μl dari larutan induk, agar diperoleh lima
konsentrasiyaitu 1.5, 3, 4.5, 6, 7.5, dan 9 µg/mL. c. Kontrol DMSO (kontrol negatif)
DMSO yang digunakan merupakan DMSO pro Analysis.
3.3.10 Persiapan Kultur HeLaCell Line
a. Aktivasi sel HeLa (Thawing Kultur Sel)
1. Mengeluarkan tabung yang berisi HeLa cell line dari tangki wadah berisi dry ice bersuhu -800C , kemudiandicairkan dalam waterbath 37oC sampai gumpalan di dalam vial mencair.
2. Didalam LAF, HeLacell line diambil seluruhnya dengan menggunakan pipet dan dimasukkan ke dalam tabungsentrifuge kemudianditambahkan 7 ml medium DMEM kemudiandisentrifus dengan kecepatan 4000 rpm selama 5 menit. 3. Supernatan yangdiperoleh kemudian dipisahkan sedangkan pellet
diresuspensikan denganmenggunakan 5 ml PBS,selanjutnya disentrifuge selama 5 menit dengan kecepatan 4000 rpm.
berserum lalu diinkubasi pada suhu 37oCdalam inkubator CO2 5% selama 24 jam hingga sel menutupi permukaan cell culture dish dengan tingkat kepadatan 95%.
b. Pembuatan dan Pengembangan sel HeLa (Subkultivasi)
1. T-Flask yang telah diinkubasi selama 1 hari dikeluarkan dari inkubator.
2. Media di dalam T-Flask dibuang kemudian dicuci dengan 15 ml PBS sebanyak 2kali. Kemudian PBS dibuang dan ditambahkan tripsinyang telah diencerkan dengan PBS sebanyak 5,8 ml (400 µl Tripsin + 5400 µlPBS = 5,8 ml).
3. Sel diinkubasi selama 3 menit dalam inkubator CO2dengan suhu 37oC (selama diinkubasi tutup T-Flask dilonggarkan). Setelah 3 menit, dishdikeluarkan dari inkubator CO2 kemudian diketuk-ketuk horizontal dindingT-Flaskbagian luar dengan menggunakan telapak tangan agar sel terlepasdari dinding T-Flask. Sel kemudian diperiksamenggunakan mikroskopinverted.
4. T-Flask dipindahkan dalam LAF kabinet kemudian didalam
T-Flaskditambahkan DMEM sebanyak 1000 luntuk menonaktifkan tripsin, kemudian dihomogenkan.
5. Larutan seldipindahkan ke dalam tabung centrifuge tube, lalu disentrifuge dengankecepatan 4000 rpm selama 5 menit.
6 .Kemudian supernatan dipisahkan dandiganti dengan medium