PENGUJIAN FRAKSI n-HEKSAN DAUN RUKU-RUKU
(Ocimum sanctum L.) YANG DIPERANGKAPKAN DALAM
MATRIKS NATA TIOUREA SEBAGAI ANTIINFLAMASI
SKRIPSI
OLEH:
SUCI ANGREINI NASUTION 050804036
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGUJIAN FRAKSI n-HEKSAN DAUN RUKU-RUKU
(Ocimum sanctum L.) YANG DIPERANGKAPKAN DALAM
MATRIKS NATA TIOUREA SEBAGAI ANTIINFLAMASI
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
SUCI ANGREINI NASUTION 050804036
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
PENGUJIAN FRAKSI n-HEKSAN DAUN RUKU-RUKU
(Ocimum sanctum L.) YANG DIPERANGKAPKAN DALAM
MATRIKS NATA TIOUREA SEBAGAI ANTIINFLAMASI
OLEH :
SUCI ANGREINI NASUTION
050804036
Dipertahankan di hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara Pada tanggal : Agustus 2010
Pembimbing I, Panitia Penguji,
(Dr. Kasmirul R. Sinaga, M.S., Apt.)
NIP 195504241983031003 NIP 195409091982011001 (Dr. Karsono, Apt.)
Pembimbing II,
NIP 195504241983031003
(Dr. Kasmirul R. Sinaga, M.S., Apt.)
(Dr. Marline Nainggolan, M.S., Apt.)
NIP 195709091985112001 NIP 195304031983032001
(Dra. Aswita Hafni Lubis, M.Si., Apt.)
NIP 194909061980032001 (Dra. Saleha Salbi, M.Si., Apt.)
Medan, Agustus 2010
Fakultas Farmasi Universitas Sumatera Utara
Dekan,
KATA PENGANTAR
Puji dan syukur kepada Tuhan Yang Maha Kuasa yang telah melimpahkan
rahmat dan anugerah-Nya sehingga penulis dapat menyelesaikan penelitian dan
penyusunan skripsi ini yang berjudul “Pengujian Fraksi n-Heksan Daun
Ruku-ruku (Ocimum sanctum L.) yang Diperangkapkan dalam Matriks Nata Tiourea
sebagai Antiinflamasi”. Skripsi ini diajukan sebagai salah satu syarat untuk
memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera
Utara.
Ucapan terima kasih dan penghargaan yang tulus kepada kedua orang tua
saya, Ayahanda H. Herman Nasution dan Ibunda Hj. Sakdiah Lubis tercinta, serta
kepada Abang saya Rifai Achmad Nasution dan Faisan Achmad Nasution atas
doa, dorongan dan semangat baik moril maupun materil kepada penulis selama
masa perkuliahan hingga selesainya penyusunan skripsi ini.
Pada kesempatan ini penulis ingin menyampaikan terima kasih yang
sebesar-besarnya kepada Bapak Dr. Kasmirul Ramlan Sinaga, M.S., Apt. dan Ibu
Dr. Marline Nainggolan, M.S., Apt. yang telah membimbing penulis dengan
penuh kesabaran, tulus dan ikhlas selama penelitian hingga selesainya penulisan
skripsi ini.
Penulis juga menyampaikan ucapan terima kasih yang sebesar-besarnya
kepada :
1. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., sebagai Dekan Fakultas
Farmasi yang telah memberikan bantuan dan fasilitas selama masa
2. Ibu Dra. Salbiah, M.Si., Apt., sebagai dosen wali yang telah membimbing
penulis selama masa pendidikan.
3. Bapak Dr. Karsono, Apt., Ibu Dra. Aswita Hafni Lubis, M.Si., Apt., Ibu Dra.
Saleha Salbi, M.Si., Apt., sebagai dosen penguji yang telah memberikan saran
dan kritikan kepada penulis hingga selesainya penulisan skripsi ini.
4. Ibu Dr. Marline Nainggolan, M.S., Apt., selaku Kepala Laboratorium
Fitokimia dan Bapak Drs. Saiful Bahri, M.S., Apt., selaku Kepala
Laboratorium Farmakologi yang telah memberikan fasilitas dan bantuan
selama penelitian.
5. Seluruh Staf Pengajar, Pegawai Tata Usaha, Kakak-kakak, Abang-abang dan
Teman-teman yang telah membantu selama penelitian hingga selesainya
penulisan skripsi ini.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini masih memiliki
banyak kekurangan, oleh karena itu sangat diharapkan kritikan dan saran yang
dapat menyempurnakan skripsi ini.
Medan, Agustus 2010
Penulis,
Pengujian Fraksi n-Heksan Daun Ruku-ruku (Ocimum sanctum L.) yang Diperangkapkan dalam Matriks Nata Tiourea sebagai Antiinflamasi
Abstrak
Telah dilakukan fraksinasi ekstrak etanol daun ruku-ruku (Ocimum sanctum L.) dengan pelarut n-heksan yang bermanfaat sebagai antiinflamasi. Fraksi n-heksan diperangkapkan dalam matriks nata yang memiliki absorptivitas yang tinggi. Pembuatan nata menggunakan air kelapa sebagai media pertumbuhan Acetobacter xylinum dapat dimodifikasi dengan sumber nitrogen yang berbeda seperti tiourea, sehingga memberikan variasi matriks obat yang dapat digunakan sebagai pelepasan diperpanjang.
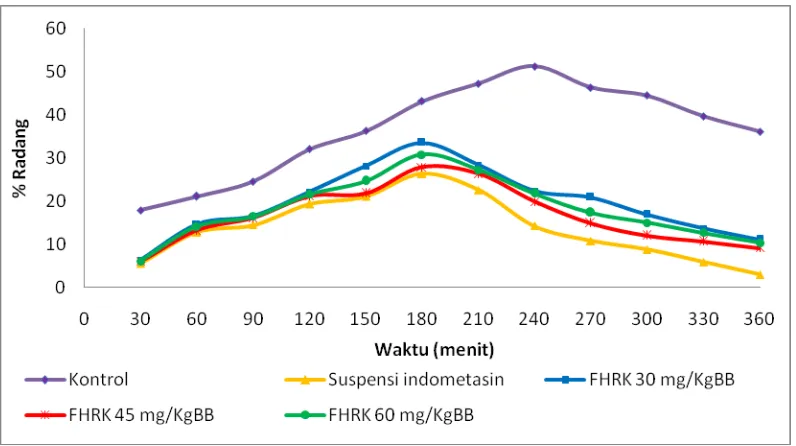
Simplisia daun ruku-ruku dikarakterisasi, kemudian diekstraksi dengan cara maserasi menggunakan etanol 80%. Ekstrak etanol yang diperoleh juga dikarakterisasi, selanjutnya difraksinasi dengan n-heksan, diuapkan memakai rotary evaporator dan dikeringkan pada freeze dryer dengan suhu -40oC. Fraksi n-heksan daun ruku-ruku (Ocimum sanctum L.) diperangkapkan dalam matriks nata dengan sumber N dari urea (NDC) dan nata dengan sumber N dari tiourea (NT) dengan cara merendam matriks nata ke dalam fraksi n-heksan selama 24 jam lalu dikeringkan kembali pada freeze dryer. Selanjutnya diuji efek antiinflamasi dengan mengukur volume radang pada kaki tikus putih yang diinduksi dengan larutan karagenan 1% menggunakan pletismometer. Pengujian antiinflamasi dibagi menjadi 10 kelompok yaitu kontrol (CMC 0.5%, matriks NDC dan NT), pembanding indometasin (bentuk suspensi, diperangkapkan dalam matriks NDC dan NT) dosis 10 mg/KgBB, fraksi n-heksan daun ruku-ruku (bentuk suspensi, diperangkapkan dalam matriks NDC dan NT) dosis 30 mg/KgBB, 45 mg/KgBB dan 60 mg/KgBB.
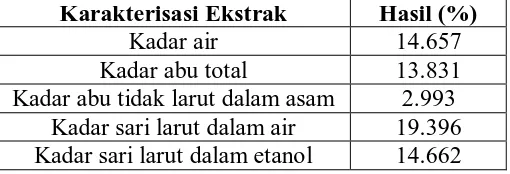
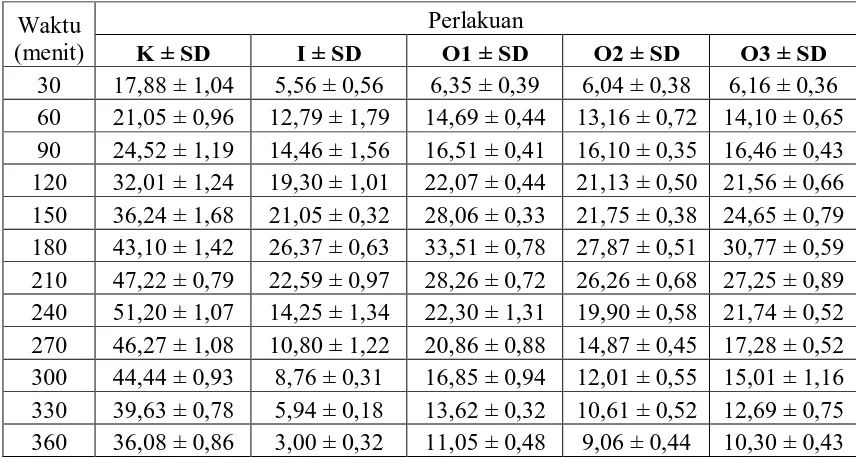
Hasil karakterisasi simplisia dan eksktrak etanol daun ruku-ruku meliputi penetapan kadar air, kadar abu total, kadar abu tidak larut asam, kadar sari larut air dan kadar sari larut etanol, berturut-turut adalah 7.331 dan 14.657 %, 10.608 dan 13.831%, 0.471 dan 2.993%, 6.267 dan 19.396%, 4.784 dan 14.662%. Fraksi n-heksan daun ruku-ruku memiliki efek antiinflamasi dan pemerangkapannya dalam matriks NDC dan NT memberikan pelepasan obat yang diperpanjang. Perbedaan suspensi fraksi n-heksan dengan yang diperangkapkan dalam matriks NT terlihat pada pelebaran puncak % radang dari t180 menjadi t300. Namun tidak terdapat perbedaan yang signifikan antara fraksi n-heksan yang diperangkapkan dalam matriks NDC maupun NT. Pemberian fraksi n-heksan daun ruku-ruku dosis 45 mg/KgBB lebih baik dibandingkan dosis 30 dan 60 mg/KgBB (α ≤ 0,05), yang mempunyai efek antiinflamasi sama dengan yang diberikan oleh indometasin.
Test of n-Hexane Fraction of Ruku-ruku Leaves (Ocimum sanctum L.) That it Trapped into Nata Thiourea Matrice for Antiinflammatory
Abstract
The fractionation ethanol extract of ruku-ruku (Ocimum sanctum L.) leaves used hexane purpose as anti-inflammatory have been investigated. n-hexane fraction was trapped into nata matrice that has high absorption. Nata matrice was made by coconut water as medium to Acetobacter xylinum growth, and it can modify with a different nitrogen source like thiourea, so it gives variation of drug matrice as prolonged action.
Ruku-ruku leaves simplex was characterized, then it was extracted by used 80% ethanol. Ethanol extract was characterized too and then fractionation with n-hexane, evaporated used rotary evaporator and was dried by freeze dryer temperature -400C. n-hexane fraction of ruku-ruku leaves was trapped into nata with nitrogen source from urea (NDC) and nata with nitrogen source from thiourea (NT) matrice by submergering dried nata matrice into test material for 24 hours and was dried by freeze dryer. The antiinflammatory effect test was done for rats that induced by intraplantar injection of 1% carrageenan with pletismometre. The rats were devided into 10 groups, control (0.5% CMC, NDC and NT matrice), standard (indomethacin suspension and was trapped into NDC and NT matrice) dosage 10 mg/Kg BW, ruku-ruku leaves n-hexane fraction (suspension and was trapped into NDC and NT matrice) dosage 30, 45, and 60 mg/Kg BW.
The result of simplex and ethanol extract ruku-ruku leaves determination consist of water content, total ash, acid insoluble ash, water soluble extract, ethanol soluble extract, respectively are 7.331 and 14.657 %, 10.608 and 13.831%, 0.471 and 2.993%, 6.267 and 19.396%, 4.784 and 14.662%. n-hexane fraction of ruku-ruku leaves used to anti-inflammatory, and it given prolonged action when it was trapped into NDC and NT. The suspension was different with n-hexane fraction trapped into NT, there are prolonged inflammation from t180 become t300. The trapping of n-hexane fraction into NDC and NT matrice gave the prolonged effect, which both of them did not give significance different. The effect at dosage 45 mg/Kg BW was better than 30 and 60 mg/Kg BW (α ≤ 0,05), it was given the same anti-inflammatory effect with indomethacine.
DAFTAR ISI
Halaman
JUDUL...i
PENGESAHAN SKRIPSI...iii
KATA PENGANTAR...iv
ABSTRAK...vi
ABSTRACT...vii
DAFTAR ISI...viii
DAFTAR TABEL...xii
DAFTAR GAMBAR...xiii
DAFTAR LAMPIRAN...xiv
BAB I PENDAHULUAN...1
1.1. Latar Belakang...1
1.2. Perumusan Masalah...4
1.3. Hipotesis...4
1.4. Tujuan Penelitian...5
1.5. Manfaat Penelitian...5
BAB II TINJAUAN PUSTAKA...6
2.1. Uraian Tumbuhan ruku-ruku...6
2.1.1 Sinonim...6
2.1.2 Klasifikasi...6
2.1.3 Kandungan dan Khasiat...7
2.3. Nata de coco...10
2.4. Tiourea...11
2.5. Senyawa Jeratan...12
2.6. Radang (Inflamasi)...13
2.6.1. Mekanisme terjadinya radang...14
2.7. Obat-obat Antiinflamasi...18
2.7.1. Obat Antiinflamasi dari golongan steroid (Glukokortikoid)....18
2.7.2. Obat Antiinflamasi non-steroid...18
2.8. Indometasin...19
BAB III METODE PENELITIAN...21
3.1 Alat dan Bahan...21
3.1.1 Alat-alat yang digunakan...21
3.1.2 Bahan-bahan yang digunakan...21
3.2 Hewan Percobaan...22
3.3 Penyiapan Serbuk Daun ruku-ruku (Ocimum sanctum L)...22
3.3.1 Pengumpulan sampel...22
3.3.1 Identifikasi tumbuhan...22
3.3.3 Pengolahan sampel ...22
3.4 Pemeriksaan Karakterisasi Simplisia dan Ekstrak ...23
3.4.1 Penetapan Kadar Air...23
3.4.2 Penetapan Kadar Abu Total………..23
3.4.3 Penetapan Kadar Abu Tidak Larut Asam...24
3.4.4 Penetapan Kadar Sari Larut Dalam Air...24
3.5 Pembuatan Ekstrak………..26
3.5.1 Pembuatan ekstrak etanol……….26
3.5.2 Pembuatan fraksi n-heksan dari ekstrak etanol...26
3.6 Pembuatan bibit atau starter...27
3.7 Pembuatan nata dengan sumber nitrogen dari urea (NDC)...27
3.8 Pembuatan nata dengan sumber nitrogen dari tiourea (NT)………...28
3.9 Pembuatan Matriks Nata...28
3.10 Penyiapan Bahan Uji, Obat Pembanding dan Kontrol...28
3.10.1 Pembuatan suspensi CMC 0,5%...28
3.10.2 Penyiapan ekstrak dalam bentuk suspensi...29
3.10.3 Penyiapan pemerangkapan fraksi n-heksan dalam matriks nata...29
3.10.4 Penyiapan Karagenan………...29
3.10.5 Pernyiapan Hewan Percobaan...29
3.11 Prosedur Penggunaan Alat Pletismometer………..30
3.11.1 Pembuatan larutan untuk reservoir………...30
3.11.2 Penyiapan alat………...30
3.11.3 Kalibrasi alat……….30
3.12 Prosedur Pengujian Efek Antiinflamasi………30
3.13 Perhitungan Persen Radang dan Persen Inhibisi Radang………….32
BAB IV HASIL DAN PEMBAHASAN...33
4.1 Hasil Pembuatan Ekstrak Etanol Daun ruku-ruku dan Fraksinasi Memakai Pelarut n-heksan………..…….33
4.2 Hasil Pembuatan Nata dengan sumber nitrogen dari urea (NDC)
dan sumber nitrogen dari tiourea (NT) ………35
4.3 Hasil Uji Antiinflamasi dari Fraksi n-heksan dalam Bentuk Suspensi………35
4.4 Hasil Uji Antiinflamasi Fraksi n-heksan yang Diperangkapkan dalam Matriks nata dengan sumber nitrogen dari urea (NDC)…….39
4.5 Hasil Uji Antiinflamasi Fraksi n-heksan yang Diperangkapkan dalam Matriks nata dengan sumber nitrogen dari tiourea (NT)……43
4.6 Perbandingan Efek Antiinflamasi Fraksi n-heksan dalam Bentuk Suspensi dengan yang Diperangkapkan dalam Matriks NT...47
4.7 Perbandingan Efek Antiinflamasi Fraksi n-heksan yang Diperangkapkan dalam Matriks nata dengan sumber nitrogen dari urea (NDC) dan sumber nitrogen dari tiourea (NT)...48
BAB V KESIMPULAN DAN SARAN... ..50
5.1 Kesimpulan... ..50
5.2 Saran... ..50
DAFTAR TABEL
Halaman
Tabel 1. Hasil karakterisasi simplisia daun ruku-ruku...33
Tabel 2. Hasil karakterisasi ekstrak etanol daun ruku-ruku...34
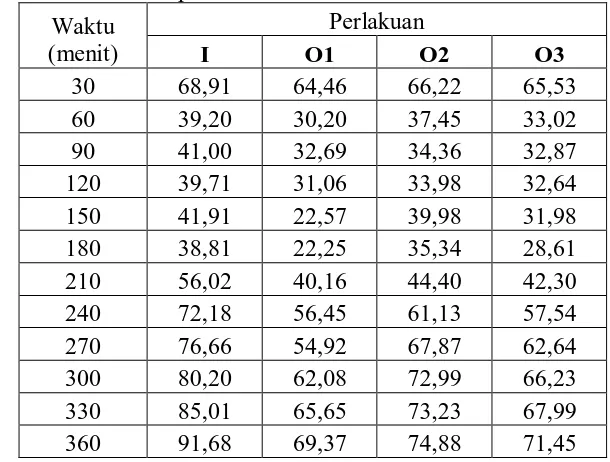
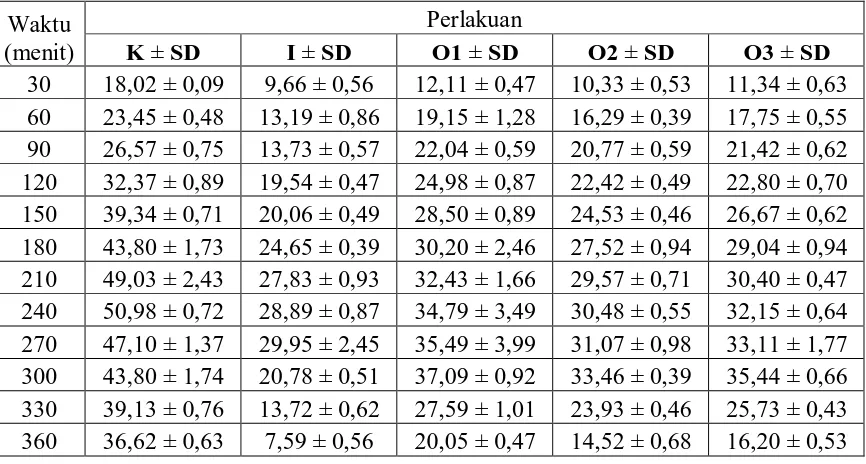
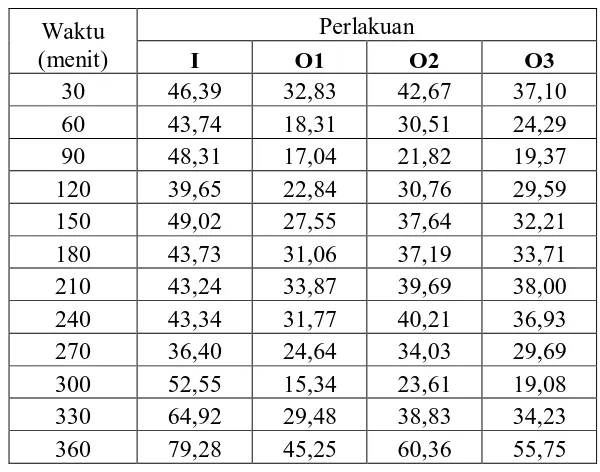
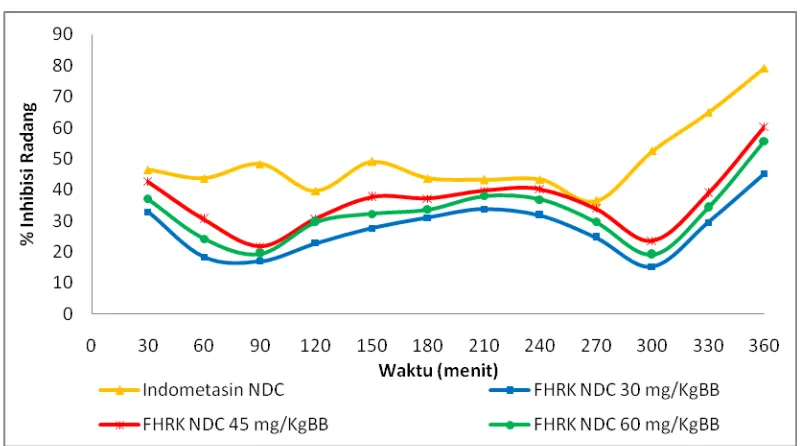
Tabel 3. Data persentase radang rata-rata tiap waktu pengamatan
fraksi n-heksan daun ruku-ruku bentuk suspensi...36
Tabel 4. Data persentase penghambatan radang rata-rata tiap waktu
pengamatan fraksi n-heksan daun ruku-ruku bentuk suspensi...38
Tabel 5. Data persentase radang rata-rata tiap waktu pengamatan
fraksi n-heksan dalam matriks NDC...40
Tabel 6. Data persentase penghambatan radang rata-rata tiap waktu
pengamatan fraksi n-heksan dalam matriks NDC...42
Tabel 7. Data persentase radang rata-rata tiap waktu pengamatan
fraksi n-heksan dalam matriks NT...44
Tabel 8. Data persentase penghambatan radang rata-rata tiap waktu
DAFTAR GAMBAR
Halaman
Gambar 1. Bagan mekanisme terjadinya inflamasi...17
Gambar 2. Grafik persentase radang rata-rata tiap waktu pengamatan
fraksi n-heksan daun ruku-ruku bentuk suspensi...37
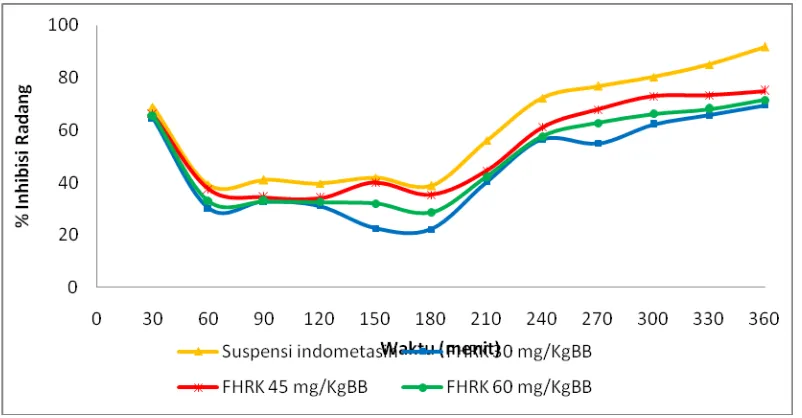
Gambar 3. Grafik persentase penghambatan radang rata-rata tiap waktu
pengamatan fraksi n-heksan daun ruku-ruku bentuk suspensi...39
Gambar 4. Grafik persentase radang rata-rata tiap waktu pengamatan
fraksi n-heksan yang diperangkapkan dalam matriks NDC…………...40
Gambar 5. Grafik persentase penghambatan radang rata-rata tiap waktu
pengamatan fraksi n-heksan yang diperangkapkan dalam
matriks NDC...43
Gambar 6. Grafik persentase radang rata-rata tiap waktu pengamatan
fraksi n-heksan yang diperangkapkan dalam matriks NT………..44
Gambar 7. Grafik luas daerah di bawah kurva dari persentase radang terhadap masing-masing fraksi n-heksan yang diperangkapkan
dalam matriks NT...47
Gambar 8. Perbandingan efek antiinflamasi fraksi n-heksan dalam bentuk suspensi dengan yang diperangkapkan dalam matriks NT...32
Gambar 9. Grafik luas daerah di bawah kurva dari persentase radang terhadap masing-masing fraksi n-heksan yang diperangkapkan
DAFTAR LAMPIRAN
Halaman
Lampiran 1.a Hasil determinasi tumbuhan ruku-ruku...54
Lampiran 1.b Tumbuhan ruku-ruku (Ocimum sanctum L.)...55
Lampiran 2. Nata dengan sumber nitrogen dari urea (NDC) dan sumber
nitrogen dari tiourea (NT) ukuran 1 cm x 1cm...56
Lampiran 3. Alat Pletismometer……….57
Lampiran 4.a Telapak kaki tikus sebelum dan sesudah penyuntikan larutan karagenan 1%...58
Lampiran 5. Flowsheet pembuatan fraksi n-heksan daun ruku-ruku
(Ocimum sanctum L.)...59
Lampiran 6.a Perhitungan karakterisasi simplisia daun ruku-ruku
(Ocimum sanctum L.)...60
Lampiran 6.b Perhitungan karakterisasi ekstrak etanol daun ruku-ruku
(Ocimum sanctum L.)...62
Lampiran 7. Flowsheet pembuatan nata dan pemerangkapannya terhadap
fraksi n-heksan daun ruku-ruku...64
Lampiran 8. Pengujian antiinflamasi dengan Pletismometer (fraksi n-heksan dalam bentuk suspensi dan yang diperangkapkan dalam
matriks NDC dan NT)...65
Lampiran 9. Contoh perhitungan dosis fraksi n-heksan yang dikonversikan dengan berat matriks...66
Lampiran 10. Contoh perhitungan persen radang dan persen inhibisi
radang………..67
Lampiran 11. Data pengukuran persen radang dan persen inhibisi radang pada t (menit) setelah pemberian fraksi n-heksan dalam
bentuk suspensi...68
Lampiran 12. Data pengukuran persen radang dan persen inhibisi radang pada t (menit) setelah pemberian fraksi n-heksan yang
Lampiran 13. Data pengukuran persen radang dan persen inhibisi radang pada t (menit) setelah pemberian fraksi n-heksan yang
diperangkapkan dalam matriks NT...84
Lampiran 14.a Hasil ANOVA secara SPSS (fraksi n-heksan dalam
bentuk suspensi)………....92
Lampiran 14.b Hasil uji Duncan (fraksi n-heksan dalam bentuk suspensi)……..93
Lampiran 15.a Hasil ANOVA secara SPSS (fraksi n-heksan
yang diperangkapkan dalam matriks NDC)………97
Lampiran 15.b Hasil Uji Duncan (fraksi n-heksan yang diperangkapkan
dalam matriks NDC)…………....………...98
Lampiran 16.a Hasil ANOVA secara SPSS (fraksi n-heksan
yang diperangkapkan dalam matriks NT)………....……….102
Lampiran 16.b Hasil Uji Duncan (fraksi n-heksan yang diperangkapkan
Pengujian Fraksi n-Heksan Daun Ruku-ruku (Ocimum sanctum L.) yang Diperangkapkan dalam Matriks Nata Tiourea sebagai Antiinflamasi
Abstrak
Telah dilakukan fraksinasi ekstrak etanol daun ruku-ruku (Ocimum sanctum L.) dengan pelarut n-heksan yang bermanfaat sebagai antiinflamasi. Fraksi n-heksan diperangkapkan dalam matriks nata yang memiliki absorptivitas yang tinggi. Pembuatan nata menggunakan air kelapa sebagai media pertumbuhan Acetobacter xylinum dapat dimodifikasi dengan sumber nitrogen yang berbeda seperti tiourea, sehingga memberikan variasi matriks obat yang dapat digunakan sebagai pelepasan diperpanjang.
Simplisia daun ruku-ruku dikarakterisasi, kemudian diekstraksi dengan cara maserasi menggunakan etanol 80%. Ekstrak etanol yang diperoleh juga dikarakterisasi, selanjutnya difraksinasi dengan n-heksan, diuapkan memakai rotary evaporator dan dikeringkan pada freeze dryer dengan suhu -40oC. Fraksi n-heksan daun ruku-ruku (Ocimum sanctum L.) diperangkapkan dalam matriks nata dengan sumber N dari urea (NDC) dan nata dengan sumber N dari tiourea (NT) dengan cara merendam matriks nata ke dalam fraksi n-heksan selama 24 jam lalu dikeringkan kembali pada freeze dryer. Selanjutnya diuji efek antiinflamasi dengan mengukur volume radang pada kaki tikus putih yang diinduksi dengan larutan karagenan 1% menggunakan pletismometer. Pengujian antiinflamasi dibagi menjadi 10 kelompok yaitu kontrol (CMC 0.5%, matriks NDC dan NT), pembanding indometasin (bentuk suspensi, diperangkapkan dalam matriks NDC dan NT) dosis 10 mg/KgBB, fraksi n-heksan daun ruku-ruku (bentuk suspensi, diperangkapkan dalam matriks NDC dan NT) dosis 30 mg/KgBB, 45 mg/KgBB dan 60 mg/KgBB.
Hasil karakterisasi simplisia dan eksktrak etanol daun ruku-ruku meliputi penetapan kadar air, kadar abu total, kadar abu tidak larut asam, kadar sari larut air dan kadar sari larut etanol, berturut-turut adalah 7.331 dan 14.657 %, 10.608 dan 13.831%, 0.471 dan 2.993%, 6.267 dan 19.396%, 4.784 dan 14.662%. Fraksi n-heksan daun ruku-ruku memiliki efek antiinflamasi dan pemerangkapannya dalam matriks NDC dan NT memberikan pelepasan obat yang diperpanjang. Perbedaan suspensi fraksi n-heksan dengan yang diperangkapkan dalam matriks NT terlihat pada pelebaran puncak % radang dari t180 menjadi t300. Namun tidak terdapat perbedaan yang signifikan antara fraksi n-heksan yang diperangkapkan dalam matriks NDC maupun NT. Pemberian fraksi n-heksan daun ruku-ruku dosis 45 mg/KgBB lebih baik dibandingkan dosis 30 dan 60 mg/KgBB (α ≤ 0,05), yang mempunyai efek antiinflamasi sama dengan yang diberikan oleh indometasin.
Test of n-Hexane Fraction of Ruku-ruku Leaves (Ocimum sanctum L.) That it Trapped into Nata Thiourea Matrice for Antiinflammatory
Abstract
The fractionation ethanol extract of ruku-ruku (Ocimum sanctum L.) leaves used hexane purpose as anti-inflammatory have been investigated. n-hexane fraction was trapped into nata matrice that has high absorption. Nata matrice was made by coconut water as medium to Acetobacter xylinum growth, and it can modify with a different nitrogen source like thiourea, so it gives variation of drug matrice as prolonged action.
Ruku-ruku leaves simplex was characterized, then it was extracted by used 80% ethanol. Ethanol extract was characterized too and then fractionation with n-hexane, evaporated used rotary evaporator and was dried by freeze dryer temperature -400C. n-hexane fraction of ruku-ruku leaves was trapped into nata with nitrogen source from urea (NDC) and nata with nitrogen source from thiourea (NT) matrice by submergering dried nata matrice into test material for 24 hours and was dried by freeze dryer. The antiinflammatory effect test was done for rats that induced by intraplantar injection of 1% carrageenan with pletismometre. The rats were devided into 10 groups, control (0.5% CMC, NDC and NT matrice), standard (indomethacin suspension and was trapped into NDC and NT matrice) dosage 10 mg/Kg BW, ruku-ruku leaves n-hexane fraction (suspension and was trapped into NDC and NT matrice) dosage 30, 45, and 60 mg/Kg BW.
The result of simplex and ethanol extract ruku-ruku leaves determination consist of water content, total ash, acid insoluble ash, water soluble extract, ethanol soluble extract, respectively are 7.331 and 14.657 %, 10.608 and 13.831%, 0.471 and 2.993%, 6.267 and 19.396%, 4.784 and 14.662%. n-hexane fraction of ruku-ruku leaves used to anti-inflammatory, and it given prolonged action when it was trapped into NDC and NT. The suspension was different with n-hexane fraction trapped into NT, there are prolonged inflammation from t180 become t300. The trapping of n-hexane fraction into NDC and NT matrice gave the prolonged effect, which both of them did not give significance different. The effect at dosage 45 mg/Kg BW was better than 30 and 60 mg/Kg BW (α ≤ 0,05), it was given the same anti-inflammatory effect with indomethacine.
BAB I
PENDAHULUAN
1.1Latar Belakang
Saat ini Indonesia merupakan salah satu negara penghasil tanaman obat
yang potensial, dimana hasil alam yang paling banyak digunakan sebagai bahan
obat adalah tumbuhan, dan telah digunakan dalam kurun waktu cukup lama,
hampir seluruh negara di dunia. Walaupun obat-obatan modern berkembang
cukup pesat, namun potensi dari tumbuhan obat tetap tinggi karena dapat
diperoleh tanpa resep dokter, dapat diramu sendiri, dan tumbuhan obat dapat
ditanam sendiri oleh pemakainya (Djauhariya dan Hermani, 2004).
Salah satu tumbuhan yang banyak digunakan sabagai obat adalah daun
ruku-ruku (Ocimum sanctum L.), suku Labiatae, merupakan tanaman semak
dengan tinggi 30-150 cm, berdaun tunggal, berakar tunggang, batangnya berkayu,
mempunyai bulu hijau. Tanaman ini dikenal dengan nama daerah kemangi hutan,
lampes (Sunda), uku-uku (Bali), kemangek (Madura), lufe-lufe (Ternate) (Puspita,
2007).
Daun ruku-ruku memiliki kandungan kimia yang sudah diuji sebelumnya,
seperti minyak atsiri, alkaloid, glikosida, saponin, flavonoid, triterpenoid, steroid
dan tanin (Darmiati, 2007). Menurut Simon and Kerry (2000), senyawa flavonoid,
tanin maupun kompleks tanin protein bermanfaat sebagai antiinflamasi. Selain itu
oleh Singh dan Majumdar (1999), juga menyebutkan bahwa minyak atsiri dari
Radang atau inflamasi merupakan serangkaian perubahan yang kompleks
dalam jaringan akibat cedera (Guyton, 1995). Ciri khas inflamasi adalah
kemerahan (rubor), panas (kalor), pembengkakan (edema), nyeri (dolor), dan
gangguan fungsi jaringan (fungsio laesa) (Kee dan Evelyn, 1996).
Berdasarkan mekanisme kerjanya obat-obat antiinflamasi dibagi dua
golongan yaitu steroid dan non steroid. Pemakaian obat-obat tersebut mempunyai
efek samping seperti iritasi gastrointestinal, kerusakan ginjal, diare, sakit kepala,
depresi, pankreatitis dan lain-lain (Katzung, 2002).
Oleh Piluharto (2003), nata de coco telah dimanfaatkan sebagai
penghantar obat untuk tujuan pelepasan obat terkontrol. Kemampuannya dalam
memerangkapkan bahan obat diharapkan dapat menurunkan efek samping dari
penggunaan obat-obat yang dapat mengiritasi lambung.
Berbagai penelitian ilmiah mencoba menggantikan air kelapa dengan
bahan lain seperti sari buah nenas dan sari buah pisang, yang dikenal dengan nata
de soya dan nata de pina. Namun air kelapa menjadi pilihan utama karena kaya
akan kandungan nutrisi dan protein, dan telah dikenal sebagai minuman kesehatan
yang disebut dengan nata de coco (Anonim, 2008).
Dalam pembuatan nata diperhatikan faktor-faktor yang mendukung
pertumbuhan Acetobacter xylinum, diantaranya ketersediaan nutrisi seperti
karbon dan nitrogen, derajat keasaman, temperatur dan ketersediaan oksigen.
Ketersediaan nutrisi selain berasal dari air kelapa juga dapat ditambahkan gula
pasir, sedangkan sumber nitrogen dapat diperoleh dari protein, ekstrak yeast, urea,
ammonium sulfat maupun ammonium fosfat. Nitrogen diperlukan dalam
enzim. Kekurangan nitrogen menyebabkan sel kurang tumbuh dengan baik dan
menghambat pembentukan enzim yang diperlukan sehingga proses fermentasi
dapat mengalami kegagalan atau tidak sempurna. Di samping itu perlu
diperhatikan derajat keasaman dengan pH optimum 4,3 pada suhu kamar dan
kebutuhan oksigen tercukupi (Anonim, 2007 ; Anonim, 2008).
Frans (2007) telah memanfaatkan matriks nata de coco untuk
memerangkapkan fraksi n-heksan daun ruku-ruku menghasilkan pelepasan obat
diperpanjang. Nata de coco dibuat dengan menggunakan air kelapa sebagai media
pertumbuhan Acetobacter xylinum dan sumber nitrogen dari urea.
Pada penelitian ini, selain memanfaatkan air kelapa sebagai media
pertumbuhan Acetobacter xylinum juga menggunakan sumber nitrogen lain yaitu
tiourea, yang merupakan senyawa mirip dengan urea. Senyawa organik ini
mengandu
Tiourea berupa hablur putih yang larut dalam air maupun etanol (DepKes, 1995).
Kandungan nitrogen di dalam tiourea diharapkan dapat memberikan variasi
bentuk nata.
Berdasarkan hal di atas, penulis melakukan penelitian terhadap aktivitas
antiiflamasi pada fraksi n-heksan daun ruku-ruku (Ocimum sanctum L.) yang
diperangkapkan pada matriks nata dengan sumber nitrogen dari urea (NDC) dan
sumber nitrogen dari tiourea (NT) yang diharapkan dapat memberikan pelepasan
1.2Perumusan Masalah
1. Apakah fraksi n-heksan daun ruku-ruku (Ocimum sanctum L.) dalam
bentuk suspensi maupun yang diperangkapkan dalam matriks nata dengan
sumber nitrogen dari urea (NDC) dan sumber nitrogen dari tiourea (NT)
mempunyai efek antiinflamasi terhadap radang buatan yang diinduksi
dengan karagenan pada telapak kaki tikus putih.
2. Apakah terdapat perbedaan efek antiinflamasi fraksi n-heksan daun
ruku-ruku (Ocimum sanctum L.) dalam bentuk suspensi maupun yang
diperangkapkan dalam matriks nata dengan sumber nitrogen dari urea
(NDC) dan sumber nitrogen dari tiourea (NT) jika diberikan secara oral
pada tikus putih.
1.3 Hipotesis
1. Fraksi n-heksan daun ruku-ruku (Ocimum sanctum L.) dalam bentuk
suspensi maupun yang diperangkapkan dalam matriks nata dengan sumber
nitrogen dari urea (NDC) dan sumber nitrogen dari tiourea (NT)
mempunyai efek antiinflamasi terhadap radang buatan yang diinduksi
dengan karagenan pada telapak kaki tikus.
2. Fraksi n-heksan daun ruku-ruku (Ocimum sanctum L.) dalam bentuk
suspensi maupun yang diperangkap dalam matriks nata dengan sumber
nitrogen dari urea (NDC) dan sumber nitrogen dari tiourea (NT)
1.4 Tujuan Penelitian
1. Untuk mengetahui adanya efek antiinflamasi dari fraksi n-heksan daun
ruku-ruku (Ocimum sanctum L.) dalam bentuk suspensi maupun yang
diperangkapkan dalam matriks nata dengan sumber nitrogen dari urea
(NDC) dan sumber nitrogen dari tiourea (NT) terhadap radang buatan
yang diinduksi dengan karagenan pada telapak kaki tikus putih.
2. Untuk mengetahui perbedaan efek fraksi n-heksan daun daun ruku-ruku
(Ocimum sanctum L.) dalam bentuk suspensi dengan yang diperangkapkan
dalam matriks nata dengan sumber nitrogen dari urea (NDC) dan sumber
nitrogen dari tiourea (NT) yang diberikan secara oral pada tikus putih.
1.5Manfaat Penelitian
Hasil penelitian dari fraksi n-heksan daun ruku-ruku (Ocimum sanctum
L.) ini diharapkan dapat bermanfaat untuk pengobatan radang dan
pemerangkapannya dalam matriks nata tiourea dapat digunakan sebagai
BAB II
TINJAUAN PUSTAKA
2.1. Uraian Tumbuhan Ruku-ruku
Tumbuhan ruku-ruku merupakan tumbuhan semak, tingginya 30 cm
sampai 150 cm. Berakar tunggang, batangnya berkayu, bercabang dan mempunyai
bulu (Puspita, 2007). Daunnya berwarna hijau smpai hijau kecoklatan, bau
aromatik, khas dan rasa agak pedas. Helain daun bentuk jorong memanjang,
pangkal daun tumpul sampai membundar dan tulang daun menyirip. Panjang daun
2,5 cm sampai 7,5 cm dan lebar 1 cm sampai 2,5 cm (DepKes, 1995).
2.1.1. Sinonim
Sinonim dari tumbuhan ruku-ruku (Ocimum sanctum L.) adalah Ocimum
tenuiflorum L., Ocimum americanum L. (O. canum Sims), Ocimum gratissimum
L., Ocimum basilicum L. (Anonim, ), dengan nama daerah lute (Maluku), lampes
(Sunda), Kemangi (Jawa), kemangek (Madura), uku-uku (Nusa Tenggara dan
Bali), lufe-lufe (Ternate) (Puspita, 2007).
2.1.2. Klasifikasi
Menurut Sharma (1993) dan Tjitrosoepomo (2002), tumbuhan ruku-ruku
dapat diklasifikasikan sebagai berikut :
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledonae
Subkelas : Sympetalae
Suku : Labiatae
Marga : Ocimum
Spesies : Ocimum sanctum L.
2.1.3. Kandungan dan Khasiat
Tumbuhan ruku-ruku mengandung minyak atsiri (1% golongan estragol,
linalool, eugenol, cineole, methyl chavicol dan sejumlah kecil methyl cinnamate,
serta golongan terpen lainnya), flavonoid (apigenin, luteolin, orientin, vicenin)
triterpenoida seperti asam urolic, alkaloid, glikosida, saponin, dan tanin
(Ganasoundari, 1997). Selain itu juga mengandung asam lemak seperti stearat,
palmitat, oleat, linoleat dan linolenat (Ntezurubanza, et al., 1985), mineral-mineral
seperti Zn, Mn dan Na juga ditemukan pada tumbuhan ruku-ruku (Samudralwar,
1996).
Berdasarkan kandungan kimianya, tumbuhan ruku-ruku dapat mengobati
gangguan pada bronkus, lambung, hati, saluran pernafasan dan saluran
pencernaan, selain itu juga mengobati penyakit diabetes mellitus. Sebagai obat
luar, masyarakat umumnya menggunakan daun ruku-ruku sebagai anthelmentik,
antiinflamasi, gangguan pada kulit, antipiretik terutama untuk demam akibat
malaria (Sethi, et al., 2004).
Berkaitan dengan penelitian saya, kandungan kimia dari tumbuhan
ruku-ruku seperti triterpenoida, flavonoid dan tanin dapat bermanfaat sebagai
antiinflamasi. Sesuai dengan penelitian Simon dan Kerry (2000) yang menyatakan
bahwa senyawa kimia seperti flavonoid (golongan flavon atau flavonol) dan tanin
2.2. Metode ekstraksi
Ekstraksi adalah suatu kegiatan penarikan kandungan kimia yang dapat
larut sehingga terpisah dari bahan yang tidak larut dengan menggunakan pelarut
cair. Senyawa aktif yang terdapat dalam berbagai simplisia dapat digolongkan ke
dalam golongan minyak atsiri, alkaloida, flavonoida, dan lain-lain. Dengan
diketahuinya senyawa aktif yang dikandung simplisia akan mempermudah
pemisahan senyawa dan pemilihan cara ekstraksi yang tepat (Anonim, 2000).
Salah satu metode ekstraksi adalah maserasi, yang berasal dari bahasa
Latin macerare, yang artinya merendam. Dalam proses maserasi, simplisia yang
akan diekstraksi ditempatkan pada wadah atau bejana yang bermulut lebar dan
ditutup rapat (Ansel, 1989). Maserasi dilakukan menggunakan cairan penyari,
dapat berupa air, etanol, air-etanol, atau pelarut lain. Cairan penyari akan
menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat
aktif. Kemudian zat aktif akan larut karena adanya perbedaaan konsentrasi antara
larutan zat aktif di dalam sel dengan di luar sel, larutan yang lebih pekat akan
didesak keluar. Peristiwa tersebut berulang sehingga terjadi kesetimbangan
konsentrasi antara laritan di luar sel dengan di dalam sel (Anonim, 2000).
Keuntungan dari metode ini adalah peralatannya sederhana, dapat digunakan
untuk sampel bertekstur lunak dan tidak tahan pemanasan. Sedangkan
kerugiannya antara lain waktu yang diperlukan untuk mengekstraksi sampel
cukup lama, cairan penyari yang digunakan lebih banyak, tidak dapat digunakan
untuk bahan-bahan yang mempunyai tekstur keras (Dinda, 2008).
Metode ekstraksi lainnya yaitu sokhletasi yaitu penyarian simplisia secara
penyari terkondensasi menjadi molekul-molekul air oleh pendingin balik dan
turun menyari simplisia dalam klongsong dan selanjutnya masuk kembali ke
dalam labu alas bulat setelah melewati pipa sifon. Keuntungan metode ini adalah
pelarut yang digunakan lebih sedikit, dapat digunakan untuk sampel bertekstur
lunak dan tidak tahan pemanasan langsung. Kerugiannya yaitu akibat pelarut yang
didaur ulang, ekstrak yang terkumpul pada wadah di sebelah bawah terus-menerus
dipanaskan sehingga dapat menyebabkan reaksi peruraian oleh panas (Dinda,
2008).
Selain itu dikenal juga metode ekstraksi lainnya yaitu perkolasi. Penyarian
zat aktif dilakukan dengan cara serbuk simplisia dimaserasi selama 3 jam,
kemudian simplisia dipindahkan ke dalam bejana silinder yang bagian bawahnya
diberi sekat berpori, cairan penyari dialirkan dari atas ke bawah melalui simplisia
tersebut, cairan penyari akan melarutkan zat aktif dalam sel-sel simplisia yang
dilalui sampai keadan jenuh. Gerakan ke bawah disebabkan oleh karena gravitasi,
kohesi, dan berat cairan di atas dikurangi gaya kapiler yang menahan gerakan ke
bawah. Perkolat yang diperoleh dikumpulkan, lalu dipekatkan. Metode ini dapat
digunakan untuk sampel bertekstur keras. Kerugian dari metode ini adalah kontak
antara sampel padat tidak merata sehingga selama proses perkolasi tidak
melarutkan komponen secara efisien (Dinda, 2008).
Refluks juga merupakan metode ekstraksi. Penarikan komponen kimia
yaitu dengan cara sampel dimasukkan ke dalam labu alas bulat bersama-sama
dengan cairan penyari lalu dipanaskan, uap-uap cairan penyari terkondensasi pada
kondensor bola menjadi molekul-molekul cairan penyari yang akan turun kembali
bulat, demikian seterusnya berlangsung secara berkesinambungan sampai
penyarian sempurna, penggantian pelarut dilakukan sebanyak 3 kali setiap 3-4
jam. Filtrat yang diperoleh dikumpulkan dan dipekatkan. Keuntungan metode ini
adalah dapat digunakan untuk sampel bertekstur keras. Sedangkan kerugiannya
yaitu tidak dapat digunakan untuk sampel yang tidak tahan pemanasan dan
dibutuhkan jumlah pelarut yang banyak (Dinda, 2008).
2.3. Nata de coco
Nata de coco merupakan selulosa yang dibentuk oleh bakteri Acetobacter
xylinum yang memanfaatkan air kelapa sebagai media pertumbuhannya, dengan
kandungan kalori rendah, kadar serat 2,5 %, dan memiliki kadar air 98 %. Nata de
coco menghasilkan selulosa bakteri yang identik dengan selulosa tanaman, tetapi
selulosa yang dihasilkan lebih murni dibandingkan selulosa tanaman yang
mengandung lignin dan hemiselulosa (Klemm et al, 2001). Serat yang ada dalam
selulosa bakteri tersebut sangat penting dalam proses fisiologis, bahkan dapat
membantu para penderita diabetes dan memperlancar pencernaan makanan, oleh
karena itu dapat dipakai sebagai sumber makanan (Anonim, 2009).
Nata de coco menghasilkan selulosa bakteri yang identik dengan selulosa
tanaman, tetapi selulosa yang dihasilkan lebih murni dibandingkan selulosa
tanaman yang mengandung lignin dan hemiselulosa (Klemm et al, 2001)
Nata de coco juga merupakan alernatif sumber selulosa yang bermanfaat
sebagai adsorban pada adsorpsi kromium(III) dalam medium air dalam rangka
pencarian metode yang efektif untuk menghilangkan logam berat. Ion logam
hewan. Salah satu logam berat tersebut adalah ion kromium yang dapat
meyebabkan kerusakan ginjal, hati, sistem imunitas, dan kulit (dermatitis).
Pemanfaatan nata de coco sebagai alternatif bahan baku selulosa memiliki
beberapa keuntungan, yaitu pemanfaatan limbah buangan air kelapa, dan bersifat
biodegradable yaitu dapat diuraikan oleh mikroba (Afrizal, 2007).
2.4. Tiourea
Struktur tiourea hampir serupa dengan urea, bersifat sebagai basa berasam
satu; merupakan serbuk hablur, tidak berwarna, larut dalam air dan tidak larut
dalam alkohol,mempunyai titik lebur 176-1800 C. Tiourea sering dipakai sebagai
zat pembawa dalam pembentukan dispersi padat dalam formulasi obat, karena
kesanggupannya membentuk kristal Channel complex atau kompleks clathrates
(Aiache dan Devissaquet, 1993).
Pada pembuatan nata de coco secara komersial sering dipakai ammonium
sulfat, amonium fosfat atau urea sebagai sumber nitrogen. Redpath dan
kawan-kawan menunjukkan bahwa spektra NMR dari kristal urea dan tiourea adalah
sesuai, dengan protonasi pada atom oksigen atau atom sulfur. Tiourea biasanya
digunakan sebagai obat anti tiroid. Senyawa ini dioksidasi oleh kelenjar tiroid
peroksidase dengan adanya iodium atau iodida dan hidrogen peroksida
membentuk formamidin disulfida (NH2(NH)CSSC(NH)NH2). Formamidin
disulfida ini tidak stabil dan terdekomposisi pada pH diatas 3,0 membentuk
Kesuma (2004) telah melakukan sintesis senyawa benzoiltiourea dengan
melakukan reaksi asilasi antara salah satu gugus amina dari tiourea dengan gugus
benzoil dari benzoil klorida. Menurut Siswandono (2000), senyawa hasil sintesis
mempunyai aktivitas yang lebih baik sebagai senyawa penekan sistem saraf pusat
bila dibandingkan dengan senyawa induknya, sebab terjadi peningkatan sifat
lipofilik dan elektronik sehingga aktivitas senyawanya meningkat.
2.5. Senyawa Jeratan
Senyawa jeratan terbentuk karena adanya interaksi bahan makromolekuler
dan bahan obat. Penjeratan/pemerangkapan hanya terjadi jika makromolekul
sebagai molekul tuan rumah merupakan molekul beruang rongga besar yang ke
dalamnya dapat dijerat molekul bahan aktif sebagai molekul tamu. Ukuran ruang
rongga menentukan jumlah bahan aktif yang dapat dijerat. Struktur molekul bahan
aktif yang berperan sebagai molekul tamu juga menentukan apakah
pemerangkapan mungkin terjadi.
Ada 3 jenis senyawa jeratan yaitu :
1. Senyawa jeratan kisi
Pada senyawa jeratan kisi molekul tamu dijerat dalam rongga kisi kristal
molekul tuan rumah. Molekul yang dapat dijerat adalah molekul panjang,
tidak bercabang atau bercabang sedangkan molekul berukuran besar tidak
dapat dijerat.
2. Senyawa jeratan molekul
Molekul tamu diperangkap dalam ruang rongga yang terbentuk melalui
3. Senyawa berisi
Pembentukan untuk senyawa jenis ini harus terjadi pembengkakan
makromolekul yang relatif sukar larut. Molekul tamu akan dijerat dalam
ruang yang terjadi karena pembengkakan makromolekul (Voigt, 1994).
2.6. Radang (Inflamasi)
Inflamasi merupakan mekanisme pertahanan tubuh sebagai respon
jaringan terhadap pengaruh-pengaruh merusak baik bersifat lokal maupun yang
masuk ke dalam tubuh. Ketika proses inflamasi berlangsung, terjadi reaksi
vascular dimana cairan elemen-elemen darah, sel darah putih (leukosit) dan
mediator kimia berkumpul pada tempat cedera jaringan atau infeksi. Oleh tubuh
melalui proses inflamasi berusaha untuk menetralisir dan membasmi agen-agen
yang berbahaya pada tempat cedera dan mempersiapkan keadaan untuk perbaikan
jaringan (Kee dan Evelyn, 1996).
Proses terjadinya inflamasi ini dapat diamati secara makroskopis dari
tanda-tanda utama inflamasi yaitu :
a. Kemerahan (rubor)
Kemerahan terjadi pada tahap pertama dari inflamasi, darah terkumpul
pada daerah cedera jaringan akibat pelepasan mediator kimia tubuh seperti
kinin, prostaglandin dan histamin.
b. Pembengkakan (tumor)
Pembengkakan merupakan tahap kedua dari inflamasi. Plasma merembes
ke dalam jaringan interstial pada tempat cedera. Kinin mendilatasi arteriol,
c. Peningkatan panas (kalor)
Panas pada tempat inflamasi dapat disebabkan oleh bertambahnya
pengumpulan darah dan mungkin juga karena pirogen (substansi yang
menimbulkan demam) yang mengganggu pusat pengatur panas pada
hipotalamus.
d. Nyeri (dolor)
Nyeri disebabkan oleh pembengkakan dan pelepasan mediator-mediator
kimia tertentu seperti histamin atau zat bioaktif lainnya dapat merangsang
syaraf. Selain itu, pembengkakan jaringan yang meradang mengakobatkan
peningkatan tekanan lokal yang juga dapat menimbulkan rasa nyeri.
e. Gangguan fungsi jaringan (fungsio laesa)
Gangguan fungsi jaringan disebabkan karena penumpukan cairan pada
tempat cedera jaringan dan karena rasa nyeri yang mengurangi mobilitas
pada daerah cedera.
Gejala-gejala ini merupakan akibat dari gangguan aliran darah yang terjadi
akibat kerusakan jaringan pembuluh darah, gangguan keluarnya plasma darah ke
dalam ruang ekstrasel akibat meningkatnya permeabilitas kapiler dan
perangsangan reseptor nyeri (Mutschler, 1999).
2.6.1. Mekanisme terjadinya radang
Proses terjadinya inflamasi dapat dibagi dalam dua fase :
1. Perubahan vaskular
Respon vaskular pada tempat terjadinya cedera merupakan suatu yang
mendasar untuk reaksi inflamasi akut. Perubahan ini meliputi perubahan
karena terjadi dilatasi arteri lokal sehingga terjadi pertambahan aliran
darah (hypermia) yang disusul dengan perlambatan aliran darah.
Akibatnya bagian tersebut menjadi merah dan panas. Sel darah putih akan
berkumpul di sepanjang dinding pembuluh darah dengan cara menempel.
Dinding pembuluh menjadi longgar susunannya sehingga memungkinkan
sel darah putih keluar melalui dinding pembuluh. Sel darah putih bertindak
sebagai sistem pertahanan untuk menghadapi serangan benda-benda asing
Mansjoer, 1999).
2. Pembentukan cairan inflamasi
Peningkatan permeabilitas pembuluh darah disertai dengan keluarnya sel
darah putih dan protein plasma ke dalam jaringan disebut eksudasi. Cairan
inilah yang menjadi dasar terjadinya pembengkakan. Pembengkakan
menyebabkan terjadinya tegangan dan tekanan pada sel syaraf sehingga
menimbulkan rasa sakit (Mansjoer, 1999).
Mediator Radang
Banyak substansi yang dikeluarkan secara endogen telah dikenal sebagai
mediator inflamasi diantaranya adalah histamin, bradikinin, kalidin, serotoin,
prostaglandin dan leukotrien. Histamin merupakan mediator pertama yang
dilepaskan dari sekian banyaknya mediator lain dan segera muncul dalam
beberapa detik yang menyebabkan peningkatan permeabilitas kapiler (Mansjoer,
1999).
Histamin bekerja dengan cara berikatan dengan reseptor histamin di sel.
Ada 4 jenis reseptor histamin yang telah diidentifikasi, yakni: Reseptor Histamin
Bila histamin berikatan dengan reseptor ini, maka akan mengakibatkan
vasodilatasi, bronkokonstriksi, nyeri, gatal pada kulit. Reseptor ini adalah reseptor
histamin yang paling bertanggungjawab terhadap gejala alergi. Reseptor Histamin
H2 ditemukan di sel-sel parietal. Kinerjanya adalah meningkatkan sekresi asam
lambung. Reseptor Histamin H3, jika reseptor ini aktif akan menyebabkan
penurunan penglepasan neurotransmitter, seperti histamin, asetilkolin,
norepinefrin, dan serotonin. Reseptor Histamin H4 Paling banyak terdapat di sel
basofil dan sumsum tulang. Juga ditemukan di kelenjar timus, usus halus, limfa,
dan usus besar. Perannya sampai saat ini belum banyak diketahui. Beberapa
fungsi pengaturan di dalam tubuh juga telah ditemukan berkaitan erat dengan
kehadiran histamin. Histamin dilepaskan sebagai neurotransmitter. Aksi
penghambatan reseptor histamin H1 (antihistamin H1) menyebabkan mengantuk.
Pasien penderita schizophrenia ternyata memiliki kadar histamin yang rendah
dalam darahnya. Hal ini mungkin disebabkan karena efek samping dari obat
antipsikotik yang berefek samping merugikan bagi histamin, contohnya
quetiapine. Ditemukan pula bahwa ketika kadar histamin kembali normal, maka
kesehatan pasien penderita schizophrenia tersebut juga ikut membaik (Anonim,
2009).
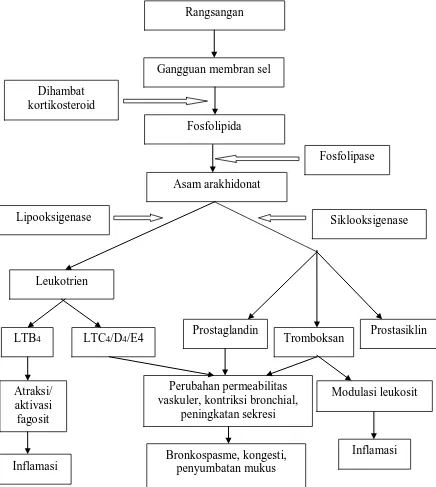
Asam arakhidonat merupakan prekursor dari sejumlah besar mediator
inflamasi. Senyawa ini merupakan komponen utama lipid seluler dan hanya
terdapat dalam keadaan bebas dengan jumlah kecil yang sebagian besar berada
dalam bentuk fosfolipid membran sel. Bila membran sel mengalami kerusakan
oleh suatu rangsangan kimiawi, fisis atau mekanis, maka enzim fosfolipase A2
Sebagai penyebab inflamasi, prostaglandin (PG) bekerja lemah, berpotensi
kuat setelah bergabung dengan mediator atau substansi lain yang dibebaskan
secara lokal seperti histamin, serotinin, atau leukotrien. Prostaglandin mampu
menginduksi vasodilatasi pembuluh darah dalam beberapa menit dan terlibat pada
terjadinya nyeri, inflamasi dan demam (Mansjoer, 1999).
Gambar 1. Bagan mekanisme terjadinya inflamasi (Katzung, 2002).
Rangsangan
LTB4 LTC4/D4/E4 Prostaglandin Tromboksan Prostasiklin
2.7 Obat-obat antiinflamasi
Obat-obat antiinflamasi adaah golongan obat yang memiliki aktivitas
menekan atau mengurangi peradangan. Aktivitas ini dapat dicapai melalui
berbagai cara, yaitu menghambat pembentukan mediator radang prostaglandin,
menghambat migrasi sel-sel leukosit ke daerah radang maupun menghambat
pelepasan prostaglandin dari sel-sel tempat pembentukannya.
Berdasarkan mekanisme kerjanya, obat-obat antiinflamasi dibagi menjadi
dua golongan utama yaitu golongan steroida dan non-steroida (Katzung, 2002).
2.7.1. Obat Antiinflamasi dari Golongan Steroid (Glukokortikoida)
Efek antiinflamasi golongan steroid (glukokortikoid) berhubungan dengan
kemampuan untuk merangsang biosintesis protein lipomodulin, yang dapat
menghambat kerja enzimatik fosfolipase A2 sehingga mencegah pelepasan
mediator seperti asam arakhidonat dan metabolitnya seperti prostaglandin (PG),
leukotrien (LT), tromboksan dan prostasiklin. Glukokortikoid dapat memblok
jalur siklooksigenase dan lipooksigenase, sedangkan AINS hanya memblok enzim
siklooksigenase. Contoh senyawa yang termasuk dalam kelompok ini adalah
kortison, hidrokortison, deksametason, prednison dan sebagainya (Kee dan
Evelyn, 1996).
2.7.2 Obat Antiinflamasi Non-Steroida (AINS)
AINS merupakan kelompok obat-obat yang bekerja dengan aktivitas
menghambat enzim siklooksigenase sehingga konversi asam arakhidonat menjadi
prostaglandin menjadi terganggu. AINS cocok digunakan untuk mengurangi
Contoh senyawa yang termasuk dalam kelompok ini adalah :
1. Turunan asam salisilat, contoh : aspirin, diflusinal, sulfasalazin, olsalazin
2. Turunan para-aminofenol, contoh : asetaminofen
3. Indol dan asam indene asetat, contoh : indometasin, sulindak, etodolak
4. Asam heteroalil asetat, contoh : tolmetin, diklofenak, ketorolak
5. Asam arilpropionat, contoh : ibuprofen, naproksen, feniprofen, ketoprofen
6. Asam antranilat (fenamat), contoh : asam mefenamat, asam meklofenamat
7. Asam enolat, contoh : oksikam (piroksikam, tenoksikam), pirazolidin
(fenilbutazon, oksifentatrazon) (Foye, 1996).
2.8 Indometasin
Indometasin mulai dikenal pada tahun 1963 dimana lebih efektif daripada
aspirin atau AINS lainnya dan di laboratorium merupakan penghambat sintesis
prostaglandin yang terkuat. Indometasin diabsorbsi dengan baik setelah pemberian
per oral, waktu paruh dalam plasma selama 4–5 jam. Dosis antiinflamasi yang
dianjurkan adalah 50-70 mg tiga kali sehari. Efek samping indometasin pada dosis
terapi meliputi gangguan saluran cerna berupa nyeri abdomen, diare ulser,
pendarahan lambung dan pankreatitis. Juga menyebabkan pusing, depresi, rasa
binggung, halusinasi, agranulositosis, anemia aplastik dan trombositopenia.
Karena toksisitasnya, indometasin tidak dianjurkan diberikan pada anak-anak,
wanita hamil, penderita gangguan psikiatri dan penderita penyakit lambung
(Wilmana, 1995; Singh dkk., 1996).
Pada dosis yang lebih tinggi, paling sedikit sepertiga dari pasien bereaksi
samping gastrointestinal bisa meliputi nyeri perut, diare, pendarahan
gastrointestinal dan pankreatitis. Sakit kepala dialami oleh 15-25% pasien dan
bisa dikaitkan dengan pusing, kebingungan dan depresi. Pemakaian indometasin
harus dihindari pada pasien dengan polip hidung atau angioedema, pada
BAB III
METODE PENELITIAN
Metode penelitian meliputi penyiapan sampel, pengumpulan sampel,
identifikasi dan pengolahan sampel, pembuatan ekstrak etanol dengan cara
maserasi dan pembuatan fraksi n-heksan dari ekstrak etanol, pembuatan nata de
coco dan nata tiourea, pembuatan matriks nata de coco dan nata tiourea,
pemerangkapan fraksi n-heksan oleh matriks nata de coco dan matriks nata tiourea
serta pengujian efek antiinflamasi dianalisis variansi serta uji duncan untuk
melihat perbedaan yang bermakna pada setiap perlakuan.
3.1 Alat dan Bahan
3.1.1 Alat-alat yang digunakan
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas
laboratorium, wadah plastik, neraca kasar (Ohaus), neraca analitik (Sartorius),
neraca hewan (GW-1500), heater, oven listrik (Fisher Scientific), penangas air
(Yenaco), lemari pendingin (Sanyo), rotary evaporator (Heidolph vv-2000),
inkubator (Gallenkamp), laminar air flow, freeze dryer (Modulyo, Edward, serial
No. 3985), termometer, jangka sorong, spuit, oral sonde, pletismometer (Ugo
Basile Cat. No. 7140).
3.1.2 Bahan-bahan yang Digunakan
Bahan-bahan yang digunakan dalam penelitian ini adalah daun ruku-ruku
(Ocimum sanctum L.), stater Acetobacter xylinum, gula pasir, urea, tiourea, air
kelapa, asam asetat 25%, NaOH, etanol (hasil destilasi), n-heksan, akuades,
3.2 Hewan Percobaan
Hewan pecobaan yang digunakan adalah tikus putih galur Wistar dengan
berat badan 150-200 g sebanyak 30 ekor, dibagi dalam 10 kelompok dimana
setiap kelompok terdiri dari 6 ekor tikus.
3.3 Penyiapan Serbuk Daun ruku-ruku (Ocimum sanctum L.)
Penyiapan serbuk daun ruku-ruku (Ocimum sanctum L.) meliputi
pengumpulan sampel, identifikasi, pengolahan sampel.
3.3.1 Pengumpulan sampel
Sampel yang digunakan adalah daun ruku-ruku (Ocimum sanctum L.)
yang masih segar, yang diambil dari Kecamatan Medan Amplas. Pengumpulan
sampel dilakukan secara purposif yaitu tanpa membandingkan dengan tumbuhan
yang sama dari daerah lain.
3.3.2 Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan oleh Lembaga Ilmu Pengetahuan
Indonesia (LIPI) Pusat Penelitian dan Pengembangan Biologi Bogor.
3.3.3 Pengolahan sampel
Daun ruku-ruku (Ocimum sanctum L.) yang telah dikumpulkan sebanyak
10 Kg, dicuci bersih dengan air mengalir, ditiriskan, kemudian dikeringkan di
udara terbuka dan terlindung dari cahaya matahari. Setelah kering, daun diserbuk
dan diperoleh serbuk daun ruku-ruku sebanyak 2,753 Kg. Serbuk daun ruku-ruku
3.4 Pemeriksaan Karakterisasi Simplisia dan Ekstrak
Pemeriksaan karakterisasi simplisia dan ekstrak meliputi penetapan kadar
air, penetapan kadar abu total, penetapan kadar abu tidak larut dalam asam,
penetapan kadar sari larut dalam air, penetapan kadar sari larut dalam etanol.
3.4.1 Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi
toluena). Cara Kerja : toluena sebanyak 200 ml dan air suling sebanyak 2 ml
dimasukkan ke dalam labu alas bulat, didestilasi selama 2 jam. Toluena
didinginkan selama 30 menit dan volume air dalam tabung penerima dibaca.
Kemudian ke dalam labu tersebut dimasukkan 5 gram sampel yang telah
ditimbang seksama, labu dipanaskan hati-hati selama 15 menit. Setelah toluena
mendidih, kecepatan tetesan diatur 2 tetes tiap detik sampai sebagian besar air
terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes tiap detik.
Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluena.
Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan
mendingin pada suhu kamar. Setelah air dan toluena memisah sempurna, volume
air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai
dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air
dihitung dalam persen (WHO, 1992).
Prosedur penetapan kadar air untuk ekstrak sama dengan penetapan kadar
air untuk simplisia.
3.4.2 Penetapan Kadar Abu Total
Sebanyak lebih kurang 2 sampai 3 g simplisia ditimbang seksama,
diratakan. Krus dipijarkan perlahan-lahan hingga arang habis, kemudian
didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu total dihitung
terhadap bahan yang telah dikeringkan di udara.
Penetapan kadar abu total untuk ekstrak yaitu dengan menimbang 2 sampai
3 g ekstrak secara seksama, dimasukkan dalam krus porselen yang telah dipijar
dan ditara, lalu diratakan. Krus dipijar perlahan-lahan hingga arang habis,
selanjutnya didinginkan dan ditimbang sampai bobot tetap. Kadar abu total
dihitung terhadap bahan yang telah dikeringkan di udara.
3.4.3 Penetapan Kadar Abu Tidak Larut Asam
Abu yang telah diperoleh dari penetapan kadar abu total dididihkan dalam
25 ml asam klorida 2 N selama 5 menit. Bagian yang tidak larut dalam asam
dikumpulkan, disaring melalui kertas saring, dipijarkan hingga bobot tetap
kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam
dihitung terhadap bahan yang telah dikeringkan di udara (DepKes, 1995).
Prosedur penetapan kadar abu tidak larut asam untuk ekstrak sama dengan
penetapan kadar abu tidak larut asam untuk simplisia. Abu yang diperoleh dari
penetapan kadar abu total dididihkan dalam 25 ml asam klorida 2 N selama 5
menit. Bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas
saring, dipijarkan hingga bobot tetap kemudian didinginkan dan ditimbang. Kadar
abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan
di udara.
3.4.4 Penetapan Kadar Sari Larut Dalam Air
Sebanyak 5 g simplisia dimaserasi selama 24 jam dalam 100 ml air
bersumbat sambil sesekali dikocok selama 6 jam pertama kemudian dibiarkan
selama 18 jam dan disaring. Sejumlah 20 ml filtrat pertama diuapkan sampai
kering dalam cawan dangkal berdasar rata yang telah ditara. Sisa dipanaskan
dalam oven pada suhu 105oC sampai diperoleh bobot konstan. Kadar sari yang
larut di dalam air dihitung terhadap bahan yang telah dikeringkan di udara
(DepKes, 1995).
Penetapan kadar sari larut dalam air untuk ekstrak yaitu dengan menimbang
5 g ekstrak, lalu dimaserasi selama 24 jam dalam 100 ml air kloroform (2,5 ml
kloroform dalam air suling sampai 1000 ml) dalam labu bersumbat sambil
sesekali dikocok selama 6 jam pertama kemudian dibiarkan selama 18 jam dan
disaring. Sejumlah 20 ml filtrat pertama diuapkan sampai kering dalam cawan
dangkal berdasar rata yang telah ditara. Sisa dipanaskan dalam oven pada suhu
105oC sampai diperoleh bobot konstan. Kadar sari yang larut di dalam air dihitung
terhadap bahan yang telah dikeringkan di udara.
3.4.5. Penetapan Kadar Sari Larut Dalam Etanol
Sebanyak 5 g simplisia yang telah dikeringkan di udara dimaserasi selama
24 jam dalam 100 ml etanol 96% dalam labu bersumbat sambil dikocok sesekali
selama 6 jam pertama dan kemudian dibiarkan selama 18 jam dan disaring.
Sejumlah 20 ml filtrat pertama diuapkan sampai kering dalam cawan dangkal
berdasar rata yang telah ditara. Sisa dipanaskan dalam oven pada suhu 105oC
sampai diperoleh bobot konstan. Kadar sari yang larut dalam etanol dihitung
terhadap bahan yang telah dikeringkan di udara (DepKes, 1995).
Prosedur penetapan kadar sari larut dalam etanol untuk ekstrak sama dengan
dimaserasi selama 24 jam dalam 100 ml etanol 96% dalam labu bersumbat sambil
dikocok sesekali selama 6 jam pertama dan kemudian dibiarkan selama 18 jam
dan disaring. Sejumlah 20 ml filtrat pertama diuapkan sampai kering dalam cawan
dangkal berdasar rata yang telah ditara. Sisa dipanaskan dalam oven pada suhu
105oC sampai diperoleh bobot konstan. Kadar sari yang larut dalam etanol
dihitung terhadap bahan yang telah dikeringkan di udara.
3.5 Pembuatan Ekstrak
Pembuatan ekstrak meliputi pembuatan ekstrak etanol dengan cara
maserasi dan pembuatan fraksi n-heksan dari ekstrak etanol.
3.5.1 Pembuatan ekstrak etanol
Sebanyak 500 gram serbuk simplisia dimasukkan ke dalam wadah gelas
berwarna gelap dan ditambahkan pelarut etanol 80% sampai serbuk terendam
sempurna. Ditutup dan dibiarkan selama 5 hari terlindung dari cahaya matahari
sambil sering diaduk, kemudian diperas dan disaring. Ampas ditambahkan cairan
penyari sampai terendam. Ditutup dan disimpan di tempat yang terlindung dari
cahaya matahari. Dibiarkan selama 2 hari sambil sering diaduk, kemudian diperas
dan disaring. Dilakukan perlakuan yang sama sampai pelarut tidak berwarna.
Seluruh filtrat digabungkan dan diuapkan menggunakan rotary evaporator pada
temperatur ± 40 oC sampai diperoleh ekstrak kental, kemudian dipekatkan dengan
freeze dryer pada suhu -40oC selama ± 24 jam.
3.5.2 Pembuatan fraksi n-heksan dari ekstrak etanol
Ekstrak pekat etanol yang diperoleh ditambahkan dengan akuades, lalu
Hasilnya digabungkan dan diuapkan dengan rotary evaporator pada temperatur ±
40 oC sehingga diperoleh fraksi n-heksan kental, kemudian dipekatkan dengan
freeze dryer pada suhu -40oC selama ± 24 jam.
3.6 Pembuatan bibit atau starter
Sebanyak 1 liter air kelapa dibiarkan hingga kotorannya mengendap dan
disaring menggunakan kain kasa. Air kelapa direbus di atas api yang besar hingga
mendidih. Selama perebusan, air kelapa diaduk. Setelah mendidih selama ± 15
menit, ditambahkan urea sebanyak 5 g, gula pasir sebanyak 200 g, dan asam cuka
25% hingga larutan ini memiliki pH 4. Diaduk hingga larutan tercampur merata.
Dalam keadaan masih panas, dituang larutan tersebut ke dalam wadah yang steril.
Setelah dingin, ditambahkan biakan murni sebanyak 200 ml. Ditutup wadah
dengan aluminium foil yang steril. Disimpan di ruang inkubasi dan dibiarkan
selama 2 minggu. Setelah 2 minggu, di permukaan media akan terbentuk lapisan
berwarna putih. Berarti, starter sudah jadi dan siap digunakan (Warisno, 2004).
3.7 Pembuatan nata dengan sumber nitrogen dari urea (NDC)
Sebanyak 1 liter air kelapa dibiarkan hingga kotorannya mengendap dan
disaring menggunakan kain kasa. Air kelapa direbus di atas api yang besar hingga
mendidih. Selama perebusan, air kelapa diaduk. Setelah mendidih selama ± 15
menit, ditambahkan urea sebanyak 5 g, gula pasir sebanyak 100 g, dan asam cuka
25% hingga larutan ini memiliki pH 4. Diaduk hingga larutan tercampur merata.
Dalam keadaan masih panas, dituang larutan tersebut ke dalam wadah yang steril
Setelah dingin, ditambahkan biakan murni sebanyak 100 ml. Ditutup
wadah dengan aluminium foil yang steril. Disimpan di ruang inkubasi selama 2
minggu.
3.8 Pembuatan nata dengan sumber nitrogen dari tiourea (NT)
Sebanyak 1 liter air kelapa dibiarkan hingga kotorannya mengendap dan
disaring menggunakan kain kasa. Air kelapa direbus di atas api yang besar hingga
mendidih. Selama perebusan, air kelapa diaduk. Setelah mendidih selama ± 15
menit, ditambahkan tiourea sebanyak 6,337 g, , gula pasir sebanyak 100 g dan
asam cuka 25% hingga larutan ini memiliki pH 4. Diaduk hingga larutan
tercampur merata. Dalam keadaan masih panas, dituang larutan tersebut ke dalam
wadah yang steril. Setelah dingin, ditambahkan biakan murni sebanyak 100 ml.
Ditutup wadah dengan aluminium foil yang steril. Disimpan di ruang inkubasi
selama 2 minggu.
3.9 Pembuatan Matriks Nata
NDC dan NT dicuci dengan NaOH 0,2 N kemudian dibilas dengan
akuades hingga bersih dan ditiriskan. Masing-masing nata dipotong dadu dengan
ukuran 1 cm x 1 cm x 1 cm. Dikeringkan pada freeze dryer selama ± 24 jam.
3.10 Penyiapan Bahan Uji, Obat Pembanding dan Kontrol
3.10.1 Pembuatan suspensi CMC 0,5%
Sebanyak 0,5 g CMC ditimbang, lalu taburkan di atas air panas pada
lalu digerus sampai homogen, ditambahkan air sampai 100 ml.
3.10.2 Penyiapan ekstrak dalam bentuk suspensi
Fraksi n-heksan daun ruku-ruku dibuat dengan konsentrasi 3 mg/ml dalam
bentuk suspensi menggunakan CMC 0,5% dengan dosis pemberian 30, 45 dan 60
mg/Kg BB. Obat pembanding indometasin dibuat dalam bentuk suspensi CMC
0,5% dengan dosis pemberian 10 mg/Kg BB. Kontrol negatif yang digunakan
adalah suspensi CMC 0,5%.
3.10.3 Penyiapan pemerangkapan ekstrak dalam matriks nata
Masing-masing matriks NDC dan NT ditimbang. Kemudian direndam
dalam ekstrak yang telah dilarutkan dalam n-heksan selama 24 jam untuk hasil
perendaman yang optimal. Kemudian nata tersebut ditiriskan dan dikeringkan
pada freeze dryer selama ± 24 jam. Juga dilakukan prosedur yang sama untuk
pemerangkapan obat pembanding indometasin yang dilarutkan dalam etanol.
3.10.4 Penyiapan Karagenan
Sebanyak 50 mg karagenan ditimbang dan dimasukkan ke dalam labu
tentukur 5 ml, dicukupkan dengan larutan infus NaCl kemudian diinkubasi pada
suhu 37 oC selama 24 jam (Gupta, 2006).
3.10.5 Pernyiapan Hewan Percobaan
Dua minggu sebelum pengujian dilakukan hewan percobaan harus
dipelihara dan dirawat dengan sebaik-baiknya pada kandang yang mempunyai
ventilasi baik dan selalu dijaga kebersihannya. Hewan yang sehat ditandai dengan
3.11 Prosedur Penggunaan Alat Pletismometer (Ugo Basile Cat No. 7140)
3.11.1 Pembuatan larutan untuk reservoir
Sebanyak 2 sampai 3 ml campuran senyawa pembasah (ornano imbibente
BBC. 97) yang telah tersedia dalam kemasan standar dimasukkan dalam labu
tentukur 1 liter, ditambahkan 0,4-0,5 g NaCl, dicukupkan dengan akuades hingga
1 liter.
3.11.2 Penyiapan alat
Larutan yang telah disiapkan dimasukkan ke dalam reservoir yang telah
dirangkai pada alat, kemudian diisi sel dengan memutar kepala katup kira-kira 45o
ke sebelah kiri atau kanan sesuai dengan posisi reservoir itu dihubungkan,
dialirkan beberapa kali dengan memutar kepala katup untuk menghindari
gelembung udara. Batas larutan diatur sampai mendekati garis merah bagian atas
sel. Alat dihidupkan maka tampilan grafik akan menyala dan menunjukkan logo
Basile. Alat dihangatkan ± 2-3 menit.
3.11.3 Kalibrasi alat
Dari menu utama ditekan F1 maka akan ditampilkan angka 0 secara
otomatis kemudian ditekan kembali F1 yang akan menunjukan angka 0,5 ml,
ditekan kembali tombol F1 yang akan menunjukkan angka 1,0; 2,0; 4,0; 8,0 ml.
setelah itu dipilih probe kalibrasi (1 ml) dan tekan F2 untuk konfirmasinya. Probe
volum dimasukkan ke dalam sel, ditunggu hingga beberapa detik hingga nilai
yang ditunjukkan stabil. Alat siap digunakan untuk pengukuran kaki tikus.
3.12 Prosedur Pengujian Efek Antiinflamasi
Sebelum pengujian, tikus dipuasakan selama 18 jam dengan tetap diberi
masing-masing kelompok terdiri dari 6 ekor tikus, yaitu I. Kontrol (CMC 0,5%, matriks
NDC dan NT), II. Pembanding indometasin (dalam bentuk suspensi, yang
diperangkapkan pada matriks NDC dan NT) dosis 10 mg/Kg BB), III. Fraksi
n-heksan (dalam bentuk suspensi, yang diperangkapkan pada matriks NDC dan NT)
dosis 30, 45, 60 mg/Kg BB.
Pada hari pengujian, masing-masing hewan ditimbang dan pada sendi kaki
kiri diberi tanda sebagai batas pengukuran. Volume kaki kiri tikus diukur dengan
cara mencelupkannya ke dalam sel pletismometer yang berisi cairan khusus yang
telah disiapkan sebelumnya sampai batas pada kaki kiri tikus berada pada garis
batas atas sel. Pedal ditahan dan dicatat angka pada monitor sebagai volume awal
(Vo). Setiap tikus diberikan suspensi fraksi n-heksan secara oral ataupun nata
yang mengandung fraksi n-heksan sesuai dengan kelompoknya. Satu jam
kemudian, masing-masing telapak kaki kiri tikus disuntik secara intraplantar
dengan larutan karagenan 1%. Setelah setengah jam dilakukan pengukuran
volume kaki kiri tikus dengan prosedur sama seperti untuk mengukur Vo.
Perubahan volume cairan yang terjadi dicatat sebagai volume telapak kaki tikus
(Vt). Pengukuran dilakukan setiap selang waktu 30 menit selama 6 jam. Setiap
kali pengukuran larutan sel tetap diadkan sampai garis tanda atau garis merah
bagian atas sel dan pada menu utama ditekan tombol 0 (zero) serta kaki tikus
dikeringkan sebelumnya.
Volume radang adalah selisih volume telapak kaki tikus setelah dan
sebelum disuntik karagenan. Pada waktu pengukuran, volume cairan harus sama
setiap kali pengukuran, tanda batas kaki tikus harus jelas, kaki tikus harus tercelup
3.13 Perhitungan Persen Radang dan Persen Inhibisi Radang
Dimana : Vt = Volume radang setelah waktu t
Vo = Volume awal kaki tikus
Dimana : a = Persen radang rata-rata kelompok kontrol
b = Persen radang rata-rata kelompok bahan uji dan pembanding
Persen Radang x100%
V V V
o o t −
=
Persen Penghambatan Radang x100%
a b
a−
BAB IV
HASIL DAN PEMBAHASAN
Hasil identifikasi tumbuhan dilakukan oleh Pusat Penelitian dan
Pengembangan Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) adalah
tumbuhan ruku-ruku (Ocimum sanctum L.) dari suku Labiatae dapat dilihat pada
lampiran 1.a (hal. 54).
4.1 Hasil Pembuatan Ekstrak Etanol Daun ruku-ruku dan Fraksinasi Memakai Pelarut n-heksan
Ekstraksi dilakukan secara maserasi dengan pelarut etanol 80% dimana
diharapkan senyawa kimia yang terkandung di dalamnya dapat tersari. Lalu
difraksinasi dengan pelarut n-heksan. Hasil dari 1000 gram serbuk diperoleh
ekstrak kering etanol 109 gram dan ekstrak kering n-heksan sebanyak 36,2 gram.
4.1.1 Karakterisasi Simplisia dan Ekstrak Daun Ruku-ruku
Untuk mengetahui apakah simplisia yang dipakai memenuhi syarat dan
dapat dipakai sebagai bahan obat, maka dilakukan uji karakterisasi terhadap
simplisia dan ekstrak.
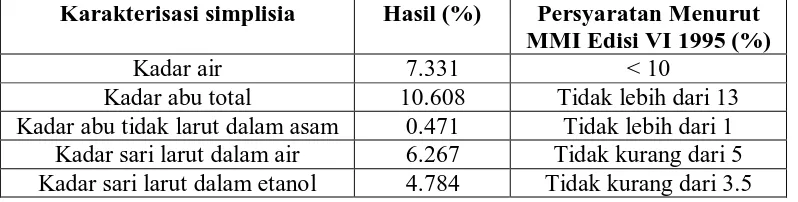
Tabel 1. Hasil Karakterisasi Simplisia Daun Ruku-ruku
Karakterisasi simplisia Hasil (%) Persyaratan Menurut MMI Edisi VI 1995 (%)
Kadar air 7.331 < 10
Kadar abu total 10.608 Tidak lebih dari 13 Kadar abu tidak larut dalam asam 0.471 Tidak lebih dari 1
Kadar sari larut dalam air 6.267 Tidak kurang dari 5 Kadar sari larut dalam etanol 4.784 Tidak kurang dari 3.5
Menurut Ditjen POM (2000), Standarisasi suatu simplisia merupakan
pemenuhan terhadap persyaratan sebagai bahan dan menjadi penetapan nilai untuk