KONSTRUKSI DAN ANALISIS KUALITAS PUSTAKA
GENOM JAGUNG (
Zea mays
(L.)) UNTUK
SEKUENSING GENOM TOTAL
SYAHDAN SAYIDAH ULFAH
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Konstruksi dan Analisis Kualitas Pustaka Genom Jagung (Zea mays (L.)) untuk Sekuensing Genom Total adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2014
Syahdan Sayidah Ulfah
2
ABSTRAK
SYAHDAN SAYIDAH ULFAH. Konstruksi dan Analisis Kualitas Pustaka Genom Jagung (Zea mays (L.)) untuk Sekuensing Genom Total. Dibimbing oleh I MADE ARTIKA dan I MADE TASMA.
Sekuensing genom total dan analisis genom jagung merupakan salah satu cara untuk mempercepat peningkatan pemuliaan jagung serta untuk meningkatkan pemahaman mengenai informasi genetik dan genomik jagung. Tujuan penelitian ini adalah mengkonstruksi pustaka genom dari empat genotipe jagung di Indonesia (Sp010BB-3-2-2-1-B, LK2-45, PSG59-8 (genjah) dan LBP54-50 (pulut)) dan menganalisis kualitas pustaka genom hasil sekuensing genom total. Konstruksi pustaka genom dilakukan secara in vitro dengan menempelkan adapter pada ujung fragmen DNA. Pustaka genom selanjutnya diklasterisasi dan disekuensing menggunakan CBOT claster generation dan Next Generation Sequencing HiSeq2000. Jumlah basa yang dihasilkan selama proses sekuensing yaitu sebanyak 287.1 Gbp. Klaster pustaka genom yang dihasilkan dengan nilai Q scores di atas 30 berkisar antara 80.8 – 87.9%. Tingkat kesalahan pembacaan basa selama proses sekuensing berkisar antara 0.32 – 0.51%. Secara keseluruhan hasil sekuensing menunjukkan bahwa kualitas klaster pustaka genom termasuk kategori ideal.
Kata kunci: jagung, pustaka genom, sekuensing genom total, Next Generation Sequencing
ABSTRACT
SYAHDAN SAYIDAH ULFAH. Construction and Quality Analysis of Maize (Zea mays (L.)) Genomic Library for Whole Genome Sequencing. Supervised by I MADE ARTIKA and I MADE TASMA.
Whole genome sequencing and analysis of the maize genome is one of the ways to accelerate the increase in corn breeding and to improve the understanding of the genetic and genomic information maize. The purpose of this study is to construct genomic libraries of four maize genotypes in Indonesia (Sp010BB-3-2-2-1-B, LK2-45, PSG59-8 (early maturing) and LBP54-50 (pulut)) and analyze the quality of the results of genomic libraries total genome sequencing. Genomic library construction performed in vitro by attaching adapters to the ends of DNA fragments. Clasterization and sequencing of genomic library in this research were conducted by using cBOT claster generation and Next Generation Sequencing HiSeq2000. The amount of base produced during the sequencing process as many as 287.1 Gbp. Cluster genomic library generated with Q values above 30 scores ranged from 80.8 – 87.9%. Base reading error rate during the sequencing process was 0.32 – 0.51%. Over all sequencing results showed that quality of the genomic library cluster was belong to the ideal category.
3
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
KONSTRUKSI DAN ANALISIS KUALITAS PUSTAKA
GENOM JAGUNG (
Zea mays
(L.)) UNTUK
SEKUENSING GENOM TOTAL
SYAHDAN SAYIDAH ULFAH
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
5 Judul Skripsi : Konstruksi dan Analisis Kualitas Pustaka Genom Jagung (Zea
mays (L.)) untuk Sekuensing Genom Total Nama : Syahdan Sayidah Ulfah
NIM : G84100059
Disetujui oleh
Dr Ir I Made Artika, MAppSc Pembimbing I
Dr Ir I Made Tasma, MSc Pembimbing II
Diketahui oleh
Dr Ir I Made Artika, MAppSc Ketua Departemen
6
PRAKATA
Puji dan syukur kehadirat Allah SWT atas rahmat dan karunia-Nya sehingga penelitian yang berjudul Konstruksi dan Analisis Kualitas Pustaka Genom Jagung (Zea mays (L.)) untuk Sekuensing Genom Total ini dapat diselesaikan dengan baik. Penelitian ini dilaksanakan selama enam bulan sejak bulan Desember 2013 sampai Mei 2014, bertempat di Laboratorium Biologi Molekuler, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian (BB Biogen), Cimanggu, Bogor.
Penulis mengucapkan terima kasih kepada kedua pembimbing penelitian yaitu Dr Ir I Made Artika MAppSc dan Dr Ir I Made Tasma MSc yang telah memberikan saran serta kritik yang membangun demi kelancaran penelitian ini. Penulis juga mengucapkan terima kasih kepada Ida Rosdianti MSi, Habib Rizjaani MSi, Titin MSi, Fajar MSi serta Ihsan Mentaya SSi yang bersedia mendampingi selama kegiatan penelitian serta memberikan masukan. Ucapan terima kasih juga penulis sampaikan kepada kedua orang tua yang senantiasa memberikan motivasi serta saran yang baik sehingga usulan penelitian ini dapat terselesaikan dengan baik. Rekan-rekan terutama Yuliana dan Asep yang telah menjadi partner yang baik selama kegiatan penelitian berlangsung serta Biokimia 47 yang telah membantu serta memberikan motivasi, penulis juga mengucapkan terima kasih.
Penulis menyadari bahwa tulisan ini masih banyak kekurangan. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun untuk memperbaiki tulisan ini. Atas kritik dan saran yang diberikan, penulis ucapkan terima kasih. Semoga tulisan ini bermanfaat dalam bidang ilmu pengetahuan khususnya biokimia.
Bogor, Oktober 2014
7
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xi
PENDAHULUAN 1
METODE 2
Bahan 2
Alat 3
Prosedur Penelitian 3
HASIL 8
Isolasi DNA Genom Jagung secara Kualitatif 8
Isolasi DNA Genom Jagung secara Kuantitatif 8
Konsentrasi DNA double stranded untuk Pustaka Genom Jagung 9
Kuantitas Hasil Fragmentasi DNA Genom Jagung 10
Kuantitas Hasil Modifikasi Ujung Fragmen DNA Genom Jagung (End Repair) 10
Kuantitas Hasil Ligasi Adapter DNA Genom Jagung 10
Kualitas Pustaka Genom Jagung 11
Sekuensing Pustaka Genom Jagung 12
PEMBAHASAN 16
Isolasi DNA Genom Jagung 16
Isolasi DNA Genom Jagung secara Kualitatif 16
Isolasi DNA Genom Jagung secara Kuantitatif 17
Konsentrasi DNA double stranded untuk Pustaka Genom Jagung 18
Kuantitas Hasil Fragmentasi DNA Genom Jagung 18
Kuantitas Hasil Modifikasi Ujung Fragmen DNA Genom Jagung (End Repair) 19
Kuantitas Hasil Adenilasi Ujung 3’OH dan Ligasi Adapter DNA Genom Jagung 20
Kualitas Pustaka Genom Jagung 21
Kuantitas Pustaka Genom Jagung 21
Klasterisasi dan Hasil Sekuensing Genom Total DNA Jagung 22
8
Densitas dan Kualitas Pustaka Genom pada Setiap Lajur dalam Flow Cell 23 Tingkat Kesalahan (error rate) dan Intensitas Basa Hasil Sekuensing 24
SIMPULAN DAN SARAN 24
Simpulan 24
Saran 25
DAFTAR PUSTAKA 25
LAMPIRAN 28
9
DAFTAR TABEL
1 Kuantitas dan rasio kemurnian DNA genom total jagung menggunakan
spektrofotometer nanodrop thermoscientific 9
2 Kuantitas double stranded DNA genom total jagung menggunakan Qubit
2.0 fluorometer 9
3 Volume DNA genom jagung yang digunakan untuk uji pustaka genomik 9 4 Kuantitas dan rasio kemurnian DNA genom jagung hasil fragmentasi 10 5 Kuantitas dan rasio kemurnian fragmen DNA setelah tahapan modifikasi
ujung fragmen DNA pada preparasi konstruksi pustaka genom jagung 10 6 Kuantitas dan rasio kemurnian DNA cetakan setelah tahapan ligasi
adapter 11
7 Ukuran fragmen dan konsentrasi DNA hasil pustaka genom untuk
sekuensing 11
8 Jumlah basa dan kualitas klaster pustaka genom hasil sekuensing secara
umum 12
9 Densitas dan kualitas pustaka genom hasil sekuensing 13 10 Tingkat kesalahan (error rate) dan intensitas basa hasil sekuensing 16
DAFTAR GAMBAR
1 Elektroforegram DNA genom total jagung 8
2 Elektroforegram hasil pustaka genom jagung menggunakan agilent bioanalyzer genotipe LK2-45 dan PSG59-8 (genjah) 11 3 Elektroforegram hasil pustaka genom yang sudah di qPCR genotipe
Sp010BB-3-2-2-1-B dan LBP54-50 (pulut) 12
4 Histrogram jumlah klaster genotipe Sp010BB-3-2-2-1 berdasarkan kualitas
sekuen yang dihasilkan 13
5 Histogram jumlah klaster genotipe LK2-45 berdasarkan kualitas sekuen
yang dihasilkan 13
6 Histogram jumlah klaster genotipe PSG59-8 (genjah) berdasarkan kualitas
sekuen yang dihasilkan 14
7 Histogram jumlah klaster genotipe LBP54-50 (pulut) berdasarkan kualitas
sekuen yang dihasilkan 14
8 Intensitas banyaknya larutan sekuensing yang tersisa selama proses
sekuensing berlangsung 14
9 Presentase basa-basa nitrogen selama proses sekuensing 15
DAFTAR LAMPIRAN
1 Strategi penelitian 28
2 Hasil analisis pustaka genom secara kuantitatif dengan qPCR 29 3 Tahapan klasterisasi pustaka genom (Illumina 2011) 31 4 Flow cell Illumina HiSeq2000 (Swiss Federal Institute of Technology
Zurich 2012) 32
10
6 Prinsip sekuensing menggunakan Next Generation Sequencing
HiSeq2000 34
PENDAHULUAN
Jagung (Zea mays L.) merupakan salah satu tanaman serealia penting yang tumbuh hampir di seluruh dunia dan digunakan sebagai bahan makanan. Di negara maju, jagung banyak digunakan untuk pati sebagai bahan pemanis, sirup dan produk fermentasi, termasuk alkohol. Jagung banyak digunakan untuk bahan baku pakan di Amerika (Prasanna et al. 2001). Jagung dibutuhkan masyarakat Indonesia dalam jumlah besar dan terus meningkat, namun tidak diikuti oleh peningkatan produksi, sehingga terjadi kekurangan sekitar 1,3 juta ton setiap tahun dan harus dipenuhi melalui import. Menutupi ketersediaan jagung perlu diupayakan melalui peningkatan produksi. Perakitan varietas unggul baru, berdaya hasil dan berkualitas tinggi merupakan salah satu upaya untuk mendorong peningkatan produksi (Azrai 2004).
Produksi tanaman pangan jagung disajikan dalam Berita Resmi Statistik (BRS) terdiri dari luas panen, produktivitas dan angka produksi jagung. Produksi jagung pada tahun 2012 mengalami peningkatan sebesar 1,74 juta ton dibandingkan tahun 2011. Produksi jagung pada tahun 2013 mengalami penurunan sebesar 0,55 juta ton dibandingkan tahun 2012. Penurunan produksi diperkirakan terjadi karena penurunan luas panen seluas 66,62 ribu hektar dan penurunan produktivitas sebesar 0,57 kuintal/hektar (BPS 2013).
Ciri penting ketahanan genetik tanaman jagung terhadap suatu hama atau penyakit adalah kestabilannya dalam berproduksi, baik pada saat ada hama atau penyakit maupun pada saat tidak ada hama atau penyakit. Ketahanan genetik harus dapat memberikan perlindungan yang baik dan menyeluruh dari kemungkinan kerusakan yang dapat disebabkan oleh suatu penyakit. Penyakit yang paling banyak menimbulkan kerusakan tanaman jagung di Indonesia adalah penyakit bulai yang disebabkan oleh strain Peronosclerospora maydis. Penyakit bulai menyerang di Indonesia secara khusus dan di Asia pada umumnya karena kondisinya yang tropis (Yen et al. 2004).
Berbagai usaha telah dilakukan untuk meningkatkan produktivitas jagung. Salah satu cara untuk meningkatkan produktivitas jagung nasional adalah dengan perbaikan genetik tanaman. Perbaikan genetik tanaman dipengaruhi oleh isolasi dan karakterisasi gen. Tahapan tersebut dapat dilakukan dengan memanfaatkan informasi genomik dan genetik jagung yang diperoleh melalui sekuensing genom total. Produksi pangan pada masa mendatang akan lebih banyak bergantung pada penerapan teknologi daripada peningkatan luas lahan pertanian.
2
DNA, klasterisasi cetakan DNA, sekuensing dan analisis data sekuens (Illumina 2010).
Sekuensing genom total jagung diawali dengan mengkonstruksi pustaka genom kentang menggunakan Low Throughput Protocol dari illumina dan disekuensing menggunakan NGS Illumina Hiseq 2000. Konstruksi pustaka ini relatif sangat mudah dan singkat karena tidak membutuhkan vektor untuk menyisipkan fragmen DNA dan juga tidak membutuhkan ruangan khusus untuk penyimpanan serta tidak membutuhkan DNA dalam jumlah banyak, namun DNA yang digunakan merupakan DNA double stranded (dsDNA) dengan konsentrasi rendah (20 ng/uL). Metode konstruksi yang digunakan memiliki prinsip yang sama dengan konstruksi genom menggunakan metode shotgun sequencing yaitu fragmen DNA yang dihasilkan dari pemotongan DNA genom tidak disisipkan dalam suatu vektor pada sel inang, namun tahapan setelah fragmentasi DNA berbeda. Metode shotgun sequencing, DNA yang telah difragmentasi tidak dilakukan ligasi adapter tetapi langsung dilakukan sekuensing. Fragmen DNA yang dihasilkan sebelum disekuens, dipreparasi dengan menempelkan adapter pada ujung fragmen DNA. adapter tersebut pada tahapan selanjutnya (klasterisasi) akan menempel pada flow cell untuk amplifikasi fragmen DNA melalui metode
bridge amplification (Mardis 2008, Metzker 2010, Commins et al. 2011).
Penelitian ini bertujuan mengkontruksi dan menganalisis kualitas pustaka genom tanaman jagung empat genotipe yaitu Sp010BB-3-2-2-1-B, LK2-45, PSG59-8 (genjah) dan LBP54-50 (pulut) yang pada tahapan selanjutnya dapat digunakan untuk pemetaan genom jagung melalui sekuensing dengan menggunakan NGS (Next Generation Sequencing) HiSeq 2000. Hipotesis penelitian ini adalah dapat mengkonstruksi pustaka genom jagung empat genotipe yaitu Sp010BB-3-2-2-1-B, LK2-45, PSG59-8 (genjah) dan LBP54-50 (pulut), kemudian disekuensing menggunakan NGS (Next Generation Sequencing) HiSeq 2000. Manfaat yang diperoleh dari penelitian ini yaitu diperoleh informasi genetika dan studi tentang keseluruhan genom jagung. Manfaat lain yaitu urutan DNA yang dihasilkan diharapkan mampu untuk pemetaan gen secara fisik pada tahapan selanjutnya.
METODE
Bahan
3 digunakan untuk adenilasi ujung 3’ DNA adalah A-tailing control dan A-tailing mix. Bahan-bahan yang digunakan untuk penempelan adapter adalah ligase control, DNA ligase mix, DNA adapter index, stop ligase mix, Sample Purification Beads, etanol 80 %, dan resuspension buffer. Bahan-bahan yang digunakan untuk uji kualitas pustaka genom dengan agilent 2100 bioanalyzer adalah sampel DNA yang sudah dipustaka, dye mix dan ladder. Bahan-bahan yang digunakan untuk uji kualitas pustaka genom menggunakan qPCR adalah sampel yang sudah dipustaka, buffer qPCR, reagen qPCR dan larutan standar. Bahan-bahan yang digunakan untuk klasterisasi dan sekuensing genom jagung adalah 2 N NaOH, buffer hibridisasi, Tris-Cl, buffer library, TruSeq SR Cluster Kit v3-cBot-HS, Truseq SBS Kit-HS (200 cycle).
Alat
Alat-alat yang digunakan meliputi mortar, tabung 15 mL, tabung 2 mL, tabung 1.5 mL, penangas air, inkubator thermostat, sentrifus 5810X, thermolyne vortex mixer maxi II, mikropipet, tip pipet, nanodrop thermoscientific 2000c, qubit
2.0 fluorometer, tabung covaris AFA Fiber Snap Cap 6x16mm, Covaris M220,
microwave panasonic, microfuge, kotak es, sarung tangan karet, termos, neraca analitik, cetakan gel, sisir, alat pengering, thermal cycler biometra T1, sudip, gelas piala, parafilm, power supply, perangkat elektroforesis, kolom elusi gel minElute Spin, UV Transilluminator DigiDoc-It Imaging System, magnetic stand, mesin pendingin tropicalized Sansio, cBot Cluster Generation, Agilent 2100
Bioanalyzer, qPCR, High Sensitivity DNA Chip dan Illumina Hiseq 2000. Prosedur Penelitian
Isolasi DNA Doyle & Doyle (1987) yang dimodifikasi
Daun jagung ditimbang 100 mg tanpa tulang daun lalu diletakkan dalam mortar pestel dan ditambah nitrogen cair dan digerus sampai halus sempurna, kemudian dimasukan ke dalam Eppendorf 2 ml. Ditambahkan 0,5 ml bufer ekstraksi CTAB (CTAB: 2%, 1 M Tris-HCl pH 8, 0.5 M EDTA pH 8, NaCl 5 M, akuades, 0,20% ß-mercaptoetanol dan natrium disulfit. Lima belas menit sebelum proses ekstraksi, bufer dipanaskan dalam waterbath dengan suhu 65°C, lalu contoh daun yang telah ditambah bufer ekstraksi CTAB.
Proses lisis dinding sel dilakukan dengan menginkubasi tabung berisi contoh ke dalam waterbath suhu 65°C selama 60 menit atau sampai fase padat terpisah dari fase cair. Selanjutnya, tabung diangkat dari waterbath dan dibiarkan beberapa menit sampai suhu contoh menurun. Tabung berisi contoh yang telah diinkubasi lalu ditambah khloroform: isoamil-alkohol (CIA 24:1) 500 μl. Tabung lalu dikocok menggunakan vortex mixer sampai contoh dann CIA 24:1 tercampur, kemudian disentrifus pada kecepatan 12.000 rpm selama 10 menit. Bagian atas contoh yang berupa cairan jernih (supernatan) dipindahkan 500 μl ke dalam tabung baru.
4
10 menit. Fase cair dibuang secara perlahan, sedangkan pelet yang tertinggal di dalam Eppendorf dicuci dengan 500 μl etanol absolut, kemudian dilarutkan dengan cara membolak-balik tabung secara perlahan-lahan. Larutan kemudian disentrifus pada kecepatan 12.000 rpm selama 5 menit. Fase cair dibuang secara perlahan, sedangkan pelet dicuci lagi dengan 200 μl etanol 70% dingin, selanjutnya dilarutkan dengan cara membolak-balik tabung secara perlahan-lahan. Larutan kemudian disentrifus pada kecepatan 12.000 rpm selama 5 menit. DNA dikeringkan di udara selama semalam.
Setelah cukup kering, pelet DNA dilarutkan dengan menambahkan 100 μl bufer TE (1M Tris-HCl pH 8,0, 12,11 g Trisma Base, 0,50 M EDTA pH 8,0, 18,61 g disodium etilen diamin tetra asetat 2H2O). Larutan DNA diinkubasi 65oC selama 15 menit. Larutan kemudian ditambahkan 2 μl RNAse pada dinding Eppendorf dan di-spin down dan diinkubasi lagi pada suhu 37oC selama 30 menit. Jika tidak langsung digunakan, DNA disimpan pada suhu -20°C. Penyimpanan pada suhu -20°C ini dilakukan agar DNA tidak rusak dan dalam kualitas yang baik.
Analisis Kualitas dan Kuantitas Isolasi DNA
Analisis kualitatif isolasi DNA (Sambrook & Russel 2001 yang dimodifikasi). Uji ini menggunakan metode elektroforesis gel agarosa. Sampel DNA diambil sebanyak 3 μL dan dielektroforesis dengan konsentrasi 1 % selama 30 menit pada kuat arus 100 V ke dalam bak elektroforesis yang berisi TAE 1x. Selanjutnya dibuat loading buffer dengan campuran loading dye 6x, SyBr Gold 100x dan molecular water. Setelah itu marker dibuat dengan campuran DNA
ladder 100 bp plus dan SyBr Gold 100x. Loading buffer dan marker ini divorteks. Kemudian diinjeksikan ke dalam sumur elektroforesis beserta sampel yang telah diisolasi.
Analisis kuantitatif isolasi DNA (Invitrogen 2010). Uji kuantitatif ini menggunakan spektrofotometer nanodrop thermoscientific dan Qubit 2.0
fluorometer. Metode menggunakan spektrofotometer nanodrop thermoscientific
sebanyak 1 μL sampel diambil dan dianalisis. Metode menggunakan fluorometer, sebanyak 200 μL buffer Qubit disiapkan masing-masing untuk dua larutan standar dan larutan yang berisi sampel. Sebanyak 190 μL working solution ditambahkan 10 μL larutan standar 0 ng, kemudian untuk larutan standar 2 sebanyak 190 μL
working solution ditambahkan 10 μL larutan standar 10 ng. Sebanyak 198 μL working solution ditambahkan 2 μL sampel. Kemudian semua larutan divortex
selama 3 detik dan diinkubasi selama 2 menit. Larutan standar 1 dan standar 2 serta sampel dibaca pada alat fluorometer.
Konstruksi Pustaka Genom (TruSeq DNA low throughput protocol 2010) Fragmentasi DNA. Fragmentasi DNA dilakukan dengan menggunakan metode sonikasi DNA. DNA yang sudah dilarutkan dengan Resuspension Buffer
sampai 55 μL diletakkan dalam tabung covaris sebanyak 52.5 μL. Kemudian
5 selama 8 menit. Sampel tetap berada pada magnetic stand, kemudian buang 125 μL supernatan tanpa menggangu beads. Kemudian pencucian pelet dilakukan secara duplo, sebanyak 200 μL etanol 80% ditambahkan dan diinkubasi selama 30 detik, selanjutnya, etanol 80% dibuang. Pelet kemudian dikeringkan selama 5 menit pada suhu ruang dan dipindahkan dari magnetic stand. Setelah itu, tambahkan 52.5 μL Resuspension Buffer dan tabung PCR diangkat dari magnetic stand. Sampel diinkubasi pada suhu ruang selama 2 menit dan diinkubasi pada
magnetic stand selama 5 menit. Supernatan dipindahkan sebanyak 50 μL ke dalam tabung PCR 0.3 ml yang baru.
Modifikasi Ujung Fragmen DNA. Sebanyak 10 μL End repair control
dan 40 μL End Repair Mix ditambahkan dalam tabung hasil fragmentasi. Sampel dicampurkan menggunakan pipet mikro dengan cara dinaik turunkan sebanyak 10 kali. Tabung yang berisi sampel ditutup dan diinkubasi dalam thermal cycler
selama 30 menit pada suhu 30oC. Kemudian tabung diangkat dari thermal cycler. Diluted beads mixture dibuat terlebih dahulu dengan komposisi 109.25 μL sample purification buffer dan 74.75 μL nuclease free water untuk 1 sampel. Sebanyak 160 μL diluted beads mixture yang telah divortex ditambahkan ke dalam sampel, kemudian diaduk dengan pipet mikro sebanyak 10 kali. Sampel tersebut diinkubasi pada suhu ruang selama 5 menit dan diinkubasi pada magnetic stand
selama 5 menit. Sampel tetap berada pada magnetic stand, kemudian transfer 125 μL supernatan tanpa menggangu beads dan lakukan sebanyak 2 kali. Kemudian 30 μL sample purification beads yang telah divortex selama 1 menit ditambahkan ke dalam sampel. Setelah itu diinkubasi pada suhu ruang selama 5 menit dan diinkubasi pada magnetic stand selama 5 menit. Supernatan dibuang sebanyak 276 μL. Pencucian pelet dilakukan secara duplo, sebanyak 200 μL etanol 80% ditambahkan dan diinkubasi selama 30 detik, selanjutnya etanol 80% dibuang. Pelet kemudian dikeringkan selama 5 menit pada suhu ruang dan dipindahkan dari
magnetic stand. Kemudian tambahkan 17.5 μL Resuspension Buffer dan tabung PCR diangkat dari magnetic stand. Sampel diinkubasi pada suhu ruang selama 2 menit dan diinkubasi pada magnetic stand selama 5 menit. Supernatan dipindahkan sebanyak 15 μL ke dalam tabung PCR 0.3 ml yang baru.
Adenilasi Ujung 3’ DNA. A-tailing control 2.5 μL dan A-tailing mix 12.5 μL ditambahkan ke dalam tabung yang berisi sampel. Sampel dicampurkan menggunakan pipet mikro dengan cara dinaik turunkan sebanyak 10 kali. Tabung yang berisi sampel ditutup dan diinkubasi dalam thermal cycler selama 30 menit pada suhu 37oC, 70oC selama 5 menit dan 4oC selama 5 menit.
Penempelan Adapter. Ligase control 2.5 μL, DNA Ligase Mix 2 2.5 μL
dan DNA Adapter Index 2.5 μL ditambahkan ke dalam tabung yang berisi sampel.
Sampel dicampurkan menggunakan pipet mikro dengan cara dinaik turunkan sebanyak 10 kali. Tabung yang berisi sampel ditutup dan diinkubasi dalam
thermal cycler selama 10 menit pada suhu 30oC. Sebanyak 5 μL Stop Ligase Mix
ditambahkan ke dalam tabung yang berisi sampel. Kemudian,sampel dicampurkan menggunakan pipet mikro dengan cara dinaik turunkan sebanyak 10 kali. Langkah selanjutnya yaitu pemurnan sampel yang diawali dengan penambahan 42.5 μL
6
magnetic stand pada suhu ruang selama 5 menit. Sebanyak 80 μL supernatan
dibuang dengan hati-hati jangan sampai mengenai pelet yang terletak pada dinding tabung.
Ulangi tahapan sebelumnya untuk menghilangkan supernatan yang masih tersisa. Pencucian pelet dilakukan secara duplo, sebanyak 200 μL etanol 80% ditambahkan dan diinkubasi selama 30 detik, selanjutnya etanol 80%. Pelet kemudian dikeringkan selama 5 menit pada suhu ruang dan dipindahkan dari
magnetic stand. Resuspension buffer sebanyak 52.5 μL ditambahkan ke dalam
tabung yang berisi pelet. Sampel dicampurkan menggunakan pipet mikro dengan cara dinaik turunkan sebanyak 10 kali. Selanjutnya, sampel diinkubasi selama 2 menit pada suhu ruang. Tabung yang berisi sampel kemudian dipindahkan dalam
magnetic stand pada suhu ruang selama 5 menit untuk memisahkan supernatan dengan pelet. Sample purification beads ditambahkan sebanyak 50 μL dan diinkubasi selama 5 menit pada suhu ruang. Tabung yang berisi sampel kemudian dipindahkan dalam magnetic stand pada suhu ruang selama 5 menit.
Kemudian sebanyak 95 μL supernatan dibuang dengan hati-hati jangan sampai mengenai pelet yang terletak pada dinding tabung. Pencucian pelet, sebanyak 200 μL etanol 80% ditambahkan dan diinkubasi selama 30 detik. Selanjutnya, etanol 80% yang telah ditambahkan dibuang dan tahapan penambahan etanol 80% diulangi kembali satu kali. Pelet kemudian dikeringkan selama 5 menit pada suhu ruang. Sample purification beads ditambahkan sebanyak 22.5 μL dan diinkubasi selama 2 menit pada suhu ruang. Tabung yang berisi sampel kemudian dipindahkan dalam magnetic stand pada suhu ruang selama 5 menit. Sebanyak 20 μL supernatan dipindahkan ke dalam tabung PCR 0.3 ml yang baru dan disimpan dalam mesin pendingin.
Analisis Pustaka Genom Jagung
Analisis pustaka genom dilakukan secara kualitatif dan kuantitatif untuk mengecek ukuran pustaka genom dan mengetahui konsentrasi dari pustaka genom yang dihasilkan memenuhi persyaratan untuk sekuensing menggunakan next generation sequencing HiSeq 2000. Syarat-syarat tersebut yaitu memiliki panjang fragmen sekitar 300-500 bp dengan konsentrasi 10 nM.
Analisis kualitas pustaka genom (Agilent Technologies 2003). Uji ini digunakan untuk mengetahui ukuran fragmen DNA hasil pemotongan yang dilakukan dengan mengikuti protokol Agilent High Sensitivity DNA Assay. High Sensitivity DNA Chip diletakkan di atas priming station chip dan kemudian ke dalam lubang berlabel G ditambahkan 9 μL dye mix kemudian ditekan menggunakan priming station selama 1 menit. Setelah dibuka kemudian ke dalam lubang lain yang berlabel G ditambahkan 9 μLdye mix dan marker pada masing-masing lubang kecuali lubang ladder, kemudian ke dalam lubang ladder ditambahkan 1 μL High Sensitivity DNA ladder. Selanjutnya 1 μL sampel dimasukkan ke dalam lubang sampel. Chip kemudian divorteks selama 1 menit dan kemudian di-running pada alat agilent 2100 bioanalyzer yang terhubung dengan komputer. Kualitas ukuran pustaka juga menggunakan metode elektroforesis agarose 2 %. Sampel yang digunakan merupakan sampel hasil dari
qPCR. Kemudian hasil elektroforegram dianalisis dengan menggunakan software
7 Analisis kuantitas pustaka genom (Sigma 2008). Tahapan ini dilakukan untuk mengetahui jumlah atau konsentrasi pustaka genom yang mencukupi sebagai syarat untuk proses klasterisasi. Sampel dibuat sebanyak triplo dan setiap ulangan dibuat tiga pengenceran berbeda, yaitu 1:1000, 1:2000 dan 1:4000. Sebanyak 1 μL sampel dilarutkan dalam 999 μL buffer qPCR, kemudian divorteks selama 10 detik. Pada ulangan ke dua yaitu sebanyak 100 μL sampel yang telah dilarutkan ditambahkan ke dalam 100 μL buffer qPCR dan untuk ulangan ketiga sebanyak 100 μL sampel dari ulangan 2 ditambahkan ke dalam 100 μL buffer
qPCR. Setiap sampel yang telah diencerkan ini kemudian diambil sebanyak 4 ul dan ditambahkan 16 ul reagen qPCR dan dimasukkan ke dalam tabung PCR. Standar larutan juga dibuat sebanyak 3 ulangan. Kemudian tabung PCR dimasukkan ke dalam alat qPCR dan di-running selama 2 jam. Hasil yang diperoleh akan digunakan untuk perhitungan klasterisasi pustaka genom. Sebelum klasterisasi pustaka terlebih dahulu dihitung konsentrasi pustaka genom yang dibutuhkan yaitu sebanyak 2 nM yang diencerkan ke dalam buffer pustaka (Tris-Cl 10 mM pH 8.5 dan 0.1 % tween 20).
Klasterisasi Pustaka Genom Jagung (cBot cluster generation protocol 2010) Klaterisasi DNA diawali dari preparasi sampel yang terdiri dari dua tahapan, yaitu denaturasi dengan menggunakan 2 N NaOH dan pelarutan DNA dalam buffer hibridisasi. Denaturasi diawali dengan penambahan 17 μL Tris-Cl 10 mM, pH 8.5 dan 1 μL 2 N NaOH ke dalam 2 μL sampel DNA sehingga diperoleh konsentrasi DNA sebesar 1 nM. Campuran tersebut kemudian divorteks sampai homogen. Sampel diinkubasi selama 5 menit pada suhu ruang untuk mendenaturasi utas ganda DNA menjadi utas tunggal. DNA yang telah didenaturasi disimpan dalam mesin pendingin sampai proses pelarutan DNA akan dilakukan.
Tahapan preparasi sampel selanjutnya yaitu pelarutan DNA dalam buffer hibridisasi. Tahapan ini diawali dengan pengenceran 1 nM DNA hasil denaturasi menjadi DNA yang memiliki konsentrasi 5 pM, 6 pM, 7 pM dan 8 pM. Konsentrasi tersebut didapat dari pengenceran 5 μL dalam 995 μL (5 pM), 6 μL dalam 994 μL (6 pM), 7 μL dalam 993 μL (7 pM) dan 8 μL dalam 992 μL (8 pM). Sebanyak 120 μL control library disiapkan dalam tabung pertama dalam suatu lajur yang memiliki 8 tabung untuk digunakan sebagai kontrol dalam flow cell. Sampel DNA yang telah diencerkan sebelumnya kemudian dipindahkan dalam tabung yang lain dalam lajur tersebut. Posisi sampel dicatat dan tabung disimpan dalam mesin pendingin sampai sampel akan dimasukkan kedalam cBot Cluster Generation.
Sekuensing Pustaka Genom Jagung (HiSeq 2000 protocol 2011)
Sekuensing pustaka genom menggunakan Illumina HiSeq 2000 terdiri dari beberapa tahap yaitu persiapan reagen, pemilihan parameter untuk sekuensing, pemasangan flow cell, sekuensing, dan post-run sequencing (maintenance wash). Reagen yang digunakan selama sekuensing diantaranya SBS reagen (TruSeq SBS kit), multiplexing reagen dan paired end reagen. Reagen-reagen tersebut dimasukkan kedalam rak reagen compartment yang terdapat dalam Illumina Hiseq 2000. Pemilihan parameter untuk sekuensing dilakukan melalui Hiseq
8
experiment, user name, flow cell type, control lane, output folder,confirm first base, keep intensity files, existing recipe, save image dan align lanes. Tahapan selanjutnya yaitu pemasangan flow cell yang telah diklasterisasi melalui cBot cluster generation pada flow cell stage. Sekuensing dilakukan selama sekitar 11 hari dengan panjang pembacaan DNA 2 x 101 siklus. Tahapan terakhir setelah proses sekuensing selesai dilakukan yaitu dengan dipindahkannya flow cell dari
flow cell stage dan dilakukannya post-run sequencing yaitu maintenance wash.
Tahapan maintenance wash terdiri dari pembilasan dengan menggunakan air dan NaOH.
HASIL
Isolasi DNA Genom Jagung secara Kualitatif
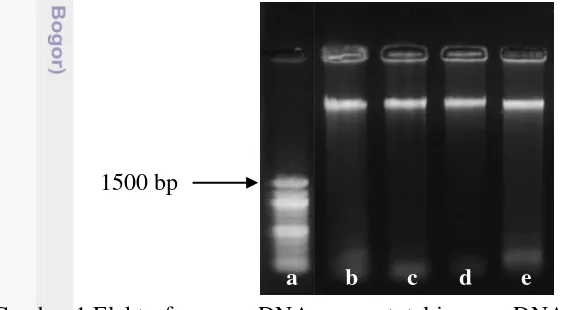
Isolasi DNA genom jagung empat genotipe yaitu Sp010BB-3-2-2-1-B, LK2-45, PSG59-8 (genjah) dan LBP54-50 (pulut) diuji secara kualitatif menggunakan metode elektroforesis gel agarose dengan konsentrasi 1%. Keempat genotipe ini menunjukkan hasil yang baik. Hal ini ditunjukkan dengan intensitas pita DNA yang jelas dan terang. Masih terdapatnya RNA ditunjukkan dengan adanya intensitas pita DNA pada dasar sumur gel. DNA yang dihasilkan juga merupakan DNA genom karena DNA yang dihasilkan berukuran besar, yaitu lebih dari 1500 bp (Gambar 1).
Gambar 1 Elektroforegram DNA genom total jagung. DNA marker (a), Sp010BB-3-2-2-1-B (b), LK2-45 (c), PSG59-8 (genjah) (d) dan LBP54-50 (pulut) (e).
Isolasi DNA Genom Jagung secara Kuantitatif
Uji kuantitatif menggunakan spektrofotometer nanodrop thermoscientific
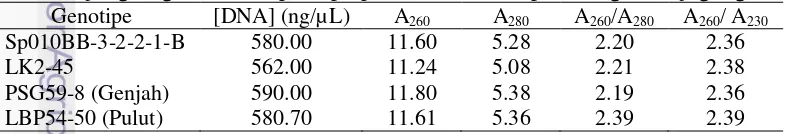
dilakukan untuk mengetahui konsentrasi DNA serta kemurnian DNA terhadap protein dan polisakarida. Keempat genotipe jagung yaitu Sp010BB-3-2-2-1-B, LK2-45, PSG59-8 (genjah) dan LBP54-50 (pulut) menunjukkan hasil yang baik dengan konsentrasi DNA yang tinggi berkisar 745.10 ng/µ L – 2547.20 ng/µ L serta rasio kemurnian A260/A280 (terhadap protein) dan A260/A230 (terhadap polisakarida) masing-masing berkisar 1.97 – 2.03 dan 2.03 – 2.17 (Tabel 1). Rasio kemurnian terhadap protein dan polisakarida ditunjukkan dengan hasil yang baik.
1500 bp
9
Uji kuantitas DNA menggunakan Qubit 2.0 fluorometer dilakukan untuk mengetahui konsentrasi DNA double stranded yang menjadi tolak ukur dalam pustaka genom dengan konsentrasi minimal 20 ng/µ L. Qubit 2.0 fluorometer
berbeda dengan spektrofotometer nanodrop thermoscientific karena Qubit 2.0
fluorometer hanya menghitung double stranded DNA yang akan digunakan untuk konstruksi pustaka genom, kemudian disekuensing. Qubit 2.0 fluorometer
memiliki akurasi yang baik karena mampu mendeteksi konsentrasi double stranded DNA dalam konsentrasi yang rendah. Konsentrasi double stranded DNA memenuhi prasyarat tersebut dengan kisaran 55.60 – 112.00 ng/µ L (Tabel 2). Tabel 2 Kuantitas double stranded DNA genom total jagung menggunakan Qubit
2.0 fluorometer
Konsentrasi DNA double stranded untuk Pustaka Genom Jagung
DNA genom yang dibutuhkan untuk konstruksi pustaka genom harus memiliki kualitas dan kuantitas yang baik. DNA genom yang digunakan harus utuh, sedikit mengandung fragmen DNA yang berukuran kecil serta memiliki konsentrasi yang tinggi. Konsentrasi DNA double stranded yang telah diukur menggunakan Qubit 2.0 fluorometer, diencerkan dengan buffer resuspensi mencapai volume 55 µL untuk memulai proses fragmentasi. Buffer resuspensi ini akan tetap menjaga DNA dalam kondisi yang baik dan stabil serta dapat melarutkan kembali DNA. DNA diencerkan dengan konsentrasi 20 ng/ µL. Volume DNA yang digunakan berkisar antara 9.82 – 19.78 µL (Tabel 3). Volume DNA yang dibutuhkan untuk pengenceran diperoleh dengan perhitungan :
10
Kuantitas Hasil Fragmentasi DNA Genom Jagung
Fragmentasi yang digunakan dalam penelitian ini yaitu fragmentasi secara fisik dengan cara sonikasi menggunakan covaris M220. Covaris M220 akan memotong dan menghasilkan fragmen double stranded DNA dengan ujung 3’
atau 5’ overhang. Setelah difragmentasi dengan teknik sonikasi menggunakan
covaris M220, kemudian dilihat kuantitas DNA dan kemurniannya menggunakan spektrofotometer nanodrop thermoscientific. Konsentrasi DNA menurun drastis karena DNA yang sudah terpotong-potong pada proses fragmentasi ini. Hasil fragmentasi juga memiliki konsentrasi DNA yang menurun drastis dibandingkan dengan DNA hasil isolasi. DNA genom hasil fragmentasi memiliki rasio A260/A280 berkisar 1.86 - 2.15 dan rasio A260/A230 berkisar 1.61 – 2.03 yang menunjukkan kemurnian yang baik (Tabel 4).
Tabel 4 Kuantitas dan rasio kemurnian DNA genom jagung hasil fragmentasi Genotipe [DNA] (ng/µL) A260 A280 A260/A280 A260/ A230
Tahapan modifikasi ujung fragmen DNA setelah fragmentasi bertujuan mengubah ujung lengket pada fragmen DNA menjadi ujung tumpul (blunt end). Hasil end repair diuji secara kuantitas menggunakan spektrofotometer nanodrop
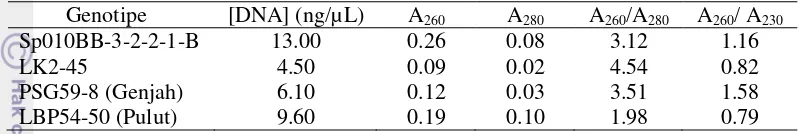
thermoscientific untuk mengetahui konsentrasi DNA dan kemurniannya. Konsentrasi DNA meningkat drastis dari tahapan fragmentasi. Konsentrasi DNA tahapan fragmentasi berkisar 13.00 – 19.10 ng/µL meningkat pada tahapan end repair menjadi kisaran 562.00 – 590.00 ng/µL (Tabel 5). Konsentrasi DNA yang meningkat dapat disebabkan karena penambahan sample purification beads
sebanyak dua kali. Sample purification beads mengandung manik-manik paramagnetik yang akan mengikat fragmen DNA dan memisahkannya dari kelebihan pereaksi-pereaksi yang digunakan sehingga DNA yang terjerap semakin banyak dan konsentrasinya meningkat. Rasio A260/A280 tergolong baik karena masih dikisaran 1.80 – 2.00.
Tabel 5 Kuantitas dan rasio kemurnian fragmen DNA setelah tahapan modifikasi ujung fragmen DNA pada preparasi konstruksi pustaka genom jagung Genotipe [DNA] (ng/µL) A260 A280 A260/A280 A260/ A230
Kuantitas Hasil Ligasi Adapter DNA Genom Jagung
11 klasterisasi pustaka genom. Konsentrasi DNA berkisar 4.50 – 13.00 ng/µ L dengan rasio A260/A280 dengan kisaran 1.98 – 4.54 (Tabel 6). Kemurnian yang didapat tidak murni. Hal ini dapat dikarenakan kontaminasi protein maupun polisakarida atau dapat dikarenakan beads masih tercampur dengan DNA ketika injeksi ke
Pustaka genom divisualisasikan melalui elektroforegram hasil pengukuran menggunakan agilent bioanalyzer. Agilent bioanalyzer mengukur semua hasil pustaka berdasarkan potongan fragmen yang ditempeli adaptor pada salah satu ujungnya atau pada kedua ujungnya. Genotipe LK2-45 berukuran 638 bp sedangkan PSG59-8 berukuran 970 bp (Gambar 2). Fragmen DNA yang dibutuhkan untuk klasterisasi yaitu berukuran kurang dari 800 bp untuk mendapatkan hasil sekuensing yang baik karena dapat mempengaruhi intensitas basa yang dihasilkan. Genotipe PSG59-8 yang berukuran lebih dari 800 bp tetap diklasterisasi untuk melihat perbandingan hasil sekuensing.
Gambar 2 Elektroforegram hasil pustaka genom jagung menggunakan agilent bioanalyzer genotipe LK2-45 dan PSG59-8 (genjah).
Analisis kualitatif pustaka genom jagung menggunakan agilent bioanalyzer juga menghasilkan tabel yang memuat ukuran fragmen dan molaritas sampel hasil pustaka. Molaritas untuk genotipe LK2-45 dan PSG59-8 masing-masing adalah 6.88 dan 10.80 nmol/L (Tabel 7).
Tabel 7 Ukuran fragmen dan konsentrasi DNA hasil pustaka genom untuk sekuensing
12
Analisis kualitatif pustaka genom juga menggunakan elektroforesis agarose dengan konsentrasi 2 %. Setelah dilektroforesis, hasilnya dianalisis menggunakan software bioinformatika photocap molecule weight. Kedua genotipe ini memiliki ukuran yang sama yaitu 658 bp (Gambar 3).
Gambar 3 Elektroforegram hasil pustaka genom yang sudah di qPCR genotipe Sp010BB-3-2-2-1-B (a) dan LBP54-50 (Pulut) (b).
Sekuensing Pustaka Genom Jagung
Jumlah basa hasil sekuensing empat genotipe jagung (Sp010BB-3-2-2-1-B, LK2-45, PSG59-8 (genjah) dan LBP54-50 (pulut)) secara total diperoleh sebanyak 287.1 Gbp atau 287.1 x 109 bp dan memiliki jumlah yang sama dengan nilai yang diprediksi selama proses sekuensing (projected total yield) 287.1 Gbp atau 287.1 x 109 bp (Tabel 8). Kualitas klaster pustaka genom hasil sekuensing ditunjukkan dengan nilai yield perfect dan yield <=3 errors. Hasil yield perfect
menunjukkan sebanyak 5.1 Gbp basa yang melewati passing filter dan yield <=3 errors yang menunjukkan bahwa sebanyak 6.1 Gbp basa pada lajur kontrol memiliki tingkat kesalahan 1-3 basa (Tabel 8). Passing filter adalah sejenis algoritma yang dipakai oleh komputer untuk menentukan keakuratan pembacaan basa saat sekuensing. Nilai % perfect menunjukkan presentase tingkat kesamaan antara basa yang dihasilkan dengan sekuen PhiX dalam 99 siklus bernilai 82%. Nilai % <=3 errors menunjukkan sebanyak 97.6% dari total basa yang dihasilkan memiliki tingkat kesalahan kurang dari 3 basa (Tabel 8).
Tabel 8 Jumlah basa dan kualitas klaster pustaka genom hasil sekuensing secara
Densitas (kerapatan klaster) yang didapat untuk keempat genotipe sangat rapat yaitu pada kisaran 673 – 875 K/mm2, sedangkan densitas yang ideal berkisar antara 400-600 K/mm2 (Tabel 9). Klaster PF menunjukkan sebanyak 87.2 – 93.3 % jumlah klaster yang melewati passing filter. Phasing menunjukkan sekitar 0.197 – 0.208% pembacaan basa berjalan lebih lambat pada saat sekuensing,
1500 bp
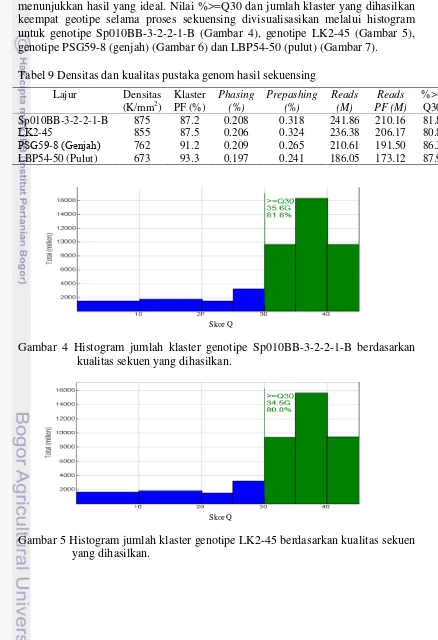
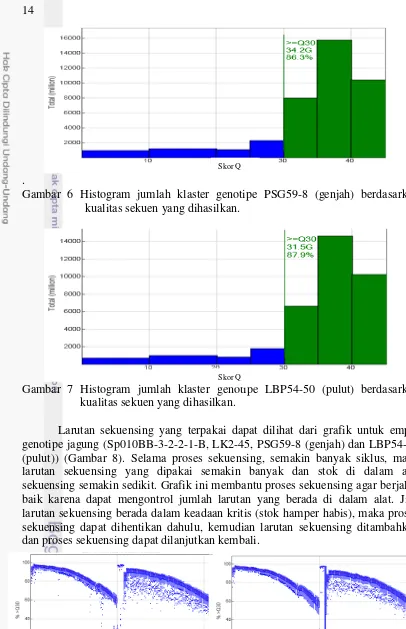
13 sedangkan prepashing menunjukkan 0.241 – 0.324% sekitar pembacaan basa berjalan lebih cepat. Reads menunjukkan sebanyak 186.05 – 241.86 M urutan basa yang terbaca pada klaster, sedangkan reads PF menunjukkan 173.12 – 210.16 M urutan basa yang berhasil melewati passing filter. Nilai %>=Q30 menunjukkan pada kisaran 80.8 – 87.8% kesalahan pembacaan hanya terjadi pada 1 basa dari 1000 basa. Nilai klaster PF, phasing, prepashing dan %>=Q30 menunjukkan hasil yang ideal. Nilai %>=Q30 dan jumlah klaster yang dihasilkan keempat geotipe selama proses sekuensing divisualisasikan melalui histogram untuk genotipe Sp010BB-3-2-2-1-B (Gambar 4), genotipe LK2-45 (Gambar 5), genotipe PSG59-8 (genjah) (Gambar 6) dan LBP54-50 (pulut) (Gambar 7).
Tabel 9 Densitas dan kualitas pustaka genom hasil sekuensing Lajur Densitas
Gambar 4 Histogram jumlah klaster genotipe Sp010BB-3-2-2-1-B berdasarkan kualitas sekuen yang dihasilkan.
Gambar 5 Histogram jumlah klaster genotipe LK2-45 berdasarkan kualitas sekuen yang dihasilkan.
14
.
Gambar 6 Histogram jumlah klaster genotipe PSG59-8 (genjah) berdasarkan kualitas sekuen yang dihasilkan.
Gambar 7 Histogram jumlah klaster genotipe LBP54-50 (pulut) berdasarkan kualitas sekuen yang dihasilkan.
Larutan sekuensing yang terpakai dapat dilihat dari grafik untuk empat genotipe jagung (Sp010BB-3-2-2-1-B, LK2-45, PSG59-8 (genjah) dan LBP54-50 (pulut)) (Gambar 8). Selama proses sekuensing, semakin banyak siklus, maka larutan sekuensing yang dipakai semakin banyak dan stok di dalam alat sekuensing semakin sedikit. Grafik ini membantu proses sekuensing agar berjalan baik karena dapat mengontrol jumlah larutan yang berada di dalam alat. Jika larutan sekuensing berada dalam keadaan kritis (stok hamper habis), maka proses sekuensing dapat dihentikan dahulu, kemudian larutan sekuensing ditambahkan dan proses sekuensing dapat dilanjutkan kembali.
a b
Skor Q
Skor Q
15
Gambar 8 Intensitas banyaknya larutan sekuensing yang tersisa selama proses sekuensing berlangsung genotipe Sp010BB-3-2-2-1-B (a), LK2-45 (b), PSG59-8 (genjah) (c) dan LBP54-50 (pulut) (d).
Jumlah basa-basa nitrogen empat genotipe jagung (Sp010BB-3-2-2-1-B, LK2-45, PSG59-8 (genjah) dan LBP54-50 (pulut)) selama proses sekuensing seperti adenin, timin, guanin dan sitosin dapat dilihat melalui grafik. Grafik tersebut berbentuk garis lurus yang menyatakan bahwa jumlah basa-basa nitrogen tersebut stabil selama proses sekuensing (Gambar 9).
Gambar 9 Presentase basa-basa nitrogen yang terbaca selama proses sekuensing genotipe Sp010BB-3-2-2-1-B (a), LK2-45 (b), PSG59-8 (genjah) (c) dan LBP54-50 (pulut) (d).
Tingkat kesalahan (error rate) yang dinyatakan dalam persen menunjukkan presentase perbandingan kesalahan pembacaan basa antara pustaka genom dengan kontrol. Nilai error rate yang dihasilkan berkisar 0.32 – 0.51%. Intensitas keempat basa dideteksi melalui hasil pendaran flourescen yang dihasilkan dari sintesis basa selama proses sekuensing (Tabel 10). Intensitas basa yang dihasilkan pada setiap lajur flow cell pada siklus pertama memiliki nilai lebih
c d
a b
c d
16
dari 3000 (Tabel 10). Nilai error rate dan intensitas basa yang dihasilkan pada siklus pertama untuk empat genotipe jagung (Sp010BB-3-2-2-1-B, LK2-45, PSG59-8 (genjah) dan LBP54-50 (pulut)) bernilai ideal.
Tabel 10 Tingkat kesalahan (error rate) dan intensitas basa hasil sekuensing Lajur Error Rate (%) Intensity Cycle 1
Isolasi DNA genom jagung empat genotipe yaitu Sp010BB-3-2-2-1-B, LK2-45, PSG59-8 (genjah) dan LBP54-50 (pulut) menggunakan metode Doyle&Doyle (1987) yang dimodifikasi. Cetil trimetil ammonium bromida (CTAB) yang digunakan dalam ekstraksi DNA ini berfungsi untuk mendegradasi senyawa-senyawa metabolit sekunder yang terdapat dalam tanaman. CTAB bersifat sebagai detergen kationik akan membentuk kompleks tak larut dengan asam nukleat sehingga dapat memisahkan kontaminan polisakarida dan polifenol dari asam nukleat serta dapat menghambat aktivitas nuklease. Metode Doyle&Doyle (1987) yang dimodifikasinya adalah penambahan natrium disulfit pada buffer CTAB.
Ekstraksi DNA pada penelitian ini menggunakan nitrogen cair untuk melisis dinding sel dapat mengeluarkan semua isi sel yang kemudian ditampung dalam larutan penyangga yang berisi Tris HCl dan EDTA. Dinding sel juga dapat dipecahkan dengan penggerusan menggunakan bufer ekstraksi diikuti dengan
penghangatan pada suhu 65°C (Subandiyah 2006). Isopropanol merupakan
alternatif dari etanol absolut. Isopropanol lebih efisien dalam persipitasi DNA dibandingkan etanol. Namun, isopropanol kurang volatil sehingga membutuhkan waktu yang lebih lama untuk mengeringkan pellet (Sambrook et al. 2001).
Berbagai metode telah dilakukan sebelumnya untuk mendapatkan kualitas DNA yang diinginkan agar dapat memenuhi persyaratan untuk pustaka genom dan metode ini yang tepat untuk menghasilkan kualitas DNA yang mengandung
double stranded DNA dengan konsentrasi yang tinggi. Banyak faktor yang mempengaruhi keberhasilan isolasi DNA untuk menghasilkan kualitas dengan konsentrasi double stranded DNA yang tinggi, salah satunya adalah tanaman yang digunakan berumur tidak terlalu tua (masih muda) dan dalam keadaan yang segar. Protokol Doyle & Doyle (1987) sering digunakan untuk ekstraksi DNA tanaman (Ribeiro et al. 2007).
Isolasi DNA Genom Jagung secara Kualitatif
17 ukurannya memiliki rentang beberapa ratus hingga sekitar 20000 kb. Konsentrasi gel yang sangat encer (0.1-0.2%) dapat meningkatkan daya pisah elektroforesis tetapi hal tersebut sulit dilakukan karena gel yang encer sangat mudah pecah. Pada konsentrasi 1% bobot per volume, gel yang berada dalam buffer yang mengandung air dalam kadar tinggi menghasilkan struktur serat yang baik dengan ukuran pori besar dan tahan terhadap gesekan. Agarosa bersifat tidak toksik, kompleks berupa bubuk yang terdiri dari campuran polimer dengan dua unit dasar galaktosa, agarosa dan agaropektin (Bintang 2010).
Hasil isolasi DNA genom jagung dari empat genotipe jagung menunjukkan hasil yang baik, terlihat dari intensitas pita DNA yang jelas. Terlihat intensitas terdapat pada dasar elektroforegram empat genotipe. Intensitas tersebut merupakan konsentrasi RNA. Hal ini dapat disebabkan karena penggunaan RNAse yang terlalu sedikit sehingga masih terdapat RNA (Gambar 2). Hasil elektroforesis juga menunjukkan bahwa keempat pita DNA yang dihasilkan merupakan DNA genom, karena ukuran pita DNA yang cukup besar (lebih dari 1500 bp). Sesuai dengan pernyataan Brown (2007) bahwa elektroforesis gel akan memisahkan molekul DNA sesuai dengan ukurannya, semakin besar molekul DNA maka pita DNA yang dihasilkan semakin dekat dengan sumur gel.
Isolasi DNA Genom Jagung secara Kuantitatif
Selain diuji secara kualitatif, DNA hasil isolasi juga diuji secara kuantitatif. Uji kuantitatif ini bertujuan untuk mengetahui konsentrasi DNA dan tingkat kemurnian DNA dari kontaminan polisakarida, dan protein. Uji kuantitatif dilakukan dengan menggunakan spektrofotometer nanodrop thermoscientific pada panjang gelombang 230, 260 dan 280 nm. Panjang gelombang 230 nm merupakan serapan maksimum untuk polisakarida, panjang gelombang 260 nm merupakan serapan maksimum untuk asam nukleat dan panjang gelombang 280 nm merupakan serapan maksimum untuk protein. Kemurnian DNA ditentukan melalui rasio A260/A280 dan A260/A230. Rasio A260/A280 menunjukkan kemurnian DNA terhadap protein, sedangkan rasio A260/A230 menunjukkan kemurnian DNA terhadap polisakarida. Hasil uji kuantitatif genom total DNA jagung yang dihasilkan memiliki kisaran 745.10 – 2547.20 ng/µ L dengan rasio A260/A280 berkisar antara 1.97 - 2.03 ng/µ L dan rasio A260/A280 berkisar antara 2.03 – 2.17 ng/µ L (Tabel 1). Menurut Walker&Wilson (2000), nilai kemurnian yang lebih dari 2.00 menujukkan adanya kontaminasi RNA, sedangkan nilai kemurnian yang kurang dari 1.80 menunjukkan sampel terkontaminasi polisakarida dan protein (Yuwono 2005). Hal ini menunjukkan hasil isolasi DNA tergolong baik meskipun ada kontaminasi RNA karena rasio lebih dari 2.00.
Uji kuantitatif juga dilakukan dengan menggunakan Qubit 2.0 fluorometer. Uji kuantitatif ini berbeda dengan uji kuantitatif sebelumnya yang menggunakan spektrofotometer nanodrop thermoscientific, karena Qubit 2.0 fluorometer hanya menghitung konsentrasi double stranded DNA (dsDNA). Double stranded DNA (dsDNA) ini dijadikan tolak ukur untuk ke tahapan selanjutnya yaitu pustaka genom yang mempunyai persyaratan bernilai 20 ng/µ L. Qubit 2.0 fluorometer
18
digunakan sebagai bahan konstruksi pustaka genom. DNA genom yang dibutuhkan untuk konstruksi pustaka genom harus memiliki kualitas dan kuantitas yang baik. DNA genom yang digunakan harus utuh dan memiliki konsentrasi yang tinggi (Michiels et al. 2003).
Konsentrasi DNA double stranded untuk Pustaka Genom Jagung
Konsentrasi double stranded DNA yang didapat dari pengukuran dengan menggunakan Qubit 2.0 fluorometer diencerkan dengan buffer resuspensi untuk difragmentasi menggunakan covaris M220. Buffer resuspensi ini digunakan untuk menjaga DNA agar selalu dalam kondisi yang baik dan stabil serta untuk melarutkan kembali DNA. Sampel DNA dicairkan sampai volume 55 µL dengan konsentrasi 20 ng/µL. Volume DNA yang akan diencerkan didapatkan dengan cara konsentrasi minimal pustaka genom yaitu 20 ng/µ L dikalikan dengan volume 55 µL dibagi dengan konsentrasi DNA double stranded dengan satuan ng/µL sehingga didapat konsentrasi double stranded DNA yang diencerkan berkisar antara 9.82 – 19.78 µL (Tabel 3). Semakin besar konsentrasi double stranded
DNA, maka semakin sedikit buffer resuspensi yang digunakan untuk mengencerkan (Covaris 2012).
Kualitas Hasil Fragmentasi DNA Genom Jagung
Fragmentasi DNA genom merupakan tahapan pertama dalam konstruksi pustaka genom. Pustaka genom merupakan kumpulan sekuens (urutan) DNA dari suatu organisme. Bagian-bagian spesifik dari genom kemudian dapat disub-klon untuk memperoleh pustaka sub-genom (Wulandari 2009). Pustaka genom merupakan bagian yang sangat penting dalam program perbaikan genetika tanaman secara molekuler maupun melalui pemuliaan konvensional karena sangat bermanfaat dalam usaha isolasi dan karakterisasi suatu gen dan dapat digunakan untuk pemetaan gen secara fisik (Suharsono 2003). Pustaka genom menggunakan DNA genomik atau kromosom sebagai sumber DNA yang digunakannya. Hal yang perlu diperhatikan ketika melakukan konstruksi suatu perpustakaan gen adalah perpustakaan tersebut harus merepresentasikan semua gen yang ada di dalam sumber DNA asalnya. Perpustakaan gen dikatakan representatif apabila berisi semua sekuens aslinya. Perpustakaan genom yang representatif dapat dibuat dengan cara memurnikan DNA genomik, kemudian dipotong secara acak menjadi fragmen-fragmen yang ukurannya sesuai dengan keperluan kloning menggunakan vektor yang dipilih. Pemurnian DNA genomik eukariot biasanya dilakukan dengan terlebih dahulu mengisolasi nukleus dan menghilangkan protein, lemak, serta makromolekul lain yang tidak diinginkan dengan memberikan protease dan melakukan ekstraksi fenol-kloroform. Sementara itu, DNA prokariot dapat diekstraksi langsung (Wahyudi 2001).
Menurut Wahyudi (2001), DNA genomik hasil pemurnian tersebut selanjutnya dipotong-potong secara acak. Pada dasarnya ada dua cara pemotongan, yaitu pemotongan fisik seperti sonikasi dan digesti menggunakan enzim restriksi. Fragmentasi yang dilakukan dalam penelitian ini dengan cara sonikasi dengan memotong DNA genom secara acak pada kisaran pemotongan 300-400 bp. Fragmentasi dengan teknik sonikasi ini menggunakan insrumen
19 hidrodinamik menjadi potongan acak. Proses ini berlangsung dalam keadaan
isothermal untuk memastikan kedua fragmen dalam potongan yang sama dan memiliki konsentrasi double stranded DNA yang tinggi (Covaris 2012).
Konstruksi pustaka genom jagung pada penelitian ini mengikuti protokol
TruSeq DNA low troughput protocol dari Illumina yang dimodifikasi pada beberapa tahapannya. Tujuan dari protokol ini yaitu menambahkan sekuen adaptor ke dalam ujung fragmen DNA untuk menghasilkan pembacaan ganda atau sekuen ujung pasangan pustaka. Tahapan awal konstruksi pustaka genom jagung ini adalah isolasi DNA genom utuh dari jagung , kemudian dilakukan pemotongan DNA pada panjang tertentu yang diharapkan potongan tersebut telah dapat mewakilkan gen-gen penyandi genom jagung, modifikasi ujung DNA, adenilasi ujung 3’OH dan ligasi adaptor. Hasil konstruksi dari pustaka genom nantinya dapat dianalisis agar dapat dilanjutkan ke tahap berikutnya (Illumina 2010c).
Selanjutnya hasil fragmentasi dengan covaris M220 diuji secara kuantitatif dengan menggunakan spektrofotometer nanodrop thermoscientific. Konsentrasi DNA mengalami penurunan dari kisaran 55.60 – 112.00 (ng/µ L) (hasil isolasi DNA genom) menjadi kisaran 13.00 – 19.10 ng/µ L (setelah dilakukan fragmentasi) (Tabel 4). Hasil konsentrasi DNA yang mengalami penurunan tersebut menunjukkan bahwa DNA sudah terpotong-potong. Rasio A260/A280 berkisar antara 1.85 – 2.15 menunjukkan DNA masih memiliki kemurnian yang baik karena rasio A260/A280 masih berada dalam kisaran 1.8 – 2.0 (Walker & Wilson 2000).
Kuantitas Hasil Modifikasi Ujung Fragmen DNA Genom Jagung (End Repair)
Modifikasi ujung fragmen DNA merupakan tahapan kedua setelah fragmentasi dalam konstruksi pustaka genom. Modifikasi ujung fragmen DNA atau end repair memiliki tujuan untuk mengubah ujung lengket pada fragmen DNA menjadi ujung tumpul (blunt end). Tahapan end repair ditambahkan end repair mix yang mengandung enzim eksonuklease dan enzim polymerase. Kerja kedua enzim ini bergantung pada letak ujung lengket. Jika ujung lengket terletak pada 3’OH dari fragmen DNA, maka enzim eksonuklease akan memotong ujung lengket tersebut. Tapi jika ujung lengket terletak pada ujung 5’P dari fragmen DNA maka enzim polimerase akan membentuk utas DNA baru yang bersifat komplemen dengan utas DNA pada ujung lengket (Illumina 2010a).
fragmen-20
fragmen DNA yang masih menempel pada dinding tabung (Agencourt Bioscience Corp 2009).
Hasil modifikasi ujung fragmen atau end repair diuji secara kuantitatif menggunakan spektrofotometer nanodrop thermoscientific. Konsentrasi DNA pada tahapan fragmentasi berkisar antara 13.00 – 19.10 ng/µ L dan pada tahapan
end repair mengalami peningkatan dengan kisaran 562 – 590 ng/µ L (Tabel 5). Peningkatan konsentrasi DNA ini dapat disebabkan karena penambahan Sample Purification Beads sebanyak 2x. Pertama berupa dilute beads mix yang merupakan campuran antara Sample Purification Beads dengan buffer resuspensi dan kedua dengan Sample Purification Beads. Agencourt Bioscience Corp (2009) menyatakan bahwa Sample Purification Beads berfungsi untuk mengikat DNA sehingga banyak DNA yang terjerap oleh manik-manik paramagnetik dan pada akhir tahapan end repair hanya dilarutkan dengan 17.5 µL buffer resuspensi. Berbeda pada tahapan fragmentasi sebanyak 55 µL sehingga konsentrasi larutan menjadi pekat. Hal ini yang dapat menyebabkan konsentrasi DNA meningkat pada tahapan modifikasi ujung fragmen atau end repair. Rasio A260/A280 pada
Tahapan adenilasi ujung 3’OH dan ligase adapter, kedua ujung 3’OH pada fragmen DNA berikatan dengan basa tunggal adenin. Tujuan dari tahapan ini adalah mencegah ligasi antar fragmen DNA dan mempersiapkan fragmen DNA sebelum dilakukan ligasi adapter. Basa tunggal timin pada ujung adapter berikatan dengan basa adenin pada ujung fragmen DNA. Ligasi adapter pada preparasi konstruksi pustaka genom bertujuan untuk membantu pengikatan pustaka genom pada flow cell saat tahapan klasterisasi pustaka genom (Illumina 2010b). Tahap adenilasi menggunakan a tailing mix bertujuan untuk membuat fragmen DNA menjadi kompatibel dengan adaptor dan mencegah ligasi sendiri (self ligation) dengan penambahan adenin tersebut pada 3’. Tahap adenilasi juga didukung dengan pengoptimasian inkubasi menggunakan thermocycle dengan suhu dan waktu yang telah ditentukan dalam TruSeq DNA low troughput protocol dari Illumina (Illumina 2010c).
21 Kualitas Pustaka Genom Jagung
Setelah konstruksi pustaka genom dilakukan, langkah selanjutnya adalah pengujian hasil pustaka secara kuantitatif menggunakan quantitative PCR (qPCR), sedangkan secara kualitatif menggunakan agilent bioanalyzer. qPCR memiliki fungsi yang berbeda dengan agilent bioanalyzer, yaitu qPCR memiliki akurasi yang lebih baik dibandingkan agilent bioanalyzer, karena qPCR hanya menghitung pustaka yang memiliki fragmen dengan ditempeli adaptor pada kedua ujungnya dan menggunakan dua primer sehingga konsentrasi atau molaritas yang dihasilkan lebih sedikit. Berbeda dengan qPCR, agilent bioanalyzer mengukur semua hasil pustaka berdasarkan potongannya meskipun fragmen hanya ditempeli adaptor pada salah satu ujungnya sehingga konsentrasi atau molaritas yang dihasilkan jauh lebih besar dibandingkan dengan qPCR (Sigma 2008).
Prinsip pengujian elektroforesis yang didasarkan pada prinsip gel elektroforesis yang dipindahkan ke dalam bentuk chip atau lempengan. Bentuk lempengan akan mengurangi penggunaan waktu dan penggunaan sampel. Untuk pengujian kuantitas DNA dan protein dapat diselesaikan dengan bantuan “upper marker”. Peak sampel berada dibawah daerah upper marker dan karena
konsentrasi upper marker telah diketahui maka konsentrasi tiap sampel juga dapat dihitung (Agilent Technologies 2003). Berdasarkan (Tabel 7) yang didapat dari
agilent bioanalyzer, ukuran fragmen DNA hasil pustaka berada pada kisaran 638 dan 970 bp. Kualitas pustaka yang baik memiliki ukuran fragmen <800 bp. Genotipe PSG59-8 (genjah) memiliki ukuran fragmen >800 bp namun memiliki konsentrasi yang paling tinggi sebesar 10.80 (nmol/L). Meskipun genotipe PSG59-8 (genjah) kurang memenuhi persyaratan, namun klasterisasi dan sekuensing tetap dilakukan untuk melihat hasilnya.
Penghitungan ukuran basa juga dilakukan menggunakan elektroforesis 2 %. Sampel yang digunakan merupakan hasil dari qPCR. Genotipe yang diuji menggunakan elektroforesis yaitu Sp010BB-3-2-2-1-B dan LBP54-50 (pulut). Kedua genotipe ini memiliki ukuran basa yang sama setelah dianalisis menggunakan software bioinformatika yaitu photocap molecule weight, yaitu bernilai 658 bp (Gambar 3). Kekurangan dari teknik menggunakan elektroforesis dan dianalisis menggunakan software bioinformatika photocap adalah hasil yang didapat kurang akurat dibandingkan dengan agilent bioanalyzer.
Kuantitas Pustaka Genom Jagung
22
sendiri menggunakan pustaka DNA genom dengan konsentrasi 8 pM dan 13 pM, hasil ini bisa diperoleh dari pengenceran stok pustaka DNA 2 nM.
Klasterisasi dan Hasil Sekuensing Genom Total DNA Jagung
Konstruksi pustaka genom yang telah dilakukan serta diuji hasilnya secara kuantitatif dengan qPCR dan agilent bioanalyzer, kemudian diklasterisasi menggunakan cBot Cluster Generation. Klasterisasi pustaka genom terdiri dari lima tahapan, yaitu denaturasi, immobilisasi dan perpanjangan DNA, amplifikasi, linearisasi dan hibridisasi (Lampiran 3). Klasterisasi ini bertujuan untuk menghasilkan klaster atau kelompok salinan dari pustaka genom yang akan disekuen (Mardis 2008).
Sekuensing genom total menggunakan Next Generation Sequencing
(NGS) memiliki beberapa kelebihan, diantaranya memiliki akurasi yang tinggi yaitu 99% dan biaya yang dibutuhkan juga lebih murah dibandingkan dengan metode Sanger. Instrumen NGS yang digunakan pada penelitian ini salah satunya adalah HiSeq2000 (Lampiran 5). Kelebihan Hiseq2000 yaitu mampu mengurutkan lebih dari lima genom manusia dalam 30 kali cakupan secara bersamaan, serta mengurutkan lebih dari 192 ekspresi gen. instrument ini juga menghasilkan 540-600 Gb dengan panjang fragmen 2 x 100 bp selama kurang lebih 11 hari. Terdapat empat tahapan secara umum dalam sekuensing DNA menggunakan HiSeq2000, yaitu preparasi sampel pustaka genom, klasterisasi pustaka genom, sekuensing dan analisis data sekuens (Illumina 2010a).
Prinsip sekuensing menggunakan NGS HiSeq2000 adalah Sequencing by Synthesis (SBS) (Lampiran 6). Selama proses sekuensing berlangsung, keempat basa nitrogen penyusun DNA (adenin, timin, guanin dan sitosin) dialirkan secara simultan ke dalam flow cell (Lampiran 7). Kemudian akan berikatan dengan fragmen DNA polymerase. Secara spesifik, keempat basa tersebut membawa penanda berupa fluorescen yang akan berpendar ketika basa-basa tersebut berikatan membentuk utas DNA yang komplemen dengan fragmen DNA pada klaster. Gugus 3’OH pada basa-basa tersebut mengalami modifikasi sehingga tidak dapat berikatan dengan basa penyusunnya yang lain sebelum satu siklus sintesis telah selesai dilakukan. Satu siklus telah selesai jika pendaran fluorescen yang dihasilkan dari basa yang telah disintesis dideteksi oleh kamera CCD. Kamera CCD ini akan menangkap pendaran fluorescen hasil reaksi pembentukan utas DNA dan akan menampilkan hasilnya melalui tampilan Real Time Analysis
pada monitor NGS HiSeq2000. Berakhirnya satu siklus ditandai dengan putusnya ikatan kimia penanda fluorescen dan gugus 3’OH termdifikasi yang selama sintesis berikatan dengan fragmen DNA dalam klaster (Mardis 2008, Ansorge 2009, Metzker 2010).
Jumlah Basa dan Kualitas Klaster Pustaka Genom Secara Umum
23
multiplexed single read dan multiplexed paired end. Pada penelitian ini dilakukan tipe pembacaan paired read dengan pembacaan sebanyak 200 siklus (Illumina 2010a). Yield perfect yang diperoleh selama proses sekuensing sebesar 5.1 Gbp (Tabel 8). Nilai yield perfect menunjukan jumlah basa yang secara akurat melewati passing filter. Passing filter merupakan sejenis algoritma yang dipakai oleh komputer untuk menentukan kearutan pembacaan basa saat sekuensing.
Tingkat kesalahan selama proses sekuensing berlangsung dapat dilihat dari
yield <=3 errors, % perfect dan % <=3 errors. Yield <=3 errors menunjukkan
Densitas dan Kualitas Pustaka Genom pada Setiap Lajur dalam Flow Cell Densitas atau kerapatan klaster dan kualitas selama proses sekuensing dihitung dari proses klaster pustaka genom. Densitas klaster pustaka genom yang dihasilkan berkisar antara 673 – 875 K/mm2 (Tabel 9). Hasil yang didapat tidak ideal dengan Illumina (2009) yang menyatakan bahwa densitas atau kerapatan klaster pustaka genom memiliki nilai ideal antara 400-600 K/mm2. Densitas tinggi yang dihasilkan dapat disebabkan karena konsentrasi pustaka genom yang digunakan pada proses klasterisasi lebih tinggi dari konsentrasi seharusnya yaitu 7 pM atau 13 pM (Quail et al. 2008). Presentase klaster PF menunjukkan kisaran antara 87.2 - 93.3 % klaster yang melewati passing filter. Nilai ini dikategorikan ideal karena >70% (Illumina 2009).
Kualitas hasil sekuensing juga dapat dilihat melalui presentase phasing
dan prepashing. Nilai phasing dan prepashing ini menunjukkan pembacaan basa dari urutan salinan klaster kehilangan sinkronisasi. Presentase phasing yang dihasilkan selama proses sekuensing berlangsung yaitu berkisar antara 0.197 – 0.209 % yang menunjukkan pada kisaran presentase tersebut pembacaan basa berjalan lebih lambat. Sedangkan presentase prepashing berkisar antara 0.241 – 0.324 % yang menunjukkan pada kisaran presentase tersebut pembacaan basa berjalan lebih cepat. Terjadi pashing dan prepashing ini dapat dipengaruhi oleh aliran fluida reagen sekuensing dan reaksi kimia yang terjadi selama proses sekuensing (Illumina 2009). Phasing ini dapat menyebabkan pada siklus selanjutnya tidak ada penempelan basa pada klaster tersebut sehingga pendaran fluorescen yang terbaca bukan berasal dari siklus sintesis basa yang baru melainkan berasal dari pendaran fuorescen hasil sintesis basa sebelumnya.
Phasing dapat disebabkan karena tidak sempurnanya pemutusan ikatan kimia penanda fuorescen pada proses terminasi gugus 3’OH dalam satu klaster. Sedangkan prepashing disebabkan karena proses pemblokiran yang tidak efektif saat penempelan pada basa 3’OH yang menyebabkan terjadinya penempelan dua basa sekaligus dalam waktu yang bersamaan.
24
menunjukkan kisaran antara 80.8 – 87.9 % akurasi kesalahan pembacaan hanya terjadi pada 1 basa dari 1000 basa (Ewing & Green 1998, Voelkerderling et al. 2009). Nilai %>=Q30 paling besar pada genotipe LBP54-50 (pulut) dan divisualisasikan melalui histogram dalam bentuk grafik (Gambar 8).
Tingkat Kesalahan (error rate) dan Intensitas Basa Hasil Sekuensing
Selama proses sekuensing berlangsung dihitung presentase kesalahan pembacaan basa nitrogen. Hal ini dapat dilihat dari % error rate. Nilai % error rate berada pada kisaran 0.32 – 0.51 % yang menyatakan pada kisaran presentase tersebut terjadi kesalahan pembacaan basa antara pustaka genom dengan kontrol (Tabel 10). Hasil tersebut menunjukkan bahwa sekuensing berjalan baik dengan tingkat kesalahan yang kecil. Kontrol yang digunakan adalah PhiX. Hasil sekuensing akan dibandingkan dengan sekuen PhiX pada database. PhiX merupakan sejenis virus yang termasuk ke dalam Group II (ssDNA), Famili Microviridae, Genus Microvirus dan spesies Fage PhiX174. PhiX yang digunakan sebagai kontrol memiliki beberapa keunggulan, yaitu mempunyai ukuran genom yang kecil, mengandung komposisi basa dan penyusun genom yang beragam (45% GC dan 55% AT) dan memiliki urutan genom yang telah diketahui secara lengkap (Kircher et al. 2011, Illumina 2012).
Basa adenin, timin, guanin dan sitosin yang dihasilkan selama proses sekuensing dihitung intensitas setiap siklusnya. Intensitas basa-basa nitrogen dideteksi melalui hasil pendaran fluorescen yang dihasilkan dari sintesis basa selama proses sekuensing berlangsung. Secara keseluruhan, intensitas basa-basa nitrogen setiap siklus dapat dilihat pada Gambar 10. Basa-basa nitrogen memiliki intensitas antara 3695 – 4022 basa (Tabel 10). Kisaran tersebut bernilai ideal, karena nilai intensitas yang ideal selama proses sekuensing sebesar 1000 (Illumina 2009). Nilai intensitas basa yang kecil dapat disebabkan oleh beberapa hal, diantaranya klaster pustaka genom yang dihasilkan selama proses bridge amplification, ukuran pustaka genom yang terlalu panjang, penempelan primer yang tidak efisien, aktivitas enzim polimerase yang tidak optimal dan terjadi gangguan dalam pendeteksian pendaran fluorescen (Kircher et al. 2011).
SIMPULAN DAN SARAN
Simpulan
Pada penelitian ini, pustaka genom empat genotipe jagung (Sp010BB-3-2-2-1-B, LK2-45, PSG59-8 (genjah) dan LBP54-50 (pulut)) berhasil dikonstruksi dan telah memenuhi persyaratan untuk sekuensing genom total menggunakan